需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
温度控制组件和液滴接口比莱耶的特征
摘要
该协议详细说明了使用反馈温度控制加热系统来促进脂质单层组件和液滴接口双层形成,用于熔化温度升高的脂质,以及电容测量,以描述膜中温度驱动的变化。
摘要
用于组装脂质双层的液滴接口双层 (DIB) 方法 (即, 与其它方法相比,油中脂质涂层水滴之间的 DIB 具有关键益处:DIB 是稳定的,而且通常具有持久性,双层区域可以逆向调整,传单不对称很容易通过液滴成分控制,并且通过相邻的许多液滴可以获得类似组织的双层水滴网络。形成 DIB 需要在液滴表面自发地将脂质组装成高密度脂质单层。虽然这在室温下很容易发生,但足够的单层或稳定的双层纤维不能在类似条件下形成,其熔点高于室温,包括一些细胞脂质提取物。这种行为可能限制了模型膜研究中DIB的组成——或许还有生物学相关性。为了解决这个问题,提出了一个实验方案,以仔细加热油藏托管DIB液滴,并描述温度对脂质膜的影响。具体来说,此协议展示了如何使用反馈环控制的热导电铝夹具和电阻加热元件来规定温度升高,从而改善单层组件和双层形成,用于更广泛的脂质类型。通过测量 DIB 电容的变化,可以量化膜的结构特征以及由双层纤维组成的脂质的温相过渡。该程序有助于评估模型膜中不同温度的生物物理现象,包括确定多成分脂质混合物的有效熔化温度(TM)。因此,这种能力将允许在模型膜中更密切地复制自然相位转换,并鼓励从更广泛的膜成分(包括那些能够更好地捕获其细胞对应体异质性)形成和使用模型膜。
引言
细胞膜是选择性渗透屏障,由数千种脂质类型1、蛋白质、碳水化合物和固醇组成,这些屏障封装和细分所有活细胞。因此,了解其组成如何影响其功能,揭示自然分子和合成分子如何与细胞膜相互作用、粘附、破坏和转移,是生物学、医学、化学、物理学和材料工程领域具有广泛影响的重要研究领域。
这些发现的目的直接受益于经过验证的组装、操纵和研究模型膜的技术,包括从合成或自然产生的脂质中组装的脂质双层,这些双层细胞模仿其细胞对应体的组成、结构和传输特性。近年来,在油脂涂层水滴之间构建平面脂质双层的液滴接口双层(DIB)方法2、3、4受到重视,5、6、7、8、9、10、11、11、12、13、14、15、16、17、18、19、20、21、22、23,在模型膜形成的其他方法上显示出实用优势:DIB方法操作简单, 不需要复杂的制造或准备(例如, "绘画")的基板,以支持膜,一贯产生膜与优越寿命长,允许标准电生理学测量,并简化模型膜的形成与不对称的传单成分3。因为双层在液滴之间自发形成,每个液滴都可以在位置和妆容中量身定做, DIB技术也吸引了相当的兴趣,开发细胞启发材料系统,建立在使用刺激反应膜18,24,25,26,27,28,29、平衡分割和运输14、30、31和组织状材料17、23、32、33、34、35、36。
大多数已公布的模型膜实验,包括使用 DIB 的实验,都是在室温下(RT,+20-25 °C)和少量合成脂质(如 DOPC、DPHPC 等)进行的。这种做法限制了可在模型膜中研究的生物物理问题的范围,基于观察,它还可以限制可用于组装DIB的脂质类型。例如,合成脂质,如 DPPC,其熔化温度为 42 °C,不会在 RT37中组装紧密包装的单层或形成 DIB。室温下的DIB形成也被证明是困难的自然提取物,如那些来自哺乳动物(如大脑总脂质提取物,BTLE)38或细菌(如大肠杆菌总脂质提取物,ETLE)37,其中含有许多不同类型的脂质,并来自细胞,居住在高温(37°C)。因此,能够研究不同的成分,为了解生物相关条件下膜介介的过程提供了机会。
提高油的温度可以达到两个目的:它增加单层组件的动力学,并可能导致脂质经历融化过渡,以达到液体紊乱阶段。这两种后果都有助于单层组件39,这是 DIB 的先决条件。除了为双层形成加热外,形成后冷却膜还可用于识别单脂双层38中的热向过渡,包括天然脂质混合物(如BTLE)中难以使用热量测量检测的热向过渡。除了评估脂质的温电性过渡外, 精确改变DIB的温度可用于研究膜结构38 的温度诱发变化,并检查脂质组成和流动性如何影响膜活性物种的动力学(例如,孔隙形成肽和转膜蛋白37),包括哺乳动物和细菌模型膜在生理相关温度(37°C)。
在此,将解释如何组装经过改进的 DIB 油藏并操作反馈温度控制器,以便在高于 RT 的温度下实现单层组件和双层地层的形成。与以前的第40号议定书不同,在油藏DIB的组装和定性的同时,对测量和控制温度所需的仪器进行了整合,其中包括了明确的细节。因此,该过程将使用户能够应用此方法在各种科学环境中在各种温度下形成和研究 DIB。此外,具有代表性的结果为膜结构和离子传输中可能因温度变化而发生的可测量变化类型提供了具体示例。这些技术是许多生物物理研究的重要补充,这些研究可以在DIB中有效设计和执行,包括研究不同膜成分中膜活性物种的动力学。
研究方案
1. 加热夹具准备
- 收集2块1毫米厚的绝缘橡胶修剪为25毫米×40毫米的宽度和长度,分别2件6毫米厚的橡胶,也是25毫米×40毫米,一个预制的铝基夹具组装,和一个丙烯酸油藏,适合在铝基夹具的观景窗口(见 图S1,S2和S3 的制造细节和爆炸的组装视图)。首先将铝夹具连接到夹具底部,用紫外线可固化胶粘剂将玻璃盖片查看窗口连接起来,并将 1 个电阻加热元件固定在每根 25 mm x 25 mm 侧面法兰的顶部。
- 将较薄的橡胶片放在显微镜的舞台上,使每块橡胶片的长边与舞台开口切线(图1)。
- 将铝基夹具放置在绝缘垫的顶部,夹具的查看窗口位于目标镜头上方。成像连接的液滴需要适当的对齐。
- 将较厚的橡胶放在每个电阻加热元件的顶部,并使用显微镜舞台夹将其保持到位。这些部件可保护加热元件免受舞台夹子和绝缘装置的损坏,防止加热元件与铝夹具和显微镜阶段之间发生意外的电气短路。
- 小心弯曲热电偶的测量端,以~4 mm的距离实现90°角。
- 将热电偶的弯曲尖端插入铝夹具的左下角,用锁螺丝轻轻固定。
- 将丙烯酸储液池放入铝夹具的井中。这是在将六角油添加到铝夹具的油井(第 1.8 步)之前完成的,以最大限度地降低在观景窗和丙烯酸储层底部之间捕获气泡的风险,这可能会阻碍液滴的视图。
注:添加到铝夹具观察舱的油用于与丙烯酸和玻璃的折射指数相匹配,以便更清楚地成像丙烯酸储层内的液滴。因此,值得注意的是,铝夹具井中的油不接触丙烯酸储层的内容,不需要对铝夹具进行严格清洗。 - 将约 1,000μL 的六角形油放入铝夹具井中(即丙烯酸储层和铝夹具之间的墙壁),注意不要过度灌装。铝夹具井中的油位应尽可能高,以最大限度地扩大传热表面积,同时不允许油溢出夹具边缘到显微镜舞台或客观透镜上。
- 将约 1,000μL 的六角形油放入丙烯酸储层中,同时注意不要过度灌装。
注意:丙烯酸储层应始终在实验之间彻底清洗。用户必须使用由连续冲洗乙醇和除离子水组成的团,然后在干燥器碗中干燥超过 12 小时。

图1:加热舞台装配。 图像显示用于DIB形成的热导电夹具和油藏的组装:每个图像下方的数字可识别协议的相应步骤。 请单击此处查看此图的较大版本。
2. 用于 DIB 同时反馈温度控制和电气特征的仪器
注意:本协议集成了以下工具,用于启用反馈温度控制和 DIB 的同步电气特征:具有两个可用的通用串行总线 (USB) 连接的个人计算机 (PC),与专用数据采集 (DAQ-1) 系统配对的补丁夹放大器、波形发生器、具有电压输出和温度输入模块的第二个可编程 DAQ (DAQ-2)以及电源/放大器。以下步骤描述了这些仪器的必要连接(如 图 2a所示),用于将温度的测量和控制与 DIB 的同步电生理学隔离开来。可根据需要替代等值文书。
- 建立与 DAQ-2 模块的输出和输入连接。
- 在电压输出模块上选择两对螺丝终端进行微分电压连接,并连接导线到这些位置。奇数终端是共同的地面连接,偶数终端是无根据输出,如图 2c所示。将这两对铅导线连接到单独的螺丝终端-BNC 适配器,然后将每个适配器连接到用于将电压信号路由到其他仪器的单独 BNC 电缆。
注意:在此设置中,将 0 号和 1 号终端的差分连接分配给功率放大器的温度控制输出,而 6 号和 7 号终端的另一对连接则指定用于通过贴片夹钳放大器将电压输出发送到液滴。 - 参照(图2c),在热电偶输入模块上选择一组热电偶终端(例如,2号和3号终端被指定为TC1对),并连接到热电偶线。
- 在电压输出模块上选择两对螺丝终端进行微分电压连接,并连接导线到这些位置。奇数终端是共同的地面连接,偶数终端是无根据输出,如图 2c所示。将这两对铅导线连接到单独的螺丝终端-BNC 适配器,然后将每个适配器连接到用于将电压信号路由到其他仪器的单独 BNC 电缆。
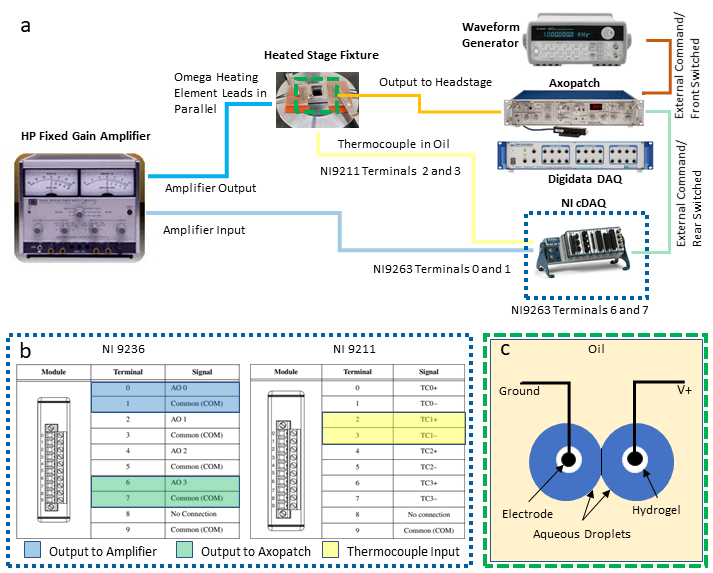
图2:系统布线连接。 系统所需的设备和布线示意图显示在(a),而在(b)中提供了 DAQ-2 连接的详细查看。图中(c)显示了浸入油中的水凝胶涂层电极上的水滴,用于 DIB 形成。两个电极分别连接到贴片夹钳放大器的头台单元上的接地和无接地 (V+) 连接。 请单击此处查看此图的较大版本。
- 与 DAQ-2 模块进行电气连接后,通过 USB 连接将 DAQ-2 底盘连接到 PC,并连接到电源。然后在使用商业软件之前确认成功的驱动程序和软件安装。
- 在 DAQ-2 和电阻加热元件之间配置并连接功率放大器。
- 配置放大器,以固定增益放大模式运行,增益为 10 倍。
- 使用香蕉千斤顶-BNC适配器,将来自电压输出模块(图 2b)上来自 0 号和 1 号终端的 BNC 电缆连接到电源放大器上的输入连接。
- 使用额外的 BNC 适配器和布线,将功率放大器的输出终端连接到两组加热元件,这两组加热元件并行连接,放大器确保两个元件在使用过程中保持相同的电压下降。
- 为电生理设备建立必要的连接。
- 将来自电压输出模块(图 2b)上 6 号和 7 号终端的 BNC 电缆连接到补丁夹放大器后部的后切换外部命令 BNC 连接器。
- 在波形发生器输出和修补程序夹放大器后部的前开关外部命令连接之间连接第二根 BNC 电缆。
注意:这两个连接提供了通过贴片夹钳放大器产生电压波形的替代方法。波形发生器特别可用于生成用于测量膜电容的三角波形电压。用户可以决定哪些(如果有的话)是自己应用程序所必需的。 - 使用第三根 BNC 电缆,将位于贴片夹钳放大器前面板上的测量电流输出连接到 DAQ-1 前面可用的模拟输入 BNC 连接器。
- 使用第四根 BNC 电缆,将测量的膜电压输出(在贴片夹钳放大器的后部)连接到 DAQ-1 上的单独模拟输入连接器。这使电极上施加的电压数字化。
- 随着两个液滴电极的准备和支持在微操纵器上,如步骤7-9在参考40,连接电极导致补丁夹头,这是通过电缆连接到补丁夹放大器。
注意:头台的作用是控制电极之间的电压并测量产生的电流,电流被转换成比例电压,通过贴片夹钳放大器将输出到 DAQ-1。 - 通过 USB 连接将 DAQ-1 连接到 PC,并将相应的电源电缆连接到补丁夹钳放大器和 DAQ-1。
- 所有测量设备的电源。
注意:此设置中最重要的细节可能是确保功率放大器输出 (mA-A) 连接与贴片夹钳放大器的头部单元进行电气隔离,该单元使用敏感电路测量 DIB 中的 pA-nA 水平电流。
3. 水滴接口双层机的反馈温度控制
注:运行反馈温度控制系统的以下步骤基于为实现比例积分 (PI) 反馈温度控制40、41(参见补充编码文件)而创建的自定义图形用户界面 (GUI)。可以改用其他软件和控制算法。向读者提供此程序的副本,并提供论文的补充信息,但用户有责任根据自己的设备和需求配置它。
- 在 PC 上启动 DAQ-2 软件并打开温度控制程序文件。GUI 打开后,只需单击 GUI 左下角的文件夹图标并选择温度控制程序(图 3),再次打开程序。
- 输入适当的数字值,以获得比例控制增益(KP)和积分控制增益(KI)。
注 :KP 和 KI 值分别为 0.598 和 0.00445,在设置中效果良好。这些值通过模拟反复确定,使用系统模型,该模型包含从测量的开环加热响应中获得的参数(见 图 4)。在 开环加热过程中,规定的加热功率独立于测量的温度。相比之下, 闭环加热 包括不断调整加热器的应用功率,以帮助将测量的温度接近所需的温度。这是使用 PI 控制方案实现的。 - 要测试温度控制方案,请输入所需的设定点温度(高于室温),然后在GUI内打开反馈温度控制。在反馈(闭环)控制下观察测量的温度信号,该信号将在未来几分钟内显示在GUI中。如果测量到的油温大大超过预期温度,对变化反应太慢,或未能收敛到所需的设定点,则用户需要调整控制增益以实现所需的闭环性能。
注意:程序定义了提供给电阻加热元件的功率(因此为电压)的饱和限制。例如,此处报告的两个元素每个元素消耗高达 5 W 的功率。并联布它们意味着总耗电量不应超过 10 W。建议用户考虑应向设备提供的最大功率量,并知道此限制会影响闭环系统响应所需温度变化的速度。更高的功率加热元件可实现更快的加热和更高的设定点温度,但需要更高的供热电流。 - 系统调整为可接受的闭环性能,输入 DIB 形成所需的油温作为 GUI 中的设定点。
注:例如,在水滴37中的BTLE脂质体实验中,设定的点温度为60°C,效果良好。用户被转介到其他地方2,40用于解释DIB组装之间的液滴挂在电线型电极和配置电生理设备使用补丁夹钳放大器,DAQ-1和电生理测量软件。具体来说,纳杰姆等人的议定书可以密切遵守,直到第13步。除了这一步骤之外,在使用需要加热的脂质来促进单层或双层形成时,使用稍微不同的方法来成功形成单层和双层。 - 将氯化银/氯化银(Ag/AgCl)电极的尖端降低到油中,直到它们接近丙烯酸储层的底部。电极尖端的这种定位对于将电极上的液滴保持在加热油中至关重要,在热油中观察到油中的对流电流,以便从水凝胶涂层电极(图 2c)中分离出液滴。
- 派佩特在每个电极尖端上滴出250nL液态脂质溶液,其中含有2毫克/mL的BTLE、100m氯化钾(KCl)和10mM 3-(N-莫索利诺)丙烷磺酸(MOPS),并让它们在加热油中孵育至少10分钟,以促进单层形成。
- 用接地法拉第笼盖住头饰和加热的舞台夹具。
- 慢慢地将液滴轻轻接触
操纵电极的水平位置,直到用户看到液滴从接触变形或开始互相置换,并等待几分钟,直到双层形成开始。如果几分钟后双层尚未形成,液滴可以强制在一起更多,以促进双层形成。通过目视检查(图5a)或测量产生10mV、10Hz三角电压22的波形发电机诱导的方形电容电流的振幅增大,可以确认变薄的面际双层星的形成。允许双层平衡至少 10 分钟,以便在初始形成时和在初始设定点进行后续特征之前达到稳定的校际区域。
注意:该油类型可对双层稀释、膜厚度和液滴间接触角度产生重大影响。一般来说,油分子越小,就越容易留在脂质乙酰链占据的双层的疏水核心中。油保留增加了单层和双层的张力和厚度,并减少了液滴之间的接触面积和角度。这些指标表示粘附状态较弱。更大、更笨重的分子产生相反的效果。例如,污秽烯是比六角形等藻类分子更笨重的分子,这使得它在双层稀薄过程中很容易被排除在单层分子之间。因此,在污秽中形成的DIB更薄,它们显示更高的接触区域和角度,并且它们表现出形成22,42(水滴粘附的量度)更高的自由能量。
4. DIB 中温度依赖行为的特征
注:许多物理过程可以在基于 DIB 的模型膜中研究,包括温度变化如何影响膜的结构和传输特性。以下步骤应在双层形成成功后在所需的温度下执行。
- 测量膜的名义电容,同时从允许双层形成的设定点降低油浴温度,以识别膜38中脂质的温相过渡。
- 右键单击GUI上的 温度图 并清除显示的数据。这确保了缓冲区有足够的空间供后续录制使用。
- 使用连接到贴片夹放大器的波形发生器,在 DIB 电极上应用三角电压波形(例如 10 mV、10 Hz),并通过双层电压器记录诱导电流响应。
- 通过将设定点温度降低 5 °C 增量,并在温度变化之间的新稳定状态温度下等待至少 5 分钟,直到达到所需的温度,从而冷却双层。或者,尝试通过关闭反馈控制系统来被动冷却双层。但是,请注意,在 50-60 °C 中实现被动冷却的实验会导致更高的凝聚率。
- 油浴和双层冷却至所需的最低温度后,再次右键单击GUI中的温度图,并将温度数据与时间导出到电子表格软件。停止当前录制。
- 从测量的电流中,计算平方波电流响应与冷却期间时间的名义电容。
- 绘制名义电容(C) 与温度(T),以观察膜电容的变化。定位 C 与 T 中的非一元变化以识别 TM。
注:名义电容可以从方波电流43的振幅计算(|我|)使用关系 |我| = C dv/dt,其中 dv/dt 等于电压振幅产品的四倍(|V|)和应用三角电压的频率(f) 。从这些方程中 ,C = |我|/(4|V|f)。
- 同样,通过连续增加油浴和双层区域的温度,在固定温度下评估双层的准静电容(Cm)。
- 使用 GUI 更改 10 °C 增量中的设定点温度,并允许系统与新温度相等。
- 执行步骤 4.1.2 以启动电容电流和记录的测量。
- 通过使用微操纵器(即分离电极减少双层区域)仔细调整电极的位置来改变双层区域。允许方波电流达到稳定的状态振幅,并收集 DIB 的图像,以便使用安装在显微镜上的摄像机对从显微镜阶段的光圈中看到的双层图像来计算膜面积与时间。同时,在当前录制软件中添加数字标签,以标记图像收集的相应时间点。
注意:微操纵器允许精确控制电极,从而在液滴之间温和接触。通过将液滴凝聚或导致液滴从电极上掉下来,对液滴进行粗操作可能导致实验失败。正如在其他地方讨论的22,双层区域是从水滴之间的接触长度计算的,在底部视图中,水滴之间呈重叠的圆圈。水滴的位置和尺寸以及接触线的长度可以使用图像处理软件或其他科学编程工具进行计算。 - 重复步骤 4.2.1.2 至少 4 次,以获得总共 5 个 DIB 图像和双层电流的稳定状态区域。
- 在每个所需的温度下重复步骤 4.2.1。
- 在标记的时间点对应于获得图像的稳态双层区域,分析当前记录和 DIB 图像,以提取每个温度的 C 和 A 数据。
- 绘制C与A数据,计算一阶回归的斜率,在每个温度22下表示双层的Cm 。
- 从步骤 4.2.4 与T获得 Cm的绘图值。
- 检查Cm与T数据是否为非单调变化,以确定熔化温度,TM。
- 使用 GUI 更改 10 °C 增量中的设定点温度,并允许系统与新温度相等。
- 通过在双层中生成直流电压步进,评估电压依赖离子通道形成的动态。
- 将 初始电压 设置为 mV 中所需的步值(例如,100 mV)。
- 将 最终电压 和 步幅大小 设置为高于所需步骤的价值(例如,110 mV 最终电压和 110 mV 步径大小)。
- 在秒内为步进设置所需的持续时间(例如,90 秒)。
- 选择所需的极性以进行步进输入(例如,正极性)。
- 切换贴片夹放大器,将来自GUI/电压输出模块的命令电压发送到头部。
- 启动当前录音。
- 打开电压并记录诱导电流响应,该响应应显示对临界电压的 S 形响应(例如,2 毫克/mL BTLE 中 1μg/mL Mz 的 70 mV)。
- 另外,膜的动态电流电压关系可以在所需的温度下获得,以揭示电压依赖关系,如离子通道行为。
- 切换贴片夹放大器,将来自波形发生器的命令电压发送到头部,并启动电流记录。
- 在波形发生器上,输出具有所需振幅、偏移和频率的连续鼻窦波形。
- 记录一个或多个周期的诱导电流响应。
- 根据需要重复不同的波振幅、频率和温度。
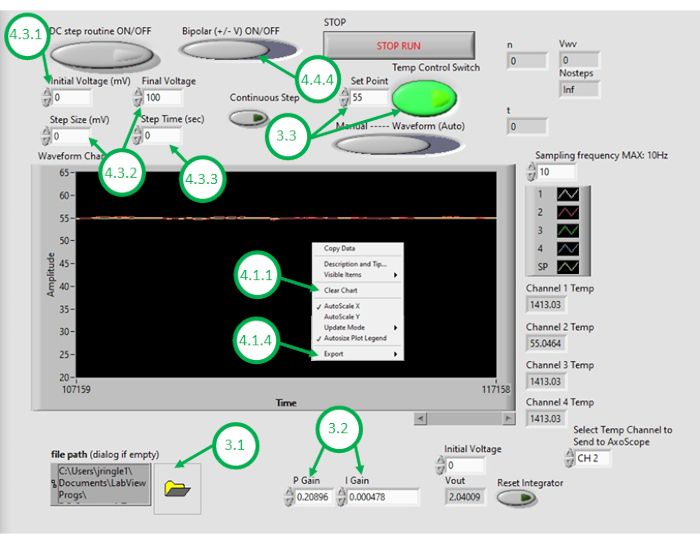
图3:温度控制GUI。 此图突出显示并标记了使用程序的 GUI 来控制油浴温度所需的关键步骤。 请单击此处查看此图的较大版本。
结果
图1显示了铝夹具和丙烯酸油储层是如何在显微镜阶段为DIB形成准备的。装配步骤 1.2-1.4 用于将固定装置与舞台隔热,以便更高效地加热。步骤 1.5-1.7 显示如何正确地将热电偶连接到夹具上并定位油藏,步骤 1.8 -1.9 显示将油分配到这些部件中的建议位置。
图 2 概述用于建立反馈温度控制并在 DIB 上执行电气测量的组件:PC、固定增益?...
讨论
此处描述的协议为组装和操作用于形成 DIB 的油和液滴的温度提供了组装和操作实验系统的说明。它特别有利于使用温度高于RT的脂质形成DIB。此外,通过精确改变油藏的温度,可以操纵双层温度来研究温度升高对各种膜特性和特征的影响,包括电容、面积、厚度、诱导的温带相变化、膜活性物种的动力学以及双层界面37、38的粘附能量。
披露声明
作者没有利益冲突。
致谢
财政支助由国家科学基金会赠款CBET-1752197和空军科学研究办公室赠款FA9550-19-1-0213提供。
材料
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
参考文献
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。