JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
온도 제어 어셈블리 및 방울 인터페이스 Bilayer의 특성화
요약
이 프로토콜은 높은 용융 온도와 지질에 대한 지질 단층 조립 및 방울 인터페이스 이중 층 형성을 촉진하기 위해 피드백 온도 제어 가열 시스템의 사용을 자세히 설명, 멤브레인의 온도 중심변화를 특성화하는 커패시턴스 측정.
초록
지질 코팅 수성 물방울 사이에 지질 이중층(즉, DIBs)을 조립하는 물방울 인터페이스 바이레이어(DIB) 방법은 다른 방법에 비해 주요 이점을 제공합니다: DIB는 안정적이고 종종 오래 지속되며, 이중층 영역은 가역적으로 튜닝될 수 있으며, 리플렛 비대칭은 방울 조성물을 통해 용이하게 조절되고, 양층과 같은 많은 양층 네트워크와 같은 양층 렌즈에 의해 용이하게 제어된다. DIB를 형성하려면 물방울 표면의 고밀도 지질 단층으로 지질의 자발적인 조립이 필요합니다. 이것은 일반적인 합성 지질을 위한 실온에서 쉽게 생기는 동안, 충분한 단층 또는 안정한 이중층은 몇몇 세포 지질 추출물을 포함하여 실온 위의 융점을 가진 지질을 위한 유사한 조건에서 형성하는 것을 실패합니다. 이 행동은 모형 막 연구 결과에서 DIBs의 조성 및 아마 생물학 관련성 -를 제한했습니다. 이 문제를 해결하기 위해 DIB 방울을 호스팅하는 오일 저장소를 조심스럽게 가열하고 지질 막에 온도가 미치는 영향을 특성화하기 위해 실험 프로토콜이 제공됩니다. 특히, 이 프로토콜은 피드백 루프에 의해 제어되는 열 전도성 알루미늄 기구 및 저항 가열 원소를 사용하여 더 넓은 지질 유형에 대한 단층 조립 및 이중층 형성을 향상시키는 높은 온도를 처방하는 방법을 보여줍니다. 멤브레인의 구조적 특성뿐만 아니라 이중층을 포함하는 지질의 열TROPIC 상 전이는 DIB의 전기 커패시턴스의 변화를 측정하여 정량화된다. 이 절차는 다중 성분 지질 혼합물에 대한 효과적인 용융온도(TM)를결정하는 것을 포함하여 다양한 온도에 걸쳐 모델 멤브레인에서 생물 물리 학적 현상을 평가하는 데 도움이 될 수 있습니다. 이 기능은 따라서 모형 막에 있는 자연적인 위상 전이의 더 가깝게 복제하고 더 나은 그들의 세포 대조물의 이질성을 포착하는 것을 포함하여 막 성분의 더 넓은 swath에서 모형 막의 형성 그리고 사용을 격려할 것입니다.
서문
세포막은 모든 살아있는 세포를 캡슐화하고 세분화하는 수천 가지 지질 유형1,단백질, 탄수화물 및 스테롤로 구성된 선택적으로 투과성 장벽입니다. 그들의 구성이 그들의 기능에 어떻게 영향을 미치는지 이해하고 자연 및 합성 분자가 세포막과 상호 작용, 준수, 중단 및 배할당하는 방법을 밝히는 방법, 따라서 생물학, 의학, 화학, 물리학 및 재료 공학에 광범위한 영향을 미치는 연구의 중요한 영역입니다.
이러한 발견을 목표로 하는 목적은 세포 측의 구성, 구조 및 운송 특성을 모방한 합성 또는 자연발생 지질에서 조립된 지질 이중층을 포함하여 모델 멤브레인을 조립, 조작 및 연구하기 위한 입증된 기술의 직접적인 이점을 누릴 수 있습니다. 최근에는, 액적 인터페이스 바이레이어(DIB) 방법2,3,4는 지질 코팅물 양적물 사이의 평면 지질 이중층을 생성하기 위한것으로, 5,6,7,8,9,10,11,12,13,14,15,16,17,18, 19,20,21,22,23,모델 멤브레인 형성을 위한 다른 접근법에 비해 실질적인 이점을 입증하였다: DIB 방법은 수행하기 가 간단하다. 정교한 제작이나 준비가 필요하지 않습니다(예: 멤브레인을 지원하는 기판의 "페인팅") 지속적으로 우수한 멤브레인을 산출 수명은 표준 전기 생리학 측정을 허용하며 비대칭 전단지조성물 3로모델 멤브레인의 형성을 단순화합니다. 이중 레이어는 물방울과 각 방울 사이에 자발적으로 형성되기 때문에 위치와 메이크업에 맞게 조정할 수 있습니다. DIB 기술은 또한 자극 반응형 멤브레인18,24,25,26,27, 28,29,균형 잡힌 구획화 및 수송14,30,31,및 조직형 재료17,23,32,33, 33,35, 35,35의사용에 기반한 세포에서 영감을 받은 재료 시스템 개발에 상당한 관심을 모으고있다.
DIB를 가진 사람들을 포함하여 모형 막에 간행된 실험의 대다수는, 실온에서 수행되었습니다 (RT, 20-25°C) 및 합성 지질의 소수와 (예를 들면, DOPC, DPhPC 등). 이 사례는 모형 막에서 공부될 수 있는 생물물리학적인 질문의 범위를 제한하고, 관찰에 근거하여, 또한 DIB를 조립하기 위하여 이용될 수 있는 지질의 모형을 제한할 수 있습니다. 예를 들어, 42°C의 용융 온도를 가지는 DPPC와 같은 합성 지질은 RT37에서단단히 포장된 단층층을 조립하거나 DIB를 형성하지 않는다. 실온에서 DIB 형성은 또한 포유류(예를 들어, 뇌 총 지질 추출물, BTLE)38 또는 박테리아(예를 들어, 에체리치아 대장균 총 지질 추출물, ETLE) 37, 높은 온도(37°C)에 상주하는 세포에서 유래하는 천연 추출물(예를 들어, 뇌 총 지질 추출물, BTLE)37과같은 천연 추출물에 대해도 어렵다는 것이 입증되었습니다. 따라서 다양한 조성물의 연구를 가능하게 하면 생물학적으로 관련된 조건에서 막 매개 공정을 이해할 수 있는 기회를 제공합니다.
오일의 온도를 올리는 것은 두 가지 목적을 제공 할 수 있습니다 : 그것은 단층 조립의 운동을 증가하고 지질이 액체 무질서한 단계에 도달하기 위해 용융 전환을 겪을 수 있습니다. 두 결과 모두 DIB의 전제 조건인 단층어셈블리(39)에도움이 됩니다. 이중층 형성을 위한 가열 이외에, 형성 후 멤브레인을 냉각시켜 열량계를 사용하여 검출하기 어려울 수 있는 천연 지질 혼합물(예를 들어, BTLE)을 포함하여 단일 지질이중층(38)에서열tropic 전이를 식별하는 데 사용될 수 있다. 지질의 열Tropic 전이를 평가하는 것 외에도, DIB의 온도를 정확하게 변화하여 막구조(38)의 온도 유발 변화를 연구하고 지질 조성 및 유동성이 막 활성 종의 운동(예를 들어, 모공 형성 펩타이드 및 트랜스멤브레인 단백질37)의운동에 어떤 영향을 미치는지 검사할 수 있다.37), 포유동물 및 세균성 모델 멤브레인을 포함하는 포유류 및 세균성 모델 멤브레인(37).
본 명세서에서는, 수정된 DIB 오일 저장소를 조립하고 피드백 온도 컨트롤러를 작동시켜 RT보다 높은 온도에서 단층 조립 및 이중층 형성을 가능하게 하는 방법에 대한 설명이 설명될 것이다. 이전프로토콜(40)과구별되는, 오일 저수지내DIB의 조립 및 특성화에 병행하여 온도를 측정하고 제어하는 데 필요한 계측의 통합에 관한 명시적 세부 사항이 포함되어 있다. 따라서 이 절차를 통해 사용자는 다양한 과학적 맥락에서 다양한 온도에서 DIB를 형성하고 연구하기 위한 이 방법을 적용할 수 있습니다. 더욱이, 대표적인 결과는 온도가 다양함에 따라 발생할 수 있는 멤브레인 구조와 이온 수송 모두에서 측정 가능한 변화의 유형에 대한 구체적인 예를 제공한다. 이러한 기술은 다른 막 조성에서 막 활성 종의 운동학을 연구하는 것을 포함하여 DIBs에서 효과적으로 설계및 수행 될 수있는 많은 생물 물리학 연구에 중요한 추가입니다.
프로토콜
1. 가열 된 설비 준비
- 각각 25mm x 40mm로 트리밍된 1mm 두께의 절연 고무 2개, 각각 25mm x 40mm의 6mm 두께 고무 2개, 알루미늄 베이스 설비의 관측 창에 맞는 알루미늄 베이스 설비 조립품 및 아크릴 오일 저장소 2개(그림 S1, S2, S3 참조). UV 경화 접착제가 있는 유리 커버슬립 보기 창에 부착하고 1 저항 가열 요소를 고정물의 각 25mm x 25mm 측면 플랜지의 상단에 부착하여 알루미늄 설비를 먼저 준비합니다.
- 각 조각의 긴 가장자리가 무대 개구부(도 1)에접선될 정도로 더 얇은 고무 조각을 현미경의 무대에 놓습니다.
- 알루미늄 베이스 설비를 절연 패드 위에 배치하고 객관적인 렌즈 위에 고정물의 시야 창을 배치합니다. 연결된 액적을 이미징하려면 적절한 정렬이 필요합니다.
- 각 저항 가열 요소 위에 고무의 두꺼운 조각을 배치하고 장소에 그것을 유지하기 위해 현미경 무대 클립을 사용합니다. 이 조각들은 무대 클립으로 인한 손상으로부터 가열 요소를 보호하고 가열 요소와 알루미늄 설비 및 현미경 단계 사이의 우발적 인 전기 단락으로부터 절연합니다.
- 열전대의 측정 끝을 조심스럽게 구부려 끝에서 ~ 4mm에서 90° 각도를 달성합니다.
- 열전대의 구부러진 끝을 알루미늄 설비의 왼쪽 아래 모서리에 삽입하고 잠금 나사로 부드럽게 고정합니다.
- 아크릴 저수지를 알루미늄 설비의 우물에 넣습니다. 이는 알루미늄 설비의 우물(1.8단계)에 헥사데카네 오일을 첨가하기 전에 수행되어 물방울의 시야를 저해할 수 있는 아크릴 저수지의 관측 창과 바닥 사이에 기포를 포획할 위험을 최소화합니다.
참고: 알루미늄 설비의 관측실에 첨가된 오일은 아크릴 저수지에 포함된 액물의 선명한 이미징을 위해 아크릴과 유리의 굴절률과 일치하도록 사용됩니다. 따라서 알루미늄 설비의 우물에 있는 오일은 아크릴 저수지의 내용과 접촉하지 않으며 알루미늄 설비의 엄격한 세척이 필요하지 않다는 점에 유의할 필요가 있다. - 육사데카네 오일의 1,000 μL을 알루미늄 설비의 우물(즉, 아크릴 저수지와 알루미늄 기구의 벽 사이)에 분배하여 덮어지지 않도록 주의하십시오. 알루미늄 설비의 우물의 오일 레벨은 열 전달을 위한 표면적을 최대화하는 동시에 오일이 현미경 단계 또는 객관적렌즈에 고정물의 가장자리를 통해 유출되는 것을 허용하지 않는 것만큼 높어야 합니다.
- 헥사데카네 오일의 1,000 μL을 아크릴 저수지에 분배하고, 과로하지 않도록 염두에 두었습니다.
참고: 아크릴 저수지는 항상 실험 사이에 철저히 청소되어야 합니다. 사용자는 에틸 알코올과 탈이온 된 물로 연속 헹굼으로 구성된 연대를 고용해야하며 12 시간 이상 건조기 그릇에 건조물을 마셔야합니다.

그림 1: 가열 된 단계 어셈블리. 이미지는 DIB 형성을 위한 열전도성 기구 및 오일 저장소의 어셈블리를 보여줍니다. 각 이미지 아래에 있는 숫자는 프로토콜의 해당 단계를 식별합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. DIB의 동시 피드백 온도 제어 및 전기 특성화를 위한 계측
참고: 이 프로토콜은 DIB의 피드백 온도 제어 및 동시 전기 특성화를 가능하게 하기 위한 다음 계측기를 통합합니다: 2개의 사용 가능한 범용 시리얼 버스(USB) 연결이 있는 개인용 컴퓨터(PC), 전용 데이터 수집(DAQ-1) 시스템, 파형 발전기, 전압 및 출력 및 전력 과 함께 두 번째 프로그래밍 가능한 DAQ(DAQ-2)와 결합된 패치 클램프 증폭기. 다음 단계는 DIB의 동시 전기 생리학으로부터 온도의 측정 및 제어를 격리하는 데 필요한 이러한 계측기(도 2a에도시된 대로)의 필요한 연결을 설명합니다. 동등한 계측기의 대체품은 필요에 따라 이루어질 수 있다.
- DAQ-2 모듈에 대한 출력 및 입력 연결을 설정합니다.
- 전압 출력 모듈에서 두 쌍의 나사 단자기를 선택하여 차동 전압 연결을 선택하고 이러한 위치에 와이어 리드를 연결합니다. 홀수 터미널은 공통 접지 연결이며 짝수 단말은(그림 2c)에도시된 바와 같이 접지되지 않은 출력이다. 이 두 쌍의 리드 와이어를 연결하여 나사-단자-BNC 어댑터를 분리한 다음 각 어댑터를 다른 기기에 전압 신호를 라우팅하는 데 사용되는 별도의 BNC 케이블에 연결합니다.
참고: 이 설정에서, 단자 0과 1의 차동 연결은 전력 증폭기로 온도 제어 출력에 할당되고, 6과 7의 다른 연결 쌍은 패치 클램프 증폭기를 통해 방울로 전송되는 전압 출력을 위해 지정됩니다. - 지칭(도 2c)열전대 입력 모듈에서 열전대 단자 1세트(예: 단자 2 및 3은 TC1 쌍으로 지정됨)을 선택하고 열전대 와이어에 연결한다.
- 전압 출력 모듈에서 두 쌍의 나사 단자기를 선택하여 차동 전압 연결을 선택하고 이러한 위치에 와이어 리드를 연결합니다. 홀수 터미널은 공통 접지 연결이며 짝수 단말은(그림 2c)에도시된 바와 같이 접지되지 않은 출력이다. 이 두 쌍의 리드 와이어를 연결하여 나사-단자-BNC 어댑터를 분리한 다음 각 어댑터를 다른 기기에 전압 신호를 라우팅하는 데 사용되는 별도의 BNC 케이블에 연결합니다.
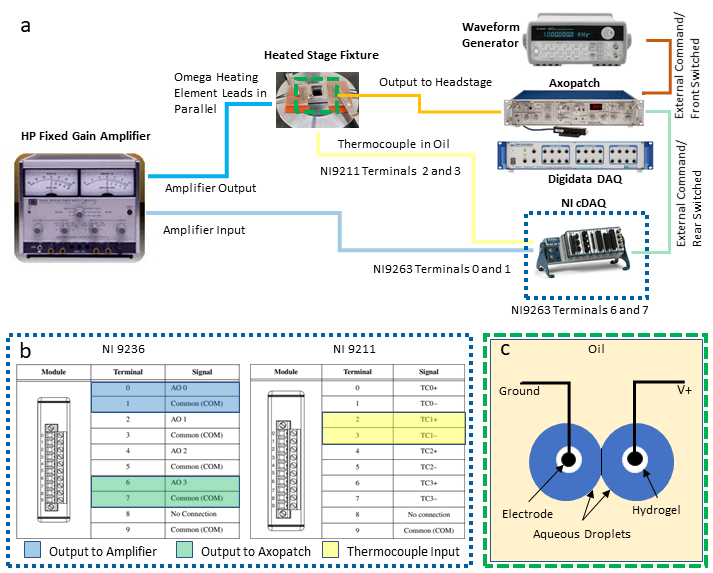
그림 2: 시스템 배선 연결. 시스템에 필요한 장치 및 배선의 회로도가(a)에표시되고 DAQ-2 연결을 자세히 살펴보면(b)에제공됩니다. (c)일러스트는 DIB 형성을 위해 오일에 침수된 하이드로겔 코팅 전극의 수성 방울을 나타낸다. 두 전극은 패치 클램프 증폭기의 헤드스테이지 유닛에 각각 접지 및 접지(V+) 연결에 연결됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- DAQ-2 모듈에 대한 전기 연결이 이루어진 후 USB 연결을 통해 DAQ-2 섀시를 PC에 연결하고 전원에 연결합니다. 그런 다음 상용 소프트웨어와 함께 사용하기 전에 성공적인 드라이버 및 소프트웨어 설치를 확인합니다.
- DAQ-2와 저항 가열 요소 사이의 전원 증폭기를 구성하고 연결합니다.
- 10배의 게인으로 고정 게인 증폭 모드에서 작동하도록 증폭기를 구성합니다.
- 바나나 잭-BNC 어댑터를 사용하여 전압 출력모듈(도 2b)의단자 0과 1에서 시작된 BNC 케이블을 전원 증폭기의 입력 연결에 연결합니다.
- 추가 BNC 어댑터와 케이블링을 사용하여 전력 증폭기의 출력 단자를 서로 병렬로 유선하는 두 가열 요소 세트와 앰프를 연결하여 두 요소가 사용 중에 동일한 전압 강하를 유지할 수 있도록 합니다.
- 전기 생리학 장비에 필요한 연결을 설정합니다.
- 전압 출력모듈(그림 2b)에단자 6과 7에서 유래한 BNC 케이블을 패치 클램프 증폭기 후면의 후방 전환 외부 명령 BNC 커넥터에 연결합니다.
- 파형 생성기의 출력과 패치 클램프 증폭기 의 뒷면에 전면 스위치 외부 명령 연결 사이에 두 번째 BNC 케이블을 연결합니다.
참고: 이 두 연결은 패치 클램프 증폭기를 통해 액적 전극에 적용되는 전압 파형을 생성하는 대체 방법을 제공합니다. 파형 발생기는 멤브레인 커패시턴스를 측정하는 데 사용되는 삼각형 파형 전압을 생성하는 데 특히 유용합니다. 사용자는 자신의 응용 프로그램에 필요한 경우 어느 쪽을 결정할 수 있습니다. - 세 번째 BNC 케이블을 사용하면 패치 클램프 증폭기의 전면 패널에 있는 측정전류의 출력을 DAQ-1 전면에 있는 사용 가능한 아날로그 입력 BNC 커넥터에 연결합니다.
- 제4 BNC 케이블을 사용하면 측정된 멤브레인 전압(패치 클램프 증폭기 의 후면)의 출력을 DAQ-1의 별도의 아날로그 입력 커넥터에 연결합니다. 이를 통해 전극에 적용되는 전압의 디지털화를 가능하게 합니다.
- 2개의액적 전극을 7-9단계에서 설명한 바와 같이 마이크로 조작기에서 제조 및 지원되며, 전극을 패치 클램프 증폭기에 케이블을 통해 부착된 패치 클램프 헤드스테이지로 연결한다.
참고: 헤드스테이지의 역할은 전극 사이의 전압을 제어하고 패치 클램프 증폭기에 의해 DAQ-1로 출력되는 비례 전압으로 변환되는 결과 전류를 측정하는 것입니다. - USB 연결을 통해 DAQ-1을 PC에 연결하고 해당 전원 공급 장치 케이블을 패치 클램프 증폭기와 DAQ-1 모두에 연결합니다.
- 모든 측정 장비에 전력을 공급합니다.
참고: 아마도 이 설정에서 가장 중요한 세부 사항은 전력 증폭기 출력(mA-A) 연결이 DIB에서 pA-nA 레벨 전류를 측정하기 위해 민감한 회로를 사용하는 패치 클램프 증폭기의 헤드스테이지 유닛으로부터 전기적으로 분리되도록 하는 것입니다.
3. 액적 인터페이스 양층의 피드백 온도 제어
참고: 피드백 온도 제어 시스템을 작동하기 위한 다음 단계는 비례 적분(PI) 피드백 온도 제어40,41(보충 코딩 파일참조)을 구현하기 위해 만들어진 사용자 지정 그래픽 사용자 인터페이스(GUI)를 기반으로 합니다. 대신 다른 소프트웨어 및 제어 알고리즘을 사용할 수 있습니다. 이 프로그램의 사본은 논문에 대한 추가 정보와 함께 독자에게 제공되지만 사용자는 자신의 장비와 필요에 맞게 구성할 책임이 있습니다.
- PC에서 DAQ-2 소프트웨어를 시작하고 온도 제어 프로그램 파일을 엽니다. GUI가 열리면 GUI왼쪽 하단모서리의 폴더 아이콘을 클릭하고 온도 제어프로그램(그림 3)을선택하여 프로그램을 다시 엽니다.
- 비례 제어이득(KP)및 일체형 제어 이득(KI)에적합한 수치 값을 입력합니다.
참고: KP와 KI 값은 각각 0.598 및 0.00445로 설정에서 잘 작동하는 것으로 나타났습니다. 이러한 값은 측정된 오픈 루프 가열 응답에서 얻은 매개 변수를 통합하는 시스템 모델을 사용하여 시뮬레이션을 통해 반복적으로 결정되었습니다(그림 4참조). 오픈 루프 가열하는 동안, 규정 된 가열 전력 측정 된 온도 와 무관. 반면, 폐쇄 루프 가열은 측정된 온도를 원하는 온도에 가깝게 구동하는 방식으로 히터에 적용된 전력을 지속적으로 조정하는 것으로 구성됩니다. 이는 PI 제어 체계를 사용하여 본원에 달성된다. - 온도 제어 구성표를 테스트하려면 원하는 설정점 온도(실온 위)를 입력한 다음 GUI 내에서 피드백 온도 제어를 켭니다. 다음 몇 분 동안 GUI에 표시되는 피드백(폐쇄 루프) 제어하에서 측정된 온도 신호를 관찰합니다. 오일의 측정 온도가 원하는 온도를 크게 오버슈트하거나, 변화에 너무 느리게 반응하거나, 원하는 설정점에 수렴하지 못하면, 사용자는 원하는 폐쇄 루프 성능을 달성하기 위해 제어 이득을 조정해야 합니다.
참고: 이 프로그램은 저항 가열 요소에 제공된 전력(및 전압)에 대한 채도 제한을 정의합니다. 예를 들어, 본 명세서에 보고된 두 요소는 각각 최대 5W 전력을 소비한다. 병렬로 배선하면 총 전력 소비가 10W를 초과해서는 안 됩니다. 사용자는 장치에 제공해야 하는 최대 전력량을 고려하고 이 제한이 폐쇄 루프 시스템이 원하는 온도 변화에 대응하는 속도에 영향을 줄 수 있음을 알고 있는 것이 좋습니다. 높은 전력 가열 요소는 더 빠른 가열과 더 높은 설정 점 온도를 가능하게하지만 난방을 위해 더 높은 공급 전류가 필요합니다. - 허용 가능한 폐쇄 루프 성능으로 조정된 시스템을 통해 GUI의 세트포인트로서 DIB 형성에 원하는 오일 온도를 입력합니다.
참고: 예를 들어, 60°C의 세트 포인트 온도는 수성액적(37)에서BTLE 리포솜을 실험하는 데 좋은 결과를 산출하였다. 사용자는 패치 클램프증폭기,DAQ-1 및 전기 생리학 측정 소프트웨어를 사용하여 와이어 형 전극에 매달려있는 방울과 전기 생리 장비의 구성 사이의 DIB 어셈블리를 설명하는 프로토콜에대해 다른곳에서 언급된다. 구체적으로, Najem,외. 40에 의한 프로토콜은 13단계까지 밀접하게 따를 수 있다. 그 단계 를 넘어, 약간 다른 접근 방식은 단층 또는 이중 층 형성을 촉진하기 위해 가열을 필요로 지질을 사용하는 경우 성공적인 단층 및 이중 층 형성을 위해 사용된다. - 은/은 염화물(Ag/AgCl) 전극의 끝을 거의 아크릴 저수지의 바닥에 닿을 때까지 오일로 낮춥니다. 전극 팁의 이러한 위치는 수레겔 코팅 전극(도2c)에서액적을 분리하는 것으로 관찰된 가열된 오일의 전극에 액적물 방울을 유지하는 데 매우 중요합니다.
- 파이펫 은 BTLE 2 mg/mL, 염화 100m 칼륨(KCl), 10mMM 3-(N-morpholino) 프로판술포닉산(MOPS)을 함유한 수성 지질 용액 250nL 액수의 물방울을 각 전극 팁에 넣고 최소 10분 동안 가열된 오일에 인큐베이트할 수 있도록 합니다.
- 접지 패러데이 케이지로 헤드 스테이지와 가열된 스테이지 비품을 덮습니다.
- 천천히 부드러운 접촉에 물방울을 가져
사용자가 물방울이 접촉에서 변형되는 것을 보거나 서로 변위하기 시작하고 이중 층 형성이 시작될 때까지 몇 분 정도 기다릴 때까지 전극의 수평 위치를 조작합니다. 몇 분 후에 이중 층이 형성되지 않은 경우, 물방울은 이중 층 형성을 용이하게하기 위해 더 함께 강요 할 수 있습니다. 얇은 면면 양층의 형성은 육안검사(도 5a)를통해 또는 10mV, 10Hz 삼각형전압(22)을배설하는 파형 발생기에 의해 유도된 제곱파형 정전전류의 진폭증가를 측정함으로써 확인할 수 있다. 이중 레이어가 초기 형성 시 및 초기 세트 점에서 후속 특성화 하기 전에 안정된 안면 영역에 도달하기 위해 최소 10분 동안 평형화되도록 허용합니다.
참고: 오일의 종류는 이중 레이어 숱이, 막 두께 및 액수 간 접촉 각도에 큰 영향을 미칠 수 있습니다. 일반적으로, 오일 분자가 작을수록 지질 아실 사슬에 의해 점유된 이중층의 소수성 코어에 더 쉽게 남을 수 있다. 오일 보존은 단층및 이중층 장력과 두께를 모두 증가시키고 물방울 사이의 접촉 영역과 각도를 감소시킵니다. 이러한 메트릭은 약한 유착 상태를 의미합니다. 더 크고 부피가 큰 분자는 반대의 효과를 발휘합니다. 예를 들어, 스쿼렌은 육사데카네와 같은 알칸보다 부피가 큰 분자로, 이중 층 숱이 있는 동안 단층 사이에서 쉽게 배제될 수 있게 한다. 이와 같이, 스쿼렌에서 형성된 DIB는 더 얇고, 접촉 영역과 각도를 더 높게 표시하며,형성 22,42 (액적 물방울 접착의 척도)의 더 높은 자유로운 에너지를 나타낸다.
4. DIB의 온도 의존적 행동의 특성화
참고: 온도 변화가 멤브레인의 구조 및 운송 특성에 미치는 영향을 포함하여 DIB 기반 모델 멤브레인에서 많은 물리적 프로세스를 연구할 수 있습니다. 다음 단계는 원하는 온도에서 성공적인 이중 층 형성 후에 수행되어야합니다.
- 멤브레인(38)에서지질의 열tropic 상 전이를 식별할 수 있도록 이중층 형성을 허용하는 세트점에서 오일 배스의 온도를 낮추면서 멤브레인의 명목 커패시턴스를 측정한다.
- GUI의 온도 그래프를 마우스 오른쪽 단추로 클릭하고 표시된 데이터를 지웁웁입니다. 이렇게 하면 버퍼에 충분한 공간을 후속 레코딩에 사용할 수 있습니다.
- 패치 클램프 증폭기에 연결된 파형 발생기를 사용하여 DIB 전극에 삼각형 전압 파형(예: 10mV, 10Hz)을 적용하고 이중층을 통해 유도된 전류 반응을 기록한다.
- 5°C 단위로 세트포인트 온도를 낮추고 원하는 온도가 달성될 때까지 온도 변화 사이의 새로운 정상 상태 온도에서 최소 5분 대기하여 이중층을 냉각시킵니다. 또는 피드백 제어 시스템을 끄면 이중 레이어를 수동적으로 냉각해 보십시오. 그러나 50-60°C에서 수동 냉각을 구현하는 실험은 더 높은 결합 율을 초래한다는 점에 유의하십시오.
- 오일 목욕과 이중층이 원하는 최소 온도로 냉각된 후 GUI의 온도 그래프를 다시 클릭하고 온도 데이터와 시간 대 스프레드시트 소프트웨어로 내보냅니다. 현재 레코딩을 중지합니다.
- 측정된 전류로부터, 냉각 기간 동안 제곱파 전류 응답의 공칭 커패시턴스를 계산한다.
- 명목 커패시턴스(C) 대온도(T)를플롯하여 멤브레인 커패시턴스가 어떻게 변했는지 관찰한다. T M을 식별하려면 C 대 T의 비monotonic 변경 사항을 찾습니다.
참고: 명목 커패시턴스는 제곱파전류(43)의 진폭으로부터 계산할 수| i|) 관계 | 사용 나는 | = DV/dt가 전압 진폭의 4배와 동일한 C dv/dt(| V|) 및 적용 된 삼각형 전압의 주파수(f) 이러한 방정식에서 C = | i|/(4| V|f).
- 마찬가지로, 오일 목욕및 이중층 면적의 온도를 연속적으로 증가시킴으로써 고정 된 온도에서 이중 층의 준 정적 특정 커패시턴스(Cm)를평가합니다.
- GUI를 사용하여 10°C 단위로 세트 포인트 온도를 변경하고 시스템이 새 온도에 평형화할 수 있도록 합니다.
- 4.1.2 단계를 수행하여 정전 용량 전류 및 기록 측정을 시작합니다.
- 마이크로 조작기(즉, 전극분리를 분리하면 이중레이어 영역을 줄여줍니다)를 사용하여 전극의 위치를 신중하게 조정하여 이중레이어 영역을 변경합니다. 제곱파 전류가 일정한 상태 진폭에 도달하고 DIB의 이미지를 수집하여 현미경에 장착된 카메라를 사용하여 현미경 스테이지의 조리개에서 볼 수 있는 이중층을 이미지화하여 멤브레인 영역대 시간의 계산을 가능하게 한다. 동시에 현재 레코딩 소프트웨어에 디지털 태그를 추가하여 이미지 컬렉션에 해당하는 시간점을 표시합니다.
참고: 마이크로 조작기는 전극을 정밀하게 제어할 수 있으므로 방울 사이의 부드러운 접촉을 허용합니다. 물방울의 거친 조작은 물방울의 결합에 의해 또는 전극에서 떨어지는 물방울을 일으키는 원인이 되는 실패한 실험으로 이끌어 낼 수 있습니다. 다른 곳에서 설명한 바와같이,이중 레이어 영역은 아래쪽 뷰 이미지에서 겹치는 원으로 나타나는 방울 사이의 접촉 길이에서 계산됩니다. 액적의 위치와 치수 및 접촉 선의 길이는 이미지 처리 소프트웨어 또는 기타 과학 프로그래밍 도구를 사용하여 계산할 수 있습니다. - 4.2.1.2를 반복하여 총 5개의 DIB 이미지와 이중레이어 전류의 정상 상태 영역을 얻으려면 최소 4회.
- 원하는 각 온도에서 4.2.1 단계를 반복합니다.
- 획득된 이미지에 대해 상시 상태 이중레이어 영역에 해당하는 태그된 시간점에서 현재 레코딩 및 DIB 이미지를 분석하여 각 온도에 대한 C 및 A 데이터를 추출합니다.
- 각 온도에 대한 C 대 A 데이터를 플롯하고 각 온도22에서이중 레이어의 Cm을 나타내는 1차 회귀의 경사를 계산합니다.
- 4.2.4 단계 대 T에서얻은 Cm의 플롯 값.
- 용융 온도를 식별하기 위해 비 단조로운 변이에 대한 Cm 대 T 데이터를 검사합니다.
- GUI를 사용하여 10°C 단위로 세트 포인트 온도를 변경하고 시스템이 새 온도에 평형화할 수 있도록 합니다.
- 이중 레이어에 걸쳐 dc 전압 스텝 입력을 생성하여 전압 에의존하는 이온 채널 형성의 역학을 평가합니다.
- 초기 전압을 mV(예: 100mV)에서 원하는 단계 값으로 설정합니다.
- 최종 전압 및 스텝 크기를 원하는 단계보다 높은 값(예: 110mV 최종 전압 및 110mV 스텝 크기)으로 설정합니다.
- 단계 입력에 대해 원하는 지속 시간(예: 90s)을 설정합니다.
- 단계 입력에 대해 원하는 극성을 선택합니다(예: 양수).
- 패치 클램프 증폭기를 전환하여 GUI/전압 출력 모듈에서 발생하는 명령 전압을 헤드스테이지로 보냅니다.
- 현재 레코딩을 시작합니다.
- 전압을 켜고 임계 전압에 대한 S-자형 반응을 나타내야 하는 유도된 전류 응답을 기록합니다(예: 2 mg/mL BTLE에서 1 μg/mL Mz에 대한 ~70mV).
- 이와 는 별도로 멤브레인에 대한 동적 전류 전압 관계를 원하는 온도에서 획득하여 이온 채널 동작과 같은 전압 의존관계를 나타낼 수 있습니다.
- 패치 클램프 증폭기를 전환하여 파형 발생기에서 유래한 명령 전압을 헤드스테이지로 보내고 현재 레코딩을 시작합니다.
- 파형 발생기에서 원하는 진폭, 오프셋 및 주파수로 연속 부비동 파형을 출력합니다.
- 하나 또는 여러 사이클에서 유도된 전류 응답을 기록합니다.
- 다른 죄 파 진폭및 주파수 및 온도에 원하는대로 반복합니다.
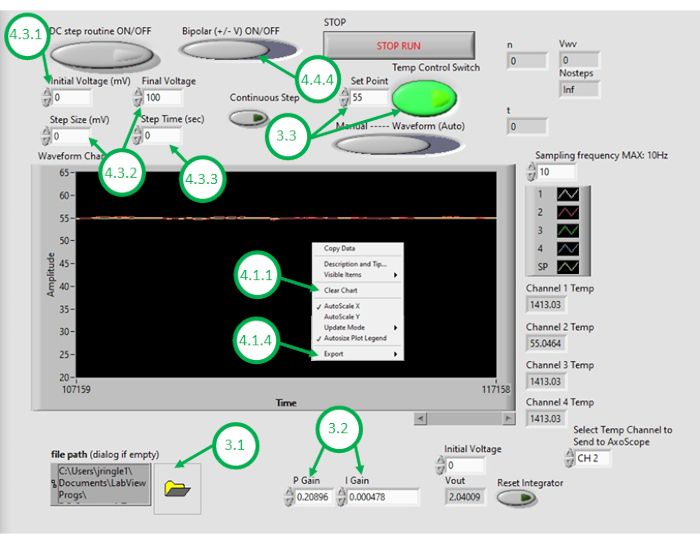
그림 3: 온도 제어 GUI. 이 수치는 프로그램의 GUI를 사용하여 오일 목욕의 온도를 제어하는 데 필요한 중요한 단계를 강조하고 라벨을 붙입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
도 1은 알루미늄 설비 및 아크릴 오일 저장소가 DIB 형성을 위한 현미경 단계에서 어떻게 제조되는지를 보여줍니다. 조립 단계 1.2-1.4는 보다 효율적인 가열을 위해 단계에서 설비를 열로 절연하는 역할을 합니다. 1.5-1.7 단계는 열전대를 고정장치에 올바르게 부착하고 오일 저장소를 배치하는 방법을 보여주며, 1.8 -1.9 단계는 이 조각에 오일을 분배하는 데 권장되는 위치를 보?...
토론
본 명세서에 기재된 프로토콜은 DIB를 형성하는 데 사용되는 오일 및 물방울의 온도를 제어하기 위해 실험 시스템을 조립하고 운영하기 위한 지침을 제공한다. 특히 RT 이상의 온도가 녹는 지질을 사용하여 DIB 형성을 가능하게 하는 데 특히 유용합니다. 더욱이, 오일 저수지의 온도를 정밀하게 변화시킴으로써, 이중층 온도는 커패시턴스, 면적, 두께, 유도된 열tropic 상 변화, 막 활성 종의 운동, 및 ?...
공개
저자는 이해 관계의 충돌이 없습니다.
감사의 말
재정 지원은 국립 과학 재단 그랜트 CBET-1752197및 과학 연구 보조금 FA9550-19-1-0213의 공군 사무실에 의해 제공되었다.
자료
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
참고문헌
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유