Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Температура контролируемой сборки и характеристики droplet интерфейс Bilayer
В этой статье
Резюме
В этом протоколе подробно используется система отопления, контролируемая температурой обратной связи, для содействия сборке липидных монослой и формированию бислойного интерфейса капель для липидов с повышенными температурами плавления, а также измерения емкости для характеристики изменений, обусловленных температурой в мембране.
Аннотация
Метод капельного интерфейса bilayer (DIB) для сборки липидных двуслойных (т.е. DIBs) между липидными аквестными каплями в масле предлагает ключевые преимущества по сравнению с другими методами: DIBs стабильны и часто долговечны, область билейера может быть обратимо настроена, листовка асимметрия легко контролируется с помощью капельных композиций, и ткани, как сети Формирование DIB требует спонтанной сборки липидов в липидные монослой высокой плотности на поверхностях капель. Хотя это происходит легко при комнатной температуре для общих синтетических липидов, достаточный монослой или стабильный билейер не может сформировать в аналогичных условиях для липидов с точками плавления выше комнатной температуры, в том числе некоторые клеточные липидные экстракты. Такое поведение, вероятно, ограничило составы и, возможно, биологическую значимость DIB в модельных мембранных исследованиях. Для решения этой проблемы представлен экспериментальный протокол для тщательного нагрева нефтяного резервуара, в которого обухотятся капли DIB, и характеризует влияние температуры на липидную мембрану. В частности, этот протокол показывает, как использовать теплопроводящий алюминиевый светильник и резисторные нагревательные элементы, контролируемые циклом обратной связи, чтобы назначать повышенные температуры, что улучшает сборку монослой и образование двухслойных для более широкого набора липидных типов. Структурные характеристики мембраны, а также термотропические фазы переходов липидов, включающих билейер, количественно измеряются путем измерения изменений электрической емкости DIB. Вместе эта процедура может помочь в оценке биофизических явлений в модельных мембранах по различным температурам, включая определение эффективной температуры плавления(ТМ)для многокомпонентных липидных смесей. Таким образом, эта возможность позволит более тесно реплицировать естественные фазовые переходы в модельных мембранах и будет способствовать образованию и использованию модельных мембран из более широкой полосы мембранных компонентов, включая те, которые лучше фиксируют неоднородность их клеточных аналогов.
Введение
Клеточные мембраны избирательно проницаемые барьеры, состоящие изтысяч липидных типов 1,белков, углеводов и стерий, которые инкапсулируют и субдивидуируют все живые клетки. Понимание того, как их составы влияют на их функции и выявление того, как природные и синтетические молекулы взаимодействуют с, придерживаются, нарушают и транслокируют клеточные мембраны, являются, следовательно, важными областями исследований с широкими последствиями в биологии, медицине, химии, физике и инженерии материалов.
Эти цели для открытия непосредственно выгоду от проверенных методов для сборки, манипулирования и изучения модели мембран, в том числе липидных билейеров, собранных из синтетических или естественных липидов, которые имитируют состав, структуру и транспортные свойства своих клеточных аналогов. В последние годы, капельный интерфейс bilayer (DIB)метод 2,3,4 для построения планар липидного билейера между липидным покрытием капли воды в масле получилзначительное внимание 5,6,7,8,9,10,11 ,11,12,13,14,15,16,17,18,19,20,21,22,23, ипродемонстрировалпрактические преимущества по сравнению с другими подходами для формирования мембраны модели: метод DIB прост в работе, не требует сложной изготовления или подготовки (например, "Картина") субстрата для поддержки мембраны, последовательно дает мембраны с долговечность, позволяет проводить стандартные электрофизиологические измерения и упрощает формирование модельных мембран с асимметричными листовочными композициями3. Потому что билайер формируется спонтанно между каплями и каждой капли могут быть адаптированы в положении и макияж, Техника DIB также привлекла значительный интерес к разработке клеточных материальныхсистем,которые опираются на использование стимулов-реакционных мембран18,24,25,26,27,28,29, сбалансированнойразобщенностии транспортировки 14,30,31,итканевых материалов 17,23,32,33,34,35,36.
Большинство опубликованных экспериментов на модельных мембранах, в том числе с ДИБами, проводились при комнатной температуре (RT, 20-25 градусов по Цельсию) и с горсткой синтетических липидов (например, DOPC, DPhPC и т.д.). Эта практика ограничивает сферу биофизических вопросов, которые могут быть изучены в модельных мембранах, и, на основе наблюдения, она также может ограничить типы липидов, которые могут быть использованы для сборки DIBs. Например, синтетический липид, такой как DPPC, который имеет температуру плавления 42 градусов по Цельсию, не собирает плотно упакованные монослои или не формирует DIBs на RT37. Формирование DIB при комнатной температуре также оказалось трудным для натуральных экстрактов, таких как млекопитающие (например, общий липидный экстракт мозга, BTLE)38 или бактерии (например, общий липидный экстракт Escherichia coli, ETLE)37, которые содержат множество различных типов липидов и происходят из клеток, которые находятся при повышенных температурах (37 градусов по Цельсию). Таким образом, включение изучения различных композиций дает возможность понять мембранные процессы в биологически соответствующих условиях.
Повышение температуры масла может служить двум целям: это увеличивает кинетики сборки монослой и это может привести к липидов пройти плавления перехода для достижения жидкой неупорядоченой фазы. Оба последствия помощи в монослойнойсборки 39, предварительно необходимые для DIB. В дополнение к нагреванию для формирования билейера, охлаждение мембраны после образования может быть использовано для выявления термотропных переходов в одиночных липидныхбилейзеров 38, в том числе в естественных липидных смесей (например, BTLE), которые могут быть трудно обнаружить с помощью калорий. Помимо оценки термотропных переходов липидов, точное изменение температуры DIB может быть использовано для изучения температурных изменений вмембранной структуре 38 и изучения того, как липидный состав и текучесть влияют на кинетику мембранно-активных видов (например, порообразующих пептидов и трансмембранныхбелков 37),в том числе млекопитающих и бактериальных мембран модели при физиологически соответствующей температуре (37 С).
В этом случае будет объяснено описание того, как собрать модифицированный нефтяной резервуар DIB и работать контроллер обратной связи-температуры, позволяющий сборку монослой и образование двухслойных при температурах выше РТ. Отличается от предыдущегопротокола 40, явные детали включены в отношении интеграции приборов, необходимых для измерения и контроля температуры параллельно сборки и характеристики DIB в нефтяном резервуаре. Таким образом, эта процедура позволит пользователю применять этот метод для формирования и изучения DIB в различных температурах в различных научных контекстах. Кроме того, репрезентативные результаты дают конкретные примеры типов измеримых изменений как в структуре мембран, так и в ионные транспортные изменения, которые могут происходить по мере изменения температуры. Эти методы являются важным дополнением ко многим биофизическим исследованиям, которые могут быть разработаны и эффективно выполнены в DIBs, в том числе изучение кинетики мембранно-активных видов в различных мембранных композициях.
протокол
1. Подготовка нагретого арматуры
- Соберите 2 куска 1 мм толщиной изолятора резины обрезается до 25 мм х 40 мм в ширину и длину, соответственно, 2 части 6 мм толщиной резины, которые также 25 мм х 40 мм, подготовленный алюминиевый базовый прибор сборки, и акриловое масло резервуар, который помещается в смотровое окно алюминиевого базового прибора (см. рисунки S1, S2, и S3 для деталей на изготовление и взорвался вид сборки). Подготовка алюминиевого приспособления во-первых, прикрепив к нижней части прибора стекло coverslip смотровое окно с УФ излечимый клей и придерживаясь 1 резистивный нагревательный элемент в верхней части каждого 25 мм х 25 мм боковой фланг прибора.
- Поместите тонкие резиновые куски на сцену микроскопа так, что длинный край каждого куска является касательным к открытию сцены, как показано нарисунке 1).
- Распоить алюминиево-базовый прибор поверх изоляционных прокладок со смотровым окном прибора, расположенным выше объектива. Для визуализации соединенных капель требуется правильное выравнивание.
- Поместите более толстый кусок резины поверх каждого резистивного нагревательного элемента и используйте зажим стадии микроскопа, чтобы держать его на месте. Эти части защищают нагревательные элементы от повреждений, вызванных сценическими зажимами, и изолируют от случайного электрического замыкания между нагревательных элементов и как алюминиевого прибора, так и стадии микроскопа.
- Тщательно согните измерительный конец термокоупля, чтобы достичь угла в 90 градусов с конца.
- Вставьте изогнутый кончик термокрейла в левый нижний угол алюминиевого светильника и аккуратно закрепите его запирая винтом.
- Поместите акриловый резервуар в колодец алюминиевого светильника. Это делается до добавления гексадеканового масла в колодец (шаг 1.8) алюминиевого прибора, чтобы свести к минимуму риск захвата пузырьков воздуха между смотровым окном и дном акрилового резервуара, который может препятствовать обзору капель.
ПРИМЕЧАНИЕ: Масло, добавленное в смотровой отсек алюминиевого прибора, используется для хранения рефракционных индексов акрила и стекла для более четкой визуализации капель, содержащихся в акриловом резервуаре. Таким образом, стоит отметить, что масло в колодец алюминиевой арматуры не соедается с содержимым акрилового резервуара и строгая очистка алюминиевого прибора не требуется. - Выпределите 1000 евро гексадеканового масла в колодец алюминиевого светильника (т.е. между стенками акрилового резервуара и алюминиевого прибора), заботясь о том, чтобы не переполнить. Уровень масла в колодец алюминиевого светильника должен быть выше, чем позволяет максимизировать площадь поверхности для передачи тепла, не позволяя нефти разлива по краям прибора на стадии микроскопа или объектива цели.
- Выпределите 1000 фунтов гексадеканового масла в акриловый резервуар, оставаясь при этом внимательным к тому, чтобы не переполнить его.
ПРИМЕЧАНИЕ: Акриловый резервуар всегда должен быть тщательно очищен между экспериментами. Пользователь должен использовать полк, состоящий из последовательных полосканий этил-алкоголем и деионизированной водой с последующим высыханием в чаше децикатора более 12 ч.

Рисунок 1: Нагретая сценическая сборка. Изображения показывают сборку теплопроводяющей арматуры и нефтяного резервуара для формирования DIB; числа под каждым изображением определяют соответствующий шаг протокола. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Инструменты для одновременного контроля температуры обратной связи и электрической характеристики DIB
ПРИМЕЧАНИЕ: Этот протокол интегрирует следующие инструменты для обеспечения контроля температуры обратной связи и одновременной электрической характеристики DIB: персональный компьютер (PC) с двумя доступными универсальными серийными соединениями буса (USB), усилитель патч-зажима в паре с специализированной системой получения данных (ДАЗ-1), генератор волновой формы, второй программируемый ДАЗ (ДАЗ-2) с выходом напряжения и температурными входными модулями, а также электрогенератором/ усилителем. Следующие шаги описывают необходимые связи этих приборов (как показано на рисунке 2a), необходимых для изоляции измерения и контроля температуры от одновременной электрофизиологии DIB. По мере необходимости может быть сделана замена эквивалентных инструментов.
- Установить выходные и входные соединения с модулями ДАЗ-2.
- Выберите две пары винтовых терминалов на модуле вывода напряжения для дифференциальных соединений напряжения и прикрепите провод приводит к этим местам. Нечетные число терминалов являются общими наземными соединениями, а терминалы четных номеров являются необоснованными выходами, как показано нарисунке 2c). Подключите каждую из этих двух пар свинцовых проводов к отдельным адаптерам screw-terminal-BNC, а затем подключите каждый адаптер к отдельному кабелю BNC, используемому для маршрутного передачи сигналов напряжения к другим инструментам.
ПРИМЕЧАНИЕ: В этой настройке дифференциальные соединения на терминалах 0 и 1 назначаются для выхода контроля температуры усилителю питания, в то время как другая пара соединений на терминалах 6 и 7 предназначена для выхода напряжения, который будет отправлен в капли через усилитель зажима патча. - Ссылаясь на(рисунок 2c), выберите один набор термокомпых терминалов (например, терминалы 2 и 3 обозначены как пара TC1) на термокопловом входном модуле и подключите к нему термокомпые провода.
- Выберите две пары винтовых терминалов на модуле вывода напряжения для дифференциальных соединений напряжения и прикрепите провод приводит к этим местам. Нечетные число терминалов являются общими наземными соединениями, а терминалы четных номеров являются необоснованными выходами, как показано нарисунке 2c). Подключите каждую из этих двух пар свинцовых проводов к отдельным адаптерам screw-terminal-BNC, а затем подключите каждый адаптер к отдельному кабелю BNC, используемому для маршрутного передачи сигналов напряжения к другим инструментам.
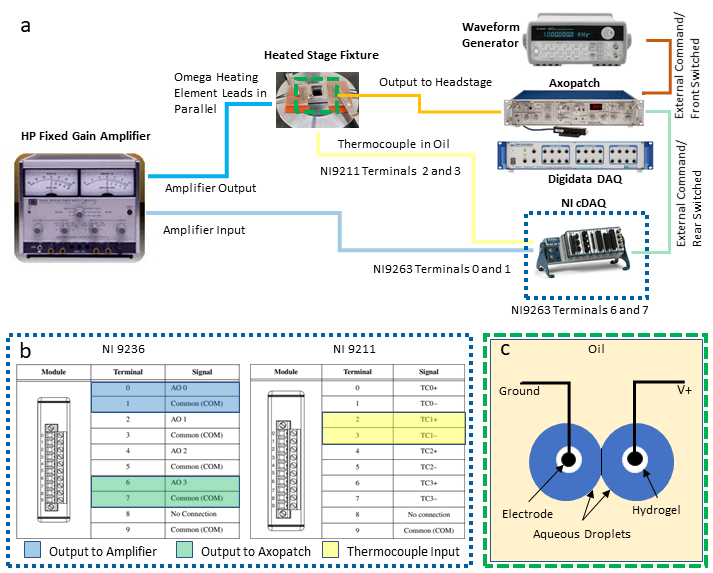
Рисунок 2: Подключение системной проводки. Схема устройств и проводки, необходимых для системы, отображаетсяв a, в то время как подробный взгляд на соединения ДАЗ-2 предоставляется в (b). Иллюстрация в c) показываетаковые капли на электродах с гидрогельным покрытием, погруженных в масло для образования DIB. Два электрода соединены с заземленными и необоснованными соединениями (ВЗ), соответственно, на головной части усилителя зажима патча. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- После подключения к модулям ДАЗ-2 подключите шасси ДАК-2 к ПК через USB-соединение и подключим к источнику питания. Затем подтвердите успешную установку драйвера и программного обеспечения перед использованием с коммерческим программным обеспечением.
- Настройте и соедините усилитель питания между элементами ДАЗ-2 и резисторным нагревательным элементом.
- Настройте усилитель для работы в режиме усиления фиксированной прибыли с выигрышем 10X.
- Используя адаптер banana jack-BNC, подключите кабель BNC, исходящий от терминалов 0 и 1, на выходе из модулянапряжения (рисунок 2b)к входным соединениям на усилителе питания.
- Используя дополнительные адаптеры ИНК и кабели, подключите выходные терминалы усилителя питания к обоим наборам нагревательных элементов, которые подключены параллельно друг другу, и усилителю, чтобы обе элемента поддерживать одинаковое падение напряжения во время использования.
- Установить необходимые соединения для электрофизиологического оборудования.
- Подключите кабель BNC, исходящий от терминалов 6 и 7 на модуле выводанапряжения (рисунок 2b)к разъемам заднего переключенного внешнего командования BNC на задней части усилителя зажима патча.
- Подключите второй кабель BNC между выходом генератора волновой формы и соединением внешнего командования Front Switch на задней части усилителя зажима патча.
ПРИМЕЧАНИЕ: Эти два соединения обеспечивают альтернативные методы для генерации волновых форм напряжения, которые применяются к каплям электродов через усилитель зажима патча. Генератор волновой формы особенно полезен для генерации треугольных волнообразных напряжений, используемых для измерения емкости мембраны. Пользователь может решить, какие из них необходимы для собственного приложения. - С помощью третьего кабеля BNC подключите выход измеренного тока, расположенного на передней панели усилителя зажима патча, к доступен аналоговому разъему BNC на передней панели ДАЗ-1.
- С помощью четвертого кабеля BNC соедините выход измеренного мембранного напряжения (на задней части усилителя зажима патча) с отдельным аналоговым входным разъемом на ДАЗ-1. Это позволяет оцифровки напряжения, применяемого через электроды.
- С двумя каплями электродов подготовлены и поддерживаются на микроманипуляторов, как описано в шагах 7-9 в ref.40, подключить электрод приводит к патч зажим headstage, который прилагается через кабель к усилителю зажима патч.
ПРИМЕЧАНИЕ: Роль головной сцены заключается в контроле напряжения между электродами и измерении полученного тока, который преобразуется в пропорциональное напряжение, которое получает выход усилителем зажима патча в ДАЗ-1. - Подключите ДАК-1 к ПК через USB-соединение и подключите соответствующие кабели питания как к усилителю зажима патча, так и к ДАЗ-1.
- Питание на всех измерительных приборов.
ПРИМЕЧАНИЕ: Возможно, наиболее важной деталью в этой установке является обеспечение выхода усилителя питания (mA-A) соединения электрически изолированы от головного блока усилителя зажима патча, который использует чувствительную схему для измерения тока уровня pA-nA в DIB.
3. Контроль температуры обратной связи капель интерфейса bilayers
ПРИМЕЧАНИЕ: Следующие шаги для работы системы контроля температуры обратной связи основаны на пользовательском графическом пользовательском интерфейсе (GUI), созданном для реализации пропорционально-интегрального (PI)контроля температуры обратной связи 40,41 (см. Дополнительные файлы кодирования). Вместо этого могут использоваться другие алгоритмы программного обеспечения и управления. Копия этой программы предоставляется читателю с дополнительной информацией для бумаги, однако пользователь несет ответственность за настройку его для собственного оборудования и потребностей.
- Запустите программное обеспечение ДАК-2 на ПК и откройте файл программы контроля температуры. Как только графический интерфейс откроется, откройте программу снова, нажав на значок папки в левом нижнем углу графического интерфейса и выбрав программу контроля температуры(рисунок 3).
- Введите соответствующие численные значения для получения пропорциональногоконтроля (KP)и интегрального усиления управления(KI).
ПРИМЕЧАНИЕ: KP и K Iзначения 0,598 и 0,00445, соответственно, были найдены хорошо работать в установке. Эти значения были определены итеративно с помощью моделирования с использованием системной модели, которая включает параметры, полученные от измеренных ответов на нагревание с открытым циклом (см. рисунок 4). Во время нагрева открытой петлипредписанная теплоснабжаемая мощность не зависит от измеренной температуры. В отличие от этого, отопление замкнутой петли состоит из постоянной регулировки применяемой мощности к нагревателям таким образом, чтобы помочь приблизить измеренную температуру к желаемой температуре. Это достигается в настоящем случае с помощью схемы управления PI. - Чтобы проверить схему контроля температуры, введите нужную температуру точки набора (выше комнатной температуры), а затем включите контроль температуры обратной связи в рамках ГРАФИЧЕСКОГО интерфейса. Наблюдайте за измеренным температурным сигналом под контролем обратной связи (замкнутого цикла), который отображается в графическом интерфейсе в течение следующих нескольких минут. Если измеренная температура масла значительно перевыполнять нужную температуру, реагирует слишком медленно на изменения, или не сходится с желаемой точкой набора, пользователю необходимо будет настроить контроль выгоды для достижения желаемой производительности замкнутого цикла.
ПРИМЕЧАНИЕ: Программа определяет предел насыщения для питания (и, следовательно, напряжения), поставляемого в резистивные нагревательные элементы. Например, два элемента, о которых сообщается в настоящем, потребляют до 5 Вт энергии каждый. Параллельное их проводка означает, что общее энергопотребление не должно превышать 10 Вт. Пользователю рекомендуется учитывать максимальное количество энергии, которое должно быть поставлено на устройства, и знать, что этот предел может повлиять на скорость, с которой система замкнутого цикла будет реагировать на желаемые изменения температуры. Более высокие элементы обогрева питания обеспечивают более быстрое нагревание и более высокие температуры тока, но требуют более высоких поставляемых тока для отопления. - С помощью системы, настроенной на приемлемую производительность замкнутого цикла, введите нужную температуру масла для формирования DIB в качестве установленной точки в графическом интерфейсе.
ПРИМЕЧАНИЕ: Например, установленная температура точки 60 градусов по Цельсию дала хорошие результаты в экспериментах с липосомами BTLE в акальных каплях37. Пользователь сослался в другомместе 2,40 для протоколов, объясняющих DIB сборки между каплями висит на проволоке типа электродов и конфигурации электрофизиологического оборудования с использованием усилителя патч зажим, ДАЗ-1, и электрофизиологии измерения программного обеспечения. В частности, протокол Najem, и др.40 можно внимательно следить до шага 13. Помимо этого шага, несколько иной подход используется для успешного формирования монослой и двуслойных при использовании липидов, которые требуют нагрева для содействия монослой или двухслойного образования. - Опустите кончики серебра / серебра хлорида (Ag/AgCl) электроды в масло, пока они почти не коснуться нижней части акрилового резервуара. Такое позиционирование наконечников электрода имеет решающее значение для хранения капли на электроде в нагретом масле, где конвективные токи в масле наблюдались, чтобы отделить капли от электродов с гидрогелем(рисунок 2c).
- Pipette 250 nL капли аквеозного липидного раствора, содержащего 2 мг/мл BTLE, 100 мМ хлорида калия (KCl), и 10 mM 3-(N-morpholino) пропансульфоновой кислоты (MOPS) на каждом кончике электрода и дайте им инкубировать в нагретом масле в течение как минимум 10 минут для содействия образованию монослой.
- Обложка headstage и подогревом сцены приспособление с заземленной клетке Фарадея.
- Принесите капли в нежный контакт медленно
манипулирование горизонтальным положением электродов до тех пор, пока пользователь не увидит, что капли деформируются от контакта или не начнет вытеснять друг друга, и подождите несколько минут, пока не начнется образование билейера. Если через несколько минут двуслойник не сформировался, капли могут быть принуждены вместе больше, чтобы облегчить образование билейера. Формирование истонченного межфациального бислойного можно подтвердитьс помощью визуального осмотра (рисунок 5а)или путем измерения увеличения амплитуды квадратно-волнового емкостного тока, индуцированного волнообразным генератором, выдающий треугольное напряжение 10Гц 22. Разрешить bilayer равномерный в течение как минимум 10 минут, чтобы достичь устойчивой межфациальной области, при первоначальном формировании и до последующей характеристики в начальной точке набора.
ПРИМЕЧАНИЕ: Тип масла может оказать значительное влияние на истончение двухслойных, толщина мембраны, и меж капельного угла контакта. В общем, чем меньше молекула масла, тем легче она может оставаться в гидрофобном ядре билейера, занятого липидными ариловой цепями. Удержание масла увеличивает как монослойное, так и билейерное напряжение и толщину и уменьшает область и угол контакта между каплями. Эти показатели означают более слабое состояние адгезии. Большие, громоздкие молекулы оказывают противоположный эффект. Например, сквален является более громоздкой молекулой, чем алканы, такие как гексадекан, что позволяет легко исключить его из монослой во время истончения билейера. Таким образом, DIBs, образованные в сквалене тоньше, они отображают более высокие контактные области и углы, и они демонстрируют более высокие свободныеэнергииформирования22,42 (мера капли капли адгезии).
4. Характеристика поведения, зависящего от температуры в ДИБ
ПРИМЕЧАНИЕ: Многие физические процессы могут быть изучены в DIB основе модели мембран, в том числе, как изменения температуры влияют на структуру и транспортные свойства мембраны. Следующие шаги должны быть выполнены после успешного формирования билейера при желаемой температуре.
- Измерьте номинальную емкость мембраны при одновременном снижении температуры масляной ванны с установленной точки, которая позволяет двухслойное образование для выявления термотропных фазовых переходов липидов вмембране 38.
- Нажмите правой кнопкой "График температуры" на графическом интерфейсе и очистите отображаемые данные. Это гарантирует, что достаточно места в буфере доступно для последующих записей.
- Используя генератор волновой формы, подключенный к усилителю зажима патча, нанесите треугольную волновую форму напряжения (например, 10 мВ, 10 Гц) через электроды DIB и замитвните индуцированную реакцию тока через билейер.
- Охладить билейер, снизив температуру установленного уровня приращениями на 5 градусов Цельсия и ожидая минимум 5 минут при новой устойчивой температуре между изменениями температуры до достижения желаемой температуры. Кроме того, попробуйте пассивное охлаждение билейера, выключив систему управления обратной связью. Имейте в виду, однако, что эксперименты по внедрению пассивного охлаждения от 50-60 градусов по Цельсию привели к более высоким темпам коалесценции.
- После того, как масляная ванна и билейер остынет до нужной минимальной температуры, нажмите на график температуры в графическом интерфейсе снова и экспорт данных о температуре по сравнению со временем в электронную таблицу программного обеспечения. Остановите текущую запись.
- Из измеренного тока вычислите номинальную емкость квадратной волно-текущей реакции по сравнению со временем в период охлаждения.
- Участок номинальной емкости (C) по сравнению стемпературой ( T), чтобы наблюдать, как мембрана емкости изменилась. Найдите немонотонические изменения в C и T для идентификации TM.
ПРИМЕЧАНИЕ: Номинальная емкость может быть рассчитана по амплитуде квадратно-волновоготока 43 (| I|) использование отношения | Я| C dv/dt, где dv/dt равен в четыре раза продукт амплитуды напряжения(| В|) и частота(f)прикладного треугольного напряжения. Из этих уравнений, C и | Я |/(4| В|f).
- Аналогичным образом, оценить квази-статические конкретные емкости (Cм) из bilayer при фиксированных температурах путем последовательного увеличения температуры масляной ванны и площади билейера.
- Измените температуру установленного пункта приращениями на 10 градусов по Цельсию с помощью графического интерфейса и позвольте системе уравночные до новой температуры.
- Выполните шаг 4.1.2, чтобы инициировать измерение емкостного тока и записи.
- Измените область двухслойного, тщательно регулируя положение электродов с помощью микромипуляторов (т.е. разделение электродов уменьшает площадь билейера). Разрешить для квадратного волнового тока для достижения стабильного состояния амплитуды и собирать изображения DIB, чтобы позволить расчет области мембраны по сравнению со временем с помощью камеры, установленной на микроскоп для изображения билейера, как видно из диафрагмы микроскопа этапе. Одновременно добавьте цифровой тег в текущее программное обеспечение для записи, чтобы отметить соответствующую точку времени для сбора изображений.
ПРИМЕЧАНИЕ: Микро-манипуляторы позволяют точно контролировать электроды и, таким образом, мягкий контакт между каплями. Грубые манипуляции каплями могут привести к неудачному эксперименту путем сгливания капель или путем причинения капли упасть электрода. Как уже говорилосьв других местах 22, область билейера рассчитывается из длины контакта между каплями, которые отображаются как перекрывающиеся круги на изображении снизу. Положение и размеры капель, а также длина линии соприкосновения могут быть рассчитаны с помощью программного обеспечения для обработки изображений или с помощью других научных инструментов программирования. - Повторите шаг 4.2.1.2 минимум 4 раза, чтобы получить в общей сложности 5 DIB изображений и устойчивых состояний регионов билейного тока.
- Повторите шаг 4.2.1 при каждой желаемой температуре.
- В отмеченных точках времени, соответствующих областям бислойного состояния для полученных изображений, проанализируйте текущие записи и изображения DIB для извлечения данных C и A для каждой температуры.
- Участок C против данных для каждой температуры и вычислить наклон регрессии первого порядка, которая представляет собой Cм бислой при каждой температуре22.
- Значения участка Cm, полученные из шага 4.2.4 против T.
- Изучите данные Cm по сравнению с T на не монотонные вариации для определения температуры плавления, TM.
- Измените температуру установленного пункта приращениями на 10 градусов по Цельсию с помощью графического интерфейса и позвольте системе уравночные до новой температуры.
- Оцените динамику формирования ионных каналов, зависящих от напряжения, генерируя входный шаг dc напряжения через билейер.
- Установите начальное напряжение до желаемого значения шага в mV (например, 100 мВ).
- Установите окончательное напряжение и размер шага до значения выше желаемого шага (например, 110 мВ конечного напряжения и 110 мВ шаг размер).
- Установите желаемое время длительности для ввода шага в секундах (например, 90 с).
- Выберите желаемую полярность для ввода шага (например, положительный).
- Включите усилитель зажима патча, чтобы отправить на головной сцене командное напряжение, возникают из модуля вывода GUI/voltage.
- Инициировать текущие записи.
- Включите напряжение и замечем индуцированную текущую реакцию, которая должна дать S-образную реакцию на критическое напряжение (например, 70 мВ за 1 мкг/мл МЗ в 2 мг/мл BTLE).
- Отдельно, динамические отношения тока-напряжения для мембраны можно получить на пожеланные температуры для того чтобы показать напряжения-зависимые отношения, such as поведение канала иона.
- Переключите усилитель зажима патча, чтобы отправить на головной сцену командное напряжение, возникают из генератора волновой формы, и инициировать текущие записи.
- На генераторе волновой формы выводится непрерывная синусоидальная волновая форма с желаемой амплитудой, смещением и частотой.
- Завехать индуцированную текущую реакцию в течение одного или нескольких циклов.
- Повторите по желанию для различных амплитуд синус волн и частот и температур.
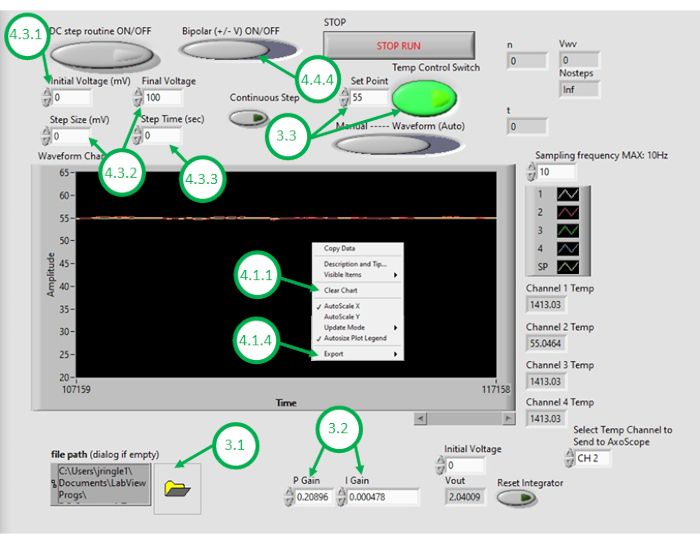
Рисунок 3: Графический интерфейс контроля температуры. Эта цифра подчеркивает и маркирует критические шаги, необходимые для использования графического интерфейса программы для контроля температуры масляной ванны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
На рисунке 1 показано, как на стадии микроскопа готовятся алюминиевые светильники и акриловое масло. Сборка шаги 1.2-1.4 служить для термически изолировать приспособление от сцены для более эффективного отопления. Шаги 1.5-1.7 показывают, как правильно прикрепить термокупл к...
Обсуждение
В описанном в настоящем протоколе содержатся инструкции по сборке и эксплуатации экспериментальной системы контроля температуры масла и капель, используемых для формирования ДИБ. Это особенно полезно для включения образования DIB с использованием липидов, которые имеют температуру п?...
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Финансовую поддержку оказали Национальный научный фонд Грант CBET-1752197 и Управление ввс по научным исследованиям Грант FA9550-19-1-0213.
Материалы
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Ссылки
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены