A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הרכבה ואפיון מבוקרי טמפרטורה של Bilayer ממשק טיפה
In This Article
Summary
פרוטוקול זה מפרט את השימוש במערכת חימום מבוקרת טמפרטורת משוב כדי לקדם הרכבה מונולאייר השומנים ואת היווצרות bilayer ממשק טיפה עבור שומנים עם טמפרטורות התכה גבוהות, ומדידות קיבוליות לאפיון שינויים מונחי טמפרטורה בקרום.
Abstract
שיטת bilayer ממשק טיפה (DIB) להרכבת bilayers השומנים (כלומר, DIBs) בין טיפות מימיות מצופות שומנים בשמן מציע יתרונות מרכזיים לעומת שיטות אחרות: DIBs הם יציבים ולעתים קרובות לאורך זמן, אזור bilayer ניתן לכוונן באופן הפיך, אסימטריה עלון נשלטת בקלות באמצעות קומפוזיציות טיפה, רשתות כמו רקמות של bilayers ניתן להשיג על ידי הסמוך טיפות רבות. יצירת DIBs דורש הרכבה ספונטנית של שומנים לתוך monolayers השומנים בצפיפות גבוהה על פני השטח של טיפות. בעוד זה קורה בקלות בטמפרטורת החדר עבור שומנים סינתטיים נפוצים, monolayer מספיק או bilayer יציב אינו מצליח להיווצר בתנאים דומים עבור שומנים עם נקודות התכה מעל טמפרטורת החדר, כולל כמה תמציות שומנים הסלולר. התנהגות זו הגבילה ככל הנראה את ההרכבים – ואולי גם את הרלוונטיות הביולוגית – של DIBs במחקרי קרום מודל. כדי לטפל בבעיה זו, פרוטוקול ניסיוני מוצג כדי לחמם בזהירות את מאגר הנפט המארח טיפות DIB ולאפיין את ההשפעות של הטמפרטורה על קרום השומנים. באופן ספציפי, פרוטוקול זה מראה כיצד להשתמש גוף אלומיניום מוליך תרמית ואלמנטים חימום התנגדותי נשלט על ידי לולאת משוב לרשום טמפרטורות גבוהות, אשר משפר הרכבה monolayer היווצרות bilayer עבור קבוצה רחבה יותר של סוגי שומנים. מאפיינים מבניים של הממברנה, כמו גם את המעברים שלב תרמוטרופי של השומנים המרכיבים את bilayer, הם מכמתים על ידי מדידת השינויים קיבוליות חשמלית של DIB. יחד, הליך זה יכול לסייע בהערכת תופעות ביופיזיות בקרומי מודל על פני טמפרטורות שונות, כולל קביעת טמפרטורת התכה יעילה (TM) עבור תערובות שומנים רב רכיבים. יכולת זו תאפשר כך שכפול קרוב יותר של מעברי פאזה טבעיים בקרומי מודל ותעודד היווצרות ושימוש בקרומי מודל ממגוון רחב יותר של מרכיבי קרום, כולל אלה הלוכדים טוב יותר את ההטרוגניות של עמיתיהם התאיים.
Introduction
ממברנות הסלולר הן מחסומים חדירים באופן סלקטיבי המורכבים מאלפי סוגי שומנים1, חלבונים, פחמימות וטרולים העוטפים ומחלקים את כל התאים החיים. הבנת האופן שבו הרכביהם משפיעים על תפקודיהם וחושפים כיצד מולקולות טבעיות וסינתטיות מתקשרות, דבקות, משבשות ומשתנות קרום תאי, ולכן תחומי מחקר חשובים בעלי השלכות רחבות היקף בביולוגיה, רפואה, כימיה, פיזיקה והנדסת חומרים.
מטרות אלה לגילוי נהנות ישירות מטכניקות מוכחות להרכבה, מניפולציה ולימוד של ממברנות מודל – כולל ביליאריות שומנים המורכבות משומנים סינתטיים או טבעיים – המחקות את ההרכב, המבנה ותכונות ההובלה של מקביליהם התאיים. בשנים האחרונות, ממשק טיפה bilayer (DIB) שיטה2,3,4 לבניית bilayer השומנים מישורי בין טיפות מים מצופות שומנים בשמן קיבל תשומת לב משמעותית 5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23, והפגין יתרונות מעשיים על פני גישות אחרות עבור היווצרות קרום מודל: שיטת DIB היא פשוטה לביצוע, לא דורש ייצור או הכנה מתוחכמים (למשל, "ציור") של מצע לתמיכה בקרום, מניב באופן עקבי ממברנות עם מעולה אריכות ימים, מאפשר מדידות אלקטרופיזיולוגיות סטנדרטיות, ומפשט את היווצרותם של קרום מודל עם קומפוזיציות עלון אסימטרי3. מכיוון שהדו-שכבה נוצרת באופן ספונטני בין טיפות וכל טיפה יכולה להיות מותאמת במיקום ובאיפור, טכניקת DIB משכה גם עניין רב בפיתוח מערכות חומר בהשראת תאים המתבססות על שימוש בקרומים מגיביםלגירויים 18,24,25,26,27,28,29,מידור מאוזן והובלה14,30,31, וחומרים דמויירקמות 17,23,32,33,34,35,36.
רוב הניסויים שפורסמו על קרום המודל, כולל אלה עם DIBs, בוצעו בטמפרטורת החדר (RT, ~ 20-25 מעלות צלזיוס) ועם קומץ שומנים סינתטיים (למשל, DOPC, DPhPC, וכו '). תרגול זה מגביל את היקף השאלות הביופיזיות שניתן ללמוד בקרומי מודל, ובהתבסס על התבוננות, הוא יכול גם להגביל את סוגי השומנים שניתן להשתמש בהם להרכבת DIBs. לדוגמה, שומנים סינתטיים כגון DPPC, אשר יש טמפרטורת התכה של 42 °C (69 °F), אינו להרכיב monolayers ארוז היטב או טופס DIBs ב RT37. היווצרות DIB בטמפרטורת החדר הוכיחה גם קשה עבור תמציות טבעיות, כגון אלה מיונקים (למשל, תמצית השומנים הכוללת במוח, BTLE)38 או חיידקים (למשל, תמצית השומנים הכוללת Escherichia coli, ETLE)37, אשר מכילים סוגים רבים ושונים של שומנים ומקורם תאים המתגוררים בטמפרטורות גבוהות (37 °C (37 °F). מתן אפשרות ללמוד קומפוזיציות מגוונות ובכך מספק הזדמנויות להבנת תהליכים בתיווך ממברנה בתנאים רלוונטיים ביולוגית.
העלאת הטמפרטורה של השמן יכולה לשרת שתי מטרות: זה מגביר את הקינטיקה של הרכבה monolayer וזה יכול לגרום שומנים לעבור מעבר נמס להגיע לשלב מופרע נוזלי. שתי ההשלכות מסייעות בהרכבה חד שכבתית39, דרישה מוקדמת עבור DIB. בנוסף לחימום להיווצרות bilayer, קירור הממברנה לאחר היווצרות יכול לשמש כדי לזהות מעברים תרמוטרופיים bilayers השומנים יחיד38, כולל אלה תערובות השומנים הטבעיות (למשל, BTLE) זה יכול להיות קשה לזהות באמצעות קלורימטריה. מלבד הערכת מעברים תרמוטרופיים של שומנים, דווקא שינוי הטמפרטורה של DIB יכול לשמש כדי לחקור שינויים הנגרמים על ידי טמפרטורה במבנה קרום38 ולבחון כיצד הרכב השומנים ונזילות להשפיע על קינטיקה של מינים פעילים קרום (למשל, פפטידים יוצרי נקבוביות וחלבונים transmembrane37), כולל קרום מודל יונקים וחיידקים בטמפרטורה רלוונטית מבחינה פיזיולוגית (37 מעלות צלזיוס).
להלן, תיאור של כיצד להרכיב מאגר שמן DIB שונה ולהפעיל בקר משוב טמפרטורה כדי לאפשר הרכבה monolayer היווצרות bilayer בטמפרטורות גבוהות יותר RT יוסבר. בהבדיל מפרוטוקול40הקודם , נכלל פרט מפורש לגבי שילוב המכשור הדרוש למדידה ובקרה של הטמפרטורה במקביל להרכבה ואפיון של ה- DIB במאגר הנפט. ההליך יאפשר למשתמש ליישם שיטה זו לגיבוש ולימוד DIBs על פני מגוון טמפרטורות במגוון הקשרים מדעיים. יתר על כן, התוצאות הייצוגיות מספקות דוגמאות ספציפיות לסוגי השינויים הניתנים מדידה הן במבנה הממברנה והן בהובלת היונים שיכולים להתרחש מכיוון שהטמפרטורה מגוונת. טכניקות אלה הן תוספות חשובות למחקרים הביופיזיים הרבים שניתן לתכנן ולבצע ביעילות ב- DIBs, כולל לימוד הקינטיקה של מינים פעילים בקרום בהרכבי קרום שונים.
Protocol
1. הכנת מתקן מחומם
- לאסוף 2 חתיכות של גומי מבודד בעובי 1 מ"מ קצוץ ל 25 מ"מ x 40 מ"מ רוחב ואורך, בהתאמה, 2 חתיכות של גומי 6 מ"מ עבה כי הם גם 25 מ"מ x 40 מ"מ, מכלול בסיס אלומיניום מוכן, מאגר שמן אקרילי שמתאים בחלון הצפייה של גוף בסיס אלומיניום (ראה איורים S1, S2, ו S3 לפרטים על ייצור תצוגה מתפוצצת של הרכבה). הכינו תחילה את גוף האלומיניום על ידי הצמדה לתחתית המתקן חלון צפייה מכוסה זכוכית עם דבק UV לריפוי ודבק 1 גוף חימום התנגדותי לחלק העליון של כל אוגן צד 25 מ"מ x 25 מ"מ של המתקן.
- מניחים את חתיכות הגומי הדקות יותר על במת המיקרוסקופ כך שהקצה הארוך של כל חתיכה משיק לפתיחת הבמה כפי שמוצג ב -איור 1.
- מקם את גוף בסיס האלומיניום על גבי רפידות הבידוד עם חלון הצפייה של המתקן ממורכז מעל העדשה האובייקטיבית. נדרש יישור נכון להדמיית הטיפות המחוברות.
- מניחים חתיכת גומי עבה יותר על גבי כל גינל חימום התנגדותי ומשתמשים בקליפ שלב מיקרוסקופ כדי להחזיק אותו במקומו. חלקים אלה מגנים על גופי החימום מפני נזק שנגרם על ידי מהדקי הבמה ומבודדים מפני קצר חשמלי מקרי בין גופי החימום והן גוף האלומיניום לשלב המיקרוסקופ.
- בזהירות לכופף את קצה המדידה של thermocouple כדי להשיג זווית של 90 ° ב ~ 4 מ"מ מהקצה.
- הכנס את הקצה הכפוף של התרמופול לפינה השמאלית התחתונה של גוף האלומיניום ואבטח אותו בעדינות באמצעות בורג הנעילה.
- מניחים את המאגר האקרילי בבאר של גוף האלומיניום. זה נעשה לפני הוספת שמן הקסדקאן לבאר (שלב 1.8) של מתקן האלומיניום כדי למזער את הסיכון של לכידת בועות אוויר בין חלון הצפייה לתחתית המאגר האקרילי, אשר יכול לחסום את התצוגה של טיפות.
הערה: שמן שנוסף לתא הצפייה של גוף האלומיניום משמש להתאמת מדדי השבירה של האקריליק והזכוכית להדמיה ברורה יותר של הטיפות הכלולות במאגר האקרילי. לכן, ראוי לציין כי שמן בבאר של מתקן אלומיניום אינו יוצר קשר עם התוכן של המאגר האקרילי וניקוי קפדני של מתקן אלומיניום אינו נדרש. - לוותר ~ 1,000 μL של שמן הקסדקאן לתוך הבאר של מתקן אלומיניום (כלומר, בין הקירות של המאגר האקרילי גוף אלומיניום), מקפיד לא למלא יתר על המידה. רמת השמן בבאר של מתקן האלומיניום צריכה להיות גבוהה ככל האפשר כדי למקסם את שטח הפנים להעברת חום, תוך לא מאפשר שמן לשפוך על הקצוות של המתקן על שלב מיקרוסקופ או עדשה אובייקטיבית.
- לוותר ~ 1,000 μL של שמן הקסדקאן לתוך המאגר האקרילי, תוך שמירה על מודעות לא למלא יתר על הזמן.
הערה: יש תמיד לנקות ביסודיות את מאגר האקריליק בין הניסויים. המשתמש חייב להעסיק גדוד המורכב שטיפות רצופות עם אתיל אלכוהול ומים deionized ואחריו ייבוש בקערת יבוש במשך 12 שעות.

איור 1: הרכבת במה מחוממת. תמונות מראות את ההרכבה של גוף מוליך תרמית ומאגר שמן עבור היווצרות DIB; מספרים מתחת לכל תמונה מזהים את השלב המתאים של הפרוטוקול. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. מכשור לבקרת טמפרטורת משוב בו זמנית ואפיון חשמלי של DIB
הערה: פרוטוקול זה משלב את המכשירים הבאים להפעלת בקרת טמפרטורת משוב ואפיון חשמלי בו זמנית של DIB: מחשב אישי (PC) עם שני חיבורי אפיק טורי אוניברסלי (USB) זמינים, מגבר מהדק תיקון המשויך למערכת רכישת נתונים ייעודית (DAQ-1), מחולל צורת גל, DAQ לתכנות שני (DAQ-2) עם מודולי יציאת מתח וכניסת טמפרטורה, ואספקת חשמל/ מגבר. השלבים הבאים מתארים את החיבורים הדרושים של מכשירים אלה (כפי שמודגם באיור 2a)הדרושים לבידוד המדידה והבקרה של הטמפרטורה מאלקטרופיזיולוגיה סימולטנית של DIB. החלפות עבור מכשירים מקבילים עשויות להתבצע כנדרש.
- צור חיבורי פלט וקלט למודולים DAQ-2.
- בחר שני זוגות של מסופי בורג במודול יציאת המתח עבור חיבורי מתח דיפרנציאליים והצמד מוביל חוט למיקומים אלה. מסופי מספרים אי-זוגיים הם חיבורי קרקע נפוצים, ומסופי המספרים הזוגיים הם יציאות לא מוארקות, כפי שמוצג ב- (איור 2c). חבר כל אחד משני זוגות חוטי העופרת הללו למתאמי BNC נפרדים של מסוף-בורג ולאחר מכן חבר כל מתאם לכבל BNC נפרד המשמש לניתוב אותות מתח למכשירים אחרים.
הערה: בהתקנה זו, חיבורים דיפרנציאליים במסופים 0 ו- 1 מוקצים עבור פלט בקרת הטמפרטורה למגבר החשמל, בעוד שזוג חיבורים נוסף במסופים 6 ו- 7 מיועדים לתפוקת מתח להישלח לטיפות באמצעות מגבר המהדק של התיקון. - בהתייחס (איור 2c), בחר ערכה אחת של מסופי תרמוקופול (למשל, מסופים 2 ו- 3 מוגדרים כזוג TC1) במודול הקלט התרמוקופול וחבר אליו את חוטי התרמופול.
- בחר שני זוגות של מסופי בורג במודול יציאת המתח עבור חיבורי מתח דיפרנציאליים והצמד מוביל חוט למיקומים אלה. מסופי מספרים אי-זוגיים הם חיבורי קרקע נפוצים, ומסופי המספרים הזוגיים הם יציאות לא מוארקות, כפי שמוצג ב- (איור 2c). חבר כל אחד משני זוגות חוטי העופרת הללו למתאמי BNC נפרדים של מסוף-בורג ולאחר מכן חבר כל מתאם לכבל BNC נפרד המשמש לניתוב אותות מתח למכשירים אחרים.
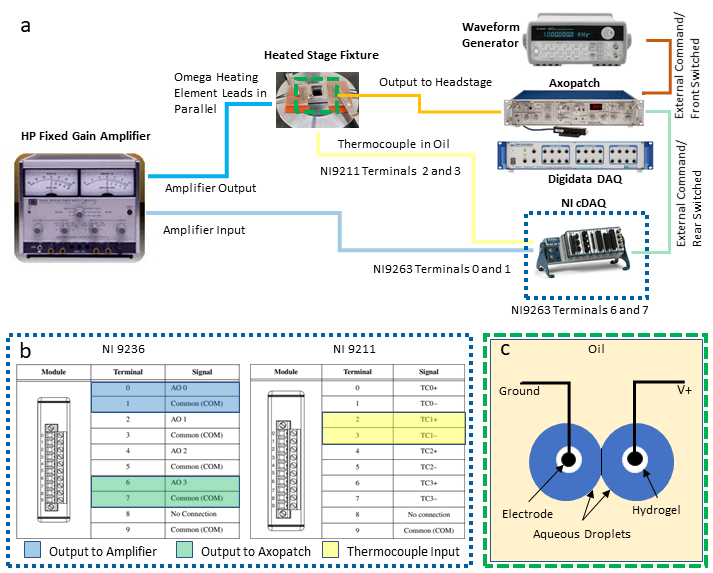
איור 2: חיבורי חיווט מערכת. סכמטי של ההתקנים והחיווט הדרושים למערכת מוצג ב- (א), בעוד שמבט מפורט על חיבורי DAQ-2 מסופק ב - (b). האיור ב- (c) מציג טיפות מימיות על אלקטרודות מצופות הידרוג'ל שקועות בשמן להיווצרות DIB. שתי האלקטרודות מחוברות לחיבורים המוארקים והלא מוארקים (V+), בהתאמה, על יחידת הראש של מגבר המהדק. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לאחר שבוצעו חיבורים חשמליים למודולים DAQ-2, חבר את מארז DAQ-2 למחשב באמצעות חיבור USB והתחבר למקור חשמל. לאחר מכן אשר התקנה מוצלחת של מנהלי התקנים ותוכנות לפני השימוש עם תוכנה מסחרית.
- קבע תצורה וחבר מגבר הספק בין DAQ-2 לבין רכיבי חימום התנגדותיים.
- קבע את תצורת המגבר כך שיפעל במצב הגברה ברווח קבוע עם רווח של פי 10.
- באמצעות מתאם שקע בננה-BNC, חבר את כבל BNC שמקורו במסופים 0 ו- 1 במודול יציאת המתח (איור 2b) לחיבורי הקלט במגבר החשמל.
- באמצעות מתאמי BNC וכבלים נוספים, חבר את מסופי היציאה של מגבר החשמל לשתי קבוצות של רכיבי חימום, המחוברים במקביל זה לזה והמגבר כדי להבטיח ששני האלמנטים ישמרו על אותו ירידת מתח במהלך השימוש.
- ליצור קשרים הדרושים עבור ציוד אלקטרופיזיולוגיה.
- חבר כבל BNC שמקורו במסופים 6 ו- 7 במודול יציאת המתח (איור 2b)למחברי BNC של הפקודה החיצונית המתויגת האחורית בחלק האחורי של מגבר המהדק של התיקון.
- חבר כבל BNC שני בין הפלט של מחולל צורת הגל לבין חיבור הפיקוד החיצוני של המתג הקדמי בחלק האחורי של מגבר המהדק של התיקון.
הערה: שני חיבורים אלה מספקים שיטות חלופיות ליצירת צורות גל מתח המוחלות על אלקטרודות טיפה באמצעות מגבר מהדק התיקון. מחולל צורת הגל שימושי במיוחד ליצירת מתחי צורת גל משולשים המשמשים למדידת קיבוליות קרום. המשתמש עשוי להחליט אילו, אם בכלל, נחוצים ליישום שלו. - באמצעות כבל BNC שלישי, חבר את הפלט של הזרם הנמדד הממוקם בלוח הקדמי של מגבר המהדק של התיקון למחבר BNC עם קלט אנלוגי זמין בחזית DAQ-1.
- באמצעות כבל BNC רביעי, חבר את היציאה של מתח ממברנה נמדד (בחלק האחורי של מגבר המהדק של התיקון) למחבר כניסה אנלוגי נפרד ב- DAQ-1. זה מאפשר דיגיטציה של המתח המוחל על פני האלקטרודות.
- עם שתי אלקטרודות טיפה מוכן ונתמך על micromanipulators כמתואר בשלבים 7-9 ב ref.40, לחבר את האלקטרודה מוביל ראש מהדק תיקון, שהוא מחובר באמצעות כבל למגבר מהדק תיקון.
הערה: תפקידו של כיסוי הראש הוא לשלוט במתח בין האלקטרודות ולמדוד את הזרם שנוצר, אשר מומר למתח פרופורציונלי שמקבל יציאה על ידי מגבר מהדק התיקון ל- DAQ-1. - חבר DAQ-1 למחשב באמצעות חיבור USB וחבר את כבלי אספקת החשמל המתאימים הן למגבר המהדק של התיקון והן ל- DAQ-1.
- כוח על כל ציוד המדידה.
הערה: אולי הפרט החשוב ביותר בהתקנה זו הוא להבטיח שחיבורי פלט מגבר החשמל (mA-A) מבודדים חשמלית מיחידת הראש של מגבר המהדק של התיקון, המשתמש במעגל רגיש למדידת זרמי רמת pA-nA ב- DIB.
3. בקרת טמפרטורת משוב של bilayers ממשק טיפה
הערה: השלבים הבאים להפעלת מערכת בקרת טמפרטורת המשוב מבוססים על ממשק משתמש גרפי (GUI) מותאם אישית שנוצר ליישום בקרת טמפרטורת משוב פרופורציונלית-אינטגרלית (PI)40,41 (ראה קבצי קידוד משלימים). במקום זאת, ניתן להשתמש באלגוריתמים אחרים של תוכנה ובקרה. עותק של תוכנית זו מסופק לקורא עם מידע משלים עבור הנייר, אולם המשתמש אחראי להגדיר את זה עבור הציוד שלהם ואת הצרכים.
- הפעל את תוכנת DAQ-2 במחשב ופתח את קובץ התוכנית לבקרת טמפרטורה. לאחר פתיחת ממשק משתמש גרפי, פתח את התוכנית שוב על-ידי לחיצה על סמל התיקיה בפינה השמאלית התחתונה של ממשק ה- GUI ובחירת תוכנית בקרת הטמפרטורה (איור 3).
- הזן ערכים מספריים מתאימים עבור הגבר הפקד היחסי (KP) ורווח שליטה אינטגרלי (KI).
הערה: נמצאו ערכי KP ו- KI של 0.598 ו- 0.00445, בהתאמה, פועלים היטב בהגדרה. ערכים אלה נקבעו באופן איטרטיבי באמצעות סימולציה באמצעות מודל מערכת המשלב פרמטרים המתקבלים מתגובות חימום מדודות בלולאה פתוחה (ראו איור 4). במהלך חימום לולאה פתוחה, כוח החימום שנקבע אינו תלוי בטמפרטורה הנמדדת. לעומת זאת, חימום בלולאה סגורה מורכב מהתאמת הכוח המוחל ללא הרף לתנורים באופן המסייע לקרב את הטמפרטורה הנמדדת לטמפרטורה הרצויה. הדבר מושג בזאת באמצעות ערכת בקרת PI. - כדי לבדוק את ערכת בקרת הטמפרטורה, הזן את טמפרטורת נקודת ההגדרה הרצויה (מעל טמפרטורת החדר) ולאחר מכן הפעל את בקרת טמפרטורת המשוב בתוך ממשק ה- GUI. שים לב לאות הטמפרטורה הנמדד תחת פקד משוב (לולאה סגורה), המוצג ב- GUI במשך הדקות הקרובות. אם הטמפרטורה הנמדדת של השמן עולה במידה ניכרת על הטמפרטורה הרצויה, מגיבה לאט מדי לשינויים, או אינה מתכנסת לנקודת ההגדרה הרצויה, המשתמש יצטרך להתאים את רווחי הבקרה כדי להשיג את ביצועי הלולאה הסגורה הרצויים.
הערה: התוכנית מגדירה מגבלת רוויה עבור הכוח (ובכך מתח) המסופקים אלמנטים חימום התנגדותי. לדוגמה, שני אלמנטים המדווחים בזאת צורכים עד 5 ואט כל אחד. חיווט אותם במקביל פירושו שצריכת החשמל הכוללת לא תעלה על 10 ואט. מומלץ למשתמש לשקול את כמות החשמל המרבית שיש לספק למכשירים ולדעת כי מגבלה זו יכולה להשפיע על המהירות שבה מערכת הלולאה הסגורה תגיב לשינויי הטמפרטורה הרצויים. רכיבי חימום הספק גבוהים יותר מאפשרים חימום מהיר יותר ומפרטורות גבוהות יותר של נקודות הגדרה, אך דורשים זרמים מסופקים גבוהים יותר לחימום. - כאשר המערכת מכוונת לביצועי לולאה סגורה מקובלים, הזן את טמפרטורת השמן הרצויה להיווצרות DIB כנקודת ההגדרה ב- GUI.
הערה: לדוגמה, טמפרטורת נקודה מוגדרת של 60 °C (60 °F) הניבה תוצאות טובות בניסויים עם ליפוזומים BTLE ב טיפות מימית37. המשתמש מופנה למקום אחר2,40 עבור פרוטוקולים המסבירים הרכבה DIB בין טיפות תלויות על אלקטרודות מסוג חוט ותצורה של ציוד אלקטרופיזיולוגיה באמצעות מגבר מהדק תיקון, DAQ-1, ותוכנת מדידה אלקטרופיזיולוגית. באופן ספציפי, הפרוטוקול על ידי Najem, ואח'40 ניתן לעקוב מקרוב עד שלב 13. מעבר לצעד זה, גישה שונה במקצת משמשת להיווצרות מוצלחת של מונולאייר וביליאר בעת שימוש בליפידים הדורשים חימום כדי לקדם היווצרות מונולאייר או bilayer. - מנמיכים את קצות האלקטרודות כסף / כסף כלוריד (Ag / AgCl) לתוך השמן עד שהם כמעט לגעת בתחתית המאגר האקרילי. מיקום זה של קצות האלקטרודה חיוני לשמירת הטיפה על האלקטרודה בשמן מחומם, שבו נצפו זרמים קונבקטיביים בשמן כדי לנתק טיפות מהאלקטרודות מצופות ההידרוגל(איור 2c).
- פיפטה טיפת 250 nL של תמיסת השומנים מימית המכילה 2 מ"ג / מ"ל של BTLE, 100 מ"מ אשלגן כלורי (KCl), ו 10 מ"מ 3-(N-מורפולינו) חומצה פרופאנסולפונית (MOPS) על כל קצה אלקטרודה ולתת להם דגירה בשמן מחומם במשך מינימום של 10 דקות כדי לקדם היווצרות monolayer.
- מכסים את כיסוי הראש ואת גוף הבמה המחומם בכלוב פאראדיי מקורקע.
- הביאו את הטיפות למגע עדין באיטיות
מניפולציה המיקומים האופקיים של האלקטרודות עד שהמשתמש רואה את הטיפות לעוות ממגע או להתחיל לעקור אחד את השני ולחכות כמה דקות עד היווצרות bilayer מתחיל. אם לאחר מספר דקות bilayer לא נוצר, טיפות ניתן לכפות יחד יותר כדי להקל על היווצרות bilayer. ניתן לאשר היווצרות דו-שכבתית בין-גזעית דקה באמצעות בדיקה ויזואלית(איור 5a)או על ידי מדידת הגידול במשרעת של זרם קיבולי בצורת גל מרובע המושרה על ידי מחולל צורת גל המפיק מתח משולש 10 mV, 10 הרץ22. אפשר את bilayer כדי להשוות במשך מינימום של 10 דקות כדי להגיע לאזור בין-גזעי יציב, על היווצרות ראשונית ולפני האפיון הבא בנקודת הסט הראשונית.
הערה: לסוג השמן יכולה להיות השפעה משמעותית על דילול הדו-שכבתי, עובי הממברנה וזווית המגע בין טיפות. באופן כללי, ככל שמולקולת השמן קטנה יותר, כך היא יכולה להישאר בקלות רבה יותר בליבה ההידרופובית של הביליאר שנכבש על ידי שרשראות אסיל השומנים. החזקת שמן מגבירה הן את המתחים והן את העובי הדו-שכבתי ומפחיתה את האזור ואת זווית המגע בין טיפות. מדדים אלה מסמלים מצב חלש יותר של הידבקות. מולקולות גדולות ומגושמים יותר מפעילות את האפקט ההפוך. לדוגמה, סקוואלן היא מולקולה מגושמת יותר מאלקנים כגון הקסדקאן, המאפשרת להוציא אותה בקלות בין מונוליירים במהלך דילול bilayer. ככאלה, DIBs שנוצרו סקוואלן הם דקים יותר, הם מציגים אזורי מגע וזוויות מגע גבוהים יותר, והם מפגינים אנרגיות חופשיות גבוהות יותר של היווצרות22,42 (מידה של הידבקות טיפת טיפה).
4. אפיון התנהגויות תלויות טמפרטורה ב- DIBs
הערה: תהליכים פיזיקליים רבים ניתן ללמוד בקרומי מודל מבוססי DIB, כולל כיצד שינויים בטמפרטורה משפיעים על תכונות המבנה והתחבורה של הממברנה. השלבים הבאים צריכים להתבצע לאחר היווצרות דו שכבתית מוצלחת בטמפרטורה הרצויה.
- למדוד את הקיבוליות הנומינלית של הממברנה תוך הורדת הטמפרטורה של אמבט השמן מנקודת מוגדרת המאפשרת היווצרות bilayer לזהות מעברי שלב תרמוטרופיים של השומנים בקרום38.
- לחץ באמצעות לחצן העכבר הימני על גרף הטמפרטורה ב- GUI ונקה את הנתונים המוצגים. פעולה זו מבטיחה שטח מספיק במאגר זמין עבור הקלטות עוקבות.
- באמצעות מחולל צורת הגל המחובר למגבר מהדק התיקון, החל צורת גל מתח משולש (למשל, 10 mV, 10 הרץ) על פני אלקטרודות DIB ולתעד את התגובה הנוכחית המושרה דרך bilayer.
- מצננים את הדו-שכבתית על ידי הפחתת טמפרטורת הנקודה שנקבעה במרווחים של 5 מעלות צלזיוס והמתנה של 5 דקות לפחות בטמפרטורת המצב היציבה החדשה בין שינויי הטמפרטורה עד להשגת הטמפרטורה הרצויה. לחלופין, נסה לקירור פסיבי של הדו-שכבתי על-ידי כיבוי מערכת בקרת המשוב. שים לב, עם זאת, כי ניסויים המיישמים קירור פסיבי מ 50-60 מעלות צלזיוס הביא לשיעורים גבוהים יותר של התמזגות.
- לאחר אמבט השמן ואת bilayer מגניב לטמפרטורה המינימלית הרצויה, לחץ באמצעות לחצן העכבר הימני על גרף הטמפרטורה ב- GUI שוב ולייצא את נתוני הטמפרטורה לעומת זמן לתוכנת גיליון אלקטרוני. הפסק את ההקלטה הנוכחית.
- מהזרם הנמדד, חשב את התפקוד הנומינלי של התגובה הנוכחית של הגל המרובע לעומת הזמן במהלך תקופת הקירור.
- קיבוליות נומינלית עלילה (C) לעומת טמפרטורה (T) כדי לבחון כיצד קיבוליות הממברנה השתנתה. אתר שינויים לא-מונוטוניים ב- C לעומת T כדי לזהות את TM.
הערה: קיבוליות נומינלית ניתן לחשב משרעת של גל מרובע הנוכחי43 (| אני |) שימוש | קשר הגומלין אני | = C dv / dt, שבו dv / dt שווה פי ארבעה מהתוצר של משרעת המתח (| V|) ותדר(f)של המתח המשולש המיושם. מתוך משוואות אלה, C = | אני |/(4| V|f).
- באופן דומה, להעריך את קיבוליות ספציפית מעין סטטית (Cm) של bilayer בטמפרטורות קבועות על ידי הגדלה רצופה של הטמפרטורה של אמבט השמן ואת אזור bilayer.
- שנה את טמפרטורת הנקודה שנקבעה במרווחים של 10 °C (70 °F) באמצעות ממשק המשתמש הגרפי (GUI) ואפשר למערכת להשתוות לטמפרטורה החדשה.
- בצע את שלב 4.1.2 כדי ליזום את המדידה של זרם והקלטה קיבוליים.
- שנה את אזור הדו-שכבתי על-ידי כוונון קפדני של מיקומי האלקטרודות באמצעות המיקרו-מניפולטורים (כלומר, הפרדת האלקטרודות מפחיתה את אזור הדו-שכבתי). אפשר לזרם הגל המרובע להגיע משרעת מצב יציב ולאסוף תמונות של DIB כדי לאפשר חישוב של אזור קרום לעומת זמן באמצעות מצלמה המותקנת על המיקרוסקופ כדי לדמיין את bilayer כפי שניתן לראות מן הצמצם של שלב המיקרוסקופ. בו-זמנית, הוסף תגית דיגיטלית בתוכנת ההקלטה הנוכחית כדי לסמן את נקודת הזמן המתאימה לאיסוף תמונות.
הערה: מיקרו מניפולטורים מאפשרים שליטה מדויקת של האלקטרודות ובכך מגע עדין בין טיפות. מניפולציה גסה של הטיפות יכולה להוביל לניסוי כושל על ידי התמזגות של הטיפות או על ידי גרימת טיפה ליפול מהאלקטרודה. כפי שנדון במקומותאחרים 22, אזור bilayer מחושב מאורך המגע בין טיפות, המופיעות כעיגולים חופפים בתמונה בתצוגה התחתונה. ניתן לחשב את המיקומים והממדים של הטיפות, ואת אורך קו המגע, באמצעות תוכנת עיבוד תמונה או באמצעות כלי תכנות מדעיים אחרים. - חזור על שלב 4.2.1.2 מינימום של 4 פעמים כדי להשיג סך של 5 תמונות DIB ואזורים במצב יציב של זרם bilayer.
- חזור על שלב 4.2.1 בכל טמפרטורה רצויה.
- בנקודות הזמן המתויגות המתאימות לאזורים דו-שכבתיים במצב יציב עבור תמונות שנרכשו, נתח את ההקלטות הנוכחיות ואת תמונות ה- DIB כדי לחלץ נתוני C ו- A עבור כל טמפרטורה.
- התוויית נתונים C לעומת A עבור כל טמפרטורה וחישוב השיפוע של רגרסיה מסדר ראשון, המייצגת את Cm של bilayer בכל טמפרטורה22.
- ערכי התוויה של Cm שהתקבלו משלב 4.2.4 לעומת T.
- בדוק את נתוני Cm לעומת T עבור וריאציות לא מונוטוניות לזיהוי טמפרטורות נמסות, TM.
- שנה את טמפרטורת הנקודה שנקבעה במרווחים של 10 °C (70 °F) באמצעות ממשק המשתמש הגרפי (GUI) ואפשר למערכת להשתוות לטמפרטורה החדשה.
- להעריך את הדינמיקה של היווצרות ערוץ יון תלוי מתח על ידי יצירת קלט שלב מתח dc על פני bilayer.
- הגדר מתח התחלתי לערך השלב הרצוי ב- mV (למשל,100 mV).
- הגדר מתח סופי וגודל צעד לערך גבוה יותר מהשלב הרצוי (למשל, מתח סופי של 110 mV וגודל צעד של 110 מ"ו).
- הגדר משך זמן רצוי עבור קלט השלב בשניות (לדוגמה, 90 שניות).
- בחר את הקוטביות הרצויה עבור קלט השלב (למשל, חיובי).
- החלף את מגבר מלחצי התיקון כדי לשלוח לראשי הבמה את מתח הפקודה שמקורו במודול יציאת ה- GUI/מתח.
- אתחל הקלטות נוכחיות.
- הפעל את המתח ותקליט את תגובת הזרם המושרה, שאמורה להציג תגובה בצורת S למתח קריטי (למשל, ~ 70 mV עבור Mz 1 מיקרוגרם / מ"ל ב 2 מ"ג / מ"ל BTLE).
- בנפרד, ניתן להשיג קשרי מתח זרם דינמיים עבור קרום בטמפרטורות הרצויות כדי לחשוף קשרים תלויי מתח, כגון התנהגויות ערוץ היונים.
- החלף את מגבר המהדק של התיקון כדי לשלוח לראש את מתח הפקודה שמקורו במחולל צורת הגל וליזום הקלטות זרם.
- במחולל צורת הגל, פלט צורת גל סינוסואידית רציפה עם משרעת, היסט ותדירות רצויים.
- רשום את התגובה הנוכחית המושרה על-פני מחזור אחד או יותר.
- חזור על הפעולה הרצויה עבור משרעת גלי סינוס שונים ותדרים וטמפרטורות.
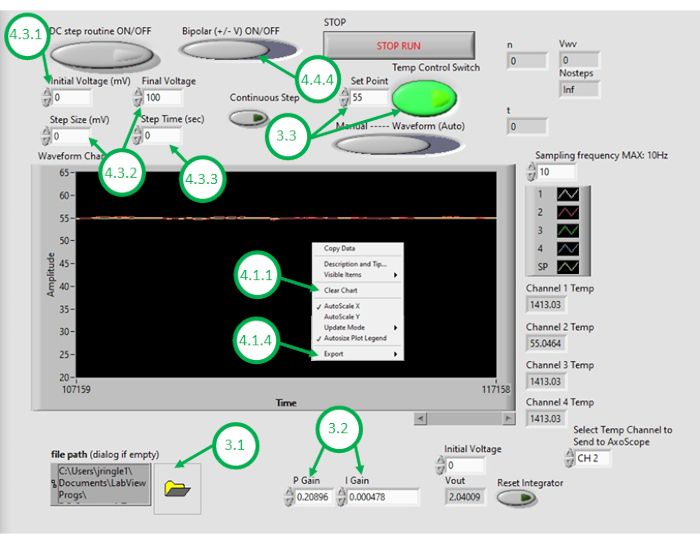
איור 3: ממשק משתמש גרפי של בקרת טמפרטורה. נתון זה מדגיש ומתייג את השלבים הקריטיים הנדרשים כדי להשתמש ב- GUI של התוכנית כדי לשלוט בטמפרטורה של אמבט השמן. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
איור 1 מראה כיצד גוף האלומיניום ומאגר הנפט האקרילי מוכנים על במת המיקרוסקופ להיווצרות DIB. שלבי ההרכבה 1.2-1.4 משמשים לבידוד תרמי של המתקן מהבמה לחימום יעיל יותר. שלבים 1.5-1.7 מראים כיצד לחבר כראוי את התרמופול למתקן ולמקם את מאגר הנפט, וצעדים 1.8-1.9 מראים מיקומים מומלצים לחלוקת שמן ?...
Discussion
הפרוטוקול המתואר בזאת מספק הוראות להרכבה ותפעול של מערכת ניסיונית לשליטה בטמפרטורת השמן והטיפות המשמשות ליצירת DIBs. זה מועיל במיוחד עבור הפעלת היווצרות DIB באמצעות שומנים כי יש טמפרטורות נמס מעל RT. יתר על כן, על ידי שינוי מדויק של הטמפרטורה של מאגר הנפט, טמפרטורת bilayer ניתן לתפעל כדי ללמוד את ?...
Disclosures
למחברים אין ניגודי אינטרסים.
Acknowledgements
תמיכה כספית ניתנה על ידי הקרן הלאומית למדע גרנט CBET-1752197 ומשרד חיל האוויר של מענק מחקר מדעי FA9550-19-1-0213.
Materials
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
References
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved