Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Ensemble à température contrôlée et caractérisation d’une bicouche d’interface de gouttelettes
Dans cet article
Résumé
Ce protocole détaille l’utilisation d’un système de chauffage à température contrôlée par rétroaction pour promouvoir l’assemblage de monocouche lipidique et la formation de bicouches d’interface de gouttelettes pour les lipides avec des températures de fusion élevées, ainsi que des mesures de capacité pour caractériser les changements induits par la température dans la membrane.
Résumé
La méthode de bicouche d’interface de gouttelettes (DIB) pour assembler des bicouches lipidiques (c’est-à-dire des DIB) entre des gouttelettes aqueuses enrobées de lipides dans l’huile offre des avantages clés par rapport à d’autres méthodes: les DIB sont stables et souvent durables, la zone de la bicouche peut être réglée de manière réversible, l’asymétrie des feuillets est facilement contrôlée via des compositions de gouttelettes et des réseaux de bicouches ressemblant à des tissus peuvent être obtenus en attenant de nombreuses gouttelettes. La formation de DIB nécessite l’assemblage spontané de lipides en monocouches lipidiques de haute densité à la surface des gouttelettes. Bien que cela se produise facilement à température ambiante pour les lipides synthétiques courants, une monocouche suffisante ou une bicouche stable ne parvient pas à se former dans des conditions similaires pour les lipides avec des points de fusion au-dessus de la température ambiante, y compris certains extraits lipidiques cellulaires. Ce comportement a probablement limité les compositions — et peut-être la pertinence biologique — des DIB dans les études de membrane de modèle. Pour résoudre ce problème, un protocole expérimental est présenté pour chauffer soigneusement le réservoir d’huile hébergeant des gouttelettes DIB et caractériser les effets de la température sur la membrane lipidique. Plus précisément, ce protocole montre comment utiliser un appareil en aluminium thermoconducteur et des éléments chauffants résistifs contrôlés par une boucle de rétroaction pour prescrire des températures élevées, ce qui améliore l’assemblage monocouche et la formation de bicouche pour un ensemble plus large de types de lipides. Les caractéristiques structurelles de la membrane, ainsi que les transitions de phase thermotrope des lipides composant la bicouche, sont quantifiées en mesurant les changements de capacité électrique du DIB. Ensemble, cette procédure peut aider à évaluer les phénomènes biophysiques dans les membranes modèles à différentes températures, y compris la détermination d’une température de fusion efficace(TM)pour les mélanges lipidiques multicomposants. Cette capacité permettra ainsi une réplication plus étroite des transitions de phase naturelles dans les membranes modèles et encouragera la formation et l’utilisation de membranes modèles à partir d’une plus grande bande de constituants membranaires, y compris ceux qui capturent mieux l’hétérogénéité de leurs homologues cellulaires.
Introduction
Les membranes cellulaires sont des barrières sélectivement perméables composées de milliers de lipides de types1,de protéines, de glucides et de stérols qui encapsulent et subdivisent toutes les cellules vivantes. Comprendre comment leurs compositions affectent leurs fonctions et révéler comment les molécules naturelles et synthétiques interagissent avec, adhèrent, perturbent et transfèrent les membranes cellulaires sont, par conséquent, des domaines de recherche importants avec de vastes implications en biologie, médecine, chimie, physique et génie des matériaux.
Ces objectifs de découverte bénéficient directement de techniques éprouvées d’assemblage, de manipulation et d’étude de membranes modèles, y compris des bicouches lipidiques assemblées à partir de lipides synthétiques ou naturels, qui imitent la composition, la structure et les propriétés de transport de leurs homologues cellulaires. Ces dernières années, la méthode2,3,4 de la bicouche d’interface gouttelettes (DIB) pour la construction d’une bicouche lipidique plane entre des gouttelettes d’eau recouvertes de lipides dans l’huile a fait l’objet d’une attention significative5,6,7,8,9,10,11, 12,13,14, 15,16, 17, 18,19,20,21,22,23,et a démontré des avantages pratiques par rapport à d’autres approches pour la formation de membranes modèles: la méthode DIB est simple à réaliser, ne nécessite aucune fabrication ou préparation sophistiquée (par exemple, « peinture ») d’un substrat pour soutenir la membrane, donne constamment des membranes avec des membranes supérieures longévité, permet des mesures électrophysiologiques standard, et simplifie la formation de membranes modèles avec des compositions de feuillets asymétriques3. Parce que la bicouche se forme spontanément entre les gouttelettes et que chaque gouttelette peut être adaptée en position et en maquillage, la technique DIB a également suscité un intérêt considérable pour le développement de systèmes de matériaux inspirés des cellules qui s’appuient sur l’utilisation de membranes sensibles auxstimuli18,24,25, 26,27, 28,29,compartimentation et transport équilibrés14,30,31,et de matériaux tissulaires17,23,32,33,34,35,36.
La majorité des expériences publiées sur des membranes modèles, y compris celles avec des DIB, ont été réalisées à température ambiante (RT, ~20-25 °C) et avec une poignée de lipides synthétiques (p. ex. DOPC, DPhPC, etc.). Cette pratique limite la portée des questions biophysiques qui peuvent être étudiées dans les membranes modèles et, sur la base de l’observation, elle peut également restreindre les types de lipides qui peuvent être utilisés pour assembler les DIB. Par exemple, un lipide synthétique tel que dppc, qui a une température de fusion de 42 °C, n’assemble pas de monocouches serrées ni ne forme de DIB à RT37. La formation de DIB à température ambiante s’est également avérée difficile pour les extraits naturels, tels que ceux des mammifères (par exemple, l’extrait lipidique total du cerveau, BTLE)38 ou des bactéries (par exemple, l’extrait lipidique total d’Escherichia coli, ETLE)37, qui contiennent de nombreux types différents de lipides et proviennent de cellules qui résident à des températures élevées (37 ° C). L’étude de diverses compositions offre ainsi des occasions de comprendre les processus à médiation membranaire dans des conditions biologiquement pertinentes.
L’élévation de la température de l’huile peut servir à deux fins: elle augmente la cinétique de l’assemblage monocouche et elle peut provoquer une transition de fusion des lipides pour atteindre une phase de désordre liquide. Les deux conséquences facilitent l’assemblagemonocouche 39,un pré-requis pour un DIB. En plus du chauffage pour la formation de bicouches, le refroidissement de la membrane après la formation peut être utilisé pour identifier les transitions thermotropes dans les bicouches lipidiques simples38,y compris celles dans les mélanges lipidiques naturels (par exemple, BTLE) qui peuvent être difficiles à détecter en utilisant la calorimétrie. En plus d’évaluer les transitions thermotropes des lipides, la variation précise de la température du DIB peut être utilisée pour étudier les changements induits par la température dans la structure de la membrane38 et examiner comment la composition lipidique et la fluidité affectent la cinétique des espèces membranaires actives (par exemple, les peptides formant des pores et les protéines transmembranaires37),y compris les membranes modèles mammifères et bactériennes à une température physiologiquement pertinente (37 °C).
Ici, une description de la façon d’assembler un réservoir d’huile DIB modifié et de faire fonctionner un contrôleur de température de rétroaction pour permettre l’assemblage monocouche et la formation de bicouche à des températures supérieures à RT sera expliquée. À la différence d’un protocole précédent40,des détails explicites sont inclus concernant l’intégration de l’instrumentation nécessaire à la mesure et au contrôle de la température parallèlement à l’assemblage et à la caractérisation du DIB dans le réservoir d’huile. La procédure permettra ainsi à un utilisateur d’appliquer cette méthode pour former et étudier des DIB à travers une gamme de températures dans une variété de contextes scientifiques. De plus, les résultats représentatifs fournissent des exemples précis pour les types de changements mesurables dans la structure de la membrane et le transport des ions qui peuvent se produire lorsque la température varie. Ces techniques sont des ajouts importants aux nombreuses études biophysiques qui peuvent être conçues et réalisées efficacement dans les DIB, y compris l’étude de la cinétique des espèces membranaires actives dans différentes compositions membranaires.
Protocole
1. Préparation des appareils chauffés
- Rassemblez 2 pièces de caoutchouc isolant de 1 mm d’épaisseur garnies de 25 mm x 40 mm de largeur et de longueur, respectivement, 2 pièces d’un caoutchouc de 6 mm d’épaisseur qui sont également de 25 mm x 40 mm, un ensemble de fixation de base en aluminium préparé et un réservoir d’huile acrylique qui s’insère dans la fenêtre d’observation de l’appareil de base en aluminium (voir les figures S1, S2 et S3 pour plus de détails sur la fabrication et une vue éclatée de l’assemblage). Préparez d’abord le luminaire en aluminium en fixant au bas du luminaire une fenêtre de visualisation de la lame de couverture en verre avec adhésif durcissable uv et en adhérant à 1 élément chauffant résistif au sommet de chaque bride latérale de 25 mm x 25 mm du luminaire.
- Placez les morceaux de caoutchouc les plus minces sur l’étage du microscope de sorte que le bord long de chaque pièce soit tangent à l’ouverture de l’étage, comme indiqué sur laFigure 1.
- Placez le luminaire à base en aluminium sur le dessus des coussinets isolants avec la fenêtre de visualisation du luminaire centrée au-dessus de l’objectif. Un alignement approprié est nécessaire pour l’imagerie des gouttelettes connectées.
- Placez un morceau de caoutchouc plus épais sur chaque élément chauffant résistif et utilisez un clip d’étage de microscope pour le maintenir en place. Ces pièces protègent les éléments chauffants des dommages causés par les clips de scène et isolent contre les courts-circuit électriques accidentels entre les éléments chauffants et le luminaire en aluminium et l’étage de microscope.
- Pliez soigneusement l’extrémité de mesure d’un thermocouple pour obtenir un angle de 90° à environ 4 mm de l’extrémité.
- Insérez la pointe pliue du thermocouple dans le coin inférieur gauche du luminaire en aluminium et fixez-la doucement avec la vis de verrouillage.
- Placez le réservoir acrylique dans le puits du luminaire en aluminium. Ceci est fait avant l’ajout d’huile d’hexadécane au puits (étape 1.8) de l’appareil en aluminium afin de minimiser le risque de piégeage des bulles d’air entre la fenêtre de visualisation et le fond du réservoir acrylique, ce qui peut obstruer la vue des gouttelettes.
REMARQUE: L’huile ajoutée au compartiment de visualisation de l’appareil en aluminium est utilisée pour correspondre aux indices de réfraction de l’acrylique et du verre pour une imagerie plus claire des gouttelettes contenues dans le réservoir acrylique. Ainsi, il convient de noter que l’huile dans le puits du luminaire en aluminium n’entre pas en contact avec le contenu du réservoir acrylique et qu’un nettoyage rigoureux du luminaire en aluminium n’est pas nécessaire. - Distribuer environ 1 000 μL d’huile d’hexadécane dans le puits de l’appareil en aluminium (c.-à-d. entre les parois du réservoir acrylique et de l’appareil en aluminium), en prenant soin de ne pas trop remplir. Le niveau d’huile dans le puits de l’appareil en aluminium doit être aussi élevé que possible pour maximiser la surface pour le transfert de chaleur, tout en ne permettant pas à l’huile de se répandre sur les bords de l’appareil sur l’étage du microscope ou la lentille de l’objectif.
- Distribuer environ 1 000 μL d’huile d’hexadécane dans le réservoir acrylique, tout en gardant à l’esprit de ne pas trop remplir.
REMARQUE: Le réservoir acrylique doit toujours être soigneusement nettoyé entre les expériences. L’utilisateur doit employer un régiment composé de rinçages successifs à l’alcool éthylique et à l’eau désionisée suivis d’un séchage dans un bol de dessicateur pendant plus de 12 h.

Figure 1: Ensemble de scènes chauffées. Les images montrent l’assemblage du dispositif thermoconducteur et du réservoir d’huile pour la formation de DIB; sous chaque image identifient l’étape correspondante du protocole. Veuillez cliquer ici pour voir une version plus grande de cette figure.
2. Instrumentation pour le contrôle simultané de la température de rétroaction et la caractérisation électrique d’un DIB
REMARQUE: Ce protocole intègre les instruments suivants pour permettre le contrôle de la température de rétroaction et la caractérisation électrique simultanée d’un DIB: un ordinateur personnel (PC) avec deux connexions USB (Universal Serial Bus) disponibles, un amplificateur de serrage de raccordement couplé à un système d’acquisition de données dédié (DAQ-1), un générateur de forme d’onde, un deuxième DAQ programable (DAQ-2) avec des modules de sortie de tension et d’entrée de température, et une alimentation / amplificateur. Les étapes suivantes décrivent les connexions nécessaires de ces instruments (comme illustré à la figure 2a)nécessaires pour isoler la mesure et le contrôle de la température de l’électrophysiologie simultanée d’un DIB. Des substitutions d’instruments équivalents peuvent être effectuées au besoin.
- Établissez des connexions de sortie et d’entrée aux modules DAQ-2.
- Sélectionnez deux paires de bornes de vis sur le module de sortie de tension pour les connexions de tension différentielle et fixez les fils à ces emplacements. Les bornes impaires sont des connexions à terre communes, et les bornes de nombre pair sont des sorties non ancrées, comme le montre (Figure 2c). Connectez chacune de ces deux paires de fils de plomb à des adaptateurs BNC à bornes vissées séparées, puis connectez chaque adaptateur à un câble BNC distinct utilisé pour acheminer les signaux de tension vers d’autres instruments.
REMARQUE: Dans cette configuration, des connexions différentielles aux bornes 0 et 1 sont affectées pour la sortie de contrôle de température à l’amplificateur de puissance, tandis qu’une autre paire de connexions aux bornes 6 et 7 est désignée pour la sortie de tension à envoyer aux gouttelettes via l’amplificateur de serrage de patch. - En se référant à(Figure 2c),sélectionnez un ensemble de bornes de thermocouple (par exemple, les bornes 2 et 3 sont désignées comme la paire TC1) sur le module d’entrée du thermocouple et connectez-y les fils du thermocouple.
- Sélectionnez deux paires de bornes de vis sur le module de sortie de tension pour les connexions de tension différentielle et fixez les fils à ces emplacements. Les bornes impaires sont des connexions à terre communes, et les bornes de nombre pair sont des sorties non ancrées, comme le montre (Figure 2c). Connectez chacune de ces deux paires de fils de plomb à des adaptateurs BNC à bornes vissées séparées, puis connectez chaque adaptateur à un câble BNC distinct utilisé pour acheminer les signaux de tension vers d’autres instruments.
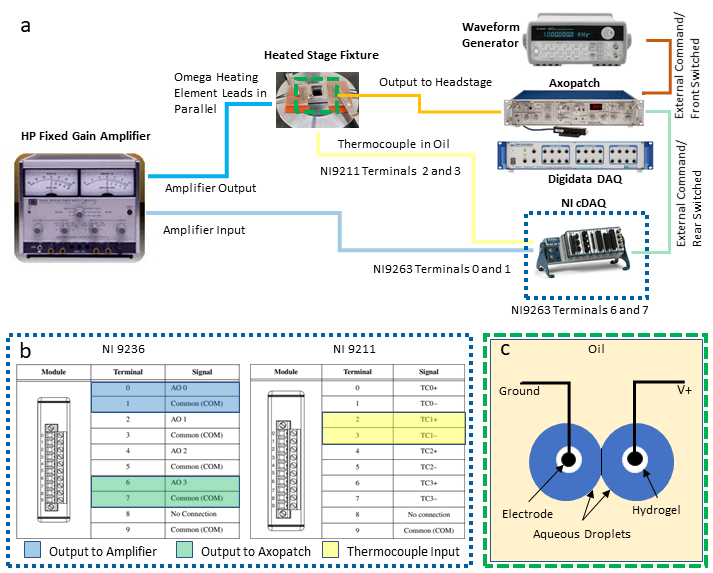
Figure 2: Connexions de câblage du système. Un schéma des dispositifs et du câblage requis pour le système est présenté en (a), tandis qu’un aperçu détaillé des connexions DAQ-2 est fourni en (b). L’illustration en(c)montre des gouttelettes aqueuses sur des électrodes revêtues d’hydrogel immergées dans de l’huile pour la formation de DIB. Les deux électrodes sont connectées aux connexions mise à la terre et non mise à la terre (V +), respectivement, sur l’unité de tête de l’amplificateur de serrage de patch. Veuillez cliquer ici pour voir une version plus grande de cette figure.
- Une fois les connexions électriques aux modules DAQ-2 effectuées, connectez le châssis DAQ-2 à un PC via une connexion USB et connectez-vous à une source d’alimentation électrique. Confirmez ensuite la réussite de l’installation du pilote et du logiciel avant de l’utiliser avec un logiciel commercial.
- Configurez et connectez un amplificateur de puissance entre le DAQ-2 et les éléments chauffants résistifs.
- Configurez l’amplificateur pour qu’il fonctionne en mode d’amplification à gain fixe avec un gain de 10X.
- À l’aide d’un adaptateur banana jack-BNC, connectez le câble BNC provenant des bornes 0 et 1 du module de sortie de tension(Figure 2b)aux connexions d’entrée de l’amplificateur de puissance.
- À l’aide d’adaptateurs BNC et d’un câblage supplémentaires, connectez les bornes de sortie de l’amplificateur de puissance aux deux ensembles d’éléments chauffants, qui sont câblés en parallèle l’un à l’autre et à l’amplificateur pour vous assurer que les deux éléments maintiennent la même chute de tension pendant l’utilisation.
- Établir les connexions nécessaires pour l’équipement d’électrophysiologie.
- Connectez un câble BNC provenant des bornes 6 et 7 du module de sortie de tension(Figure 2b)aux connecteurs BNC de commande externe commutée arrière situés à l’arrière de l’amplificateur de serrage de raccordement.
- Connectez un deuxième câble BNC entre la sortie du générateur de forme d’onde et la connexion de commande externe du commutateur avant à l’arrière de l’amplificateur de serrage de patch.
REMARQUE: Ces deux connexions fournissent des méthodes alternatives pour générer des formes d’onde de tension qui sont appliquées aux électrodes de gouttelettes via l’amplificateur de serrage de patch. Le générateur de forme d’onde est particulièrement utile pour générer des tensions de forme d’onde triangulaires utilisées pour mesurer la capacité de la membrane. L’utilisateur peut décider lesquels, le cas échéant, sont nécessaires pour sa propre application. - Avec un troisième câble BNC, connectez la sortie du courant mesuré situé sur le panneau avant de l’amplificateur de serrage de raccordement à un connecteur BNC d’entrée analogique disponible à l’avant du DAQ-1.
- Avec un quatrième câble BNC, connectez la sortie de la tension de membrane mesurée (à l’arrière de l’amplificateur de serrage de raccordement) à un connecteur d’entrée analogique séparé sur DAQ-1. Cela permet la numérisation de la tension appliquée à travers les électrodes.
- Avec les deux électrodes de gouttelettes préparées et supportées sur des micromanipulateurs comme décrit dans les étapes 7-9 de la réf.40,connectez l’électrode mène à la tête de serrage de patch, qui est le câble fixé via à l’amplificateur de pince de patch.
REMARQUE: Le rôle de la scène de tête est de contrôler la tension entre les électrodes et de mesurer le courant résultant, qui est converti en une tension proportionnelle qui obtient la sortie par l’amplificateur de pince de raccordement à DAQ-1. - Connectez le DAQ-1 à un PC via une connexion USB et connectez les câbles d’alimentation correspondants à l’amplificateur de serrage de raccordement et au DAQ-1.
- Mettez sous tension tout l’équipement de mesure.
REMARQUE: Peut-être le détail le plus important dans cette configuration est de s’assurer que les connexions de sortie de l’amplificateur de puissance (mA-A) sont électriquement isolées de l’unité de tête de l’amplificateur de serrage de raccordement, qui utilise un circuit sensible pour mesurer les courants de niveau pA-nA dans un DIB.
3. Contrôle de la température de rétroaction des bicouches d’interface de gouttelettes
REMARQUE: Les étapes suivantes pour le fonctionnement du système de contrôle de la température de rétroaction sont basées sur une interface utilisateur graphique (GUI) personnalisée créée pour la mise en œuvre du contrôle de température de rétroaction proportionnelle-intégrale (PI)40,41 (voir Fichiers de codage supplémentaires). D’autres logiciels et algorithmes de contrôle peuvent être utilisés à la place. Une copie de ce programme est fournie au lecteur avec les informations supplémentaires pour le papier, mais l’utilisateur est responsable de le configurer pour son propre équipement et ses besoins.
- Démarrez le logiciel DAQ-2 sur le PC et ouvrez le fichier de programme de contrôle de la température. Une fois l’interface graphique ouverte, ouvrez à nouveau le programme en cliquant sur l’icône du dossier dans le coin inférieur gauche de l’interface graphique et en sélectionnant le programme de contrôle de la température (Figure 3).
- Entrez les valeurs numériques appropriées pour le gain de commande proportionnel(KP)et le gain de contrôle intégral(KI).
Remarque : KP et KI valeurs de 0,598 et 0,00445, respectivement, ont été trouvés pour fonctionner correctement dans la configuration. Ces valeurs ont été déterminées de manière itérative par simulation à l’aide d’un modèle de système qui intègre des paramètres obtenus à partir des réponses de chauffage en boucle ouverte mesurées (voir la figure 4). Pendant le chauffage en boucle ouverte,la puissance de chauffage prescrite est indépendante de la température mesurée. En revanche, le chauffage en boucle fermée consiste à ajuster continuellement la puissance appliquée aux appareils de chauffage d’une manière qui aide à rapprocher la température mesurée de la température souhaitée. Ceci est réalisé ici à l’aide d’un schéma de contrôle PI. - Pour tester le schéma de contrôle de la température, entrez une température de consigne souhaitée (au-dessus de la température ambiante), puis activez le contrôle de la température de rétroaction dans l’interface graphique. Observez le signal de température mesuré sous contrôle de rétroaction (boucle fermée), qui est affiché dans l’interface graphique pendant les prochaines minutes. Si la température mesurée de l’huile dépasse considérablement la température souhaitée, réagit trop lentement aux changements ou ne parvient pas à converger vers le point de jeu souhaité, l’utilisateur devra ajuster les gains de contrôle pour atteindre les performances en boucle fermée souhaitées.
REMARQUE: Le programme définit une limite de saturation pour la puissance (et donc la tension) fournie aux éléments chauffants résistifs. Par exemple, deux éléments signalés dans le présent document consomment jusqu’à 5 W d’énergie chacun. Les câbler en parallèle signifie que la consommation totale d’énergie ne doit pas dépasser 10 W. Il est conseillé à l’utilisateur de tenir compte de la quantité maximale d’énergie qui devrait être fournie aux appareils et de savoir que cette limite peut affecter la vitesse à laquelle le système en boucle fermée répondra aux changements de température souhaités. Les éléments chauffants de puissance plus élevée permettent un chauffage plus rapide et des températures de point de réglage plus élevées, mais nécessitent des courants fournis plus élevés pour le chauffage. - Avec le système réglé sur des performances en boucle fermée acceptables, entrez la température d’huile souhaitée pour la formation de DIB comme point de réglage dans l’interface graphique.
REMARQUE: Par exemple, une température de point de réglage de 60 °C a donné de bons résultats dans les expériences avec des liposomes BTLE dans les gouttelettes aqueuses37. L’utilisateur est référé ailleurs2,40 pour des protocoles expliquant l’assemblage DIB entre des gouttelettes accrochées à des électrodes de type fil et la configuration d’équipements d’électrophysiologie à l’aide de l’amplificateur de serrage de patch, DAQ-1, et du logiciel de mesure d’électrophysiologie. Plus précisément, le protocole de Najem et al.40 peut être suivi de près jusqu’à l’étape 13. Au-delà de cette étape, une approche légèrement différente est utilisée pour une formation réussie de monocouche et de bicouche lors de l’utilisation de lipides qui nécessitent un chauffage pour favoriser la formation de monocouche ou de bicouche. - Abaissez les extrémités des électrodes argent/chlorure d’argent (Ag/AgCl) dans l’huile jusqu’à ce qu’elles touchent presque le fond du réservoir acrylique. Ce positionnement des extrémités de l’électrode est crucial pour maintenir la gouttelette sur l’électrode dans de l’huile chauffée, où des courants convectifs dans l’huile ont été observés pour détacher les gouttelettes des électrodes revêtues d’hydrogel(Figure 2c).
- Pipeter une gouttelette de 250 nL de solution aqueuse de lipides contenant 2 mg/mL de BTLE, 100 mM de chlorure de potassium (KCl) et 10 mM d’acide propanesulfonique 3-(N-morpholino) (MOPS) sur chaque extrémité d’électrode et les laisser incuber dans l’huile chauffée pendant au moins 10 minutes pour favoriser la formation de monocouche.
- Couvrez la scène d’tête et le montage de scène chauffant avec une cage Faraday mise à la terre.
- Amenez les gouttelettes en contact doux en lent
manipuler les positions horizontales des électrodes jusqu’à ce que l’utilisateur voit les gouttelettes se déformer au contact ou commencer à se déplacer les unes les autres et attendre quelques minutes jusqu’à ce que la formation de la bicouche commence. Si après plusieurs minutes, une bicouche ne s’est pas formée, les gouttelettes peuvent être rapprochées davantage pour faciliter la formation de la bicouche. La formation d’une bicouche interfaciale éclaircie peut être confirmée par une inspection visuelle(figure 5a)ou par la mesure de l’augmentation de l’amplitude d’un courant capacitif de forme d’onde carrée induite par un générateur de forme d’onde extrayant une tension triangulaire de 10 mV, 10Hz 22. Laisser la bicouche s’équilibrer pendant au moins 10 minutes pour atteindre une zone interfaciale stable, lors de la formation initiale et avant la caractérisation ultérieure au point de jeu initial.
REMARQUE: Le type d’huile peut avoir un impact significatif sur l’amincissement de la couche bicouche, l’épaisseur de la membrane et l’angle de contact inter-gouttelettes. En général, plus la molécule d’huile est petite, plus elle peut facilement rester dans le noyau hydrophobe de la bicouche occupée par les chaînes acétyliques lipidiques. La rétention d’huile augmente les tensions et l’épaisseur de la monocouche et de la bicouche et diminue la surface et l’angle de contact entre les gouttelettes. Ces mesures signifient un état d’adhérence plus faible. Des molécules plus grosses et plus volumineuses exercent l’effet inverse. Par exemple, le squalène est une molécule plus volumineuse que les alcanes tels que l’hexadécane, ce qui lui permet d’être facilement exclu entre les monocouches lors de l’amincissement bicouche. En tant que tels, les DIB formés dans le squalène sont plus minces, ils présentent des zones de contact et des angles plus élevés, et ils présentent des énergies libres de formationplus élevées 22,42 (une mesure de l’adhérence gouttelettes-gouttelettes).
4. Caractérisation des comportements dépendant de la température dans les DIB
REMARQUE: De nombreux processus physiques peuvent être étudiés dans les membranes modèles à base de DIB, y compris la façon dont les changements de température affectent la structure et les propriétés de transport de la membrane. Les étapes suivantes doivent être effectuées après la formation réussie de la bicouche à la température souhaitée.
- Mesurer la capacité nominale de la membrane tout en abaissant la température du bain d’huile à partir d’un point de réglage qui permet la formation de bicouche pour identifier les transitions de phase thermotrope des lipides dans la membrane38.
- Cliquez avec le bouton droit sur le graphique de température sur l’interface graphique et effacez les données affichées. Cela garantit que suffisamment d’espace dans la mémoire tampon est disponible pour les enregistrements suivants.
- À l’aide du générateur de forme d’onde connecté à l’amplificateur de serrage de raccordement, appliquez une forme d’onde de tension triangulaire (p. ex. 10 mV, 10 Hz) à travers les électrodes DIB et enregistrez la réponse de courant induite à travers la bicouche.
- Refroidir la bicouche en réduisant la température du point de réglage par incréments de 5 °C et en attendant un minimum de 5 min à la nouvelle température d’équilibre entre les changements de température jusqu’à ce que la température souhaitée soit atteinte. Vous pouvez également essayer de refroidir passivement la bicouche en éteignant le système de contrôle de rétroaction. Sachez toutefois que les expériences mettant en œuvre un refroidissement passif de 50 à 60 °C ont entraîné des taux de coalescence plus élevés.
- Une fois que le bain d’huile et la bicouche refroidissent à la température minimale souhaitée, cliquez à nouveau avec le bouton droit sur le graphique de la température dans l’interface graphique et exportez les données de température en fonction du temps vers un tableur. Arrêtez l’enregistrement en cours.
- À partir du courant mesuré, calculer la capacité nominale de la réponse onde-courant carré en fonction du temps pendant la période de refroidissement.
- Tracer la capacité nominale(C)par rapport à la température(T)pour observer comment la capacité de la membrane a changé. Localisez les changements nonmonotoniques de C par rapport à T pour identifier TM.
REMARQUE: La capacité nominale peut être calculée à partir de l’amplitude du courant d’onde carrée43 (| I|) à l’aide de la relation | Je | = C dv/dt, où dv/dt est égal à quatre fois le produit de l’amplitude de tension (| V|) et fréquence(f)de la tension triangulaire appliquée. D’après ces équations, C = | I|/(4| V|f).
- De même, évaluer la capacité spécifique quasi statique(Cm)de la bicouche à des températures fixes en incrémentant successivement la température du bain d’huile et de la zone bicouche.
- Modifiez la température du point de réglage par incréments de 10 °C à l’aide de l’interface graphique et permettez au système de s’équilibrer à la nouvelle température.
- Effectuez l’étape 4.1.2 pour lancer la mesure du courant capacitif et l’enregistrement.
- Modifiez la zone bicouche en ajustant soigneusement les positions des électrodes à l’aide des micro-manipulateurs (c’est-à-dire que la séparation des électrodes réduit la surface de la bicouche). Permettre au courant d’onde carrée d’atteindre une amplitude à l’état stable et recueillir des images du DIB pour permettre le calcul de la surface de la membrane en fonction du temps en utilisant une caméra montée sur le microscope pour imager la bicouche vue de l’ouverture de l’étage du microscope. Simultanément, ajoutez une balise numérique dans le logiciel d’enregistrement actuel pour marquer le point temporel correspondant pour la collection d’images.
NOTE: Les micro-manipulateurs permettent le contrôle précis des électrodes et donc un contact doux entre les gouttelettes. La manipulation grossière des gouttelettes peut conduire à un échec de l’expérience par coalescence des gouttelettes ou en provoquant la chute d’une gouttelette de l’électrode. Comme indiqué ailleurs22, la surface bicouche est calculée à partir de la longueur de contact entre les gouttelettes, qui apparaissent sous forme de cercles superposés dans une image vue de dessous. Les positions et dimensions des gouttelettes, ainsi que la longueur de la ligne de contact, peuvent être calculées à l’aide d’un logiciel de traitement d’images ou avec d’autres outils de programmation scientifique. - Répétez l’étape 4.2.1.2 au moins 4 fois pour obtenir un total de 5 images DIB et régions d’équilibre du courant bicouche.
- Répétez l’étape 4.2.1 à chaque température souhaitée.
- Aux points de temps balisés correspondant aux zones bicouches à l’état d’équilibre pour les images acquises, analysez les enregistrements actuels et les images DIB pour extraire les données C et A pour chaque température.
- Tracer les données C versus A pour chaque température et calculer la pente d’une régression de premier ordre, qui représente le Cm de la bicouche à chaque température22.
- Valeurs de la placette de Cm obtenues à partir de l’étape 4.2.4 par rapport à T.
- Examiner les données Cm par rapport aux données T pour les variations non monotones afin d’identifier les températures de fusion, TM.
- Modifiez la température du point de réglage par incréments de 10 °C à l’aide de l’interface graphique et permettez au système de s’équilibrer à la nouvelle température.
- Évaluer la dynamique de la formation de canaux ioniques dépendant de la tension en générant une entrée de pas de tension continue à travers la bicouche.
- Réglez la tension initiale sur la valeur de pas souhaitée en mV (par exemple, 100 mV).
- Définissez la tension finale et la taille du pas sur une valeur supérieure à l’étape souhaitée (p. ex., tension finale de 110 mV et taille de pas de 110 mV).
- Définissez une durée souhaitée pour l’entrée de l’étape en secondes (par exemple, 90 s).
- Choisissez la polarité souhaitée pour l’entrée de l’étape (par exemple, positive).
- Changez l’amplificateur de serrage de patch pour envoyer à la scène la tension de commande provenant du module de sortie GUI/tension.
- Lancez les enregistrements en cours.
- Activez la tension et enregistrez la réponse au courant induit, qui devrait présenter une réponse en forme de S à une tension critique (p. ex., ~70 mV pour 1 μg/mL Mz dans 2 mg/mL de BTLE).
- Séparément, des relations dynamiques courant-tension pour une membrane peuvent être obtenues aux températures souhaitées pour révéler les relations dépendantes de la tension, telles que les comportements des canaux ioniques.
- Changez l’amplificateur de serrage de patch pour envoyer à la scène d’tête la tension de commande provenant du générateur de forme d’onde et lancer des enregistrements de courant.
- Sur le générateur de forme d’onde, extrayez une forme d’onde sinusoïdale continue avec une amplitude, un décalage et une fréquence souhaités.
- Enregistrer la réponse actuelle induite sur un ou plusieurs cycles.
- Répétez comme vous le souhaitez pour différentes amplitudes, fréquences et températures d’ondes sinusoïdales.
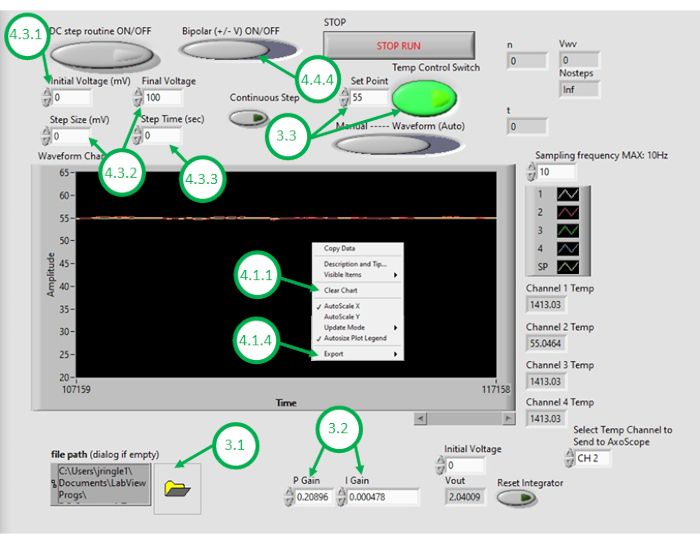
Figure 3: L’interface graphique de contrôle de la température. Cette figure met en évidence et étiquette les étapes critiques requises pour utiliser l’interface graphique du programme pour contrôler la température du bain d’huile. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
La figure 1 montre comment le luminaire en aluminium et le réservoir d’huile acrylique sont préparés sur l’étage du microscope pour la formation de DIB. Les étapes d’assemblage 1.2 à 1.4 servent à isoler thermiquement le luminaire de la scène pour un chauffage plus efficace. Les étapes 1.5 à 1.7 montrent comment fixer correctement le thermocouple au luminaire et positionner le réservoir d’huile, et les étapes 1.8 à 1.9 montrent les emplacements recommandés pour la distr...
Discussion
Le protocole décrit ici fournit des instructions pour l’assemblage et l’exploitation d’un système expérimental pour contrôler la température de l’huile et des gouttelettes utilisées pour former des DIB. Il est particulièrement bénéfique pour permettre la formation de DIB en utilisant des lipides qui ont des températures de fusion supérieures à RT. De plus, en faisant varier précisément la température du réservoir d’huile, la température bicouche peut être manipulée pour étudier les effets de...
Déclarations de divulgation
Les auteurs n’ont pas de conflit d’intérêts.
Remerciements
Le soutien financier a été fourni par la subvention CBET-1752197 de la National Science Foundation et la subvention FA9550-19-1-0213 du Bureau de la recherche scientifique de la Force aérienne.
matériels
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Références
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon