需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用小动物辐射研究平台在胶质母细胞瘤大鼠模型中基于正电子发射断层扫描的剂量绘画放射治疗
摘要
在这里,我们提出了一种方案,使用内部开发的算法在大鼠胶质母细胞瘤模型中执行基于临床前正电子发射断层扫描的放射治疗,以优化准确性和效率。
摘要
先前已建立了一种大鼠胶质母细胞瘤模型,以模拟临床中人类胶质母细胞瘤的化学放射治疗。与临床治疗类似,在治疗计划过程中结合计算机断层扫描(CT)和磁共振成像(MRI)。随后添加了正电子发射断层扫描(PET)成像,以使用微辐照系统实现亚体积增大。然而,使用微照射系统组合三种成像方式(CT、MRI 和 PET)被证明是劳动密集型的,因为在临床前环境中必须按顺序完成多模式成像、治疗计划和剂量递送。这也会导致工作流更容易出现人为错误。因此,实施了一种用户友好的算法,以进一步优化基于临床前多模态成像的放射治疗计划。该软件工具用于通过使用计算机研究设计来评估微辐照剂量绘画放射治疗 的 准确性和效率。剂量涂装放射治疗的新方法在准确性,时间效率以及用户内部和用户间变异性方面优于先前描述的方法。这也是朝着在微型辐照器上实施逆向治疗计划迈出的重要一步,与临床系统相比,前瞻性计划仍然普遍使用。
引言
胶质母细胞瘤(GB)是一种恶性且非常具有侵袭性的原发性脑肿瘤。GB 是一种实体异质性肿瘤,通常以浸润性边界、核异型性和坏死为特征1。血脑屏障的存在以及大脑作为免疫特权位点的地位使得发现化疗和免疫治疗的新靶点成为一项艰巨的任务2,3,4。值得注意的是,自 2005 年引入 Stupp 方案以来,GB 患者的治疗几乎没有变化,该方案将外照射放射治疗 (RT) 与伴随的替莫唑胺相结合,通常随后是替莫唑胺佐胺佐胺5。通常,在 Stupp 方案之前进行最大程度的手术切除。因此,替代治疗方法至关重要。
目前针对胶质母细胞瘤患者的放射治疗将均匀的辐射剂量输送到定义的肿瘤体积。在放射肿瘤学中,胶质母细胞瘤与剂量增加存在重要的剂量反应相关性,由于对正常大脑的毒性增加,似乎上限在60 Gy左右6,7。然而,肿瘤可能非常(放射生物学上)异质性,具有氧水平梯度和/或细胞密度差异很大。代谢成像技术,如PET,可以可视化这些生物学特征,并可用于定制剂量处方。这种方法称为剂量绘画RT。这个术语是由Ling等人在2000年引入的。作者将剂量绘画RT定义为在辐射传播和散射的约束下产生"精细的共形剂量分布"8。
有两种类型的剂量绘画RT,按轮廓进行剂量绘画(DPBC),根据该剂量将剂量规定为一组嵌套的子体积,以及剂量绘画按数字(DPBN),其中剂量在体素水平上规定。可以从功能图像中提取DPBN RT的剂量分布。每个体素中的剂量由图像中相应体素的强度I确定,具有下限和上限,以确保一方面将足够的剂量输送到肿瘤的每个部分。另一方面,剂量不超过上限,以保护处于危险中的器官并避免毒性。最直接的方法是在最小剂量Dmin和最大剂量Dmax之间进行线性插值(见等式1),在目标体积内的最小强度Imax和最大强度之间按比例变化9,10
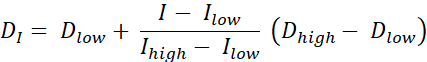 等式 1
等式 1
由于对DPBN RT的质量保证存在一些怀疑,因此应通过临床前和临床研究来验证剂量的沉积10。然而,只能从临床试验中获得有限的数据,并且假设可以通过缩小到实验动物来获得更多的见解11,12。因此,利用精确的图像引导辐射研究平台进行临床前研究,允许与一些非常具体的技术(如放射自显影)相结合,适用于检查开放问题,并为个性化医疗和新型治疗策略铺平道路,例如剂量绘画RT13,14。但是,必须谨慎解释临床前数据,并且必须考虑这些临床前设置的缺点14。
微辐照系统,如小动物辐射研究平台(SARRP),配备了与临床对应物类似的技术。它们包括车载锥形束CT(CBCT)成像,临床前治疗计划系统(PCTPS),并提供亚毫米级精度。临床剂量计算通过逆向治疗计划进行,从所需的剂量分布开始,通过迭代算法确定光束。临床前照射器通常使用前瞻性规划。在前瞻性规划中,选择所需的光束量和角度,然后PCTPS计算剂量分布。计划的优化通过人工迭代执行,这是劳动密集型的15。
2009年后,新的发展使得在这些研究平台上实施逆向规划成为可能16,17,18。为了增加与临床方法的相似性,开发了一种电动可变矩形准直器(MVC)作为多叶准直器的临床前对应物。Cho等人发表了一种利用可变准直器的二维剂量绘画方法。该研究小组在微辐照器上实施了三维(3D)逆治疗计划方案,并确定了目标体积的最小和最大剂量以及风险器官的最大剂量。这些技术主要 在计算机中进行了评估,其临床前应用需要探索。
本文提出了一项计算机研究,以比较使用小动物辐射研究平台在GB大鼠模型20,21,22中[18F]-氟乙基-L-酪氨酸([18F]FET)PET剂量涂装的两种方法。这两种方法是(1)使用预定义的光束尺寸进行亚体积增强和(2)使用电动可变准直器进行剂量涂漆,其中颌骨尺寸根据肿瘤体积中的PET示踪剂摄取进行修改。[18楼]FET是一种PET示踪剂,通常用于神经肿瘤学,因为它具有检测脑肿瘤的能力23。[18楼]FET是一种人造氨基酸,内化到肿瘤细胞中,但未掺入细胞蛋白中。[18楼]FET摄取与细胞增殖速率、肿瘤细胞密度和血管生成相对应24。由于这是这些作者研究所中最常用的肿瘤脑PET示踪剂,因此选择这种放射性示踪剂来评估新的工作流程。
研究方案
该研究得到了当地动物实验伦理委员会的批准(ECD 18/21)。麻醉监测是通过使用传感器获取动物的呼吸频率来进行的。
1. F98国标大鼠细胞模型
- 使用Dulbecco的改良鹰培养基在单层中培养F98 GB细胞,补充10%小牛血清,1%青霉素,1%链霉素和1%L-谷氨酰胺,并将它们置于CO2 培养箱(5%CO 2 和37°C)中。
- 将胶质瘤细胞接种到雌性Fischer F344大鼠的大脑中(体重170克)。
注意:使用无菌器械并始终戴上无菌手套。- 通过鼻锥吸入异氟醚(5%诱导,2%维持)与氧气(0.3mL / min)混合来麻醉大鼠。通过没有肢体的戒断反射来确认麻醉,并使用鼻子和耳朵的固定点在立体定向装置中固定大鼠。使用卡波姆眼胶,以防止麻醉下干眼。通过温控加热垫和直肠探头将体温保持在37°C。
- 将大鼠从眼睛水平剃到颅骨后部,并用异贝他定对皮肤进行消毒。皮下注射木卡因(肾上腺素1:200000,0.1 mL)进行局部麻醉。
- 通过中线头皮切口暴露颅骨,并用钻头工具在右半球的胸毛后方3毫米和3毫米的侧孔上打一个小孔。
- 插入立体触觉引导的胰岛素针(29 G),并使用微注射器泵控制器注射5μL细胞悬浮液(20,000 F98 GB细胞)3mm深。将针头留在原位5分钟,使细胞悬浮液有时间扩散到组织中。
- 慢慢取出注射器,用骨蜡封闭颅骨上的孔。缝合皮肤(聚酰胺6,厚度4-0)并皮下注射美洛昔康(1mg / kg,2mg / mL)。涂抹木糖卡因凝胶。
- 使用红灯稳定手术后动物的体温。监测老鼠的觉醒,直到它恢复足够的意识。在完全康复之前,不要将动物归还给其他动物。将所有动物置于环境控制条件下(12小时光/暗循环,20-24°C和40-70%相对湿度 ),随意食用和水。
- 确保每天监测动物,并通过检查它们的体重,食物,水摄入量以及它们的活动和行为来保持每日健康状况日志。如果观察到体重下降20%或正常行为严重恶化(例如,缺乏修饰),则使用致命剂量的戊巴比妥钠对动物实施安乐死(160mg / kg)。
2. 肿瘤生长的确认
- 接种后8天评估肿瘤生长。通过鼻锥吸入异氟醚(5%诱导,2%维持)与氧气(0.3mL / min)混合来麻醉大鼠。通过肢体无戒断反射来确认麻醉。
- 通过静脉注射尾静脉内放置的导管注射含钆造影剂(0.4 mL/kg)。用温水循环加热毯盖住动物,并将它们放在MRI床上。使用卡波姆眼胶,以防止麻醉下干眼。将MRI床放在带有Tx / Rx大鼠脑容积线圈的支架中。
- 执行定位器扫描,然后进行 T2 加权自旋回波扫描以评估肿瘤生长。使用这些 T2-MRI 序列设置:重复时间 (TR)/回波时间 (TE) 3661/37.1 ms,109 μm 各向同性面内分辨率,切片厚度 600 μm,4 个平均值,30 个切片,总采集时间 (TA) 9 min 45 s。
- 如果在 T2 加权采集中确认肿瘤,则进行 T1 加权造影剂增强旋转回波扫描。使用这些 T1-MRI 序列设置:TR/TE 1539/9.7 ms、0.117 mm 各向同性面内分辨率、切片厚度 600 μm、3 个平均值、30 个切片、TA 4 分钟 15 秒。
- 核磁共振成像后,持续监督动物,直到它恢复完全意识。
- 当肿瘤直径达到7~8mm时,通常在接种后12天观察,选择动物进行治疗。
3. 目标体积选择的多模态成像
注意:PET/MRI 引导照射需要按顺序采集多模式数据集。静脉内给予放射性示踪剂后,开始PET成像,然后进行造影剂增强T1加权MRI,最后进行治疗计划CT。
- 使用鼻锥将异氟醚(5%诱导,2%维持)与氧气(0.3 L / min)混合麻醉动物。当大鼠不表现出肢体的任何戒断反射时,确认麻醉。应用卡波姆眼胶,防止麻醉下眼睛干涩。
- 将管路静脉插入侧尾静脉,能够注入溶解在200μL盐水中的10-12 MBq的PET放射性示踪剂。注入 [18F]-FET,在采集 PET 前 1 小时。让动物恢复意识,而示踪剂分布在体内。
- 再次麻醉动物,如步骤3.1中所述。将动物放在多模态床上(此处为内部制造),并使用钩环紧固件固定,在成像和微照射期间保持固定位置。固定充满MRI / PET试剂的毛细管(见 材料表),以便于共同注册。用气泡膜包裹动物,以在多模态成像和治疗期间保持其体温。
- 在注射PET示踪剂后1小时进行PET扫描。通过使用 30 次迭代应用最大似然期望最大化 (MLEM) 算法,将 PET 扫描重建为具有 0.4 mm 体素大小的 3D 体积(192 x 192 x 384 矩阵)。
注:用于实验动物成像的专用PET扫描仪的轴向视场为130 mm,孔径为72 mm。该系统提供亚毫米(0.85毫米)的空间分辨率。 - 将 MRI 造影剂 (0.4 mL/kg) 静脉注射到尾静脉中。将仍然固定在多模态床上的大鼠放在MRI扫描仪(材料表)的动物支架中。执行定位器扫描,然后执行对比度增强的 T1 加权自旋回波序列,类似于步骤 2.4。
- 将仍固定在多模态床上的动物放在固定在微型辐照器上的四轴机器人定位台上的塑料支架上。使用 70 kV 的管电压、0.4 mA 的管电流、1 mm 铝滤光片和 20 x 20 cm(1024 x 1024 像素)的非晶硅平板探测器执行高分辨率治疗规划锥形束 CT。在 360° 上总共获取 360 个投影。重建CT图像,各向同性体素尺寸为0.275 mm(411 x 411 x 251矩阵)。
4. 图像协同配准
注意:共同注册是使用内部开发的半自动 MATLAB 代码执行的。代码可以在Github上找到,网址为 https://github.com/sdonche/DosePainting。下面描述了不同的步骤。
- 将三种影像模式([18F]FET PET、对比度增强 T1 加权 MRI 和锥形束 CT)放入一个文件夹中。使用来自 mricron 图像查看器24 的 dcm2niix 函数将 DICOM 图像转换为 NIfTI 格式。
- 将转换后的图像导入 MATLAB,并使用 1 mm 的全宽半最大值 (FWHM) 使用高斯滤镜过滤 PET 图像。
- 重新定向图像,以便所有成像模态的笛卡尔轴彼此对应。
注意:对于此设置,CT图像围绕Y轴翻转;MRI围绕X轴翻转,PET围绕Y轴翻转。 - 裁剪 PET 图像以简化自动共同配准。
注意:对于此设置,从X轴的两侧(动物的左侧和右侧)将40个像素设置为零。在动物的背侧和腹侧(Y轴),分别将60和40像素设置为零;沿着纵轴(或 Z 轴),对于劣等侧和上侧,分别将 170 和 30 像素设置为零。 - 将图像中心彼此靠近移动以简化自动共同配准。
- 使用 MATLAB26 中的统计参数映射 (SPM) 执行实际的刚体共配准。使用以下注册参数(默认使用其他参数):目标函数:互信息;分离: [4 1 0.2];公差: [0.02 0.02 0.02 0.001 0.001 0.001 0.01 0.01 0.01 0.001 0.001 0.001];直方图平滑: [1 1];插值:三线性。
5. 放射治疗计划
注意:为放射治疗计划编写了一个 MATLAB 应用程序和多个 MATLAB 脚本。代码可以在Github上找到,网址为 https://github.com/sdonche/DosePainting。下面介绍了不同的步骤。
- 方法 1
- 将三种不同的成像模式加载到 MATLAB 应用程序中。在T1加权MRI扫描的对比度增强周围放置一个宽大的边界框(图1)。使用阈值确定对比度增强的音量(图2)。如果选择了多个区域,则仅选择最大体积,其中心被认为是第一个为RT提供规定剂量的同位中心(图3)。
- 将先前确定的 MRI 对比度增强在每个方向上扩展 10 个像素。如果检测到多个区域,则仅保留最大的PET体积,其中心被认为是为RT提供规定剂量的第二个等位中心。
注:在此 PET 音量中,PET 增强音量由此音量中信号强度高于 0.90 ×最大信号强度(在边界框中)的像素定义。 - 对计算出的同位中心使用以下照射设置(图4 和 表1)。
- 对于第一个等中心(MRI),在0°,-45°和-90°的卧床位置使用3个非共面弧,分别旋转120°,120°和60°,给予规定的剂量2000 cGy。使用10 x 10 mm的固定准直器尺寸,但在需要照射较小肿瘤尺寸时使用适当的准直器(例如,5 x 5 mm准直器)。当肿瘤体积大于10毫米时,要小心考虑动物的福利。
- 对于第二等中心(PET),在卧床位置0°,-45°和-90°使用3个非共面弧,分别旋转120°,120°和60°,给予800 cGy的规定剂量。使用 3 x 3 mm 的固定准直器尺寸。
- 计算动物体内的剂量分布和光束传递参数。
- 方法 2
- 将三种不同的成像模式加载到 MATLAB 应用程序中。在 [18F] FET PET 图像的对比度增强周围放置一个宽大的边界框,类似于步骤 5.1.1。
- 确定由信号强度高于 A 的像素定义的体积×最大信号强度(在上述边界框中),其中 A 等于 0.50、0.60、0.70、0.80 和 0.90。分别将这些卷命名为 V50、V60、V70、V80 和 V90。
- 使用 MATLAB 脚本确定引导电动可变准直器所需的每个光束的等中心和钳口尺寸(见 图 5)。
- 对计算出的同心和钳口尺寸使用以下设置:
- 对于V50,给予2000 cGy的规定剂量,分布在16个光束上(每个125 cGy; 表2中的沙发和龙门架位置)。使用 MVC 的计算钳口尺寸。
注意:在这里,包括1 mm的额外切缘,以解释微观肿瘤浸润。 - 对于V60-V90,给予800 cGy的规定剂量,分布在40个光束上(每个20 cGy; 表2中的沙发和龙门架位置)。使用 MVC 的计算钳口尺寸。
- 对于V50,给予2000 cGy的规定剂量,分布在16个光束上(每个125 cGy; 表2中的沙发和龙门架位置)。使用 MVC 的计算钳口尺寸。
- 计算动物体内的剂量分布和光束传递参数。
6. 计划评估
注意:要比较这两种方法,请计算V50 PET体积中的剂量 - 体积直方图(DVH)和Q体积直方图(QVH)。这里使用了内部开发的 MATLAB 脚本。代码可以在Github上找到,网址为 https://github.com/sdonche/DosePainting。
- 剂量-体积直方图
- 从从SARRP获得的剂量分布中产生DVH。
- 通过计算 D10、D50 和 D90 确定 DVH 的最大、平均和最小剂量,其中 Dx 代表体积 x% 的剂量。
- Q 体积直方图
- 使用 等式1计算每个像素的理想剂量,这是最小和最大剂量之间的线性插值,在目标体积内的最小PET强度和最大PET强度之间按比例变化,以提供理想的剂量图。
- 使用以下等式(等式 2)计算每个像素的 Q 值 Qp:
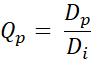 等式 2
等式 2
Dp是通过计划获得的剂量,Di是计划的剂量目标。 - 从获得的 Q 值生成 QVH。
- 使用公式3计算质量因子(Q因子,QF)以评估计划剂量和预期剂量之间的差异:
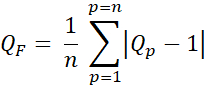 等式 3
等式 3
结果
在胶质母细胞瘤大鼠模型中使用SARRP模拟人类治疗策略的PET和MRI引导照射的可行性之前已经描述过20,21,22。虽然将动物固定在内部制作的多模式床上,但可以创建一个可接受的放射治疗计划,结合三种成像方式:PET,MRI和CT。在这些方法中,使用外部软件包(参见 材料表)手动使用刚体变换来共同注册图像。对对?...
讨论
先前描述了一种大鼠GB模型,用于模拟临床上胶质母细胞瘤患者的化疗放射治疗20。与临床方法类似,CT和MRI在治疗计划过程中相结合,以获得更精确的照射。当动物从一个成像系统移动到另一个成像系统时,使用多模态床来最小化(头部)运动。随后,将PET成像添加到治疗计划过程中,并且可以成功实施基于PET的亚容量提升21,22。在?...
披露声明
作者没有利益冲突需要披露。
致谢
作者要感谢Lux Luka基金会对这项工作的支持。
材料
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
参考文献
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。