Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Radiothérapie par peinture de dose basée sur la tomographie par émission de positons dans un modèle de rat de glioblastome à l’aide de la plate-forme de recherche sur les rayonnements de petits animaux
Dans cet article
Résumé
Nous présentons ici un protocole pour effectuer une radiothérapie préclinique basée sur la tomographie par émission de positons dans un modèle de glioblastome de rat à l’aide d’algorithmes développés en interne pour optimiser la précision et l’efficacité.
Résumé
Un modèle de glioblastome de rat pour imiter le traitement chimio-radiothérapie du glioblastome humain en clinique a déjà été établi. À l’instar du traitement clinique, la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM) ont été combinées au cours du processus de planification du traitement. L’imagerie par tomographie par émission de positons (TEP) a ensuite été ajoutée pour mettre en œuvre l’amplification du sous-volume à l’aide d’un système de micro-irradiation. Cependant, la combinaison de trois modalités d’imagerie (tomodensitométrie, IRM et TEP) à l’aide d’un système de micro-irradiation s’est avérée laborieuse, car l’imagerie multimodale, la planification du traitement et l’administration des doses doivent être effectuées séquentiellement dans le cadre préclinique. Il en résulte également un flux de travail plus sujet aux erreurs humaines. Par conséquent, un algorithme convivial pour optimiser davantage la planification de la radiothérapie basée sur l’imagerie multimodale préclinique a été mis en œuvre. Cet outil logiciel a été utilisé pour évaluer la précision et l’efficacité de la radiothérapie par peinture de dose avec micro-irradiation à l’aide d’un plan d’étude in silico . La nouvelle méthodologie pour la radiothérapie par peinture de dose est supérieure à la méthode décrite précédemment en termes de précision, d’efficacité temporelle et de variabilité intra- et inter-utilisateurs. Il s’agit également d’une étape importante vers la mise en œuvre de la planification du traitement inverse sur les micro-irradiateurs, où la planification prospective est encore couramment utilisée, contrairement aux systèmes cliniques.
Introduction
Le glioblastome (GB) est une tumeur cérébrale primitive maligne et très agressive. Gb est une tumeur hétérogène solide généralement caractérisée par des limites infiltrantes, une atypie nucléaire et une nécrose1. La présence de la barrière hémato-encéphalique et le statut du cerveau en tant que site immuno-privilégié font de la découverte de nouvelles cibles pour la chimiothérapie et l’immunothérapie une tâche ardue2,3,4. Il est à noter que le traitement des patients atteints de GB a à peine changé depuis l’introduction, en 2005, du protocole Stupp qui combine la radiothérapie par faisceau externe (RT) avec le témozolomide concomitant, généralement suivi du témozolomide adjuvant5. En règle générale, le protocole Stupp est précédé d’une résection chirurgicale maximale. Par conséquent, les approches de traitement alternatives sont d’une importance cruciale.
La radiothérapie actuelle pour les patients atteints de glioblastome délivre une dose de rayonnement uniforme au volume tumoral défini. En radio-oncologie, il existe une corrélation dose-réponse importante pour le glioblastome avec une dose croissante, qui semble plafonner autour de 60 Gy, en raison d’une toxicité accrue pour le cerveau normal6,7. Cependant, les tumeurs peuvent être très (radiobiologiquement) hétérogènes, avec des gradients de niveau d’oxygène et/ou de grandes différences de densité cellulaire. Les techniques d’imagerie métabolique, telles que la TEP, peuvent visualiser ces caractéristiques biologiques et peuvent être utilisées pour personnaliser la prescription de dose. Cette approche est connue sous le nom de peinture de dose RT. Ce terme a été introduit par Ling et al. en 2000. Les auteurs ont défini la RT de peinture de dose comme produisant « des distributions de dose extrêmement conformes dans les contraintes de propagation et de diffusion du rayonnement »8.
Il existe deux types de peinture de dose RT, la peinture de dose par contours (DPBC), par laquelle une dose est prescrite à un ensemble de sous-volumes imbriqués, et la peinture de dose par nombres (DPBN), par laquelle une dose est prescrite au niveau du voxel. La distribution de dose pour DPBN RT peut être extraite à partir d’images fonctionnelles. La dose dans chaque voxel est déterminée par l’intensité I du voxel correspondant dans l’image, avec une limite inférieure et supérieure, pour s’assurer que, d’une part, une dose suffisante est administrée à chaque partie de la tumeur. D’autre part, les doses ne dépassent pas une limite supérieure pour protéger les organes à risque et éviter la toxicité. La méthode la plus simple est une interpolation linéaire (voir Eq. 1) entre la dose minimale Dmin et la dose maximale Dmax, variant proportionnellement entre l’intensité minimale Imax et l’intensité maximale dans le volume cible9,10
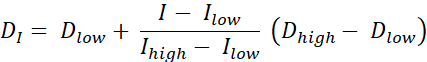 Eq. 1
Eq. 1
Parce qu’il y a un certain scepticisme quant à l’assurance de la qualité de DPBN RT, le dépôt de la dose devrait être vérifié par la recherche préclinique et clinique10. Cependant, seules des données limitées peuvent être obtenues à partir d’essais cliniques, et il a été émis l’hypothèse que davantage d’informations peuvent être obtenues en réduisant la taille d’échelle aux animaux de laboratoire11,12. Par conséquent, les études précliniques utilisant des plates-formes de recherche sur les rayonnements guidés par l’image de précision qui permettent le couplage avec certaines techniques très spécifiques, telles que l’autoradiographie, sont adaptées pour examiner les questions en suspens et ouvrir la voie à la médecine personnalisée et à de nouvelles stratégies de traitement, telles que la peinture de dose RT13,14. Cependant, l’interprétation des données précliniques doit être effectuée avec prudence et les inconvénients de ces configurations précliniques doivent être pris en compte14.
Les systèmes de micro-irradiation, tels que la Small Animal Radiation Research Platform (SARRP), sont équipés de technologies similaires à celles de leur homologue clinique. Ils comprennent l’imagerie CT à faisceau conique (CBCT) embarquée, un système de planification de traitement préclinique (PCTPS) et offrent une précision submillimétrique. Les calculs de dose clinique sont effectués par planification inverse du traitement, par laquelle on commence à partir de la distribution de dose souhaitée pour déterminer les faisceaux via un algorithme itératif. Les irradiateurs précliniques utilisent souvent la planification prospective. Dans la planification prospective, la quantité et l’angle requis des faisceaux sont sélectionnés, et le PCTPS calcule ensuite la distribution de la dose. L’optimisation des plans est effectuée par itération manuelle, ce qui nécessite beaucoup de main-d’œuvre15.
Après 2009, de nouveaux développements ont rendu possible la mise en œuvre de la planification inverse sur ces plateformes de recherche16,17,18. Pour augmenter la similitude avec la méthode clinique, un collimateur rectangulaire variable motorisé (MVC) a été développé comme contrepartie préclinique du collimateur à feuilles multiples. Une méthode de peinture à dose bidimensionnelle utilisant un collimateur variable a été publiée par Cho et al.19. Ce groupe de recherche a mis en œuvre un protocole de planification de traitement inverse tridimensionnel (3D) sur un micro-irradiateur et a déterminé les doses minimales et maximales pour le volume cible et une dose maximale pour les organes à risque. Ces techniques ont été principalement évaluées in silico et leurs applications précliniques doivent être explorées.
Cet article présente une étude in silico pour comparer deux méthodologies pour la peinture à dose à base de PET [18F]-fluoro-éthyl-L-tyrosine ([18F]FET) dans un modèle de rat GB20,21,22 à l’aide d’une plate-forme de recherche sur les rayonnements de petits animaux. Ces deux méthodologies sont (1) l’amplification du sous-volume à l’aide de tailles de faisceau prédéfinies et (2) la peinture de dose à l’aide d’un collimateur variable motorisé où les dimensions de la mâchoire sont modifiées en fonction de l’absorption du traceur PET dans le volume tumoral. [18F] Le FET est un traceur TEP souvent utilisé en neuro-oncologie en raison de sa capacité à détecter les tumeurs cérébrales23. [18F] Le FET est un acide aminé artificiel qui est internalisé dans les cellules tumorales mais pas incorporé dans les protéines cellulaires. [18F] L’absorption du FET correspond au taux de prolifération cellulaire, à la densité des cellules tumorales et à l’angiogenèse24. Comme il s’agit du traceur TEP cérébral oncologique le plus couramment utilisé dans l’institut de ces auteurs, ce radiotraceur a été choisi pour évaluer le nouveau flux de travail.
Protocole
L’étude a été approuvée par le comité d’éthique local pour l’expérimentation animale (ECD 18/21). La surveillance de l’anesthésie est effectuée en acquérant la fréquence respiratoire des animaux à l’aide d’un capteur.
1. Modèle de cellule de rat F98 GB
- Cultivez les cellules F98 GB dans une monocouche à l’aide du milieu Eagle modifié de Dulbecco, complété par 10% de sérum de veau, 1% de pénicilline, 1% de streptomycine et 1% de L-glutamine, et placez-les dans un incubateur à CO2 (5% de CO2 et 37 ° C).
- Inoculer les cellules de gliome dans le cerveau des rats Fischer F344 femelles (poids corporel 170 g).
REMARQUE: Utilisez des instruments stériles et portez des gants stériles en tout temps.- Anesthésier les rats par inhalation d’isoflurane (5% d’induction, 2% d’entretien) mélangé à de l’oxygène (0,3 mL / min) à travers un cône nasal. Confirmer l’anesthésie par l’absence de réflexe de retrait du membre, et immobiliser les rats dans un dispositif stéréotaxique en utilisant des points de fixation pour le nez et les oreilles. Appliquez un gel pour les yeux en carbomère pour prévenir la sécheresse oculaire sous anesthésie. Maintenir la température corporelle à l’aide d’un coussin chauffant thermorégulé et d’une sonde rectale à 37 °C.
- Rasez le rat du niveau des yeux à l’arrière du crâne et désinfectez la peau avec de l’isobétadine. Injecter de la xylocaïne (avec de l’adrénaline 1:200000, 0,1 mL) par voie sous-cutanée pour une anesthésie locale.
- Exposez le crâne à travers une incision médiane du cuir chevelu et faites un petit trou avec un outil de forage de 3 mm postérieur et latéral de 3 mm au bregma dans l’hémisphère droit.
- Insérez une aiguille à insuline à guidage stéréotactique (29 G) et injectez 5 μL de suspension cellulaire (20 000 cellules F98 Go) de profondeur de 3 mm à l’aide d’un contrôleur de pompe à microsyringe. Laissez l’aiguille en place pendant 5 minutes, ce qui donne à la suspension cellulaire le temps de se diffuser dans les tissus.
- Retirez la seringue lentement et fermez le trou dans le crâne avec de la cire osseuse. Suturer la peau (polyamide 6, épaisseur 4-0) et injecter du méloxicam par voie sous-cutanée (1 mg/kg, 2 mg/mL). Appliquer le gel de xylocaïne.
- Stabiliser la température corporelle de l’animal après la chirurgie à l’aide d’une lampe rouge. Surveillez le réveil du rat jusqu’à ce qu’il ait retrouvé une conscience suffisante. Ne retournez pas l’animal en compagnie d’autres animaux avant qu’il ne soit complètement rétabli. Hébergez tous les animaux dans des conditions contrôlées par l’environnement (cycle lumière/obscurité de 12 h, 20-24 °C et 40-70% d’humidité relative) avec de la nourriture et de l’eau ad libitum.
- Assurez-vous de surveiller les animaux quotidiennement et de tenir un journal quotidien de l’état de santé en vérifiant leur poids corporel, leur nourriture, leur consommation d’eau, ainsi que leur activité et leur comportement. Utiliser une dose létale de pentobarbital sodique pour euthanasier les animaux (160 mg/kg) si une baisse de 20 % du poids corporel est observée ou lorsque le comportement normal se détériore gravement (p. ex., manque de toilettage).
2. Confirmation de la croissance tumorale
- Évaluer la croissance tumorale 8 jours après l’inoculation. Anesthésier les rats par inhalation d’isoflurane (5% d’induction, 2% d’entretien) mélangé à de l’oxygène (0,3 mL / min) à travers un cône nasal. Confirmer l’anesthésie par l’absence de réflexe de retrait du membre.
- Injecter un agent de contraste contenant du gadolinium (0,4 mL/kg) à travers un tube placé par voie intraveineuse dans la veine latérale de la queue. Couvrez l’animal avec une couverture chauffante à circulation d’eau tiède et placez-le dans le lit d’IRM. Appliquez un gel pour les yeux en carbomère pour prévenir la sécheresse oculaire sous anesthésie. Placez le lit d’IRM dans le support avec une bobine de volume cérébral Tx / Rx Rat.
- Effectuez une analyse de localisation suivie d’une analyse de spin-écho pondérée en T2 pour évaluer la croissance tumorale. Utilisez ces paramètres de séquence T2-IRM : temps de répétition (TR)/temps d’écho (TE) 3661/37,1 ms, résolution isotrope dans le plan de 109 μm, épaisseur de tranche 600 μm, 4 moyennes, 30 tranches, temps total d’acquisition (TA) 9 min 45 s.
- Si une tumeur est confirmée lors de l’acquisition pondérée en T2, effectuez un balayage de spin amélioré par contraste pondéré T1. Utilisez ces paramètres de séquence IRM T1 : TR/TE 1539/9,7 ms, résolution isotrope dans le plan de 0,117 mm, épaisseur de tranche 600 μm, 3 moyennes, 30 tranches, TA 4 min 15 s.
- Après l’IRM, surveillez continuellement l’animal jusqu’à ce qu’il reprenne pleine conscience.
- Lorsque la tumeur atteint un diamètre de 7 à 8 mm, généralement observé 12 jours après l’inoculation, sélectionnez l’animal pour le traitement.
3. Imagerie multimodale de la sélection du volume cible
REMARQUE : L’irradiation guidée par TEP/IRM nécessite l’acquisition séquentielle d’un ensemble de données multimodales. Après l’administration intraveineuse du radiotraceur, l’imagerie TEP est commencée, suivie d’une IRM pondérée T1 améliorée par contraste et enfin d’une tomodensitométrie de planification du traitement.
- Anesthésier l’animal avec de l’isoflurane (5% d’induction, 2% d’entretien) mélangé à de l’oxygène (0,3 L/min) à l’aide d’un cône de nez. Confirmer l’anesthésie lorsque les rats ne présentent aucun réflexe de retrait du membre. Appliquez un gel pour les yeux carbomère pour prévenir la sécheresse oculaire sous anesthésie.
- Insérer le tube par voie intraveineuse dans la veine latérale de la queue, permettant l’injection de 10 à 12 MBq de traceur radioactif PET dissous dans 200 μL de solution saline. Injecter [18F]-FET, 1 h avant l’acquisition du PET. Laissez l’animal reprendre conscience pendant que le traceur est distribué dans le corps.
- Anesthésier à nouveau l’animal, comme décrit à l’étape 3.1. Placez l’animal sur un lit multimodal (ici, fabriqué en interne) et fixez-le à l’aide de fixations à crochet et à boucle, en maintenant une position fixe pendant l’imagerie et la micro-irradiation. Fixez un capillaire rempli de l’agent IRM/TEP (voir la table des matériaux) pour faciliter la co-enregistrement. Enveloppez l’animal dans du papier bulle pour préserver sa température corporelle pendant l’imagerie et la thérapie multimodales.
- Effectuez une TEP 1 h après l’injection du traceur TEP. Reconstruisez le PET scan en un volume 3D (matrice 192 x 192 x 384) avec une taille de voxel de 0,4 mm en appliquant un algorithme MLEM (Maximum-Likelihood Expectation-Maximization) à l’aide de 30 itérations.
REMARQUE: Un scanner PET dédié à l’imagerie des animaux de laboratoire a été utilisé avec un champ de vision axial de 130 mm et un diamètre d’alésage de 72 mm. Ce système fournit une résolution spatiale inférieure à mm (0,85 mm). - Injecter un agent de contraste IRM (0,4 mL/kg) par voie intraveineuse dans la veine caudale. Placez le rat, toujours fixé sur le lit multimodal, dans le porte-animal de l’IRM (Table des matériaux). Effectuez une analyse de localisation suivie d’une séquence d’écho de spin pondérée T1 améliorée par contraste, analogue à l’étape 2.4.
- Placez l’animal, toujours fixé sur le lit multimodal, sur un support en plastique fixé sur la table de positionnement robotique à quatre axes du micro-irradiateur. Effectuez une tomodensitométrie à faisceau conique de planification de traitement à haute résolution à l’aide d’une tension de tube de 70 kV, d’un courant de tube de 0,4 mA, d’un filtre en aluminium de 1 mm et d’un détecteur à écran plat amorphe Si de 20 x 20 cm (1024 x 1024 pixels). Acquérir un total de 360 projections à plus de 360°. Reconstruisez les images CT avec une taille de voxel isotrope de 0,275 mm (matrice 411 x 411 x 251).
4. Co-enregistrement de l’image
REMARQUE: La co-inscription est effectuée avec un code MATLAB semi-automatique développé en interne. Le code peut être trouvé sur Github à https://github.com/sdonche/DosePainting. Les différentes étapes sont décrites ci-dessous.
- Placez les trois modalités d’image ([18F]PET FET, IRM pondérée T1 à contraste amélioré et tomodensitométrie à faisceau conique) dans un seul dossier. Convertissez les images DICOM au format NIfTI à l’aide de la fonction dcm2niix de la visionneuse d’images mricron24.
- Importez les images converties dans MATLAB et filtrez l’image PET avec un filtre gaussien à l’aide d’un Half-Max pleine largeur (FWHM) de 1 mm.
- Réorientez les images de manière à ce que les axes cartésiens de toutes les modalités d’imagerie correspondent les uns aux autres.
REMARQUE: Pour cette configuration, l’image CT a été inversée autour de l’axe Y; l’IRM a été retournée autour de l’axe X et la TEP a été retournée autour de l’axe Y. - Recadrez l’image PET pour simplifier la co-enregistrement automatique.
REMARQUE: Pour cette configuration, 40 pixels ont été mis à zéro des deux côtés de l’axe X (gauche et droite de l’animal); sur la face dorsale et ventrale de l’animal (axe Y), 60 et 40 pixels ont été mis à zéro, respectivement; le long de l’axe longitudinal (ou axe Z), 170 et 30 pixels sont mis à zéro pour le côté inférieur et supérieur, respectivement. - Déplacez les centres d’images les uns à proximité les uns des autres pour simplifier la co-inscription automatique.
- Effectuez le co-enregistrement réel du corps rigide à l’aide de la cartographie paramétrique statistique (SPM) dans MATLAB26. Utilisez les paramètres d’enregistrement suivants (autres par défaut) : fonction objective : informations mutuelles ; séparation: [4 1 0,2]; tolérances: [0,02 0,02 0,02 0,001 0,001 0,001 0,01 0,01 0,01 0,001 0,001 0,001]; lissage de l’histogramme: [1 1]; interpolation : trilinéaire.
5. Planification de la radiothérapie
REMARQUE : Une application MATLAB et plusieurs scripts MATLAB ont été écrits pour la planification de la radiothérapie. Le code peut être trouvé sur Github à https://github.com/sdonche/DosePainting. Les différentes étapes sont expliquées ci-dessous.
- Méthode 1
- Chargez les trois différentes modalités d’imagerie dans l’application MATLAB. Placez un cadre de sélection généreux autour de l’amélioration du contraste sur l’IRM pondérée T1 (Figure 1). Déterminez le volume à contraste amélioré à l’aide d’un seuil (Figure 2). Si plusieurs régions ont été sélectionnées, sélectionnez uniquement le plus grand volume, dont le centre est considéré comme le premier isocentre à administrer une dose prescrite pour la RT (Figure 3).
- Développez l’amélioration du contraste IRM précédemment déterminée de 10 pixels dans chaque direction. Si plusieurs régions sont détectées, ne conservez que le plus grand volume de TEP, dont le centre est considéré comme le deuxième isocentre à délivrer une dose prescrite pour la RT.
REMARQUE: Dans ce volume PET, le volume d’amplification PET est défini par les pixels dont l’intensité du signal est supérieure à 0,90 × intensité maximale du signal (dans le cadre de sélection) de ce volume. - Utilisez les paramètres d’irradiation suivants pour les isocentres calculés (Figure 4 et Tableau 1).
- Pour le premier isocentre (IRM), donnez une dose prescrite de 2000 cGy en utilisant 3 arcs non coplanaires aux positions du canapé 0°, -45° et -90° avec une rotation du portique de 120°, 120° et 60°, respectivement. Utilisez un collimateur fixe de 10 x 10 mm, mais utilisez un collimateur approprié (par exemple, un collimateur de 5 x 5 mm) lorsque des tumeurs de plus petite taille doivent être irradiées. Soyez prudent en tenant compte du bien-être de l’animal lorsque les volumes tumoraux sont supérieurs à 10 mm.
- Pour le deuxième isocentre (PET), donnez une dose prescrite de 800 cGy en utilisant 3 arcs non coplanaires aux positions du canapé 0°, -45° et -90° avec une rotation du portique de 120°, 120° et 60°, respectivement. Utilisez un collimateur fixe de 3 x 3 mm.
- Calculer la distribution de la dose au sein de l’animal et les paramètres d’administration du faisceau.
- Méthode 2
- Chargez les trois différentes modalités d’imagerie dans l’application MATLAB. Placez un cadre de sélection généreux autour de l’amélioration du contraste sur l’image PET [18F]FET, analogue à l’étape 5.1.1.
- Déterminez les volumes définis par les pixels dont l’intensité du signal est supérieure à A × intensité maximale du signal (dans le cadre de sélection susmentionné), avec A égal à 0,50, 0,60, 0,70, 0,80 et 0,90. Nommez ces volumes V50, V60, V70, V80 et V90, respectivement.
- Déterminez les isocentres et les dimensions de la mâchoire pour chaque faisceau nécessaire pour guider le collimateur variable motorisé à l’aide du script MATLAB (voir Figure 5).
- Utilisez les paramètres suivants pour les isocentres et les dimensions de la mâchoire calculés :
- Pour le V50, administrer une dose prescrite de 2000 cGy répartis sur 16 faisceaux (chacun 125 cGy; positions du canapé et du portique dans le tableau 2). Utilisez les dimensions de mâchoire calculées pour le MVC.
REMARQUE: Ici, une marge supplémentaire de 1 mm a été incluse pour tenir compte de l’infiltration microscopique de la tumeur. - Pour le V60-V90, administrer une dose prescrite de 800 cGy répartis sur 40 faisceaux (chacun 20 cGy; positions du canapé et du portique dans le tableau 2). Utilisez les dimensions de mâchoire calculées pour le MVC.
- Pour le V50, administrer une dose prescrite de 2000 cGy répartis sur 16 faisceaux (chacun 125 cGy; positions du canapé et du portique dans le tableau 2). Utilisez les dimensions de mâchoire calculées pour le MVC.
- Calculer la distribution de la dose au sein de l’animal et les paramètres d’administration du faisceau.
6. Évaluation du plan
REMARQUE: Pour comparer les deux méthodes, calculez les histogrammes dose-volume (DVH) et l’histogramme Q-volume (QVH) dans le volume PET V50. Ici, un script MATLAB, développé en interne, a été utilisé. Le code peut être trouvé sur Github à https://github.com/sdonche/DosePainting.
- Histogramme dose-volume
- Générer de la DVH à partir de la distribution de dose obtenue à partir du SARRP.
- Déterminez les doses maximales, moyennes et minimales de la DVH en calculant les doses D10, D50 et D90, où Dx représente la dose reçue par x % du volume.
- Histogramme Q-volume
- Calculez une dose idéale pour chaque pixel en utilisant Eq. 1, qui est une interpolation linéaire entre les doses minimale et maximale, variant proportionnellement entre l’intensité minimale de PET et l’intensité maximale de PET dans le volume cible pour donner une carte de dose idéale.
- Calculez la valeur Qp pour chaque pixel à l’aide de l’équation suivante (Eq. 2) :
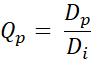 Eq. 2
Eq. 2
Dp étant la dose obtenue par planification et Di, l’objectif de dose pour la planification. - Générez QVH à partir des valeurs Q obtenues.
- Calculer le facteur de qualité (facteur Q, QF) pour évaluer la différence entre les doses prévues et prévues en utilisant Eq. 3:
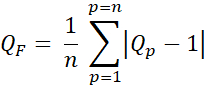 Eq. 3
Eq. 3
Résultats
La faisabilité de l’irradiation guidée par TEP et IRM dans un modèle de rat glioblastome utilisant le SARRP pour imiter la stratégie de traitement humain a déjà été décrite20,21,22. Alors que l’animal était fixé sur un lit multimodal fabriqué en interne, il a été possible de créer un plan de radiothérapie acceptable combinant trois modalités d’imagerie: TEP, IRM et CT. Dans ces méthodes, un progiciel exte...
Discussion
Un modèle GB de rat pour imiter le traitement de chimiothérapie-radiothérapie en clinique pour les patients atteints de glioblastome a été précédemment décrit20. Semblable à la méthode clinique, la tomodensitométrie et l’IRM ont été combinées au cours du processus de planification du traitement pour obtenir une irradiation plus précise. Un lit multimodal pour minimiser les mouvements (de la tête) a été utilisé lorsque l’animal a été déplacé d’un système d’imagerie ?...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier la Fondation Lux Luka pour son soutien à ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Références
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon