É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Positron Emission Tomography-based Dose Radiation Therapy em um modelo de rato glioblastoma usando a plataforma de pesquisa de radiação animal de pequeno porte
Neste Artigo
Resumo
Aqui apresentamos um protocolo para realizar radioterapia baseada em tomografias pré-pêtrons em um modelo de glioblastoma de ratos usando algoritmos desenvolvidos internamente para otimizar a precisão e eficiência.
Resumo
Um modelo de glioblastoma de rato para imitar o tratamento de quimioterapia-radiação do glioblastoma humano na clínica foi previamente estabelecido. Semelhante ao tratamento clínico, tomografia computadorizada (TC) e ressonância magnética (RM) foram combinadas durante o processo de planejamento do tratamento. A tomografia de emissão de pósitrons (PET) foi posteriormente adicionada para implementar o aumento de sub volume usando um sistema de microrraseamento. No entanto, a combinação de três modalidades de imagem (TC, Ressonância Magnética e PET) utilizando um sistema de microdiadistração mostrou-se trabalhosa, pois a imagem multimodal, o planejamento do tratamento e a entrega de doses devem ser concluídas sequencialmente no ambiente pré-clínico. Isso também resulta em um fluxo de trabalho mais propenso a erros humanos. Portanto, foi implementado um algoritmo fácil de usar para otimizar ainda mais o planejamento de tratamento de radiação multimodal pré-clínico baseado em imagens. Esta ferramenta de software foi utilizada para avaliar a precisão e eficiência da radioterapia de pintura de doses com micro-irradiação usando um projeto de estudo em silico . A nova metodologia para a radioterapia de pintura de doses é superior ao método descrito anteriormente em termos de precisão, eficiência de tempo e variabilidade intra e interusativa. É também um passo importante para a implementação do planejamento inverso do tratamento em micro-irradiadores, onde o planejamento futuro ainda é comumente utilizado, em contraste com os sistemas clínicos.
Introdução
Glioblastoma (GB) é um tumor cerebral primário maligno e muito agressivo. Gb é um tumor heterogêneo sólido tipicamente caracterizado por limites infiltrados, atypia nuclear e necrose1. A presença da barreira hemato-cerebral e do estado cerebral como um local imuno-privilegiado torna a descoberta de novos alvos para quimioterapia e imunoterapia uma tarefa assustadora2,3,4. Vale ressaltar que o tratamento de pacientes com GB mal mudou desde a introdução, em 2005, do protocolo Stupp que combina radioterapia de feixe externo (RT) com temozolomide concomitante, geralmente seguido por temozolomide adjuvante5. Normalmente, o protocolo Stupp é precedido por ressecção cirúrgica máxima. Portanto, abordagens alternativas de tratamento são de fundamental importância.
A radioterapia atual para pacientes com glioblastoma fornece uma dose uniforme de radiação ao volume do tumor definido. Na oncologia da radiação, há uma importante correlação dose-resposta para glioblastoma com dose crescente, que parece limitar cerca de 60 Gy, devido ao aumento da toxicidade ao cérebro normal6,7. No entanto, os tumores podem ser muito (radiobiologicamente) heterogêneos, com gradientes de nível de oxigênio e/ou grandes diferenças na densidade celular. Técnicas de imagem metabólica, como o PET, podem visualizar essas características biológicas e podem ser utilizadas para personalizar a prescrição de dose. Esta abordagem é conhecida como pintura de dose RT. Este termo foi introduzido por Ling et al. em 2000. Os autores definiram a pintura de dose RT como produzindo "distribuições de dose requintadamente conformais dentro das restrições de propagação e dispersão de radiação"8.
Existem dois tipos de pintura de dose RT, pintura de dose por contornos (DPBC), pelo qual uma dose é prescrita para um conjunto de sub-volumes aninhados, e pintura de dose por números (DPBN), pelo qual uma dose é prescrita no nível voxel. A distribuição de dose para DPBN RT pode ser extraída de imagens funcionais. A dose em cada voxel é determinada pela intensidade I do voxel correspondente na imagem, com um limite inferior e superior, para garantir que, por um lado, uma dose suficiente seja entregue a cada parte do tumor. Por outro lado, as doses não excedem um limite superior para proteger órgãos em risco e evitar a toxicidade. O método mais simples é uma interpolação linear (ver Eq. 1) entre a dose mínima Dmin e a dose máxima Dmax, variando proporcionalmente entre intensidade mínima Imax e intensidade máxima dentro do volume alvo9,10
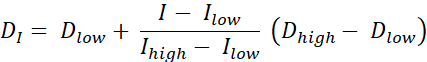 Eq. 1
Eq. 1
Como há algum ceticismo sobre a garantia de qualidade do DPBN RT, a deposição da dose deve ser verificada através de pesquisas pré-clínicas10. No entanto, apenas dados limitados podem ser adquiridos a partir de ensaios clínicos, e tem sido hipótese de que mais insights podem ser obtidos por downscaling para animais de laboratório11,12. Assim, estudos pré-clínicos utilizando plataformas de pesquisa de radiação guiadas por imagem de precisão que permitem o acoplamento com algumas técnicas muito específicas, como a autoradiografia, são adequados para examinar questões abertas e abrir caminho para a medicina personalizada e novas estratégias de tratamento, como a pintura de doses RT13,14. No entanto, a interpretação dos dados pré-clínicos deve ser realizada com cautela, e as desvantagens dessas configurações pré-clínicas devem ser consideradas14.
Sistemas de microdia irradiação, como a Small Animal Radiation Research Platform (SARRP), são equipados com tecnologias semelhantes às suas contrapartes clínicas. Eles incluem imagens ct de feixe de cone a bordo (CBCT), um sistema de planejamento de tratamento pré-clínico (PCTPS), e fornecem precisão submilímetro. Os cálculos de dose clínica são realizados pelo planejamento do tratamento inverso, pelo qual se inicia a partir da distribuição de dose desejada para determinar os feixes através de um algoritmo iterativo. Irradiadores pré-clínicos geralmente usam planejamento avançado. No planejamento futuro, a quantidade e o ângulo necessários das vigas são selecionados e, em seguida, o PCTPS calcula a distribuição da dose. A otimização dos planos é realizada por iteração manual, que é intensiva em mão-de-obra15.
Após 2009, novos desenvolvimentos tornaram possível a implementação do planejamento inverso dessas plataformas de pesquisa16,17,18. Para aumentar a semelhança com o método clínico, um colmíador retangular variável motorizado (MVC) foi desenvolvido como uma contrapartida pré-clínica do colmíador de várias folhas. Um método de pintura de dose bidimensional utilizando um colmíador variável foi publicado por Cho et al.19. Este grupo de pesquisa implementou um protocolo de planejamento de tratamento inverso tridimensional (3D) em um micro-irradiador e determinou doses mínimas e máximas para o volume alvo e uma dose máxima para os órgãos em risco. Essas técnicas têm sido avaliadas principalmente em sílico, e suas aplicações pré-clínicas precisam ser exploradas.
Este artigo apresenta um estudo em silico para comparar duas metodologias para [18F]-fluoro-ethyl-L-tyrosine ([18F]FET) pintura de dose pet em um modelo de rato GB20,21,22 usando uma pequena plataforma de pesquisa de radiação animal. Estas duas metodologias são (1) aumento de sub volume usando tamanhos de feixe predefinidos e (2) pintura de dose usando um colômulo variável motorizado onde as dimensões da mandíbula são modificadas com base na absorção do rastreador PET no volume do tumor. [18F] FET é um rastreador PET frequentemente usado em neuro-oncologia devido à sua capacidade de detectar tumores cerebrais23. [18F] FET é um aminoácido artificial que é internalizado em células tumorais, mas não incorporado em proteínas celulares. [18F] A absorção de FET corresponde à taxa de proliferação celular, densidade celular tumoral e angiogênese24. Como este é o rastreador PET cerebral oncológico mais utilizado no instituto desses autores, este radiotracer foi escolhido para avaliar o novo fluxo de trabalho.
Protocolo
O estudo foi aprovado pelo comitê de ética local para experimentos em animais (ECD 18/21). O monitoramento da anestesia é realizado através da aquisição da taxa respiratória dos animais por meio de um sensor.
1. Modelo de célula de rato F98 GB
- Cultura as células F98 GB em uma monocamada usando o Medium De Águia Modificada de Dulbecco, complementada com 10% de soro de bezerro, 1% penicilina, 1% estreptomicina e 1% L-glutamina, e colocá-las em uma incubadora de CO2 (5% CO2 e 37 °C).
- Inocular as células de glioma no cérebro de ratos Fischer F344 fêmeas (peso corporal 170 g).
NOTA: Use instrumentos estéreis e use luvas estéreis o tempo todo.- Anestesiar os ratos através da inalação de isoflurane (5% de indução, 2% de manutenção) misturado com oxigênio (0,3 mL/min) através de um cone de nariz. Confirme a anestesia pela ausência de reflexo de abstinência do membro e imobilize os ratos em um dispositivo estereotático usando pontos de fixação para o nariz e ouvidos. Aplique um gel de olho carbomer para evitar olhos secos sob anestesia. Mantenha a temperatura do corpo por uma almofada de aquecimento termoregulada e sonda retal a 37 °C.
- Raspe o rato do nível dos olhos até a parte de trás do crânio, e desinfete a pele com isobetadina. Injete xylocaine (com adrenalina 1:200000, 0,1 mL) subcutânea para anestesia local.
- Exponha o crânio através de uma incisão do couro cabeludo médio e faça um pequeno orifício com uma ferramenta de perfuração 3 mm posterior e 3 mm lateral ao bregma no hemisfério direito.
- Insira uma agulha de insulina estereticamente guiada (29 G) e injete 5 μL de suspensão celular (20.000 células F98 GB) 3 mm de profundidade usando um controlador de bomba de microsiringe. Deixe a agulha no lugar por 5 minutos, dando tempo de suspensão da célula para difundir no tecido.
- Retire a seringa lentamente e feche o buraco no crânio com cera óssea. Suturar a pele (poliamida 6, espessura 4-0) e injetar meloxicam subcutânea (1 mg/kg, 2 mg/mL). Aplique gel de xilocaine.
- Estabilize a temperatura corporal do animal após a cirurgia usando uma lâmpada vermelha. Monitore o despertar do rato até que ele recupere a consciência suficiente. Não devolva o animal à companhia de outros animais até que esteja totalmente recuperado. Abrigar todos os animais em condições ambientalmente controladas (ciclo claro/escuro de 12h, 20-24 °C e 40-70% de umidade relativa) com alimento e ad libitum de água.
- Certifique-se de monitorar os animais diariamente e manter um registro diário de estado de saúde verificando seu peso corporal, alimentação, ingestão de água e sua atividade e comportamento. Use uma dose letal de sódio pentobarbital para eutanásia dos animais (160 mg/kg) se observar um declínio de 20% do peso corporal ou quando o comportamento normal se deteriorar severamente (por exemplo, falta de preparo).
2. Confirmação do crescimento do tumor
- Avalie o crescimento do tumor 8 dias após a inoculação. Anestesiar os ratos através da inalação de isoflurane (5% de indução, 2% de manutenção) misturado com oxigênio (0,3 mL/min) através de um cone de nariz. Confirme a anestesia pela ausência de reflexo de abstinência do membro.
- Injete um agente de contraste contendo gadolínio (0,4 mL/kg) através de um tubo colocado por via intravenosa na veia traseira lateral. Cubra o animal com um cobertor de aquecimento que circula água morna e coloque-os na cama de ressonância magnética. Aplique um gel de olho carbomer para evitar olhos secos sob anestesia. Coloque a cama de ressonância magnética no suporte com uma bobina de volume cerebral Tx/Rx Rat.
- Realize uma varredura de localização seguida de uma varredura de spin-echo ponderada t2 para avaliar o crescimento do tumor. Use estas configurações de sequência T2-MRI: tempo de repetição (TR)/tempo de eco (TE) 3661/37.1 ms, resolução isotrópico de 109 μm no plano, espessura da fatia 600 μm, 4 médias, 30 fatias, tempo total de aquisição (TA) 9 min 45 s.
- Se um tumor for confirmado na aquisição ponderada por T2, realize uma varredura de eco de spin com peso T1. Use estas configurações de sequência T1-MRI: TR/TE 1539/9,7 ms, resolução isotrópica de 0,117 mm no plano, espessura de fatia 600 μm, 3 médias, 30 fatias, TA 4 min 15 s.
- Após a ressonância magnética, supervisione continuamente o animal até que ele recupere a consciência plena.
- Quando o tumor atingir um diâmetro de 7 a 8 mm, geralmente observado 12 dias após a inoculação, selecione o animal para terapia.
3. Imagem multimodalidade da seleção de volume de destino
NOTA: A irradiação guiada por PET/MRI requer a aquisição sequencial de um conjunto de dados multimodal. Após a administração intravenosa do radiotracer, a imagem PET é iniciada, seguida de ressonância magnética ponderada t1 com contraste e, finalmente, uma tomografia de planejamento de tratamento.
- Anestesiar o animal com isoflurane (5% de indução, 2% de manutenção) misturado com oxigênio (0,3 L/min) usando um cone de nariz. Confirme a anestesia quando os ratos não apresentarem qualquer reflexo de abstinência do membro. Aplique gel ocular carbomer para evitar olhos secos sob anestesia.
- Insira o tubo por via intravenosa na veia traseira lateral, permitindo a injeção de 10-12 MBq de rastreador radioativo PET dissolvido em 200 μL de soro fisiológico. Injete [18F]-FET, 1h antes da aquisição do PET. Deixe o animal recuperar a consciência enquanto o rastreador é distribuído pelo corpo.
- Anestesiar o animal novamente, como descrito na etapa 3.1. Coloque o animal em uma cama multimodalidade (aqui, feito internamente) e fixe-o usando fixadores de gancho e laço, mantendo uma posição fixa durante a imagem e micro-irradiação. Fixar um capilar preenchido com o agente de ressonância magnética/PET (ver a Tabela de Materiais) para facilitar o co-registro. Enrole o animal em plástico bolha para preservar sua temperatura corporal durante a imagem e terapia multimodalidade.
- Realize uma tomografia 1h após a injeção do rastreador PET. Reconstrua a varredura PET em um volume 3D (matriz 192 x 192 x 384) com tamanho de voxel de 0,4 mm aplicando um algoritmo de maximização de expectativa de probabilidade máxima (MLEM)-algoritmo usando 30 iterações.
NOTA: Um scanner PET dedicado para imagens de animais de laboratório foi utilizado com um campo de visão axial de 130 mm e um diâmetro de furo de 72 mm. Este sistema fornece resolução espacial submm (0,85 mm). - Injete um agente de contraste de ressonância magnética (0,4 mL/kg) por via intravenosa na veia da cauda. Coloque o rato, ainda fixado no leito multimodalidade, no porta-animais do scanner de ressonância magnética (Tabela de Materiais). Execute uma varredura de localizador seguida de uma sequência de spin-echo ponderada t1 com contraste, análoga ao passo 2.4.
- Coloque o animal, ainda fixado no leito multimodalidade, em um suporte plástico preso na mesa de posicionamento robótico de quatro eixos sobre o micro-irradiador. Realize uma ct de cone-feixe de alta resolução de planejamento de tratamento usando uma tensão de tubo de 70 kV, uma corrente de tubo de 0,4 mA, um filtro de alumínio de 1 mm e um detector de painel liso Si de 20 x 20 cm (1024 x 1024 pixels). Adquira um total de 360 projeções acima de 360°. Reconstrua as imagens CT com um voxel isotrópica de 0,275 mm (matriz 411 x 411 x 251).
4. Co-registro de imagem
NOTA: O co-registro é realizado com um código MATLAB semiautomá-automático desenvolvido internamente. O código pode ser encontrado no Github em https://github.com/sdonche/DosePainting. Os diferentes passos são descritos abaixo.
- Coloque as três modalidades de imagem ([18F]FET PET, ressonância magnética ponderada por T1 com contraste e CT de feixe de cone) em uma pasta. Converta as imagens DICOM para o formato NIfTI usando a função dcm2niix do visualizador de imagem mricron24.
- Importe as imagens convertidas em MATLAB e filtre a imagem PET com um filtro gaussiano usando um Half-Max de largura total (FWHM) de 1 mm.
- Reoriente as imagens para que os eixos cartesianos de todas as modalidades de imagem correspondam entre si.
NOTA: Para esta configuração, a imagem ct foi virada em torno do eixo Y; a ressonância magnética foi virada em torno do eixo X, e o PET foi virado em torno do eixo Y. - Corte a imagem PET para simplificar o co-registro automático.
NOTA: Para esta configuração, 40 pixels foram definidos a zero de ambos os lados do eixo X (esquerda e direita do animal); no lado dorsal e ventral do animal (eixo Y), 60 e 40 pixels foram definidos como zero, respectivamente; ao longo do eixo longitudinal (ou eixo Z), 170 e 30 pixels são definidos como zero para lado inferior e superior, respectivamente. - Mova os centros de imagem próximos uns dos outros para simplificar o co-registro automático.
- Realize o co-registro real do corpo rígido utilizando o Mapeamento Paramétrico Estatístico (SPM) no MATLAB26. Utilizar os seguintes parâmetros de registro (outros por padrão): função objetiva: informações mútuas; separação: [4 1 0.2]; tolerâncias: [0.02 0.02 0.02 0.001 0.001 0.001 0.01 0.01 0.001 0.001 0.001 0.001]; histograma de suavização: [11]; interpolação: trilinear.
5. Planejamento do tratamento de radiação
NOTA: Um aplicativo MATLAB e vários scripts MATLAB foram escritos para o planejamento do tratamento de radiação. O código pode ser encontrado no Github em https://github.com/sdonche/DosePainting. Os diferentes passos são explicados abaixo.
- Método 1
- Carregue as três diferentes modalidades de imagem no aplicativo MATLAB. Coloque uma caixa delimitada generosa ao redor do aprimoramento de contraste na ressonância magnética ponderada t1 (Figura 1). Determine o volume aprimorado de contraste usando um limiar (Figura 2). Se várias regiões tiverem sido selecionadas, selecione apenas o maior volume, sendo que o centro é considerado o primeiro isocentro a fornecer uma dose prescrita para TR (Figura 3).
- Expanda o aprimoramento de contraste de ressonância magnética previamente determinado em 10 pixels em cada direção. Se forem detectadas várias regiões, retenha apenas o maior volume PET, sendo considerado o segundo isocentro a fornecer uma dose prescrita para TR.
NOTA: Neste volume PET, o volume de impulso PET é definido pelos pixels com maior intensidade de sinal do que 0,90 × intensidade máxima de sinal (na caixa delimitadora) neste volume. - Utilize as seguintes configurações de irradiação para os isocentros calculados (Figura 4 e Tabela 1).
- Para o primeiro isocentro (RM), dê uma dose prescrita de 2000 cGy utilizando 3 arcos não coplanares nas posições do sofá 0°, -45°, e -90° com uma rotação de pórtico de 120°, 120°e 60°, respectivamente. Use um collimador fixo de 10 x 10 mm, mas use um collimador apropriado (por exemplo, um collimador de 5 x 5 mm) quando tamanhos menores de tumores precisam ser irradiados. Tenha cuidado ao considerar o bem-estar do animal quando os volumes do tumor forem maiores que 10 mm.
- Para o segundo isocentro (PET), dê uma dose prescrita de 800 cGy utilizando 3 arcos não coplanares nas posições do sofá 0°, -45°, e -90° com uma rotação de pórtico de 120°, 120°e 60°, respectivamente. Use um tamanho de collimador fixo de 3 x 3 mm.
- Calcule a distribuição da dose dentro do animal e dos parâmetros de entrega do feixe.
- Método 2
- Carregue as três diferentes modalidades de imagem no aplicativo MATLAB. Coloque uma caixa delimitamento generosa em torno do aprimoramento de contraste na imagem PET [18F], análoga ao passo 5.1.1.
- Determine os volumes definidos pelos pixels com intensidade de sinal superior a A × intensidade máxima de sinal (na caixa delimitamento acima mencionada), com A igual a 0,50, 0,60, 0,70, 0,80 e 0,90. Nomeie esses volumes V50, V60, V70, V80 e V90, respectivamente.
- Determine os isocentros e as dimensões da mandíbula para cada feixe necessário para guiar o colisimador variável motorizado usando o script MATLAB (ver Figura 5).
- Use as seguintes configurações para os isocentros calculados e dimensões da mandíbula:
- Para V50, dê uma dose prescrita de 2000 cGy distribuída em 16 vigas (cada 125 cGy; sofá e posições de pórtico na Tabela 2). Use as dimensões calculadas da mandíbula para o MVC.
NOTA: Aqui, uma margem adicional de 1 mm foi incluída para explicar a infiltração de tumores microscópicos. - Para V60-V90, dê uma dose prescrita de 800 cGy distribuída em 40 vigas (cada 20 cGy; sofá e posições de pórtico na Tabela 2). Use as dimensões calculadas da mandíbula para o MVC.
- Para V50, dê uma dose prescrita de 2000 cGy distribuída em 16 vigas (cada 125 cGy; sofá e posições de pórtico na Tabela 2). Use as dimensões calculadas da mandíbula para o MVC.
- Calcule a distribuição da dose dentro do animal e dos parâmetros de entrega do feixe.
6. Avaliação do plano
NOTA: Para comparar os dois métodos, calcule os histogramas de volume de dose (DVH) e o histograma de volume Q (QVH) no volume PET V50. Aqui, um roteiro MATLAB, desenvolvido internamente, foi usado. O código pode ser encontrado no Github em https://github.com/sdonche/DosePainting.
- Histograma de volume de dose
- Gerar DVH a partir da distribuição de dose que foi obtida a partir do SARRP.
- Determine as doses máximas, médias e mínimas do DVH calculando as D10, D50 e D90, onde Dx representa a dose recebida por x% do volume.
- Histograma de volume Q
- Calcule uma dose ideal para cada pixel usando Eq. 1, que é uma interpolação linear entre as doses mínimas e máximas, variando proporcionalmente entre a intensidade mínima pet e intensidade máxima pet dentro do volume alvo para dar um mapa de dose ideal.
- Calcule o Qp de valor Q para cada pixel usando a seguinte equação (Eq. 2):
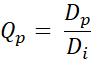 Eq. 2
Eq. 2
Sendo dp a dose obtida pelo planejamento e Di, a dose objetiva para o planejamento. - Gerar QVH a partir dos valores Q obtidos.
- Calcule o fator de qualidade (fator Q, QF) para avaliar a diferença entre as doses planejadas e pretendidas utilizando Eq. 3:
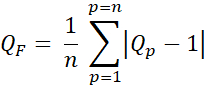 Eq. 3
Eq. 3
Resultados
A viabilidade da irradiação guiada por PET e ressonância magnética em um modelo de rato glioblastoma utilizando o SARRP para imitar a estratégia de tratamento humano foi descrita anteriormente20,21,22. Enquanto o animal foi fixado em um leito de multimodalidade feito internamente, foi possível criar um plano de tratamento de radiação aceitável combinando três modalidades de imagem: PET, Ressonância Magnética e TC. Ne...
Discussão
Um modelo gb de rato para imitar o tratamento de quimioterapia-radiação na clínica para pacientes com glioblastoma foi descrito anteriormente20. Semelhante ao método clínico, a TC e a ressonância magnética foram combinadas durante o processo de planejamento do tratamento para obter irradiação mais precisa. Uma cama multimodalidade para minimizar o movimento (cabeça) foi usada quando o animal foi movido de um sistema de imagem para outro. Posteriormente, a imagem PET foi adicionada ao pro...
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Os autores gostariam de agradecer à Fundação Lux Luka por apoiar este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referências
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados