È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Radioterapia con pittura a dose basata sulla tomografia a emissione di positroni in un modello di ratto glioblastoma utilizzando la piattaforma di ricerca sulle radiazioni dei piccoli animali
In questo articolo
Riepilogo
Qui presentiamo un protocollo per eseguire la radioterapia preclinica basata sulla tomografia ad emissione di positroni in un modello di glioblastoma di ratto utilizzando algoritmi sviluppati internamente per ottimizzare l'accuratezza e l'efficienza.
Abstract
In precedenza è stato stabilito un modello di glioblastoma di ratto per imitare il trattamento con radiazioni chemio del glioblastoma umano nella clinica. Analogamente al trattamento clinico, la tomografia computerizzata (TC) e la risonanza magnetica (MRI) sono state combinate durante il processo di pianificazione del trattamento. L'imaging della tomografia ad emissione di positroni (PET) è stato successivamente aggiunto per implementare l'aumento del sottovolume utilizzando un sistema di microirraggiamento. Tuttavia, la combinazione di tre modalità di imaging (TC, RISONANZA MAGNETICA e PET) utilizzando un sistema di microirraggiamento si è rivelata laboriosa perché l'imaging multimodale, la pianificazione del trattamento e la somministrazione della dose devono essere completati sequenzialmente in ambito preclinico. Ciò si traduce anche in un flusso di lavoro più soggetto a errori umani. Pertanto, è stato implementato un algoritmo di facile utilizzo per ottimizzare ulteriormente la pianificazione del trattamento con radiazioni preclinico multimodale basato sull'imaging. Questo strumento software è stato utilizzato per valutare l'accuratezza e l'efficienza della radioterapia con verniciatura a dose con micro-irradiazione utilizzando un progetto di studio in silico . La nuova metodologia per la radioterapia con verniciatura a dose è superiore al metodo precedentemente descritto in termini di accuratezza, efficienza temporale e variabilità intra e interutente. È anche un passo importante verso l'implementazione della pianificazione del trattamento inverso sui microirraggiatori, dove la pianificazione anticipata è ancora comunemente utilizzata, in contrasto con i sistemi clinici.
Introduzione
Il glioblastoma (GB) è un tumore cerebrale primario maligno e molto aggressivo. GB è un tumore eterogeneo solido tipicamente caratterizzato da confini infiltrativi, atipia nucleare e necrosi1. La presenza della barriera emato-encefalica e lo status del cervello come sito immuno-privilegiato rende la scoperta di nuovi bersagli per la chemio- e l'immunoterapia un compito scoraggiante2,3,4. È interessante notare che il trattamento dei pazienti con GB è cambiato a malapena dall'introduzione, nel 2005, del protocollo Stupp che combina la radioterapia a fascio esterno (RT) con temozolomide concomitante, di solito seguita da temozolomide adiuvante5. Tipicamente, il protocollo Stupp è preceduto dalla massima resezione chirurgica. Pertanto, gli approcci terapeutici alternativi sono di fondamentale importanza.
L'attuale radioterapia per i pazienti con glioblastoma fornisce una dose di radiazioni uniforme al volume tumorale definito. In radioterapia oncologica, esiste un'importante correlazione dose-risposta per il glioblastoma con dose crescente, che sembra limitarsi a circa 60 Gy, a causa dell'aumentata tossicità per il cervello normale6,7. Tuttavia, i tumori possono essere molto (radiobiologicamente) eterogenei, con gradienti di livello di ossigeno e / o grandi differenze nella densità cellulare. Le tecniche di imaging metabolico, come la PET, possono visualizzare queste caratteristiche biologiche e possono essere utilizzate per personalizzare la prescrizione della dose. Questo approccio è noto come dose painting RT. Questo termine è stato introdotto da Ling et al. nel 2000. Gli autori hanno definito la pittura di dose RT come la produzione di "distribuzioni di dose squisitamente conformi entro i vincoli della propagazione e della dispersione delle radiazioni"8.
Esistono due tipi di pittura a dose RT, la pittura a dose per contorni (DPBC), con la quale viene prescritta una dose a una serie di sottovolumi nidificati, e la pittura a dose per numeri (DPBN), per cui viene prescritta una dose a livello di voxel. La distribuzione della dose per DPBN RT può essere estratta da immagini funzionali. La dose in ogni voxel è determinata dall'intensità I del voxel corrispondente nell'immagine, con un limite inferiore e superiore, per assicurarsi che, da un lato, venga erogata una dose sufficiente ad ogni parte del tumore. D'altra parte, le dosi non superano un limite superiore per proteggere gli organi a rischio ed evitare la tossicità. Il metodo più semplice è un'interpolazione lineare (vedi Eq. 1) tra la dose minima Dmin e la dose massima Dmax, che varia proporzionalmente tra intensità minima Imax e intensità massima all'interno del volume target9,10
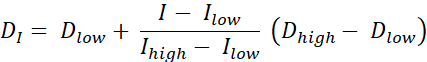 Eq. 1
Eq. 1
Poiché vi è un certo scetticismo sulla garanzia della qualità di DPBN RT, la deposizione della dose deve essere verificata attraverso la ricerca preclinica e clinica10. Tuttavia, solo dati limitati possono essere acquisiti da studi clinici, ed è stato ipotizzato che si possano ottenere maggiori informazioni mediante il downscaling agli animali da laboratorio11,12. Quindi, gli studi preclinici che utilizzano piattaforme di ricerca sulle radiazioni guidate da immagini di precisione che consentono l'accoppiamento con alcune tecniche molto specifiche, come l'autoradiografia, sono adatti per esaminare questioni aperte e aprire la strada verso la medicina personalizzata e nuove strategie di trattamento, come la pittura della dose RT13,14. Tuttavia, l'interpretazione dei dati preclinici deve essere eseguita con cautela e devono essere considerati gli svantaggi di queste configurazioni precliniche14.
I sistemi di microirraggiamento, come la Small Animal Radiation Research Platform (SARRP), sono dotati di tecnologie simili a quelle della loro controparte clinica. Includono l'imaging CBCT (Cone-beam CT) a bordo, un sistema di pianificazione del trattamento preclinico (PCTPS) e forniscono una precisione sub-millimetrica. I calcoli della dose clinica vengono eseguiti mediante pianificazione inversa del trattamento, in cui si inizia dalla distribuzione della dose desiderata per determinare i fasci tramite un algoritmo iterativo. Gli irradiatori preclinici utilizzano spesso la pianificazione anticipata. Nella pianificazione futura, vengono selezionati la quantità e l'angolo richiesti delle travi e il PCTPS calcola quindi la distribuzione della dose. L'ottimizzazione dei piani viene eseguita mediante iterazione manuale, che richiede molta manodopera15.
Dopo il 2009, nuovi sviluppi hanno reso possibile l'implementazione della pianificazione inversa su queste piattaforme di ricerca16,17,18. Per aumentare la somiglianza con il metodo clinico, è stato sviluppato un collimatore rettangolare variabile motorizzato (MVC) come controparte preclinica del collimatore multi-foglia. Un metodo di pittura a dose bidimensionale che utilizza un collimatore variabile è stato pubblicato da Cho et al.19. Questo gruppo di ricerca ha implementato un protocollo tridimensionale (3D) di pianificazione del trattamento inverso su un microirraggiatore e ha determinato dosi minime e massime per il volume target e una dose massima per gli organi a rischio. Queste tecniche sono state valutate principalmente in silico e le loro applicazioni precliniche devono essere esplorate.
Questo documento presenta uno studio in silico per confrontare due metodologie per la verniciatura a base di PET [18F]-fluoro-etil-L-tirosina ([18F]FET) in un modello di ratto GB20,21,22 utilizzando una piattaforma di ricerca sulle radiazioni di piccoli animali. Queste due metodologie sono (1) l'aumento del sottovolume utilizzando dimensioni del fascio predefinite e (2) la verniciatura della dose utilizzando un collimatore variabile motorizzato in cui le dimensioni della mascella vengono modificate in base all'assorbimento del tracciante PET nel volume tumorale. [18F] FET è un tracciante PET spesso utilizzato in neuro-oncologia a causa della sua capacità di rilevare tumori cerebrali23. [18F] FET è un amminoacido artificiale che viene internalizzato nelle cellule tumorali ma non incorporato nelle proteine cellulari. [18F] L'assorbimento del FET corrisponde al tasso di proliferazione cellulare, alla densità delle cellule tumorali e all'angiogenesi24. Poiché questo è il tracciante PET cerebrale oncologico più comunemente usato nell'istituto di questi autori, questo radiotracciante è stato scelto per valutare il nuovo flusso di lavoro.
Protocollo
Lo studio è stato approvato dal comitato etico locale per gli esperimenti sugli animali (ECD 18/21). Il monitoraggio dell'anestesia viene eseguito acquisendo la frequenza respiratoria degli animali utilizzando un sensore.
1. Modello di cella di ratto F98 GB
- Coltivare le cellule F98 GB in un monostrato utilizzando il Modified Eagle Medium di Dulbecco, integrato con il 10% di siero di vitello, l'1% di penicillina, l'1% di streptomicina e l'1% di L-glutammina, e metterle in un incubatore a CO2 (5% CO2 e 37 °C).
- Inoculare le cellule del glioma nel cervello di ratti Fischer F344 femmina (peso corporeo 170 g).
NOTA: Utilizzare strumenti sterili e indossare guanti sterili in ogni momento.- Anestetizzare i ratti attraverso l'inalazione di isoflurano (5% di induzione, 2% di mantenimento) miscelato con ossigeno (0,3 ml/min) attraverso un cono nasale. Confermare l'anestesia dall'assenza di riflesso di astinenza dell'arto e immobilizzare i ratti in un dispositivo stereotassico utilizzando punti di fissazione per il naso e le orecchie. Applicare un gel per gli occhi carbomer per prevenire la secchezza oculare in anestesia. Mantenere la temperatura corporea con una piastra riscaldante termoregolata e una sonda rettale a 37 °C.
- Rasare il ratto dall'altezza degli occhi alla parte posteriore del cranio e disinfettare la pelle con isobetadina. Iniettare xilocaina (con adrenalina 1:200000, 0,1 ml) per via sottocutanea per anestesia locale.
- Esporre il cranio attraverso un'incisione del cuoio capelluto della linea mediana e fare un piccolo foro con uno strumento di perforazione di 3 mm posteriore e 3 mm laterale al bregma nell'emisfero destro.
- Inserire un ago da insulina a guida stereotassica (29 G) e iniettare 5 μL di sospensione cellulare (20.000 cellule F98 GB) a 3 mm di profondità utilizzando un controller della pompa a microsiringa. Lasciare l'ago in posizione per 5 minuti, dando alla sospensione cellulare il tempo di diffondersi nel tessuto.
- Prelevare lentamente la siringa e chiudere il foro nel cranio con cera ossea. Suturare la pelle (poliammide 6, spessore 4-0) e iniettare meloxicam per via sottocutanea (1 mg/kg, 2 mg/ml). Applicare il gel di xilocaina.
- Stabilizzare la temperatura corporea dell'animale post-operatorio usando una lampada rossa. Monitorare il risveglio del ratto fino a quando non ha riacquistato sufficiente coscienza. Non restituire l'animale alla compagnia di altri animali fino a quando non viene completamente recuperato. Ospitare tutti gli animali in condizioni controllate dall'ambiente (12 ore di ciclo luce/buio, 20-24 °C e 40-70% di umidità relativa) con cibo e acqua ad libitum.
- Assicurati di monitorare quotidianamente gli animali e di mantenere un registro giornaliero dello stato di salute controllando il loro peso corporeo, il cibo, l'assunzione di acqua e la loro attività e comportamento. Utilizzare una dose letale di pentobarbital sodico per eutanasizzare gli animali (160 mg/kg) se si osserva un calo del 20% del peso corporeo o quando il comportamento normale si deteriora gravemente (ad esempio, mancanza di toelettatura).
2. Conferma della crescita tumorale
- Valutare la crescita del tumore 8 giorni dopo l'inoculazione. Anestetizzare i ratti attraverso l'inalazione di isoflurano (5% di induzione, 2% di mantenimento) miscelato con ossigeno (0,3 ml/min) attraverso un cono nasale. Confermare l'anestesia dall'assenza di riflesso di astinenza dell'arto.
- Iniettare un mezzo di contrasto contenente gadolinio (0,4 ml/kg) attraverso un tubo posizionato per via endovenosa nella vena laterale della coda. Coprire l'animale con una coperta riscaldante circolante ad acqua calda e metterli nel letto MRI. Applicare un gel per gli occhi carbomer per prevenire la secchezza oculare in anestesia. Posizionare il letto MRI nel supporto con una bobina di volume cerebrale Tx/Rx Rat.
- Eseguire una scansione del localizzatore seguita da una scansione spin-echo ponderata T2 per valutare la crescita del tumore. Utilizzare queste impostazioni della sequenza T2-MRI: tempo di ripetizione (TR)/tempo di eco (TE) 3661/37,1 ms, risoluzione isotropa nel piano 109 μm, spessore della fetta 600 μm, 4 medie, 30 fette, tempo totale di acquisizione (TA) 9 min 45 s.
- Se un tumore è confermato sull'acquisizione ponderata T2, eseguire una scansione eco di spin potenziata con contrasto ponderato T1. Utilizzare queste impostazioni della sequenza T1-MRI: TR/TE 1539/9,7 ms, risoluzione isotropa nel piano di 0,117 mm, spessore della fetta 600 μm, 3 medie, 30 fette, TA 4 min 15 s.
- Dopo la risonanza magnetica, supervisionare continuamente l'animale fino a quando non riacquista piena consapevolezza.
- Quando il tumore raggiunge un diametro da 7 a 8 mm, di solito osservato 12 giorni dopo l'inoculazione, selezionare l'animale per la terapia.
3. Imaging multimodale della selezione del volume target
NOTA: l'irradiazione guidata da PET/MRI richiede l'acquisizione sequenziale di un set di dati multimodale. Dopo la somministrazione endovenosa del radiotracciante, viene avviata l'imaging PET, seguito da una risonanza magnetica ponderata T1 potenziata con contrasto e infine da una TC di pianificazione del trattamento.
- Anestetizzare l'animale con isoflurano (5% induzione, 2% mantenimento) miscelato con ossigeno (0,3 L/min) utilizzando un cono nasale. Confermare l'anestesia quando i ratti non mostrano alcun riflesso di astinenza dell'arto. Applicare carbomer eye gel per prevenire la secchezza oculare in anestesia.
- Inserire il tubo per via endovenosa nella vena laterale della coda, consentendo l'iniezione di 10-12 MBq di tracciante radioattivo PET disciolto in 200 μL di soluzione salina. Iniettare [18F]-FET, 1 ora prima dell'acquisizione del PET. Lascia che l'animale riprenda conoscenza mentre il tracciante è distribuito attraverso il corpo.
- Anestetizzare nuovamente l'animale, come descritto nel passaggio 3.1. Posizionare l'animale su un letto multimodale (qui, realizzato internamente) e fissarlo utilizzando elementi di fissaggio hook-and-loop, mantenendo una posizione fissa durante l'imaging e la micro-irradiazione. Fissare un capillare riempito con l'agente MRI/PET (vedere la Tabella dei materiali) per una più facile co-registrazione. Avvolgere l'animale in pluriball per preservare la sua temperatura corporea durante l'imaging e la terapia multimodale.
- Eseguire una scansione PET 1 ora dopo l'iniezione del tracciante PET. Ricostruisci la scansione PET in un volume 3D (matrice 192 x 192 x 384) con una dimensione voxel di 0,4 mm applicando un algoritmo MLEM (Maximum-Likelihood Expectation-Maximization) utilizzando 30 iterazioni.
NOTA: è stato utilizzato uno scanner PET dedicato per l'imaging di animali da laboratorio con un campo visivo assiale di 130 mm e un diametro del foro di 72 mm. Questo sistema fornisce una risoluzione spaziale inferiore a mm (0,85 mm). - Iniettare un mezzo di contrasto MRI (0,4 ml/kg) per via endovenosa nella vena della coda. Posizionare il ratto, ancora fissato sul letto multimodale, nel supporto animale dello scanner MRI (Table of Materials). Eseguire una scansione del localizzatore seguita da una sequenza spin-echo ponderata T1 con contrasto, analoga al passaggio 2.4.
- Posizionare l'animale, ancora fissato sul letto multimodale, su un supporto di plastica fissato sul tavolo di posizionamento robotico a quattro assi sul microirraggiatore. Eseguire una TC a fascio cono ad alta risoluzione per la pianificazione del trattamento utilizzando una tensione del tubo di 70 kV, una corrente del tubo di 0,4 mA, un filtro in alluminio da 1 mm e un rilevatore a schermo piatto Si amorfo da 20 x 20 cm (1024 x 1024 pixel). Acquisisci un totale di 360 proiezioni su 360°. Ricostruire le immagini TC con una dimensione voxel isotropa di 0,275 mm (matrice 411 x 411 x 251).
4. Co-registrazione dell'immagine
NOTA: La co-registrazione viene eseguita con un codice MATLAB semiautomatico sviluppato internamente. Il codice può essere trovato su Github all'https://github.com/sdonche/DosePainting. I diversi passaggi sono descritti di seguito.
- Posizionare le tre modalità di immagine ([18F]FET PET, risonanza magnetica ponderata T1 con contrasto e TC a fascio conico) in un'unica cartella. Convertire le immagini DICOM nel formato NIfTI utilizzando la funzione dcm2niix dal visualizzatore di immagini mricron24.
- Importa le immagini convertite in MATLAB e filtra l'immagine PET con un filtro gaussiano utilizzando un Full-Width Half-Max (FWHM) di 1 mm.
- Riorientare le immagini in modo che gli assi cartesiani di tutte le modalità di imaging corrispondano tra loro.
NOTA: per questa configurazione, l'immagine CT è stata capovolta attorno all'asse Y; la risonanza magnetica è stata capovolta attorno all'asse X e il PET è stato capovolto attorno all'asse Y. - Ritaglia l'immagine PET per semplificare la co-registrazione automatica.
NOTA: per questa configurazione, 40 pixel sono stati impostati a zero da entrambi i lati dell'asse X (sinistra e destra dell'animale); sul lato dorsale e ventrale dell'animale (asse Y), 60 e 40 pixel sono stati impostati rispettivamente a zero; lungo l'asse longitudinale (o asse Z), 170 e 30 pixel sono impostati a zero rispettivamente per il lato inferiore e superiore. - Sposta i centri immagine vicini l'uno all'altro per semplificare la co-registrazione automatica.
- Esegui l'effettiva co-registrazione del corpo rigido utilizzando la mappatura parametrica statistica (SPM) in MATLAB26. Utilizzare i seguenti parametri di registrazione (altri di default): funzione obiettivo: informazioni reciproche; separazione: [4 1 0.2]; tolleranze: [0,02 0,02 0,02 0,001 0,001 0,001 0,01 0,01 0,01 0,001 0,001 0,001]; levigatura dell'istogramma: [1 1]; interpolazione: trilineare.
5. Pianificazione del trattamento con radiazioni
NOTA: un'app MATLAB e più script MATLAB sono stati scritti per la pianificazione del trattamento con radiazioni. Il codice può essere trovato su Github all'https://github.com/sdonche/DosePainting. I diversi passaggi sono spiegati di seguito.
- Metodo 1
- Carica le tre diverse modalità di imaging nell'app MATLAB. Posizionare un generoso riquadro di delimitazione attorno al miglioramento del contrasto sulla scansione MRI ponderata T1 (Figura 1). Determinare il volume con contrasto migliorato utilizzando una soglia (Figura 2). Se sono state selezionate più regioni, selezionare solo il volume più grande, il cui centro è considerato come il primo isocentro a fornire una dose prescritta per RT (Figura 3).
- Espandere il miglioramento del contrasto MRI determinato in precedenza di 10 pixel in ciascuna direzione. Se vengono rilevate più regioni, conservare solo il volume pet più grande, il cui centro è considerato il secondo isocentro a fornire una dose prescritta per RT.
NOTA: in questo volume PET, il volume di boost PET è definito dai pixel con un'intensità del segnale superiore a 0,90 × intensità massima del segnale (nel riquadro di delimitazione) in questo volume. - Utilizzare le seguenti impostazioni di irradiazione per gli isocentri calcolati (Figura 4 e Tabella 1).
- Per il primo isocentro (MRI), somministrare una dose prescritta di 2000 cGy utilizzando 3 archi non complanari nelle posizioni del divano 0°, -45° e -90° con una rotazione del portale di 120°, 120° e 60°, rispettivamente. Utilizzare una dimensione del collimatore fissa di 10 x 10 mm, ma utilizzare un collimatore appropriato (ad esempio, un collimatore di 5 x 5 mm) quando è necessario irradiare tumori di dimensioni inferiori. Fare attenzione nel considerare il benessere dell'animale quando i volumi tumorali sono più grandi di 10 mm.
- Per il secondo isocentro (PET), somministrare una dose prescritta di 800 cGy utilizzando 3 archi non complanari in posizioni di divano 0°, -45° e -90° con una rotazione del portale di 120°, 120° e 60°, rispettivamente. Utilizzare una dimensione del collimatore fisso di 3 x 3 mm.
- Calcolare la distribuzione della dose all'interno dell'animale e i parametri di consegna del fascio.
- Metodo 2
- Carica le tre diverse modalità di imaging nell'app MATLAB. Posizionare un generoso riquadro di delimitazione attorno al miglioramento del contrasto sull'immagine PET [18F]FET, analogamente al passaggio 5.1.1.
- Determinare i volumi definiti dai pixel con un'intensità del segnale superiore a A × intensità massima del segnale (nel riquadro di delimitazione di cui sopra), con A uguale a 0,50, 0,60, 0,70, 0,80 e 0,90. Denominare questi volumi rispettivamente V50, V60, V70, V80 e V90.
- Determinare gli isocentri e le dimensioni della mascella per ciascun fascio necessario per guidare il collimatore variabile motorizzato utilizzando lo script MATLAB (vedere la Figura 5).
- Utilizzare le seguenti impostazioni per gli isocentri calcolati e le dimensioni della mascella:
- Per V50, somministrare una dose prescritta di 2000 cGy distribuita su 16 travi (ciascuna 125 cGy; posizioni divano e portale nella Tabella 2). Utilizzare le dimensioni della mascella calcolate per l'MVC.
NOTA: Qui, è stato incluso un margine aggiuntivo di 1 mm per tenere conto dell'infiltrazione microscopica del tumore. - Per V60-V90, somministrare una dose prescritta di 800 cGy distribuiti su 40 travi (ciascuna 20 cGy; posizioni divano e portale nella Tabella 2). Utilizzare le dimensioni della mascella calcolate per l'MVC.
- Per V50, somministrare una dose prescritta di 2000 cGy distribuita su 16 travi (ciascuna 125 cGy; posizioni divano e portale nella Tabella 2). Utilizzare le dimensioni della mascella calcolate per l'MVC.
- Calcolare la distribuzione della dose all'interno dell'animale e i parametri di consegna del fascio.
6. Valutazione del piano
NOTA: per confrontare i due metodi, calcolare gli istogrammi dose-volume (DVH) e l'istogramma Q-volume (QVH) nel volume PET V50. Qui è stato utilizzato uno script MATLAB, sviluppato internamente. Il codice può essere trovato su Github all'https://github.com/sdonche/DosePainting.
- Istogramma dose-volume
- Generare DVH dalla distribuzione della dose ottenuta dal SARRP.
- Determinare le dosi massime, medie e minime dal DVH calcolando D10, D50 e D90, dove Dx sta per la dose ricevuta dall'x% del volume.
- Istogramma del volume Q
- Calcola una dose ideale per ogni pixel usando Eq. 1, che è un'interpolazione lineare tra le dosi minime e massime, che varia proporzionalmente tra l'intensità minima pet e l'intensità PET massima all'interno del volume target per fornire una mappa della dose ideale.
- Calcola il valore Q Qp per ogni pixel usando la seguente equazione (Eq. 2):
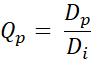 Eq. 2
Eq. 2
Con Dp che è la dose ottenuta dalla pianificazione e Di, l'obiettivo della dose per la pianificazione. - Generare QVH dai valori Q ottenuti.
- Calcolare il fattore di qualità (fattore Q, QF) per valutare la differenza tra le dosi pianificate e previste utilizzando Eq. 3:
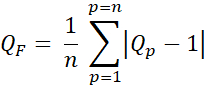 Eq. 3
Eq. 3
Risultati
La fattibilità dell'irradiazione guidata da PET e RISONANZA MAGNETICA in un modello di ratto glioblastoma che utilizza il SARRP per imitare la strategia di trattamento umano è stata precedentemente descritta20,21,22. Mentre l'animale è stato fissato su un letto multimodale realizzato internamente, è stato possibile creare un piano di trattamento con radiazioni accettabile combinando tre modalità di imaging: PET, RISONANZA M...
Discussione
Un modello gb di ratto per imitare il trattamento chemioterapico-radioterapico nella clinica per i pazienti con glioblastoma è stato precedentemente descritto20. Analogamente al metodo clinico, la TC e la risonanza magnetica sono state combinate durante il processo di pianificazione del trattamento per ottenere un'irradiazione più precisa. Un letto multimodale per ridurre al minimo il movimento (della testa) è stato utilizzato quando l'animale è stato spostato da un sistema di imaging a un alt...
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Gli autori desiderano ringraziare la Lux Luka Foundation per aver sostenuto questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Riferimenti
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon