A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פוזיטרונים פליטת טומוגרפיה מבוסס מינון ציור הקרנות טיפול במודל חולדת Glioblastoma באמצעות פלטפורמת מחקר קרינה בבעלי חיים קטנים
In This Article
Summary
כאן אנו מציגים פרוטוקול לביצוע טומוגרפיה מבוססת טומוגרפיה של פליטת פוזיטרונים פרה-קלינית במודל גליובלסטומה עכברוש באמצעות אלגוריתמים שפותחו בתוך הבית כדי לייעל את הדיוק והיעילות.
Abstract
מודל גליובלסטומה עכברוש לחקות טיפול כימותרפיה-קרינה של גליובלסטומה אנושית במרפאה הוקם בעבר. בדומה לטיפול הקליני, טומוגרפיה ממוחשבת (CT) והדמיה תהודה מגנטית (MRI) שולבו במהלך תהליך תכנון הטיפול. הדמיית טומוגרפיה של פליטת פוזיטרונים (PET) נוספה לאחר מכן כדי ליישם הגברת נפח משנה באמצעות מערכת מיקרו-הקרנה. עם זאת, שילוב של שלוש שיטות הדמיה (CT, MRI ו- PET) באמצעות מערכת מיקרו-הקרנה התגלה כגורם עתיר עבודה מכיוון שיש להשלים הדמיה רב-מודאלית, תכנון טיפול ואספקת מינון ברצף בסביבה הפרה-קלינית. התוצאה היא גם זרימת עבודה נוטה יותר לטעות אנוש. לכן, אלגוריתם ידידותי למשתמש כדי לייעל עוד יותר תכנון טיפול קרינה רב-קליני מבוסס הדמיה פרה-קלינית יושם. כלי תוכנה זה שימש להערכת הדיוק והיעילות של טיפול בקרינה בצביעת מינון עם מיקרו הקרנה באמצעות עיצוב מחקר סיליקו . המתודולוגיה החדשה לצביעת מינון הקרנות עדיפה על השיטה שתוארה בעבר מבחינת דיוק, יעילות זמן ושונות פנים-משתמשית ובין-משתמשית. זהו גם צעד חשוב לקראת יישום תכנון טיפול הפוך על מיקרו-הקרנות, שבו תכנון קדימה עדיין נפוץ, בניגוד למערכות קליניות.
Introduction
גליובלסטומה (GB) הוא גידול ממאיר ואגרסיבי מאוד במוח. GB הוא גידול הטרוגני מוצק המאופיין בדרך כלל על ידי גבולות חודרניים, אטיפיה גרעינית, ונמק1. הנוכחות של מחסום הדם - מוח ומעמדו של המוח כאתר בעל זכויות חיסוניות הופכת את גילוי המטרות החדשות לכימותרפיה ואימונותרפיה למשימה מרתיעה 2,3,4. ראוי לציין כי הטיפול בחולי GB בקושי השתנה מאז ההקדמה, בשנת 2005, של פרוטוקול Stupp המשלב טיפול קרינת קרן חיצונית (RT) עם טמוזולומייד במקביל, בדרך כלל ואחריו temozolomide אדג'ובנטית5. בדרך כלל, לפרוטוקול סטאפ קדם כריתה כירורגית מקסימלית. לכן, גישות טיפול אלטרנטיבי הן בעלות חשיבות מכרעת.
טיפול קרינה נוכחי לחולי גליובלסטומה מספק מינון קרינה אחיד לנפח הגידול המוגדר. בקרינה אונקולוגית, יש מתאם חשוב של תגובת מינון עבור גליובלסטומה עם הגדלת המינון, אשר נראה לכסות סביב 60 Gy, בשל רעילות מוגברת למוח הרגיל6,7. עם זאת, גידולים יכולים להיות הטרוגניים מאוד (רדיוביולוגית), עם שיפועים של רמת חמצן ו / או הבדלים גדולים בצפיפות התאים. טכניקות הדמיה מטבולית, כגון PET, יכול לדמיין תכונות ביולוגיות אלה, ניתן להשתמש כדי להתאים אישית את מרשם המינון. גישה זו ידועה בשם ציור מינון RT. מונח זה הוצג על ידי לינג ואח 'בשנת 2000. המחברים הגדירו את צביעת המינון RT כמפיקה "התפלגות מינון קונפורמית להפליא בתוך האילוצים של התפשטות קרינה ופיזור"8.
ישנם שני סוגים של ציור מינון RT, ציור מינון על ידי קווי מתאר (DPBC), שבאמצעותו מינון נקבע לקבוצה של תת-כרכים מקוננים, וציור מינון לפי מספרים (DPBN), לפיו מינון נקבע ברמת voxel. התפלגות המינון עבור DPBN RT ניתן לחלץ מתמונות פונקציונליות. המינון בכל voxel נקבע על ידי האינטנסיביות I של voxel המתאים בתמונה, עם גבול תחתון ועליון, כדי לוודא כי, מצד אחד, מנה מספקת מועברת לכל חלק של הגידול. מצד שני, מינונים אינם חורגים מהגבול העליון כדי להגן על איברים בסיכון ולהימנע מרעילות. השיטה הפשוטה ביותר היא אינטרפולציה ליניארית (ראה Eq. 1) בין מינון מינימלי Dmin לבין Dmax במינון מקסימלי, המשתנה באופן יחסי בין Imax בעוצמה מינימלית לבין עוצמה מקסימלית בתוך נפח היעד9,10
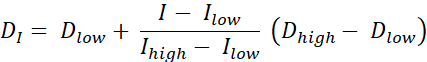 א.ק. 1
א.ק. 1
כי יש כמה ספקנות לגבי אבטחת האיכות של DPBN RT, התצהיר של המינון צריך להיות מאומת באמצעות מחקר פרה קליני וקליני10. עם זאת, ניתן לרכוש רק נתונים מוגבלים מניסויים קליניים, וההשערה היא שניתן להשיג תובנות נוספות על ידי צמצום לבעלי חיים במעבדה1,12. לפיכך, מחקרים פרה-קליניים המשתמשים בפלטפורמות מחקר קרינה מונחות תמונה מדויקות המאפשרות צימוד עם כמה טכניקות ספציפיות מאוד, כגון אוטורדיוגרפיה, מתאימים לבחינת סוגיות פתוחות ולסלול את הדרך לרפואה מותאמת אישית ואסטרטגיות טיפול חדשניות, כגון ציור מינון RT13,14. עם זאת, הפרשנות של נתונים פרה-קליניים חייבת להתבצע בזהירות, וחסרונות של הגדרות פרה-קליניות אלה צריכים להיחשב 14.
מערכות מיקרו-הקרנה, כגון הפלטפורמה לחקר קרינת בעלי חיים קטנים (SARRP), מצוידות בטכנולוגיות דומות למקבילותן הקליניות. הם כוללים הדמיית CT קרן חרוט (CBCT) על הלוח, מערכת תכנון טיפול פרה-קלינית (PCTPS), ומספקים דיוק תת-מילימטרי. חישובי מינון קליני מבוצעים על ידי תכנון טיפול הפוך, לפיו יוזם מהתפלגות המינון הרצויה כדי לקבוע את הקורות באמצעות אלגוריתם איטרטיבי. מקרינים פרה-קליניים משתמשים לעתים קרובות בתכנון קדימה. בתכנון קדימה, הכמות והזווית הנדרשות של הקורות נבחרות, ולאחר מכן PCTPS מחשב את התפלגות המינון. האופטימיזציה של התוכניות מתבצעת על ידי איטרציה ידנית, שהיא עתירת עבודה15.
לאחר 2009, התפתחויות חדשניות הפכו את יישום התכנון ההפוך בפלטפורמות מחקר אלה לאפשרי16,17,18. כדי להגביר את הדמיון עם השיטה הקלינית, קולימטור מלבני משתנה ממונע (MVC) פותח כמקביל פרה-קליני של הקולימטור מרובה העלים. שיטת ציור מינון דו מימדית המשתמשת בקולימטור משתנה פורסמה על ידי Cho et al.19. קבוצת מחקר זו יישמה פרוטוקול תכנון טיפול הפוך תלת מימדי (3D) על מיקרו-קרינה וקבעה מינונים מינימליים ומקסימליים לנפח היעד ומינון מקסימלי לאיברים בסיכון. טכניקות אלה הוערכו בעיקר בסיליקו, ויש לחקור את היישומים הפרה-קליניים שלהם.
מאמר זה מציג מחקר בסיליקו כדי להשוות בין שתי מתודולוגיות עבור [18F]-פלואורו-אתיל-L-טירוזין ([18F]FET) ציור מינון מבוסס PET במודל עכברוש GB 20,21,222 באמצעות פלטפורמת מחקר קרינה קטנה בבעלי חיים. שתי מתודולוגיות אלה הן (1) הגברת נפח משנה באמצעות גדלי קרן מוגדרים מראש ו -(2) ציור מינון באמצעות קולימטור משתנה ממונע שבו מידות הלסת משתנות בהתבסס על ספיגת מעקב PET בנפח הגידול. [18F] FET הוא נותב PET המשמש לעתים קרובות נוירו-אונקולוגיה בגלל יכולתו לזהות גידולים במוח23. [18F] FET היא חומצת אמינו מלאכותית המופנמת לתאים סרטניים אך אינה משולבת בחלבוני תאים. [18F] ספיגת FET תואמת את קצב התפשטות התאים, צפיפות תאי הגידול ואנגיוגנזה24. מכיוון שזהו המעקב האונקולוגי הנפוץ ביותר של המוח האונקולוגי PET במכון של מחברים אלה, רדיוגרף זה נבחר להעריך את זרימת העבודה החדשה.
Protocol
המחקר אושר על ידי ועדת האתיקה המקומית לניסויים בבעלי חיים (ECD 18/21). ניטור הרדמה מתבצע על ידי רכישת קצב הנשימה של בעלי החיים באמצעות חיישן.
1. דגם תא עכברוש F98 GB
- תרבית את תאי F98 GB במונולייר באמצעות מדיום הנשר המותאם של Dulbecco, בתוספת סרום עגל 10%, 1% פניצילין, 1% סטרפטומיצין, ו 1% L-גלוטמין, ומניחים אותם בחממה CO2 (5% CO2 ו 37 °C (5% CO2 ו 37 °C (57 °C ).
- לחסן את תאי glioma לתוך המוח של חולדות פישר F344 הנשי (משקל גוף 170 גרם).
הערה: יש להשתמש במכשירים סטריליים וללבוש כפפות סטריליות בכל עת.- מרדים את החולדות באמצעות שאיפת איזופלורן (5% אינדוקציה, 2% תחזוקה) מעורבב עם חמצן (0.3 מ"ל / דקה) דרך חרוט האף. אשר את ההרסדה על ידי היעדר רפלקס גמילה של האיבר, ולשתק את החולדות במכשיר סטריאוטקטי באמצעות נקודות קיבוע לאף ולאוזניים. החל ג'ל עין קרבומר כדי למנוע עיניים יבשות תחת הרדמה. שמור על טמפרטורת הגוף על ידי כרית חימום thermoregulated בדיקה רקטלית ב 37 °C (50 °F).
- לגלח את החולדה מגובה העיניים לחלק האחורי של הגולגולת, ולחטא את העור עם איזובטדין. הזרקו קסילוקאין (עם אדרנלין 1:200000, 0.1 מ"ל) תת עורית להרדמה מקומית.
- לחשוף את הגולגולת דרך חתך קרקפת קו האמצע ולעשות חור קטן עם כלי מקדחה 3 מ"מ אחורי ו 3 מ"מ לרוחב ברגמה בחצי הכדור הימני.
- הכנס מחט אינסולין מונחית סטריאוטקטית (29 גרם) והזריק 5 μL של השעיית תאים (20,000 תאי F98 GB) בעומק 3 מ"מ באמצעות בקר משאבת מיקרו-מזרק. השאר את המחט במקום במשך 5 דקות, נותן את זמן השעיית התא כדי להתפזר לתוך הרקמה.
- הסר את המזרק באיטיות וסגור את החור בגולגולת עם שעוות עצם. לתפור את העור (פוליאמיד 6, עובי 4-0) ולהזריק meloxicam תת עורית (1 מ"ג / קילוגרם, 2 מ"ג / מ"ל). יש למרוח ג'ל קסילוקאין.
- לייצב את טמפרטורת הגוף של החיה לאחר הניתוח באמצעות מנורה אדומה. עקוב אחר התעוררות החולדה עד שהיא תחזור להכרה מספקת. אין להחזיר את החיה לחברתם של בעלי חיים אחרים עד להחלמה מלאה. בית כל בעלי החיים בתנאים מבוקרים מבחינה סביבתית (12 שעות אור / מחזור כהה, 20-24 °C (60 °F), ו 40-70% לחות יחסית) עם מזון ומים עד ליביטום.
- הקפד לעקוב אחר בעלי החיים מדי יום ולשמור על יומן מצב בריאותי יומי על ידי בדיקת משקל הגוף שלהם, מזון, צריכת מים, ואת הפעילות וההתנהגות שלהם. השתמש במינון קטלני של נתרן פנטוברביטל כדי להרדים את בעלי החיים (160 מ"ג / קילוגרם) אם נצפתה ירידה של 20% ממשקל הגוף או כאשר ההתנהגות הרגילה מתדרדרת קשות (למשל, חוסר טיפוח).
2. אישור של גידול הגידול
- להעריך את גידול הגידול 8 ימים לאחר החיסון. מרדים את החולדות באמצעות שאיפת איזופלורן (5% אינדוקציה, 2% תחזוקה) מעורבב עם חמצן (0.3 מ"ל / דקה) דרך חרוט האף. אשר את ההרדמה על ידי היעדר רפלקס נסיגה של האיבר.
- הזרקו חומר ניגוד המכיל גדליניום (0.4 מ"ל/ק"ג) דרך צינורות בתוך הוורידים בווריד הזנב לרוחב. לכסות את החיה עם שמיכת חימום זורמת מים חמים ולהניח אותם במיטת MRI. החל ג'ל עין קרבומר כדי למנוע עיניים יבשות תחת הרדמה. מניחים את מיטת ה-MRI במחזיק עם סליל נפח מוח Tx/Rx Rat.
- בצע סריקת לוקליזר ואחריו סריקת ספין-הד משוקלל T2 כדי להעריך את צמיחת הגידול. השתמש בהגדרות רצף T2-MRI אלה: זמן חזרה (TR)/זמן הד (TE) 3661/37.1 אלפיות השנייה, רזולוציה איזוטרופית של 109 מיקרומטר איזוטרופי במישור, עובי פרוסה 600 מיקרומטר, 4 ממוצעים, 30 פרוסות, זמן רכישה כולל (TA) 9 דקות 45 שניות.
- אם גידול מאושר ברכישה המשוקללת T2, בצע סריקת הד ספין משופרת ניגודיות T1. השתמש בהגדרות אלה של רצף T1-MRI: TR/TE 1539/9.7 אלפיות השנייה, רזולוציה איזוטרופית של 0.117 מ"מ במישור, עובי פרוסה 600 מיקרומטר, 3 ממוצעים, 30 פרוסות, TA 4 דקות 15 שניות.
- לאחר ה-MRI, יש לפקח באופן רציף על החיה עד שהיא חוזרת להכרה מלאה.
- כאשר הגידול מגיע לקוטר של 7 עד 8 מ"מ, שבדרך כלל נצפה 12 ימים לאחר החיסון, בחר את החיה לטיפול.
3. הדמיה רב-מודנטלית של בחירת אמצעי אחסון יעד
הערה: הקרנה מונחית PET/MRI דורשת רכישה רציפה של ערכת נתונים רב-מודולרית. לאחר ניהול תוך ורידי של מכשיר הרדיו, הדמיית PET מתחילה, ואחריה MRI משוקלל T1 משופר בניגוד ולבסוף CT תכנון טיפול.
- מרדים את החיה עם איזופלוריין (5% אינדוקציה, 2% תחזוקה) מעורבב עם חמצן (0.3 ליטר / דקה) באמצעות חרוט האף. אשר הרדמה כאשר החולדות אינן מציגות כל רפלקס נסיגה של האיבר. יש למרוח ג'ל עיניים קרבומר כדי למנוע עיניים יבשות בהרדמה.
- הכנס את הצינורות תוך ורידי בווריד הזנב לרוחב, המאפשר הזרקה של 10-12 MBq של מעקב רדיואקטיבי PET מומס ב 200 μL של תמיסת מלח. הזרקו [18F]-FET, שעה אחת לפני רכישת PET. תן לחיה לחזור להכרה בזמן שהמעקב מופץ דרך הגוף.
- להרדים את החיה שוב, כמתואר בשלב 3.1. מניחים את החיה על מיטה רב-מודנטלית (כאן, מיוצרת בתוך הבית) ומאבטחים אותה באמצעות מחברים של וו-לולאה, תוך שמירה על מיקום קבוע במהלך ההדמיה והמיקרו-הקרנה. תקן נימי מלא סוכן MRI / PET (ראה את טבלת החומרים) לרישום משותף קל יותר. לעטוף את החיה בניילון נצמד כדי לשמור על טמפרטורת הגוף שלה במהלך הדמיה וטיפול מולטימודליות.
- בצע סריקת PET 1 שעות לאחר הזרקת מכשיר המעקב PET. לשחזר את סריקת PET לתוך נפח 3D (192 x 192 x 192 x מטריצה 384) עם גודל voxel 0.4 מ"מ על ידי החלת אלגוריתם ציפייה-מקסימום סבירות מקסימלית (MLEM)-באמצעות 30 איטראציות.
הערה: סורק PET ייעודי להדמיית בעלי חיים במעבדה שימש עם שדה ראייה צירי של 130 מ"מ וקוטר נשא של 72 מ"מ. מערכת זו מספקת רזולוציה מרחבית של תת-מ"מ (0.85 מ"מ). - הזריקו חומר ניגודיות MRI (0.4 מ"ל/ק"ג) דרך הווריד דרך הווריד האחורי. מניחים את החולדה, עדיין קבוע על המיטה multimodality, במחזיק בעלי החיים של סורק MRI (שולחן של חומרים). בצע סריקת לוקליזר ואחריה רצף ספין-הד משוקלל T1 משופר בניגודיות, מקביל לשלב 2.4.
- מניחים את החיה, עדיין קבוע על המיטה multimodality, על מחזיק פלסטיק מאובטח על שולחן מיקום רובוטי ארבעה צירים על מיקרו-הקרנה. בצע CT קרן חרוט ברזולוציה גבוהה לתכנון טיפול באמצעות מתח צינור של 70 kV, זרם צינור של 0.4 mA, מסנן אלומיניום 1 מ"מ, וגלאי פאנל שטוח אמורפי Si בגודל 20 x 20 ס"מ (1024 x 1024 פיקסלים). לרכוש סך של 360 תחזיות מעל 360°. שחזרו את תמונות ה-CT עם גודל ווקסל איזוטרופי של 0.275 מ"מ (411 x 411 x מטריצה 251).
4. רישום משותף של תמונה
הערה: הרישום המשותף מתבצע עם קוד MATLAB חצי אוטומטי שפותח בתוך הבית. הקוד ניתן למצוא על Github https://github.com/sdonche/DosePainting. השלבים השונים מתוארים להלן.
- מקם את שלוש שיטות התמונה ([18F]FET PET, MRI משוקלל T1 משופר בניגודיות ו- CT עם קרן חרוט) בתיקיה אחת. המר תמונות DICOM לתבנית NIfTI באמצעות הפונקציה dcm2niix ממציג התמונה של mricron24.
- יבא את התמונות שהומרו ל- MATLAB וסנן את תמונת PET באמצעות מסנן גאוסי באמצעות חצי מקס ברוחב מלא (FWHM) של 1 מ"מ.
- כוון מחדש את התמונות כך שהצירים הקרטזיים מכל שיטות ההדמיה יתכתבו זה עם זה.
הערה: עבור הגדרה זו, תמונת ה- CT התהפכה סביב ציר ה- Y; ה- MRI התהפך סביב ציר ה- X, ו- PET התהפך סביב ציר ה- Y. - חתוך את תמונת PET כדי לפשט את הרישום המשותף האוטומטי.
הערה: עבור הגדרה זו, 40 פיקסלים הוגדרו לאפס משני צידי ציר ה- X (משמאל ומימין לחיה); בצד הגבי והגחוני של החיה (ציר Y), 60 ו-40 פיקסלים הוגדרו לאפס, בהתאמה; לאורך ציר האורך (או ציר Z), 170 ו- 30 פיקסלים מוגדרים לאפס עבור צד נחות ועדוף, בהתאמה. - הזז את מרכזי התמונות קרוב זה לזה כדי לפשט את הרישום המשותף האוטומטי.
- בצע את הרישום המשותף של הגוף הנוקשה בפועל באמצעות מיפוי פרמטרי סטטיסטי (SPM) ב- MATLAB26. השתמש בפרמטרי הרישום הבאים (אחרים כברירת מחדל): פונקציה אובייקטיבית: מידע הדדי; הפרדה: [4 1 0.2]; טולרנסים: [0.02 0.02 0.02 0.001 0.001 0.001 0.01 0.01 0.01 0.001 0.001 0.001]; החלקת היסטוגרמה: [11]; אינטרפולציה: משולשת.
5. תכנון טיפול בקרינה
הערה: אפליקציית MATLAB וסקריפטים מרובים של MATLAB נכתבו לתכנון הטיפול בקרינה. הקוד ניתן למצוא על Github https://github.com/sdonche/DosePainting. השלבים השונים מוסברים להלן.
- שיטה 1
- טען את שלושת שיטות ההדמיה השונות לאפליקציית MATLAB. הניחו תיבה תוחמת נדיבה סביב שיפור הניגודיות בסריקת MRI משוקלל T1 (איור 1). קבעו את אמצעי האחסון המשופר בניגודיות באמצעות סף (איור 2). אם נבחרו מספר אזורים, בחר רק את אמצעי האחסון הגדול ביותר, שבמרכזו נחשב לאיזומרכז הראשון המספק מינון שנקבע ל-RT (איור 3).
- הרחב את שיפור ניגודיות ה- MRI שנקבע בעבר ב- 10 פיקסלים בכל כיוון. אם אזורים מרובים מזוהים, לשמור רק על נפח PET הגדול ביותר, שבמרכזו נחשב isocenter השני כדי לספק מינון שנקבע עבור RT.
הערה: באמצעי אחסון PET זה, עוצמת ההגברה של PET מוגדרת על-ידי הפיקסלים עם עוצמת אות גבוהה יותר מ- 0.90 × עוצמת האות המרבית (בתיבה התוחמת) באמצעי אחסון זה. - השתמש בהגדרות ההקרנה הבאות עבור האיזוצנטרים המחושבים (איור 4 וטבלה 1).
- עבור isocenter הראשון (MRI), לתת מנה שנקבעה של 2000 cGy באמצעות 3 קשתות שאינן coplanar במיקומים ספה 0 °, -45 °, ו -90° עם סיבוב gantry של 120 °, 120 °, ו 60 °, בהתאמה. השתמש בגודל קולימטור קבוע של 10 x 10 מ"מ, אך השתמש בקולימטור מתאים (לדוגמה, קולימטור בגודל 5 x 5 מ"מ) כאשר יש להקרין גדלי גידול קטנים יותר. היזהר בהתחשב ברווחת החיה כאשר נפחי הגידול גדולים מ -10 מ"מ.
- עבור isocenter השני (PET), לתת מנה שנקבעה של 800 cGy באמצעות 3 קשתות שאינן coplanar במיקומים ספה 0 °, -45°, ו -90° עם סיבוב gantry של 120 °, 120 °, ו 60 °, בהתאמה. השתמש בגודל קולימטור קבוע של 3 x 3 מ"מ.
- חשב את התפלגות המינון בתוך החיה ואת הפרמטרים משלוח הקרן.
- שיטה 2
- טען את שלושת שיטות ההדמיה השונות לאפליקציית MATLAB. מקם תיבה תוחמת נדיבה סביב שיפור הניגודיות בתמונת [18F]FET PET, המקבילה לשלב 5.1.1.1.
- קבע את אמצעי האחסון המוגדרים על-ידי הפיקסלים עם עוצמת אות גבוהה יותר מעוצמת האות המקסימלית של A × (בתיבה התוחמת הנ"ל), כאשר A שווה ל- 0.50, 0.60, 0.60, 0.70, 0.80 ו- 0.90. תן שם לאמצעי אחסון אלה V50, V60, V70, V80 ו- V90, בהתאמה.
- קבעו את האיזוצנטרים ואת ממדי הלסת עבור כל קרן הנדרשת להנחות את קולימטור המשתנה הממונע באמצעות סקריפט MATLAB (ראו איור 5).
- השתמש בהגדרות הבאות עבור האיזוצנטרים והממדים המחושבים של הלסת:
- עבור V50, לתת מנה שנקבעה של 2000 cGy מופץ מעל 16 קורות (כל 125 cGy; ספה ותנוחות gantry בטבלה 2). השתמש במידות הלסת המחושב עבור ה- MVC.
הערה: כאן, שוליים נוספים של 1 מ"מ נכללו כדי להסביר חדירת גידול מיקרוסקופי. - עבור V60-V90, לתת מנה שנקבעה של 800 cGy מופץ מעל 40 קורות (כל 20 cGy; ספה ותנוחות gantry בטבלה 2). השתמש במידות הלסת המחושב עבור ה- MVC.
- עבור V50, לתת מנה שנקבעה של 2000 cGy מופץ מעל 16 קורות (כל 125 cGy; ספה ותנוחות gantry בטבלה 2). השתמש במידות הלסת המחושב עבור ה- MVC.
- חשב את התפלגות המינון בתוך החיה ואת הפרמטרים משלוח הקרן.
6. הערכת תוכנית
הערה: כדי להשוות בין שתי השיטות, חשב את ההיסטוגרמות של נפח המינון (DVH) והיסטוגרמה של נפח Q (QVH) בנפח V50 PET. כאן נעשה שימוש בתסריט MATLAB, שפותח בתוך הבית. הקוד ניתן למצוא על Github https://github.com/sdonche/DosePainting.
- היסטוגרמה של נפח מינון
- צור DVH מהפצת המינון שהתקבלה מ- SARRP.
- קבע את המינונים המרביים, הממוצעים והמינימליים מה- DVH על-ידי חישוב ה- D10, D50 ו- D90, כאשר Dx מייצג את המינון המתקבל ב- x% מהנפח.
- היסטוגרמה של נפח Q
- חשב מינון אידיאלי עבור כל פיקסל באמצעות Eq. 1, שהוא אינטרפולציה ליניארית בין המינונים המינימליים והמקסימליים, המשתנה באופן יחסי בין עוצמת PET המינימלית לבין עוצמת PET המרבית בתוך נפח היעד כדי לתת מפת מינון אידיאלית.
- חשב את Q-value Qp עבור כל פיקסל באמצעות המשוואה הבאה (Eq. 2):
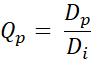 א.ק. 2
א.ק. 2
עם Dp להיות המינון המתקבל על ידי תכנון ו- Di, מטרת המינון לתכנון. - צור QVH מערכי Q שהושגו.
- חשב את גורם האיכות (Q-factor, QF) כדי להעריך את ההבדל בין המינונים המתוכננים והמיועדים באמצעות Eq. 3:
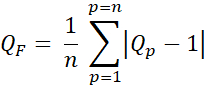 א.ק. 3
א.ק. 3
תוצאות
ההיתכנות של הקרנה מונחית PET ו- MRI במודל חולדת גליובלסטומה באמצעות SARRP כדי לחקות את אסטרטגיית הטיפול האנושי תוארה בעבר 20,21,22. בעוד החיה תוקנה על מיטה רב-מודאלית המיוצרת בתוך הבית, ניתן היה ליצור תוכנית טיפול בקרינה מקובלת המשלבת שלוש שיטות ה?...
Discussion
מודל GB חולדה לחקות את הטיפול כימותרפיה-קרינה במרפאה לחולי גליובלסטומה תואר בעבר20. בדומה לשיטה הקלינית, CT ו- MRI שולבו במהלך תהליך תכנון הטיפול כדי לקבל הקרנה מדויקת יותר. מיטה רב-מודלית כדי למזער (את תנועת הראש) שימשה כאשר החיה הועברה ממערכת הדמיה אחת לאחרת. לאחר מכן, הדמיית PET נו?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים רוצים להודות לקרן לוקס לוקה על תמיכתה בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
References
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved