このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小動物放射線研究プラットフォームを用いたラット膠芽腫モデルにおける陽電子放射断層撮影に基づく線量塗装放射線療法
要約
ここでは、精度と効率を最適化するために自社開発したアルゴリズムを使用して、ラット膠芽腫モデルにおいて前臨床陽電子放射断層撮影ベースの放射線療法を実行するためのプロトコルを提示する。
要約
診療所におけるヒト膠芽腫の化学放射線治療を模倣するラット膠芽腫モデルが以前に確立されていた。臨床治療と同様に、コンピュータ断層撮影法(CT)と磁気共鳴画像法(MRI)が治療計画プロセス中に組み合わされた。陽電子放射断層撮影(PET)イメージングは、その後、マイクロ照射システムを使用してサブボリュームブースティングを実施するために追加された。しかし、マイクロ照射システムを使用して3つのイメージングモダリティ(CT、MRI、PET)を組み合わせることは、マルチモーダルイメージング、治療計画、および線量送達を前臨床現場で順番に完了する必要があるため、労働集約的であることが判明しました。これにより、ワークフローが人為的エラーが発生しやすくなります。したがって、前臨床マルチモーダルイメージングベースの放射線治療計画をさらに最適化するためのユーザーフレンドリーなアルゴリズムが実装されました。このソフトウェアツールは、 in silico 試験デザインを使用して、マイクロ照射による線量塗装放射線療法の精度と効率を評価するために使用されました。線量塗装放射線療法の新しい方法論は、精度、時間効率、およびユーザー内およびユーザー間の変動性の点で、前述の方法よりも優れています。また、臨床システムとは対照的に、フォワードプランニングが依然として一般的に使用されているマイクロ照射器での逆治療計画の実施に向けた重要なステップでもあります。
概要
膠芽腫(GB)は、悪性で非常に攻撃的な原発性脳腫瘍である。GBは、浸潤性境界、核異型、および壊死によって典型的に特徴付けられる固体の不均一な腫瘍である1。血液脳関門の存在と免疫特権部位としての脳の地位は、化学療法および免疫療法のための新規標的の発見を困難な課題としています2,3,4。GB患者の治療は、2005年に外部ビーム放射線療法(RT)と併用テモゾロミドを組み合わせたStuppプロトコルの導入以来、ほとんど変化していないことは注目に値します5。典型的には、Stuppプロトコルの前には、最大外科的切除術が先行する。したがって、代替治療アプローチは極めて重要である。
膠芽腫患者に対する現在の放射線療法は、定義された腫瘍体積に均一な放射線量をもたらす。放射線腫瘍学では、膠芽腫には線量の増加を伴う重要な線量反応相関があり、正常な脳に対する毒性の増加により、約60Gyに制限されるようです6,7。しかし、腫瘍は非常に(放射線生物学的に)不均一であり、酸素レベルの勾配および/または細胞密度の大きな差異であり得る。PETなどの代謝イメージング技術は、これらの生物学的特徴を視覚化することができ、用量処方をカスタマイズするために利用することができる。このアプローチは、線量塗装RTとして知られています。この用語は、2000年にLingらによって導入された。著者らは、線量塗装RTを「放射線の伝播と散乱の制約内で絶妙にコンフォーマルな線量分布」を生成すると定義した8。
線量塗装RTには、ネストされたサブボリュームのセットに線量を処方する輪郭による線量塗装(DPBC)と、ボクセルレベルで線量が処方される数値による線量塗装(DPBN)の2種類がある。DPBN RTの線量分布は、機能画像から抽出することができる。各ボクセルの線量は、画像内の対応するボクセルの強度Iによって決定され、下限および上限とともに、一方では、腫瘍のあらゆる部分に十分な用量が送達されることを確認する。一方、用量は、リスクのある臓器を保護し、毒性を回避するために上限を超えない。最も直接的な方法は、最小線量Dminと最大線量Dmaxの間の線形補間(式1を参照)であり、目標体積内の最小強度Imaxと最大強度の間で比例的に変化する9,10
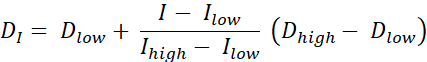 式 1
式 1
DPBN RTの品質保証については懐疑的であるため、線量の沈着は前臨床および臨床研究を通じて検証する必要があります10。しかし、臨床試験から取得できるデータは限られており、実験動物にダウンスケーリングすることでより多くの洞察が得られるという仮説が立てられています11,12。したがって、オートラジオグラフィーなどの非常に特殊な技術との結合を可能にする精密画像誘導放射線研究プラットフォームを利用した前臨床試験は、未解決の問題を検討し、個別化医療や線量塗装RT13,14などの新しい治療戦略への道を開くのに適しています。しかし、前臨床データの解釈は慎重に行う必要があり、これらの前臨床設定の欠点を考慮する必要があります14。
小動物放射線研究プラットフォーム(SARRP)などのマイクロ照射システムには、臨床的対応物と同様の技術が装備されています。オンボードコーンビームCT(CBCT)イメージング、前臨床治療計画システム(PCTPS)を含み、サブミリメートルの精度を提供します。臨床線量計算は、逆治療計画によって実行され、それによって、所望の線量分布から開始し、反復アルゴリズムを介してビームを決定する。前臨床照射器は、多くの場合、フォワードプランニングを使用します。フォワードプランニングでは、ビームの必要な量と角度が選択され、PCTPSは線量分布を計算します。計画の最適化は、手作業のかかる手動イテレーションによって実行されます15。
2009年以降、新しい開発により、これらの研究プラットフォームでの逆計画の実装が可能になりました16,17,18。臨床方法との類似性を高めるために、多葉コリメータの前臨床対応物として電動可変長方形コリメータ(MVC)が開発された。可変コリメータを利用した2次元線量塗装法がChoらによって発表された19。本研究グループは、マイクロ照射器に3次元(3D)逆治療計画プロトコルを実装し、標的体積の最小線量と最大線量、およびリスクのある臓器の最大線量を決定しました。これらの技術は主にインシリコで評価されており、その前臨床応用を探求する必要があります。
この論文は、小動物放射線研究プラットフォームを用いて、GBラットモデルにおける[18F]-フルオロエチル-L-チロシン([18F]FET)PETベースの線量塗装20,21,22の2つの方法論を比較するためのインシリコ研究を提示する。これらの2つの方法論は、(1)予め定義されたビームサイズを用いたサブボリュームブースティングと、(2)腫瘍体積におけるPETトレーサー取り込みに基づいて顎の寸法が変更される電動可変コリメータを使用した線量塗装である。[18F]FETは、脳腫瘍を検出する能力があるため、神経腫瘍学でよく使用されるPETトレーサーです23。[18F]FETは、腫瘍細胞に内在化されるが、細胞タンパク質には取り込まれない人工アミノ酸である。[18F]FETの取り込みは、細胞増殖速度、腫瘍細胞密度、および血管新生に対応します24。これは、これらの著者の研究所で最も一般的に使用されている腫瘍学的脳PETトレーサーであるため、この放射性トレーサーは、新しいワークフローを評価するために選択されました。
プロトコル
この研究は、動物実験のための地元の倫理委員会(ECD 18/21)によって承認された。麻酔モニタリングは、センサを用いて動物の呼吸数を取得することにより行われる。
1. F98 GBラット細胞モデル
- 10%ふくらはぎ血清、1%ペニシリン、1%ストレプトマイシン、および1%L-グルタミンを添加したダルベッコの改変イーグル培地を用いてF98 GB細胞を単層で培養し、CO2 インキュベーター(5%CO2 および37°C)に入れた。
- グリオーマ細胞を雌フィッシャーF344ラット(体重170g)の脳に接種する。
注:滅菌器具を使用し、滅菌手袋を常に着用してください。- 鼻円錐を通して酸素(0.3mL/分)と混合したイソフルラン(5%誘導、2%維持)の吸入を通してラットを麻酔する。四肢の離脱反射の不在による麻酔を確認するとともに、鼻と耳の固定点を用いてラットを定位装置に固定化した。麻酔下でのドライアイを防ぐためにカルボマーアイジェルを塗布する。体温調節された加熱パッドと直腸プローブで体温を37°Cに保ちます。
- ラットを目の高さから頭蓋骨の後ろまで剃り、イソベタジンで皮膚を消毒する。キシロカイン(アドレナリン1:200000、0.1mL)を局所麻酔のために皮下に注射する。
- 正中線の頭皮切開部を通して頭蓋骨を露出させ、右半球のブレグマの後方3mmおよび横3mmのドリルツールで小さな穴を開ける。
- 定位誘導インスリン針(29G)を挿入し、マイクロシリンジポンプコントローラを使用して深さ3mmの細胞懸濁液(20,000F98GB細胞)5μLを注入する。針を所定の位置に5分間放置し、細胞懸濁液が組織内に拡散する時間を与える。
- シリンジをゆっくりと引き出し、骨ワックスで頭蓋骨の穴を閉じます。皮膚(ポリアミド6、厚さ4-0)を縫合し、メロキシカムを皮下に注射する(1mg / kg、2mg / mL)。キシロカインゲルを塗布する。
- 赤いランプを使用して手術後の動物の体温を安定させる。ラットが十分な意識を取り戻すまで、ラットの覚醒を監視します。完全に回復するまで、動物を他の動物の会社に返さないでください。すべての動物を環境制御された条件(12時間の明暗サイクル、20〜24°C、相対湿度40〜70%)で餌と水を 自由に飼育します。
- 動物を毎日監視し、体重、食物、水分摂取量、および活動と行動をチェックして、毎日の健康状態ログを維持してください。致死量のペントバルビタールナトリウムを使用して、20%体重の減少が観察された場合、または正常な行動が著しく悪化した場合(例えば、グルーミングの欠如)に動物を安楽死させる(160mg / kg)。
2. 腫瘍増殖の確認
- 接種後8日目に腫瘍増殖を評価した。鼻円錐を通して酸素(0.3mL/分)と混合したイソフルラン(5%誘導、2%維持)の吸入を通してラットを麻酔する。四肢の離脱反射の不在による麻酔を確認する。
- ガドリニウム含有造影剤(0.4mL/kg)を静脈内に配置されたチューブを通して側尾静脈に注入する。温水を循環させる加熱毛布で動物を覆い、MRIベッドに置きます。麻酔下でのドライアイを防ぐためにカルボマーアイジェルを塗布する。Tx/Rxラット脳容積コイルを備えたホルダーにMRIベッドを置きます。
- ローカライザスキャンに続いてT2強調スピンエコースキャンを実行し、腫瘍の増殖を評価します。繰り返し時間(TR)/エコー時間(TE)3661/37.1 ms、等方性面内分解能109 μm、スライス厚さ600 μm、平均4個、スライス30個、合計取得時間(TA)9分45秒のT2-MRIシーケンス設定を使用します。
- T2強調取得で腫瘍が確認された場合は、T1強調コントラスト増強スピンエコースキャンを実行します。TR/TE 1539/9.7 ms、0.117 mm 等方性面内分解能、スライス厚さ 600 μm、平均 3 枚、平均 30 枚、TA 4 分 15 秒の T1-MRI シーケンス設定を使用します。
- MRIの後、動物が完全意識を取り戻すまで継続的に動物を監督します。
- 腫瘍が直径7〜8mmに達したら、通常は接種後12日目に観察され、治療のために動物を選択する。
3. ターゲットボリューム選択のマルチモダリティイメージング
注: PET/MRI ガイド付き照射では、マルチモーダル データセットを順次取得する必要があります。放射性トレーサーの静脈内投与後、PET画像化が開始され、続いてコントラスト増強T1強調MRIおよび最後に治療計画CTが開始される。
- 鼻円錐形を使用して酸素(0.3L /分)と混合したイソフルラン(5%誘導、2%維持)で動物を麻酔する。ラットが四肢の離脱反射を示さない場合、麻酔を確認する。麻酔下でのドライアイを防ぐためにカルボマーアイジェルを塗布する。
- チューブを側尾静脈に静脈内に挿入し、200 μLの生理食塩水に溶解した10〜12 MBqのPET放射性トレーサーの注射を可能にする。PET取得の1時間前に[18F]-FETを注入する。トレーサーが体全体に分布している間に動物に意識を取り戻させましょう。
- ステップ3.1で説明されているように、動物をもう一度麻酔します。動物をマルチモダリティベッド(ここでは社内製)に置き、面ファスナーを使用して固定し、イメージングとマイクロ照射の間は一定の位置を維持します。MRI/PET剤で満たされた毛細血管を固定し( 材料表を参照)、共同登録を容易にします。マルチモダリティイメージングと治療中に体温を維持するために、動物をバブルラップで包みます。
- PETトレーサーの注入から1時間後にPETスキャンを実行します。PETスキャンを0.4mmボクセルサイズの3Dボリューム(192 x 192 x 384マトリックス)に再構築するには、30回の反復を使用して最大尤度期待値最大化(MLEM)アルゴリズムを適用します。
注:実験動物イメージング専用のPETスキャナを使用し、軸方向の視野は130mm、ボア径は72mmでした。このシステムは、サブミリメートル(0.85ミリメートル)の空間分解能を提供します。 - MRI造影剤(0.4mL/kg)を尾静脈に静脈内注射する。マルチモダリティベッドに固定されたままのラットを、MRIスキャナーの動物ホルダー(材料表)に置きます。ローカライザスキャンを実行してから、コントラストを高めたT1強調スピンエコーシーケンスを実行します(手順2.4と同様)。
- マルチモダリティベッドに固定されたままの動物を、マイクロ照射器の4軸ロボット位置決めテーブルに固定されたプラスチックホルダーの上に置きます。管電圧70kV、管電流0.4mA、1mmアルミフィルター、20×20cm(1024×1024ピクセル)のアモルファスSiフラットパネル検出器を用いて、高解像度の施術計画コーンビームCTを行います。360°以上の投影を合計360個取得します。0.275 mm(411 x 411 x 251マトリックス)の等方性ボクセルサイズでCT画像を再構築します。
4. 画像の共同登録
注: 共同登録は、社内で開発された半自動 MATLAB コードを使用して実行されます。コードはGithubの https://github.com/sdonche/DosePainting にあります。さまざまな手順を以下に説明します。
- 3つの画像モダリティ([18F]FETペット、コントラスト強化T1強調MRI、コーンビームCT)を1つのフォルダに配置します。mricron 画像ビューア 24 の dcm2niix 関数を使用して、DICOM 画像を NIfTI 形式に変換します。
- 変換された画像をMATLABにインポートし、1mm の全幅ハーフマックス(FWHM) を使用してガウスフィルタで PET画像をフィルタリングします。
- すべてのイメージングモダリティのデカルト軸が互いに一致するように、イメージの方向を変更します。
メモ: この設定では、CT 画像は Y 軸を中心に反転されました。MRIはX軸の周りを反転させ、PETはY軸の周りに反転させた。 - PET 画像をトリミングして、自動共同登録を簡素化します。
注: この設定では、X 軸の両側 (動物の左右) から 40 ピクセルがゼロに設定されました。動物の背側および腹側(Y軸)では、それぞれ60および40ピクセルをゼロに設定した。縦軸 (または Z 軸) に沿って、170 ピクセルと 30 ピクセルがそれぞれ劣辺と上辺に対してゼロに設定されます。 - 画像の中心を互いに近づけて、自動共同登録を簡素化します。
- MATLAB26 の統計的パラメトリック マッピング (SPM) を使用して、実際の剛体とボディの共登録を実行します。次の登録パラメータ(デフォルトではその他)を使用します:目的関数:相互情報。分離: [4 1 0.2];公差: [0.02 0.02 0.02 0.001 0.001 0.001 0.01 0.01 0.01 0.001 0.001];ヒストグラム平滑化: [1 1];補間: 三線形。
5. 放射線治療計画
注: 放射線治療計画のために MATLAB アプリケーションと複数の MATLAB スクリプトが作成されました。コードはGithubの https://github.com/sdonche/DosePainting にあります。さまざまな手順については、以下で説明します。
- 方法1
- 3 つの異なるイメージング モダリティを MATLAB アプリに読み込みます。T1強調MRIスキャンのコントラスト強調の周囲に寛大なバウンディングボックスを配置します(図1)。しきい値を使用してコントラストが強化されたボリュームを決定します(図2)。複数の領域が選択されている場合は、最大の体積のみを選択し、その中心がRTの処方線量を送達する最初のアイソセンターと見なされます(図3)。
- 以前に決定した MRI コントラスト強調を各方向に 10 ピクセルずつ拡大します。複数の領域が検出された場合は、最大のPET体積のみを保持し、その中心はRTの処方用量を送達するための第2のアイソセンターとみなされる。
メモ: この PET ボリュームでは、PET ブーストボリュームは、このボリュームの最大信号強度 (バウンディングボックス内) の 0.90 × より高い信号強度を持つピクセルによって定義されます。 - 計算されたアイソセンターには、次の照射設定を使用します(図4 および 表1)。
- 最初のアイソセンター(MRI)の場合、ソファの位置でそれぞれ120°、120°、および60°のガントリ回転で、3つの非同一平面円弧を使用して2000cGyの処方線量を与える。10 x 10 mmの固定コリメータサイズを使用しますが、より小さな腫瘍サイズを照射する必要がある場合は、適切なコリメータ(5 x 5mmコリメータなど)を使用してください。腫瘍体積が10mmより大きい場合、動物の福祉を考慮する際には注意してください。
- 第2アイソセンター(PET)の場合、ソファ位置0°、-45°、および-90°で3つの非同一平面円弧を使用して、それぞれ120°、120°、および60°のガントリ回転で800cGyの処方用量を与える。3 x 3 mmの固定コリメータサイズを使用してください。
- 動物内の線量分布とビーム送達パラメータを計算する。
- 方法2
- 3 つの異なるイメージング モダリティを MATLAB アプリに読み込みます。[18F]FETのPET画像上のコントラスト強調の周囲に、ステップ5.1.1と同様に寛大なバウンディングボックスを配置します。
- 信号強度が A より大きいピクセルと最大信号強度 (前述の境界ボックス内) で、A が 0.50、0.60、0.70、0.80、および 0.90× に等しいピクセルによって定義されるボリュームを決定します。これらのボリュームには、それぞれ V50、V60、V70、V80、および V90 という名前が付けられます。
- MATLABスクリプトを使用して、電動可変コリメータをガイドするために必要な各ビームのアイソセンターとジョー寸法を決定します( 図5参照)。
- 計算されたアイソセンターとジョーの寸法には、次の設定を使用します。
- V50の場合、16本のビーム(各125cGy; 表2のソファとガントリーの位置)に分配された2000cGyの処方線量を与える。MVC の計算された顎の寸法を使用します。
注:ここでは、顕微鏡的腫瘍浸潤を説明するために1mmの追加マージンが含まれている。 - V60-V90の場合、40本のビーム(各20cGy、 表2のソファとガントリーの位置)に分配された800cGyの処方線量を与える。MVC の計算された顎の寸法を使用します。
- V50の場合、16本のビーム(各125cGy; 表2のソファとガントリーの位置)に分配された2000cGyの処方線量を与える。MVC の計算された顎の寸法を使用します。
- 動物内の線量分布とビーム送達パラメータを計算する。
6. 計画評価
注:2つの方法を比較するには、V50 PET体積の線量 - 体積ヒストグラム(DVH)およびQ体積ヒストグラム(QVH)を計算します。ここでは、社内で開発されたMATLABスクリプトが使用されました。コードはGithubの https://github.com/sdonche/DosePainting にあります。
- 線量-体積ヒストグラム
- SARRPから得られた線量分布からDVHを生成する。
- D10、D50、およびD90を計算して、DVHから最大線量、平均線量、および最小線量を決定します(Dxは体積のx%で受けた線量を表します)。
- Qボリュームヒストグラム
- 最小線量と最大線量の間の線形補間である 式1を使用して、各ピクセルの理想的な線量を計算し、ターゲット体積内の最小PET強度と最大PET強度の間で比例的に変化させて、理想的な線量マップを得る。
- 次の式を使用して、各ピクセルの Q値Qp を計算します(式2)。
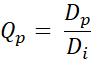 式 2
式 2
Dpは計画によって得られた線量であり、Diは計画のための線量目標である。 - 取得したQ値からQVHを生成します。
- 質因子(Q因子、QF)を計算し、式3を使用して計画線量と意図線量の差を評価します。
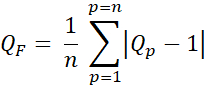 式 3
式 3
結果
ヒトの治療戦略を模倣するためにSARRPを用いた膠芽腫ラットモデルにおけるPETおよびMRI誘導照射の実現可能性は、以前に説明されている20、21、22。動物を社内製のマルチモダリティベッドに固定しながら、PET、MRI、CTの3つのイメージングモダリティを組み合わせた許容可能な放射線治療計画を作成することができました。?...
ディスカッション
膠芽腫患者に対する診療所における化学放射線治療を模倣するラットGBモデルが以前に記載されていた20。臨床方法と同様に、CTとMRIを治療計画プロセス中に組み合わせて、より正確な照射を得た。動物をある画像化システムから別のイメージングシステムに移動するときに、(頭部)動きを最小限に抑えるためのマルチモダリティベッドが使用されました。その後、PETイメー?...
開示事項
著者らは、開示する利益相反はありません。
謝辞
著者らは、この作業を支援してくれたLux Luka Foundationに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
参考文献
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved