Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Positronen-Emissions-Tomographie-basierte Dosismalerei-Strahlentherapie in einem Glioblastom-Rattenmodell unter Verwendung der Small Animal Radiation Research Platform
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Durchführung einer präklinischen Positronen-Emissions-Tomographie-basierten Strahlentherapie in einem Ratten-Glioblastom-Modell unter Verwendung von Algorithmen, die intern entwickelt wurden, um die Genauigkeit und Effizienz zu optimieren.
Zusammenfassung
Ein Ratten-Glioblastom-Modell zur Nachahmung der Chemo-Strahlenbehandlung des menschlichen Glioblastoms in der Klinik wurde zuvor etabliert. Ähnlich wie bei der klinischen Behandlung wurden Computertomographie (CT) und Magnetresonanztomographie (MRT) während des Behandlungsplanungsprozesses kombiniert. Anschließend wurde die Positronen-Emissions-Tomographie (PET) hinzugefügt, um die Subvolumenverstärkung mit einem Mikrobestrahlungssystem zu implementieren. Die Kombination von drei Bildgebungsmodalitäten (CT, MRT und PET) mit einem Mikrobestrahlungssystem erwies sich jedoch als arbeitsintensiv, da multimodale Bildgebung, Behandlungsplanung und Dosisabgabe im präklinischen Umfeld sequentiell durchgeführt werden müssen. Dies führt auch zu einem Workflow, der anfälliger für menschliche Fehler ist. Daher wurde ein benutzerfreundlicher Algorithmus zur weiteren Optimierung der präklinischen multimodalen bildgebungsbasierten Strahlenbehandlungsplanung implementiert. Dieses Software-Tool wurde verwendet, um die Genauigkeit und Effizienz der Dosis-Mal-Strahlentherapie mit Mikrobestrahlung unter Verwendung eines In-silico-Studiendesigns zu bewerten. Die neue Methodik für die Dosislackierungs-Strahlentherapie ist der zuvor beschriebenen Methode in Bezug auf Genauigkeit, Zeiteffizienz und Intra- und Inter-User-Variabilität überlegen. Es ist auch ein wichtiger Schritt zur Umsetzung der inversen Behandlungsplanung für Mikrobestrahlungsgeräte, bei denen im Gegensatz zu klinischen Systemen immer noch häufig eine Vorausplanung verwendet wird.
Einleitung
Das Glioblastom (GB) ist ein bösartiger und sehr aggressiver primärer Hirntumor. GB ist ein solider heterogener Tumor, der typischerweise durch infiltrative Grenzen, Kernatypie und Nekrose gekennzeichnet ist1. Das Vorhandensein der Blut-Hirn-Schranke und der Status des Gehirns als immunprivilegierter Ort machen die Entdeckung neuer Ziele für die Chemo- und Immuntherapie zu einer gewaltigen Aufgabe2,3,4. Es ist bemerkenswert, dass sich die Behandlung von GB-Patienten seit der Einführung des Stupp-Protokolls im Jahr 2005, das die externe Strahlentherapie (RT) mit begleitendem Temozolomid kombiniert, kaum verändert hat, in der Regel gefolgt von adjuvantem Temozolomid5. Typischerweise geht dem Stupp-Protokoll eine maximale chirurgische Resektion voraus. Daher sind alternative Behandlungsansätze von zentraler Bedeutung.
Die aktuelle Strahlentherapie für Glioblastom-Patienten liefert eine gleichmäßige Strahlendosis auf das definierte Tumorvolumen. In der Radioonkologie gibt es eine wichtige Dosis-Wirkungs-Korrelation für das Glioblastom mit steigender Dosis, die aufgrund der erhöhten Toxizität für das normale Gehirn etwa 60 Gy zu begrenzen scheint6,7. Tumore können jedoch sehr (radiobiologisch) heterogen sein, mit Gradienten des Sauerstoffgehalts und/oder großen Unterschieden in der Zelldichte. Metabolische Bildgebungstechniken wie PET können diese biologischen Merkmale visualisieren und können verwendet werden, um die Dosisverschreibung anzupassen. Dieser Ansatz wird als Dose Painting RT bezeichnet. Dieser Begriff wurde im Jahr 2000 von Ling et al. eingeführt. Die Autoren definierten Dosismalerei RT als "exquisit konforme Dosisverteilungen innerhalb der Grenzen der Strahlungsausbreitung und -streuung"8.
Es gibt zwei Arten von Dosismalerei RT, Dosismalerei durch Konturen (DPBC), bei der eine Dosis an eine Reihe von verschachtelten Teilvolumina verschrieben wird, und Dosismalerei nach Zahlen (DPBN), wobei eine Dosis auf Voxelebene verschrieben wird. Die Dosisverteilung für DPBN RT kann aus funktionellen Bildern extrahiert werden. Die Dosis in jedem Voxel wird durch die Intensität I des entsprechenden Voxels im Bild mit einer unteren und oberen Grenze bestimmt, um sicherzustellen, dass einerseits eine ausreichende Dosis an jeden Teil des Tumors abgegeben wird. Auf der anderen Seite überschreiten die Dosen nicht eine Obergrenze, um gefährdete Organe zu schützen und Toxizität zu vermeiden. Die einfachste Methode ist eine lineare Interpolation (siehe Gleichung 1) zwischen der minimalen Dosis Dmin und der maximalen Dosis Dmax, proportional variierend zwischen der minimalen Intensität Imax und der maximalen Intensität innerhalb des Zielvolumens9,10
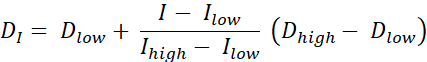 Gl. 1
Gl. 1
Da es eine gewisse Skepsis gegenüber der Qualitätssicherung von DPBN RT gibt, sollte die Ablagerung der Dosis durch präklinische und klinische Forschung verifiziert werden10. Es können jedoch nur begrenzte Daten aus klinischen Studien gewonnen werden, und es wurde die Hypothese aufgestellt, dass durch das Herunterskalieren auf Labortiere mehr Erkenntnisse gewonnen werden können11,12. Präklinische Studien, die präzisionsbildgeführte Strahlungsforschungsplattformen verwenden, die eine Kopplung mit einigen sehr spezifischen Techniken wie der Autoradiographie ermöglichen, eignen sich daher, um offene Fragen zu untersuchen und den Weg zu personalisierter Medizin und neuartigen Behandlungsstrategien wie Dosislackierung zu ebnen RT13,14. Die Interpretation präklinischer Daten muss jedoch mit Vorsicht erfolgen, und die Nachteile dieser präklinischen Aufbauten müssen berücksichtigt werden14.
Mikrobestrahlungssysteme wie die Small Animal Radiation Research Platform (SARRP) sind mit ähnlichen Technologien ausgestattet wie ihr klinisches Gegenstück. Dazu gehören die On-Board-Kone-Beam-CT (CBCT), ein präklinisches Behandlungsplanungssystem (PCTPS) und eine Präzision im Submillimeterbereich. Klinische Dosisberechnungen werden durch inverse Behandlungsplanung durchgeführt, wobei man aus der gewünschten Dosisverteilung heraus die Strahlen über einen iterativen Algorithmus bestimmt. Präklinische Bestrahlungsgeräte verwenden oft eine Vorausplanung. In der Vorausplanung werden die benötigte Menge und der Winkel der Strahlen ausgewählt und der PCTPS berechnet dann die Dosisverteilung. Die Optimierung der Pläne erfolgt durch manuelle Iteration, die arbeitsintensiv ist15.
Nach 2009 haben neuartige Entwicklungen die Umsetzung der inversen Planung auf diesen Forschungsplattformen ermöglicht16,17,18. Um die Ähnlichkeit mit der klinischen Methode zu erhöhen, wurde ein motorisierter variabler Rechteckiger Kollimator (MVC) als präklinisches Gegenstück zum Mehrblattkollimator entwickelt. Eine zweidimensionale Dosismalmethode unter Verwendung eines variablen Kollimators wurde von Cho et al.19 veröffentlicht. Diese Forschungsgruppe implementierte ein dreidimensionales (3D) inverses Behandlungsplanungsprotokoll auf einem Mikrobestrahlungsgerät und bestimmte minimale und maximale Dosen für das Zielvolumen und eine maximale Dosis für die gefährdeten Organe. Diese Techniken wurden hauptsächlich in silico evaluiert, und ihre präklinischen Anwendungen müssen erforscht werden.
Dieser Artikel stellt eine In-silico-Studie vor, um zwei Methoden für [18F]-Fluor-Ethyl-L-Tyrosin ([18F]FET) PET-basierte Dosislackierung in einem GB-Rattenmodell zu vergleichen20,21,22 unter Verwendung einer Kleintierstrahlungsforschungsplattform. Diese beiden Methoden sind (1) Subvolumenverstärkung mit vordefinierten Strahlgrößen und (2) Dosislackierung mit einem motorisierten variablen Kollimator, bei dem die Kieferabmessungen basierend auf der PET-Traceraufnahme im Tumorvolumen modifiziert werden. [18F] FET ist ein PET-Tracer, der aufgrund seiner Fähigkeit, Hirntumore zu erkennen, häufig in der Neuroonkologie verwendet wird23. [18F] FET ist eine künstliche Aminosäure, die in Tumorzellen verinnerlicht, aber nicht in Zellproteine eingebaut wird. [18F] Die FET-Aufnahme entspricht der Zellproliferationsrate, der Tumorzelldichte und der Angiogenese24. Da dies der am häufigsten verwendete onkologische Gehirn-PET-Tracer im Institut dieser Autoren ist, wurde dieser Radiotracer ausgewählt, um den neuen Workflow zu bewerten.
Protokoll
Die Studie wurde von der örtlichen Ethikkommission für Tierversuche genehmigt (ECD 18/21). Die Anästhesieüberwachung erfolgt durch Erfassung der Atemfrequenz der Tiere mit einem Sensor.
1. F98 GB Rattenzellmodell
- Kulturieren Sie die F98 GB-Zellen in einer Monoschicht mit Dulbeccos Modified Eagle Medium, ergänzt mit 10% Kälberserum, 1% Penicillin, 1% Streptomycin und 1% L-Glutamin, und legen Sie sie in einen CO2-Inkubator (5% CO2 und 37 ° C).
- Impfen der Gliomzellen in das Gehirn weiblicher Fischer F344 Ratten (Körpergewicht 170 g).
HINWEIS: Verwenden Sie sterile Instrumente und tragen Sie jederzeit sterile Handschuhe.- Betäuben Sie die Ratten durch Inhalation von Isofluran (5% Induktion, 2% Wartung) gemischt mit Sauerstoff (0,3 ml/min) durch einen Nasenkegel. Bestätigen Sie die Anästhesie durch das Fehlen eines Entzugsreflexes der Extremität und immobilisieren Sie die Ratten in einem stereotaktischen Gerät mit Fixationspunkten für Nase und Ohren. Tragen Sie ein Carbomer-Augengel auf, um trockene Augen unter Narkose zu verhindern. Halten Sie die Körpertemperatur durch ein thermoreguliertes Heizkissen und eine Rektalsonde bei 37 °C.
- Rasieren Sie die Ratte von der Augenhöhe bis zur Rückseite des Schädels und desinfizieren Sie die Haut mit Isobetadin. Injizieren Sie Xylocain (mit Adrenalin 1:200000, 0,1 ml) subkutan zur Lokalanästhesie.
- Legen Sie den Schädel durch einen Mittellinien-Kopfhautschnitt frei und machen Sie ein kleines Loch mit einem Bohrwerkzeug 3 mm posterior und 3 mm seitlich zum Bregma in der rechten Hemisphäre.
- Führen Sie eine stereotaktisch geführte Insulinnadel (29 G) ein und injizieren Sie 5 μL Zellsuspension (20.000 F98 GB-Zellen) in 3 mm Tiefe mit einem Mikrospritzenpumpenregler. Lassen Sie die Nadel für 5 Minuten an Ort und Stelle und geben Sie der Zellsuspension Zeit, in das Gewebe zu diffundieren.
- Ziehen Sie die Spritze langsam zurück und schließen Sie das Loch im Schädel mit Knochenwachs. Nähen Sie die Haut (Polyamid 6, Dicke 4-0) und injizieren Sie Meloxicam subkutan (1 mg/kg, 2 mg/ml). Xylocain-Gel auftragen.
- Stabilisieren Sie die Körpertemperatur des Tieres nach der Operation mit einer roten Lampe. Überwachen Sie das Erwachen der Ratte, bis sie ein ausreichendes Bewusstsein wiedererlangt hat. Geben Sie das Tier erst dann in die Gesellschaft anderer Tiere zurück, wenn Sie sich vollständig erholt haben. Beherbergen Sie alle Tiere unter umweltkontrollierten Bedingungen (12 h Hell-Dunkel-Zyklus, 20-24 °C und 40-70% relative Luftfeuchtigkeit) mit Futter und Wasser ad libitum.
- Achten Sie darauf, die Tiere täglich zu überwachen und ein tägliches Gesundheitszustandsprotokoll zu führen, indem Sie ihr Körpergewicht, ihre Nahrung, ihre Wasseraufnahme sowie ihre Aktivität und ihr Verhalten überprüfen. Verwenden Sie eine tödliche Dosis Pentobarbital-Natrium, um die Tiere einzuschläfern (160 mg/kg), wenn ein Rückgang des Körpergewichts um 20% beobachtet wird oder wenn sich das normale Verhalten stark verschlechtert (z. B. mangelnde Pflege).
2. Bestätigung des Tumorwachstums
- Bewerten Sie das Tumorwachstum 8 Tage nach der Impfung. Betäuben Sie die Ratten durch Inhalation von Isofluran (5% Induktion, 2% Wartung) gemischt mit Sauerstoff (0,3 ml/min) durch einen Nasenkegel. Bestätigen Sie die Betäubung durch das Fehlen eines Rückzugsreflexes der Extremität.
- Injizieren Sie ein Gadolinium-haltiges Kontrastmittel (0,4 ml/kg) durch einen intravenös platzierten Schlauch in der lateralen Schwanzvene. Decken Sie das Tier mit einer warmen Wasserzirkulationsdecke ab und legen Sie es in das MRT-Bett. Tragen Sie ein Carbomer-Augengel auf, um trockene Augen unter Narkose zu verhindern. Legen Sie das MRT-Bett mit einer Tx/ Rx-Gehirnvolumenspule in die Halterung.
- Führen Sie einen Lokalisierer-Scan durch, gefolgt von einem T2-gewichteten Spin-Echo-Scan, um das Tumorwachstum zu beurteilen. Verwenden Sie diese T2-MRT-Sequenzeinstellungen: Wiederholungszeit (TR)/Echozeit (TE) 3661/37,1 ms, 109 μm isotrope In-Plane-Auflösung, Schichtdicke 600 μm, 4 Mittelwerte, 30 Scheiben, Gesamterfassungszeit (TA) 9 min 45 s.
- Wenn ein Tumor bei der T2-gewichteten Erfassung bestätigt wird, führen Sie einen T1-gewichteten kontrastverstärkten Spin-Echo-Scan durch. Verwenden Sie diese T1-MRT-Sequenzeinstellungen: TR/TE 1539/9,7 ms, 0,117 mm isotrope In-Plane-Auflösung, Scheibendicke 600 μm, 3 Mittelwerte, 30 Scheiben, TA 4 min 15 s.
- Überwachen Sie das Tier nach dem MRT kontinuierlich, bis es wieder zu vollem Bewusstsein kommt.
- Wenn der Tumor einen Durchmesser von 7 bis 8 mm erreicht, der normalerweise 12 Tage nach der Impfung beobachtet wird, wählen Sie das Tier für die Therapie aus.
3. Multimodale Bildgebung der Zielvolumenauswahl
HINWEIS: PET/MRT-gesteuerte Bestrahlung erfordert die sequentielle Erfassung eines multimodalen Datensatzes. Nach intravenöser Verabreichung des Radiotracers wird mit der PET-Bildgebung begonnen, gefolgt von einer kontrastverstärkten T1-gewichteten MRT und schließlich einem Behandlungsplanungs-CT.
- Betäuben Sie das Tier mit Isofluran (5% Induktion, 2% Erhaltung), gemischt mit Sauerstoff (0,3 l/min) unter Verwendung eines Nasenkegels. Bestätigen Sie die Anästhesie, wenn die Ratten keinen Rückzugsreflex der Extremität zeigen. Tragen Sie Carbomer-Augengel auf, um trockene Augen unter Narkose zu verhindern.
- Führen Sie den Schlauch intravenös in die laterale Schwanzvene ein, wodurch die Injektion von 10-12 MBq radioaktivem PET-Tracer ermöglicht wird, der in 200 μL Kochsalzlösung gelöst ist. Injizieren Sie [18F]-FET, 1 h vor der PET-Akquisition. Lassen Sie das Tier das Bewusstsein wiedererlangen, während der Tracer durch den Körper verteilt wird.
- Betäuben Sie das Tier erneut, wie in Schritt 3.1 beschrieben. Legen Sie das Tier auf ein multimodales Bett (hier im eigenen Haus hergestellt) und sichern Sie es mit Klettverschlüssen, wobei sie während der Bildgebung und Mikrobestrahlung eine feste Position beibehalten. Befestigen Sie eine mit dem MRT/PET-Mittel gefüllte Kapillare (siehe Materialtabelle) für eine einfachere Mitregistrierung. Wickeln Sie das Tier in Luftpolsterfolie, um seine Körpertemperatur während der multimodalen Bildgebung und Therapie zu erhalten.
- Führen Sie 1 h nach der Injektion des PET-Tracers einen PET-Scan durch. Rekonstruieren Sie den PET-Scan in ein 3D-Volumen (192 x 192 x 384 Matrix) mit 0,4 mm Voxelgröße, indem Sie einen Maximum-Likelihood Expectation-Maximization (MLEM)-Algorithmus mit 30 Iterationen anwenden.
HINWEIS: Es wurde ein spezieller PET-Scanner für die Labortierbildgebung mit einem axialen Sichtfeld von 130 mm und einem Bohrungsdurchmesser von 72 mm verwendet. Dieses System bietet eine räumliche Auflösung im Sub-mm-Bereich (0,85 mm). - Injektion eines MRT-Kontrastmittels (0,4 ml/kg) intravenös in die Schwanzvene. Legen Sie die Ratte, die noch auf dem multimodalen Bett befestigt ist, in die Tierhalterung des MRT-Scanners (Table of Materials). Führen Sie einen Lokalisierungsscan durch, gefolgt von einer kontrastverstärkten T1-gewichteten Spin-Echo-Sequenz, analog zu Schritt 2.4.
- Legen Sie das Tier, das noch auf dem Multimodalitätsbett befestigt ist, auf einen Kunststoffhalter, der auf dem vierachsigen Roboter-Positioniertisch auf dem Mikrobestrahlungsgerät befestigt ist. Führen Sie eine hochauflösende Behandlungsplanungs-Kegelstrahl-CT mit einer Röhrenspannung von 70 kV, einem Röhrenstrom von 0,4 mA, einem 1 mm Aluminiumfilter und einem 20 x 20 cm (1024 x 1024 Pixel) großen amorphen Si-Flachbilddetektor durch. Erfassen Sie insgesamt 360 Projektionen über 360°. Rekonstruieren Sie die CT-Bilder mit einer isotropen Voxelgröße von 0,275 mm (411 x 411 x 251 Matrix).
4. Bild-Mitregistrierung
HINWEIS: Die Mitregistrierung erfolgt mit einem halbautomatischen MATLAB-Code, der selbst entwickelt wurde. Den Code finden Sie auf Github unter https://github.com/sdonche/DosePainting. Die verschiedenen Schritte werden im Folgenden beschrieben.
- Legen Sie die drei Bildmodalitäten ([18F]FET PET, kontrastverstärktes T1-gewichtetes MRT und Kegelstrahl-CT) in einem Ordner ab. Konvertieren Sie DICOM-Bilder mit der funktion dcm2niix aus dem mricron image viewer24 in das NIfTI-Format.
- Importieren Sie die konvertierten Bilder in MATLAB und filtern Sie das PET-Bild mit einem Gaußschen Filter mit einem Full-Width Half-Max (FWHM) von 1 mm.
- Richten Sie die Bilder neu aus, so dass die kartesischen Achsen aus allen Bildgebungsmodalitäten miteinander korrespondieren.
HINWEIS: Für dieses Setup wurde das CT-Bild um die Y-Achse gedreht; Das MRT wurde um die X-Achse und das PET um die Y-Achse gedreht. - Schneiden Sie das PET-Bild zu, um die automatische Mitregistrierung zu vereinfachen.
HINWEIS: Für dieses Setup wurden 40 Pixel von beiden Seiten der X-Achse (links und rechts des Tieres) auf Null gesetzt; auf der dorsalen und ventralen Seite des Tieres (Y-Achse) wurden 60 bzw. 40 Pixel auf Null gesetzt; Entlang der Längsachse (oder Z-Achse) werden 170 bzw. 30 Pixel für die untere bzw. obere Seite auf Null gesetzt. - Verschieben Sie die Bildmitte nahe beieinander, um die automatische Mitregistrierung zu vereinfachen.
- Führen Sie die eigentliche Starrkörper-Co-Registrierung mithilfe von Statistical Parametric Mapping (SPM) in MATLAB26 durch. Verwenden Sie die folgenden Registrierungsparameter (andere standardmäßig): Zielfunktion: gegenseitige Information; Trennung: [4 1 0,2]; Toleranzen: [0,02 0,02 0,02 0,001 0,001 0,001 0,01 0,01 0,01 0,001 0,001 0,001]; Histogramm-Glättung: [1 1]; Interpolation: trilinear.
5. Planung der Strahlenbehandlung
HINWEIS: Für die Planung der Strahlenbehandlung wurden eine MATLAB-App und mehrere MATLAB-Skripte geschrieben. Den Code finden Sie auf Github unter https://github.com/sdonche/DosePainting. Die verschiedenen Schritte werden im Folgenden erläutert.
- Methode 1
- Laden Sie die drei verschiedenen Bildgebungsmodalitäten in die MATLAB-App. Legen Sie einen großzügigen Begrenzungsrahmen um die Kontrastverstärkung des T1-gewichteten MRT-Scans (Abbildung 1). Bestimmen Sie die kontrastverstärkte Lautstärke mithilfe eines Schwellenwerts (Abbildung 2). Wenn mehrere Regionen ausgewählt wurden, wählen Sie nur das größte Volumen aus, dessen Zentrum als das erste Isozentrum betrachtet wird, das eine vorgeschriebene Dosis für RT abgibt (Abbildung 3).
- Erweitern Sie die zuvor ermittelte MRT-Kontrastverstärkung um 10 Pixel in jede Richtung. Wenn mehrere Regionen erkannt werden, behalten Sie nur das größte PET-Volumen bei, dessen Zentrum als das zweite Isozentrum angesehen wird, das eine vorgeschriebene Dosis für RT liefert.
HINWEIS: In diesem PET-Volume wird das PET-Boost-Volumen durch die Pixel mit einer höheren Signalintensität als 0,90 × maximalen Signalintensität (im Begrenzungsrahmen) in diesem Volume definiert. - Verwenden Sie die folgenden Bestrahlungseinstellungen für die berechneten Isozentren (Abbildung 4 und Tabelle 1).
- Geben Sie für das erste Isozentrum (MRT) eine vorgeschriebene Dosis von 2000 cGy unter Verwendung von 3 nicht-koplanaren Lichtbögen an den Couchpositionen 0 °, -45 ° und -90 ° mit einer Gantry-Rotation von 120 °, 120 ° bzw. 60 °. Verwenden Sie eine feste Kollimatorgröße von 10 x 10 mm, aber verwenden Sie einen geeigneten Kollimator (z. B. einen 5 x 5 mm Kollimator), wenn kleinere Tumorgrößen bestrahlt werden müssen. Achten Sie darauf, das Wohlergehen des Tieres zu berücksichtigen, wenn das Tumorvolumen größer als 10 mm ist.
- Geben Sie für das zweite Isozentrum (PET) eine vorgeschriebene Dosis von 800 cGy unter Verwendung von 3 nicht-koplanaren Bögen an den Couchpositionen 0 °, -45 ° und -90 ° mit einer Gantry-Rotation von 120 °, 120 ° bzw. 60 °. Verwenden Sie eine feste Kollimatorgröße von 3 x 3 mm.
- Berechnen Sie die Dosisverteilung innerhalb des Tieres und die Strahlabgabeparameter.
- Methode 2
- Laden Sie die drei verschiedenen Bildgebungsmodalitäten in die MATLAB-App. Platzieren Sie einen großzügigen Begrenzungsrahmen um die Kontrastverstärkung auf dem [18F]FET-PET-Bild, analog zu Schritt 5.1.1.
- Bestimmen Sie die von den Pixeln definierten Volumina mit einer Signalintensität von mehr als A × maximaler Signalintensität (im oben genannten Begrenzungsrahmen), wobei A gleich 0,50, 0,60, 0,70, 0,80 und 0,90 ist. Nennen Sie diese Volumes V50, V60, V70, V80 bzw. V90.
- Bestimmen Sie die Isozentren und die Backenabmessungen für jeden Balken, der zur Führung des motorisierten variablen Kollimators erforderlich ist, mit dem MATLAB-Skript (siehe Abbildung 5).
- Verwenden Sie die folgenden Einstellungen für die berechneten Isozentren und Backenabmessungen:
- Geben Sie für V50 eine vorgeschriebene Dosis von 2000 cGy an, verteilt auf 16 Balken (je 125 cGy; Liege- und Portalpositionen in Tabelle 2). Verwenden Sie die berechneten Backenabmessungen für den MVC.
HINWEIS: Hier wurde ein zusätzlicher Rand von 1 mm hinzugefügt, um die mikroskopische Tumorinfiltration zu berücksichtigen. - Geben Sie für V60-V90 eine vorgeschriebene Dosis von 800 cGy an, verteilt auf 40 Balken (je 20 cGy; Couch- und Portalpositionen in Tabelle 2). Verwenden Sie die berechneten Backenabmessungen für den MVC.
- Geben Sie für V50 eine vorgeschriebene Dosis von 2000 cGy an, verteilt auf 16 Balken (je 125 cGy; Liege- und Portalpositionen in Tabelle 2). Verwenden Sie die berechneten Backenabmessungen für den MVC.
- Berechnen Sie die Dosisverteilung innerhalb des Tieres und die Strahlabgabeparameter.
6. Evaluierung planen
HINWEIS: Um die beiden Methoden zu vergleichen, berechnen Sie die Dosis-Volumen-Histogramme (DVH) und Q-Volumen-Histogramme (QVH) im V50-PET-Volumen. Hier kam ein selbst entwickeltes MATLAB-Skript zum Einsatz. Den Code finden Sie auf Github unter https://github.com/sdonche/DosePainting.
- Dosis-Volumen-Histogramm
- Erzeugen Sie DVH aus der Dosisverteilung, die aus dem SARRP erhalten wurde.
- Bestimmen Sie die maximalen, mittleren und minimalen Dosen aus dem DVH, indem Sie D10, D50 und D90 berechnen, wobei Dx für die erhaltene Dosis von x% des Volumens steht.
- Q-Volumen-Histogramm
- Berechnen Sie eine ideale Dosis für jedes Pixel mit Gleichung 1, einer linearen Interpolation zwischen der minimalen und maximalen Dosis, die proportional zwischen der minimalen PET-Intensität und der maximalen PET-Intensität innerhalb des Zielvolumens variiert, um eine ideale Dosiskarte zu erhalten.
- Berechnen Sie den Q-Wert Qp für jedes Pixel mit der folgenden Gleichung (Gl. 2):
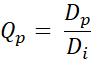 Gl. 2
Gl. 2
Wobei Dp die durch Planung erhaltene Dosis und Di das Dosisziel für die Planung ist. - Generieren Sie QVH aus den erhaltenen Q-Werten.
- Berechnen Sie den Qualitätsfaktor (Q-Faktor, QF), um die Differenz zwischen der geplanten und der beabsichtigten Dosis anhand von Gleichung 3 zu bewerten:
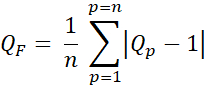 Gl. 3
Gl. 3
Ergebnisse
Die Durchführbarkeit einer PET- und MRT-gesteuerten Bestrahlung in einem Glioblastom-Rattenmodell unter Verwendung des SARRP zur Nachahmung der menschlichen Behandlungsstrategie wurde bereits beschrieben20,21,22. Während das Tier auf einem multimodalen Bett im eigenen Haus fixiert wurde, war es möglich, einen akzeptablen Strahlenbehandlungsplan zu erstellen, der drei Bildgebungsmodalitäten kombiniert: PET, MRT und CT. Bei di...
Diskussion
Zuvor wurde ein RATTEN-GB-Modell zur Nachahmung der Chemotherapie in der Klinik für Glioblastom-Patienten beschrieben20. Ähnlich wie bei der klinischen Methode wurden CT und MRT während des Behandlungsplanungsprozesses kombiniert, um eine präzisere Bestrahlung zu erhalten. Ein multimodales Bett zur Minimierung der (Kopf-) Bewegung wurde verwendet, wenn das Tier von einem Bildgebungssystem zum anderen bewegt wurde. Anschließend wurde die PET-Bildgebung in den Behandlungsplanungsprozess aufgeno...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken der Lux Luka Foundation für die Unterstützung dieser Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | - | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | - | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | - | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | - | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | - | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | - | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain - Mouse Whole Body Volumecoil | Bruker Biospin | - | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | - | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referenzen
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten