Method Article
秀丽隐杆线虫运动障碍评估 肌萎缩性侧索硬化症模型
摘要
该协议描述了两种敏感的检测方法,用于区分肌萎缩性侧索硬化症秀 丽隐杆线虫 模型中的轻度、中度和重度运动障碍,通常适用于运动改变的 秀丽隐杆线虫 菌株。
摘要
神经退行性疾病肌萎缩性侧索硬化症(ALS)的特征是运动神经元的进行性丧失,伴有肌肉无力和运动障碍,随着时间的推移而恶化。虽然在确定一部分患者的ALS遗传驱动因素方面取得了相当大的进展,但大多数病例的病因尚不清楚。此外,运动神经元功能障碍和退化的潜在机制尚不清楚;因此,需要不断开发和表征代表性模型来研究这些过程。 秀丽隐杆线虫 可以使其运动适应周围环境的物理限制,在实验室环境中研究了两种主要的运动范式 - 在固体表面上爬行并在液体中游泳。这些代表了感觉,运动神经元和肌肉之间的复杂相互作用。ALS 的秀丽隐杆线虫 模型可以在这些运动范式中的一种或两种表现出损伤。该协议描述了两种用于评估 秀丽隐杆线虫运动性的灵敏测定:优化的径向运动测定法测量固体表面上的爬行情况,以及用于跟踪和分析液体游泳(暴击)的自动化方法。除了表征ALS模型的基线运动损伤外,这些测定还可以检测遗传或小分子干预对表型的抑制或增强。因此,这些方法对于研究ALS模型和任何表现出运动改变的 秀丽隐杆线虫 菌株具有实用性。
引言
肌萎缩性侧索硬化症(ALS)是一种使人衰弱的,与衰老相关的神经退行性疾病,对运动神经元有特别的影响。该病的特征是大脑和脊髓中的运动神经元丧失以及进行性运动障碍。这会导致严重的功能障碍和过早死亡,通常在诊断后 3-5 年内1。至少38个基因的突变可引起ALS;然而,大多数ALS患者在神经元和神经胶质细胞中积累了泛素化的TDP-43蛋白包涵体作为其主要病理学2,3,4。已经开发了许多动物模型来研究导致或促成 体内 ALS的潜在机制(在5中回顾)。 在 秀丽隐杆线虫中, 这些模型包括ALS致病基因同源物中的遗传功能丧失突变或人类ALS基因的转基因表达。在 秀丽隐杆线虫中对 ALS 进行建模有许多优点。 秀丽隐杆线虫 是一种易于处理的简单动物,具有分化的神经系统,具有良好的行为范式特征,并且与人类具有相当大的遗传同源性6,7。存在许多用于与 秀丽隐杆线虫合作的工具,包括强大的基因组编辑能力,神经变性的 体内 荧光报告基因,RNAi筛选范式,可处理的遗传学以及已建立的行为和表型测定。ALS的 秀丽隐杆线虫 模型概括了人类疾病的各个方面,包括不溶性蛋白的积累,神经变性和早逝8,9。此外,许多 秀丽隐杆线虫 ALS 模型中都存在以爬行和游泳行为障碍为特征的运动功能障碍。
该协议描述了表征 秀丽隐杆线虫 运动表型的两种方法:用于评估固体表面爬行的径向运动测定和使用WormLab自动跟踪和分析评估液体游泳(暴击)。这些表征运动缺陷的灵敏方法允许比较严重程度,并为测量运动表型的抑制和增强提供了工具。径向运动测定可量化蠕虫种群之间爬行运动(固体表面上的正弦运动)的差异。该测定利用 秀丽隐杆线虫 的自然未受刺激的探索行为,将蠕虫放置在板上的单个位置,并在给定的时间段后标记其最终位置10。或者,在液体中游泳(打捻)测定在设定的时间段内计算单个蠕虫的身体弯曲。人眼对身体弯曲的手动计数是耗时的,并且通常在实验者之间表现出相当大的差异。使用计算机辅助的自动跟踪和分析可以消除大部分这种可变性。除了表征ALS模型的基线运动损伤外,径向运动和游泳测定都可以从遗传或小分子干预中检测出不同运动表型的调节。这些方法对于研究ALS模型和任何表现出运动改变的 秀丽隐杆线虫 菌株具有实用性。
研究方案
1. 径向运动测定
- 准备直径为100毫米或150毫米的培养皿,大约一半充满线虫生长培养基(NGM),并用均匀的OP50细菌草坪播种以覆盖琼脂的整个表面。
- 将NGM测定板倒置,并在底部标记要测定的 秀丽隐杆线虫 菌株的标识符,每个菌株2个板(图1A)。
- 用倒置板中心的标记做一个小点(图1A)。
- 在使用解剖显微镜时,使用铂线拾取将15-20个分阶段匹配的11蠕虫直接转移到中心点(通过NGM可见)上的测定板的中心(图1B)。
注意:尝试同时或尽快转移所有蠕虫。- 将蠕虫放置在板的中心后,设置计时器30分钟。将盖子放回板上并将其放在一边(图1C)。
- 继续转移蠕虫,直到所有菌株都在指定的测定板上,记下在板之间转移大约需要多长时间(目标是在板之间转移约1分钟)。保持所有板的设置顺序相同。
- 30分钟后,开始得分第一盘。
- 取下盖子,将板面朝下放在解剖显微镜下,使得标记的板背面朝上,NGM琼脂位于视线和蠕虫之间。盘子将从正常使用中倒置。
- 调整显微镜焦点,直到通过琼脂看到蠕虫。
- 使用不同颜色的毡尖笔从中心点开始,在每条蠕虫的位置放一个小点 - 沿着蠕虫的踪迹穿过细菌草坪,找到最远端的动物。
- 检查板的边缘,因为一些蠕虫可能会在那里结束。此外,计算并记录中心点中的蠕虫数量(图1D)。
- 继续按顺序标记所有测定板,使所有板都有30分钟的活性时间,并注意设置板所需的时间。然后,按照步骤1.8或1.9中所述执行手动或数字测量。
- 使用尺子进行手动测量。
- 使用尺子测量毫米,从中心点到每个蠕虫的最终位置标记的距离并记录距离。为了帮助跟踪评分过程中的进度,请使用小标记线标记第一个得分点。
- 通过顺时针旋转板连续记录每个点的长度数据(图1E)。
- 使用扫描仪和 ImageJ 执行数字测量。
- 使用平板扫描仪,扫描标尺旁边的测定板背面(面向扫描表面的数字)(图2A)。
- 在 ImageJ 或类似程序中打开扫描的板图像。
注意:ImageJ是由NIH托管的基于Java的免费图像处理软件。 - 单击 直线工具, 然后绘制一条线,连接标尺扫描图像上的1厘米和2厘米点(图2B)。
注:按住 Shift 计算机键将强制将线路置于最近的 45° 角度。 - 导航到" 分析 "菜单并使用它来设置比例("分析|设置比例)(图2C)。
- 在相应的框中输入 "已知距离 (10)"和 "长度单位 (mm)",不要调整距离(以像素数表示)。选中 "全局 "以将相同的比例应用于每个 ImageJ 会话中正在分析的所有图像;否则,请在打开时设置每个图像的比例(图2D)。单击" 确定"。
注:执行步骤1.9.2-1.9.5以设置测量比例。现在,此图像的测量值将自动将线的长度与定义的像素:长度关系相关联。以 300 dpi 扫描的图像将具有每毫米 11.8 像素的近似关系。 - 使用 画笔工具 在要得分的第一分上方进行标记。
注意:这是第一个已评分蠕虫的视觉指示器。 - 使用 直线工具 绘制一条从中心点到第一个蠕虫数据点的线。
- 单击键盘上的 M 键以测量距离。或者,导航到" 分析 "菜单,然后选择" 测量 (分析|测量)。在这两种情况下,测量都将出现在新窗口中;此窗口将收集每个图像的所有测量值。
- 保持中心点恒定,将接触第一个蠕虫点的线的末端移动到下一个蠕虫点,顺时针移动,然后单击 M 键进行测量。
- 继续以顺时针方向测量每个点,直到所有点都得分。
-
将 长度测量数据复制并 粘贴 到电子表格中以保存。然后,对每个扫描的板图像重复该过程。
注:步骤1.9.6 - 1.9.11测量蜗杆位移值(图2E-F)。
- 执行统计分析。
- 在单个实验中合并重复,使总得分数在30-40个蠕虫之间。
- 在不同的日子和独立的蠕虫群中执行独立的实验重复,最终得到3个独立的实验重复。
- 使用适当的统计分析分析数据,例如 2 个菌株的学生 t 检验或 3 个或更多菌株的单因子方差分析。
2. 计算机分析游泳检测
注:此协议包含市售 WormLab 硬件和软件系统的详细说明(请参见 材料表)。但是,该工作流程可以应用于其他计算机分析的游泳测定系统。
- 设置和录制视频。
- 抬起成像硬件上的屏蔽层(图3),并验证相机高度是否设置为预期位置。
注:在 35 mm 板上捕获蜗杆的最佳高度是,可调节摄像机安装支架下方的第三个螺纹螺钉孔可见,但在螺钉孔上方(载物台上方约 30.5 cm)看不到额外的安装孔(图 3C)。这将导致捕获比为11.43μm /像素。考虑添加"正确高度"指示剂,以便在开始测定之前更容易确认。请参阅协议步骤 2.18 以考虑高度调整。 - 打开相关软件(补充图1A)。
- 单击" 视频捕捉" 图标(中间带有右指向三角形的胶片)以打开新的 "视频捕捉" 窗口。相机将处于 实时取景中,但显示屏将为黑色(补充图1B)。
- 按下调光旋钮,然后顺时针旋转以调节灯光。
注:调光旋钮位于成像系统舞台上,靠近明场光源。 视频捕捉 实时取景显示屏将从黑色变为亮起。 - 返回" 视频捕捉 "窗口,单击 "设置" 选项卡,按如下方式进行调整: 视频模式: 2456 x 2052_Mono8, 帧速率: 14, 输出: 单色, 曝光: 0.00300 s, 增益: 1 dB , 伽玛: 1, 旋转 180 (选中)。
- 移回 "捕获 "选项卡。选择录制文件夹(补充图1B)。
注意:这是存储所有录制文件和项目文件的位置。为各个实验创建唯一的文件夹,以保持数据井井有条。 - 通过将文件名输入到 "文件前缀 "文本框中来分配文件名。
注意:软件将自动在前缀末尾附加一个渐进数字,格式为"0001"。建议对文件使用一致的命名方案,例如:"YYYYMMDD_treatmentName_rep#_"。 - 按如下方式设置其他 捕获 设置: 缓冲区:128 帧(默认), 持续时间 (选中):00 h:01min:00 s。忽略或关闭此选项卡中的其他设置。
- 将测定板,盖子放在设备台上,并将其置于 视频捕获 屏幕的中心;取下盖子。
注意:提前准备测定板。每个板由一个35毫米的培养皿组成,大约一半装满了未播种(无细菌草坪)NGM。 - 使用微量移液管将1 mL M9中的载物台同步11 蠕虫洗涤到测定板上 - 目标是约50个蠕虫(图3D)。轻轻旋转板将动物带到中心,或使用微量移液器将几滴M9添加到单独的动物中(图3E)。将计时器设置为60秒,以使蠕虫适应游泳。
注:该印版在屏幕上不会 100% 可见。重叠时无法准确跟踪动物。 - 在计时器倒计时时,通过在观看显示屏时转动相机镜头主体上的对焦环来手动调整相机对焦(图3F)。可以使用滚轮鼠标放大蠕虫,从而实现更精确的对焦。
- 设置焦点后,调整光旋钮,使显示屏尽可能明亮而不会过度曝光(在显示屏上显示为红色像素)。
- 60 秒后,按" 录制 "按钮。
注意:视频将从 实时取景 转到 录制 ,并且计时器将可见。捕获完成后, 视频捕获 显示将返回到 实时取景 (补充图 1B)。 - 录制后取出印版并设置下一个印版。根据需要重命名前缀。将蠕虫洗入测定板中,孵育60秒,并记录每次处理。
- 完成实验的所有录制后,关闭所有打开的视频选项卡,然后通过按下调光器旋钮关闭光源。
- 通过单击窗口右上角的红色x按钮关闭视频捕获窗口;或者,关闭整个软件包并重新打开。
- 准备视频以进行跟踪。
- 从 "工作流" 侧边栏菜单中,选择此菜单上的第一个按钮" 导入图像序列",然后查找并双击视频。视频将在中间窗口中打开(补充图2A)。
注意:软件的默认显示是工作流侧边栏菜单;此菜单也可以通过视图 [视图|下的视图顶部下拉菜单访问工作流]。工作流菜单有几个视图选项;"跟踪"视图在协议中的此时是合适的。如果"设置序列信息"按钮在菜单中不可见,则这不是正确的视图。首先,查看菜单的底部并检查"工作流"选项卡是否处于活动状态,接下来,通过单击"跟踪"图标检查"查看是否处于活动状态。菜单在窗口中的显示位置取决于监视器大小和其他打开的菜单的位置。可以通过拖放、调整大小和关闭来移动菜单。大多数菜单也可以通过视图下拉菜单打开。 - 从"工作流"菜单中,选择" 设置序列信息"(补充图 2B)。在新菜单窗口中,检查命名方案、添加注释和验证元数据。
- 检查缩放设置是否正确; 比例:11.43 μm/像素, 测量 将自动填充,因为 1000 μm 为 87 像素。如果照相机高度的调整与此处规定的不同,请按照此菜单中的说明更新刻度。单击 保存 按钮。
- 在"工作流"菜单中,选择" 调整图像",将打开一个名为" 图像调整 "的新弹出菜单(补充图 2C)。选择 浅色背景上的深色蠕虫(亮场) 。
- 调整其他设置。推荐 的图像处理设置 如下: 背景平滑:10, 高斯平滑:5, 填充孔:2, 小对象滤镜:0,并跳过 积分导数分割。
- 调整 阈值 级别,使动物完全充满绿色,但仍与背景不同。单击" 应用"。
注意:允许捡起一些不是蠕虫的物体。 - 从 "工作流 "菜单中,选择" 检测并跟踪 (附图 2D)"。
注意:视频的侧面将出现一个菜单,其中包含3个选项卡:" 检测"、" 跟踪"和" 修复"。光标在视频显示屏上时看起来像一个指向手指。或者,单击软件左上 角图标菜单中 的选择图标(光标箭头)。- 使用手指选择器工具选择 3-7 个蠕虫,然后单击"检测"选项卡中的"检测蠕虫"按钮。
注意:此选择有助于软件在给定条件下准确识别蠕虫,并且必须针对每个视频进行选择。几秒钟后,大多数蠕虫将以绿色突出显示,并以黄色显示数字。正在接触或蜷缩的蠕虫可能不会突出显示;但是,程序很可能会在跟踪过程中找到它们。有一个选项可以调整检测参数;但是,默认值在大多数情况下都可以正常工作。如果对检测参数进行了调整,请确保样品和重复项之间保持一致。
- 使用手指选择器工具选择 3-7 个蠕虫,然后单击"检测"选项卡中的"检测蠕虫"按钮。
- 仍在 "检测并跟踪 "窗口中,移动到" 跟踪 "选项卡(补充图 2E)。在 跟踪参数 选中 使用回溯,取消选中 跟踪图像边缘的蠕虫。
- 将 最大跟踪假设 设置为 5。将 跟踪模式 设置为 游泳。
注意:Max 跟踪假设设置可调整允许单个跟踪蠕虫的潜在蠕虫轨迹数量,并为程序在不丢失对单个蠕虫的跟踪方面准确跟踪该蠕虫的准确度留出一些余地。5是游泳的好地方。 - 移至 "高级设置" 部分并设置以下内容: 帧蠕虫可以接触边界:50, 帧蠕虫可以重叠:500, 位置容差:0.50, 形状容差:0.50。保存这些设置,并通过将其另存为配置来为实验(及更高版本)中的所有视频部署这些设置。
注意:不建议使用 跟踪过滤 ,可以很容易地进行后期处理,请离开。 - 导航到左上角图标菜单中的 配置管理器 (齿轮图标)。单击后,将打开 配置管理器 侧边栏菜单。接下来,单击 保存(齿轮 +)图标,为此配置提供名称和说明,然后单击 确定 按钮。
- 要在将来访问此配置,请打开 "配置 "菜单,选择所需的配置,然后单击 "加载 (向上加速箭头)"图标。然后添加序列信息,可能微调阈值级别,并选择蠕虫进行检测。所有其他设置将相同。
- 在" 工作流 "菜单中,单击" 保存项目",验证保存位置并添加项目文件名(将项目文件名与视频名称匹配有助于保持连续性)。关闭视频。
注意:这些项目以 .wpr 文件类型保存。 - 对所有视频重复此操作:导入图像序列 (2.18)、加载已保存配置 (2.28.1)、调整阈值 (2.23)、设置序列信息 (2.19)、检测蠕虫 (2.24.1)、保存项目 (2.29)、关闭视频。
- 跟踪视频
- 要跟踪项目文件,请转到 "工作流 "菜单,然后单击" 批处理 (包含蠕虫页面的文件夹)"图标(补充图 2F)。
注:将显示 "批处理 "面板(附图2G)。有时它是隐藏的,但可以在 批处理工作流 菜单的最底部访问;窗口可能需要展开才能看到它。 - 单击此批处理菜单的"文件选择"部分下的"添加"按钮。导航到并选择要处理的所有项目文件 (.wpr),单击"打开"。
注意:"批处理"菜单将填充所选文件路径、状态指示器和每个文件的灰色进度条。 - 单击 "开始" (播放按钮图标)。请注意第一个文件上的绿色进度指示器。允许处理所有文件。当所有文件读完(绿色)时,软件可以关闭(补充图2G)。
- 如果项目文件卡住,请考虑单独运行挂起的文件,这通常可以解决问题。如果这不能解决问题,请打开项目文件,删除选定的蠕虫("检测 和 跟踪 "菜单),然后从新的训练集中重新选择。然后重新处理项目文件。
- 要跟踪项目文件,请转到 "工作流 "菜单,然后单击" 批处理 (包含蠕虫页面的文件夹)"图标(补充图 2F)。
- 修复轨道(推荐)
注:修复磁道可以提高磁道的精度。常见的修复方法是合并明显属于人眼所查看的同一蠕虫的轨道,删除不准确或无法捕获真实蠕虫数据的轨道,以及拆分由于蠕虫接触而被歪曲的轨道(删除坏部分,如果可行,合并不良部分之前和之后的轨道)。- 打开软件并打开项目文件[文件|打开感兴趣的项目]。单击 打开 ,然后单击 是 以使用此文件。等待加载时态筛选器。处理后的视频将在屏幕上显示;蠕虫将以绿色突出显示,并以黄色勾勒出轮廓。使用视频播放器浏览或播放视频。
- 从 "工作流 "菜单中,选择" 检测并跟踪 (附图 2D)"。切换到" 修复 "选项卡。通过单击 选择器 工具图标(光标箭头)激活 选择器 光标。浏览视频,查找并选择蠕虫轨迹,然后使用修复菜单创建所需的更改。
注意:要从战略上快速解决大多数问题,请放大以使大约1/6的 板块可见,从轨道#1周围的区域开始。快速浏览视频,检查神秘出现的蠕虫,跟踪数字变化的地方,或者蠕虫相互碰撞,在出现问题时进行编辑。从起始位置开始按数字顺序跟踪蠕虫。根据需要来回擦洗以跟踪每个蠕虫,直到整个板被修复。仔细注意板材的边缘;通常,假蠕虫出现在板边缘的阴影中。
- 数据分析
- 从 "工作流 "菜单中,选择" 分析数据" (补充图 3A)。
注:将出现一个名为" 数据分析和绘图" 的新窗口(补充图3B)。此窗口有多种方法可以评估和查看特定项目文件的蠕虫种群的移动数据。这些分析中的大多数都允许从给定视频中选择特定,多个或所有蠕虫,从而允许以不同的方式绘制轨迹信息。 - 要分析转弯数,请导航到 "轨迹摘要"[位置和速度|曲目摘要](补充图3C)。使用右下角的" 导出 "按钮以电子表格可读格式(.csv)导出数据,选择电子表格所需位置的路径,包括将其重命名为令人难忘的内容。默认设置是一个不错的选择(补充图3D)。
- 将此数据以及任何其他相关项目数据集粘贴到合并的电子表格工作簿中(补充图 3E)。
- 使用电子表格函数(= 转弯 次数/ 赛道 持续时间 * 60)计算每个赛道的每分钟转弯数,或者根据需要使用不同的指标(补充图3F)。
注意:每分钟匝数捕获的信息与手动打扫测定非常相似,手动打斗测定是液体中广泛使用的活性指标,但有很多选择,并且很可能不同的指标可以识别给定处理或比较的其他有趣数据。 - 如果需要,请使用条件格式工具筛选蠕虫大小、跟踪持续时间和/或其他一些选定的指标,以突出显示要删除的轨道(如果它们可能混淆)。在处理和重复之间保持一致的数据处理。
- 使用适当的统计分析分析数据,例如 2 个菌株的学生 t 检验,或 3 个或更多菌株的单因素方差分析。在不同日期和独立蠕虫群中进行独立实验重复,至少进行3次独立实验重复。
- 从 "工作流 "菜单中,选择" 分析数据" (补充图 3A)。
结果
径向运动和游泳测定都提供了对运动障碍的灵敏检测(图4和图5)。为了研究ALS中病理性TDP-43的潜在机制,已经开发了秀丽隐杆线虫模型,该模型以全神经元方式表达野生型或ALS突变型人TDP-43。这些动物表现出让人联想到ALS的分子和细胞特征,包括运动功能障碍9。重要的是,它们表现出中度运动障碍,表达野生型人TDP-43,并且在使用桡向运动和游泳测定表达ALS突变TDP-43的动物中表现出更严重的运动障碍。一些突变或转基因动物的爬行障碍比游泳更大,反之亦然。通过使用两种不同的运动测定,可以更清楚地了解菌株之间的表型差异。
径向运动
当被放置在播种的琼脂平板上时,秀丽隐杆线虫会探索周围的环境,包括寻找食物来源的边界。径向运动测定是利用该行为作为身体健康状况指标的一种方法。通过以受控和可量化的方式分析运动行为(在固体表面上爬行),径向运动测定为评估运动缺陷和其他运动相关表型的严重程度提供了一种简单有效的工具。桡骨运动测定可捕获中度或重度受损ALS模型蠕虫的运动差异,并提供基线来比较运动表型的调节或运动随年龄的变化(图6)。该策略可用于量化任何改变野生型(N2)或对照蠕虫运动的菌株的爬行行为。然而,这种方法可能不是评估无法正常爬行的动物的好选择,例如滚轮突变体或瘫痪的动物。通常,野生型蠕虫在20°C下升高和测试时,平均位移在200-300μm/min之间。 图4中提供的示例数据显示了N2的预期结果,N2是两种表达野生型人TDP-43的不同转基因菌株,具有轻度表型[TDP-43(WT-mild),CK402(bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])]或更强的表型[TDP-43(WT-中度),CK410(bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])],一种表达突变人TDP-43的转基因菌株,具有严重的表型[TDP-43(M337V),CK423(bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]),以及一种表达另一种神经退行性疾病相关蛋白的转基因菌株,野生型人tau[tau(WT),CK144(bkIs144[Paex-3::tau(4R1N);Pmyo-2::GFP])])。表达野生型TDP-43的两种菌株具有通过径向运动检测到的不同程度的损伤。TDP-43(WT-low)与N2没有显着差异,而TDP-43(WT-high)在运动性方面表现出明显的差异。TDP-43(M337V)和tau(WT)菌株的运动性损伤更严重。
游泳检测
秀丽隐杆线虫在浸泡在液体中时会进行典型的游泳(摔跤)运动。在淹没后,蠕虫立即开始特征性地将头部和尾巴相互弯曲,弯曲角度约为45°,角度顶点是蠕虫的中点。蠕虫在腹侧和背侧方向交替弯曲。由软件测量的一次撞击表示从直线到20°或更大的身体弯曲角度的运动,而不管方向性如何(角度阈值可以在分析和绘图窗口中进行后处理调整 [Workflow |分析数据|体型|弯曲角度|中点|振幅阈值:# 度]。这里描述的游泳测定使用基于计算机的自动跟踪和分析来提供游泳活动的无偏倚评分。预计野生型(N2)蠕虫在20°C下升高和记录时,平均每分钟将进行150-200次暴击。 图5中提供的示例数据显示,N2是两种表达野生型人TDP-43的不同转基因菌株,具有轻度表型[TDP-43(WT-mild),CK402(bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])]或更强的表型[TDP-43(WT-中度),CK410(bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])],以及一种表达另一种神经退行性疾病相关蛋白的转基因菌株,野生型人tau[tau(WT),CK144(bkIs144[Paex-3::tau(4R1N);Pmyo-2::GFP])])。表达ALS突变体TDP-43 [TDP-43(M337V)]的转基因菌株不会在液体中暴动,因此在图表上表示为ND(无数据)。该测定可以区分与图4所示的径向运动测定不同的表型。例如,在径向运动测定中(图4),TDP-43(WT-low)与N2没有显着差异。然而,在游泳测定中(图5),TDP-43(WT-low)和TDP-43(WT-high)都与N2显着不同,并且彼此显着不同。此外,尽管TDP-43(M337V)和tau(WT)都因径向运动而具有严重的爬行障碍(图4),但只有tau(WT)能够被软件跟踪(图5)。TDP-43(M337V)动物无法暴击,基于软件的分析无法准确检测或跟踪这些蠕虫。因此,没有收集有关这些蠕虫的数据(ND,没有数据)。
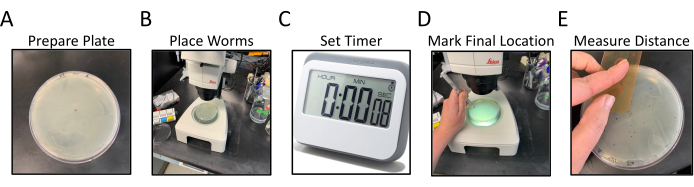
图1:径向运动测定工作流程。 图 A-E 显示了径向运动测定的广义步骤。步骤如下:(A)NGM板,OP50播种到边缘,通过标记和标记中心点来制备,(B)蠕虫放置在琼脂的中心,如中心点标记,(C)允许蠕虫自由移动一定时间,(D)板自下而上翻转,每个蠕虫的最终位置以与中心点不同的颜色标记, (E)从中心点到每个最终蠕虫位置的距离,用手或数字方式测量。 请点击此处查看此图的放大版本。
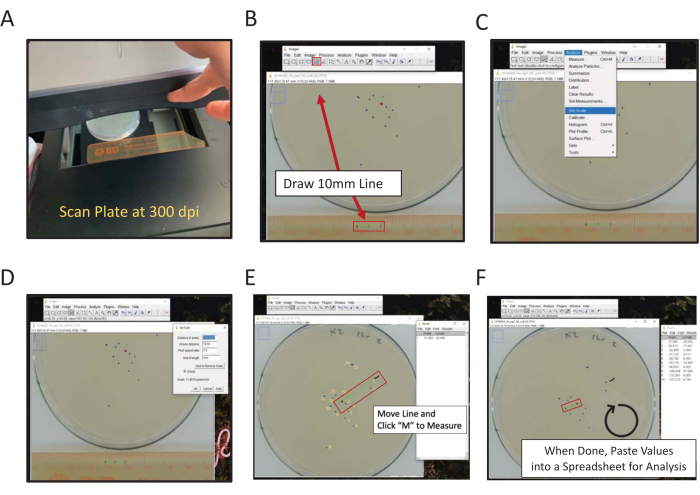
图 2:使用 ImageJ 对最终位置进行数字测量。 与中心测量的距离可以通过手动或数字方式测量,以使用图像J(A)扫描板的背面和框架中的标尺进行数字测量。(B) 使用线条工具绘制已知长度。(C) 使用(B)中绘制的已知长度来设置比例[分析|设置比例...]。(D)使用线条工具绘制一条从中心点到最终位置标记的线,对每个标记重复。(E) 标出第一个被测标记的画笔线有助于评分(1标记附近的波浪形黑线)。最终位置标记以黄色编号,以说明评分的方向性。(F) 测量结果记录在"结果"窗口中。将结果保存在其他位置以进行统计分析。 请点击此处查看此图的放大版本。

图3:使用软件的材料和硬件调整。 (A)用于软件辅助游泳测定的材料。(二)一般设置的软件和所需材料,注意外壳是否处于凸起位置。(C)镜头安装支架高度可调节。该图像显示了可调节的轨道和标记游泳测定的首选高度的胶带指示器。在录制之前,有必要调整明场光和相机焦点。(D)将35毫米的测定板放在载物台上,将M9中的动物加入板中,并启动1分钟计时器。(E)有时有利地轻轻旋转板以将蠕虫移动到更靠近中心的位置 - 在实时捕获屏幕上观察位置;或者,从移液器中滴几滴M9可用于分离蠕虫。(F)调整相机镜头上的对焦环,观察屏幕上的蠕虫以确定最佳对焦。 请点击此处查看此图的放大版本。
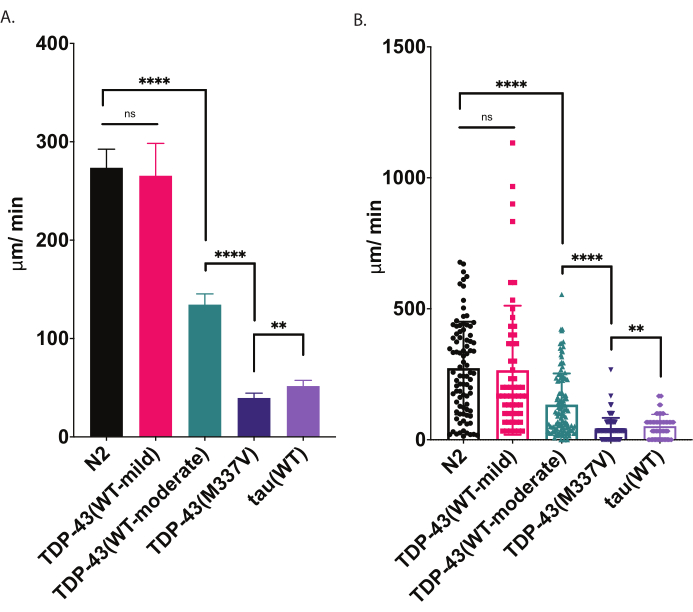
图4:径向运动测定检测爬行速度的差异。 使用上述径向运动测定法测量发育阶段L4幼虫的未刺激分散,并绘制为μm / min行进(A-B)。(A)和(B)中绘制的相同数据演示了两种不同的图形表示。在(A)中,数据显示为条形图,使菌株之间的相对差异更清晰。在(B)中,每个蠕虫的最终位移都分布在图中,从而可以更好地可视化种群内的变异。为了评估所测试菌株之间的显著性,使用Tukey多重比较检验的单因素方差分析(方差分析)。**p=0.0022,****p<0.0001,ns=不显著。TDP-43(M337V)和tau(WT)也与N2,p<0.0001有显着差异。(A) 中的误差线是平均值 (SEM) 的标准误差,(B) 中的误差线是标准差。 请点击此处查看此图的放大版本。
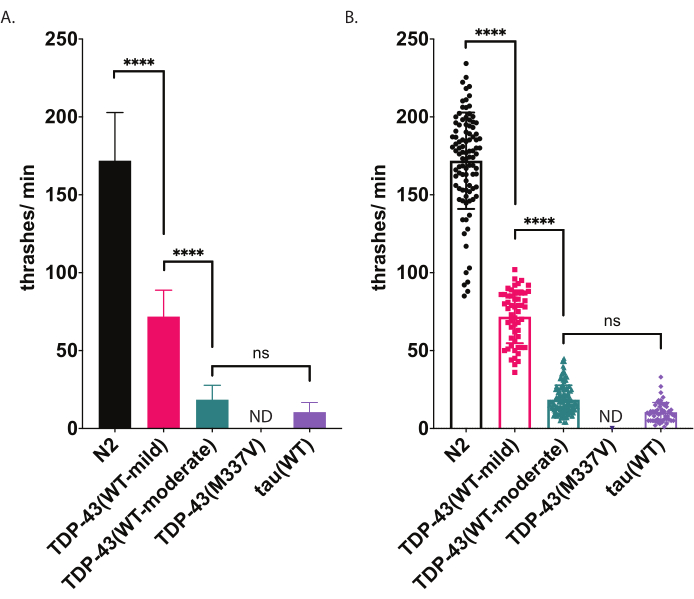
图5:游泳测定法检测液体中抖动的差异。 游泳速率(液体中的撞击或起伏频率)使用上述无偏倚的计算机辅助评分和分析进行测量,并绘制为击球/分钟(A-B)。(A) 和 (B) 中绘制的数据相同。 在(A)中,数据被绘制为条形图,这使得菌株之间的相对差异更容易看到。在(B)中,来自每个单独评分的蠕虫的数据绘制在图表中,从而可以更好地可视化种群内的变异。为了评估所测试菌株之间的显著性,使用Tukey多重比较检验的单因素方差分析(ANOVA)。p<0.0001,ns=不显著。TDP-43(WT-中等)和tau(WT)也与N2,p<0.0001显着不同.(A)中的误差条是平均值的标准误差(SEM),(B)中的误差条是标准偏差。 请点击此处查看此图的放大版本。
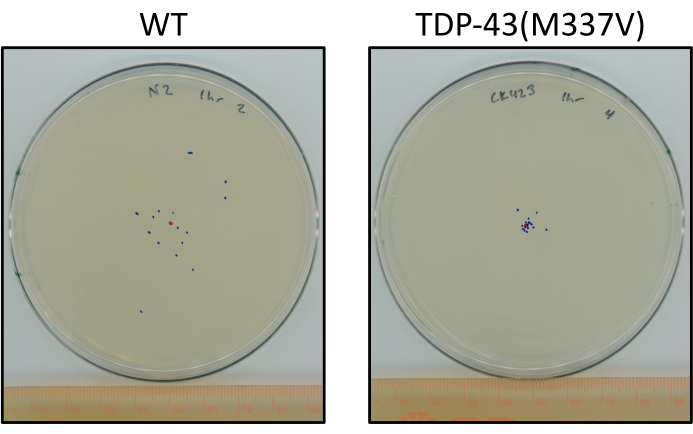
图 6:突变 TDP-43 蠕虫比野生型蠕虫传播得更少。 板块显示分期L4 N2(野生型)和TDP-43(M337V)的最终位置具有代表性差异(CK423(bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]),一种表达突变人TDP-43的菌株,在室温下未经刺激爬行1小时后,运动功能严重受损。板块用红点标记中心点,蓝点表示动物的最终位置。请点击此处查看此图的放大版本。
补充图1:使用成像和跟踪软件记录游泳行为。 (A)跟踪工作流程和视频捕获图标的位置。(B) " 视频捕捉 "窗口显示在 "实时取景"中, 并突出显示最重要的方面。激活录制按钮时,绿色的"实时视图"字词将更改为红色的"录制"。 请点击此处下载此文件。
补充图2:准备和跟踪游泳行为。此图显示了一系列屏幕截图,以帮助设置要跟踪的视频图像序列。准备视频序列的一般协议是按以下顺序打开每个工作流菜单:"导入图像序列"|设置序列信息|调整图像|检测和跟踪|保存项目。"分析数据"窗口只能在跟踪项目文件后使用。(A) 显示从"跟踪"工作流中将序列导入软件后打开的.avi(视频)文件。(B) "设置序列信息"窗口提供了一个位置,用于注释、设置/更改比例以及检查视频序列的元数据。有关更改刻度的说明,请参阅此窗口,在降低或升高相机时应遵循这些说明(B)。图像 (C) 显示"调整图像"窗口设置。(D) 显示"检测和跟踪"窗口的"检测"选项卡的屏幕截图。检测蠕虫用于训练软件,必须为每个视频序列进行设置。如果需要,可以在此处设置其他检测参数。(E) "检测和跟踪"窗口的"跟踪"选项卡的屏幕截图,其中包含跟踪游泳行为的建议设置。这是设置视频序列的最后一步。使用"保存项目"窗口将序列另存为项目。对每个视频序列重复这些步骤。可以将设置另存为配置,以减少工作负载并确保所有序列都被视为相同(不显示)。要跟踪项目文件以进行分析,请导航到批处理工作流。(F) 显示用于导航到"批处理"工作流的图标,(G) 显示批处理窗口,突出显示添加和开始按钮,并显示已跟踪的项目文件的预期外观。请点击此处下载此文件。
补充图3:游泳行为分析。 跟踪项目文件后,可以使用[文件|打开它打开项目]。蠕虫将以绿色显示,如 (A) 所示。通过擦除视频可以快速检查视频是否按预期进行处理,绿色突出显示将在擦洗时消失。"数据分析和绘图"窗口从" 分析数据" 工作流项中打开。(B) 显示"数据分析和绘图"窗口,其中"位置"视图处于打开状态(默认),所有轨迹均突出显示。数据点下方是一个图,显示每个突出显示的蠕虫的记录轨迹。轨迹汇总分析用于计算每分钟转弯数。(C-D) 显示曲目摘要报告和导出详细信息。(E-F)在电子表格中显示轨迹摘要以及如何计算每分钟匝数,即在此测定中测量的输出。 请点击此处下载此文件。
讨论
径向运动:
通过更改时间变量可以轻松控制该测定的分辨率。增加时间长度可以更容易地观察具有严重表型的动物之间的差异,从而识别细微的差异。然而,由于该测定法测量位移,如果测定时间延长过长,具有正常运动性的动物(例如N2)将移动到板的边缘,并且觅食行为将导致回溯。这将人为地减少对行进距离的测量。时间过长可能导致菌株之间的差异消失,特别是在运动表型不太严重的动物之间,因为动物均匀地分散在板上。缩短时间变量将防止更活跃的蠕虫找到板的边缘。此方法不跟踪每个蠕虫行进的总距离,而是将每个蠕虫的行进距离压缩为距板中心的线性距离。因此,它本质上不如记录单个蠕虫总轨道长度的方法可靠。然而,径向运动测定只需要很少的研究人员培训,使用大多数蠕虫实验室中常见的相对经济实惠的试剂,并且足够灵敏,可以产生显着且可重复的结果。对于更喜欢自动视频跟踪的实验室,之前已经建立了几种方法来跟踪和分析爬行运动12,或者可以更改本文中用于游泳测定的软件参数,以允许爬行检测和分析。
该实验通常一式三份的独立重复进行,每次复制一组30-40个蠕虫。每个复制被分成两个不同的100 mm或150 mm板,每个板有15-20个蠕虫。使用比建议的更多的蠕虫可能会使它难以有效地得分。总得分为 90+ 的人数足以确定轻度、中度或重度运动障碍的重要性。与评分菌株之间的时间一致对于准确性和可重复性至关重要。30分钟通常足够长,以建立中度至重度表型之间的差异,例如表达人类突变TDP-43的转基因菌株与野生型蠕虫相比(图4)。如果时间变量将延长,建议将板的尺寸从100 mm增加到150 mm。温度和湿度等环境因素会影响该测定,该测定通常在环境室温下进行,因此在比较重复时始终使用野生型(N2)对照很重要。此外,该测定可以测量一些在液体中不表现出正常游泳行为(暴击)的菌株的运动性,使其成为游泳测定的有用补充。
游泳检测:
使用成像和采集系统自动跟踪和分析蠕虫游泳,可以获得严格和无偏倚的数据。但是,在实验的初始设置过程中,需要在样品之间控制几个因素。这些包括开始记录之前适应液体的时间,环境条件(即温度,湿度)以及一致的光线和记录设置。在录制阶段,有几个功能有助于减少板之间的可变性。其中包括集成的轨道安装式摄像机和明场载物台,使录制视频在板之间保持一致,载物台周围的屏蔽可防止录制时的反射,眩光和空气流动,以及强大的软件包,可可靠地检测蠕虫并允许在视频后期处理中手动校正轨迹。在该协议中,将带有蠕虫的35 mm板的视频录制1分钟,然后使用软件包进行处理。处理后,手动校正跟踪可确保准确记录蠕虫行为,而不会混淆跟踪错误。转弯计数和跟踪持续时间数据用于确定每分钟转弯数作为最终读数。为了确保可重复性,在至少3个独立的重复实验中收集数据,每个实验对40-50只动物进行评分,以实现120-150只动物的总和最终数量。这个数字足以区分游泳行为与对照蠕虫的微小差异。一些蠕虫的运动缺陷太严重,无法通过游泳测定捕获。例如,如果将动物置于液体介质卷曲而不是执行预期的暴动反应,则该测定将不能准确记录这些运动,并且另一种运动测定,例如径向运动,可以更好地捕获这些运动缺陷。所提供的协议使用市售的成像系统(有关详细信息,请参阅 材料表 ),但其他蠕虫跟踪系统可能提供类似的实用程序,其中一些是开源的12。以前发布的方法描述了蠕虫暴击的手动评分13。虽然自动分析为每个单独的蠕虫生成了许多指标,但以每分钟撞击次数为单位测量的身体弯曲检测在实验之间提供了一致的结果,并且通过眼睛对蠕虫撞击的传统评分可以很好地跟踪。
披露声明
作者声明他们没有披露。
致谢
我们感谢审稿人的有益意见和建议。我们感谢Aleen Saxton,Brandon Henderson和Jade Stair出色的技术援助。我们感谢Brian Kraemer和Rebecca Kow协助开发这些检测方法。这些材料是VA普吉特海湾医疗保健系统的资源支持和设施使用的结果。这项工作得到了美国(U.S.)的资助。退伍军人事务部(VA)生物医学实验室研究与发展服务[向N.F.L.颁发的功绩审查#I01BX004044]
材料
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
参考文献
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。