Method Article
Valutazione della compromissione motoria in modelli di C. elegans di sclerosi laterale amiotrofica
In questo articolo
Riepilogo
Questo protocollo descrive due saggi sensibili per discriminare tra compromissione motoria lieve, moderata e grave in modelli di sclerosi laterale amiotrofica di C. elegans , con utilità generale per ceppi di C. elegans , con motilità alterata.
Abstract
La malattia neurodegenerativa sclerosi laterale amiotrofica (SLA) presenta una progressiva perdita di motoneuroni accompagnata da debolezza muscolare e compromissione motoria che peggiora con il tempo. Mentre sono stati fatti notevoli progressi nel determinare i driver genetici della SLA per un sottogruppo di pazienti, la maggior parte dei casi ha un'eziologia sconosciuta. Inoltre, i meccanismi alla base della disfunzione e della degenerazione dei motoneuroni non sono ben compresi; pertanto, vi è una continua necessità di sviluppare e caratterizzare modelli rappresentativi per studiare questi processi. Caenorhabditis elegans può adattare il loro movimento ai vincoli fisici dell'ambiente circostante, con due paradigmi di movimento primari studiati in un ambiente di laboratorio: strisciare su una superficie solida e nuotare nel liquido. Questi rappresentano una complessa interazione tra sensazione, motoneuroni e muscoli. I modelli di C. elegans della SLA possono mostrare compromissione in uno o entrambi questi paradigmi di movimento. Questo protocollo descrive due saggi sensibili per valutare la motilità in C. elegans: un saggio di locomozione radiale ottimizzato che misura la strisciatura su una superficie solida e un metodo automatizzato per tracciare e analizzare il nuoto nel liquido (thrashing). Oltre alla caratterizzazione della compromissione motoria al basale dei modelli di SLA, questi saggi possono rilevare la soppressione o il miglioramento dei fenotipi da interventi genetici o di piccole molecole. Pertanto, questi metodi hanno utilità per studiare i modelli di SLA e qualsiasi ceppo di C. elegans che presenta una motilità alterata.
Introduzione
La sclerosi laterale amiotrofica (SLA) è una malattia neurodegenerativa debilitante, correlata all'invecchiamento, con un particolare impatto sui motoneuroni. La malattia presenta perdita di motoneuroni nel cervello e nel midollo spinale e compromissione motoria progressiva. Ciò si traduce in grave disabilità funzionale e morte prematura, in genere entro 3-5 anni dalla diagnosi1. Mutazioni in almeno 38 geni possono causare la SLA; tuttavia, la maggior parte dei pazienti con SLA accumula inclusioni ubiquitinate della proteina TDP-43 come patologia primaria nei neuroni e nelle cellule gliali2,3,4. Un certo numero di modelli animali sono stati sviluppati per studiare i meccanismi sottostanti che causano o contribuiscono alla SLA in vivo (esaminato in 5). In C. elegans, questi modelli includono mutazioni genetiche di perdita di funzione negli omologhi di geni che causano la SLA o l'espressione transgenica di geni umani della SLA. Ci sono numerosi vantaggi nel modellare la SLA in C. elegans. C. elegans è un animale semplice trattabile con un sistema nervoso differenziato, paradigmi comportamentali ben caratterizzati e una notevole omologia genetica per l'uomo6,7. Esistono molti strumenti per lavorare con C. elegans, tra cui robuste capacità di editing del genoma, reporter fluorescenti in vivo di neurodegenerazione, paradigmi di screening RNAi, genetica trattabile e saggi comportamentali e fenotipici stabiliti. I modelli di C. elegans della SLA ricapitolano aspetti della malattia umana, tra cui l'accumulo di proteine insolubili, la neurodegenerazione e la morte precoce8,9. Inoltre, la disfunzione motoria con disturbi dei comportamenti di gattonare e nuotare è presente in molti modelli di SLA di C. elegans.
Questo protocollo descrive due metodi per caratterizzare i fenotipi motori di C. elegans : il test di locomozione radiale per valutare il crawling su una superficie solida e la valutazione del nuoto in liquido (thrashing) utilizzando il tracciamento e l'analisi automatizzati di WormLab. Questi metodi sensibili per caratterizzare i deficit motori consentono confronti di gravità e offrono strumenti per misurare la soppressione e i miglioramenti dei fenotipi motori. Il test di locomozione radiale quantifica le differenze nella motilità strisciante (movimento sinusoidale su una superficie solida) tra le popolazioni di vermi. Questo test sfrutta il comportamento naturale di esplorazione non stimolata di C. elegans posizionando i vermi in una singola posizione su una piastra e segnando la loro posizione finale dopo un determinato periodo di tempo10. In alternativa, il nuoto in saggi liquidi (thrashing) conta le curve del corpo dei singoli vermi per un determinato periodo di tempo. Il conteggio manuale delle curve del corpo da parte dell'occhio umano richiede molto tempo e in genere presenta una notevole variabilità tra gli sperimentatori. L'uso del monitoraggio e dell'analisi automatizzati assistiti da computer può eliminare gran parte di tale variabilità. Oltre alla caratterizzazione della compromissione motoria al basale dei modelli di SLA, sia la locomozione radiale che i saggi di nuoto possono rilevare la modulazione di fenotipi locomotori distinti da interventi genetici o di piccole molecole. Questi metodi hanno utilità per studiare i modelli di SLA e qualsiasi ceppo di C. elegans che presenta una motilità alterata.
Protocollo
1. Saggio di locomozione radiale
- Preparare piastre di Petri da 100 mm o 150 mm di diametro circa la metà piene di mezzi di crescita dei nematodi (NGM) e seminate con un prato uniforme di batteri OP50 per coprire l'intera superficie dell'agar.
- Capovolgere le piastre di analisi NGM ed etichettare il fondo con un identificatore per i ceppi di C. elegans da analizzare, 2 piastre per ceppo (Figura 1A).
- Crea un piccolo punto con il pennarello al centro della piastra capovolta (Figura 1A).
- Mentre si lavora con un microscopio di dissezione, trasferire 15-20 vermi abbinati allo stadio11 al centro della piastra di analisi direttamente sopra il punto centrale (visibile attraverso l'NGM) utilizzando un plettro a filo di platino (Figura 1B).
NOTA: provare a trasferire tutti i worm contemporaneamente o il più rapidamente possibile.- Impostare un timer per 30 minuti dopo che i vermi sono stati posizionati al centro della piastra. Rimettere il coperchio sul piatto e metterlo da parte (Figura 1C).
- Continuare a trasferire i vermi fino a quando tutti i ceppi sono sulle piastre di analisi designate, prendendo nota di circa quanto tempo ci vuole per trasferire tra le piastre (mirare a ~ 1 minuto tra le piastre). Mantieni tutte le piastre nello stesso ordine in cui sono state impostate.
- Dopo 30 minuti, inizia a segnare il primo piatto.
- Rimuovere il coperchio e posizionare la piastra a faccia in giù sotto il microscopio di dissezione, in modo tale che il retro etichettato della piastra sia rivolto verso l'alto e l'agar NGM sia tra la linea di vista e i vermi. La piastra sarà capovolta rispetto al normale utilizzo.
- Regolare la messa a fuoco del microscopio fino a quando i vermi sono visibili attraverso l'agar.
- Usando un pennarello di colore diverso dal punto centrale, metti un piccolo punto nella posizione di ciascun verme - segui le tracce del verme attraverso il prato batterico per trovare gli animali più distali.
- Controlla il bordo del piatto poiché alcuni vermi potrebbero finire lì. Inoltre, contare e registrare il numero di worm nel punto centrale (Figura 1D).
- Continuare a contrassegnare tutte le piastre di analisi in ordine, in modo che tutte le piastre abbiano 30 minuti di tempo di attività, facendo attenzione a tenere conto del tempo necessario per impostare la piastra. Quindi, eseguire misurazioni manuali o digitali come descritto nei passaggi 1.8 o 1.9.
- Eseguire misurazioni manuali utilizzando un righello.
- Utilizzare un righello per misurare in mm la distanza dal punto centrale ai contrassegni di posizione finale per ciascun worm e registrare la distanza. Per tenere traccia dei progressi durante il punteggio, etichetta il primo punto segnato con una piccola linea di marcatura.
- Registrare i dati di lunghezza per ogni punto consecutivamente ruotando la piastra in senso orario (Figura 1E).
- Eseguire misurazioni digitali utilizzando uno scanner e ImageJ.
- Utilizzando uno scanner piano, eseguire la scansione del retro delle piastre di analisi accanto a un righello (numeri rivolti verso la superficie di scansione) (Figura 2A).
- Aprire l'immagine della piastra scansionata in ImageJ o in un programma simile.
NOTA: ImageJ è un software gratuito di elaborazione delle immagini basato su Java ospitato dal NIH. - Fare clic sullo strumento Linea retta e quindi disegnare una linea che collega i punti da 1 cm e 2 cm sull'immagine scansionata del righello (Figura 2B).
NOTA: tenendo premuto il tasto Maiusc del computer si forza la linea all'angolo di 45° più vicino. - Passare al menu Analizza e utilizzarlo per impostare la scala (Analizza | Imposta scala) (Figura 2C).
- Immettere la distanza nota (10) e le unità di lunghezza (mm) nelle caselle appropriate, non regolare la distanza in numero di pixel. Selezionare Globale per applicare la stessa scala a tutte le immagini analizzate in ogni sessione ImageJ; in caso contrario, impostare la scala per ogni immagine all'apertura (Figura 2D). Fare clic su OK.
NOTA: i passaggi 1.9.2-1.9.5 vengono eseguiti per impostare la scala di misurazione. Le misurazioni per questa immagine ora correleranno automaticamente la lunghezza delle linee alla relazione pixel: lunghezza definita. Le immagini scansionate a 300 dpi avranno una relazione approssimativa di 11,8 pixel per mm. - Utilizzare lo strumento pennello per contrassegnare appena sopra il primo punto da segnare.
NOTA: si tratta di un indicatore visivo per il primo worm valutato. - Utilizzate lo strumento Linea retta per disegnare una linea dal punto centrale al primo punto dati worm.
- Fare clic sul tasto M sulla tastiera per misurare la distanza. In alternativa, passare al menu Analizza e scegliere Misura (Analizza | Misura). In entrambi i casi, la misurazione apparirà in una nuova finestra; questa finestra raccoglierà tutte le misure per immagine.
- Mantenendo costante il punto centrale, spostare la fine della linea toccando il primo punto worm sul punto worm successivo, spostandosi in senso orario e fare clic sul tasto M per misurare.
- Continua a misurare ogni punto in senso orario fino a quando tutti i punti non vengono segnati.
-
Copia e incolla i dati di misurazione della lunghezza in un foglio di calcolo per salvarli. Quindi, ripetere il processo per ogni immagine della piastra scansionata.
NOTA: i passaggi 1.9.6 - 1.9.11 misurano i valori di spostamento del worm (Figura 2E-F).
- Eseguire analisi statistiche.
- Combinare le repliche all'interno di un singolo esperimento in modo che un numero totale segnato sia compreso tra 30-40 worm.
- Eseguire repliche sperimentali indipendenti in giorni diversi e con popolazioni indipendenti di vermi per finire con 3 repliche sperimentali indipendenti.
- Analizza i dati utilizzando analisi statistiche appropriate come il t-test di Student per 2 ceppi o ANOVA a 1 via per tre o più ceppi.
2. Test di nuoto analizzato al computer
NOTA: questo protocollo contiene istruzioni dettagliate per il sistema hardware e software WormLab disponibile in commercio (vedere Tabella dei materiali). Tuttavia, il flusso di lavoro può essere applicato ad altri sistemi di analisi del nuoto analizzati al computer.
- Impostazione e registrazione di video.
- Sollevare la schermatura sull'hardware di imaging (Figura 3) e verificare che l'altezza della fotocamera sia impostata sulla posizione prevista.
NOTA: l'altezza ottimale per l'acquisizione di vite senza fine su una piastra da 35 mm è tale che il terzo del foro della vite filettato inferiore è visibile sotto la staffa di montaggio della telecamera regolabile, ma non si vede alcun foro di montaggio aggiuntivo sopra il foro della vite (circa 30,5 cm sopra lo stadio) (Figura 3C). Ciò si tradurrà in un rapporto di acquisizione di 11,43 μm / pixel. Prendi in considerazione l'aggiunta di un indicatore di "altezza corretta" in modo che sia più facile da confermare prima di iniziare il test. Vedere il passaggio del protocollo 2.18 per tenere conto delle regolazioni in altezza. - Aprire il software associato (Figura supplementare 1A).
- Fai clic sull'icona Acquisizione video (pellicola con un triangolo rivolto a destra al centro) per aprire una nuova finestra Acquisizione video . La fotocamera sarà nella Vista Dal vivo, ma il display sarà nero (Figura supplementare 1B).
- Premere verso il basso sulla manopola del dimmer e ruotarla in senso orario per regolare la luce.
NOTA: la manopola del dimmer si trova sul palco del sistema di imaging vicino alla sorgente luminosa a campo luminoso. Il display live view di Acquisizione video passerà dal nero all'illuminato. - Di nuovo nella finestra Acquisizione video , fare clic sulla scheda Impostazioni , regolare come segue: Modalità video: 2456 x 2052_Mono8, Frequenza fotogrammi: 14, Uscita: monocromatica, Esposizione: 0,00300 s, Guadagno: 1 dB , Gamma: 1, Ruota 180 (check-on).
- Tornare alla scheda Acquisizione . Selezionare la cartella di registrazione (Figura supplementare 1B).
NOTA: qui verranno archiviate tutte le registrazioni e i file di progetto. Crea cartelle univoche per singoli esperimenti per mantenere i dati organizzati. - Assegnare un nome di file immettendolo nella casella di testo Prefisso file .
NOTA: il software aggiungerà automaticamente un numero progressivo alla fine del prefisso nel formato "0001". Si consiglia di avere uno schema di denominazione coerente per i file come: "YYYYMMDD_treatmentName_rep#_". - Impostare altre impostazioni di acquisizione come segue: Buffer: 128 fotogrammi (predefinito), Durata (check-on): 00 h:01min:00 s. Ignora o disattiva altre impostazioni in questa scheda.
- Posizionare la piastra di analisi, il coperchio sul palco del dispositivo e centrarlo nella schermata Acquisizione video ; rimuovere il coperchio.
NOTA: Preparare le piastre di analisi in anticipo. Ogni piastra è composta da una capsula di Petri da 35 mm piena circa la metà di NGM non seminato (senza prato batterico). - Utilizzare una micropipetta per lavare lo stadio sincronizzato11 vermi in 1 mL di M9 sulla piastra di analisi - mirare a circa 50 vermi (Figura 3D). Ruotare delicatamente la piastra per portare gli animali al centro o utilizzare una micropipetta per aggiungere alcune gocce di M9 agli animali separati (Figura 3E). Imposta un timer per 60 s per consentire ai vermi di acclimatarsi al nuoto.
NOTA: la piastra non sarà visibile al 100% sullo schermo. Gli animali non vengono tracciati con precisione durante la sovrapposizione. - Mentre il timer esegue il conto alla rovescia, regolare manualmente la messa a fuoco della fotocamera ruotando la ghiera di messa a fuoco sul corpo dell'obiettivo della fotocamera mentre si guarda il display (Figura 3F). È possibile ingrandire i worm utilizzando un mouse con rotellina di scorrimento che consente una messa a fuoco più precisa.
- Dopo aver impostato la messa a fuoco, regolare la manopola della luce in modo che il display sia il più luminoso possibile senza sovraesposizione (viene visualizzato come pixel rossi sul display).
- Dopo 60 s, premere il pulsante Registra .
NOTA: il video passerà dalla live view alla registrazione e sarà visibile un timer. Al termine dell'acquisizione, la visualizzazione Acquisizione video tornerà alla Vista dal vivo (Figura supplementare 1B). - Rimuovere la piastra dopo la registrazione e impostare la piastra successiva. Rinominare il prefisso in base alle esigenze. Lavare i vermi nella piastra del saggio, incubare per 60 s e registrare ogni trattamento.
- Dopo aver completato tutte le registrazioni per un esperimento, chiudere tutte le schede video aperte e spegnere la sorgente luminosa premendo la manopola del dimmer.
- Chiudi la finestra Acquisizione video facendo clic sul pulsante x rosso nell'angolo in alto a destra della finestra; in alternativa, chiudere l'intero pacchetto software e riaprire.
- Prepara i video per il monitoraggio.
- Dal menu della barra laterale Flusso di lavoro , seleziona il primo pulsante in questo menu, Importa sequenza immagine, e trova e fai doppio clic su un video. Il video si aprirà nella finestra centrale (Figura supplementare 2A).
NOTA: la visualizzazione predefinita per il software è il menu della barra laterale Workflow ; è possibile accedere a questo menu anche tramite il menu a discesa Visualizza in alto in Visualizza [Visualizza | Flusso di lavoro]. Il menu Workflow dispone di diverse opzioni di visualizzazione; la vista Traccia è appropriata a questo punto del protocollo. Se il pulsante Imposta informazioni sequenza non è visibile nel menu, questa non è la visualizzazione corretta. Innanzitutto, guarda nella parte inferiore del menu e controlla che la scheda Flusso di lavoro sia attiva, quindi controlla che la vista Traccia sia attiva facendo clic sull'icona Traccia . La posizione dei menu visualizzati nella finestra dipende dalle dimensioni del monitor e dalla posizione di altri menu aperti. I menu possono essere spostati mediante trascinamento della selezione, ridimensionati e chiusi. La maggior parte dei menu può anche essere aperta tramite il menu a discesa Visualizza . - Dal menu Flusso di lavoro, selezionare Imposta informazioni sequenza (Figura supplementare 2B). Nella finestra nuovo menu, controllare lo schema di denominazione, aggiungere note e convalidare i metadati.
- Verificare che il ridimensionamento sia impostato correttamente; Scala: 11,43 μm/pixel e Measure si riempiranno automaticamente poiché 1000 μm sono 87 pixel. Se l'altezza della fotocamera è stata regolata in modo diverso da quanto prescritto qui, seguire le istruzioni in questo menu per aggiornare la bilancia. Fare clic sul pulsante Salva .
- Nel menu Flusso di lavoro, selezionare Regola immagine e si aprirà un nuovo menu a comparsa denominato Regolazioni immagine (Figura supplementare 2C). Selezionare Vermi scuri su sfondo chiaro (campo luminoso).
- Regolare le impostazioni aggiuntive. Le impostazioni di elaborazione delle immagini consigliate sono le seguenti: Levigatura dello sfondo: 10, Levigatura gaussiana: 5, Fori di riempimento: 2, Filtro oggetto piccolo: 0 e Salta segmentazione derivata integrale.
- Regola il livello di soglia in modo che gli animali siano completamente pieni di verde ma ancora distinti dallo sfondo. Fare clic su Applica.
NOTA: è consentito raccogliere alcuni oggetti che non sono worm. - Dal menu Flusso di lavoro , selezionare Rileva e traccia (Figura supplementare 2D).
NOTA: un menu apparirà a lato del video con 3 schede: Rilevamento, Tracciamento e Riparazione. Il cursore avrà l'aspetto di un dito puntato quando si trova sopra il display video. In alternativa, fare clic sull'icona Seleziona (freccia del cursore) nel menu delle icone nella parte superiore sinistra del software.- Utilizzare lo strumento di selezione delle dita per selezionare 3-7 worm e fare clic sul pulsante Rileva worm nella scheda Rilevamento .
NOTA: questa selezione aiuta il software a identificare con precisione i worm per determinate condizioni e deve essere eseguita per ogni video. Dopo alcuni secondi, la maggior parte dei vermi sarà evidenziata in verde e avrà un numero in giallo. I vermi che si toccano o si raggomitolano probabilmente non saranno evidenziati; tuttavia, il programma molto probabilmente li troverà durante il monitoraggio. C'è un'opzione per regolare i parametri di rilevamento; tuttavia, le impostazioni predefinite funzionano bene nella maggior parte delle condizioni. Se vengono apportate modifiche ai parametri di rilevamento, assicurarsi di essere coerenti tra campioni e repliche.
- Utilizzare lo strumento di selezione delle dita per selezionare 3-7 worm e fare clic sul pulsante Rileva worm nella scheda Rilevamento .
- Sempre nella finestra Rileva e traccia , passare alla scheda Rilevamento (Figura supplementare 2E). Nella sezione Parametri di tracciamento Usa backtracking, deseleziona Traccia worm sul bordo dell'immagine.
- Impostare l'ipotesi Max tracked su 5. Imposta la modalità di tracciamento su Nuoto.
NOTA: l'impostazione Max tracked hypothesis regola il numero di potenziali worm-track che un worm single tracked può avere e dà al programma un certo margine di manovra sulla precisione con cui tracciare un singolo worm senza perderne traccia. 5 è un buon ambiente per nuotare. - Passare alla sezione Impostazioni avanzate e impostare quanto segue: I worm dei frame possono toccare il limite: 50, i worm dei frame possono sovrapporsi: 500, Tolleranza di posizione: 0,50, Tolleranza della forma: 0,50. Salva queste impostazioni e distribuiscile per tutti i video in un esperimento (e oltre) salvandole come configurazione.
NOTA: il filtraggio delle tracce non è raccomandato e può essere facilmente eseguito in post-elaborazione, lasciare fuori. - Passare a Configuration Manager (icona a forma di ingranaggio) nel menu dell'icona in alto a sinistra. Quando si fa clic su di esso, si aprirà il menu della barra laterale di Configuration Manager . Quindi, fai clic sull'icona Salva (ingranaggio +), assegna a questa configurazione un nome e una descrizione, quindi fai clic sul pulsante OK .
- Per accedere a questa configurazione in futuro, aprire il menu Configurazione , selezionare la configurazione desiderata e fare clic sull'icona Carica (freccia di marcia in su). Quindi aggiungere informazioni sulla sequenza, eventualmente ottimizzare il livello di soglia e selezionare i worm per il rilevamento. Tutte le altre impostazioni saranno le stesse.
- Nel menu Flusso di lavoro , fare clic su Salva progetto, verificare il percorso di salvataggio e aggiungere un nome di file di progetto (la corrispondenza del nome del file di progetto con il nome del video facilita la continuità). Chiudi il video.
Nota : questi progetti vengono salvati con il tipo di file .wpr. - Ripeti per tutti i video: Importa sequenza immagine (2.18), Carica configurazione salvata (2.28.1), regola la soglia (2.23), imposta informazioni sequenza (2.19), rileva worm (2.24.1), salva il progetto (2.29), chiudi video.
- Tieni traccia dei video
- Per tenere traccia dei file di progetto, accedere al menu Flusso di lavoro e fare clic sull'icona Batch (cartella contenente pagine worm) (Figura supplementare 2F).
NOTA: verrà visualizzato il pannello Elaborazione batch (Figura supplementare 2G). A volte è nascosto ma è possibile accedervi nella parte inferiore del menu Flusso di lavoro batch ; potrebbe essere necessario espandere la finestra per vederla. - Fare clic sul pulsante Aggiungi nella sezione Selezione file di questo menu Elaborazione batch . Individuare e selezionare tutti i file di progetto (con estensione wpr) da elaborare, fare clic su Apri.
NOTA: il menu Elaborazione batch verrà riempito con il percorso del file selezionato, un indicatore di stato e una barra di avanzamento grigia per ogni file. - Fare clic sull'icona Start (pulsante di riproduzione). Prendere nota dell'indicatore di stato verde sul primo file. Consentire l'elaborazione di tutti i file. Quando tutti i file vengono letti come completati (verde), il software può essere chiuso (Figura supplementare 2G).
- Se un file di progetto si blocca, considera l'esecuzione del file appeso da solo, questo di solito risolve il problema. Se il problema persiste, aprire il file di progetto, eliminare i worm selezionati (menu Rileva e traccia) e riselezionare da un nuovo set di formazione. Quindi rielaborare il file di progetto.
- Per tenere traccia dei file di progetto, accedere al menu Flusso di lavoro e fare clic sull'icona Batch (cartella contenente pagine worm) (Figura supplementare 2F).
- Riparazione di tracce (consigliato)
NOTA: la riparazione delle tracce può aumentare la precisione delle tracce. Le correzioni comuni sono la combinazione di tracce che appartengono chiaramente allo stesso worm visto dall'occhio umano, l'eliminazione di tracce che non sono accurate o non catturano dati worm reali e la divisione di tracce che sono travisate perché i worm si stanno toccando (rimuovere la sezione danneggiata e combinare le tracce da prima e dopo la sezione povera se possibile).- Aprire il software e aprire un file di progetto [File | Open Project] di interesse. Fare clic su Apri e fare clic su Sì per utilizzare questo file. Attendere il caricamento del filtro temporale. Il video elaborato sarà sullo schermo; i vermi saranno evidenziati in verde e delineati in giallo. Usa il lettore video per pulire o riprodurre il video.
- Dal menu Flusso di lavoro , selezionare Rileva e traccia (Figura supplementare 2D). Passare alla scheda Ripristina . Attivare il cursore del selettore facendo clic sull'icona dello strumento selettore (freccia del cursore). Scorri il video, trovando e selezionando una traccia worm, quindi utilizza il menu di riparazione per creare la modifica desiderata.
NOTA: per risolvere strategicamente la maggior parte dei problemi rapidamente, ingrandisci in modo tale che sia visibile circa 1/6 della piastra, inizia con l'area circostante la traccia #1. Scorri rapidamente il video controllando i worm che appaiono misteriosamente dal nulla, le tracce in cui i numeri cambiano o i worm che si scontrano l'uno con l'altro, modificando man mano che sorgono problemi. Seguire i worm in ordine numerico dalla posizione iniziale. Strofinare avanti e indietro per seguire ogni verme se necessario fino a quando l'intera piastra non viene riparata. Prestare particolare attenzione ai bordi del piatto; spesso, i vermi falsi appaiono nell'ombra dei bordi delle piastre.
- Analisi dei dati
- Dal menu Flusso di lavoro , selezionare Analizza dati (Figura supplementare 3A).
NOTA: verrà visualizzata una nuova finestra denominata Analisi e stampa dei dati (Figura supplementare 3B). Questa finestra offre molti modi per valutare e visualizzare i dati di movimento della popolazione di worm di un file di progetto specifico. La maggior parte di queste analisi consente la selezione di worm specifici, multipli o tutti da un determinato video, consentendo di tracciare le informazioni sulla traccia in modi diversi. - Per analizzare il conteggio dei turni, vai a Riepilogo traccia [Posizione e velocità | Riepilogo delle tracce] (Figura supplementare 3C). Usa il pulsante Esporta in basso a destra per esportare i dati in un formato leggibile dal foglio di calcolo (.csv), scegli un percorso nella posizione desiderata del foglio di calcolo, inclusa la ridenominazione in qualcosa di memorabile. Le impostazioni predefinite sono una buona scelta (Figura supplementare 3D).
- Incollare questi dati, così come qualsiasi altro set di dati di progetto pertinente in una cartella di lavoro consolidata del foglio di calcolo (Figura supplementare 3E).
- Utilizzare il conteggio dei giri e la durata della traccia per calcolare i giri al minuto per ogni traccia utilizzando le funzioni di foglio di calcolo (= durata giri/traccia * 60) o utilizzare una metrica diversa come desiderato (Figura supplementare 3F).
NOTA: Turns per minute cattura informazioni molto simili a un test di thrashing manuale che è una metrica di attività ampiamente utilizzata nel liquido, ma ci sono molte opzioni ed è del tutto possibile che una metrica diversa possa identificare altri dati interessanti per un determinato trattamento o confronto. - Se lo si desidera, selezionare le dimensioni del worm, la durata della traccia e/o altre metriche scelte utilizzando strumenti di formattazione condizionale per evidenziare le tracce da rimuovere se sono potenzialmente confondenti. Mantenere un'elaborazione coerente dei dati tra trattamenti e repliche.
- Analizza i dati utilizzando analisi statistiche appropriate come il t-test di Student per 2 ceppi o ANOVA a 1 via per 3 o più ceppi. Eseguire repliche sperimentali indipendenti in giorni diversi e con popolazioni indipendenti di vermi per almeno 3 repliche sperimentali indipendenti.
- Dal menu Flusso di lavoro , selezionare Analizza dati (Figura supplementare 3A).
Risultati
Sia la locomozione radiale che i saggi di nuoto offrono un rilevamento sensibile della compromissione della motilità (Figura 4 e Figura 5). Per studiare i meccanismi alla base del TDP-43 patologico nella SLA, sono stati sviluppati modelli di C. elegans che esprimono panneurnalmente il TDP-43 umano wild-type o ALS-mutante. Questi animali mostrano caratteristiche molecolari e cellulari che ricordano la SLA, compresa la disfunzione motoria9. È importante sottolineare che mostrano una moderata compromissione della motilità con l'espressione di TDP-43 umano wild-type e una compromissione della motilità più grave negli animali che esprimono TDP-43 mutante della SLA utilizzando sia la locomozione radiale che i saggi di nuoto. Alcuni animali mutanti o transgenici avranno una maggiore compromissione nel gattonare rispetto al nuoto, o viceversa. Utilizzando due diversi saggi di motilità, si ottiene un quadro più chiaro delle differenze fenotipiche tra i ceppi.
Locomozione radiale
Quando viene posto su un piatto di agar seminato, C. elegans esplora l'ambiente circostante, anche cercando i confini della loro fonte di cibo. I test di locomozione radiale sono un modo per sfruttare quel comportamento come metrica per la forma fisica. Analizzando il comportamento locomotore (strisciando su una superficie solida) in modo controllato e quantificabile, il test locomotore radiale offre uno strumento semplice ed efficace per valutare la gravità dei deficit motori e di altri fenotipi legati al motore. I saggi di locomozione radiale catturano le differenze di motilità nei vermi modello di SLA moderatamente o gravemente compromessi e offrono una linea di base per confrontare la modulazione dei fenotipi della motilità o i cambiamenti nella motilità con l'età (Figura 6). Questa strategia può essere applicata per quantificare il comportamento di strisciamento di qualsiasi ceppo che ha alterato il movimento da wild type (N2) o vermi di controllo. Tuttavia, questo metodo potrebbe non essere una buona scelta per valutare gli animali incapaci di strisciare normalmente, come i mutanti a rulli o gli animali paralizzati. Tipicamente, i vermi wild-type presentano uno spostamento medio tra 200-300 μm/min quando vengono sollevati e testati a 20 °C. I dati di esempio presentati nella Figura 4 mostrano risultati attesi confrontando N2, due diversi ceppi transgenici che esprimono TDP-43 umano wild-type con un fenotipo lieve [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] o fenotipo più forte [TDP-43(WT-moderato), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], un ceppo transgenico che esprime TDP-43 umano mutante con fenotipo grave [TDP-43(M337V), CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), e un ceppo transgenico che esprime un'altra proteina associata a malattie neurodegenerative, la tau umana wild-type [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. I due ceppi che esprimono TDP-43 wild-type hanno diversi gradi di compromissione rilevati dalla locomozione radiale. TDP-43 (WT-low) non è significativamente diverso da N2, mentre TDP-43 (WT-high) mostra chiare differenze nella motilità. I ceppi TDP-43 (M337V) e tau (WT) hanno menomazioni più gravi nella motilità.
Saggio di nuoto
C. elegans si impegna in movimenti stereotipati di nuoto (thrashing) quando sono immersi nel liquido. Immediatamente dopo l'immersione, i vermi iniziano a piegare tipicamente la testa e la coda l'una verso l'altra con un angolo di curvatura di circa 45 °, con il vertice angolare che è il punto medio del verme. I vermi alternano la flessione nelle direzioni ventrale e dorsale. Un thrash, misurato dal software, rappresenta il movimento di passare da un angolo di piegatura del corpo di 20° o superiore, indipendentemente dalla direzionalità (la soglia angolare può essere regolata in post-elaborazione all'interno della finestra Analisi e stampa [Workflow | Analizzare i dati | Forma del corpo | Angolo di piegatura | | a metà punto Soglia di ampiezza: # gradi]. Il test di nuoto qui descritto utilizza il monitoraggio e l'analisi automatizzati basati su computer per fornire un punteggio imparziale dell'attività di nuoto. Si prevede che i vermi wild-type (N2) avranno una media di 150-200 thrashes al minuto quando sollevati e registrati a 20 °C. I dati di esempio presentati nella Figura 5 mostrano i risultati attesi confrontando N2, due diversi ceppi transgenici che esprimono TDP-43 umano wild-type con un fenotipo lieve [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] o fenotipo più forte [TDP-43(WT-moderato), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], e un ceppo transgenico che esprime un'altra proteina associata a malattie neurodegenerative, la tau umana wild-type [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. Il ceppo transgenico che esprime il mutante ALS TDP-43 [TDP-43(M337V)] non si scioglie nel liquido, e quindi è indicato sul grafico come ND (nessun dato). Questo test può discriminare fenotipi diversi rispetto al test di locomozione radiale mostrato nella Figura 4. Ad esempio, nel test di locomozione radiale (Figura 4), TDP-43 (WT-low) non era significativamente diverso da N2. Tuttavia, nel test di nuoto (Figura 5), sia TDP-43 (WT-low) che TDP-43 (WT-high) sono significativamente diversi da N2, oltre che significativamente diversi l'uno dall'altro. Inoltre, nonostante sia TDP-43 (M337V) che tau (WT) abbiano gravi disturbi di scansione da locomozione radiale (Figura 4), solo tau (WT) è in grado di thrash abbastanza da essere tracciato dal software (Figura 5). Gli animali TDP-43 (M337V) non sono in grado di colpire e l'analisi basata su software non rileva o traccia questi vermi in modo accurato. Pertanto, i dati su questi worm non sono stati raccolti (ND, nessun dato).
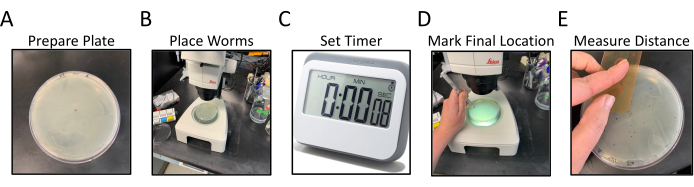
Figura 1: Flusso di lavoro del saggio di locomozione radiale. I pannelli A-E mostrano le fasi generalizzate del test di locomozione radiale. I passaggi sono i seguenti: (A) Le piastre NGM, con OP50 seminato ai bordi, sono preparate etichettando e contrassegnando il punto centrale, (B) i vermi sono posizionati al centro dell'agar come contrassegnato dal punto centrale, (C) i vermi sono autorizzati a muoversi liberamente per un determinato periodo di tempo, (D) la piastra è capovolta dal basso verso l'alto e la posizione finale di ciascun verme è contrassegnata in un colore diverso dal punto centrale, (E) La distanza dal punto centrale a ciascuna posizione finale del worm misurata a mano o digitalmente. Fare clic qui per visualizzare una versione più grande di questa figura.
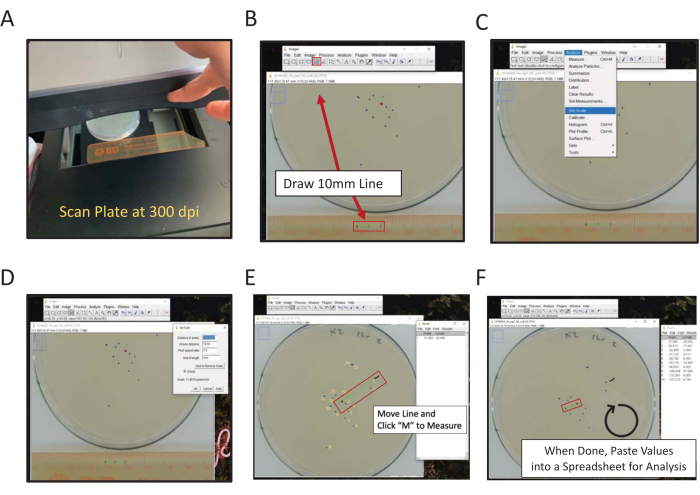
Figura 2: Misurazione digitale della posizione finale utilizzando ImageJ. La distanza dalle misurazioni centrali può essere misurata a mano o digitalmente, per misurare digitalmente utilizzando la scansione ImageJ (A) sul retro della piastra con un righello nella cornice. (B) Disegnare una lunghezza nota utilizzando lo strumento linea. (C) Utilizzare la lunghezza nota disegnata in (B) per impostare la scala [Analizza | Imposta Scala...]. (D) Utilizzare lo strumento linea per disegnare una linea dal punto centrale a un segno di posizione finale, ripetere per ogni segno. (E) Una linea di pennello che segna il primo segno misurato aiuta a segnare (linea nera ondulata vicino al segno 1). I segni di posizione finali sono numerati in giallo per illustrare la direzionalità del punteggio. (F) Le misurazioni sono registrate nella finestra Risultati. Salva i risultati altrove per l'analisi statistica. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Regolazioni dei materiali e dell'hardware per l'utilizzo del software. (A) Materiali utilizzati per il test di nuoto assistito da software. (B) Impostazione generale del software e dei materiali necessari, si noti che l'alloggiamento è in posizione rialzata. (C) L'altezza della staffa di montaggio dell'obiettivo può essere regolata. Questa immagine mostra la traccia regolabile e un indicatore a nastro che segna l'altezza preferita per l'esecuzione di saggi di nuoto. È necessario regolare la luce a campo brillante e la messa a fuoco della fotocamera prima della registrazione. (D) Una piastra di dosaggio da 35 mm viene posizionata sul palco, gli animali in M9 vengono aggiunti alla piastra e viene avviato un timer di 1 minuto. (E) A volte è vantaggioso ruotare delicatamente la piastra per spostare i vermi più vicino al centro - osservare la posizione sullo schermo di cattura dal vivo; in alternativa, alcune gocce di M9 da un pipettor possono essere utilizzate per separare i vermi. (F) Regolare la ghiera di messa a fuoco sull'obiettivo della fotocamera, osservare i vermi sullo schermo per determinare la messa a fuoco ottimale. Fare clic qui per visualizzare una versione più grande di questa figura.
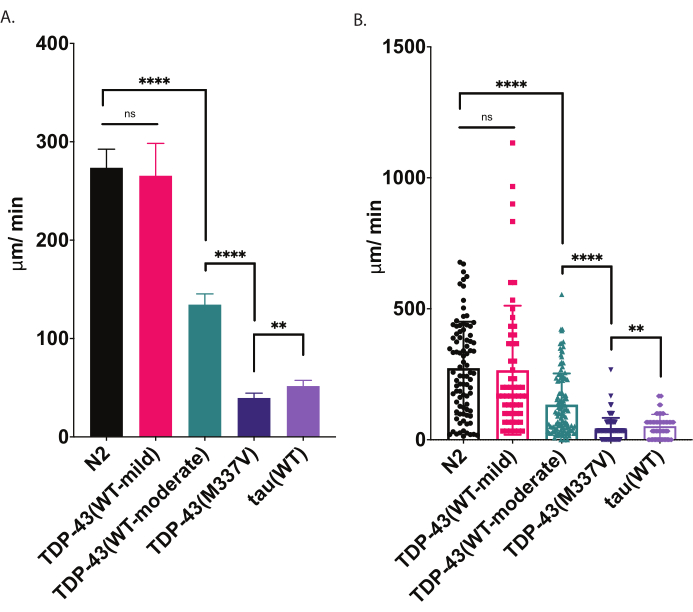
Figura 4: I saggi di locomozione radiale rilevano le differenze nella velocità di scansione. La dispersione non stimolata delle larve L4 in fase di sviluppo è stata misurata utilizzando il test di locomozione radiale sopra descritto e rappresentata graficamente come μm / min viaggiato (A-B). Gli stessi dati tracciati in (A) e (B) dimostrano due diverse possibili presentazioni grafiche. In (A), i dati vengono visualizzati come un grafico a barre, rendendo più chiare le differenze relative tra i ceppi. In (B), lo spostamento finale di ciascun worm è suddiviso all'interno del grafico, consentendo di visualizzare meglio la variazione all'interno della popolazione. Per valutare la significatività tra i ceppi testati, è stata utilizzata l'analisi unidirezionale della varianza (ANOVA) con il test di confronto multiplo di Tukey. **p=0,0022, ****p<0,0001, ns=non significativo. TDP-43 (M337V) e tau (WT) sono anche significativamente diversi da N2, p<0.0001. Le barre di errore in (A) sono errori standard della media (SEM) e in (B) sono deviazione standard. Fare clic qui per visualizzare una versione più grande di questa figura.
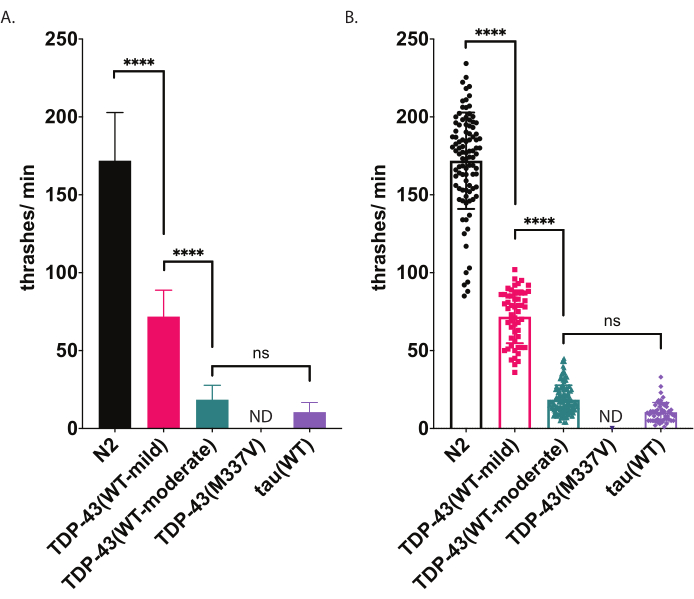
Figura 5: I saggi di nuoto rilevano le differenze di thrashing nel liquido. I tassi di nuoto (frequenza di battitura o ondulazione nel liquido) sono stati misurati utilizzando un punteggio imparziale assistito da computer e analisi sopra descritte e rappresentate graficamente come thrashes / min (A-B). Stessi dati tracciati in (A) e (B). In (A), i dati sono rappresentati graficamente come un grafico a barre, il che rende più facili da vedere le differenze relative tra i ceppi. In (B), i dati di ogni singolo worm segnato sono tracciati all'interno del grafico, consentendo di visualizzare meglio la variazione all'interno della popolazione. Per valutare la significatività tra i ceppi testati, è stata utilizzata un'analisi unidirezionale della varianza (ANOVA) con il test di confronto multiplo di Tukey. p<0.0001, ns=non significativo. TDP-43 (WT-moderato) e tau (WT) sono anche significativamente diversi da N2, p <0.0001.Le barre di errore in (A) sono errori standard della media (SEM) e in (B) sono deviazione standard. Fare clic qui per visualizzare una versione più grande di questa figura.
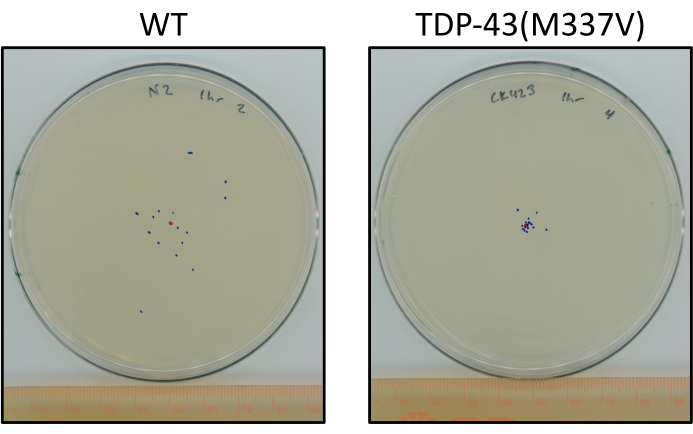
Figura 6: I vermi mutanti TDP-43 viaggiano meno dei vermi selvatici. Piastre che mostrano una differenza rappresentativa nella posizione finale di L4 N2 (wild-type) e TDP-43(M337V) (CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), un ceppo che esprime TDP-43 umano mutante con funzione motoria gravemente compromessa dopo 1 ora di strisciamento non stimolato a temperatura ambiente. Le piastre sono contrassegnate con un punto rosso per il punto centrale e punti blu per la posizione finale degli animali. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Registrazione del comportamento di nuoto utilizzando il software di imaging e tracciamento. (A) Il flusso di lavoro di tracciamento e la posizione dell'icona di acquisizione video. (B) La finestra Acquisizione video viene visualizzata in Live View e vengono evidenziati gli aspetti più importanti. Le parole verdi "Live view" cambieranno in un rosso "Registrazione" quando il pulsante di registrazione è attivato. Fare clic qui per scaricare questo file.
Figura 2 supplementare: Preparazione e monitoraggio del comportamento di nuoto. Questa figura mostra una serie di schermate per aiutare a impostare una sequenza di immagini video per il monitoraggio. Il protocollo generale per la preparazione di una sequenza video consiste nell'aprire ogni menu del flusso di lavoro in questo ordine: Importa sequenza di immagini | Impostare le informazioni sulla sequenza | Regolare | immagine Rileva e tieni traccia delle | Salva progetto. La finestra Analizza dati può essere utilizzata solo dopo aver registrato un file di progetto. (A) mostra un file .avi (video) aperto dopo aver importato la sequenza nel software dall'interno del flusso di lavoro Track . (B) La finestra Imposta informazioni sequenza fornisce un posto per le note, impostare/modificare la scala e controllare i metadati per una sequenza video. Le istruzioni per cambiare la bilancia si trovano in questa finestra e devono essere seguite quando la fotocamera è abbassata o sollevata (B). L'immagine (C) mostra le impostazioni della finestra Regola immagine . (D) Screenshot che mostra la scheda di rilevamento della finestra Rileva e traccia . Il rilevamento dei worm viene utilizzato per addestrare il software e deve essere impostato per ogni sequenza video. Ulteriori parametri di rilevamento possono essere impostati qui, se lo si desidera. (E) Screenshot della scheda Tracciamento della finestra Rileva e traccia con le impostazioni consigliate per il monitoraggio del comportamento di nuoto. Questo è l'ultimo passaggio per impostare una sequenza video. Salvate la sequenza come progetto utilizzando la finestra Salva progetto . Ripetete questi passaggi per ogni sequenza video. Le impostazioni possono essere salvate come configurazione per ridurre il carico di lavoro e garantire che tutte le sequenze siano trattate allo stesso modo (non visualizzate). Per tenere traccia dei file di progetto per l'analisi, passare al flusso di lavoro batch . (F) mostra l'icona utilizzata per passare al flusso di lavoro Batch e (G) mostra la finestra di elaborazione batch, evidenzia i pulsanti Aggiungi e Avvia e mostra l'aspetto previsto di un file di progetto che è stato monitorato. Fare clic qui per scaricare questo file.
Figura 3 supplementare: Analisi del comportamento di nuoto. Dopo aver monitorato un file di progetto, è possibile aprirlo utilizzando [File | Apri Progetto]. I worm appariranno in verde come mostrato nella (A). Pulire il video offre un rapido controllo che il video elaborato come previsto, l'evidenziazione verde scomparirà durante lo scrubbing. La finestra Analisi e stampa dei dati viene aperta dall'elemento del flusso di lavoro Analizza dati . (B) mostra la finestra Analisi dati e plottaggio con la vista Posizione aperta (impostazione predefinita), tutte le tracce sono evidenziate. Sotto i punti dati c'è un grafico che mostra la traccia registrata per ogni worm evidenziato. L'analisi di riepilogo della traccia viene utilizzata per calcolare i giri al minuto. (C-D) mostra il rapporto di riepilogo della traccia e i dettagli di esportazione. (E-F) mostra il riepilogo della traccia in un foglio di calcolo e come calcolare i giri al minuto, l'output misurato in questo test. Fare clic qui per scaricare questo file.
Discussione
Locomozione radiale:
La risoluzione di questo test è facilmente controllabile modificando la variabile temporale. Aumentare il periodo di tempo rende più facile osservare le differenze tra animali con fenotipi gravi, identificando così sottili differenze. Tuttavia, poiché questo test misura lo spostamento, se il tempo di analisi è esteso troppo a lungo, gli animali con motilità normale, come N2, viaggeranno verso i bordi della piastra e il comportamento di foraggiamento porterà al backtracking. Ciò ridurrà artificialmente la misurazione della distanza percorsa. Periodi di tempo troppo lunghi possono comportare la scomparsa delle differenze tra i ceppi, in particolare tra gli animali con fenotipi motori meno gravi, poiché gli animali diventano uniformemente dispersi attraverso la piastra. Accorciare la variabile temporale impedirà ai vermi più attivi di trovare i bordi della piastra. Questo metodo non tiene traccia della distanza totale percorsa per ciascun verme, ma comprime la distanza percorsa per ciascun verme in una distanza lineare dal centro della piastra. Come tale, è intrinsecamente meno robusto di un metodo che registra la lunghezza totale della traccia dei singoli worm. Tuttavia, il test di locomozione radiale richiede pochissima formazione da parte dei ricercatori, utilizza reagenti relativamente convenienti che sono comunemente disponibili nella maggior parte dei worm lab ed è abbastanza sensibile da produrre risultati significativi e riproducibili. Per i laboratori che preferiscono il monitoraggio video automatizzato, sono stati precedentemente stabiliti diversi metodi per tracciare e analizzare i movimenti di scansione12, oppure i parametri software utilizzati per il test di nuoto in questo documento potrebbero essere modificati per consentire il rilevamento e l'analisi della scansione.
Questo esperimento viene solitamente eseguito in repliche indipendenti triplicate, con un insieme di 30-40 worm per replica. Ogni replica è divisa su due diverse piastre da 100 mm o 150 mm, con 15-20 vermi per piastra. L'uso di più vermi di quelli raccomandati per piatto può rendere difficile segnare in modo efficiente. Un numero totale di 90+ è sufficientemente potenziato per stabilire il significato per la compromissione della motilità lieve, moderata o grave. Essere coerenti con i tempi tra i ceppi valutati è essenziale per l'accuratezza e la riproducibilità. 30 minuti sono generalmente sufficienti per stabilire differenze tra fenotipi da moderati a gravi come i ceppi transgenici che esprimono TDP-43 mutante umano rispetto ai vermi wild-type (Figura 4). Se la variabile temporale verrà estesa, è consigliabile aumentare anche la dimensione della piastra da 100 mm a 150 mm. Fattori ambientali come la temperatura e l'umidità possono influenzare questo test, che viene tipicamente condotto a temperatura ambiente, quindi è importante utilizzare sempre un controllo wild-type (N2) quando si confrontano tra le repliche. Inoltre, questo test può misurare la motilità di alcuni ceppi che non mostrano un normale comportamento di nuoto nel liquido (thrashing), rendendolo un utile complemento al test di nuoto.
Test di nuoto:
L'uso del sistema di imaging e acquisizione per automatizzare il tracciamento e l'analisi del nuoto dei vermi consente di ottenere dati rigorosi e imparziali. Tuttavia, ci sono diversi fattori durante la configurazione iniziale dell'esperimento che devono essere controllati tra i campioni. Questi includono il tempo di acclimatarsi al liquido prima di iniziare la registrazione, le condizioni ambientali (ad esempio, temperatura, umidità) e la luce costante e le impostazioni di registrazione. Nella fase di registrazione, ci sono diverse caratteristiche che aiutano a ridurre la variabilità tra le piastre. Questi includono una telecamera integrata montata su traccia e uno stadio a campo luminoso che rende la registrazione video coerente tra le lastre, schermatura attorno al palco che impedisce riflessi, abbagliamento e movimenti d'aria durante la registrazione e un robusto pacchetto software che rileva in modo affidabile i worm e consente la correzione manuale delle tracce nella post-elaborazione video. In questo protocollo, i video di una piastra da 35 mm con worm vengono registrati per 1 minuto e quindi elaborati utilizzando il pacchetto software. Dopo l'elaborazione, la correzione manuale delle tracce garantisce che i comportamenti dei worm vengano registrati in modo accurato senza confondere gli errori di tracciamento. I dati relativi al conteggio dei turni e alla durata della traccia vengono utilizzati per determinare i turni al minuto come lettura finale. Per garantire la riproducibilità, i dati vengono raccolti su un minimo di 3 esperimenti di replica indipendenti, ciascuno con 40-50 animali valutati, per ottenere un numero finale combinato di animali 120-150. Questo numero è sufficiente per discriminare piccole differenze nel comportamento di nuoto dai vermi di controllo. Alcuni vermi hanno deficit motori troppo gravi per essere catturati da saggi di nuoto. Ad esempio, se gli animali vengono posti in un arricciatura media liquida invece di eseguire la risposta di thrashing prevista, questo test non registrerà accuratamente quei movimenti e un altro test di movimento, come la locomozione radiale, potrebbe catturare meglio quei difetti di motilità. Il protocollo fornito utilizza un sistema di imaging disponibile in commercio (vedere Tabella dei materiali per maggiori dettagli), ma altri sistemi di tracciamento dei worm possono fornire un'utilità simile, con alcuni open source12. I metodi pubblicati in precedenza descrivono il punteggio manuale del worm thrashing13. Mentre l'analisi automatizzata produce una serie di metriche per ogni singolo worm, il rilevamento delle curve del corpo che viene misurato in thrashes al minuto, fornisce risultati coerenti tra esperimenti e tracce ben con il punteggio convenzionale dei worm thrashes a occhio.
Divulgazioni
Gli autori dichiarano di non avere divulgazioni.
Riconoscimenti
Ringraziamo i recensori per i commenti e i suggerimenti utili. Ringraziamo Aleen Saxton, Brandon Henderson e Jade Stair per l'eccezionale assistenza tecnica. Ringraziamo Brian Kraemer e Rebecca Kow per l'assistenza nello sviluppo di questi test. Questo materiale è il risultato del lavoro supportato con risorse e l'uso delle strutture del VA Puget Sound Health Care System. Questo lavoro è stato sostenuto da una sovvenzione degli Stati Uniti (USA) Department of Veterans Affairs (VA) Biomedical Laboratory Research and Development Service [Merit Review Grant #I01BX004044 a N.F.L.]
Materiali
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
Riferimenti
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon