Method Article
Evaluation der motorischen Beeinträchtigung bei C. elegans Modellen der amyotrophen Lateralsklerose
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt zwei empfindliche Assays zur Unterscheidung zwischen leichter, mittelschwerer und schwerer motorischer Beeinträchtigung in C. elegans-Modellen der amyotrophen Lateralsklerose, mit allgemeinem Nutzen für C. elegans-Stämme mit veränderter Motilität.
Zusammenfassung
Die neurodegenerative Erkrankung Amyotrophe Lateralsklerose (ALS) weist einen fortschreitenden Verlust von Motoneuronen auf, der von Muskelschwäche und motorischen Beeinträchtigungen begleitet wird, die sich mit der Zeit verschlimmern. Während bei der Bestimmung der genetischen Treiber von ALS für eine Untergruppe von Patienten erhebliche Fortschritte erzielt wurden, hat die Mehrheit der Fälle eine unbekannte Ätiologie. Darüber hinaus sind die Mechanismen, die der Dysfunktion und Degeneration der Motoneuronen zugrunde liegen, nicht gut verstanden; Daher besteht ein ständiger Bedarf, repräsentative Modelle zu entwickeln und zu charakterisieren, um diese Prozesse zu untersuchen. Caenorhabditis elegans kann ihre Bewegung an die physischen Einschränkungen ihrer Umgebung anpassen, wobei zwei primäre Bewegungsparadigmen in einer Laborumgebung untersucht wurden - auf einer festen Oberfläche kriechen und in Flüssigkeit schwimmen. Diese stellen ein komplexes Zusammenspiel zwischen Empfindung, Motoneuronen und Muskeln dar. C. elegans-Modelle von ALS können in einem oder beiden dieser Bewegungsparadigmen eine Beeinträchtigung aufweisen. Dieses Protokoll beschreibt zwei empfindliche Assays zur Bewertung der Motilität in C. elegans: einen optimierten radialen Fortbewegungsassay, der das Crawlen auf einer festen Oberfläche misst, und eine automatisierte Methode zur Verfolgung und Analyse des Schwimmens in Flüssigkeit (Thrashing). Zusätzlich zur Charakterisierung der motorischen Beeinträchtigung von ALS-Modellen zu Studienbeginn können diese Assays eine Unterdrückung oder Verbesserung der Phänotypen durch genetische oder niedermolekulare Interventionen nachweisen. Daher haben diese Methoden einen Nutzen für die Untersuchung von ALS-Modellen und jedem C. elegans-Stamm , der eine veränderte Motilität aufweist.
Einleitung
Amyotrophe Lateralsklerose (ALS) ist eine schwächende, altersbedingte neurodegenerative Erkrankung mit besonderen Auswirkungen auf Motoneuronen. Die Krankheit kennzeichnet den Verlust von Motoneuronen im Gehirn und Rückenmark sowie eine fortschreitende motorische Beeinträchtigung. Dies führt zu einer schweren funktionellen Behinderung und einem vorzeitigen Tod, typischerweise innerhalb von 3-5 Jahren nach der Diagnose1. Mutationen in mindestens 38 Genen können ALS verursachen; Die meisten Patienten mit ALS akkumulieren jedoch ubiquitinierte Einschlüsse des Proteins TDP-43 als primäre Pathologie in Neuronen und Gliazellen2,3,4. Eine Reihe von Tiermodellen wurde entwickelt, um die zugrunde liegenden Mechanismen zu untersuchen, die ALS in vivo verursachen oder dazu beitragen (überprüft in5). In C. elegans umfassen diese Modelle genetische Loss-of-Function-Mutationen in Homologen von ALS-verursachenden Genen oder transgene Expression von menschlichen ALS-Genen. Es gibt zahlreiche Vorteile bei der Modellierung von ALS in C. elegans. C. elegans sind ein handhabbares einfaches Tier mit einem differenzierten Nervensystem, gut charakterisierten Verhaltensparadigmen und einer beträchtlichen genetischen Homologie für den Menschen6,7. Es gibt viele Werkzeuge für die Arbeit mit C. elegans, darunter robuste Genom-Editing-Fähigkeiten, In-vivo-Fluoreszenz-Reporter der Neurodegeneration, RNAi-Screening-Paradigmen, handhabbare Genetik und etablierte verhaltens- und phänotypische Assays. C. elegans-Modelle von ALS rekapitulieren Aspekte menschlicher Erkrankungen, einschließlich der Akkumulation unlöslicher Proteine, der Neurodegeneration und des frühen Todes8,9. Darüber hinaus ist eine motorische Dysfunktion mit Störungen des Krabbel- und Schwimmverhaltens bei vielen C. elegans ALS-Modellen vorhanden.
Dieses Protokoll beschreibt zwei Methoden zur Charakterisierung der motorischen Phänotypen von C. elegans : den radialen Fortbewegungstest zur Bewertung des Kriechens auf einer festen Oberfläche und die Beurteilung des Schwimmens in Flüssigkeit (Thrashing) mit dem automatisierten Tracking und der Analyse von WormLab. Diese sensitiven Methoden zur Charakterisierung motorischer Defizite ermöglichen Schweregradvergleiche und bieten Werkzeuge zur Messung der Unterdrückung und Verbesserung motorischer Phänotypen. Der radiale Fortbewegungsassay quantifiziert Unterschiede in der Kriechmotilität (sinusförmige Bewegung auf einer festen Oberfläche) zwischen Populationen von Würmern. Dieser Assay nutzt das natürliche unstimulierte Explorationsverhalten von C. elegans , indem er Würmer an einer einzigen Stelle auf einer Platte platziert und ihre endgültige Position nach einer bestimmten Zeit markiert10. Alternativ zählen Schwimmen in flüssigen (Thrashing) Assays Körperbiegungen einzelner Würmer über einen bestimmten Zeitraum. Die manuelle Zählung von Körperbeugen durch das menschliche Auge ist zeitintensiv und weist typischerweise eine erhebliche Variabilität zwischen den Experimentatoren auf. Die Verwendung von computergestützter automatisierter Verfolgung und Analyse kann einen Großteil dieser Variabilität eliminieren. Zusätzlich zur Charakterisierung der motorischen Beeinträchtigung von ALS-Modellen zu Studienbeginn können sowohl radiale Fortbewegungs- als auch Schwimmassays die Modulation verschiedener lokomotorischer Phänotypen aus genetischen oder niedermolekularen Interventionen nachweisen. Diese Methoden sind nützlich für die Untersuchung von ALS-Modellen und jedem C. elegans-Stamm , der eine veränderte Motilität aufweist.
Protokoll
1. Radialer Fortbewegungstest
- Bereiten Sie Petrischalen mit einem Durchmesser von 100 mm oder 150 mm vor, die etwa zur Hälfte mit Nematoden-Wachstumsmedien (NGM) gefüllt sind und mit einem gleichmäßigen Rasen aus OP50-Bakterien ausgesät werden, um die gesamte Oberfläche des Agars zu bedecken.
- Drehen Sie die NGM-Assay-Platten auf den Kopf und beschriften Sie den Boden mit einem Identifikator für die zu untersuchenden C. elegans-Stämme , 2 Platten pro Stamm (Abbildung 1A).
- Machen Sie einen kleinen Punkt mit der Markierung in der Mitte der umgedrehten Platte (Abbildung 1A).
- Übertragen Sie bei der Arbeit mit einem Seziermikroskop 15-20 inszenierte Matched11-Würmer mit einem Platindrahtpickel direkt über dem mittleren Punkt (sichtbar durch das NGM) in die Mitte der Assay-Platte (Abbildung 1B).
HINWEIS: Versuchen Sie, alle Würmer gleichzeitig oder so schnell wie möglich zu übertragen.- Stellen Sie einen Timer für 30 Minuten ein, nachdem Würmer in die Mitte der Platte gelegt wurden. Setzen Sie den Deckel wieder auf die Platte, und legen Sie ihn beiseite (Abbildung 1C).
- Fahren Sie mit dem Übertragen von Würmern fort, bis sich alle Stämme auf den dafür vorgesehenen Assay-Platten befinden, und notieren Sie sich ungefähr, wie lange es dauert, zwischen den Platten zu übertragen (zielen Sie auf ~ 1 min zwischen den Platten). Bewahren Sie alle Platten in der gleichen Reihenfolge auf, in der sie aufgestellt wurden.
- Beginnen Sie nach 30 Minuten mit der ersten Platte.
- Entfernen Sie den Deckel und legen Sie die Platte mit der Vorderseite nach unten unter das Seziermikroskop, so dass die beschriftete Rückseite der Platte nach oben zeigt und sich das NGM-Agar zwischen der Sichtlinie und den Würmern befindet. Die Platte wird vom normalen Gebrauch auf den Kopf gestellt.
- Stellen Sie den Mikroskopfokus ein, bis Würmer durch das Agar sichtbar sind.
- Setzen Sie mit einem andersfarbigen Filzstift vom Mittelpunkt aus einen kleinen Punkt an die Position jedes Wurms - folgen Sie den Wurmspuren durch den Bakterienrasen, um die distalsten Tiere zu finden.
- Überprüfen Sie den Rand der Platte, da einige Würmer dort landen können. Zählen und notieren Sie auch die Anzahl der Würmer im Mittelpunktspunktpunkt (Abbildung 1D).
- Markieren Sie weiterhin alle Assay-Platten in der richtigen Reihenfolge, so dass alle Platten 30 Minuten Aktivitätszeit haben, und achten Sie darauf, die Zeit zu berücksichtigen, die zum Einrichten der Platte benötigt wurde. Führen Sie dann manuelle oder digitale Messungen durch, wie in den Schritten 1.8 oder 1.9 beschrieben.
- Führen Sie manuelle Messungen mit einem Lineal durch.
- Verwenden Sie ein Lineal, um den Abstand vom Mittelpunkt bis zu den endgültigen Positionsmarkierungen für jeden Wurm in mm zu messen und den Abstand aufzuzeichnen. Um den Fortschritt während der Bewertung zu verfolgen, beschriften Sie den ersten erzielten Punkt mit einer kleinen Markierungslinie.
- Zeichnen Sie Längendaten für jeden Punkt nacheinander auf, indem Sie die Platte im Uhrzeigersinn drehen (Abbildung 1E).
- Führen Sie digitale Messungen mit einem Scanner und ImageJ durch.
- Scannen Sie mit einem Flachbettscanner die Rückseite der Assay-Platte(n) neben einem Lineal (Zahlen zur Scanfläche) (Abbildung 2A).
- Öffnen Sie das gescannte Plattenbild in ImageJ oder einem ähnlichen Programm.
HINWEIS: ImageJ ist eine kostenlose Java-basierte Bildverarbeitungssoftware, die vom NIH gehostet wird. - Klicken Sie auf das Geradeauswerkzeug und zeichnen Sie dann eine Linie, die die 1 cm und 2 cm Punkte auf dem gescannten Bild des Lineals verbindet (Abbildung 2B).
HINWEIS: Wenn Sie die Shift-Computertaste gedrückt halten, wird die Linie auf den nächsten Winkel von 45 ° gedrückt. - Navigieren Sie zum Menü Analysieren und verwenden Sie es, um die Skalierung festzulegen (analysieren | Skalierung festlegen) (Abbildung 2C).
- Geben Sie den bekannten Abstand (10) und die Längeneinheiten (mm) in die entsprechenden Felder ein, passen Sie den Abstand nicht in Pixeln an. Aktivieren Sie Global , um die gleiche Skalierung auf alle Bilder anzuwenden, die in jeder ImageJ-Sitzung analysiert werden. Legen Sie andernfalls den Maßstab für jedes Bild beim Öffnen fest (Abbildung 2D). Klicken Sie auf OK.
HINWEIS: Die Schritte 1.9.2-1.9.5 werden ausgeführt, um die Messskala einzustellen. Messungen für dieses Bild beziehen nun automatisch die Länge der Linien auf die definierte Pixel: Längenbeziehung. Bilder, die mit 300 dpi gescannt werden, haben ein ungefähres Verhältnis von 11,8 Pixeln pro mm. - Verwenden Sie das Paintbrush-Werkzeug , um knapp über dem ersten Punkt zu markieren, der erzielt werden soll.
HINWEIS: Dies ist ein visueller Indikator für den ersten Wurm, der bewertet wurde. - Verwenden Sie das Geradeauswerkzeug , um eine Linie vom Mittelpunkt zum ersten Wurmdatenpunkt zu zeichnen.
- Klicken Sie auf die Taste M auf der Tastatur, um die Entfernung zu messen. Alternativ können Sie zum Menü Analysieren navigieren und Measure (Analyze | Messen). In beiden Fällen wird die Messung in einem neuen Fenster angezeigt. In diesem Fenster werden alle Messungen pro Bild erfasst.
- Halten Sie den Mittelpunkt konstant, bewegen Sie das Ende der Linie, indem Sie den ersten Wurmpunkt berühren, zum nächsten Wurmpunkt, bewegen Sie sich im Uhrzeigersinn, und klicken Sie auf die Taste M , um zu messen.
- Messen Sie jeden Punkt im Uhrzeigersinn weiter, bis alle Punkte erzielt sind.
-
Kopieren Sie Längenmessdaten und fügen Sie sie in eine Tabelle ein, um sie zu speichern. Wiederholen Sie dann den Vorgang für jedes gescannte Plattenbild.
HINWEIS: In den Schritten 1.9.6 - 1.9.11 werden die Wurmverschiebungswerte gemessen (Abbildung 2E-F).
- Führen Sie statistische Analysen durch.
- Kombinieren Sie Replikate innerhalb eines einzelnen Experiments, so dass die Gesamtzahl der bewerteten Würmer zwischen 30 und 40 Würmern liegt.
- Führen Sie unabhängige experimentelle Replikate an verschiedenen Tagen und mit unabhängigen Populationen von Würmern durch, um mit 3 unabhängigen experimentellen Replikaten zu enden.
- Analysieren Sie die Daten mit geeigneten statistischen Analysen wie dem Student's t-Test für 2 Stämme oder der 1-Wege-ANOVA für drei oder mehr Stämme.
2. Computeranalysierter Schwimmassay
HINWEIS: Dieses Protokoll enthält detaillierte Anweisungen für das handelsübliche WormLab Hard- und Softwaresystem (siehe Tabelle der Materialien). Der Workflow kann jedoch auf andere computeranalysierte Schwimmassaysysteme angewendet werden.
- Einrichten und Aufnehmen von Videos.
- Erhöhen Sie die Abschirmung der Imaging-Hardware (Abbildung 3), und stellen Sie sicher, dass die Kamerahöhe auf die erwartete Position eingestellt ist.
HINWEIS: Die optimale Höhe für die Erfassung von Würmern auf einer 35-mm-Platte ist so, dass die dritte von unten gewindeförmige Schraubenbohrung unterhalb der verstellbaren Kamerahalterung sichtbar ist, aber kein zusätzliches Montageloch über der Schraubbohrung (ca. 30,5 cm über der Bühne) zu sehen ist (Abbildung 3C). Dies führt zu einem Erfassungsverhältnis von 11,43 μm/Pixel. Erwägen Sie, einen Indikator für die "korrekte Höhe" hinzuzufügen, damit dies vor Beginn des Tests leichter zu bestätigen ist. Siehe Protokollschritt 2.18, um Höhenverstellungen zu berücksichtigen. - Öffnen Sie die zugehörige Software (Ergänzende Abbildung 1A).
- Klicken Sie auf das Videoaufnahmesymbol (Film mit einem nach rechts zeigenden Dreieck in der Mitte), um ein neues Videoaufnahmefenster zu öffnen. Die Kamera befindet sich in der Live-Ansicht, aber das Display ist schwarz (ergänzende Abbildung 1B).
- Drücken Sie auf den Dimmerknopf und drehen Sie ihn im Uhrzeigersinn, um das Licht einzustellen.
HINWEIS: Der Dimmerknopf befindet sich auf der Bühne des Bildgebungssystems in der Nähe der Hellfeldlichtquelle. Das Video Capture Live-View-Display wechselt von schwarz zu beleuchtet. - Zurück im Fenster Videoaufnahme klicken Sie auf die Registerkarte Einstellungen , passen Sie sie wie folgt an: Videomodus: 2456 x 2052_Mono8, Bildrate: 14, Ausgabe: monochrom, Belichtung: 0,00300 s, Verstärkung: 1 dB, Gamma: 1, Drehen 180 (überprüfen).
- Wechseln Sie zurück zur Registerkarte Erfassen . Wählen Sie den Aufzeichnungsordner aus (Ergänzende Abbildung 1B).
HINWEIS: Hier werden alle Aufzeichnungen und Projektdateien gespeichert. Erstellen Sie eindeutige Ordner für einzelne Experimente, um die Daten zu organisieren. - Weisen Sie einen Dateinamen zu, indem Sie ihn in das Textfeld Dateipräfix eingeben.
HINWEIS: Die Software hängt automatisch eine progressive Zahl an das Ende des Präfixes im Format "0001" an. Es ist ratsam, ein einheitliches Benennungsschema für die Dateien zu haben, wie zum Beispiel: "YYYYMMDD_treatmentName_rep#_". - Legen Sie weitere Aufnahmeeinstellungen wie folgt fest: Puffer: 128 Frames (Standard), Dauer (check on): 00 h:01min:00 s. Ignorieren oder deaktivieren Sie andere Einstellungen auf dieser Registerkarte.
- Legen Sie die Assay-Platte mit offenem Deckel auf die Gerätebühne und zentrieren Sie sie im Video Capture-Bildschirm . Entfernen Sie den Deckel.
HINWEIS: Bereiten Sie die Assay-Platten im Voraus vor. Jede Platte besteht aus einer 35 mm Petrischale, die etwa zur Hälfte mit ungesetztem (kein Bakterienrasen) NGM gefüllt ist. - Verwenden Sie eine Mikropipette, um die bühnensynchronisierten 11 Würmer in 1 ml M9 auf die Assay-Platte zu waschen - zielen Sie auf etwa 50 Würmer ab (Abbildung 3D). Schwenken Sie die Platte vorsichtig, um die Tiere in die Mitte zu bringen, oder verwenden Sie eine Mikropipette, um ein paar Tropfen M9 hinzuzufügen, um die Tiere zu trennen (Abbildung 3E). Stellen Sie einen Timer auf 60 s ein, damit sich Würmer an das Schwimmen gewöhnen können.
HINWEIS: Die Platte ist nicht zu 100% auf dem Bildschirm sichtbar. Tiere werden bei Überlappungen nicht genau verfolgt. - Während der Timer herunterzählt, passen Sie den Kamerafokus manuell an, indem Sie den Fokussierring am Objektivgehäuse der Kamera drehen, während Sie das Display betrachten (Abbildung 3F). Es ist möglich, die Würmer mit einer Scrollrad-Maus zu vergrößern, was eine präzisere Fokussierung ermöglicht.
- Nachdem Sie den Fokus eingestellt haben, stellen Sie den Lichtregler so ein, dass das Display ohne Überbelichtung so hell wie möglich ist (wird als rote Pixel auf dem Display angezeigt).
- Drücken Sie nach 60 s die Aufnahmetaste .
HINWEIS: Das Video wechselt von der Live-Ansicht zur Aufnahme und ein Timer ist sichtbar. Wenn die Aufnahme abgeschlossen ist, kehrt die Videoaufnahmeanzeige zur Live-Ansicht zurück (ergänzende Abbildung 1B). - Entfernen Sie die Platte nach der Aufnahme und richten Sie die nächste Platte ein. Benennen Sie das Präfix nach Bedarf um. Würmer in die Testplatte waschen, 60 s inkubieren und jede Behandlung aufzeichnen.
- Nachdem Sie alle Aufzeichnungen für ein Experiment abgeschlossen haben, schließen Sie alle geöffneten Videoregisterkarten und schalten Sie die Lichtquelle aus, indem Sie den Dimmerknopf drücken.
- Schließen Sie das Videoaufnahmefenster, indem Sie auf die Schaltfläche "Rotes X " in der oberen rechten Ecke des Fensters klicken. Alternativ können Sie das gesamte Softwarepaket schließen und erneut öffnen.
- Bereiten Sie Videos für das Tracking vor.
- Wählen Sie im Menü Workflow die Option Sequenzinfo festlegen (Ergänzende Abbildung 2B). Überprüfen Sie im neuen Menüfenster das Benennungsschema, fügen Sie Notizen hinzu und überprüfen Sie Die Metadaten.
- Überprüfen Sie, ob die Skalierung korrekt eingestellt ist. Maßstab: 11,43 μm / Pixel und Measure füllt sich automatisch aus, da 1000 μm 87 Pixel sind. Wenn die Kamerahöhe anders eingestellt wurde als hier vorgeschrieben, folgen Sie den Anweisungen in diesem Menü, um die Skala zu aktualisieren. Klicken Sie auf die Schaltfläche Speichern .
- Wählen Sie im Menü Workflow die Option Bild anpassen aus, und ein neues Popupmenü mit dem Namen Bildanpassungen wird geöffnet (ergänzende Abbildung 2C). Wählen Sie Dunkle Würmer auf hellem Hintergrund (helles Feld).
- Passen Sie zusätzliche Einstellungen an. Die empfohlenen Bildverarbeitungseinstellungen lauten wie folgt: Hintergrundglättung: 10, Gaußsche Glättung: 5, Füllen von Löchern: 2, Filter für kleine Objekte: 0 und Überspringen der Segmentierung der integralen Ableitung.
- Passen Sie den Schwellenwert so an, dass die Tiere vollständig mit Grün gefüllt sind, sich aber dennoch vom Hintergrund unterscheiden. Klicken Sie auf Übernehmen.
HINWEIS: Es ist zulässig, einige Objekte aufzunehmen, die keine Würmer sind. - Wählen Sie im Menü Workflow die Option Erkennen und nachverfolgen (ergänzende Abbildung 2D).
HINWEIS: An der Seite des Videos erscheint ein Menü mit 3 Registerkarten: Erkennen, Verfolgen und Reparieren. Der Cursor sieht aus wie ein zeigender Finger, wenn er sich über die Videoanzeige befindet. Alternativ können Sie im Symbolmenü oben links in der Software auf das Symbolsymbol (Cursorpfeil) klicken.- Verwenden Sie das Fingerauswahlwerkzeug, um 3-7 Würmer auszuwählen, und klicken Sie auf der Registerkarte Erkennung auf die Schaltfläche Würmer erkennen.
HINWEIS: Diese Auswahl hilft der Software, Würmer für bestimmte Bedingungen genau zu identifizieren und muss für jedes Video durchgeführt werden. Nach einigen Sekunden werden die meisten Würmer grün hervorgehoben und haben eine Nummer in Gelb. Würmer, die sich berühren oder zusammenrollen, werden wahrscheinlich nicht hervorgehoben; Das Programm wird sie jedoch höchstwahrscheinlich während der Verfolgung finden. Es gibt eine Option zum Anpassen der Erkennungsparameter. Die Standardeinstellungen funktionieren jedoch unter den meisten Bedingungen gut. Wenn Anpassungen an den Erkennungsparametern vorgenommen werden, stellen Sie sicher, dass sie zwischen Proben und Replikaten konsistent sind.
- Verwenden Sie das Fingerauswahlwerkzeug, um 3-7 Würmer auszuwählen, und klicken Sie auf der Registerkarte Erkennung auf die Schaltfläche Würmer erkennen.
- Wechseln Sie im Fenster Erkennen und Nachverfolgen zur Registerkarte Nachverfolgung (ergänzende Abbildung 2E). Deaktivieren Sie im Kontrollkästchen Tracking-Parameter Backtracking verwenden das Kontrollkästchen Würmer am Bildrand verfolgen.
- Legen Sie die Hypothese Max tracked auf 5 fest. Stellen Sie den Tracking-Modus auf Schwimmen ein.
HINWEIS: Die Einstellung Max tracked hypothesis passt an, wie viele potenzielle Wurmspuren ein einzelner verfolgter Wurm haben darf, und gibt dem Programm einen gewissen Spielraum, wie genau ein einzelner Wurm verfolgt werden kann, ohne den Überblick zu verlieren. 5 ist eine gute Kulisse zum Schwimmen. - Wechseln Sie zum Abschnitt Erweiterte Einstellungen und legen Sie Folgendes fest: Frames-Würmer können Berandung berühren: 50, Frames-Würmer können sich überlappen: 500, Positionstoleranz: 0,50, Formtoleranz: 0,50. Speichern Sie diese Einstellungen und stellen Sie sie für alle Videos in einem Experiment (und darüber hinaus) bereit, indem Sie sie als Konfiguration speichern.
HINWEIS: Die Spurfilterung wird nicht empfohlen und kann leicht nach der Verarbeitung durchgeführt werden. - Navigieren Sie im Symbolmenü oben links zum Konfigurations-Manager (Zahnradsymbol). Wenn Sie darauf klicken, wird das Configuration Manager-Seitenleistenmenü geöffnet. Klicken Sie anschließend auf das Symbol Speichern (Zahnrad +), geben Sie dieser Konfiguration einen Namen und eine Beschreibung und klicken Sie dann auf die Schaltfläche OK .
- Um in Zukunft auf diese Konfiguration zuzugreifen, öffnen Sie das Menü Konfiguration , wählen Sie die gewünschte Konfiguration aus und klicken Sie auf das Symbol Laden (Zahnradpfeil). Fügen Sie dann Sequenzinformationen hinzu, passen Sie möglicherweise den Schwellenwert an und wählen Sie Würmer für die Erkennung aus. Alle anderen Einstellungen sind gleich.
- Klicken Sie im Menü Workflow auf Projekt speichern, überprüfen Sie den Speicherort und fügen Sie einen Projektdateinamen hinzu (das Abgleichen des Projektdateinamens mit dem Videonamen trägt zur Kontinuität bei). Schließen Sie das Video.
HINWEIS: Diese Projekte werden mit dem Dateityp .wpr gespeichert. - Wiederholung für alle Videos: Bildsequenz importieren (2.18), Gespeicherte Konfiguration laden (2.28.1), Schwellenwert anpassen (2.23), Sequenzinformationen festlegen (2.19), Würmer erkennen (2.24.1), Projekt speichern (2.29), Video schließen.
- Videos verfolgen
- Um die Projektdateien zu verfolgen, wechseln Sie zum Menü Workflow und klicken Sie auf das Symbol Stapelverarbeitung (Ordner mit Wurmseiten) (ergänzende Abbildung 2F).
HINWEIS: Das Bedienfeld "Stapelverarbeitung " wird angezeigt (ergänzende Abbildung 2G). Manchmal ist es ausgeblendet, kann aber ganz unten im Batch-Workflow-Menü aufgerufen werden. Das Fenster muss möglicherweise erweitert werden, um es zu sehen. - Klicken Sie im Abschnitt Dateiauswahl dieses Menüs auf die Schaltfläche Hinzufügen. Navigieren Sie zu allen zu verarbeitenden Projektdateien (.wpr), wählen Sie sie aus, klicken Sie auf Öffnen.
HINWEIS: Das Menü Stapelverarbeitung wird mit dem ausgewählten Dateipfad, einer Statusanzeige und einem grauen Fortschrittsbalken für jede Datei gefüllt. - Klicken Sie auf das Symbol Start (Wiedergabeschaltfläche). Beachten Sie die grüne Fortschrittsanzeige in der ersten Datei. Lassen Sie zu, dass alle Dateien verarbeitet werden. Wenn alle Dateien als fertig (grün) gelesen sind, kann die Software geschlossen werden (ergänzende Abbildung 2G).
- Wenn eine Projektdatei hängen bleibt, sollten Sie die aufgelegte Datei selbst ausführen, da dies normalerweise das Problem behebt. Wenn das Problem dadurch nicht behoben wird, öffnen Sie die Projektdatei, löschen Sie die ausgewählten Würmer (Menü "Erkennen und Verfolgen ") und wählen Sie erneut aus einem neuen Trainingssatz aus. Verarbeiten Sie dann die Projektdatei erneut.
- Um die Projektdateien zu verfolgen, wechseln Sie zum Menü Workflow und klicken Sie auf das Symbol Stapelverarbeitung (Ordner mit Wurmseiten) (ergänzende Abbildung 2F).
- Reparatur von Gleisen (empfohlen)
HINWEIS: Das Reparieren von Spuren kann die Genauigkeit der Spuren erhöhen. Übliche Korrekturen sind das Kombinieren von Spuren, die eindeutig zum selben Wurm gehören, wie es vom menschlichen Auge gesehen wird, das Löschen von Spuren, die nicht genau sind oder keine echten Wurmdaten erfassen, und das Aufteilen von Spuren, die falsch dargestellt werden, weil sich Würmer berühren (entfernen Sie den schlechten Abschnitt und kombinieren Sie Spuren vor und nach dem schlechten Abschnitt, wenn dies praktikabel ist).- Öffnen Sie die Software und öffnen Sie eine Projektdatei [Datei | Offenes Projekt] von Interesse. Klicken Sie auf Öffnen und dann auf Ja , um diese Datei zu verwenden. Warten Sie, bis der Zeitfilter geladen ist. Das verarbeitete Video wird auf dem Bildschirm angezeigt. Würmer werden grün hervorgehoben und gelb umrandet. Verwenden Sie den Videoplayer, um das Video zu durchsuchen oder abzuspielen.
- Wählen Sie im Menü Workflow die Option Erkennen und nachverfolgen (ergänzende Abbildung 2D). Wechseln Sie zur Registerkarte Reparieren . Aktivieren Sie den Selektorcursor , indem Sie auf das Symbol des Auswahlwerkzeugs (Cursorpfeil) klicken. Durchsuchen Sie das Video, suchen und wählen Sie eine Wurmspur aus, und verwenden Sie dann das Reparaturmenü, um die gewünschte Änderung zu erstellen.
HINWEIS: Um die meisten Probleme strategisch schnell zu beheben, zoomen Sie so heran, dass etwa 1/6 der Platte sichtbar ist, beginnen Sie mit dem Bereich um Track #1. Schrubben Sie schnell durch das Video und suchen Sie nach Würmern, die auf mysteriöse Weise aus dem Nichts auftauchen, nach Spuren, wo sich die Zahlen ändern, oder nach Würmern, die aufeinander stoßen und probleme auftreten. Folgen Sie den Würmern in numerischer Reihenfolge von der Startposition aus. Schrubben Sie hin und her, um jedem Wurm nach Bedarf zu folgen, bis die gesamte Platte repariert ist. Achten Sie sorgfältig auf die Ränder der Platte; Oft erscheinen falsche Würmer im Schatten der Plattenränder.
- Datenanalyse
- Wählen Sie im Menü Workflow die Option Daten analysieren aus (Ergänzende Abbildung 3A).
HINWEIS: Ein neues Fenster mit dem Namen Datenanalyse und Plotten wird angezeigt (ergänzende Abbildung 3B). Dieses Fenster bietet viele Möglichkeiten, die Bewegungsdaten der Wurmpopulation einer bestimmten Projektdatei zu bewerten und anzuzeigen. Die meisten dieser Analysen ermöglichen die Auswahl spezifischer, mehrerer oder aller Würmer aus einem bestimmten Video, sodass Spurinformationen auf unterschiedliche Weise dargestellt werden können. - Um die Anzahl der Kurven zu analysieren, navigieren Sie zur Track-Zusammenfassung [Position & Geschwindigkeit | Track Summary] (Ergänzende Abbildung 3C). Verwenden Sie die Schaltfläche Exportieren unten rechts, um Daten in einem lesbaren Tabellenkalkulationsformat (.csv) zu exportieren, wählen Sie einen Pfad zum gewünschten Speicherort der Tabelle aus, einschließlich der Umbenennung in etwas Einprägsames. Die Standardeinstellungen sind eine gute Wahl (Ergänzende Abbildung 3D).
- Fügen Sie diese Daten sowie alle anderen relevanten Projektdatensätze in eine konsolidierte Tabellenkalkulationsarbeitsmappe ein (Ergänzende Abbildung 3E).
- Verwenden Sie die Kurvenanzahl und die Spurdauer , um Kurven pro Minute für jede Spur zu berechnen, indem Sie Tabellenkalkulationsfunktionen verwenden (=Kurven/Spurdauer * 60), oder verwenden Sie eine andere Metrik nach Belieben (Ergänzende Abbildung 3F).
HINWEIS: Turns per Minute erfasst sehr ähnliche Informationen wie ein manueller Thrashing-Assay, der eine weit verbreitete Metrik der Aktivität in Flüssigkeit ist, aber es gibt viele Optionen, und es ist durchaus möglich, dass eine andere Metrik andere interessante Daten für eine bestimmte Behandlung oder einen bestimmten Vergleich identifiziert. - Falls gewünscht, suchen Sie nach Wurmgröße, Trackdauer und/oder anderen ausgewählten Metriken, indem Sie bedingte Formatierungswerkzeuge verwenden, um Spuren für die Entfernung hervorzuheben, wenn sie möglicherweise verwirrend sind. Sorgen Sie für eine konsistente Datenverarbeitung zwischen Behandlungen und Replikaten.
- Analysieren Sie Daten mit geeigneten statistischen Analysen wie dem Student's t-Test für 2 Stämme oder der 1-Wege-ANOVA für 3 oder mehr Stämme. Führen Sie unabhängige experimentelle Replikate an verschiedenen Tagen und mit unabhängigen Populationen von Würmern für mindestens 3 unabhängige experimentelle Replikate durch.
- Wählen Sie im Menü Workflow die Option Daten analysieren aus (Ergänzende Abbildung 3A).
Ergebnisse
Sowohl radiale Fortbewegungs- als auch Schwimmtests bieten einen empfindlichen Nachweis von Motilitätsstörungen (Abbildung 4 und Abbildung 5). Um die Mechanismen zu untersuchen, die dem pathologischen TDP-43 bei ALS zugrunde liegen, wurden C. elegans-Modelle entwickelt, die Wildtyp- oder ALS-mutiertes menschliches TDP-43 panneuronal exprimieren. Diese Tiere zeigen molekulare und zelluläre Eigenschaften, die an ALS erinnern, einschließlich motorischer Dysfunktion9. Wichtig ist, dass sie eine moderate Motilitätsbeeinträchtigung mit der Expression von Human-TDP-43 vom Wildtyp und eine schwerere Motilitätsstörung bei Tieren aufweisen, die ALS-mutierteS TDP-43 sowohl unter Verwendung radialer Fortbewegungs- als auch von Schwimmtests exprimieren. Einige mutierte oder transgene Tiere haben eine größere Beeinträchtigung beim Krabbeln als beim Schwimmen oder umgekehrt. Durch die Verwendung von zwei verschiedenen Motilitätstests wird ein klareres Bild der phänotypischen Unterschiede zwischen den Stämmen erhalten.
Radiale Fortbewegung
Wenn sie auf einen gesäten Agarteller gelegt werden, erkunden C. elegans ihre Umgebung, einschließlich der Suche nach den Grenzen ihrer Nahrungsquelle. Radiale Fortbewegungsassays sind eine Möglichkeit, dieses Verhalten als Metrik für die körperliche Fitness zu nutzen. Durch die kontrollierte und quantifizierbare Analyse des lokomotorischen Verhaltens (Kriechen auf einer festen Oberfläche) bietet der radiale Lokomotor-Assay ein einfaches und effektives Werkzeug zur Beurteilung der Schwere von motorischen Defiziten und anderen motorbedingten Phänotypen. Radiale Lokomotionsassays erfassen Unterschiede in der Motilität bei mäßig oder stark beeinträchtigten ALS-Modellwürmern und bieten eine Baseline für den Vergleich der Modulation von Motilitätsphänotypen oder Veränderungen der Motilität mit dem Alter (Abbildung 6). Diese Strategie kann angewendet werden, um das Kriechverhalten jedes Stammes zu quantifizieren, der die Bewegung von Wildtyp- (N2) oder Kontrollwürmern verändert hat. Diese Methode ist jedoch möglicherweise keine gute Wahl, um Tiere zu beurteilen, die nicht normal kriechen können, wie z. B. Rollermutanten oder Tiere, die gelähmt sind. Typischerweise zeigen Wildtypwürmer eine durchschnittliche Verschiebung zwischen 200-300 μm/min, wenn sie angehoben und bei 20 °C getestet werden. Die in Abbildung 4 dargestellten Beispieldaten zeigen erwartete Ergebnisse beim Vergleich von N2, zwei verschiedenen transgenen Stämmen, die wildtypisches menschliches TDP-43 exprimieren, mit einem milden Phänotyp [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] oder stärkerer Phänotyp [TDP-43(WT-moderate), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], ein transgener Stamm, der mutiertes menschliches TDP-43 mit einem schweren Phänotyp [TDP-43(M337V), CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), und ein transgener Stamm, der ein anderes neurodegenerativ-krankheitsassoziiertes Protein exprimiert, Wildtyp human tau [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. Die beiden Stämme, die Wildtyp TDP-43 exprimieren, weisen unterschiedliche Beeinträchtigungsgrade auf, wie durch die radiale Fortbewegung nachgewiesen. TDP-43 (WT-niedrig) unterscheidet sich nicht signifikant von N2, während TDP-43 (WT-hoch) deutliche Unterschiede in der Motilität aufweist. TDP-43(M337V) und Tau (WT) Stämme weisen schwerere Beeinträchtigungen der Motilität auf.
Schwimm-Assay
C. elegans üben eine stereotype Schwimmbewegung (Thrashing) aus, wenn sie in Flüssigkeit eingetaucht wird. Unmittelbar nach dem Eintauchen beginnen die Würmer Kopf und Schwanz mit einem Biegewinkel von ca. 45° charakteristisch zueinander zu biegen, wobei der Winkelpunkt der Mittelpunkt des Wurms ist. Würmer biegen sich abwechselnd in ventraler und dorsaler Richtung. Ein Schlag, wie von der Software gemessen, stellt die Bewegung des Wechsels von geradem zu einem Körperbiegewinkel von 20° oder mehr dar, unabhängig von der Richtungsabhängigkeit (Winkelschwellenwerte können nach der Verarbeitung innerhalb des Analyse- und Plotfensters angepasst werden [Workflow | Analysieren von | Körperform | Biegewinkel | Mid-Point-| Amplitudenschwelle: # Grad]. Der hier beschriebene Schwimmassay verwendet automatisierte computergestützte Verfolgung und Analyse, um eine unvoreingenommene Bewertung der Schwimmaktivität zu ermöglichen. Es wird erwartet, dass Wildtypwürmer (N2) durchschnittlich zwischen 150-200 Schlägen pro Minute liegen, wenn sie bei 20 ° C aufgezogen und aufgezeichnet werden. Die in Abbildung 5 dargestellten Beispieldaten zeigen erwartete Ergebnisse beim Vergleich von N2, zwei verschiedenen transgenen Stämmen, die wildtypische menschliche TDP-43 exprimieren, mit einem milden Phänotyp [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] oder stärkerer Phänotyp [TDP-43(WT-moderate), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], und ein transgener Stamm, der ein anderes neurodegenerativ-krankheitsassoziiertes Protein exprimiert, Wildtyp human tau [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. Der transgene Stamm, der ALS-mutant TDP-43 [TDP-43(M337V)] exprimiert, wirft keine Flüssigkeit ein und wird daher in der Grafik als ND bezeichnet (keine Daten). Dieser Assay kann verschiedene Phänotypen unterscheiden als der in Abbildung 4 gezeigte radiale Fortbewegungsassay. Zum Beispiel unterschied sich TDP-43 (WT-niedrig) im radialen Fortbewegungstest (Abbildung 4) nicht signifikant von N2. Im Schwimmassay (Abbildung 5) unterscheiden sich jedoch sowohl TDP-43 (WT-niedrig) als auch TDP-43 (WT-hoch) signifikant von N2 und signifikant voneinander. Obwohl sowohl TDP-43 (M337V) als auch Tau (WT) schwere Kriechstörungen durch radiale Fortbewegung aufweisen (Abbildung 4), ist nur tau (WT) in der Lage, genug zu schlagen, um von der Software verfolgt zu werden (Abbildung 5). TDP-43 (M337V) -Tiere sind nicht in der Lage zu schlagen, und softwarebasierte Analysen erkennen oder verfolgen diese Würmer nicht genau. Daher wurden keine Daten zu diesen Würmern gesammelt (ND, keine Daten).
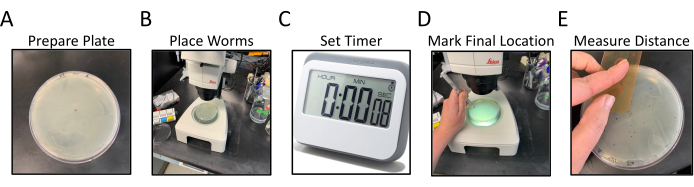
Abbildung 1: Ablauf des radialen Lokomotionsassays. Die Panels A-E zeigen die verallgemeinerten Schritte des radialen Lokomotionsassays. Die Schritte sind wie folgt: (A) NGM-Platten, mit OP50 an den Rändern ausgesät, werden durch Beschriften und Markieren des zentralen Punktes vorbereitet, (B) Würmer werden in der Mitte des Agars platziert, wie durch den zentralen Punkt markiert, (C) Würmer dürfen sich für eine bestimmte Zeit frei bewegen, (D) Platte wird von unten nach oben gedreht und die endgültige Position jedes Wurms wird in einer anderen Farbe als der zentrale Punkt markiert, (E) Der Abstand vom Mittelpunktspunkt zu jeder endgültigen Wurmposition, entweder von Hand oder digital gemessen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
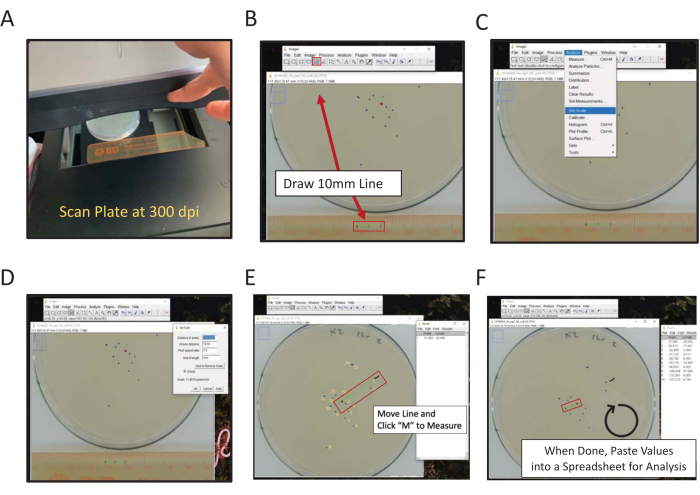
Abbildung 2: Digitale Messung des Endgültigen Standorts mit ImageJ. Entfernung von der Mitte Messungen können von Hand oder digital gemessen werden, um digital mit ImageJ (A) Scan Rückseite der Platte mit einem Lineal im Rahmen zu messen. (B) Zeichnen Sie eine bekannte Länge mit dem Linienwerkzeug. (C) Verwenden Sie die bekannte Länge, die in (B) gezeichnet wurde, um den Maßstab festzulegen [analysieren | Skalierung festlegen...]. (D) Verwenden Sie das Linienwerkzeug, um eine Linie vom Mittelpunkt bis zu einer endgültigen Positionsmarkierung zu zeichnen, wiederholen Sie dies für jede Markierung. (E) Eine Pinsellinie, die die erste gemessene Markierung markiert, hilft bei der Bewertung (schnörkelige schwarze Linie in der Nähe der 1-Markierung). Die endgültigen Positionsmarkierungen sind gelb nummeriert, um die Richtungsabhängigkeit der Bewertung zu veranschaulichen. (F) Die Messungen werden im Fenster Ergebnisse aufgezeichnet. Speichern Sie die Ergebnisse an anderer Stelle für statistische Analysen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Material- und Hardwareanpassungen für die Verwendung der Software. (A) Materialien, die für den softwaregestützten Schwimmassay verwendet werden. (B) Allgemeine Einrichtung der Software und der benötigten Materialien, beachten Sie, dass sich das Gehäuse in der erhöhten Position befindet. (C) Die Höhe der Objektivhalterung kann eingestellt werden. Dieses Bild zeigt die verstellbare Spur und eine Bandanzeige, die die bevorzugte Höhe für die Durchführung von Schwimmtests markiert. Es ist notwendig, das Hellfeldlicht und den Kamerafokus vor der Aufnahme einzustellen. (D) Eine 35-mm-Analyseplatte wird auf die Bühne gelegt, Tiere in M9 werden auf die Platte gegeben und ein 1-minuten-Timer wird gestartet. (E) Es ist manchmal vorteilhaft, die Platte vorsichtig zu schwenken, um Würmer näher an die Mitte zu bewegen - beobachten Sie die Position auf dem Live-Capture-Bildschirm; Alternativ können einige Tropfen M9 von einem Pipettier verwendet werden, um Würmer zu trennen. (F) Stellen Sie den Fokusring am Kameraobjektiv ein, beobachten Sie Würmer auf dem Bildschirm, um den optimalen Fokus zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
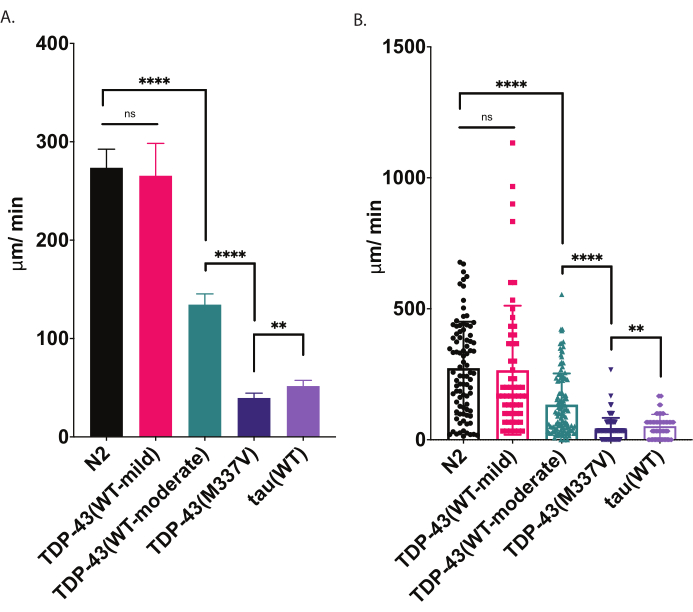
Abbildung 4: Radiale Fortbewegungstests erkennen Unterschiede in der Kriechgeschwindigkeit. Die unstimulierte Dispersion von entwicklungsbedingten L4-Larven wurde mit dem oben beschriebenen radialen Fortbewegungsassay gemessen und als μm/min gereist (A-B) grafisch dargestellt. Die gleichen Daten, die in (A) und (B) dargestellt sind, zeigen zwei verschiedene mögliche grafische Darstellungen. In (A) werden die Daten als Balkendiagramm angezeigt, wodurch die relativen Unterschiede zwischen den Dehnungen deutlicher werden. In (B) wird die endgültige Verschiebung jedes Wurms innerhalb des Graphen geplottiert, wodurch die Variation innerhalb der Population besser visualisiert werden kann. Um die Signifikanz zwischen den getesteten Stämmen zu bewerten, wurde eine Einweg-Varianzanalyse (ANOVA) mit tukeys Mehrfachvergleichstest verwendet. **p=0,0022, ****p<0,0001, ns=nicht signifikant. TDP-43 (M337V) und Tau (WT) unterscheiden sich ebenfalls signifikant von N2, p<0.0001. Fehlerbalken in (A) sind Standardfehler des Mittelwerts (REM) und in (B) sind Standardabweichung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
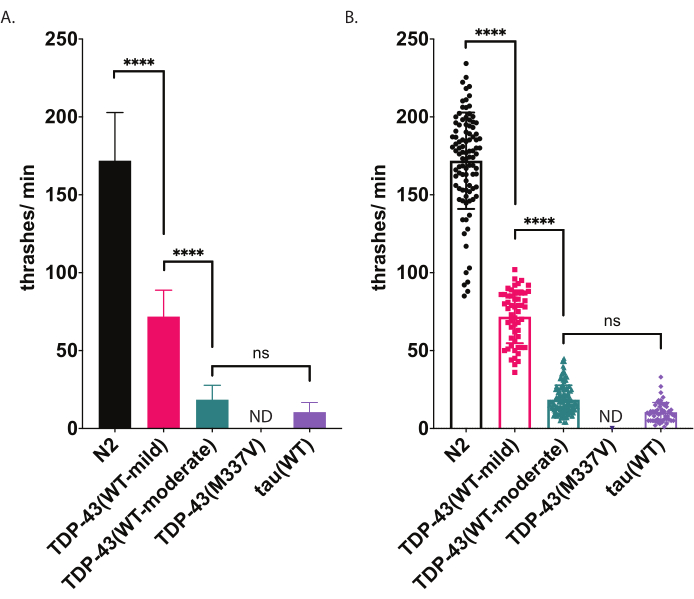
Abbildung 5: Schwimmassays erkennen Unterschiede beim Werfen in Flüssigkeit. Die Schwimmraten (Schlag- oder Wellenfrequenz in Flüssigkeit) wurden mit hilfe der oben beschriebenen unvoreingenommenen computergestützten Bewertung und Analyse gemessen und als Thrashes / min (A-B) grafisch dargestellt. Dieselben Daten wurden in (A) und (B) dargestellt. In (A) werden die Daten als Balkendiagramm grafisch dargestellt, wodurch die relativen Unterschiede zwischen den Dehnungen leichter zu erkennen sind. In (B) werden die Daten von jedem einzelnen bewerteten Wurm innerhalb des Diagramms dargestellt, so dass die Variation innerhalb der Population besser visualisiert werden kann. Um die Signifikanz zwischen den getesteten Stämmen zu bewerten, wurde eine Einweg-Varianzanalyse (ANOVA) mit tukeys Mehrfachvergleichstest verwendet. p<0,0001, ns=nicht signifikant. TDP-43(WT-moderate) und tau(WT) unterscheiden sich ebenfalls signifikant von N2, p<0.0001.Fehlerbalken in (A) sind Standardfehler des Mittelwerts (REM) und in (B) sind Standardabweichung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
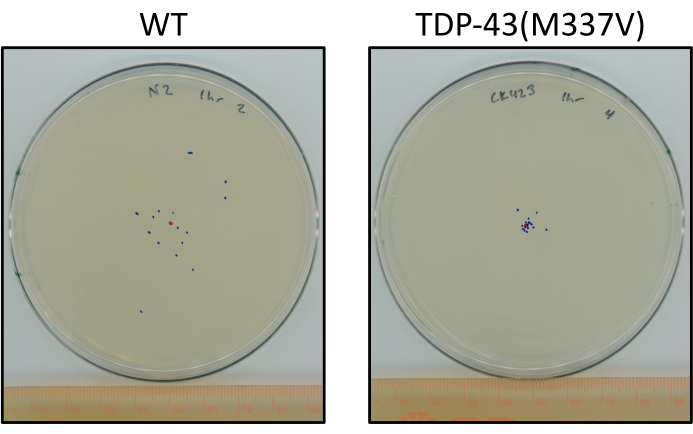
Abbildung 6: Mutierte TDP-43-Würmer reisen weniger als Wildtypwürmer. Platten, die einen repräsentativen Unterschied in der endförmigen Position von inszenierten L4 N2 (Wildtyp) und TDP-43(M337V) (CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), ein Stamm, der mutiertes menschliches TDP-43 mit stark beeinträchtigter motorischer Funktion nach 1 Stunde unstimuliertem Kriechen bei Raumtemperatur exprimiert. Die Platten sind mit einem roten Punkt für den Mittelpunkt und blauen Punkten für den endgültigen Standort der Tiere markiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Aufzeichnung des Schwimmverhaltens mit der Bildgebungs- und Tracking-Software. (A) Der Tracking-Workflow und der Speicherort des Videoaufnahmesymbols. (B) Das Videoaufnahmefenster wird in der Live-Ansicht angezeigt und die wichtigsten Aspekte werden hervorgehoben. Die grünen Wörter "Live View" ändern sich in ein rotes "Recording", wenn die Aufnahmetaste aktiviert ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Vorbereitung und Verfolgung des Schwimmverhaltens. Diese Abbildung zeigt eine Reihe von Screenshots, die beim Einrichten einer Videobildsequenz für die Nachverfolgung helfen. Das allgemeine Protokoll zum Vorbereiten einer Videosequenz besteht darin, jedes Workflow-Menü in dieser Reihenfolge zu öffnen: Bildsequenz importieren | | "Sequenzinfo festlegen" Bild | anpassen Erkennen und Nachverfolgen von | Projekt speichern. Das Fenster Daten analysieren kann nur verwendet werden, nachdem eine Projektdatei nachverfolgt wurde. (A) zeigt eine geöffnete .avi (Video-) Datei nach dem Importieren der Sequenz in die Software aus dem Track-Workflow an. (B) Das Fenster Set Sequence Info bietet Platz für Notizen, das Festlegen/Ändern des Maßstabs und das Überprüfen der Metadaten für eine Videosequenz. Anweisungen zum Ändern der Skala finden Sie in diesem Fenster und sollten befolgt werden, wenn die Kamera abgesenkt oder angehoben wird (B). Bild (C) zeigt die Einstellungen des Fensters "Bild anpassen". (D) Screenshot mit der Registerkarte Erkennung des Fensters Erkennen und Verfolgen. Das Erkennen von Würmern dient zum Trainieren der Software und muss für jede Videosequenz eingestellt werden. Hier können auf Wunsch zusätzliche Erkennungsparameter eingestellt werden. (E) Screenshot der Registerkarte Tracking des Fensters Detect and Track mit den empfohlenen Einstellungen zur Verfolgung des Schwimmverhaltens. Dies ist der letzte Schritt beim Einrichten einer Videosequenz. Speichern Sie die Sequenz im Fenster Projekt speichern als Projekt. Wiederholen Sie diese Schritte für jede Videosequenz. Einstellungen können als Konfiguration gespeichert werden, um die Arbeitslast zu reduzieren und sicherzustellen, dass alle Sequenzen gleich behandelt werden (nicht gezeigt). Um Projektdateien für die Analyse nachzuverfolgen, navigieren Sie zum Batch-Workflow. (F) zeigt das Symbol an, das zum Navigieren zum Stapelverarbeitungsworkflow verwendet wird, und (G) zeigt das Stapelverarbeitungsfenster an, hebt die Schaltflächen "Hinzufügen" und "Start" hervor und zeigt das erwartete Erscheinungsbild einer Projektdatei an, die nachverfolgt wurde. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Analyse des Schwimmverhaltens. Nachdem eine Projektdatei nachverfolgt wurde, kann sie mit [Datei | Projekt öffnen]. Würmer werden grün angezeigt, wie in (A) gezeigt. Das Durchsuchen des Videos bietet eine schnelle Überprüfung, ob das Video wie erwartet verarbeitet wurde, die grüne Hervorhebung verschwindet während der Bereinigung. Das Fenster Datenanalyse und -plotten wird über das Workflowelement Daten analysieren geöffnet. (B) zeigt das Fenster Datenanalyse und Plotten mit geöffneter Positionsansicht (Standard), alle Spuren sind hervorgehoben. Unter den Datenpunkten befindet sich ein Diagramm, das die aufgezeichnete Spur für jeden markierten Wurm zeigt. Die Gleiszusammenfassungsanalyse wird verwendet, um Kurven pro Minute zu berechnen. (C-D) den Track-Zusammenfassungsbericht und Exportdetails anzeigen. (E-F) zeigen die Streckenzusammenfassung in einer Tabelle und wie man Kurven pro Minute berechnet, die in diesem Assay gemessene Ausgabe. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Radiale Fortbewegung:
Die Auflösung dieses Assays kann leicht durch Ändern der Zeitvariablen gesteuert werden. Die Vergrößerung der Zeitdauer erleichtert die Beobachtung von Unterschieden zwischen Tieren mit schweren Phänotypen und identifiziert so subtile Unterschiede. Da dieser Assay jedoch die Verdrängung misst, wandern Tiere mit normaler Motilität, wie z. B. N2, zu den Rändern der Platte, und das Futterverhalten führt zu einem Backtracking. Dadurch wird die Messung der zurückgelegten Strecke künstlich verringert. Zu lange Zeiträume können zum Verschwinden von Unterschieden zwischen Stämmen führen, insbesondere zwischen Tieren mit weniger schweren motorischen Phänotypen, da die Tiere gleichmäßig über die Platte verteilt werden. Durch die Verkürzung der Zeitvariablen wird verhindert, dass aktivere Würmer die Kanten der Platte finden. Diese Methode verfolgt nicht die Gesamtstrecke, die für jeden Wurm zurückgelegt wird, sondern komprimiert die für jeden Wurm zurückgelegte Strecke in einen linearen Abstand von der Mitte der Platte. Als solches ist es von Natur aus weniger robust als eine Methode, die die gesamte Spurlänge einzelner Würmer aufzeichnet. Der radiale Fortbewegungsassay erfordert jedoch sehr wenig Forscherausbildung, verwendet relativ erschwingliche Reagenzien, die in den meisten Wurmlabors allgemein verfügbar sind, und ist empfindlich genug, um signifikante und reproduzierbare Ergebnisse zu erzielen. Für Labore, die eine automatisierte Videoverfolgung bevorzugen, wurden zuvor mehrere Methoden zur Verfolgung und Analyse von Kriechbewegungen12 etabliert, oder die in diesem Papier für den Schwimmassay verwendeten Softwareparameter könnten geändert werden, um eine Crawling-Erkennung und -Analyse zu ermöglichen.
Dieses Experiment wird normalerweise in dreifachen unabhängigen Replikaten mit einem Satz von 30-40 Würmern pro Replikat durchgeführt. Jedes Replikat wird auf zwei verschiedene 100-mm- oder 150-mm-Platten mit 15-20 Würmern pro Platte aufgeteilt. Die Verwendung von mehr Würmern als pro Platte empfohlen kann es schwierig machen, effizient zu punkten. Eine Gesamtzahl von 90+ ist ausreichend, um die Signifikanz für eine leichte, mittelschwere oder schwere Motilitätsbeeinträchtigung zu ermitteln. Die Konsistenz des Timings zwischen den bewerteten Dehnungen ist für die Genauigkeit und Reproduzierbarkeit unerlässlich. 30 Minuten sind im Allgemeinen lang genug, um Unterschiede zwischen mittelschweren bis schweren Phänotypen wie transgenen Stämmen, die menschliche mutante TDP-43 exprimieren, im Vergleich zu Wildtypwürmern festzustellen (Abbildung 4). Wenn die Zeitvariable verlängert wird, ist es ratsam, auch die Größe der Platte von 100 mm auf 150 mm zu erhöhen. Umweltfaktoren wie Temperatur und Luftfeuchtigkeit können diesen Assay beeinflussen, der typischerweise bei Raumtemperatur durchgeführt wird, daher ist es wichtig, beim Vergleich zwischen Replikaten immer eine Wildtyp-Kontrolle (N2) zu verwenden. Darüber hinaus kann dieser Assay die Motilität einiger Stämme messen, die kein normales Schwimmverhalten in Flüssigkeit (Thrashing) aufweisen, was ihn zu einer nützlichen Ergänzung des Schwimmassays macht.
Schwimm-Assay:
Die Verwendung des Bildgebungs- und Erfassungssystems zur Automatisierung der Verfolgung und Analyse des Wurmschwimmens ermöglicht rigorose und unvoreingenommene Daten. Es gibt jedoch mehrere Faktoren während der Ersteinrichtung des Experiments, die zwischen den Proben kontrolliert werden müssen. Dazu gehören die Zeit, um sich vor Beginn der Aufnahme an Flüssigkeit zu gewöhnen, Umgebungsbedingungen (z. B. Temperatur, Luftfeuchtigkeit) sowie konsistente Licht- und Aufnahmeeinstellungen. Auf der Aufnahmebühne gibt es mehrere Funktionen, die dazu beitragen, die Variabilität zwischen den Platten zu reduzieren. Dazu gehören eine integrierte Spurkamera und eine Hellfeldbühne, die die Videoaufzeichnung zwischen den Platten konsistent macht, eine Abschirmung um die Bühne, die Reflexionen, Blendung und Luftbewegungen während der Aufnahme verhindert, und ein robustes Softwarepaket, das Würmer zuverlässig erkennt und die manuelle Korrektur von Spuren in der Videonachbearbeitung ermöglicht. In diesem Protokoll werden Videos einer 35-mm-Platte mit Würmern für 1 Minute aufgezeichnet und dann mit dem Softwarepaket verarbeitet. Nach der Verarbeitung stellt die manuelle Korrektur der Spuren sicher, dass das Wurmverhalten genau aufgezeichnet wird, ohne Tracking-Fehler zu verwirren. Turn Count- und Track-Duration-Daten werden verwendet, um Turns pro Minute als endgültige Anzeige zu bestimmen. Um die Reproduzierbarkeit zu gewährleisten, werden Daten über mindestens 3 unabhängige Wiederholungsexperimente mit jeweils 40-50 bewerteten Tieren gesammelt, um eine kombinierte endgültige Anzahl von Tieren von 120-150 zu erreichen. Diese Zahl reicht aus, um kleine Unterschiede im Schwimmverhalten von Kontrollwürmern zu unterscheiden. Einige Würmer haben motorische Defizite, die zu schwerwiegend sind, um durch Schwimmtests erfasst zu werden. Wenn sich beispielsweise die Tiere in einem flüssigen Medium zusammenrollen, anstatt die erwartete Schlagreaktion auszuführen, zeichnet dieser Assay diese Bewegungen nicht genau auf, und ein anderer Bewegungsassay, wie z. B. die radiale Fortbewegung, kann diese Motilitätsfehler besser erfassen. Das bereitgestellte Protokoll verwendet ein kommerziell erhältliches Bildgebungssystem (siehe Tabelle der Materialien für weitere Details), aber andere Wurmverfolgungssysteme können ein ähnliches Dienstprogramm bieten, wobei einige Open Source sind12. Zuvor veröffentlichte Methoden beschreiben die manuelle Bewertung von Wurm-Thrashing13. Während die automatisierte Analyse eine Reihe von Metriken für jeden einzelnen Wurm liefert, liefert die Erkennung von Körperbiegungen, die in Thrashes pro Minute gemessen wird, konsistente Ergebnisse zwischen Experimenten und Tracks gut mit herkömmlicher Bewertung von Wurm-Thrashes nach Auge.
Offenlegungen
Die Autoren erklären, dass sie keine Offenlegungen haben.
Danksagungen
Wir danken den Rezensenten für hilfreiche Kommentare und Anregungen. Wir danken Aleen Saxton, Brandon Henderson und Jade Stair für die hervorragende technische Unterstützung. Wir danken Brian Kraemer und Rebecca Kow für die Unterstützung bei der Entwicklung dieser Assays. Dieses Material ist das Ergebnis der Arbeit, die mit Ressourcen und der Nutzung von Einrichtungen im VA Puget Sound Health Care System unterstützt wird. Diese Arbeit wurde durch ein Stipendium der Vereinigten Staaten (U.S.) Department of Veterans Affairs (VA) Biomedical Laboratory Research and Development Service [Merit Review Grant #I01BX004044 an N.F.L.]
Materialien
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
Referenzen
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten