Method Article
הערכה של ליקוי מוטורי בדגמי C. elegans של טרשת אמיוטרופית לרוחב
In This Article
Summary
פרוטוקול זה מתאר שתי בדיקות רגישות להפלות בין ליקויים מוטוריים קלים, בינוניים וחמורים בדגמי C. elegans של טרשת אמיוטרופית לרוחב, עם תועלת כללית לזני C. elegans , עם תנועתיות שונה.
Abstract
המחלה הנוירודגנרטיבית אמיוטרופית אמיוטרופית טרשת לרוחב (ALS) תכונות אובדן הדרגתי של נוירונים מוטוריים מלווה בחולשת שרירים ופגיעה מוטורית המחמירה עם הזמן. בעוד התקדמות ניכרת נעשתה בקביעת מניעים גנטיים של ALS עבור תת קבוצה של חולים, רוב המקרים יש אטיולוגיה לא ידועה. יתר על כן, המנגנונים שבביסת תפקוד לקוי של נוירון מוטורי והתנוונות אינם מובנים היטב; לכן, יש צורך מתמשך לפתח ולאפיין מודלים מייצגים ללמוד תהליכים אלה. אלגנים Caenorhabditis יכול להתאים את תנועתם לאילוצים הפיזיים של סביבתם, עם שתי פרדיגמות תנועה עיקריות נחקרו בסביבת מעבדה - זוחל על משטח מוצק ושוחה בנוזל. אלה מייצגים יחסי הגומלין מורכבים בין תחושה, נוירונים מוטוריים ושרירים. ג. מודלים אלגנס של ALS יכולים להפגין ליקוי באחת פרדיגמות התנועה האלה או בשתיהן. פרוטוקול זה מתאר שתי בדיקות רגישות להערכת תנועתיות ב - C. elegans: מתקן קטר רדיאלי ממוטב המודד זחילה על משטח מוצק ושיטה אוטומטית למעקב וניתוח שחייה בנוזל (חבטות). בנוסף לאפיון של פגיעה מוטורית בסיסית של דגמי ALS, בדיקות אלה יכולות לזהות דיכוי או שיפור של הפנוטיפים מהתערבויות גנטיות או קטנות של מולקולות. לכן, שיטות אלה יש תועלת ללימוד מודלים ALS וכל זן C. elegans המציג תנועתיות שונה.
Introduction
טרשת אמיוטרופית לרוחב (ALS) היא מחלה נוירודגנרטיבית מתישה הקשורה להזדקנות עם השפעה מיוחדת על נוירונים מוטוריים. המחלה כוללת אובדן נוירונים מוטוריים במוח ובחוט השדרה ופגיעה מוטורית מתקדמת. התוצאה היא נכות תפקודית גדולה ומוות בטרם עת, בדרך כלל בתוך 3-5 שנים לאחר האבחון1. מוטציות בלפחות 38 גנים יכולות לגרום ל- ALS; עם זאת, רוב החולים עם ALS לצבור בכל מקום תכלילים של חלבון TDP-43 כמו הפתולוגיה העיקרית שלהם נוירונים ותאי גליה2,3,4. מספר מודלים של בעלי חיים פותחו כדי לחקור את המנגנונים הבסיסיים הגורמים או תורמים ALS in vivo (נבדק ב5). ב- C. elegans, מודלים אלה כוללים מוטציות גנטיות של אובדן תפקוד בהומולוגים של גנים הגורמים ל- ALS או ביטוי מהונדס של גנים אנושיים של ALS. ישנם יתרונות רבים לדגמן ALS ב C. elegans. C. elegans הם חיה פשוטה ומתיחה עם מערכת עצבים מובחנת, פרדיגמות התנהגותיות מאופיינות היטב, והומולוגיה גנטית ניכרת לבני אדם6,7. קיימים כלים רבים לעבודה עם C. elegans, כולל יכולות עריכת גנום חזקות, בכתבים פלואורסצנטיים של ניוון עצבי, פרדיגמות סינון RNAi, גנטיקה מתיחה, ובדיקות התנהגותיות ופנוטיפיות מבוססות. ג. מודלים אלגנס של ALS recapitulate היבטים של מחלות אנושיות, כולל הצטברות של חלבון מסיס, ניוון עצבי, ומוות מוקדם8,9. יתר על כן, תפקוד מוטורי הכולל הפרעה של התנהגויות זחילה ושחייה קיים במודלים רבים של C. elegans ALS.
פרוטוקול זה מתאר שתי שיטות לאפיון פנוטיפים מוטוריים C. elegans : בחן הקטר הרדיאלי להערכת זחילה על משטח מוצק והערכת שחייה בנוזל (חבטות) באמצעות מעקב וניתוח אוטומטיים של WormLab. שיטות רגישות אלה לאפיון ליקויים מוטוריים מאפשרות השוואות של חומרה ומציעות כלים למדידת דיכוי ושיפורים של פנוטיפים מוטוריים. תנועת הקטר הרדיאלית מסמיכה הבדלים בתנועתיות זוחלת (תנועה סינוסורלית על משטח מוצק) בין אוכלוסיות של תולעים. בדיקה זו מנצלת את התנהגות המחקר הטבעית של C. elegans unstimulated על ידי הצבת תולעים במיקום אחד על צלחת וסימון מיקומם הסופי לאחר פרק זמן נתון10. לחלופין, שחייה בנוזל (חבטות) ספירת כיפופי גוף של תולעים בודדות לאורך פרק זמן מוגדר. הספירה הידנית של כיפופי הגוף על ידי העין האנושית היא עתירת זמן ובדרך כלל מציגה שונות ניכרת בין הנסיינים. השימוש במעקב וניתוח אוטומטיים בסיוע מחשב יכול לחסל חלק גדול מההשתנות הזו. בנוסף לאפיון של פגיעה מוטורית בסיסית של דגמי ALS, הן קטר רדיאלי והן בדיקות שחייה יכולות לזהות אפנון של פנוטיפים לוקומוטוריים מובחנים מהתערבויות גנטיות או קטנות של מולקולות. שיטות אלה יש תועלת ללימוד מודלים ALS וכל זן C. elegans המציג תנועתיות שונה.
Protocol
1. תוחם רדיאלי
- הכן 100 מ"מ או 150 מ"מ קוטר פטרי מנות כמחצית מלא מדיה צמיחה נמטודה (NGM) וזרע עם דשא אחיד של חיידקי OP50 כדי לכסות את כל פני השטח של אגר.
- הפכו את לוחות ה-NGM הפוך ותייגו את התחתית עם מזהה לזני C. elegans שיש לתקל, 2 צלחות לכל זן (איור 1A).
- הכינו נקודה קטנה עם הסמן במרכז הצלחת ההפוכה (איור 1A).
- תוך כדי עבודה עם מיקרוסקופ ניתוח, העבר 15-20 תולעים מבוימות תואמות למרכז לוח ה- assay ישירות מעל הנקודה המרכזית (הנראית דרך ה- NGM) באמצעות פיק פלטינה (איור 1B).
הערה: נסה להעביר את כל התולעים בו זמנית או מהר ככל האפשר.- הגדר טיימר במשך 30 דקות לאחר תולעים ממוקמות במרכז הצלחת. החזירו את המכסה לצלחת ושימו אותו בצד (איור 1C).
- ממשיכים להעביר תולעים עד שכל הזנים נמצאים על לוחות ה- assay המיועדים, תוך שים לב לכמה זמן לוקח להעביר בין הצלחות (כוון לכ - 1 דקות בין הצלחות). שמור את כל הצלחות באותו סדר שהם הוקמו.
- לאחר 30 דקות, להתחיל להבקיע את הצלחת הראשונה.
- הסר את המכסה והניח את הלוח עם הפנים כלפי מטה תחת המיקרוסקופ הניתוח, כך שהחלק האחורי המסומן של הלוח פונה כלפי מעלה, והאגר NGM הוא בין קו הראייה לתולעים. הצלחת תהיה הפוכה מהשימוש הרגיל.
- כוונן את מוקד המיקרוסקופ עד שהתולעים וגלויות דרך הגר.
- באמצעות עט קצה לבד בצבע אחר מנקודת המרכז, לשים נקודה קטנה במיקום של כל תולעת - בצע את עקבות התולעת דרך הדשא החיידקי כדי למצוא את בעלי החיים הדיסטליים ביותר.
- בדוק את קצה הצלחת כמו כמה תולעים עלולות בסופו של דבר שם. כמו כן, ספרו ורשמו את מספר התולעים בנקודת המרכז (איור 1D).
- המשך לסמן את כל לוחות ההסתה לפי הסדר, כך שלכל הצלחות יש 30 דקות של זמן פעילות, תוך הקפדה לקחת בחשבון את הזמן שלקח להגדיר את הצלחת. לאחר מכן, בצע מדידות ידניות או דיגיטליות כמתואר בשלבים 1.8 או 1.9.
- בצע מדידות ידניות באמצעות סרגל.
- השתמש בסרגל כדי למדוד מ"מ, המרחק מהמרכז מצביע לסימוני המיקום הסופיים עבור כל תולעת ולתעד את המרחק. כדי לסייע במעקב אחר ההתקדמות במהלך הניקוד, סמן את נקודת הניקוד הראשונה עם קו סימון קטן.
- תיעדו נתוני אורך עבור כל נקודה ברציפות על-ידי סיבוב הלוח בצורה בכיוון השעון (איור 1E).
- בצע מדידה דיגיטלית באמצעות סורק ו- ImageJ.
- באמצעות סורק שטוח, סרקו את החלק האחורי של לוחות ה- assay לצד סרגל (מספרים הפונים למשטח הסריקה) (איור 2A).
- פתח את תמונת הלוח הסרוק ב- ImageJ או בתוכנית דומה.
הערה: ImageJ היא תוכנת עיבוד תמונה מבוססת Java בחינם המתארחת על ידי NIH. - לחצו על הכלי 'קו ישר' ולאחר מכן ציירו קו המחבר בין נקודות הס"מ וה-2 ס"מ בתמונה הסרוקה של הסרגל (איור 2B).
הערה: החזקת מקש המחשב Shift תאלץ את הקו לזווית הקרובה ביותר של 45°. - נווט לתפריט ניתוח והשתמש בו כדי להגדיר את קנה המידה (נתח | קבע קנה מידה) (איור 2C).
- הזן את המרחק הידוע (10) ויחידות אורך (מ"מ) בתיבות המתאימות, אל תתאים את המרחק במספר הפיקסלים. בדוק כללי כדי להחיל את אותו קנה מידה על כל התמונות המנותחות בכל הפעלת ImageJ; אחרת, קבעו את קנה המידה של כל תמונה בעת הפתיחה (איור 2D). לחץ על אישור.
הערה: שלבים 1.9.2-1.9.5 מבוצעים כדי להגדיר את קנה המידה. מידות עבור תמונה זו יקשרו כעת באופן אוטומטי את אורך השורות לפיקסל המוגדר: קשרי גומלין לאורך. תמונות שנסרקו ב- 300 dpi יהיו עם קשר משוער של 11.8 פיקסלים למ"מ. - השתמש בכלי מברשת צבע כדי לסמן מעט מעל הנקודה הראשונה שיש להבקיע.
הערה: זהו מחוון חזותי עבור התולעת הראשונה שהבקיעה. - השתמש בכלי קו ישר כדי לצייר קו מנקודת המרכז לנקודת הנתונים הראשונה של התולעת.
- לחץ על מקש M בלוח המקשים כדי למדוד את המרחק. לחלופין, נווטו לתפריט 'ניתוח' ובחרו 'מדידה' (ניתוח | מידה). בשני המקרים, המדידה תופיע בחלון חדש; חלון זה יאסוף את כל המדידות לכל תמונה.
- שמירה על קבוע נקודת המרכז, הזז את קצה הקו נוגע בנקודת התולעת הראשונה לנקודת התולעת הבאה, נע בכיוון השעון ולחץ על מקש M כדי למדוד.
- המשך למדוד כל נקודה בצורה בכיוון השעון עד שכל הנקודות ציוני.
-
העתק והדבק נתוני מדידה באורך בגיליון אלקטרוני כדי לשמור אותם. לאחר מכן, חזור על התהליך עבור כל תמונת לוח סרוקה.
הערה: שלבים 1.9.6 - 1.9.11 מודדים את ערכי תזוזת התולעת (איור 2E-F).
- בצע ניתוח סטטיסטי.
- שלב שכפולים בתוך ניסוי יחיד כך שמספר כולל ציון הוא בין 30-40 תולעים.
- בצע שכפולים ניסיוניים עצמאיים בימים שונים ועם אוכלוסיות עצמאיות של תולעים כדי בסופו של דבר עם 3 שכפולים ניסיוניים עצמאיים.
- לנתח נתונים באמצעות ניתוחים סטטיסטיים מתאימים כגון t-test של סטודנט עבור 2 זנים או ANOVA בכיוון אחד עבור שלושה זנים או יותר.
2. ניתוח מחשב של שחייה
הערה: פרוטוקול זה מכיל הוראות מפורטות עבור מערכת החומרה והתוכנה של WormLab הזמינה מסחרית (ראה טבלת חומרים). עם זאת, ניתן להחיל את זרימת העבודה על מערכות אחרות לבדיקת שחייה שניתחו על-ידי המחשב.
- הגדרה והקלטה של סרטונים.
- הרם את המיגון על חומרת ההדמיה (איור 3) וודא שגובה המצלמה מוגדר למיקום הצפוי.
הערה: הגובה האופטימלי ללכידת תולעים על צלחת 35 מ"מ הוא כזה שהשלישי מהבורג המשורשר התחתון נראה מתחת לתנוחת הרכבה מתכווננת של המצלמה, אך לא נראה חור הרכבה נוסף מעל הבורג (כ-30.5 ס"מ מעל הבמה) (איור 3C). התוצאה תהיה יחס לכידה של 11.43 מיקרומטר/פיקסל. שקול להוסיף מחוון "גובה נכון" כך שזה קל יותר לאשר לפני תחילת ההסתה. ראה פרוטוקול שלב 2.18 כדי להסביר התאמות גובה. - פתח את התוכנה המשויכת (איור 1A משלים).
- לחץ על סמל לכידת וידאו (סרט עם משולש הצבעה ימנית באמצע) כדי לפתוח חלון לכידת וידאו חדש. המצלמה תהיה בתצוגה החיה, אך התצוגה תהיה שחורה (איור 1B משלים).
- לחץ על ידית העמעום וסובב אותה בכיוון השעון כדי לכוונן את האור.
הערה: הידית העמומה נמצאת על הבמה של מערכת ההדמיה ליד מקור האור של השדה הבהיר. תצוגת התצוגה החיה של לכידת וידאו תהפוך משחורה למוארת. - בחזרה בחלון לכידת וידאו , לחץ על הכרטיסייה הגדרות , התאם כדלקמן: מצב וידאו: 2456 x 2052_Mono8, קצב פריימים: 14, פלט: מונוכרום, חשיפה: 0.00300 s, רווח: 1 dB , גמא: 1, סיבוב 180 (בדוק).
- חזור לכרטיסיה לכידה . בחר את תיקיית ההקלטה (איור 1B משלים).
הערה: כאן יאוחסנו כל ההקלטות וקבצי הפרוייקט. צור תיקיות ייחודיות עבור ניסויים בודדים כדי לשמור על ארגון נתונים. - הקצה שם קובץ על-ידי הזנתו בתיבת הטקסט קידומת קובץ .
הערה: התוכנה תצרף באופן אוטומטי מספר מתקדם לסוף הקידומת בתבנית "0001". מומלץ שתהיה ערכת מתן שמות עקבית עבור הקבצים כגון: "YYYYMMDD_treatmentName_rep#_". - הגדר הגדרות לכידה אחרות באופן הבא: מאגר: 128 מסגרות (ברירת מחדל), משך זמן (בדוק): 00 שעות:01 דקות:00 s. התעלם או בטל הגדרות אחרות בכרטיסיה זו.
- הנח את צלחת ה- assay, מכסה, על במת המכשיר ומרכז אותה במסך לכידת וידאו ; הסר את המכסה.
הערה: הכן לוחות צ'קים מראש. כל צלחת מורכבת ממנת פטרי 35 מ"מ כמחצית מלאה ב- NGM לא מנוצל (ללא דשא חיידקי). - השתמש micropipette לשטוף את הבמה מסונכרנת 11 תולעים ב 1 מ"ל של M9 על צלחת בדיקות - לכוון כ 50 תולעים (איור 3D). מערבבים בעדינות את הצלחת כדי להביא את החיות למרכז או להשתמש במיקרופיפט כדי להוסיף כמה טיפות M9 כדי להפריד בעלי חיים (איור 3E). הגדר טיימר עבור 60 s כדי לאפשר לתולעים להתאקלם לשחייה.
הערה: הצלחת לא תהיה גלויה ב-100% על המסך. בעלי חיים אינם במעקב מדויק בעת חפיפה. - בזמן ששעון התזמן סופר לאחור, כוונן ידנית את מוקד המצלמה על-ידי הפיכת טבעת המיקוד על גוף העדשה של המצלמה תוך כדי צפייה בצג (איור 3F). ניתן להגדיל את התולעים באמצעות עכבר גלגל גלילה המאפשר התמקדות מדויקת יותר.
- לאחר הגדרת המוקד, התאם את ידית האור כך שהצג בהיר ככל האפשר ללא חשיפת יתר (מופיע כפיקסלים אדומים בתצוגה).
- לאחר 60, לחץ על לחצן הקלט .
הערה: הווידאו יעבור מהתצוגה החיה להקלטה ושעון התזמן יהיה גלוי. לאחר השלמת הלכידה, התצוגה 'לכידת וידאו' תחזור לתצוגה החיה (איור 1B משלים). - הסר את הצלחת לאחר ההקלטה והגדר את הצלחת הבאה. שנה את שם הקידומת לפי הצורך. לשטוף תולעים לתוך צלחת ההסתה, דגירה במשך 60 s, ולתעד כל טיפול.
- לאחר השלמת כל ההקלטות לניסוי, סגור את כרטיסיות הווידאו הפתוחות וכבה את מקור האור על-ידי הדחקת ידית הדימר.
- סגור את החלון לכידת וידאו על-ידי לחיצה על לחצן x האדום בפינה השמאלית העליונה של החלון; לחלופין, סגור את חבילת התוכנה כולה ופתח מחדש.
- הכן סרטוני וידאו למעקב.
- מתפריט סרגל צידי של זרימת עבודה , בחר את הלחצן הראשון בתפריט זה, יבא רצף תמונות, ומצא ולחץ פעמיים על וידאו. הסרטון ייפתח בחלון האמצעי (איור 2A משלים).
הערה: תצוגת ברירת המחדל עבור התוכנה היא תפריט סרגל צידי של זרימת עבודה ; ניתן לגשת לתפריט זה גם דרך התפריט הנפתח העליון של התצוגה תחת תצוגה [הצג | זרימת עבודה]. תפריט זרימת עבודה כולל מספר אפשרויות תצוגה; תצוגת הרצועה מתאימה בשלב זה בפרוטוקול. אם לחצן הגדר מידע רצף אינו גלוי בתפריט, זו אינה התצוגה הנכונה. תחילה, עיין בתחתית התפריט ובדוק שהכרטיסיה זרימת עבודה פעילה, ולאחר מכן ודא שהתצוגה מעקב פעילה על-ידי לחיצה על סמל רצועה . המיקום שבו מופיעים תפריטים בחלון תלוי בגודל הצג ובמיקום של תפריטים אחרים שנפתחו. ניתן להזיז תפריטים על-ידי גרירה ושחרור, שינוי גודל וסגירה. ניתן גם לפתוח את רוב התפריטים באמצעות התפריט הנפתח View . - מתפריט זרימת עבודה, בחר הגדר פרטי רצף (איור 2B משלים). בחלון התפריט החדש, בדוק את ערכת מתן השמות, הוסף הערות ואמת מטה-נתונים.
- ודא ששינוי קנה המידה מוגדר כראוי; קנה מידה: 11.43 מיקרומטר/פיקסל ו-Measure יתמלא אוטומטית מכיוון ש- 1000 מיקרומטר הוא 87 פיקסלים. אם גובה המצלמה הותאם באופן שונה מזה שנקבע כאן, בצע את ההוראות בתפריט זה כדי לעדכן את קנה המידה. לחץ על לחצן שמור .
- בתפריט 'זרימת עבודה', בחרו 'התאם תמונה' ותפריט מוקפץ חדש בשם ' התאמות תמונה' ייפתח (איור 2C משלים). בחר תולעים כהות על רקע בהיר (שדה בהיר).
- התאם הגדרות נוספות. הגדרות עיבוד תמונה מומלצות הן כדלקמן: החלקת רקע: 10, החלקה גאוסית: 5, מילוי חורים: 2, מסנן אובייקט קטן: 0, ולדלג על פילוח נגזר אינטגרלי.
- התאם את רמת הסף כך שבעלי החיים מלאים לחלוטין בירוק אך עדיין נבדלים מהרקע. לחץ על החל.
הערה: מותר לאסוף כמה חפצים שאינם תולעים. - מתפריט 'זרימת עבודה' , בחרו 'זהה ומעקב' (איור 2D משלים).
הערה: תפריט יופיע בצד הווידאו עם 3 כרטיסיות: זיהוי, מעקב ותיקון. הסמן ייראה כמו אצבע מאשימה כאשר הוא מעל תצוגת הווידאו. לחלופין, לחץ על סמל בחר (חץ סמן) בתפריט הסמל בפינה הימנית העליונה של התוכנה.- השתמש בכלי בורר האצבעות כדי לבחור 3-7 תולעים ולחץ על לחצן זהה תולעים בכרטיסיה זיהוי .
הערה: בחירה זו מסייעת לתוכנה לזהות תולעים במדויק עבור תנאים נתון ויש לעשות זאת עבור כל סרטון. לאחר מספר שניות, רוב התולעים יודגשו בירוק ויש להם מספר בצהוב. תולעים שנוגעות או מכורבלות ככל הנראה לא יודגשו; עם זאת, התוכנית ככל הנראה תמצא אותם במהלך המעקב. קיימת אפשרות להתאים את פרמטרי הזיהוי; עם זאת, ברירות המחדל פועלות היטב ברוב התנאים. אם מתבצעות התאמות בפרמטרים של הזיהוי, הקפד להיות עקבי בין דגימות לשכפולים.
- השתמש בכלי בורר האצבעות כדי לבחור 3-7 תולעים ולחץ על לחצן זהה תולעים בכרטיסיה זיהוי .
- עדיין בחלון זיהוי ומעקב , עבור לכרטיסיה מעקב (איור משלים 2E). בבדיקת פרמטרי מעקב השתמש במעקב לאחור, בטל את הסימון לעקוב אחר תולעים בקצה התמונה.
- הגדר את ההשערה במעקב מקס ל-5. הגדר את מצב המעקב לשחייה.
הערה: הגדרת ההשערה במעקב Max מתאימה את מספר הרצועות הפוטנציאליות של תולעת במעקב אחת ונותנת לתוכנית מרחב תמרון כלשהו באיזו מידה לעקוב אחר תולעת אחת מבלי לאבד את עקבותיה. 5 הוא תפאורה טובה לשחייה. - עבור למקטע הגדרות מתקדמות והגדר את הדברים הבאים: תולעי מסגרות יכולות לגעת בגבולות: 50, תולעי מסגרות יכולות לחפוף: 500, עמידות למיקום: 0.50, עמידות לצורה: 0.50. שמור הגדרות אלה ופרוס אותן עבור כל סרטוני הווידאו בניסוי (ומעבר לו) על-ידי שמירתן כתצורה.
הערה: סינון מעקב אינו מומלץ וניתן לבצע אותו בקלות לאחר העיבוד, עזוב. - נווט אל מנהל התצורה (סמל גלגל שיניים) בתפריט הסמל הימני העליון. בעת לחיצה, תפריט הסרגל הצידי של מנהל התצורה ייפתח. לאחר מכן, לחץ על סמל שמור (gear +), תן לתצורה זו שם ותיאור ולאחר מכן לחץ על לחצן אישור .
- כדי לגשת לתצורה זו בעתיד, פתח את תפריט תצורה , בחר את התצורה הרצויה ולחץ על סמל טען (חץ הילוך למעלה). לאחר מכן הוסף מידע רצף, אולי כוונן את רמת הסף ובחר תולעים לזיהוי. כל ההגדרות האחרות יהיו זהות.
- בתפריט זרימת עבודה , לחץ על שמור פרוייקט, אמת את מיקום השמירה והוסף שם קובץ פרוייקט (התאמת שם קובץ הפרוייקט לשם הווידאו מסייעת בהמשכיות). סגור את הוידאו.
הערה: פרוייקטים אלה נשמרים עם סוג הקובץ .wpr - חזור על הפעולה עבור כל סרטוני הווידאו: ייבוא רצף תמונות (2.18), טען תצורה שמורה (2.28.1), התאם את הסף (2.23), הגדר פרטי רצף (2.19), זהה תולעים (2.24.1), שמור את הפרוייקט (2.29), סגור וידאו.
- מעקב אחר סרטוני וידאו
- כדי לעקוב אחר קבצי הפרוייקט, עבור לתפריט זרימת עבודה ולחץ על סמל אצווה (תיקיה המכילה דפי תולעת) (איור 2F משלים).
הערה: החלונית 'עיבוד אצווה ' תוצג (איור 2G משלים). לפעמים הוא מוסתר אך ניתן לגשת אליו בתחתית תפריט זרימת עבודה של אצווה ; ייתכן שיהיה צורך להרחיב את החלון כדי לראות אותו. - לחץ על לחצן הוסף תחת המקטע בחירת קובץ בתפריט עיבוד אצווה זה. נווט אל ובחר את כל קבצי הפרוייקט ( .wpr) לעיבוד, לחץ על פתח.
הערה: תפריט עיבוד אצווה יתמלא בנתיב הקובץ שנבחר, מחוון מצב וסרגל התקדמות אפור עבור כל קובץ. - לחץ על סמל לחצן התחל (הפעל). שים לב מחוון ההתקדמות הירוקה בקובץ הראשון. אפשר עיבוד של כל הקבצים. כאשר כל הקבצים נקראים כגמורים (ירוקים), ניתן לסגור את התוכנה (איור 2G משלים).
- אם קובץ פרוייקט נתקע, שקול להפעיל את הקובץ התלוי בעצמו, פעולה זו בדרך כלל פותרת את הבעיה. אם פעולה זו אינה פותרת את הבעיה, פתח את קובץ הפרוייקט, מחק את התולעים שנבחרו (תפריט זיהוי ומעקב) ובחר מחדש מערכת אימונים חדשה. לאחר מכן מעבד מחדש את קובץ הפרוייקט.
- כדי לעקוב אחר קבצי הפרוייקט, עבור לתפריט זרימת עבודה ולחץ על סמל אצווה (תיקיה המכילה דפי תולעת) (איור 2F משלים).
- תיקון רצועות (מומלץ)
הערה: תיקון רצועות יכול להגביר את הדיוק של הרצועות. תיקונים נפוצים משלבים מסלולים השייכים בבירור לאותה תולעת כפי שהיא נצפתה על ידי העין האנושית כמו, מחיקת רצועות שאינן מדויקות או שאינן לוכדות נתוני תולעת אמיתיים, ופיצול רצועות שאינן מוצגות באופן מסולף מכיוון שהתולעים נוגעות (הסר את המקטע הרע ו לשלב רצועות מלפני ואחרי החלק המסכן אם מעשי).- פתח את התוכנה ופתח קובץ פרוייקט [קובץ | פתח פרוייקט] מעניין. לחץ על פתח ולחץ על כן כדי להשתמש בקובץ זה. המתן לטעינת מסנן הזמן. הווידאו המעובד יהיה על המסך; תולעים יודגשו בירוק ומתוארות בצהוב. השתמש בנגן הווידאו כדי לקרצף את הווידאו או להפעיל אותו.
- מתפריט 'זרימת עבודה' , בחרו 'זהה ומעקב' (איור 2D משלים). עבור לכרטיסיה תיקון . הפעל את סמן הבורר על-ידי לחיצה על סמל הכלי בורר (חץ הסמן). קרם את הווידאו, מצא ובחר רצועה של תולעת ולאחר מכן השתמש בתפריט התיקון כדי ליצור את השינוי הרצוי.
הערה: כדי לתקן אסטרטגית את רוב הבעיות במהירות, הגדל פנימה כך בערך 1/6 של הצלחת גלוי, להתחיל עם האזור המקיף את המסלול #1. לשפשף במהירות את הווידאו בדיקת תולעים המופיעות באופן מסתורי משום מקום, רצועות שבהן המספרים משתנים, או תולעים נתקלות זו בזו, עריכה כמו בעיות להתעורר. עקוב אחר תולעים בסדר מספרי ממיקום ההתחלה. יש לשפשף הלוך ושוב כדי לעקוב אחר כל תולעת לפי הצורך עד לתיקון כל הצלחת. שימו לב לשולי הצלחת; לעתים קרובות, תולעים מזויפות מופיעות בצללים של קצות צלחת.
- ניתוח נתונים
- מתפריט זרימת עבודה , בחר ניתוח נתונים (איור 3A משלים).
הערה: יופיע חלון חדש בשם ניתוח נתונים ותווייה (איור 3B משלים). לחלון זה יש דרכים רבות להעריך ולהציג את נתוני התנועה של אוכלוסיית התולעים של קובץ פרוייקט מסוים. רוב הניתוחים הללו מאפשרים בחירה של תולעים ספציפיות, מרובות או כל תולעים מתוך וידאו נתון המאפשרת התוויית מידע מעקב בדרכים שונות. - כדי לנתח את ספירת הפניות, נווט אל תקציר המעקב [מיקום ומהירות | סיכום רצועה] (איור משלים 3C). השתמש בלחצן ייצוא בפינה השמאלית התחתונה כדי לייצא נתונים בתבנית הניתנת לקריאה בגיליון אלקטרוני (.csv), בחר נתיב למיקום הרצוי של הגיליון האלקטרוני, כולל שינוי שם למשהו בלתי נשכח. הגדרות ברירת המחדל הן בחירה טובה (איור תלת-ממדי משלים).
- הדבק נתונים אלה, כמו גם ערכות נתונים רלוונטיות אחרות של פרוייקט בחוברת עבודה מאוחדת של גיליון אלקטרוני (איור 3E משלים).
- השתמש בספירת הספירה ובמעקב כדי לחשב תורות לדקה עבור כל רצועה באמצעות פונקציות גיליון אלקטרוני (=משך סיבובים/רצועה * 60) או השתמש במדד אחר לפי הצורך (איור 3F משלים).
הערה: פניות לדקה לוכדות מידע דומה מאוד כמו חבטה ידנית assay שהוא מדד בשימוש נרחב של פעילות בנוזל, אבל יש אפשרויות רבות, וזה בהחלט אפשרי כי מדד אחר עשוי לזהות נתונים מעניינים אחרים עבור טיפול נתון או השוואה. - אם תרצה, מסך עבור גודל תולעת, משך זמן מעקב ו/או מדדים נבחרים אחרים באמצעות כלי עיצוב מותנה כדי לסמן רצועות להסרה אם הן עלולות להיות מבלבלות. שמור על עיבוד נתונים עקבי בין טיפולים לשכפולים.
- לנתח נתונים באמצעות ניתוחים סטטיסטיים מתאימים כגון t-test של סטודנט עבור 2 זנים, או ANOVA 1-way עבור 3 זנים או יותר. בצע שכפולים ניסיוניים עצמאיים בימים שונים ועם אוכלוסיות עצמאיות של תולעים עבור לפחות 3 שכפולים ניסיוניים עצמאיים.
- מתפריט זרימת עבודה , בחר ניתוח נתונים (איור 3A משלים).
תוצאות
הן הקטר הרדיאלי והן מתקן השחייה מציעים זיהוי רגיש של ליקוי תנועתיות (איור 4 ואיור 5). כדי לחקור את המנגנונים שבבסיס TDP-43 הפתולוגי ב- ALS, פותחו מודלים C. elegans המבטאים סוג פראי או ALS מוטציה אנושי TDP-43 פאן-נוירונים. בעלי חיים אלה מציגים מאפיינים מולקולריים ותאיים המזכירים ALS, כולל תפקוד לקוי של המנוע9. חשוב לציין, הם מפגינים פגיעה תנועתית מתונה עם הביטוי של TDP-43 אנושי מסוג בר ופגיעה תנועתיות חמורה יותר בבעלי חיים המבטאים ALS-מוטציה TDP-43 באמצעות קטר רדיאלי ובוחאי שחייה. לחלק מבעלי החיים המוטנטים או מהונדסים תהיה פגיעה גדולה יותר בזחילה מאשר בשחייה, או להיפך. על ידי שימוש בשתי עשייה שונה, מתקבלת תמונה ברורה יותר של הבדלים פנוטיפיים בין זנים.
קטר רדיאלי
כאשר הם מונחים על צלחת אגר זרעים, C. elegans לחקור את סביבתם, כולל מחפש את הגבולות של מקור המזון שלהם. בחינות קטר רדיאליות הן דרך אחת לנצל התנהגות זו כמדד לכושר גופני. על ידי ניתוח התנהגות locomotor (זחילה על משטח מוצק) בצורה מבוקרת וכימות, assay locomotor רדיאלי מציע כלי פשוט ויעיל להערכת חומרת ליקויים מוטוריים ופנוטיפים אחרים הקשורים מוטורית. קטר רדיאלי בוחן הבדלים תנועתיות בתולעים מודל ALS לקוי בינוני או חמור ומציע קו בסיס להשוות אפנון של פנוטיפים תנועתיות או שינויים תנועתיות עם הגיל (איור 6). אסטרטגיה זו יכולה להיות מיושמת כדי לכמת את התנהגות הזחילה של כל זן ששינה את התנועה מסוג פראי (N2) או תולעי שליטה. עם זאת, שיטה זו לא יכולה להיות בחירה טובה להעריך בעלי חיים שאינם מסוגלים לזחול כרגיל, כגון מוטציות רולר או בעלי חיים משותקים. בדרך כלל, תולעים מסוג בר יציג תזוזה ממוצעת בין 200-300 מיקרומטר/דקה כאשר מוגבה ונבדק ב 20 °C (70 °F). הנתונים לדוגמה המוצגים באיור 4 מראים תוצאות צפויות המשווה בין N2, שני זנים מהונדסים שונים המבטאים TDP-43 אנושי מסוג בר עם פנוטיפ עדין [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] או פנוטיפ חזק יותר [TDP-43(WT-מתון), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])]]], זן מהונדס המבטא מוטציה אנושית TDP-43 עם פנוטיפ חמור [TDP-43(M337V), CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), וזן מהונדס המבטא חלבון אחר הקשור למחלות ניווניות, טאו אנושי מסוג בר [Tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. שני הזנים המביעים סוג פראי TDP-43 יש דרגות שונות של ליקוי כפי שזוהה על ידי קטר רדיאלי. TDP-43(WT-low) אינו שונה באופן משמעותי מ- N2, בעוד TDP-43(WT-high) אכן מציג הבדלים ברורים בתנועתיות. לזני TDP-43(M337V) ו-Tau (WT) יש ליקויים חמורים יותר בתנועתיות.
שחייה
ג. אלגנים עוסקים בתנועת שחייה סטריאוטיפית (חבטות) כאשר הם שקועים בנוזל. מיד עם הטביעה, תולעים מתחילות לכופף את הראש והזנב באופן אופייני זה כלפי זה בזווית כיפוף של כ -45 מעלות, כאשר קודקוד הזווית הוא נקודת האמצע של התולעת. תולעים מתכופפות לסירוגין בכיוונים הגחון והיתרמי. חבטה אחת, כפי שהיא נמדדת על ידי התוכנה, מייצגת את התנועה של מעבר מזווית ישרה לזווית כיפוף גוף של 20° ומעלה, ללא קשר לכיוונים (ניתן להתאים את סף הזווית לאחר העיבוד בחלון הניתוח והתוויה [זרימת עבודה | ניתוח | נתונים | צורת גוף זווית כיפוף | | נקודת אמצע סף משרעת: # מעלות]. מטען השחייה המתואר כאן משתמש במעקב וניתוח אוטומטיים מבוססי מחשב כדי לספק ניקוד לא משוחד של פעילות השחייה. צפוי כי תולעים מסוג בר (N2) יהיה ממוצע בין 150-200 thrashes לדקה כאשר מוגבהת ומתועדת ב 20 °C (70 °F). הנתונים לדוגמה המוצגים באיור 5, מראים תוצאות צפויות השוואת N2, שני זנים מהונדסים שונים המבטאים TDP-43 אנושי מסוג בר עם פנוטיפ מתון [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] או פנוטיפ חזק יותר [TDP-43(WT-מתון), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])],], וזן מהונדס המבטא חלבון אחר הקשור למחלות ניווניות, טאו אנושי מסוג בר [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. הזן הטרנסגני המבטא את מוטציית ALS TDP-43 [TDP-43(M337V)] אינו חבט בנוזל, ולכן הוא מסומן בגרף כ- ND (ללא נתונים). בדיקת ישבן זו יכולה להפלות פנוטיפים שונים מבוחן הקטר הרדיאלי המוצג באיור 4. לדוגמה, בבוחן הקטר הרדיאלי (איור 4), TDP-43(WT-low) לא היה שונה באופן משמעותי מ-N2. עם זאת, בשחייה (איור 5), הן TDP-43(WT-low) והן TDP-43(WT-high) שונים באופן משמעותי מ- N2, כמו גם שונים באופן משמעותי זה מזה. כמו כן, למרות שגם TDP-43(M337V) וגם Tau(WT) סובלים מליקויי זחילה חמורים על ידי קטר רדיאלי (איור 4), רק טאו (WT) מסוגל להכות מספיק כדי להיות במעקב על ידי התוכנה (איור 5). בעלי חיים TDP-43(M337V) אינם מסוגלים להכות, וניתוח מבוסס תוכנה אינו מזהה או עוקב אחר תולעים אלה במדויק. לכן, נתונים על תולעים אלה לא נאספו (ND, אין נתונים).
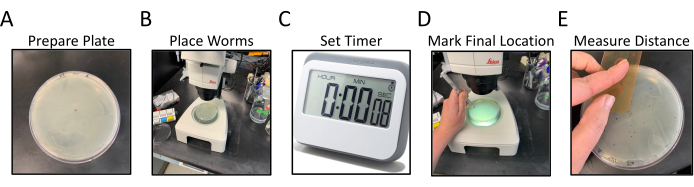
איור 1: זרימת עבודה של תהליך עבודה של תהליך תהליך עבודה של טיסת קטר רדיאלי. לוחות A-E מראים את הצעדים הכלליים של תריסת הקטר הרדיאלי. השלבים הם כדלקמן: (A) לוחות NGM, עם OP50 זרעים לקצוות, מוכנים על ידי תיוג וסימון נקודה מרכזית, (B) תולעים ממוקמות במרכז אגר כפי המסומן על ידי הנקודה המרכזית, (C) תולעים מורשות לנוע בחופשיות במשך פרק זמן מוגדר, (D) צלחת הוא התהפך בתחתית ואת המיקום הסופי של כל תולעת מסומן בצבע שונה מאשר הנקודה המרכזית, (ה) המרחק מהנקודה המרכזית לכל מיקום תולעת סופי נמדד ביד או באופן דיגיטלי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
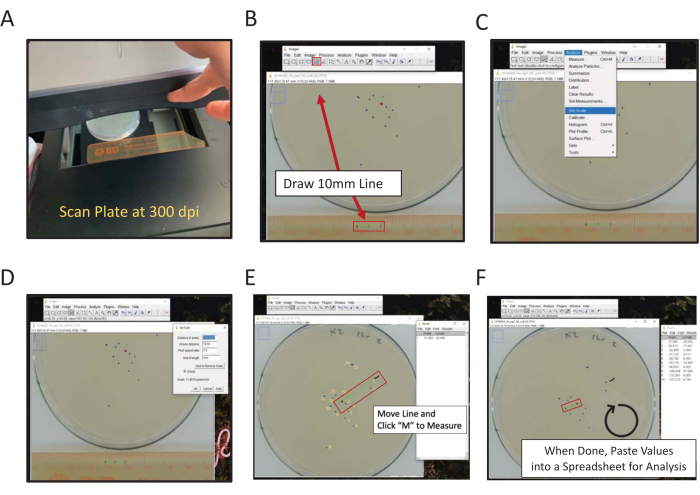
איור 2: מדידה דיגיטלית של המיקום הסופי באמצעות ImageJ. ניתן למדוד מרחק ממדידות מרכזיות באופן ידני או דיגיטלי, כדי למדוד באופן דיגיטלי באמצעות ImageJ (A) סריקה אחורית של הצלחת עם סרגל במסגרת. (ב) צייר אורך ידוע באמצעות כלי הקו. (ג) השתמש באורך הידוע שצויר ב- (B) כדי להגדיר קנה מידה [ניתוח | הגדר קנה מידה...]. (ד) השתמש בכלי הקו כדי לצייר קו מנקודת המרכז לסימן מיקום סופי, חזור על הפעולה עבור כל סימן. (ה) קו מברשת צבע המסמן את הסימן הראשון נמדד עזרים בניקוד (קו שחור משורבט ליד סימן 1). סימוני מיקום סופיים ממוספרים בצהוב כדי להמחיש את כיוון הניקוד. (ו) מדידות נרשמות בחלון התוצאות. שמור תוצאות במקום אחר לניתוח סטטיסטי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: חומרים והתאמות חומרה לשימוש בתוכנה. (א) חומרים המשמשים לבדיקת השחייה בסיוע התוכנה. (ב) הגדרת כללית של התוכנה והחומרים הדרושים, שים לב כי הדיור נמצא במצב מוגבה. (C) ניתן לכוונן את גובה הסוגר להרכבה על העדשה. תמונה זו מציגה את הרצועה המתכווננים ומחוון סרט המסמן את הגובה המועדף לביצוע צילומי שחייה. יש צורך להתאים את האור הבהיר ואת מוקד המצלמה לפני ההקלטה. (D) צלחת מ"מ 35 מ"מ מונחת על הבמה, בעלי חיים ב- M9 מתווספים לצלחת, ושעון זמן של דקה אחת מתחיל. (ה) לפעמים זה יתרון לסובב בעדינות את הצלחת כדי להזיז תולעים קרוב יותר למרכז - להתבונן מיקום על מסך לכידה חי; לחלופין, כמה טיפות של M9 מצינור יכול לשמש כדי להפריד תולעים. (ו) התאימו את טבעת המיקוד לעדשת המצלמה, צפו בתולעים על המסך כדי לקבוע את המיקוד האופטימלי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
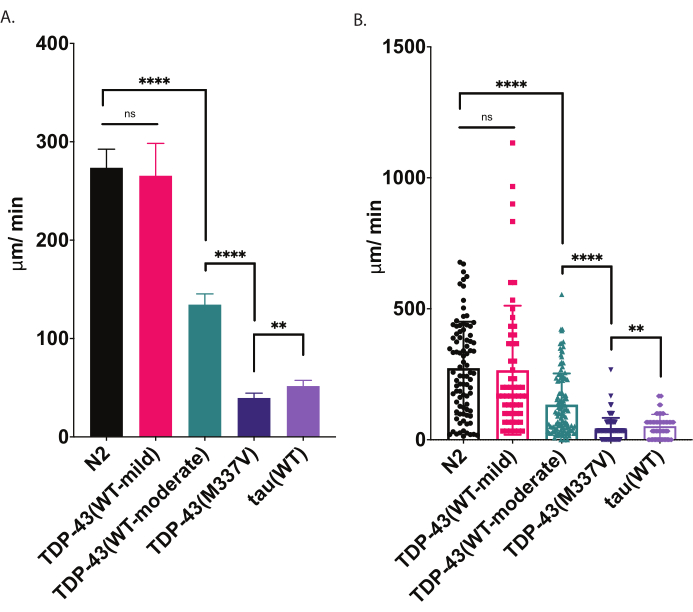
איור 4: התקפות קטר רדיאליות מזהות הבדלים במהירות הזחילה. פיזור לא מוגדר של זחלי L4 מבוימים התפתחותית נמדד באמצעות תפילת התנועה הרדיאלית שתוארה לעיל וגרפה כ- μm / min נסע (A-B). אותם נתונים המותווים ב- (A) ו- (B) מדגימים שתי מצגות גרפיות אפשריות שונות. ב- (A), הנתונים מוצגים כגרף עמודות, מה שהופך את ההבדלים היחסיים בין זנים ברורים יותר. ב- (B), ההעתקה הסופית של כל תולעת מועתקת בתוך הגרף, ומאפשרת לדמיין טוב יותר את השונות בתוך האוכלוסייה. כדי להעריך את המשמעות בקרב זנים שנבדקו, נעשה שימוש בניתוח חד כיווני של שונות (ANOVA) עם בדיקת ההשוואה המרובה של טוקי. **p=0.0022, ****p<0.0001, ns=לא משמעותי. TDP-43(M337V) ו tau (WT) שונים גם הם באופן משמעותי מ- N2, p<0.0001. קווי שגיאה ב- (A) הם שגיאה סטנדרטית של הממוצע (SEM) וב- (B) הם סטיית תקן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
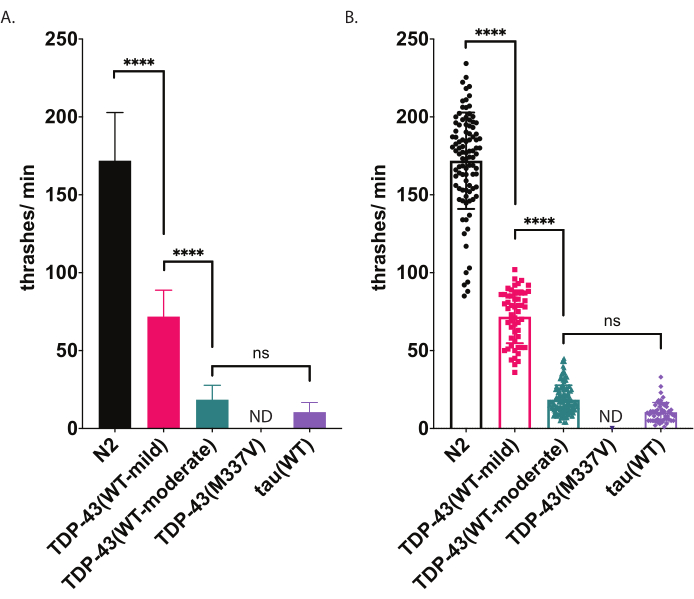
איור 5: עשיית שחייה מזהה הבדלים של חבטות בנוזל. שיעורי השחייה (חבטות או תדירות גלגול בנוזל) נמדדו באמצעות ניקוד וניתוח לא משוחדים בסיוע מחשב שתוארו לעיל וגרפו כ- thrashes / min (A-B). אותם נתונים המותווים ב- (A) ו- (B). ב- (A), הנתונים גרף כגרף עמודות, מה שהופך את ההבדלים היחסיים בין זנים קלים יותר לראות. ב- (B), נתונים מכל תולעת בודדת שהושרטטו מתווים בתוך הגרף, ומאפשרים לדמיין טוב יותר את השונות בתוך האוכלוסייה. כדי להעריך את המשמעות בקרב זנים שנבדקו, נעשה שימוש בניתוח חד כיווני של שונות (ANOVA) עם בדיקת ההשוואה המרובה של טוקי. p<0.0001, ns =לא משמעותי. TDP-43(WT-moderate) ו- tau(WT) שונים גם הם באופן משמעותי מ- N2, p<0.0001.Error bars ב- (A) הם שגיאה סטנדרטית של הממוצע (SEM) וב- (B) הם סטיית תקן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
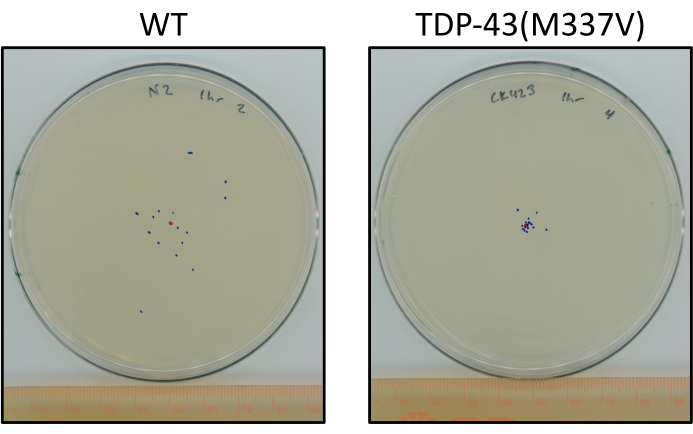
איור 6: תולעי מוטציה TDP-43 נוסעות פחות מתולעים מסוג בר. לוחות המציגים הבדל מייצג במיקום הסופי של L4 N2 מבוים (סוג פראי) ו- TDP-43 (M337V) (CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), זן המבטא מוטציה אנושית TDP-43 עם תפקוד מוטורי לקוי קשות לאחר שעה אחת של זחילה ללא גיתוי בטמפרטורת החדר. לוחות מסומנים בנקודה אדומה לנקודת המרכז ונקודות כחולות למיקום הסופי של בעלי החיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 1 משלים: הקלטת התנהגות השחייה באמצעות תוכנת ההדמיה והמעקב. (א) זרימת העבודה של המעקב והמיקום של סמל לכידת הווידאו. (ב) החלון 'לכידת וידאו' מוצג בתצוגה חיה, וההיבטים החשובים ביותר מסומנים. המילים הירוקות "תצוגה חיה" ישתנו ל"הקלטה" אדומה בעת הפעלת לחצן ההקלטה. נא לחץ כאן כדי להוריד קובץ זה.
איור 2 משלים: הכנה ומעקב אחר התנהגות השחייה. איור זה מציג סדרה של צילומי מסך כדי לסייע בהגדרת רצף תמונות וידאו למעקב. הפרוטוקול הכללי להכנת רצף וידאו הוא לפתוח כל תפריט זרימת עבודה בסדר זה: ייבוא רצף תמונות | הגדרת | מידע רצף התאמת | תמונה זיהוי ומעקב אחר | שמור פרוייקט. ניתן להשתמש בחלון ניתוח נתונים רק לאחר מעקב אחר קובץ פרוייקט. (א) מציג קובץ .avi (וידאו) שנפתח לאחר ייבוא הרצף לתוכנה מתוך זרימת העבודה Track . (B) החלון 'קבע מידע רצף' מספק מקום לה הערות, להגדיר/לשנות את קנה המידה ולבדוק אם קיימים במטה-נתונים רצף וידאו. הוראות לשינוי קנה המידה נמצאות בחלון זה ויש לעקוב אחריהן כאשר המצלמה מונמכת או מורמת (B). תמונה (C) מציגה את הגדרות החלון 'התאם תמונה '. (D) צילום מסך המציג את כרטיסיית הזיהוי של החלון זיהוי ומעקב . זיהוי תולעים משמש לאימון התוכנה ויש להגדיר אותו עבור כל רצף וידאו. ניתן להגדיר פרמטרי זיהוי נוספים כאן אם תרצה בכך. (ה) צילום מסך של הכרטיסיה מעקב בחלון זיהוי ומעקב עם ההגדרות המומלצות למעקב אחר התנהגות השחייה. זהו השלב האחרון בהגדרת רצף וידאו. שמור את הרצף כפרוייקט באמצעות החלון שמור פרוייקט . חזור על שלבים אלה עבור כל רצף וידאו. ניתן לשמור הגדרות כתצורה כדי להפחית את עומס העבודה ולהבטיח שכל הרצפים יטופלו באופן זהה (לא מוצג). כדי לעקוב אחר קבצי פרוייקט לצורך ניתוח, נווט אל זרימת העבודה של האצווה . (ו) מציג את הסמל המשמש לניווט לזרימת העבודה של האצווה , ו- (G) מציג את חלון עיבוד האצווה, מדגיש את לחצני ההוספה וההתחלה ומציג את המראה הצפוי של קובץ פרוייקט שעוקב אחריו. נא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: ניתוח התנהגות שחייה. לאחר מעקב אחר קובץ פרוייקט, ניתן לפתוח אותו באמצעות [קובץ | פתח פרוייקט]. תולעים יופיעו בירוק כפי שמוצג ב( A). קרצוף דרך הווידאו מציע בדיקה מהירה כי הווידאו מעובד כצפוי, הדגשה ירוקה תיעלם תוך קרצוף. החלון ניתוח נתונים והתוויה נפתח מפריט זרימת העבודה 'ניתוח נתונים '. (ב) מציג את החלון ניתוח נתונים והתוויה עם תצוגת מיקום פתוחה (ברירת מחדל), כל הרצועות מסומנות. מתחת לנקודות הנתונים יש התוויה המציגה את הרצועה המוקלטת עבור כל תולעת מסומנת. ניתוח סיכום הרצועה משמש לחישוב סיבובים לדקה. (C-D) הצג את דוח סיכום הרצועה ואת פרטי הייצוא. (E-F) הצג את סיכום הרצועה בגיליון אלקטרוני וכיצד לחשב סיבובים לדקה, הפלט הנמדד בבוחן זה. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
קטר רדיאלי:
הרזולוציה של מעש זה נשלטת בקלות על ידי שינוי משתנה הזמן. הגדלת משך הזמן מקלה על התבוננות בהבדלים בין בעלי חיים עם פנוטיפים חמורים, ובכך מזהה הבדלים עדינים. עם זאת, מכיוון שניסיון זה מודד עקירה, אם זמן ההסתה הוארך זמן רב מדי, בעלי חיים עם תנועתיות נורמלית, כגון N2, ייסעו לשולי הצלחת, והתנהגות חיפוש מזון תוביל לנסיגה. זה יקטין באופן מלאכותי את מדידת המרחק שעבר. פרקי זמן ארוכים מדי עלולים לגרום להיעלמותם של הבדלים בין זנים, במיוחד בין בעלי חיים עם פנוטיפים מוטוריים פחות חמורים, כמו בעלי חיים להיות מפוזרים באופן שווה על פני הצלחת. קיצור משתנה הזמן ימנע מתולעים פעילות יותר למצוא את קצוות הלוח. שיטה זו אינה עוקבת אחר המרחק הכולל שעבר עבור כל תולעת, אלא דוחסת את המרחק שעבר עבור כל תולעת למרחק ליניארי ממרכז הצלחת. ככזה, הוא מטבעו פחות חזק מאשר שיטה המתעדת את אורך המסלול הכולל של תולעים בודדות. עם זאת, הבדיקה של הקטר הרדיאלי דורשת מעט מאוד הכשרת חוקרים, משתמשת בריאגנטים זולים יחסית הזמינים בדרך כלל ברוב מעבדות התולעים, והיא רגישה מספיק כדי לייצר תוצאות משמעותיות וניתן לשחזור. עבור מעבדות המעדיפות מעקב אוטומטי אחר וידאו, הוקמו בעבר מספר שיטות כדי לעקוב ולנתח תנועות סריקה12, או שניתן לשנות את פרמטרי התוכנה המשמשים לבדיקת השחייה במאמר זה כדי לאפשר זיהוי וניתוח סריקה.
ניסוי זה נעשה בדרך כלל בשכפולים עצמאיים משולשים, עם קבוצה של 30-40 תולעים לכל שכפול. כל שכפול מחולק לשתי לוחות שונים של 100 מ"מ או 150 מ"מ, עם 15-20 תולעים לצלחת. שימוש ביותר תולעים מהמומלץ לכל צלחת יכול להקשות על הניקוד ביעילות. מספר כולל של 90+ מופעל מספיק כדי לקבוע משמעות לפגיעה קלה, בינונית או חמורה בתנועתיות. להיות עקבי עם תזמון בין זנים ציון חיוני לדיוק רבייה. 30 דקות זה בדרך כלל מספיק זמן כדי ליצור הבדלים בין פנוטיפים בינוניים עד חמורים כמו זנים מהונדסים המבטאים מוטציה אנושית TDP-43 בהשוואה לתולעים מסוג בר (איור 4). אם משתנה הזמן יוארך, מומלץ גם להגדיל את גודל הצלחת מ 100 מ"מ ל 150 מ"מ. גורמים סביבתיים כגון טמפרטורה ולחות יכולים להשפיע על בדיקת ישבן זו, אשר מתבצעת בדרך כלל בטמפרטורת החדר הסביבה, ולכן חשוב תמיד להשתמש בבקרה מסוג בר (N2) בעת השוואה בין שכפולים. בנוסף, זה בדיקות יכול למדוד את תנועתיות של כמה זנים שאינם מפגינים התנהגות שחייה נורמלית בנוזל (חבטות), מה שהופך אותו השלמה שימושית כדי assay השחייה.
שחייה:
השימוש במערכת ההדמיה והרכישה כדי להפוך את המעקב והניתוח של שחייה בתולעים לאוטומטיים מאפשר נתונים קפדניים ובלתי משוחדים. עם זאת, ישנם מספר גורמים במהלך ההתקנה הראשונית של הניסוי כי צריך להיות נשלט בין דגימות. אלה כוללים את הזמן להתאקלם לנוזל לפני תחילת ההקלטה, תנאי סביבה (כלומר, טמפרטורה, לחות), והגדרות אור והקלטה עקביות. בשלב ההקלטה, ישנן מספר תכונות המסייעות להפחית את השונות בין הצלחות. אלה כוללים מצלמה משולבת המותקנת על מסלול ושלב שדה בהיר שהופך את הקלטת הווידאו לעקבית בין לוחות, סיכוך סביב הבמה המונע השתקפויות, בוהק ותנועות אוויר בזמן ההקלטה, וחבילת תוכנה חזקה המזהה באופן אמין תולעים ומאפשרת תיקון ידני של רצועות בעיבוד וידאו. בפרוטוקול זה, קטעי וידאו של צלחת 35 מ"מ עם תולעים נרשמים במשך 1 דקה ולאחר מכן מעובד באמצעות חבילת התוכנה. לאחר העיבוד, תיקון ידני של רצועות מבטיח שהתנהגויות תולעת תירשם במדויק מבלי לבלבל שגיאות מעקב. נתוני ספירת הספירה והמעקב משמשים לקביעת תורות לדקה כהקראה סופית. כדי להבטיח רבייה, הנתונים נאספים על פני מינימום של 3 ניסויי שכפול עצמאיים, כל אחד עם 40-50 בעלי חיים ציון, כדי להשיג מספר סופי משולב של בעלי חיים 120-150. מספר זה מספיק כדי להפלות הבדלים קטנים בהתנהגות השחייה מתולעי בקרה. לחלק מהתולעים יש ליקויים מוטוריים חמורים מכדי להיתפס על ידי עשייה שוחה. לדוגמה, אם בעלי החיים ממוקמים בתלתל בינוני נוזלי במקום לבצע את התגובה החבטות הצפויה, תם זה לא לתעד תנועות אלה במדויק ובוחן תנועה אחר, כגון תנועה רדיאלית, עשוי ללכוד טוב יותר את פגמי תנועתיות אלה. הפרוטוקול שסופק משתמש במערכת הדמיה זמינה מסחרית (ראה טבלת חומרים לקבלת פרטים נוספים), אך מערכות מעקב אחר תולעים אחרות עשויות לספק כלי דומה, כאשר חלקן מקורות פתוחים12. שיטות שפורסמו בעבר מתארות ניקוד ידני של תולעת thrashing13. בעוד שהניתוח האוטומטי מייצר מספר מדדים עבור כל תולעת בודדת, זיהוי כיפופי גוף הנמדדים בתהכים לדקה, מספק תוצאות עקביות בין ניסויים ומעקבים היטב עם ניקוד קונבנציונלי של תולעים thrashes בעין.
Disclosures
המחברים מצהירים כי אין להם גילויים.
Acknowledgements
אנו מודים לסוקרים על הערות והצעות מועילות. אנו מודים לאלין סקסטון, ברנדון הנדרסון וג'ייד סטיר על הסיוע הטכני יוצא הדופן. אנו מודים לבריאן קריימר ורבקה קו על הסיוע בפיתוח המעשים הללו. חומר זה הוא תוצאה של עבודה הנתמכת במשאבים ושימוש במתקנים במערכת הבריאות של VA Puget. עבודה זו נתמכה על ידי מענק מארה"ב (ארה"ב) המחלקה לענייני יוצאי צבא (VA) מעבדה ביו-רפואית מחקר ופיתוח שירות [מענק סקירת הצטיינות #I01BX004044 N.F.L.]
Materials
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
References
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved