Method Article
筋萎縮性側索硬化症の C.エレガンス モデルにおける運動障害の評価
要約
このプロトコルは、筋萎縮性側索硬化症の C.エレガンス モデルにおける軽度、中等度、重度の運動障害を識別するための2つの敏感なアッセイを記述し、 C.エレガンス 株の一般的な有用性を有する運動性を有する。
要約
神経変性疾患筋萎縮性側索硬化症(ALS)は、筋力低下や運動障害を伴う運動ニューロンの進行性喪失を特徴とし、時間とともに悪化します。患者のサブセットに対するALSの遺伝的要因を決定する際にかなりの進歩がなされているが、大多数の症例は未知の病因を有する。さらに、運動ニューロン機能不全と変性の根底にあるメカニズムはよく理解されていません。したがって、これらのプロセスを研究するために代表的なモデルを開発し、特徴付ける必要が続いています。 カエノハブディティス・エレガンスは 、実験室環境で研究された2つの主要な運動パラダイムで、固体表面を這い、液体で泳ぐ2つの主要な運動パラダイムで、周囲の物理的な制約に彼らの動きを適応させることができます。これらは、感覚、運動ニューロン、および筋肉の間の複雑な相互作用を表しています。ALSの C.エレガンス モデルは、これらの運動パラダイムの一方または両方に障害を示すことができます。このプロトコルは、 C.エレガンスの運動性を評価するための2つの敏感なアッセイを記述します:固体表面でクロールを測定する最適化された放射状移動アッセイと、液体中の水泳を追跡および分析するための自動化された方法(スラッシング)。ALSモデルのベースライン運動障害の特徴付けに加えて、これらのアッセイは、遺伝的または低分子の介入による表現型の抑制または増強を検出することができる。したがって、これらの方法は、ALSモデルおよび変化した運動性を示す 任意のC.エレガン株 を研究するための有用性を有する。
概要
筋萎縮性側索硬化症(ALS)は、運動ニューロンに特に影響を与える衰弱、老化関連の神経変性疾患です。この疾患は、脳および脊髄および進行性運動障害における運動ニューロンの喪失を特徴とする。これは、大きな機能的障害および早期死亡をもたらし、典型的には診断後3〜5年以内に1。少なくとも38遺伝子の突然変異はALSを引き起こす可能性があります。しかし、ALSを有するほとんどの患者は、ニューロンおよびグリア細胞におけるその主要な病理としてタンパク質TDP-43のユビキチン化含包物を蓄積する2,3,4。ALS in vivo(レビューin5)を引き起こしたり寄与したりする根本的なメカニズムを研究するために、多くの動物モデルが開発されています。C.エレガンスでは、これらのモデルには、ALSを引き起こす遺伝子のホモログにおける遺伝子機能喪失変異またはヒトALS遺伝子のトランスジェニック発現が含まれる。C.エレガンスでALSをモデリングすることには多くの利点があります。C.エレガンスは、分化された神経系、よく特徴付けられた行動パラダイム、およびヒトに対するかなりの遺伝的相同性を持つ難解な単純な動物である6,7。C.エレガンスとの連携には、堅牢なゲノム編集機能、神経変性の生体内蛍光レポーター、RNAiスクリーニングパラダイム、難解遺伝学、確立された行動および表現法アッセイなど、多くのツールが存在します。ALSのC.エレガンスモデルは、不溶性タンパク質の蓄積、神経変性、早期死亡を含むヒト疾患の側面を再現する8,9.さらに、クロールと水泳の両方の挙動の乱れを特徴とする運動障害は、多くのC.エレガンスALSモデルに存在する。
このプロトコルは、C.エレガンス運動表現型を特徴付ける2つの方法、すなわち、固体表面でのクロールを評価するための放射状の移動アッセイと、WormLab自動追跡および分析を用いた液体中の泳動(スラッシング)の評価について説明する。モータの欠陥を特徴付けるためのこれらの敏感な方法は、重症度の比較を可能にし、抑制と運動の特性の強化を測定するためのツールを提供します。放射状移動アッセイは、ワームの集団間のクロール運動性(固体表面上の副次的な動き)の違いを定量化します。このアッセイは、プレート上の単一の場所にワームを配置し、特定の期間のtime10の後に最終的な位置をマークすることによって、C.エレガンス自然な刺激されない探査行動を利用します。あるいは、液体(スラッシング)アッセイで泳ぐことは、一定期間にわたって個々のワームの体の曲がりの数を数えます。人間の目による身体の曲げの手動カウントは時間がかかり、通常は実験者間でかなりの変動性を示します。コンピュータ支援の自動追跡と分析を使用することで、その変動の多くを排除できます。ALSモデルのベースライン運動障害の特徴付けに加えて、放射状運動と水泳アッセイの両方が、遺伝的または低分子の介入から異なる運動表現型の変調を検出することができる。これらの方法は、ALSモデルおよび変化した運動性を示すC.エレガン株を研究するための有用性を有する。
プロトコル
1. 放射状移動アッセイ
- 100 mm または 150 mm 直径ペトリ皿の約半分の線虫増殖培地 (NGM) を準備し、寒天の表面全体をカバーする OP50 細菌の均一な芝生を播種します。
- NGMアッセイプレートを逆さまに反転し、C .エレガン株 をアッセイする識別子で底にラベルを付け、1株当たり2プレートにします(図1A)。
- 上下逆さまのプレートの中央にマーカーを付けた小さなドットを作ります(図1A)。
- 解剖顕微鏡で作業している間、15-20段入りの15〜20個の組み込みマッチ11ワームを、プラチナワイヤーピック(図1B)を使用して、中央ドット(NGMを通して見える)の上にアッセイプレートの中心に直接移します。
注: すべてのワームを同時に、またはできるだけ早く転送するようにしてください。- プレートの中央にワームを配置した後、30分間のタイマーを設定します。蓋をプレートに戻し、脇に置きます(図1C)。
- すべての株が指定されたアッセイプレート上に入るまでワームの移送を続け、プレート間の移動にかかる時間を約1分にします(プレート間で~1分を目指します)。すべてのプレートを設定した順序と同じにします。
- 30分後、最初のプレートの得点を開始します。
- 蓋を外し、プレートの裏面を解剖顕微鏡の下に置き、プレートの背面が上向きになり、NGM寒天が視線とワームの間にあります。プレートは通常の使用法から逆さまになります。
- 寒天を通して虫が見えるまで顕微鏡の焦点を調節しなさい。
- センターポイントから異なる色のフェルトチップペンを使用して、各ワームの位置に小さなドットを入れて - 最も遠位の動物を見つけるために細菌の芝生を通してワームトラックに従ってください。
- いくつかのワームがそこに終わる可能性があるので、プレートの端を確認してください。また、中心点ドット内のワーム数をカウントして記録します(図1D)。
- すべてのプレートが30分の活動時間を持つような順番にすべてのアッセイプレートをマーキングし続け、プレートの設置にかかった時間を考慮するように注意してください。次に、手順 1.8 または 1.9 の説明に従って、手動またはデジタル測定を行います。
- ルーラーを使用して手動で測定を行います。
- ルーラーを使用して、各ワームの中心点から最終的な位置のマーキングまでの距離をミリメートル単位で測定し、距離を記録します。スコアリング中の進行状況を追跡するには、最初のスコア付けポイントに小さなマーキングラインを付けます。
- 時計回りにプレートを回転させることにより、各ドットの長さデータを連続して記録します(図1E)。
- スキャナとImageJを使用してデジタル計測を行います。
- フラットベッドスキャナーを使用して、定規(スキャン面に面した数字)の横にあるアッセイプレートの背面をスキャンします(図2A)。
- スキャンしたプレートイメージを ImageJ または同様のプログラムで開きます。
メモ: ImageJ は、NIH がホストする無料の Java ベースのイメージ処理ソフトウェアです。 - 直線ツールをクリックし、ルーラーのスキャンした画像上に1cmと2cmのポイントを接続する線を描きます(図2B)。
メモ: Shift コンピュータキーを押すと、ラインが最も近い45°の角度に強制的に移動します。 - [分析]メニューに移動し、スケールを設定するために使用します(解析|スケールを設定)(図2C)。
- 適切なボックスに 既知の距離 (10)と 長さの単位 (mm)を入力し、ピクセル数で距離を調整しません。各 ImageJ セッションで分析されるすべての画像に同じスケールを適用するには、[ Global ] をオンにします。それ以外の場合は、開くたびに各画像の尺度を設定します(図2D)。[ OK] をクリックします。
注: ステップ 1.9.2 - 1.9.5 は測定スケールを設定するために実行されます。この画像の計測値は、定義されたピクセルの長さ(長さ)に自動的に関連付けられます。300 dpi でスキャンした画像は、1mm当たり約 11.8 ピクセルの関係になります。 - ペイントブラシ ツールを使用して、最初にスコアを付けるポイントのすぐ上にマークを付けます。
注: これは、最初に採点されたワームの視覚的な指標です。 - 直線ツールを使用して、中心点から最初のワームデータポイントまでの線を描画します。
- キーボードの M キーをクリックして距離を計測します。または、[ 分析 ] メニューに移動し、[ メジャー ] (分析 |測定)。どちらの場合も、測定は新しいウィンドウに表示されます。このウィンドウは、画像ごとにすべての測定値を収集します。
- 中心点を一定に保ち、最初のワームポイントに接する線の端点を次のワームポイントに移動し、時計回りに移動して、 測定する M キーをクリックします。
- すべてのポイントが得点されるまで、時計回りに各ポイントを測定し続けます。
-
長さ測定データをスプレッドシートにコピーして貼り付けて保存します。次に、スキャンしたプレートイメージごとにこの手順を繰り返します。
注: ステップ 1.9.6 ~ 1.9.11 では、ワームの変位値を測定します(図 2E-F)。
- 統計分析を実行します。
- 1 回の実験で反復を結合して、合計得点数が 30 ~ 40 のワームの間になるようにします。
- 異なる日に独立した実験複製を実行し、ワームの独立集団で3つの独立した実験複製で終わる。
- 2系統のスチューデントt検定や3株以上の一方向ANOVAなどの適切な統計分析を使用してデータを分析します。
2. コンピュータ解析による水泳アッセイ
注: このプロトコルには、市販の WormLab ハードウェアおよびソフトウェア システムの詳細な手順が 含まれています (資料一覧を参照してください)。しかし、ワークフローは、他のコンピュータ解析された水泳アッセイシステムに適用することができます。
- ビデオの設定と録画
- イメージング ハードウェアでシールドを上げて(図 3)、カメラの高さが予想される位置に設定されていることを確認します。
注:35 mmプレート上のワームを取り込む最適な高さは、下部ネジ式ネジボアの3番目の穴が調整可能なカメラ取り付けブラケットの下に見えますが、ネジボアの上に追加の取り付け穴は見えません(図3C)。これにより、キャプチャ比は11.43μm/ピクセルになります。アッセイを開始する前に確認しやすいように、「正しい高さ」インジケータを追加することを検討してください。高さ調整については、プロトコルステップ2.18を参照してください。 - 関連するソフトウェアを開きます(補足図1A)。
- [ビデオ キャプチャ] アイコン (真ん中に右向きの三角形が表示されたフィルム) をクリックして、新しいビデオ キャプチャ ウィンドウを開きます。カメラはライブビューに表示されますが、ディスプレイは黒色になります(補助図1B)。
- 調光ノブを押し下げ、時計回りに回してライトを調整します。
メモ:調光器ノブは、明視野光源の近くの画像システムのステージ上にあります。 ビデオキャプチャ ライブビューディスプレイは、黒から照明に変わります。 - ビデオキャプチャウィンドウに戻って、設定タブをクリックし、次のように調整します:ビデオモード:2456 x 2052_Mono8、フレームレート:14、出力:モノクロ、露出:0.00300 s、ゲイン:1 dB、ガンマ:1、180回転(オン)。
- [ キャプチャ ]タブに戻ります。記録フォルダを選択します(補足図1B)。
注: これは、すべての録音とプロジェクト ファイルが格納される場所です。個々の実験用に固有のフォルダを作成し、データを整理します。 - ファイル名を割り当てるには、[ ファイルの接頭辞 ] テキスト ボックスにファイル名を入力します。
注: ソフトウェアは自動的に"0001"の形式でプレフィックスの末尾にプログレッシブ番号を追加します。"YYYYMMDD_treatmentName_rep#_" のようなファイルに対して一貫した命名方式を使用することをお勧めします。 - 次のように、他の キャプチャ 設定を設定します: バッファ: 128 フレーム (デフォルト) 、期間 (チェックオン): 00 h:01min:00 s.このタブの他の設定を無視するか、オフにします。
- デバイスステージに蓋をして、それをビデオキャプチャ画面に中央に置き、 それを中央 に置きます。ふたを取り外します。
注:事前にアッセイプレートを準備してください。各プレートは、播種されていない(細菌の芝生なし)NGMの約半分の35ミリメートルペトリ皿で構成されています。 - マイクロピペットを使用して、M9の1mLで1mLのステージ同期11 ワームをアッセイプレートに洗浄し、約50ワームを目指します(図3D)。プレートをそっと旋回して動物を中心に持ち込むか、マイクロピペットを使用してM9を数滴加え、動物を分離します(図3E)。60 sのタイマーを設定して、ワームが水泳に順応できるようにします。
メモ:プレートは、画面に100%表示されません。動物は重なっている間正確に追跡されません。 - タイマーがカウントダウンしている間、ディスプレイを見ながらカメラのレンズ本体に焦点を合わせると、カメラの焦点を手動で調整します(図3F)。より正確な焦点を合わせることができるようにスクロールホイールマウスを使用してワームを拡大することができます。
- フォーカスを設定した後、過度に露出することなくディスプレイができるだけ明るいようにライトノブを調整します(ディスプレイ上に赤いピクセルとして表示されます)。
- 60 s の後で 、録音 ボタンを押します。
注:ビデオは ライブビュー から 録画 に行き、タイマーが表示されます。キャプチャが完了すると、 ビデオキャプチャ ディスプレイが ライブビュー に戻ります(補助図1B)。 - 録音後にプレートを取り外し、次のプレートをセットします。必要に応じて、プレフィックスの名前を変更します。ワームをアッセイプレートに洗浄し、60sのインキュベートし、各治療を記録します。
- 実験のすべての録画を完了したら、開いているビデオタブを閉じて、調光ノブを押して光源をオフにします。
- ウィンドウの右上隅にある赤い x ボタンをクリックしてビデオ キャプチャ ウィンドウを閉じます。または、ソフトウェアパッケージ全体を閉じてから、もう一度開いてください。
- トラッキング用のビデオを準備します。
- [ワークフロー] メニューで、[ シーケンス情報の設定] を選択します (補助図 2B)。新しいメニュー ウィンドウで、名前付けスキームを確認し、メモを追加し、メタデータを検証します。
- スケーリングが正しく設定されていることを確認します。 スケール:11.43 μm/ピクセルと メジャー は1000 μmが87ピクセルであるため、自動充填されます。カメラの高さがここで指定した設定とは異なる場合は、このメニューの指示に従ってスケールを更新します。[ 保存 ] ボタンをクリックします。
- [ワークフロー] メニューで [ イメージの調整] を選択すると、 イメージ調整 という新しいポップアップ メニューが開きます (補助図 2C)。 「明るい背景(明るいフィールド)で暗いワーム」を選択します。
- 追加の設定を調整します。推奨 画像処理設定 は次のとおりです: 背景スムージング: 10、 ガウススムージング: 5、 穴を埋める:2、 小さなオブジェクト フィルタ: 0、 整数微分セグメンテーションをスキップします。
- 動物が完全に緑色で満たされているが、まだ背景とは異なっているような しきい値 レベルを調整します。[ 適用] をクリックします。
注: ワームではないオブジェクトを拾うことは許されます。 - [ ワークフロー ] メニューで、[ 検出と追跡 (補助図 2D)] を選択します。
注: 3 つのタブでビデオの横にメニューが表示されます: 検出、 追跡、 および修復します。カーソルは、ビデオ表示の上に指差しのように見えます。または、ソフトウェアの左上にあるアイコンメニューの 選択 アイコン(カーソルの矢印)をクリックします。- 指選択ツールを使用して 3 ~7 のワームを選択し、[検出] タブの [ワームの検出] ボタンをクリックします。
注: この選択により、ソフトウェアは特定の条件に対するワームを正確に識別し、ビデオごとに実行する必要があります。数秒後、ほとんどのワームは緑色で強調表示され、黄色の数字が表示されます。触れたり、丸めたりしているワームは、ハイライトされない可能性が高くなります。ただし、プログラムは追跡中に見つかる可能性が高くなります。検出パラメータを調整するオプションがあります。ただし、ほとんどの条件ではデフォルトが適切に機能します。検出パラメータを調整する場合は、サンプルと反復の間で一貫性があることを確認してください。
- 指選択ツールを使用して 3 ~7 のワームを選択し、[検出] タブの [ワームの検出] ボタンをクリックします。
- [ 検出と追跡 ] ウィンドウで、[ 追跡 ] タブに移動します (補助図 2E)。 追跡パラメータ で[ バックトラッキングを使用]チェックボックスをオンにし、 画像の端にあるワームを追跡するをオフにします。
- [最大追跡仮説]を 5 に設定します。トラッキングモードをスイミングに設定します。
注: [最大追跡仮説] 設定では、1 つの追跡対象ワームが持つことが許可されている潜在的なワームトラックの数を調整し、1 つのワームを追跡せずに追跡する方法をプログラムに提供します。5は水泳に適しています。 - [詳細設定] セクションに移動し、次の設定: フレーム ワームは境界に触れることができます: 50、フレームワームは重複することができます: 500、位置許容差: 0.50、形状許容値: 0.50。これらの設定を保存し、構成として保存して、実験 (およびそれ以降) のすべてのビデオに対して展開します。
注: トラックフィルタリング はお勧めできませんし、簡単に後処理を行うことができます、 オフにしておきます。 - 左上のアイコン メニューの [構成マネージャー ] (歯車アイコン) に移動します。クリックすると、 構成マネージャ サイドバーメニューが開きます。次に、 保存(ギア+)アイコンをクリックし、この設定に名前と説明を付け、[ OK ]ボタンをクリックします。
- 今後この設定にアクセスするには、[ 設定] メニューを開き、目的の設定を選択して、[ ロード ](ギアアップ矢印)アイコンをクリックします。次に、シーケンス情報を追加し、しきい値レベルを微調整し、検出するワームを選択します。その他の設定はすべて同じになります。
- [ ワークフロー ] メニューの [ プロジェクトの保存] をクリックし、保存場所を確認してプロジェクト ファイル名を追加します (プロジェクト ファイル名をビデオ名に一致させると、連続性が保たれる)。ビデオを閉じます。
注: これらのプロジェクトは、.wpr ファイルタイプで保存されます。 - すべてのビデオに対して繰り返します: イメージ シーケンスのインポート (2.18)、保存された構成の読み込み (2.28.1)、しきい値(2.23)、設定されたシーケンス情報(2.19)、ワームの検出(2.24.1)、プロジェクトの保存(2.29)、ビデオを閉じます。
- 動画を追跡する
- プロジェクト ファイルを追跡するには、[ ワークフロー ] メニューに移動し、[ バッチ (ワーム ページを含むフォルダー)] アイコンをクリックします (補足図 2F)。
メモ: バッチ処理 パネルが表示されます(補足図2G)。場合によっては、非表示ですが、 バッチワークフロー メニューの一番下にアクセスできます。ウィンドウを表示するには、ウィンドウを拡張する必要があります。 - このバッチ処理メニューの[ファイルの選択]セクションの下にある[追加]ボタンをクリックします。処理するすべてのプロジェクト ファイル (.wpr) に移動して選択し、[開く] をクリックします。
注: [バッチ処理] メニューには、選択したファイル パス、ステータス インジケータ、および各ファイルのグレーの進行状況バーが表示されます。 - [スタート](再生ボタンアイコン)をクリックします。最初のファイルの緑色の進行状況インジケータに注意してください。すべてのファイルを処理できるようにします。すべてのファイルが完了(緑)として読み取られると、ソフトウェアを閉じることができます(補助図2G)。
- プロジェクト ファイルが滞る場合は、ハングアップ ファイルを単独で実行することを検討してください。これで問題が解決しない場合は、プロジェクト ファイルを開き、選択したワームを削除し([検出 と 追跡 ]メニュー)、新しいトレーニング セットから再選択します。その後、プロジェクト ファイルを再処理します。
- プロジェクト ファイルを追跡するには、[ ワークフロー ] メニューに移動し、[ バッチ (ワーム ページを含むフォルダー)] アイコンをクリックします (補足図 2F)。
- トラックの修復 (推奨)
メモ:トラックを修復すると、トラックの精度が向上します。一般的な修正は、人間の目が見たのと同じワームに明らかに属するトラックを組み合わせたり、正確でないトラックや実際のワームデータをキャプチャしないトラックを削除したり、ワームが触れているために誤って表現されたトラックを分割することです(悪いセクションを削除し、実用的であれば貧弱なセクションの前後のトラックを組み合わせます)。- ソフトウェアを開き、プロジェクトファイルを開く [ファイル|関心のあるプロジェクトを開きます。[ 開く ] をクリックし、[ はい ] をクリックしてこのファイルを使用します。時間フィルターがロードされるのを待ちます。処理されたビデオは画面上に表示されます。ワームは緑色で強調表示され、黄色で囲まれます。ビデオプレーヤーを使用して、ビデオをスクラブまたは再生します。
- [ ワークフロー ] メニューで、[ 検出と追跡 (補助図 2D)] を選択します。 [修復 ] タブに切り替えます。 セレクタ ツールアイコン(カーソルの矢印)をクリックして 、セレクタ カーソルをアクティブにします。ビデオをスクラブして、ワームトラックを見つけて選択し、修復メニューを使用して必要な変更を作成します。
注: ほとんどの問題を戦略的に迅速に解決するには、プレートの約 1/6 が 表示されるようにズームインし、トラック #1 の周囲の領域から始めます。不思議なことにどこからともなく現れるワームをビデオチェックで素早くスクラブし、数字が変わる場所を追跡したり、ワームが互いにぶつかるのを追跡したり、問題が発生したときに編集します。開始位置から数値順にワームに従ってください。プレート全体が修復されるまで、必要に応じて各ワームに従うように前後にスクラブします。プレートの端に注意してください。多くの場合、偽のワームは、プレートエッジの影に表示されます。
- データ分析
- [ ワークフロー ] メニューの [データ分析 ] を選択します (補足図 3A)。
注: データ分析とプロット という名前の新しいウィンドウが表示されます (補助図 3B)。このウィンドウには、特定のプロジェクト ファイルのワームの作成の移動データを評価および表示するさまざまな方法があります。これらの解析の大部分は、特定のビデオから特定の、複数、またはすべてのワームを選択でき、トラック情報をさまざまな方法でプロットすることができます。 - ターン数を分析するには、[ トラックの概要][位置と速度]|[トラックの概要] (補助図 3C)。右下の [エクスポート ]ボタンを使用して、スプレッドシートの読み取り可能な形式(.csv)でデータをエクスポートし、スプレッドシートの希望する場所へのパスを選択します。デフォルト設定は、良い選択です(補助図3D)。
- このデータと、その他の関連するプロジェクト データセットを、統合されたスプレッドシート ブックに貼り付けます (補足図 3E)。
- [ターン数]と[トラック期間]を使用して、スプレッドシート関数(=ターン/トラックデュレーション* 60)を使用する各トラックの1分あたりのターン数を計算するか、必要に応じて別のメトリックを使用します(補足図3F)。
注:毎分ターンは、液体中の活動の広く使用されているメトリックである手動スラッシングアッセイとして非常によく似た情報をキャプチャしますが、多くのオプションがあり、異なるメトリックが特定の治療または比較のために他の興味深いデータを識別する可能性があります。 - 必要に応じて、ワームのサイズ、追跡期間、および/または条件付き書式ツールを使用して選択したメトリックを画面に表示し、トラックが混乱している可能性がある場合は、削除対象のトラックをハイライト表示します。処理と反復の間で一貫したデータ処理を維持します。
- 2株のスチューデントt検定、3株以上の一方向ANOVAなどの適切な統計分析を使用してデータを分析します。異なる日に独立した実験複製を実行し、少なくとも3つの独立した実験複製のためのワームの独立集団と。
- [ ワークフロー ] メニューの [データ分析 ] を選択します (補足図 3A)。
結果
放射運動と水泳の両アッセイは運動障害の敏感な検出を提供する(図4および図5)。ALSにおける病理学的TDP-43の基礎となるメカニズムを調べるには、野生型またはALS変異型ヒトTDP-43汎ニューロンを発現するC.エレガンスモデルが開発された。これらの動物は、運動機能障害9を含むALSを連想させる分子および細胞特性を示す。重要なことに、それらは、野生型ヒトTDP-43の発現と、放射状移動と水泳アッセイの両方を用いてALS変異TDP-43を発現する動物においてより重度の運動障害を有する中程度の運動性障害を示す。一部の突然変異動物またはトランスジェニック動物は、水泳よりもクロールに大きな障害を持ち、その逆も同様です。2つの異なる運動性アッセイを用いることで、株間の表現型の違いのより鮮明な画像が得られる。
放射状移動
播種された寒天プレートの上に置くと、C.エレガンスは、彼らの食料源の境界を探すなど、周囲を探検します。放射状移動アッセイは、その行動を体力の指標として利用する1つの方法です。制御された定量化可能な方法で運動運動の振る舞い(固体表面でのクロール)を分析することにより、放射状運動アッセイは、モータの欠陥および他のモータ関連表現型の重症度を評価するためのシンプルで効果的なツールを提供します。放射状移動アッセイは、中等度または重度の障害を有するALSモデルワームにおける運動性の違いを捉え、運動性表現型の変調または運動性の変化を年齢と比較するベースラインを提供する(図6)。この戦略は、野生型(N2)または制御ワームからの動きを変化させた株のクロール動作を定量化するために適用することができます。しかし、この方法は、ローラー変異体や麻痺している動物など、正常にクロールできない動物を評価するのに適していない可能性があります。通常、野生型ワームは、20°Cで上昇して試験すると、200〜300 μm/minの平均変位を示します。 図4に示すサンプルデータは、N2、野生型ヒトTDP-43を発現する2つの異なるトランスジェニック株を軽度の表現型[TDP-43(WT-マイルド)』、CK402(bkIs402[Psnb-1::TDP-43)と比較する期待結果を示しています。プミオ-3::GFP]))または強い表現型[TDP-43(WT-中等度)』、CK410(bkIs402[Psnb-1::TDP-43;; Pmyo-2::GFP]))、重症の表現型を有する変異型ヒトTDP-43を発現するトランスジェニック株[TDP-43(M337V)、CK423(bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP))、および別の神経変性疾患関連タンパク質を発現するトランスジェニック株、野生型ヒトタウ[タウ(WT)]、[CK144(bkIs144[Paex-3::tau(4R1N);プミオ-2::GFP]]野生型TDP-43を発現する2つの株は、放射状移動によって検出される障害の程度が異なります。TDP-43(WT-low)はN2と大きく異なっていませんが、TDP-43(WT-high)は明らかな運動性の違いを示しています。TDP-43(M337V)およびタウ(WT)株は運動性においてより重篤な障害を有する。
水泳アッセイ
C.エレガンスは、液体に浸漬するとステレオタイプの水泳(スラッシング)運動に従事する。水中に入るとすぐに、ワームは特徴的に頭と尾を約45°の曲げ角で互いに曲げ始め、角度頂点はワームの中間点になります。ワームは腹側および後側方向で交互に曲がる。ソフトウェアで測定された 1 つのスラッシュは、方向に関係なく、直線からボディベンド角度 20°以上への移動を表します (角度しきい値は、分析およびプロット ウィンドウ内で後処理を調整できます [ワークフロー |データ|の分析ボディシェイプ|曲げ角度|ミッドポイント|振幅しきい値: #度]ここで説明する水泳アッセイは、自動コンピュータベースの追跡と分析を使用して、水泳活動の公平なスコアリングを提供します。野生型(N2)ワームは、20°Cで飼育および記録すると、1分あたり平均150〜200スラッシングが発生すると予想されます。 図5に示すサンプルデータは、N2、野生型ヒトTDP-43を軽度の表現型を有する2つの異なるトランスジェニック株を比較する予想結果を示す[TDP-43(WT-マイルド)]、[CK402(bkIs402[Psnb-1::TDP-43;; プミオ-3::GFP]))または強い表現型[TDP-43(WT-中等度)』、CK410(bkIs402[Psnb-1::TDP-43;; Pmyo-2::GFP])、および別の神経変性疾患関連タンパク質を発現するトランスジェニック株、野生型ヒトタウ[タウ(WT)]、[CK144(bkIs144[Paex-3::タウ(4R1N))。プミオ-2::GFP]]ALS変異型TDP-43[TDP-43(M337V)]を発現するトランスジェニック株は液体中ではスラッシュしないため、グラフ上ではND(データなし)と表記されています。このアッセイは、図4に示す放射状移動アッセイとは異なる表現型を識別することができる。例えば、放射状移動アッセイ(図4)では、TDP-43(WT-low)はN2と有意に変わらなかった。しかし、水泳アッセイ(図5)では、TDP-43(WT-low)とTDP-43(WT-high)の両方がN2とは大きく異なり、互いに大きく異なります。また、TDP-43(M337V)とタウ(WT)の両方が放射運動による重度のクロール障害を有する(図4)にもかかわらず、ソフトウェアによって追跡されるほどのトー(WT)しかスラッシュできない(図5)。TDP-43(M337V)動物は、スラッシングすることができず、ソフトウェアベースの分析では、これらのワームを正確に検出または追跡しません。したがって、これらのワームに関するデータは収集されませんでした(ND、データなし)。
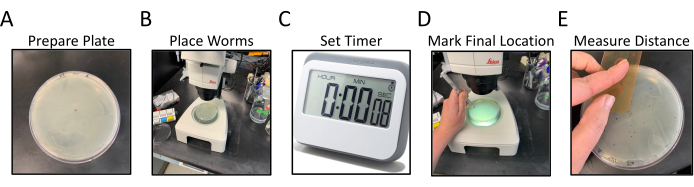
図1:放射状移動アッセイのワークフロー パネル A-E は放射状移動アッセイの一般化されたステップを示す。ステップは次のとおりです:(A)NGMプレートは、エッジに播種されたOP50で、中央ドットにラベリングとマーキングによって調製され、(B)ワームは中央ドットでマークされた寒天の中心に配置され、(C)ワームは一定の時間自由に移動することができ、(D)プレートは下に反転され、各ワームの最終的な位置は異なる色のドットでマークされます (E) 中央ドットから各最終ワーム位置までの距離を、手で、またはデジタルで測定します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
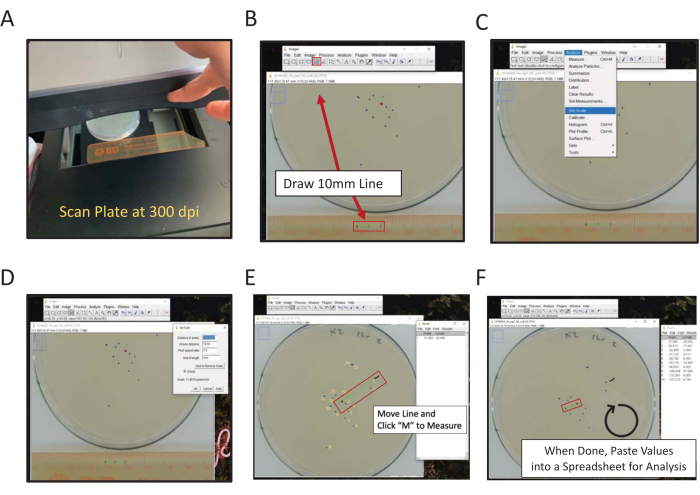
図2 ImageJを用いた最終位置のデジタル測定 中心測定値からの距離は、手またはデジタルで測定することができ、フレーム内の定規でプレートの裏面をImageJ(A)スキャンを使用してデジタル測定することができます。(B) 線ツールを使用して、既知の長さを描きます。(C) (B) で描かれた既知の長さを使用して、スケールを設定します [分析|スケールを設定します。(D) ライン ツールを使用して、中心点から最終位置マークまでの線を描画し、各マークに対して繰り返します。(E)最初のマークを示すペイントブラシラインは、得点の補助を測定しました(1マーク付近の黒い線)。最終的な位置マークは、スコアリングの方向性を示すために黄色で番号が付けられています。(F) 測定値は結果ウィンドウに記録されます。統計分析のために結果を他の場所に保存します。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:ソフトウェアを使用するための材料とハードウェアの調整。 (A)ソフトウェア支援水泳アッセイに使用される材料。(B)ソフトウェアの一般的なセットアップおよび必要な材料は、ハウジングが上げられた位置にあることに注意してください。(C) レンズ取付金ブラケットの高さは調整可能です。この画像は、水泳アッセイを実行するための好ましい高さを示す調整可能なトラックとテープインジケータを示しています。記録する前に明視野光とカメラの焦点を調整する必要があります。(D)ステージ上に35mmのアッセイプレートを設置し、M9中の動物をプレートに添加し、1分タイマーを開始する。(E)ワームを中央に近づけるためにプレートを穏やかに旋回させるのは、ライブキャプチャ画面の位置を観察する方が有利な場合があります。あるいは、ピペットからのM9の数滴を使用してワームを分離することができます。(F)カメラレンズのフォーカスリングを調整し、最適な焦点を決定するために画面上のワームを観察します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
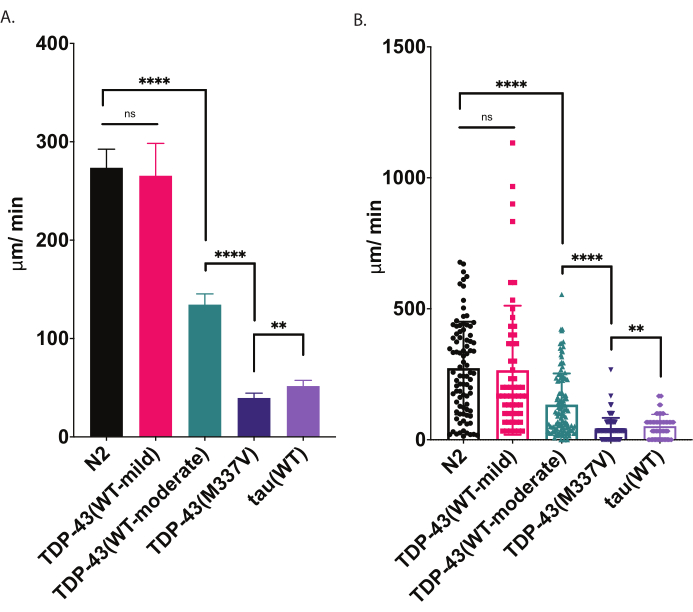
図4:放射状移動アッセイは、クロール速度の違いを検出します。 発生ステージL4幼虫の非刺激分散を、上述の放射状移動アッセイを用いて測定し、μm/min走行(A-B)としてグラフ化した。(A)と(B)にプロットされた同じデータは、2つの異なるグラフィカル・プレゼンテーションを示しています。(A)では、データが棒グラフとして表示され、歪み間の相対的な違いが明確になります。(B)では、各ワームの最終的な変位がグラフ内にプロットされ、母集団内の変動をより良く視覚化することができます。試験した株の有意性を評価するために、Tukeyの多重比較検定を用いた一方向分散分析(ANOVA)を用いた。**p=0.0022,****p<0.0001,ns=有意ではありません。TDP-43(M337V)とタウ(WT)も、N2、p<0.0001とは大きく異なります。(A)の誤差範囲は平均値(SEM)の標準誤差であり、(B)は標準偏差です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
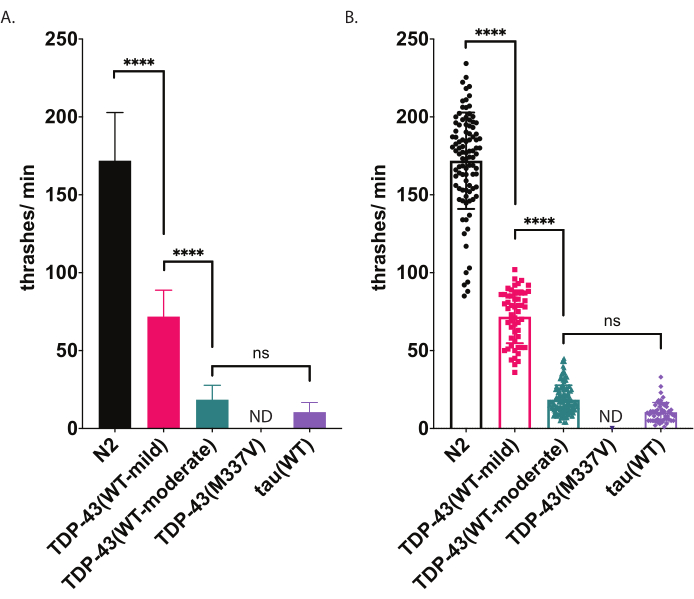
図5:水泳アッセイは、液体中のスラッシングの違いを検出します。 水泳の速度(液体中のスラッシングまたは起起き周波数)は、上記の公平なコンピュータ支援スコアリングおよび分析を使用して測定し、スラッシング/分(A-B)としてグラフ化した。(A)と(B)にプロットされた同じデータ。 (A)では、データは棒グラフとしてグラフ化され、ひずみ間の相対的な違いが見やすくなります。(B)では、各々のワームの得点データがグラフ内にプロットされ、母集団内の変動をより良く視覚化することができます。試験した株の有意性を評価するために、Tukeyの多重比較検定を用いた一方向分散分析(ANOVA)を用いた。p<0.0001、ns=有意ではありません。TDP-43(WT-中等度)とタウ(WT)もN2とは大きく異なり、p<0.0001.誤差バー(A)は平均(SEM)の標準誤差であり、(B)は標準偏差です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
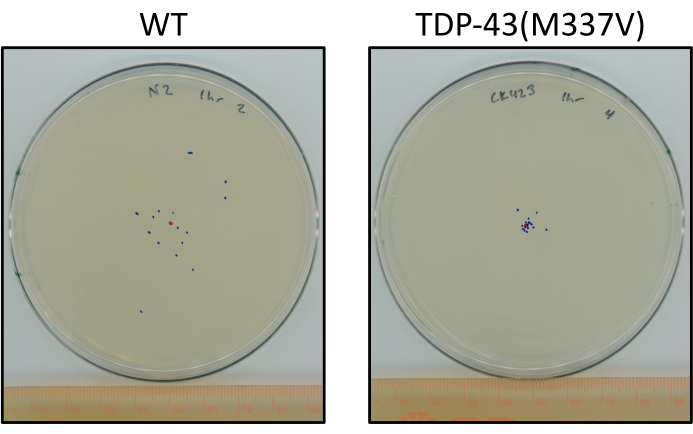
図6:変異型TDP-43ワームは野生型のワームよりも少ない移動を示す。 ステージL4 N2(野生型)とTDP-43(M337V)の最終位置における代表的な違いを示すプレート(CK423(bkIs423[Psnb-1::TDP-43;; Pmyo-2::GFP]))、室温で1時間の無刺激クロール後に運動機能が著しく損なわれた変異型ヒトTDP-43を発現する株である。プレートには、中心点の赤い点と、動物の最終的な位置に青い点が付いています。この図の大きなバージョンを表示するには、ここをクリックしてください。
補助図1:イメージングおよびトラッキングソフトウェアを使用した水泳動作の記録(A) トラッキング ワークフローとビデオ キャプチャ アイコンの場所。(B) ライブビューにビデオキャプチャウィンドウが表示され、最も重要な側面が強調表示されます。緑色の「ライブビュー」の単語は、録音ボタンがアクティブになると赤い「録音」に変わります。このファイルをダウンロードするには、ここをクリックしてください。
補足図 2: 水泳行動の準備と追跡この図は、トラッキング用のビデオ画像シーケンスの設定に役立つ一連のスクリーンショットを示しています。ビデオ シーケンスを準備するための一般的なプロトコルは、次の順序で各ワークフロー メニューを開く|シーケンス情報の設定|イメージ|を調整する|の検出と追跡プロジェクトを保存します。[データ分析] ウィンドウは、プロジェクト ファイルを追跡した後でのみ使用できます。(A) は、トラック ワークフロー内からソフトウェアにシーケンスをインポートした後に開いた.avi(ビデオ)ファイルを示します。(B) [シーケンス情報の設定]ウィンドウには、ノートの表示、スケールの設定/変更、およびビデオシーケンスのメタデータのチェックができます。スケールを変更する方法はこのウィンドウに表示され、カメラが下げたり上げたりしたときに従う必要があります(B)。イメージ(C)は、画像調整ウィンドウの設定を示しています。(D) [検出と追跡] ウィンドウの [検出] タブを示すスクリーンショット。検出するワームはソフトウェアのトレーニングに使用され、ビデオ シーケンスごとに設定する必要があります。必要に応じて、追加の検出パラメータをここで設定できます。(E) スイミング動作の追跡に推奨される設定を含む [検出と追跡] ウィンドウの [追跡] タブのスクリーンショット。これは、ビデオ シーケンスを設定する最後の手順です。「プロジェクトの保存」ウィンドウを使用して、シーケンスをプロジェクトとして保存します。ビデオ シーケンスごとに上記の手順を繰り返します。設定を設定として保存して、ワークロードを削減し、すべてのシーケンスが同じ (表示されていない) 処理されるようにすることができます。分析対象のプロジェクト ファイルを追跡するには、バッチ ワークフローに移動します。(F) は Batch ワークフローに移動するために使用するアイコンを示し、(G) バッチ処理ウィンドウを表示し、追加ボタンと開始ボタンを強調表示し、追跡されたプロジェクト ファイルの予想される外観を示します。このファイルをダウンロードするには、ここをクリックしてください。
補助図3:水泳挙動解析 プロジェクト ファイルを追跡した後、[ファイル] |を使用して開くことができます。[プロジェクトを開く](A)に示すように、ワームは緑色で表示されます。ビデオをスクラブすると、ビデオが期待どおりに処理され、スクラブ中に緑色のハイライトが消えてしまうというクイックチェックが提供されます。[データ分析とプロット] ウィンドウは、[ データ分析 ] ワークフロー アイテムから開きます。(B)は、位置ビューが開いた状態でデータ解析ウィンドウとプロットウィンドウを表示し(デフォルト)、すべてのトラックがハイライト表示されます。データポイントの下には、強調表示された各ワームの記録されたトラックを示すプロットがあります。トラックサマリー解析は、1 分あたりのターン計算に使用されます。(C-D) は、トラックの概要レポートとエクスポートの詳細を表示します。(E-F)は、このアッセイで測定された出力を、スプレッドシートでトラックの概要を示し、毎分回転数を計算する方法を示す。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
放射状移動:
このアッセイの分解能は、時間変数を変更することで容易に制御できる。時間の長さを増やすと、重症の現象を持つ動物の違いを観察しやすくなって、微妙な違いを識別できます。しかし、このアッセイは変位を測定するため、アッセイ時間が長く延長されると、N2などの正常運動性を持つ動物がプレートの端まで移動し、飼育行動がバックトラッキングにつながる。これにより、移動距離の測定が人為的に減少します。長すぎる期間は、動物がプレート全体に均等に分散するにつれて、特に重度の運動表現型の動物間で、株間の違いが消失する可能性があります。時間変数を短くすると、よりアクティブなワームがプレートのエッジを見つけないようにします。この方法では、各ワームの総移動距離は追跡されませんが、各ワームの移動距離はプレートの中心から直線距離に圧縮されます。したがって、個々のワームのトラックの全長を記録する方法よりも、本質的に堅牢性が低くなります。しかし、放射状移動アッセイは研究者の訓練をほとんど必要とせず、ほとんどのワームラボで一般的に入手可能な比較的手頃な価格の試薬を使用し、重要で再現可能な結果を生み出すのに十分な感度を持っています。自動ビデオトラッキングを好むラボでは、クロールの動きを追跡および分析するためのいくつかの方法が以前に確立されているか、この論文の水泳アッセイに使用されるソフトウェアパラメータを変更してクロールの検出と分析を可能にする可能性があります。
この実験は通常、独立した複製で30〜40ワームのセットで行われます。各複製は、プレートあたり15〜20ワームで、2つの異なる100ミリメートルまたは150ミリメートルプレートに分割されます。プレートごとに推奨されるよりも多くのワームを使用すると、効率的に得点することが困難になる可能性があります。90以上のスコアの総数は、軽度、中等度、または重度の運動障害の重要性を確立するのに十分なパワーを与えられています。スコア付けされた株間のタイミングと一致することは、正確さと再現性のために不可欠です。30分は、一般に、野生型のワームと比較してヒト変異型TDP-43を発現するトランスジェニック株などの中等度から重度の表現型間の差を確立するのに十分な長さである(図4)。時間変数を拡張する場合は、プレートのサイズを100mmから150mmに増やすことをお勧めします。温度や湿度などの環境要因は、通常は周囲室温で行われるこのアッセイに影響を与える可能性があるため、反復間で比較する場合は常に野生型(N2)コントロールを使用することが重要です。さらに、このアッセイは、液体中の正常な水泳挙動を示さないいくつかの株の運動性を測定することができ(スラッシング)、水泳アッセイに有用な補完物となる。
水泳アッセイ:
イメージングおよび取得システムを使用して、ワームスイミングの追跡と分析を自動化することで、厳格で公平なデータを可能にします。ただし、実験の初期設定時には、サンプル間で制御する必要があるいくつかの要因があります。これらには、記録を開始する前に液体に順応する時間、周囲の状態(すなわち、温度、湿度)、および一貫した光および記録設定が含まれる。録音段階では、プレート間の変動を減らすのに役立ついくつかの機能があります。これには、統合されたトラックマウントカメラと明視野ステージが含まれ、記録中に反射、グレア、空気の動きを防ぐステージの周りをシールドし、ワームを確実に検出し、ビデオ後処理でトラックを手動で修正できる堅牢なソフトウェアパッケージが含まれます。このプロトコルでは、ワームを含む35 mmプレートのビデオが1分間記録され、ソフトウェアパッケージを使用して処理されます。処理後、追跡エラーを混乱させることなく、ワームの動作を正確に記録することが、トラックの手動修正によって保証されます。ターンカウントとトラック期間データは、最終読み出しとして毎分のターンを決定するために使用されます。再現性を確保するために、データは、40〜50匹の動物が採点された3つの独立した複製実験の少なくとも3つにわたって収集され、120〜150の動物の組み合わせの最終的な数を達成する。この数は、水泳の動作の小さな違いをコントロールワームから区別するのに十分です。一部のワームは、水泳のアッセイで捕獲するにはあまりにも深刻な運動の欠陥を持っています。例えば、動物が予想されるスラッシング応答を行う代わりに液体媒体カールに入れられた場合、このアッセイはそれらの動きを正確に記録せず、放射状移動などの別の運動アッセイはそれらの運動性欠陥をよりよく捕捉する可能性がある。提供されたプロトコルは、市販のイメージングシステム(詳細については 資料表 を参照)を使用しますが、他のワーム追跡システムは、オープンソース12と同様のユーティリティを提供する可能性があります。以前に公開されたメソッドは、ワームスラッシング13の手動スコアリングについて説明しています。自動分析では、個々のワームごとに多くのメトリックが生成されますが、1 分あたりのスラッシングで測定されるボディ ベンドの検出は、従来のワームスラッシングのスコアリングで実験とトラックの間で一貫した結果を提供します。
開示事項
著者らは、開示がないと宣言している。
謝辞
私たちは、役に立つコメントや提案のためのレビュー担当者に感謝します。素晴らしい技術支援を受けたアレーン・サクストン、ブランドン・ヘンダーソン、ジェイド・ステアに感謝します。ブライアン・クレーマーとレベッカ・コウがこれらのアッセイの開発に協力してくれたことに感謝します。この資料は、VAピュージーサウンドヘルスケアシステムでのリソースと施設の使用でサポートされている作業の結果です。この作品は、米国(米国)からの助成金によって支えられた退役軍人省(VA)生物医学研究所研究開発サービス[N.F.L.に#I01BX004044メリットレビュー助成金]
資料
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
参考文献
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved