Method Article
Оценка двигательных нарушений в моделях C. elegans бокового амиотрофического склероза
В этой статье
Резюме
Этот протокол описывает два чувствительных анализа для различения легких, умеренных и тяжелых двигательных нарушений у моделей бокового амиотрофического склероза C. elegans с общей полезностью для штаммов C. elegans с измененной подвижностью.
Аннотация
Нейродегенеративное заболевание боковой амиотрофический склероз (БАС) характеризуется прогрессирующей потерей двигательных нейронов, сопровождающейся мышечной слабостью и двигательными нарушениями, которые ухудшаются со временем. Хотя значительные успехи были достигнуты в определении генетических драйверов БАС для подмножества пациентов, большинство случаев имеют неизвестную этиологию. Кроме того, механизмы, лежащие в основе дисфункции и дегенерации двигательных нейронов, недостаточно изучены; поэтому существует постоянная необходимость в разработке и характеристике репрезентативных моделей для изучения этих процессов. Caenorhabditis elegans могут адаптировать свое движение к физическим ограничениям окружающей среды, с двумя основными парадигмами движения, изученными в лабораторной среде - ползание по твердой поверхности и плавание в жидкости. Они представляют собой сложное взаимодействие между ощущениями, двигательными нейронами и мышцами. Модели ALS C. elegans могут демонстрировать нарушения в одной или обеих из этих парадигм движения. Этот протокол описывает два чувствительных анализа для оценки подвижности у C. elegans: оптимизированный радиальный локомоционный анализ, измеряющий ползание по твердой поверхности, и автоматизированный метод отслеживания и анализа плавания в жидкости (трэшинг). В дополнение к характеристике базовых двигательных нарушений моделей БАС, эти анализы могут обнаруживать подавление или усиление фенотипов в результате генетических или низкомолекулярных вмешательств. Таким образом, эти методы имеют полезность для изучения моделей БАС и любого штамма C. elegans , который проявляет измененную подвижность.
Введение
Боковой амиотрофический склероз (БАС) является изнурительным, связанным со старением нейродегенеративным заболеванием с особым воздействием на двигательные нейроны. Заболевание характеризуется потерей двигательных нейронов в головном и спинном мозге и прогрессирующими двигательными нарушениями. Это приводит к значительной функциональной инвалидности и преждевременной смерти, как правило, в течение 3-5 лет после постановки диагноза1. Мутации по крайней мере в 38 генах могут вызвать БАС; однако у большинства пациентов с БАС накапливаются убиквитинированные включения белка TDP-43 в качестве первичной патологии в нейронах и глиальных клетках2,3,4. Был разработан ряд моделей на животных для изучения основных механизмов, вызывающих или способствующих БАС in vivo (рассмотрено в 5). У C. elegans эти модели включают генетические мутации потери функции в гомологах генов, вызывающих БАС, или трансгенную экспрессию генов БАС человека. Существует множество преимуществ моделирования БАС у C. elegans. C. elegans — это сговорчивое простое животное с дифференцированной нервной системой, хорошо охарактеризованными поведенческими парадигмами и значительной генетической гомологией для человека6,7. Существует множество инструментов для работы с C. elegans, включая надежные возможности редактирования генома, флуоресцентные репортеры нейродегенерации in vivo, парадигмы скрининга РНКи, поддающуюся обработке генетику и установленные поведенческие и фенотипические анализы. Модели C. elegans ALS рекапитулируют аспекты заболеваний человека, включая накопление нерастворимого белка, нейродегенерацию и раннюю смерть8,9. Кроме того, двигательная дисфункция, характеризующаяся нарушением как ползания, так и плавания, присутствует во многих моделях C. elegans ALS.
Этот протокол описывает два метода для характеристики двигательных фенотипов C. elegans : радиальный локомоционный анализ для оценки ползания по твердой поверхности и оценку плавания в жидкости (трэшинг) с использованием автоматизированного отслеживания и анализа WormLab. Эти чувствительные методы для характеристики двигательного дефицита позволяют сравнивать тяжесть и предлагают инструменты для измерения подавления и усиления двигательных фенотипов. Анализ радиальной локомоции количественно определяет различия в подвижности ползания (синусоидальное движение по твердой поверхности) среди популяций червей. Этот анализ использует преимущества естественного нестимулированного исследовательского поведения C. elegans , помещая червей в одном месте на пластине и отмечая их окончательное местоположение через заданный период времени10. В качестве альтернативы, плавая в жидкости (трэшинг), анализы подсчитывают изгибы тела отдельных червей в течение определенного периода времени. Ручной подсчет изгибов тела человеческим глазом занимает много времени и, как правило, демонстрирует значительную изменчивость между экспериментаторами. Использование автоматизированного отслеживания и анализа с помощью компьютеров может устранить большую часть этой изменчивости. В дополнение к характеристике базовых двигательных нарушений моделей БАС, как радиальная локомоция, так и плавание могут обнаруживать модуляцию различных локомоторных фенотипов от генетических или низкомолекулярных вмешательств. Эти методы полезны для изучения моделей БАС и любого штамма C. elegans , который проявляет измененную подвижность.
протокол
1. Радиальный локомоционный анализ
- Приготовьте чашки Петри диаметром 100 мм или 150 мм, примерно наполовину заполненные средой роста нематод (NGM) и засеянные однородным газоном из бактерий OP50, чтобы покрыть всю поверхность агара.
- Переверните пробирные пластины NGM вверх ногами и пометьте дно идентификатором штаммов C. elegans , подлежащих анализу, по 2 пластины на штамм (рисунок 1A).
- Сделайте небольшую точку маркером в центре перевернутой пластины (рисунок 1А).
- При работе с рассекающим микроскопом перенесите 15-20 постановочных подобранных 11 червей в центр пробирной пластины непосредственно над центральной точкой (видимой через NGM) с помощью платиново-проволочной кирки (рисунок 1B).
ПРИМЕЧАНИЕ: Постарайтесь перенести всех червей одновременно или как можно быстрее.- Установите таймер на 30 мин после того, как черви будут помещены в центр тарелки. Положите крышку обратно на тарелку и отложите ее в сторону (рисунок 1С).
- Продолжайте переносить червей до тех пор, пока все штаммы не окажутся на обозначенных пробирных пластинах, отмечая приблизительно, сколько времени требуется для переноса между пластинами (цель ~ 1 минута между пластинами). Держите все тарелки в том же порядке, в котором они были установлены.
- Через 30 минут начните забивать первую тарелку.
- Снимите крышку и поместите пластину лицевой стороной вниз под рассекающим микроскопом таким образом, чтобы меченая задняя часть пластины была обращена вверх, а агар NGM находился между линией видимости и червями. Пластина будет перевернута по сравнению с обычным использованием.
- Отрегулируйте фокус микроскопа до тех пор, пока черви не будут видны через агар.
- Используя разноцветную фломастеровую ручку из центральной точки, поставьте небольшую точку в месте расположения каждого червя - следуйте за следами червей через бактериальный газон, чтобы найти наиболее дистальных животных.
- Проверьте край пластины, так как некоторые черви могут оказаться там. Кроме того, подсчитайте и запишите количество червей в точке центральной точки (рисунок 1D).
- Продолжайте маркировать все пробирные пластины по порядку, так что все пластины имеют 30 минут времени активности, тщательно учитывая время, необходимое для установки пластины. Затем выполните ручные или цифровые измерения, как описано в шагах 1.8 или 1.9.
- Выполняйте измерения вручную с помощью линейки.
- Используйте линейку для измерения в мм расстояния от центральной точки до конечной отметки местоположения для каждого червя и записи расстояния. Чтобы отслеживать прогресс во время подсчета очков, пометьте первое набранное очко небольшой линией маркировки.
- Записывайте данные о длине для каждой точки последовательно, вращая пластину по часовой стрелке (рисунок 1E).
- Выполняйте цифровые измерения с помощью сканера и ImageJ.
- С помощью планшетного сканера отсканируйте заднюю часть пробирной пластины (пластин) рядом с линейкой (цифры, обращенные к сканирующей поверхности) (рисунок 2A).
- Откройте отсканированное изображение пластины в ImageJ или аналогичной программе.
ПРИМЕЧАНИЕ: ImageJ - это бесплатное программное обеспечение для обработки изображений на основе Java, размещенное в NIH. - Нажмите на инструмент Straight-Line Tool , а затем нарисуйте линию, соединяющую точки 1 см и 2 см на отсканированном изображении линейки (рисунок 2B).
ПРИМЕЧАНИЕ: Удерживая клавишу Shift компьютера, вы направите линию к ближайшему углу 45°. - Перейдите в меню Анализ и используйте его для установки масштаба (Анализ | Set Scale) (Рисунок 2C).
- Введите Известные расстояния (10) и Единицы длины (мм) в соответствующие поля, не корректируйте расстояние в количестве пикселей. Установите флажок Global , чтобы применить одинаковую шкалу ко всем изображениям, анализируемым в каждом сеансе ImageJ; в противном случае установите масштаб для каждого изображения при открытии (рисунок 2D). Нажмите кнопку ОК.
ПРИМЕЧАНИЕ: Этапы 1.9.2-1.9.5 выполняются для установления шкалы измерения. Измерения для этого изображения теперь будут автоматически связывать длину линий с определенным отношением пиксель: длина. Изображения, отсканированные с разрешением 300 dpi, будут иметь приблизительное соотношение 11,8 пикселей на мм. - Используйте инструмент «Кисть», чтобы отметить чуть выше первой точки, которую нужно набрать.
ПРИМЕЧАНИЕ: Это визуальный индикатор для первого набранного червя. - Инструмент « Прямая линия» используется для проведения линии от центральной точки до первой точки данных червя.
- Нажмите клавишу M на клавиатуре, чтобы измерить расстояние. Кроме того, перейдите в меню «Анализ» и выберите «Мера (анализ | Мера). В обоих случаях измерение появится в новом окне; это окно будет собирать все измерения для каждого изображения.
- Сохраняя центральную точку постоянной, переместите конец линии, касающейся первой точки червя, в следующую точку червя, двигаясь по часовой стрелке, и щелкните клавишу M для измерения.
- Продолжайте измерять каждую точку по часовой стрелке, пока не будут набраны все очки.
-
Скопируйте и вставьте данные измерения длины в электронную таблицу, чтобы сохранить их. Затем повторите процесс для каждого отсканированного изображения пластины.
ПРИМЕЧАНИЕ: Этапы 1.9.6 - 1.9.11 измеряют значения смещения червей (рис. 2E-F).
- Выполняйте статистический анализ.
- Объедините реплики в рамках одного эксперимента, чтобы общее количество набранных баллов составляло от 30 до 40 червей.
- Выполняйте независимые экспериментальные реплики в разные дни и с независимыми популяциями червей, чтобы в конечном итоге получить 3 независимые экспериментальные реплики.
- Анализируйте данные, используя соответствующие статистические анализы, такие как t-тест Стьюдента для 2 штаммов или 1-полосный ANOVA для трех или более штаммов.
2. Компьютерный анализ плавания
ПРИМЕЧАНИЕ: Данный протокол содержит подробные инструкции для коммерчески доступного аппаратно-программного комплекса WormLab (см. Таблицу материалов). Тем не менее, рабочий процесс может быть применен к другим компьютерным системам анализа плавания.
- Настройка и запись видео.
- Поднимите экранирование на оборудовании для обработки изображений (рисунок 3) и убедитесь, что высота камеры установлена в нужное место.
ПРИМЕЧАНИЕ: Оптимальная высота для захвата червей на пластине диаметром 35 мм такова, что третье от нижнего резьбового винтового отверстия видно под регулируемым кронштейном для крепления камеры, но над отверстием винта (примерно на 30,5 см над ступенью) не видно дополнительного монтажного отверстия (примерно на 30,5 см выше ступени) (рисунок 3C). Это приведет к коэффициенту захвата 11,43 мкм/пиксель. Рассмотрите возможность добавления индикатора «правильной высоты», чтобы это было легче подтвердить до начала анализа. См. шаг протокола 2.18, чтобы учесть регулировку высоты. - Откройте соответствующее программное обеспечение (дополнительный рисунок 1A).
- Щелкните значок «Захват видео» (фильм с треугольником, направленным вправо посередине), чтобы открыть новое окно «Захват видео ». Камера будет находиться в режиме Live View, но дисплей будет черным (дополнительный рисунок 1B).
- Нажмите на ручку диммера и поверните ее по часовой стрелке, чтобы отрегулировать свет.
ПРИМЕЧАНИЕ: Ручка диммера находится на сцене системы визуализации рядом с источником света яркого поля. Дисплей Видеозахвата в режиме реального времени превратится из черного в подсвеченный. - Вернитесь в окно «Захват видео », нажмите на вкладку «Настройки», настройте следующим образом: Режим видео: 2456 x 2052_Mono8, Частота кадров: 14, Выход: монохромный, Экспозиция: 0,00300 с, Усиление: 1 дБ, Гамма: 1, Поворот 180 (проверка).
- Вернитесь на вкладку Захват . Выберите папку записи (дополнительный рисунок 1B).
ПРИМЕЧАНИЕ: Здесь будут храниться все записи и файлы проекта. Создавайте уникальные папки для отдельных экспериментов, чтобы упорядочить данные. - Назначьте имя файла, введя его в текстовое поле Префикс файла .
ПРИМЕЧАНИЕ: Программное обеспечение автоматически добавит прогрессивное число в конец префикса в формате "0001". Желательно иметь согласованную схему именования для файлов, такую как: «YYYYMMDD_treatmentName_rep#_». - Установите другие настройки захвата следующим образом: Буфер: 128 кадров (по умолчанию), Длительность (проверьте): 00 ч: 01 мин: 00 с. Игнорируйте или отключайте другие параметры на этой вкладке.
- Поместите пробирную пластину, крышку вверх на ступень устройства и центрируйте ее на экране захвата видео ; снимите крышку.
ПРИМЕЧАНИЕ: Подготовьте пробирные пластины заранее. Каждая тарелка состоит из 35-миллиметровой чашки Петри, примерно наполовину полной несеянного (без бактериального газона) NGM. - Используйте микропипетку для промывки сцены синхронизированных 11 червей в 1 мл M9 на пробирной пластине - цельтесь примерно в 50 червей (рисунок 3D). Осторожно закрутите пластину, чтобы привести животных к центру, или используйте микропипетку, чтобы добавить несколько капель M9 для разделения животных (рисунок 3E). Установите таймер на 60 с, чтобы позволить червям акклиматизироваться к плаванию.
ПРИМЕЧАНИЕ: Пластина не будет на 100% видна на экране. Животные не точно отслеживаются при перекрытии. - Пока таймер отсчитывает время, вручную отрегулируйте фокусировку камеры, повернув кольцо фокусировки на корпус объектива камеры во время просмотра дисплея (рисунок 3F). Можно увеличить масштаб червей с помощью мыши с колесиком прокрутки, что обеспечивает более точную фокусировку.
- После установки фокуса отрегулируйте световую ручку таким образом, чтобы дисплей был как можно более ярким без передержки (отображается в виде красных пикселей на дисплее).
- Через 60 с нажмите кнопку Запись .
ПРИМЕЧАНИЕ: Видео перейдет из Live View в Запись , и таймер будет виден. Когда захват будет завершен, дисплей Video Capture вернется в режим Live View (дополнительный рисунок 1B). - Снимите пластину после записи и установите следующую пластину. При необходимости переименуйте префикс. Вымойте червей в пробирную пластину, высиживайте в течение 60 с и записывайте каждую обработку.
- После завершения всех записей для эксперимента закройте все открытые вкладки видео и выключите источник света, нажав на ручку диммера.
- Закройте окно «Захват видео », нажав красную кнопку x в правом верхнем углу окна; Кроме того, можно закрыть весь пакет программного обеспечения и снова открыть его.
- Подготовьте видео для отслеживания.
- В меню боковой панели рабочего процесса выберите первую кнопку в этом меню, Импорт последовательности изображений, а затем найдите и дважды щелкните видео. Видео откроется в среднем окне (дополнительный рисунок 2A).
ПРИМЕЧАНИЕ: По умолчанию для программного обеспечения отображается меню боковой панели workflow ; Доступ к этому меню также можно получить через раскрывающееся меню Вид вверх в разделе Вид [Вид | Рабочий процесс]. Меню Рабочий процесс имеет несколько вариантов просмотра; Представление Track уместно на данном этапе протокола. Если кнопка Задать сведения о последовательности не отображается в меню, значит, это неправильное представление. Во-первых, посмотрите на нижнюю часть меню и убедитесь, что вкладка Рабочий процесс активна, затем убедитесь, что представление «Отслеживание» активно, щелкнув значок «Отслеживание ». Отображение меню в окне зависит от размера монитора и расположения других открытых меню. Меню можно перемещать путем перетаскивания, изменять размер и закрывать. Большинство меню также можно открыть через раскрывающееся меню Вид . - В меню Workflow выберите Set Sequence Info (Дополнительный рисунок 2B). В новом окне меню проверьте схему именования, добавьте заметки и проверьте метаданные.
- Убедитесь, что масштабирование установлено правильно; Масштаб: 11,43 мкм/пиксель и мера автоматически заполняется, так как 1000 мкм составляет 87 пикселей. Если высота камеры была отрегулирована иначе, чем указано здесь, следуйте инструкциям в этом меню, чтобы обновить шкалу. Нажмите кнопку Сохранить .
- В меню Рабочий процесс выберите «Настроить изображение», и откроется новое всплывающее меню под названием «Коррекция изображения» (дополнительный рисунок 2C). Выберите Темные черви на светлом фоне (яркое поле)..
- Настройте дополнительные параметры. Рекомендуемые параметры обработки изображений : Сглаживание фона: 10, Гауссовское сглаживание: 5, Заполнение отверстий: 2, Фильтр мелких объектов: 0 и пропустить интегральную производную сегментацию.
- Отрегулируйте пороговый уровень таким образом, чтобы животные были полностью заполнены зеленым, но все же отличались от фона. Нажмите кнопку Применить.
ПРИМЕЧАНИЕ: Допустимо подбирать некоторые предметы, которые не являются червями. - В меню Рабочий процесс выберите Обнаружить и отслеживать (дополнительный рисунок 2D).
ПРИМЕЧАНИЕ: Сбоку видео появится меню с 3 вкладками: Обнаружение, Отслеживание и Восстановление. Курсор будет выглядеть как указательный палец над видеодисплеем. Кроме того, можно щелкнуть значок Выбрать (стрелка курсора) в меню значков в левом верхнем углу программного обеспечения.- С помощью инструмента выбора пальцев выберите 3-7 червей и нажмите кнопку «Обнаружить червей » на вкладке «Обнаружение ».
ПРИМЕЧАНИЕ: Этот выбор помогает программному обеспечению точно идентифицировать червей для заданных условий и должен быть сделан для каждого видео. Через несколько секунд большинство червей будут выделены зеленым цветом и иметь номер желтым. Черви, которые касаются или сворачиваются, скорее всего, не будут выделены; однако программа, скорее всего, найдет их во время отслеживания. Есть возможность настройки параметров обнаружения; однако значения по умолчанию хорошо работают в большинстве условий. Если параметры обнаружения вносятся в параметры обнаружения, убедитесь, что они согласованы между образцами и репликами.
- С помощью инструмента выбора пальцев выберите 3-7 червей и нажмите кнопку «Обнаружить червей » на вкладке «Обнаружение ».
- В окне Обнаружение и отслеживание перейдите на вкладку Отслеживание (дополнительный рисунок 2E). В разделе Параметры отслеживания установите флажок Использовать обратное отслеживание снимите флажок Отслеживать червей на краю изображения.
- Установите для отслеживаемой гипотезы Макса значение 5. Установите для режима отслеживания значение Плавание.
ПРИМЕЧАНИЕ: Настройка отслеживаемой гипотезы Макса регулирует, сколько потенциальных червей может иметь один отслеживаемый червь, и дает программе некоторую свободу действий в том, насколько точно отслеживать одного червя, не теряя его. 5 - хорошая обстановка для плавания. - Перейдите в раздел Дополнительные настройки и задайте следующее: Фреймы черви могут касаться границы: 50, Фреймы черви могут перекрываться: 500, Допуск положения: 0,50, Допуск формы: 0,50. Сохраните эти параметры и разверните их для всех видео в эксперименте (и за его пределами), сохранив их в виде конфигурации.
ПРИМЕЧАНИЕ: Фильтрация треков не рекомендуется и может быть легко выполнена после обработки, оставьте. - Перейдите к Configuration Manager (значок шестеренки) в меню значков в левом верхнем углу. При щелчке откроется меню боковой панели Configuration Manager . Затем щелкните значок Сохранить (шестеренка +), присвойте этой конфигурации имя и описание, затем нажмите кнопку ОК .
- Чтобы получить доступ к этой конфигурации в будущем, откройте меню Конфигурация , выберите нужную конфигурацию и щелкните значок Загрузить (стрелка передачи вверх). Затем добавьте информацию о последовательности, возможно, точно настройте пороговый уровень и выберите червей для обнаружения. Все остальные настройки будут такими же.
- В меню Рабочий процесс выберите команду Сохранить проект, проверьте место сохранения и добавьте имя файла проекта (сопоставление имени файла проекта с именем видео помогает обеспечить непрерывность). Закройте видео.
ПРИМЕЧАНИЕ: Эти проекты сохраняются с типом файла .wpr. - Повторите для всех видео: Импорт последовательности изображений (2.18), Загрузка сохраненной конфигурации (2.28.1), настройка порога (2.23), установка информации о последовательности (2.19), обнаружение червей (2.24.1), сохранение проекта (2.29), закрытие видео.
- Отслеживание видео
- Чтобы отслеживать файлы проекта, перейдите в меню Workflow и щелкните значок Batch (папка, содержащая страницы-черви) (дополнительный рисунок 2F).
ПРИМЕЧАНИЕ: Отобразится панель пакетной обработки (дополнительный рисунок 2G). Иногда он скрыт, но доступен в самом низу меню Пакетный рабочий процесс ; возможно, потребуется развернуть окно, чтобы увидеть его. - Нажмите кнопку Добавить в разделе Выбор файла этого меню Пакетная обработка . Перейдите к и выберите все файлы проекта (WPR) для обработки, нажмите кнопку Открыть.
ПРИМЕЧАНИЕ: Меню пакетной обработки будет заполнено выбранным путем к файлу, индикатором состояния и серым индикатором выполнения для каждого файла. - Нажмите кнопку Пуск (значок кнопки воспроизведения). Обратите внимание на зеленый индикатор хода выполнения в первом файле. Разрешить обработку всех файлов. Когда все файлы прочитаны как готовые (зеленый), программное обеспечение может быть закрыто (дополнительный рисунок 2G).
- Если файл проекта застрял, рассмотрите возможность запуска зависшего файла самостоятельно, это обычно устраняет проблему. Если это не помогло устранить проблему, откройте файл проекта, удалите выбранных червей (меню «Обнаружение и отслеживание») и повторно выберите из нового набора обучения. Затем повторно обработайте файл проекта.
- Чтобы отслеживать файлы проекта, перейдите в меню Workflow и щелкните значок Batch (папка, содержащая страницы-черви) (дополнительный рисунок 2F).
- Ремонт гусениц (рекомендуется)
ПРИМЕЧАНИЕ: Ремонт гусениц может повысить точность гусениц. Общими исправлениями являются объединение треков, которые явно принадлежат тому же червю, что и человеческий глаз, удаление дорожек, которые не являются точными или не захватывают реальные данные о червях, и разделение треков, которые искажены из-за того, что черви соприкасаются (удалите плохую секцию и объедините дорожки до и после плохого раздела, если это целесообразно).- Откройте программное обеспечение и откройте файл проекта [Файл | Открытый проект] интереса. Нажмите кнопку Открыть и нажмите кнопку Да , чтобы использовать этот файл. Дождитесь загрузки временного фильтра. Обработанное видео будет на экране; черви будут выделены зеленым цветом и выделены желтым цветом. Используйте видеопроигрыватель для очистки или воспроизведения видео.
- В меню Рабочий процесс выберите Обнаружить и отслеживать (дополнительный рисунок 2D). Перейдите на вкладку Восстановление . Активируйте курсор Selector , щелкнув значок инструмента Selector (стрелка курсора). Просмотрите видео, найдя и выбрав след червя, а затем используйте меню восстановления, чтобы создать нужное изменение.
ПРИМЕЧАНИЕ: Чтобы стратегически быстро устранить большинство проблем, увеличьте масштаб так, чтобы было видно около 1/6 пластины , начните с области, окружающей дорожку No 1. Быстро просматривайте видео, проверяя червей, которые таинственным образом появляются из ниоткуда, треки, где меняются цифры, или червей, натыкающихся друг на друга, редактируя по мере возникновения проблем. Следуйте за червями в числовом порядке от начальной позиции. Чистите взад и вперед, чтобы следить за каждым червем по мере необходимости, пока вся пластина не будет отремонтирована. Обратите пристальное внимание на края пластины; часто поддельные черви появляются в тени краев пластин.
- Анализ данных
- В меню Workflow выберите Analyze Data (Дополнительный рисунок 3A).
ПРИМЕЧАНИЕ: Появится новое окно под названием Анализ данных и построение графиков (Дополнительный рисунок 3B). В этом окне есть много способов оценки и просмотра данных о перемещении популяции червей конкретного файла проекта. Большинство из этих анализов позволяют выбрать конкретных, множественных или всех червей из данного видео, что позволяет отображать информацию о треке различными способами. - Чтобы проанализировать количество оборотов, перейдите к сводке трека [Положение и скорость | Резюме трека] (Дополнительный рисунок 3С). Используйте кнопку Экспорт в правом нижнем углу для экспорта данных в читаемом формате электронной таблицы (.csv), выберите путь к нужному расположению электронной таблицы, в том числе переименовав ее во что-то запоминающееся. Настройки по умолчанию являются хорошим выбором (дополнительный рисунок 3D).
- Вставьте эти данные, а также любые другие соответствующие наборы данных проекта в консолидированную книгу электронных таблиц (дополнительный рисунок 3E).
- Используйте счетчик поворотов и продолжительность трека для расчета оборотов в минуту для каждого трека с помощью функций электронных таблиц (= продолжительность поворотов/трека * 60) или используйте другую метрику по желанию (дополнительный рисунок 3F).
ПРИМЕЧАНИЕ: Обороты в минуту захватывают очень похожую информацию, как ручной анализ, который является широко используемой метрикой активности в жидкости, но есть много вариантов, и вполне возможно, что другая метрика может идентифицировать другие интересные данные для данного лечения или сравнения. - При желании очистите размер червя, продолжительность трека и/или некоторые другие выбранные метрики с помощью инструментов условного форматирования, чтобы выделить дорожки для удаления, если они потенциально сбивают с толку. Обеспечьте согласованную обработку данных между обработками и репликами.
- Анализируйте данные, используя соответствующие статистические анализы, такие как T-тест Стьюдента для 2 штаммов или 1-полосный ANOVA для 3 или более штаммов. Выполняют независимые экспериментальные реплики в разные дни и с независимыми популяциями червей не менее 3 независимых экспериментальных реплик.
- В меню Workflow выберите Analyze Data (Дополнительный рисунок 3A).
Результаты
Как радиальная локомоция, так и плавание обеспечивают чувствительное обнаружение нарушения моторики (рисунок 4 и рисунок 5). Для исследования механизмов, лежащих в основе патологического TDP-43 при БАС, были разработаны модели C. elegans , которые экспрессируют дикий тип или ALS-мутантный человеческий TDP-43 паннейронно. Эти животные демонстрируют молекулярные и клеточные характеристики, напоминающие БАС, включая двигательную дисфункцию9. Важно отметить, что они демонстрируют умеренное нарушение моторики с экспрессией TDP-43 человека дикого типа и более тяжелое нарушение моторики у животных, экспрессирующих БАС-мутант TDP-43 с использованием как радиальной локомоции, так и плавательных анализов. Некоторые мутантные или трансгенные животные будут иметь большие нарушения в ползании, чем в плавании, или наоборот. Используя два разных анализа подвижности, получается более четкая картина фенотипических различий между штаммами.
Радиальная локомоция
При помещении на тарелку с посевом агара C. elegans исследуют свое окружение, в том числе ищут границы своего источника пищи. Радиальные локомоционные анализы являются одним из способов воспользоваться этим поведением в качестве показателя физической подготовки. Анализируя поведение опорно-двигательного аппарата (ползание по твердой поверхности) контролируемым и количественно оцениваемым способом, радиальный локомоторный анализ предлагает простой и эффективный инструмент для оценки тяжести двигательного дефицита и других фенотипов, связанных с моторикой. Анализы радиальной локомоции фиксируют различия в подвижности у умеренно или тяжело ослабленных модельных червей БАС и предлагают исходный уровень для сравнения модуляции фенотипов моторики или изменений подвижности с возрастом (рисунок 6). Эта стратегия может быть применена для количественной оценки поведения любого штамма, который изменил движение от дикого типа (N2) или контрольных червей. Тем не менее, этот метод не может быть хорошим выбором для оценки животных, неспособных нормально ползать, таких как роликовые мутанты или животные, которые парализованы. Как правило, черви дикого типа будут иметь среднее смещение между 200-300 мкм / мин при выращивании и испытании при 20 °C. Примеры данных, представленные на рисунке 4 , показывают ожидаемые результаты сравнения N2, двух различных трансгенных штаммов, экспрессирующих TDP-43 человека дикого типа с мягким фенотипом [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] или более сильный фенотип [TDP-43(WT-умеренный), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], трансгенный штамм, экспрессирующий мутантный человеческий TDP-43 с тяжелым фенотипом [TDP-43(M337V), CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), и трансгенный штамм, экспрессирующий другой нейродегенеративный белок, связанный с заболеванием, человеческий тау дикого типа [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Пмё-2::ГФП])]. Два штамма, экспрессирующие TDP-43 дикого типа, имеют различные степени нарушения, обнаруженные радиальной локомоцией. TDP-43 (WT-low) существенно не отличается от N2, в то время как TDP-43 (WT-high) демонстрирует явные различия в подвижности. Штаммы TDP-43(M337V) и тау (WT) имеют более серьезные нарушения подвижности.
Плавательный анализ
C. elegans участвуют в стереотипных плавательных (метательных) движениях при погружении в жидкость. Сразу после погружения черви начинают характерно изгибать голову и хвост навстречу друг другу с углом изгиба примерно 45°, причем вершина угла является средней точкой червя. Глисты попеременно изгибаются в вентральном и дорсальном направлениях. Один трэш, измеренный программным обеспечением, представляет собой движение от прямого к углу изгиба тела 20° или более, независимо от направленности (пороговое значение угла может быть отрегулировано после обработки в окне Анализ и построение графиков [Workflow | Анализ | данных | формы тела Угол изгиба | Среднеточечный | Порог амплитуды: # градусов]. Описанный здесь анализ плавания использует автоматизированное компьютерное отслеживание и анализ для обеспечения объективной оценки плавательной активности. Ожидается, что черви дикого типа (N2) будут в среднем составлять от 150 до 200 трэшей в минуту при выращивании и регистрации при 20 °C. Пример данных, представленный на рисунке 5, показывает ожидаемые результаты сравнения N2, двух различных трансгенных штаммов, экспрессирующих TDP-43 человека дикого типа с мягким фенотипом [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] или более сильный фенотип [TDP-43(WT-умеренный), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], и трансгенный штамм, экспрессирующий другой нейродегенеративный белок, связанный с заболеванием, человеческий тау дикого типа [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Пмё-2::ГФП])]. Трансгенный штамм, экспрессирующий БАС-мутант TDP-43 [TDP-43(M337V)], не трясется в жидкости, и поэтому он обозначен на графике как ND (без данных). Этот анализ может различать другие фенотипы, чем анализ радиальной локомоции, показанный на рисунке 4. Например, в анализе радиальной локомоции (рисунок 4) TDP-43 (WT-low) существенно не отличался от N2. Однако в плавательном анализе (рисунок 5) и TDP-43 (WT-low), и TDP-43 (WT-high) значительно отличаются от N2, а также значительно отличаются друг от друга. Кроме того, несмотря на то, что tDP-43 (M337V) и тау (WT) имеют серьезные нарушения ползания радиальной локомоцией (рисунок 4), только тау (WT) способен бить достаточно, чтобы быть отслеженным программным обеспечением (рисунок 5). Животные TDP-43 (M337V) не могут метаться, а программный анализ не обнаруживает и не отслеживает этих червей точно. Таким образом, данные об этих червях не собирались (ND, никаких данных).
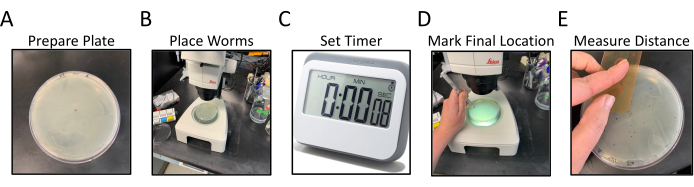
Рисунок 1: Рабочий процесс анализа радиальной локомоции. Панели A-E показывают обобщенные шаги анализа радиальной локомоции. Этапы следующие: (A) пластины NGM, с OP50, засеянными по краям, готовятся путем маркировки и маркировки центральной точки, (B) черви помещаются в центр агара, как отмечено центральной точкой, (C) червям разрешается свободно перемещаться в течение определенного периода времени, (D) пластина переворачивается снизу вверх, а окончательное местоположение каждого червя помечается другим цветом, чем центральная точка, (E) Расстояние от центральной точки до каждого конечного местоположения червя, измеренное вручную или в цифровом виде. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
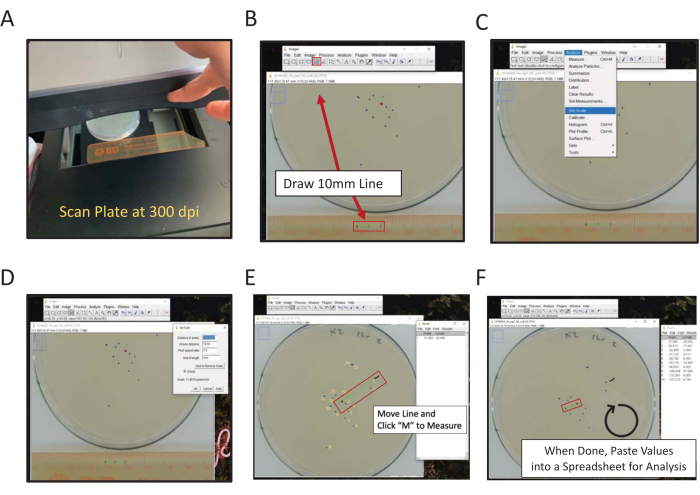
Рисунок 2: Цифровое измерение конечного местоположения с помощью ImageJ. Расстояние от центральных измерений может быть измерено вручную или в цифровом виде, для измерения в цифровом виде с помощью сканирования ImageJ (A) задней стороны пластины с линейкой в кадре. (B) Нарисуйте известную длину с помощью инструмента «Линия». (C) Использовать известную длину, нарисованную в (B), для установки масштаба [Анализ | Установить масштаб...]. (D) Используйте инструмент «Линия», чтобы провести линию от центральной точки до конечной отметки местоположения, повторите для каждой отметки. (E) Линия кисти, обозначающая первую измеренную отметку, помогает забить (волнистая черная линия около отметки 1). Конечные отметки местоположения пронумерованы желтым цветом, чтобы проиллюстрировать направленность подсчета очков. (F) Измерения записываются в окне Результаты. Сохраните результаты в другом месте для статистического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Материалы и аппаратные настройки для использования программного обеспечения. (A) Материалы, используемые для программного анализа плавания. (B) Общая настройка программного обеспечения и необходимых материалов, обратите внимание, что корпус находится в поднятом положении. (C) Высота кронштейна для крепления объектива может быть отрегулирована. На этом изображении показана регулируемая дорожка и ленточный индикатор, обозначающий предпочтительную высоту для выполнения плавательных анализов. Перед записью необходимо отрегулировать яркое поле света и фокус камеры. (D) На сцене помещается 35-миллиметровая пробирная пластина, к пластине добавляются животные в M9 и запускается таймер продолжительностью 1 минута. (E) Иногда выгодно осторожно закручивать пластину, чтобы переместить червей ближе к центру - наблюдать местоположение на экране живого захвата; в качестве альтернативы, несколько капель M9 из пипетки могут быть использованы для разделения червей. (F) Отрегулируйте кольцо фокусировки на объективе камеры, наблюдайте за червями на экране, чтобы определить оптимальную фокусировку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
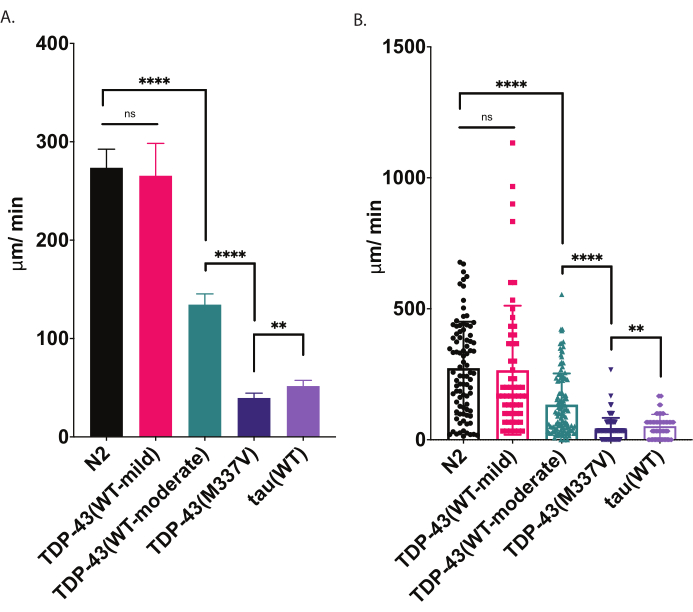
Рисунок 4: Анализы радиальной локомоции обнаруживают различия в скорости ползания. Нестимулированная дисперсия личинок L4 с стадией развития была измерена с использованием радиального анализа локомоции, описанного выше, и отображена как мкм/мин (A-B). Одни и те же данные, построенные в пунктах (A) и (B), демонстрируют два различных возможных графических представления. В (A) данные отображаются в виде гистограммы, что делает относительные различия между штаммами более четкими. В (B) окончательное смещение каждого червя распределяется внутри графа, что позволяет лучше визуализировать вариации внутри популяции. Для оценки значимости среди тестируемых штаммов был использован односторонний анализ дисперсии (ANOVA) с помощью множественного сравнительного теста Туки. **p=0.0022, ****p<0.0001, ns=незначимый. TDP-43(M337V) и тау(WT) также существенно отличаются от N2, p<0,0001. Полосы погрешностей в (A) являются стандартной погрешностью среднего значения (SEM), а в (B) - стандартным отклонением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
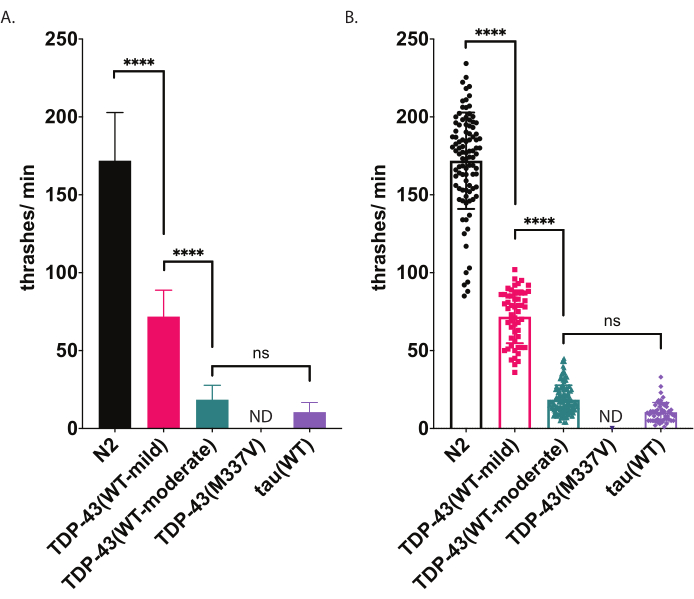
Рисунок 5: Плавательные анализы обнаруживают различия в трэшинге в жидкости. Скорость плавания (частота метания или волнения в жидкости) измерялась с использованием непредвзятого компьютерного подсчета и анализа, описанных выше и отображенных как трэш/мин (A-B). Те же данные, построенные в пунктах (A) и (B). В (A) данные отображаются в виде гистограммы, что облегчает просмотр относительных различий между штаммами. В (B) данные о каждом отдельном черве, оцененном на графике, отображаются на графике, что позволяет лучше визуализировать вариации в популяции. Для оценки значимости среди тестируемых штаммов был использован односторонний анализ дисперсии (ANOVA) с помощью множественного сравнительного теста Туки. p<0.0001, ns=незначителен. TDP-43(WT-moderate) и tau(WT) также существенно отличаются от N2, p<0.0001.Полосы ошибок в (A) являются стандартной погрешностью среднего значения (SEM) и в (B) являются стандартным отклонением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
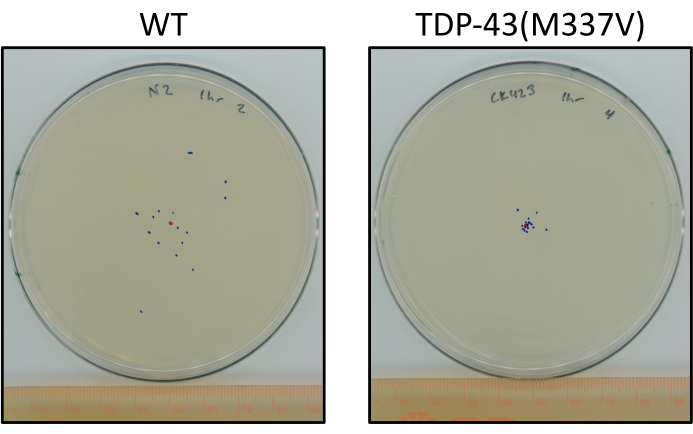
Рисунок 6: Мутантные черви TDP-43 путешествуют меньше, чем дикие черви. Пластины, показывающие репрезентативную разницу в конечном расположении ступенчатых L4 N2 (wild-type) и TDP-43(M337V) (CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), штамм, экспрессирующий мутантный человеческий TDP-43 с тяжелым нарушением двигательной функции после 1 часа нестимулированного ползания при комнатной температуре. Пластины отмечены красной точкой для центральной точки и синими точками для окончательного местоположения животных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Запись поведения при плавании с помощью программного обеспечения для визуализации и отслеживания. (A) Рабочий процесс отслеживания и местоположение значка захвата видео. (B) Окно захвата видео отображается в режиме интерактивного просмотра, и наиболее важные аспекты выделяются. Зеленые слова «Live view» изменятся на красные «Запись» при активации кнопки записи. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Подготовка и отслеживание плавательного поведения. На этом рисунке показана серия снимков экрана, помогающих настроить последовательность видеоизображений для отслеживания. Общий протокол подготовки видеоряда заключается в открытии каждого меню рабочего процесса в следующем порядке: Импорт последовательности изображений | Настройка | сведений о последовательности Настройка | изображений Обнаружение и отслеживание | Сохранить проект. Окно Анализ данных можно использовать только после отслеживания файла проекта. (A) показывает открытый .avi (видео) файл после импорта последовательности в программное обеспечение из рабочего процесса Track . (B) Окно Set Sequence Info предоставляет место для заметок, установки/изменения масштаба и проверки метаданных для видеоряда. Инструкции по изменению шкалы находятся в этом окне и должны соблюдаться при опускании или подъеме камеры (B). На рисунке (C) показаны настройки окна «Настроить изображение ». (D) Снимок экрана, показывающий вкладку обнаружения окна Обнаружение и отслеживание . Обнаружение червей используется для обучения программного обеспечения и должно быть настроено для каждой видеорядицы. При желании здесь можно задать дополнительные параметры обнаружения. (E) Снимок экрана: вкладка «Отслеживание » окна «Обнаружение и отслеживание » с рекомендуемыми настройками для отслеживания поведения при плавании. Это последний шаг в настройке видеоряда. Сохраните последовательность как проект с помощью окна Сохранить проект . Повторите эти шаги для каждого видеоряда. Параметры можно сохранить как конфигурацию, чтобы уменьшить рабочую нагрузку и гарантировать, что все последовательности обрабатываются одинаково (не отображаются). Чтобы отслеживать файлы проекта для анализа, перейдите к пакетному рабочему процессу. (F) показывает значок, используемый для перехода к пакетному рабочему процессу, и (G) показывает окно пакетной обработки, выделяет кнопки добавления и запуска и показывает ожидаемый внешний вид отслеживаемого файла проекта. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Анализ поведения при плавании. После отслеживания файла проекта его можно открыть с помощью [File | Открыть проект]. Черви будут отображаться зеленым цветом, как показано в пункте (A). Очистка видео предлагает быструю проверку того, что видео обработано так, как ожидается, зеленая подсветка исчезнет во время очистки. Окно Анализ и построение данных открывается из элемента рабочего процесса Анализ данных . (B) показывает окно Анализ данных и построение графиков с открытым представлением Позиции (по умолчанию), все дорожки выделены. Под точками данных находится график, показывающий записанный трек для каждого выделенного червя. Суммарный анализ трека используется для расчета оборотов в минуту. (C-D) показать сводный отчет о треке и сведения об экспорте. (E-F) показать сводку трека в электронной таблице и как рассчитать обороты в минуту, выход, измеренный в этом анализе. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Радиальная локомоция:
Разрешение этого анализа легко контролируется путем изменения временной переменной. Увеличение продолжительности времени облегчает наблюдение различий между животными с тяжелыми фенотипами, тем самым выявляя тонкие различия. Однако, поскольку этот анализ измеряет смещение, если время анализа слишком велико, животные с нормальной подвижностью, такие как N2, будут перемещаться к краям пластины, а поведение корма приведет к обратному отслеживанию. Это позволит искусственно уменьшить измерение пройденного расстояния. Слишком длительные периоды времени могут привести к исчезновению различий между штаммами, особенно между животными с менее тяжелыми двигательными фенотипами, поскольку животные становятся равномерно распределенными по пластине. Сокращение переменной времени помешает более активным червям найти края пластины. Этот метод не отслеживает общее расстояние, пройденное для каждого червя, но сжимает расстояние, пройденное для каждого червя, на линейное расстояние от центра пластины. Таким образом, он по своей сути менее надежен, чем метод, который записывает общую длину трека отдельных червей. Тем не менее, анализ радиальной локомоции требует очень небольшой подготовки исследователей, использует относительно доступные реагенты, которые обычно доступны в большинстве лабораторий червей, и достаточно чувствителен, чтобы получить значительные и воспроизводимые результаты. Для лабораторий, которые предпочитают автоматизированное отслеживание видео, ранее было создано несколько методов для отслеживания и анализа ползучих движений12, или параметры программного обеспечения, используемые для анализа плавания в этой статье, могут быть изменены, чтобы позволить обнаружение и анализ ползания.
Этот эксперимент обычно проводится в трех независимых репликах, с набором из 30-40 червей на реплику. Каждая реплика разделена на две разные пластины 100 мм или 150 мм, с 15-20 червями на пластину. Использование большего количества червей, чем рекомендуется на тарелку, может затруднить эффективную оценку. Общее число баллов 90+ достаточно мощно, чтобы установить значимость для легких, умеренных или тяжелых нарушений моторики. Соответствие времени между оцененными штаммами имеет важное значение для точности и воспроизводимости. 30 минут, как правило, достаточно, чтобы установить различия между умеренными и тяжелыми фенотипами, такими как трансгенные штаммы, экспрессирующие мутантный TDP-43 человека, по сравнению с червями дикого типа (рисунок 4). Если переменная времени будет расширена, желательно также увеличить размер пластины со 100 мм до 150 мм. Факторы окружающей среды, такие как температура и влажность, могут влиять на этот анализ, который обычно проводится при комнатной температуре окружающей среды, поэтому важно всегда использовать контроль дикого типа (N2) при сравнении реплик. Кроме того, этот анализ может измерять подвижность некоторых штаммов, которые не проявляют нормального плавательного поведения в жидкости (трэшинг), что делает его полезным дополнением к плавательному анализу.
Анализ плавания:
Использование системы визуализации и сбора для автоматизации отслеживания и анализа плавания червей позволяет получать точные и непредвзятые данные. Тем не менее, есть несколько факторов при первоначальной настройке эксперимента, которые необходимо контролировать между образцами. К ним относятся время акклиматизации к жидкости перед началом записи, условия окружающей среды (т. Е. Температура, влажность) и постоянные настройки освещения и записи. На этапе записи есть несколько функций, которые помогают уменьшить изменчивость между пластинами. К ним относятся встроенная камера, установленная на треке, и сцена яркого поля, которая делает запись видео согласованной между пластинами, экранирование вокруг сцены, которое предотвращает отражения, блики и движения воздуха во время записи, а также надежный программный пакет, который надежно обнаруживает червей и позволяет вручную корректировать треки в постобработке видео. В этом протоколе видео 35-мм пластины с червями записываются в течение 1 минуты, а затем обрабатываются с помощью программного пакета. После обработки ручная коррекция треков гарантирует, что поведение червей записывается точно, не смешивая ошибки отслеживания. Данные о количестве поворотов и длительности трека используются для определения оборотов в минуту в качестве окончательного считывания. Чтобы обеспечить воспроизводимость, данные собираются в течение как минимум 3 независимых экспериментов по репликации, каждый с 40-50 животными, чтобы достичь общего конечного числа животных 120-150. Этого числа достаточно, чтобы отличить небольшие различия в плавательном поведении от контрольных червей. Некоторые черви имеют двигательный дефицит, слишком серьезный, чтобы его можно было поймать с помощью плавательных анализов. Например, если животные помещены в завиток жидкой среды вместо того, чтобы выполнять ожидаемую реакцию на удар, этот анализ не будет точно записывать эти движения, и другой анализ движения, такой как радиальная локомоция, может лучше уловить эти дефекты моторики. Предоставляемый протокол использует коммерчески доступную систему визуализации (см. Таблицу материалов для получения более подробной информации ), но другие системы отслеживания червей могут предоставлять аналогичную утилиту, причем некоторые из них имеют открытый исходный код12. Ранее опубликованные методы описывают ручную оценку червячного трэшинга13. В то время как автоматизированный анализ дает ряд показателей для каждого отдельного червя, обнаружение изгибов тела, которые измеряются в трэшах в минуту, обеспечивает последовательные результаты между экспериментами и отслеживается хорошо с обычным подсчетом ударов червей на глаз.
Раскрытие информации
Авторы заявляют, что у них нет никаких раскрытий.
Благодарности
Благодарим рецензентов за полезные комментарии и предложения. Мы благодарим Алин Сакстон, Брэндона Хендерсона и Джейд Стэйр за выдающуюся техническую помощь. Мы благодарим Брайана Кремера и Ребекку Коу за помощь в разработке этих анализов. Этот материал является результатом работы, подкрепленной ресурсами и использованием объектов в системе здравоохранения VA Puget Sound. Эта работа была поддержана грантом США (США) Департамент по делам ветеранов (VA) Служба биомедицинских лабораторных исследований и разработок [Грант на рассмотрение заслуг #I01BX004044 n.F.L.]
Материалы
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
Ссылки
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены