Method Article
근위축성 측삭 경화증의 C. 엘레간 모델의 모터 손상 평가
요약
이 프로토콜은 근위축성 측삭 경화증의 C. elegans 모형에 있는 온화한, 온건한, 및 가혹한 운동 손상 사이에서 차별에 대한 2개의 민감한 분석, C. elegans 긴장에 대한 일반적인 유틸리티, 변경된 운동성.
초록
신경 퇴행성 질환 근위축성 측삭 경화증 (ALS)은 시간이 지남에 따라 악화 근육 약점과 운동 장애를 동반 운동 뉴런의 점진적 손실을 특징으로합니다. 환자의 하위 집합에 대한 ALS의 유전 드라이버를 결정하는 데 상당한 진전이 있었지만 대부분의 경우 알려지지 않은 병인이 있습니다. 또한, 운동 신경 기능 장애 및 변성기의 기전은 잘 이해되지 않는다; 따라서 이러한 프로세스를 연구하기 위해 대표적인 모델을 개발하고 특성화해야 합니다. Caenorhabditis elegans는 실험실 환경에서 연구된 두 가지 주요 운동 패러다임과 함께 주변의 물리적 제약에 맞게 움직임을 조정할 수 있으며, 고체 표면에서 기어 다니고 액체에서 수영할 수 있습니다. 이들은 감각 사이 복잡한 상호 작용을 나타냅니다., 모터 뉴런, 그리고 근육. ALS의 C. 예르간 모델은 이러한 운동 패러다임 중 하나 또는 둘 다에서 손상을 나타낼 수 있습니다. 이 프로토콜은 C. elegans의 운동성을 평가하기 위한 두 가지 민감한 분석법, 즉 고체 표면에서 크롤링을 측정하는 최적화된 방사형 운동 분석법과 액체에서 수영을 추적하고 분석하는 자동화된 방법(스래싱)을 설명합니다. ALS 모델의 기준선 모터 손상의 특성화 외에도, 이러한 검사는 유전적 또는 소분자 내정간섭으로부터 표현형의 억제 또는 향상을 검출할 수 있다. 따라서 이러한 방법은 ALS 모델과 변경된 운동성을 나타내는 C. elegans 변형을 연구하는 데 유용합니다.
서문
근위축성 측삭 경화증 (ALS)은 운동 뉴런에 특별한 영향을 미치는 쇠약하고 노화 관련 신경 퇴행성 질환입니다. 이 질병은 뇌와 척수 및 진보적 인 운동 장애의 운동 뉴런의 손실을 특징으로합니다. 이것은 진단 1 후에 3-5 년 안에 중요한 기능장애 및 조기 사망에 초래합니다. 적어도 38개의 유전자에 있는 돌연변이는 ALS를 일으키는 원인이 될 수 있습니다; 그러나, ALS를 가진 대부분의 환자는 뉴런과 신경교 세포에 있는 그들의 1 차적인 병리로서 단백질 TDP-43의 유비쿼터트 된 포함을 축적2,3,4. 많은 동물 모델이 생체 내 ALS를 유발하거나 기여하는 기본 메커니즘을 연구하기 위해 개발되었습니다 (5 검토). C. elegans에서, 이 모형은 ALS 일으키는 원인이 되는 유전자의 동종학에 있는 유전 기능 손실 돌연변이 또는 인간 ALS 유전자의 형질 발현을 포함합니다. C. elegans에서 ALS를 모델링하는 데는 많은 장점이 있습니다. C. elegans는 분화 된 신경계, 잘 특징지어지는 행동 패러다임 및 인간에게 상당한 유전 적 동성애를 가진 견실한 간단한 동물입니다6,7. 강력한 게놈 편집 기능, 신경 변성의 생체 내 형광 기자, RNAi 선별 패러다임, 기관 유전학 및 확립 된 행동 및 표피 학적 분석은 C. elegans와 함께 일하기위한 많은 도구가 존재합니다. ALS의 C. elegans 모형은 불용성 단백질의 축적, 신경 변성 및 초기 죽음의 축적을 포함하여 인간 적인 질병의 양상을 회상합니다8,9. 또한, 크롤링과 수영 행동의 교란을 특징으로 하는 모터 기능 장애는 많은 C. elegans ALS 모델에 존재합니다.
이 프로토콜은 C. elegans 모터 표현형을 특성화하는 두 가지 방법을 설명합니다: 고체 표면에서 크롤링을 평가하기 위한 방사형 운동 분석과 WormLab 자동화된 추적 및 분석을 사용하여 액체(thrashing)에서 수영하는 평가. 모터 적자를 특성화하기 위한 이러한 민감한 방법은 심각도를 비교할 수 있으며 모터 표현형의 억제 및 향상을 측정하는 도구를 제공합니다. 방사형 운동 분석은 벌레의 인구 중 운동성 (고체 표면의 부비동 운동)의 차이를 정량화합니다. 이 분석체는 접시에 있는 한 위치에 웜을 배치하고 주어진 기간 이후에 최종 위치를 표시하여 C. elegans 자연 자극되지 않은 탐사 동작을 활용합니다. 또는, 액체에서 수영 (스래싱) assays 시간의 설정 된 기간 동안 개별 벌레의 몸 굽힘 계산. 인간의 눈에 의해 구부러지는 바디의 수동 계산은 시간 집약적이며 일반적으로 실험자 들 사이에서 상당한 가변성을 나타낸다. 컴퓨터 지원 자동화 추적 및 분석을 사용하면 이러한 변동성이 크게 제거될 수 있습니다. ALS 모델의 기준선 운동 장애의 특성화 외에도 방사형 운동 및 수영 용약은 유전적 또는 작은 분자 내정간섭에서 뚜렷한 운동 표현형의 변조를 감지할 수 있습니다. 이러한 방법은 ALS 모델과 변경 된 운동성을 나타내는 모든 C. elegans 변형을 연구하기위한 유틸리티가 있습니다.
프로토콜
1. 방사형 운동 분석
- 선충 성장 매체(NGM)의 절반 정도에 100mm 또는 150mm 직경 페트리 접시를 준비하고, OP50 박테리아의 균일한 잔디로 씨를 뿌리고, 천자의 전체 표면을 덮습니다.
- NGM 분석판을 거꾸로 뒤집어 C. 엘레간 균균에 대한 식별자로 바닥에 라벨을 붙이고, 변형당 2플레이트(그림 1A).
- 거꾸로 된 플레이트의 중앙에 마커가 있는 작은 점을 만듭니다(그림 1A).
- 해부 현미경으로 작업하는 동안, 15-20 단계 일치 11 갱단은 백금 와이어 픽 (도 1B)을 사용하여 중앙 점 (NGM을 통해 볼 수)을 통해 직접 분석 플레이트의 중심으로 일치111 웜을 전송합니다.
참고: 가능한 한 빨리 모든 웜을 동시에 또는 빠르게 전송해 보십시오.- 웜을 플레이트 중앙에 놓은 후 타이머를 30분 동안 설정합니다. 뚜껑을 다시 접시에 놓고 따로 둡니다(그림 1C).
- 모든 균주가 지정된 분석 판에 올 때까지 웜을 계속 이송하여 플레이트 간에 전달하는 데 걸리는 시간을 기록합니다(플레이트 사이에 ~ 1분 정도 조준). 모든 플레이트를 설정된 순서대로 유지합니다.
- 30분 후 첫 번째 플레이트득점시작.
- 뚜껑을 제거하고 플레이트 뒷면이 위로 향하고 NGM 천이 시야와 벌레 사이에 있는 것과 같이 해부 현미경 아래에 플레이트를 아래로 놓습니다. 플레이트는 정상 사용에서 거꾸로 됩니다.
- 벌레가 천을 통해 볼 때까지 현미경 초점을 조정합니다.
- 중앙 지점에서 다른 색깔의 펠트 팁 펜을 사용하여 각 웜의 위치에 작은 점을 넣어 - 가장 단산 동물을 찾기 위해 세균 잔디를 통해 벌레 트랙을 따라.
- 일부 웜이 끝날 수 있기 때문에 접시의 가장자리를 확인하십시오. 또한 중심 점 점(그림 1D)에서 웜 수를 계산하고 기록합니다.
- 모든 접시에 30분의 활동 시간을 갖도록 모든 분석판을 순서대로 표시하여 접시를 설정하는 데 걸리는 시간을 고려하여 주의하십시오. 그런 다음 1.8 또는 1.9 단계에 설명된 대로 수동 또는 디지털 측정을 수행합니다.
- 눈금자를 사용하여 수동 측정을 수행합니다.
- 눈금자를 사용하여 각 웜의 중앙 지점에서 최종 위치 표시까지의 거리를 mm로 측정하고 거리를 기록합니다. 득점 중 진행 상황을 추적하려면 첫 번째 득점 포인트를 작은 마킹 라인으로 레이블을 지정합니다.
- 시계 방향으로 플레이트를 회전하여 각 점의 길이 데이터를 연속적으로 기록합니다(그림 1E).
- 스캐너와 ImageJ를 사용하여 디지털 측정을 수행합니다.
- 평판 스캐너를 사용하여 눈금자 옆의 분석 판 의 뒷면을 스캔합니다(스캐닝 표면을 향한 숫자)(그림 2A).
- ImageJ 또는 유사한 프로그램에서 스캔된 플레이트 이미지를 엽니다.
참고: ImageJ는 NIH가 호스팅하는 무료 Java 기반 이미지 프로세싱 소프트웨어입니다. - 직선 도구를 클릭한 다음 눈금자의 스캔 된 이미지에 1cm 및 2cm 점을 연결하는 선을 그립니다 (그림 2B).
참고: 시프트 컴퓨터 키를 유지하면 가장 가까운 45° 각도로 라인을 강제로 이동합니다. - 분석 메뉴로 이동하여 배율을 설정합니다(| 분석 설정 배율) (그림 2C).
- 적절한 상자에 알려진 거리 (10)와 길이 단위 (mm)를 입력하고 픽셀 번호로 거리를 조정하지 마십시오. 전역 을 확인하여 각 ImageJ 세션에서 분석되는 모든 이미지에 동일한 배율을 적용합니다. 그렇지 않으면 열면 각 이미지의 배율을 설정합니다(그림 2D). 확인을 클릭합니다.
참고: 단계 1.9.2-1.9.5는 측정 규모를 설정하기 위해 수행됩니다. 이제 이 이미지에 대한 측정값은 정의된 픽셀( 길이 관계)에 대한 선의 길이와 자동으로 관련이 있습니다. 300 dpi로 스캔된 이미지는 mm당 11.8픽셀의 대략적인 관계를 갖습니다. - 페인트브러시 도구를 사용하여 득점할 첫 번째 점 바로 위에 표시합니다.
참고: 이것은 득점된 첫 번째 웜에 대한 시각적 지표입니다. - 직선 도구를 사용하여 중심점에서 첫 번째 웜 데이터 포인트로 선을 그립니다.
- 거리를 측정하려면 키보드의 M 키를 클릭합니다. 또는 분석 메뉴로 이동하여 측정을 선택합니다 (| 분석 측정). 두 경우 모두 측정이 새 창에 나타납니다. 이 창은 이미지당 모든 측정값을 수집합니다.
- 중심점을 일정하게 유지한 다음 첫 번째 웜 지점에 닿는 선의 끝을 다음 웜 포인트로 이동하여 시계 방향으로 이동한 다음 M 키를 클릭하여 측정합니다.
- 모든 포인트가 득점될 때까지 시계 방향으로 각 점을 계속 측정합니다.
-
길이 측정 데이터를 스프레드시트에 복사하여 붙여 넣습니다. 그런 다음 스캔한 각 플레이트 이미지에 대한 프로세스를 반복합니다.
참고: 단계 1.9.6 - 1.9.11은 웜 변위 값을 측정합니다(그림 2E-F).
- 통계 분석을 수행합니다.
- 단일 실험 내에서 복제를 결합하여 총 수의 총 수가 30-40개의 웜 사이가 되도록 합니다.
- 다른 일에 독립적 인 실험 복제를 수행하고 3 독립적 인 실험 복제로 끝날 웜의 독립적 인 인구와 함께.
- 3개 이상의 균주에 대해 학생의 t-테스트 또는 1방향 ANOVA와 같은 적절한 통계 분석을 사용하여 데이터를 분석합니다.
2. 컴퓨터 분석 수영 분석
참고: 이 프로토콜에는 시판되는 WormLab 하드웨어 및 소프트웨어 시스템에 대한 자세한 지침이 포함되어 있습니다(재료 표 참조). 그러나 워크플로우는 다른 컴퓨터 분석 수영 분석 시스템에 적용할 수 있습니다.
- 비디오를 설정하고 녹화합니다.
- 이미징 하드웨어(그림 3)에서 차폐를 올리고 카메라 높이가 예상 위치로 설정되어 있는지 확인합니다.
참고: 35mm 플레이트에서 웜을 캡처하기 위한 최적의 높이는 아래나사 나사 보어의 세 번째 가 조정 가능한 카메라 마운팅 브래킷 아래에 표시되지만 나사 보어(스테이지 위 약 30.5cm)위에 추가 장착 구멍이 보이지 않도록 합니다(그림 3C). 이로 인해 캡처 비율이 11.43 μm/픽셀이 발생합니다. 분석기를 시작하기 전에 쉽게 확인할 수 있도록 "올바른 높이" 표시기를 추가하는 것이 좋습니다. 높이 조정을 고려하여 프로토콜 단계 2.18을 참조하십시오. - 관련 소프트웨어(보충 도 1A)를 엽니다.
- 비디오 캡처 아이콘(중간에 오른쪽 을 가리키는 삼각형이 있는 필름)을 클릭하여 새 비디오 캡처 창을 엽니다. 카메라는 라이브 뷰에 있지만 디스플레이는 검은색입니다(추가 그림 1B).
- 조광기 노브를 누르고 시계 방향으로 돌려 빛을 조정합니다.
참고: 조광기 손잡이는 밝은 필드 광원 근처의 이미징 시스템의 단계에 있습니다. 비디오 캡처 라이브 뷰 디스플레이는 검은색에서 조명으로 바뀝니다. - 다시 비디오 캡처 창에서, 설정 탭을 클릭, 다음과 같이 조정 : 비디오 모드 : 2456 x 2052_Mono8, 프레임 속도 : 14, 출력 : 흑백, 노출 : 0.00300 s, 게인 : 1 dB, 감마 : 1, 회전 180 (확인).
- 캡처 탭으로 다시 이동합니다. 레코딩 폴더(보충 도 1B)를 선택합니다.
참고: 모든 레코딩 및 프로젝트 파일이 저장되는 위치입니다. 개별 실험을 위한 고유한 폴더를 만들어 데이터를 정리합니다. - 파일 접두사 텍스트 상자에 입력하여 파일 이름을 할당합니다.
참고: 소프트웨어는 자동으로 형식 "0001"에서 접두사 끝에 프로그레시브 번호를 부가합니다. "YYYYMMDD_treatmentName_rep#_"과 같은 파일에 대한 일관된 명명 체계를 갖는 것이 좋습니다. - 다음과 같이 다른 캡처 설정을 설정: 버퍼: 128 프레임 (기본), 기간 (체크 켜기): 00 h:01min:00 s. 이 탭의 다른 설정을 무시하거나 끕니다.
- 분석 플레이트를 놓고, 뚜껑을 위로, 장치 스테이지에 놓고 비디오 캡처 화면에서 중앙집중화합니다. 뚜껑을 제거합니다.
참고: 미리 분석 판을 준비합니다. 각 플레이트는 35mm 페트리 접시로 구성되어 있으며, 약 절반은 씨를 뿌리지 않은(세균잔디 없음) NGM으로 가득합니다. - 마이크로피펫을 사용하여 M9의 1mL에서 1mL의 1mL의 웜을 분석 판에 세척하여 약 50개의 웜을 목표로 합니다(그림 3D). 부드럽게 중앙에 동물을 가지고 또는 동물을 분리하기 위해 M9의 몇 방울을 추가 마이크로 파이프를 사용하여 접시를 소용돌이 (그림 3E). 벌레가 수영하는 데 적응할 수 있도록 60s의 타이머를 설정합니다.
참고: 플레이트가 화면에 100% 표시되지 않습니다. 동물은 겹치는 동안 정확하게 추적되지 않습니다. - 타이머가 카운트다운되는 동안 디스플레이를 보면서 카메라의 렌즈 본체에 초점을 맞추는 링을 돌리면 카메라 초점을 수동으로 조정합니다(그림 3F). 스크롤 휠 마우스를 사용하여 웜을 확대하여 보다 정밀한 초점을 맞출 수 있습니다.
- 포커스를 설정한 후 디스플레이가 과다 노출 없이 가능한 한 밝게 표시될 수 있도록 라이트 노브를 조정합니다(디스플레이에 빨간색 픽셀로 표시됨).
- 60년대 후 , 레코드 버튼을 누릅니다.
참고: 비디오는 라이브 뷰 에서 녹화 로 이동하며 타이머가 표시됩니다. 캡처가 완료되면 비디오 캡처 디스플레이가 라이브 뷰 (추가 그림 1B)로 돌아갑니다. - 녹음 후 접시를 제거하고 다음 플레이트를 설정합니다. 필요에 따라 접두사 이름을 바꿉니다. 벌레를 분석 판에 씻고 60 s에 대한 배양하고 각 치료를 기록하십시오.
- 실험을 위해 모든 레코딩을 완료한 후 열린 비디오 탭을 닫고 조광기 노브를 우울하게 하여 광원을 끕니다.
- 창 오른쪽 상단 모서리에 있는 빨간색 x 버튼을 클릭하여 비디오 캡처 창을 닫습니다. 또는 전체 소프트웨어 패키지를 닫고 다시 엽니다.
- 추적을 위해 비디오를 준비합니다.
- 워크플로 사이드바 메뉴에서 이 메뉴의 첫 번째 단추인 이미지 시퀀스 가져오기를 선택하고 비디오를 찾아 두 번 클릭합니다. 비디오는 중간 창에서 열립니다 (보충 그림 2A).
참고: 소프트웨어의 기본 표시는 워크플로 우측 기 메뉴입니다. 이 메뉴는 보기 [보기 | 아래보기 상단 드롭다운 메뉴를 통해 액세스할 수도 있습니다. 워크플로]. 워크플로 메뉴에는 여러 보기 옵션이 있습니다. 트랙 뷰는 프로토콜의 이 시점에서 적절합니다. 메뉴에 설정 시퀀스 정보 버튼이 표시되지 않으면 올바른 보기가 아닙니다. 먼저 메뉴 하단을 살펴보고 워크플로 탭이 활성화되어 있는지 확인한 다음 트랙 아이콘을 클릭하여 트랙 뷰가 활성화되어 있는지 확인합니다. 창에 메뉴가 표시되는 위치는 모니터 크기와 다른 열린 메뉴의 위치에 따라 달라집니다. 메뉴는 드래그 앤 드롭, 크기 조정 및 닫기로 이동할 수 있습니다. 대부분의 메뉴는 보기 드롭다운 메뉴를 통해 열 수도 있습니다. - 워크플로 메뉴에서 시퀀스 정보 집합을 선택합니다(추가 그림 2B). 새 메뉴 창에서 명명 체계를 확인하고 메모를 추가하고 메타데이터의 유효성을 검사합니다.
- 배율 조정이 올바르게 설정되어 있는지 확인합니다. 배율: 11.43 μm/픽셀 및 측정 은 1000 μm이 87픽셀이기 때문에 자동 채웁니다. 카메라 높이가 여기에 규정된 것과 다르게 조정된 경우 이 메뉴의 지침을 따라 저울을 업데이트합니다. 저장 버튼을 클릭합니다.
- 워크플로 메뉴에서 이미지 조정을 선택하고 이미지 조정 이라는 새 팝업 메뉴가 열립니다(추가 그림 2C). 밝은 배경(밝은 필드)에서 어두운 웜을 선택합니다.
- 추가 설정을 조정합니다. 권장 이미지 처리 설정 은 다음과 같습니다: 배경 스무딩: 10, 가우시안 스무딩: 5, 채우기 구멍: 2, 작은 개체 필터: 0, 그리고 일체형 유도체 세분화건너뛰.
- 동물이 완전히 녹색으로 채워지지만 배경과 구별될 수 있도록 임계값 수준을 조정합니다. 적용을 클릭합니다.
참고: 웜이 아닌 일부 개체를 선택하는 것은 허용됩니다. - 워크플로 메뉴에서 검색 및 추적을 선택합니다(추가 그림 2D).
참고: 검색, 추적 및 복구: 3개의 탭이 있는 동영상 측면에 메뉴가 표시됩니다. 커서는 비디오 디스플레이를 통해 가리키는 손가락처럼 보입니다. 또는 소프트웨어 왼쪽 상단의 아이콘 메뉴에서 선택 아이콘(커서 화살표)을 클릭합니다.- 손가락 선택기 도구를 사용하여 3-7 웜을 선택하고 감지 탭에서 웜 감지 버튼을 클릭합니다.
참고: 이 선택은 소프트웨어가 지정된 조건에 대한 웜을 정확하게 식별하는 데 도움이 되며 각 비디오에 대해 수행해야 합니다. 몇 초 후 대부분의 웜이 녹색으로 강조 표시되고 숫자가 노란색으로 표시됩니다. 만지거나 웅크려는 벌레는 강조되지 않을 것입니다. 그러나 이 프로그램은 추적 중에 해당 프로그램을 찾을 가능성이 큽습니다. 검색 매개 변수를 조정하는 옵션이 있습니다. 그러나 기본값은 대부분의 조건에서 잘 작동합니다. 검출 매개 변수를 조정하는 경우 샘플과 복제 간에 일관성을 유지해야 합니다.
- 손가락 선택기 도구를 사용하여 3-7 웜을 선택하고 감지 탭에서 웜 감지 버튼을 클릭합니다.
- 검색 및 추적 창에서 추적 탭으로 이동합니다(추가 그림 2E). 추적 매개 변수에서 역추적 사용 확인, 이미지의 가장자리에 추적 웜을 선택 해제.
- 최대 추적 가설을 5로 설정합니다. 추적 모드를 수영으로 설정합니다.
참고: Max 추적 가설 설정은 추적된 단일 웜이 가질 수 있는 잠재적 웜 트랙 수를 조정하고 이를 추적하지 않고 단일 웜을 추적하는 방법에 대한 약간의 여유를 프로그램에 제공합니다. 5는 수영을위한 좋은 환경입니다. - 고급 설정 섹션으로 이동하여 다음을 설정합니다: 프레임 웜이 경계를 만질 수 있습니다: 50, 프레임 웜이 겹칠 수 있습니다: 500, 위치 허용 오차: 0.50, 모양 허용 오차: 0.50. 이러한 설정을 저장하고 실험(및 그 너머)에 모든 비디오에 배포하여 구성으로 저장합니다.
참고: 트랙 필터링 은 권장되지 않으며 쉽게 후처리를 수행 할 수 있습니다, 떠나. - 왼쪽 위 아이콘 메뉴에서 구성 관리자 (기어 아이콘)로 이동합니다. 클릭하면 구성 관리자 사이드바 메뉴가 열립니다. 그런 다음 저장(기어 +) 아이콘을 클릭하고 이 구성에 이름과 설명을 한 다음 확인 단추를 클릭합니다.
- 나중에 이 구성에 액세스하려면 구성 메뉴를 열고 원하는 구성을 선택하고 로드 (기어업 화살표) 아이콘을 클릭합니다. 그런 다음 시퀀스 정보를 추가하고 임계값 수준을 미세 조정하고 검색을 위해 웜을 선택합니다. 다른 모든 설정은 동일합니다.
- 워크플로 메뉴에서 프로젝트 저장을 클릭하고 저장 위치를 확인하고 프로젝트 파일 이름을 추가합니다(프로젝트 파일 이름을 비디오 이름에 일치하면 연속성에 도움이 됩니다). 비디오를 닫습니다.
참고: 이러한 프로젝트는 .wpr 파일 유형으로 저장됩니다. - 모든 동영상에 대해 반복: 이미지 시퀀스 가져오기(2.18), 저장된 구성로드(2.28.1), 임계값 조정(2.23), 시퀀스 정보(2.19), 웜 감지(2.24.1), 프로젝트 저장(2.29), 닫기 비디오.
- 동영상 추적
- 프로젝트 파일을 추적하려면 워크플로 메뉴로 이동하여 일괄 처리 (웜 페이지가 포함된 폴더) 아이콘(추가 그림 2F)을 클릭합니다.
참고: 배치 처리 패널이 표시됩니다(보조 그림 2G). 때로는 숨겨져 있지만 일괄 처리 워크플로 메뉴의 맨 아래에 액세스 할 수 있습니다. 창을 보려면 창을 확장해야 할 수 있습니다. - 이 일괄 처리 메뉴의 파일 선택 섹션 아래의 추가 단추를 클릭합니다. 처리할 모든 프로젝트 파일(.wpr)을 탐색하고 선택하려면 열기를 클릭합니다.
참고: 배치 처리 메뉴는 선택한 파일 경로, 상태 표시기 및 각 파일에 대한 회색 진행률 표시줄로 채워집니다. - 시작(재생 버튼 아이콘)을 클릭합니다. 첫 번째 파일의 녹색 진행률 표시기를 기록합니다. 모든 파일을 처리하도록 허용합니다. 모든 파일이 완료된 것처럼 읽을 때(녹색), 소프트웨어를 닫을 수 있습니다(보충 도 2G).
- 프로젝트 파일이 막히면 중단 파일을 단독으로 실행하는 것이 좋습니다. 이 문제가 해결되지 않으면 프로젝트 파일을 열고 선택한 웜(검색 및 트랙 메뉴)을 삭제하고 새 교육 집합에서 다시 선택합니다. 그런 다음 프로젝트 파일을 다시 처리합니다.
- 프로젝트 파일을 추적하려면 워크플로 메뉴로 이동하여 일괄 처리 (웜 페이지가 포함된 폴더) 아이콘(추가 그림 2F)을 클릭합니다.
- 트랙 수리(권장)
참고 : 트랙을 복구하면 트랙의 정확도를 높일 수 있습니다. 일반적인 수정 사항은 정확하지 않거나 실제 웜 데이터를 캡처하지 않는 트랙을 삭제하고 웜이 접촉하기 때문에 잘못 표현되는 트랙을 분할하는 것과 같이 인간의 눈으로 볼 수있는 동일한 웜에 명확하게 속하는 트랙을 결합하고 있습니다 (나쁜 섹션을 제거하고 실제 경우 불량 한 섹션 전후의 트랙을 결합).- 소프트웨어를 열고 프로젝트 파일 [파일 | 열립니다. 관심의 프로젝트]를 엽니 다. 열기 를 클릭하고 이 파일을 사용하려면 예를 클릭합니다. 시간 필터가 로드될 때까지 기다립니다. 처리된 비디오가 화면에 표시됩니다. 웜은 녹색으로 강조 표시되고 노란색으로 설명됩니다. 비디오 플레이어를 사용하여 비디오를 스크럽하거나 재생합니다.
- 워크플로 메뉴에서 검색 및 추적을 선택합니다(추가 그림 2D). 복구 탭으로 전환합니다. 선택기 도구 아이콘(커서 화살표)을 클릭하여 선택기 커서를 활성화합니다. 비디오를 스크럽하고 웜 트랙을 찾은 다음 복구 메뉴를 사용하여 원하는 변경 을 만듭니다.
참고: 대부분의 문제를 전략적으로 신속하게 해결하려면 플레이트의 약 1/6이 표시되는 것을 확대하여 트랙 #1을 둘러싼 영역으로 시작합니다. 아무 데도 없는 웜을 확인하여 비디오를 빠르게 스크럽하고, 숫자가 바뀌는지, 또는 벌레가 서로 부딪히는 곳을 추적하여 문제가 발생하면 편집합니다. 시작 위치에서 숫자 순서로 웜을 따릅니다. 전체 플레이트가 수리될 때까지 필요에 따라 각 웜을 따르도록 앞뒤로 문지십시오. 접시의 가장자리에주의하십시오. 종종 가짜 웜이 플레이트 가장자리의 그림자에 나타납니다.
- 데이터 분석
- 워크플로 메뉴에서 데이터 분석(추가 그림 3A)을 선택합니다.
참고: 데이터 분석 및 플롯 이라는 새 창이 나타납니다(추가 그림 3B). 이 창에는 특정 프로젝트 파일의 웜 채우기의 이동 데이터를 평가하고 볼 수 있는 여러 가지 방법이 있습니다. 이러한 분석의 대부분은 주어진 비디오에서 특정, 여러 또는 모든 웜을 선택할 수 있으므로 트랙 정보를 다양한 방식으로 플롯할 수 있습니다. - 턴 수를 분석하려면 트랙 요약 [위치 및 속도 | 트랙 요약] (보충 도 3C). 오른쪽 하단의 내보내기 버튼을 사용하여 스프레드시트가 읽을 수 있는 형식(.csv)으로 데이터를 내보내고, 스프레드시트의 원하는 위치로 가는 경로를 선택합니다. 기본 설정은 좋은 선택입니다(추가 그림 3D).
- 이 데이터와 기타 관련 프로젝트 데이터 집합을 통합 스프레드시트 워크북(보충 그림 3E)에 붙여 넣습니다.
- 회전 수 및 트랙 기간을 사용하여 스프레드시트 함수(=회전/트랙 기간 * 60)를 사용하여 각 트랙에 대해 최소 회전을 계산하거나 원하는 대로 다른 메트릭(추가 그림 3F)을 사용합니다.
참고: 분당 회전은 액체에서 활동의 널리 사용되는 메트릭인 수동 스래싱 분석과 매우 유사한 정보를 캡처하지만 많은 옵션이 있으며, 다른 메트릭이 주어진 치료 또는 비교를 위해 다른 흥미로운 데이터를 식별할 수 있습니다. - 원하는 경우 조건부 서식 도구를 사용하여 웜 크기, 트랙 기간 및/또는 기타 선택한 메트릭을 화면으로 표시하여 제거를 위한 트랙을 강조 표시합니다. 치료와 복제 간에 일관된 데이터 처리를 유지관리합니다.
- 2균주에 대한 학생의 t-테스트 또는 3개 이상의 균주에 대한 1방향 ANOVA와 같은 적절한 통계 분석을 사용하여 데이터를 분석합니다. 다른 일 및 적어도 3 개의 독립적 인 실험 복제에 대한 웜의 독립적 인 인구와 독립적 인 실험 복제를 수행합니다.
- 워크플로 메뉴에서 데이터 분석(추가 그림 3A)을 선택합니다.
결과
방사형 운동과 수영 용액 은 모두 운동성 장애의 민감한 검출을 제공합니다 (그림 4 및 도 5). ALS에서 병리학적 TDP-43의 기본 메커니즘을 조사하기 위해 C. elegans 모델은 야생 형 또는 ALS 돌연변이 인간 TDP-43을 범뉴런으로 표현하는 것으로 개발되었습니다. 이 동물은 모터 기능 장애를 포함하여 ALS를 연상시키는 분자 및 세포 특성을 표시합니다9. 중요한 것은, 방사형 운동과 수영 용색을 모두 사용하여 ALS 돌연변이 TDP-43을 표현하는 동물에서 야생형 인간 TDP-43의 발현과 보다 심한 운동 장애로 적당한 운동성 장애를 나타낸다. 일부 돌연변이 또는 형질 전환 동물은 수영보다 크롤링에 더 큰 장애가있을 것입니다, 또는 그 반대의 경우도 마찬가지입니다. 두 가지 운동성 애서를 사용 하 여, 균주 사이 현상 차이의 명확한 그림을 얻을.
방사형 운동
씨앗을 뿌신 한천 접시에 놓이면 , C. 엘레간들은 음식 원천의 경계를 찾는 등 주변 을 탐험합니다. 방사형 운동 분석은 체력에 대한 지표로 그 행동을 활용하는 한 가지 방법입니다. 방사형 운동 분석법은 조절되고 정량화 가능한 방식으로 운동 동작(고체 표면에서 크롤링)을 분석함으로써 모터 적자 및 기타 모터 관련 표현형의 심각도를 평가하기 위한 간단하고 효과적인 도구를 제공합니다. 방사형 운동 액약은 적당히 또는 심각하게 손상된 ALS 모델 웜에서 운동성의 차이를 포착하고 운동성 표현형의 변조 또는 나이가 들면 운동성 변화를 비교하는 기준선을 제공합니다(그림 6). 이 전략은 야생 유형(N2) 또는 제어 웜에서 이동을 변경한 변형된 변형의 크롤링 동작을 정량화하기 위해 적용될 수 있습니다. 그러나,이 방법은 마비된 롤러 돌연변이또는 동물과 같이 정상적으로 크롤링할 수 없는 동물을 평가하는 데 좋은 선택이 아닐 수 있습니다. 일반적으로 야생형 웜은 20°C에서 올리고 테스트할 때 200-300 μm/min 사이의 평균 변위를 제시합니다. 도 4 에 제시된 예 데이터는 온화한 표현형 [TDP-43(WT-mild), CK402(bkIs402[Psnb-1:TDP-43;; Pmyo-3::GFP])] 또는 더 강한 표현형 [TDP-43(WT-보통), CK410 (bkIs402[Psnb-1:TDP-43; Pmyo-2::GFP]], 돌연변이 인간 TDP-43을 절전형으로 발현하는 형질균 [TDP-43V(M337V), CK423(bkIs423[Psnb-1:TDP-43; Pmyo-2::GFP]), 및 또 다른 신경 퇴행성 질환 관련 단백질을 발현하는 형질균, 야생형 인간 타우 [타우(Tau(WT), CK144(bkIs144[Paex-3:tau(4R1N); Pmyo-2:::GFP]]. 야생형 TDP-43을 발현하는 두 균주는 방사형 운동으로 인해 검출된 것과 같이 다양한 장애를 가지고 있습니다. TDP-43(WT-low)은 N2와 크게 다르지 않으며 TDP-43(WT-high)은 운동성에 분명한 차이를 나타낸다. TDP-43(M337V) 및 타우(WT) 균주는 운동성에서 더 심각한 손상을 가한다.
수영 분석
C. 엘레간은 액체에 침지 될 때 고정 관념 수영 (스래싱) 운동에 종사합니다. 침수 직후, 벌레는 약 45°의 굽힘 각도로 머리와 꼬리를 서로 향하게 구부리기 시작하고 각도 정점이 웜의 중간점입니다. 벌레는 복부 및 등대 방향으로 번갈아 구부립니다. 소프트웨어에 의해 측정된 한 번의 스래쉬는 방향성에 관계없이 직선에서 20° 이상의 바디 굽힘 각도로 이동하는 움직임을 나타냅니다(각도 임계값은 분석 및 플로팅 창 내에서 후처리를 조정할 수 있습니다[워크플로| 데이터 | 분석 바디 쉐이프 | 구부리기 각도 | 미드 포인트 | 진폭 임계값: # 도]. 여기에 설명된 수영 분석은 자동화된 컴퓨터 기반 추적 및 분석을 사용하여 수영 활동의 편견 없는 점수를 제공합니다. 야생형(N2) 벌레는 20°C에서 제기되고 기록될 때 분당 150~200마리의 스래시 사이를 볼 것으로 예상된다. 도 5에 제시된 예 데이터는, 온화한 표현형 [TDP-43(WT-mild), CK402(bkIs402[Psnb-1:TDP-43;; Pmyo-3::GFP])] 또는 더 강한 표현형 [TDP-43(WT-보통), CK410 (bkIs402[Psnb-1:TDP-43; Pmyo-2::GFP]],및 또 다른 신경 퇴행성 질환 관련 단백질을 발현하는 형질균, 야생형 인간 타우 [타우(WT), CK144(bkIs144[paex-3:tau(4R1N); Pmyo-2:::GFP]]. ALS 돌연변이 TDP-43 [TDP-43(M337V)]을 발현하는 형질 균주는 액체에 스래시하지 않으므로 그래프에 ND(데이터 없음)로 표시됩니다. 이 분석체는 도 4에 도시된 방사형 운동 분석과 다른 표현형을 구별할 수 있다. 예를 들어, 방사형 운동 분석법(도 4)에서 TDP-43(WT-low)은 N2와 크게 다르지 않았다. 그러나 수영 분석법(그림 5)에서는 TDP-43(WT-low)과 TDP-43(WT-high)이 모두 N2와 크게 다르며 서로 크게 다릅니다. 또한, TDP-43(M337V)과 타우(WT)가 방사형 운동(그림 4)에 의해 심각한 크롤링 장애를 가지고 있음에도 불구하고 타우(WT)만이 소프트웨어(그림 5)에 의해 추적될 수 있을 만큼 충분히 분쇄할 수 있다. TDP-43(M337V) 동물은 분쇄할 수 없으며 소프트웨어 기반 분석은 이러한 웜을 정확하게 감지하거나 추적하지 않습니다. 따라서 이러한 웜에 대한 데이터는 수집되지 않았습니다(ND, 데이터 없음).
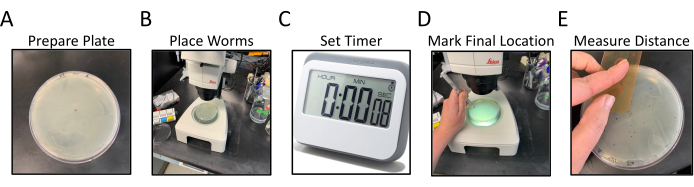
그림 1: 방사형 운동 분석 워크플로우. 패널 A-E 는 방사형 운동 분석의 일반화된 단계를 보여줍니다. 단계는 다음과 같습니다 : (A) NGM 플레이트, 가장자리에 OP50 시드와, 라벨 및 중앙 점을 표시하여 제조, (B) 벌레는 중앙 점에 의해 표시된 대로 한고의 중앙에 배치되고, (C) 벌레는 시간의 설정 된 금액에 대해 자유롭게 이동할 수 있습니다, (D) 플레이트는 아래로 뒤집혀 각 웜의 최종 위치는 중앙 색으로 표시되고, (D) 플레이트는 중앙 의 색상이 다른 것으로 표시된다. (E) 중앙 점에서 각 최종 웜 위치로의 거리는 손으로 또는 디지털로 측정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
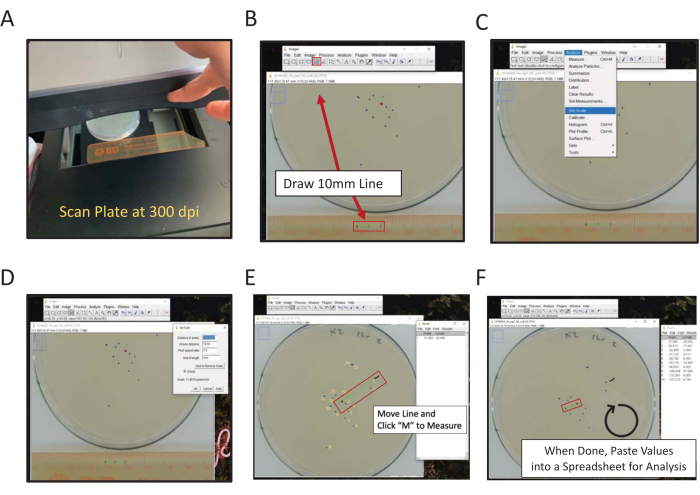
그림 2: ImageJ를 사용하여 최종 위치의 디지털 측정. 중앙 측정으로부터의 거리는 손으로 또는 디지털로 측정할 수 있으며, 프레임에 눈금자가 있는 ImageJ(A) 스캔 뒷면을 사용하여 디지털 방식으로 측정할 수 있다. (B) 선 도구를 사용하여 알려진 길이를 그립니다. (C) (B)에 그려진 알려진 길이를 사용하여 배율을 설정 [| 분석 스케일 설정...]. (D) 라인 도구를 사용하여 중앙 점에서 최종 위치 표시로 선을 그리고 각 마크에 대해 반복합니다. (E) 첫 번째 마크 측정 보조 보조장치를 표시하는 페인트 브러시 라인(1 마크 근처의 검정선). 최종 위치 표시는 점수 매기기의 방향을 설명하기 위해 노란색으로 번호가 매겨져 있습니다. (F) 측정값은 결과 창에 기록됩니다. 통계 분석을 위해 결과를 다른 곳에 저장합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 소프트웨어 사용에 대한 재료 및 하드웨어 조정. (A) 소프트웨어 지원 수영 분석에 사용되는 자료. (B) 일반 소프트웨어 및 필요한 재료의 설정, 하우징이 제기 된 위치에 있음을 유의하십시오. (C) 렌즈 장착 브래킷 높이를 조정할 수 있습니다. 이 이미지는 조정 가능한 트랙과 수영 에세이를 수행하기 위한 선호 되는 높이를 표시하는 테이프 표시기를 보여줍니다. 녹화하기 전에 밝은 시야 의 빛과 카메라 초점을 조정해야합니다. (D) 35mm 분석판이 무대에 배치되고, M9의 동물은 접시에 첨가되고, 1분 타이머가 시작된다. (E) 웜을 중앙에 더 가깝게 이동시키기 위해 접시를 부드럽게 소용돌이치는 것이 때로는 유리합니다 - 라이브 캡처 화면의 위치를 관찰; 또는 피펫터에서 몇 방울떨어진 M9을 사용하여 웜을 분리할 수 있습니다. (F) 카메라 렌즈의 초점 링을 조정하고 화면의 웜을 관찰하여 최적의 초점을 결정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
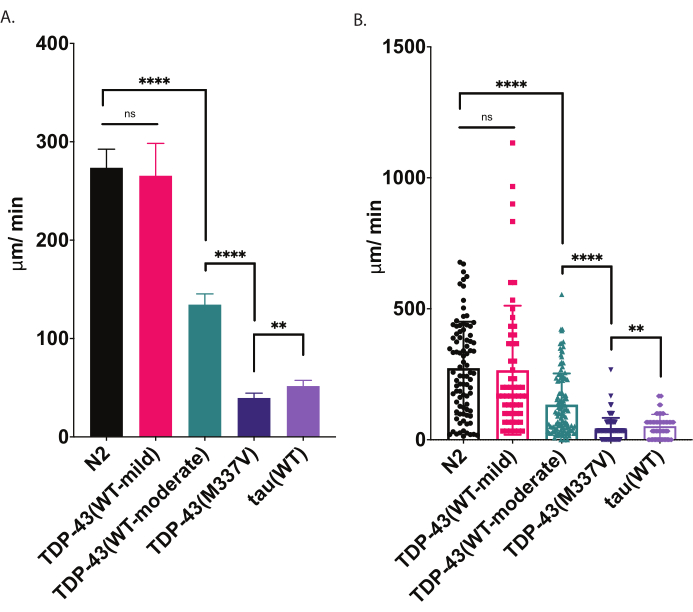
그림 4: 방사형 운동 액약은 크롤링 속도의 차이를 감지합니다. 개발 단계적 L4 애벌레의 자극되지 않은 분산은 위에서 설명한 방사형 운동 분석체를 이용하여 측정하고 μm/min 이동(A-B)으로 그래프로 그래프로 그래프로 분석하였다. (A) 및 (B)에 플롯된 동일한 데이터는 두 가지 다른 그래픽 프레젠테이션을 보여 줍니다. (A)에서 데이터는 막대 그래프로 표시되어 균주 간의 상대적 차이를 더 선명하게 만듭니다. (B)에서 각 웜의 최종 변위는 그래프 내에서 플로팅되어 모집단 내의 변동이 더 잘 시각화될 수 있도록 합니다. 테스트된 균주 들 간의 중요성을 평가하기 위해 Tukey의 다중 비교 테스트를 통해 분산(ANOVA)의 단방향 분석이 사용되었습니다. **p=0.0022, ****p<0.0001, ns=중요하지 않습니다. TDP-43(M337V) 및 타우(WT)도 N2, p<0.0001과 크게 다릅니다. (A)의 오류 막대는 평균(SEM)의 표준 오류이며(B)는 표준 편차입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
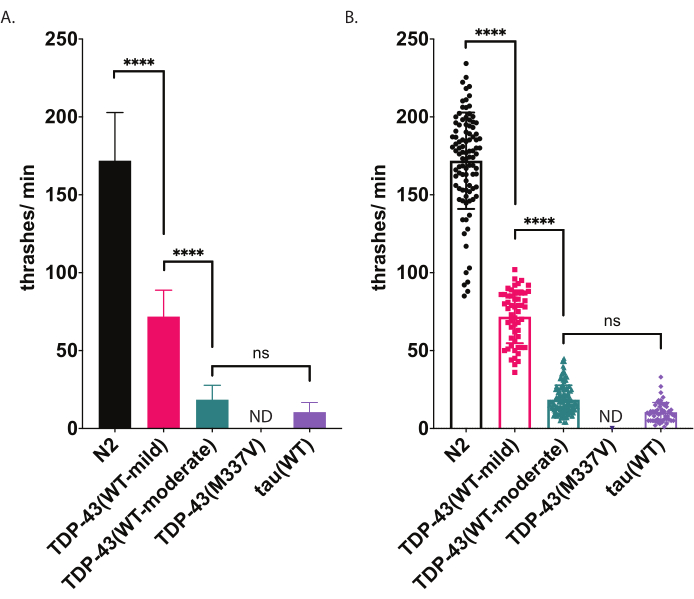
그림 5: 수영 에세이는 액체에서 스래싱의 차이를 감지합니다. 수영속도(액체의 스래싱 또는 기복 주파수)는 위에서 설명한 편견없는 컴퓨터 보조 점수 및 분석을 사용하여 측정되었으며 스래시/분(A-B)으로 그래프화되었습니다. (A) 및 (B)에 플롯된 동일한 데이터입니다. (A)에서 데이터는 막대 그래프로 그래프로 표시되어 균주 간의 상대적 차이를 쉽게 볼 수 있습니다. (B)에서 채점된 각 개별 웜의 데이터가 그래프 내에 플롯되어 모집단 내의 변동이 더 잘 시각화될 수 있습니다. 테스트된 균주 들 간의 중요성을 평가하기 위해 Tukey의 다중 비교 테스트를 통해 분산(ANOVA)에 대한 단방향 분석이 사용되었습니다. p<0.0001, ns=중요하지 않습니다. TDP-43(WT-보통) 및 타우(WT)도 N2와 크게 다르며, p<0.0001.error 막대(A)는 평균(SEM)의 표준 오차이며(B)는 표준 편차이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
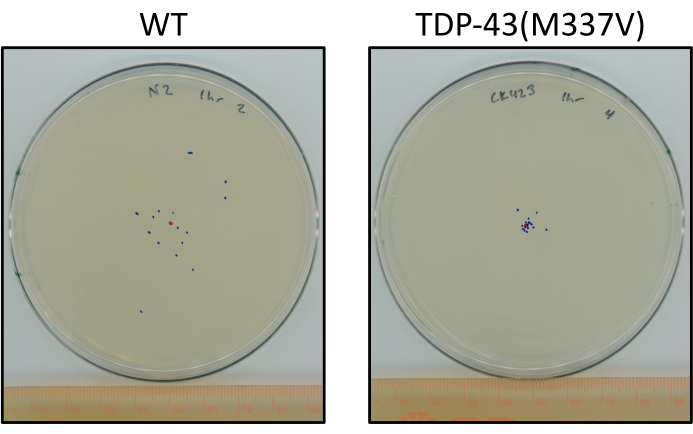
그림 6: 돌연변이 TDP-43 웜은 야생 형 웜보다 적게 이동합니다. 단계적 L4 N2(와일드 타입) 및 TDP-43(M337V)의 최종 위치(CK423(bkIs423[Psnb-1:TDP-43]의 최종 위치에 대표적인 차이를 나타내는 플레이트; Pmyo-2::GFP]), 실온에서 1시간 동안 자극받지 않은 크롤링 후 심하게 손상된 모터 기능을 가진 돌연변이 인간 TDP-43을 발현하는 균주. 플레이트는 동물의 최종 위치에 대한 중앙 점과 파란색 점에 대한 빨간색 점으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 1: 이미징 및 추적 소프트웨어를 사용하여 수영 동작을 기록합니다. (A) 추적 워크플로및 비디오 캡처 아이콘의 위치입니다. (B) 비디오 캡처 창은 라이브 뷰 에 표시되며 가장 중요한 측면이 강조 표시됩니다. 레코드 버튼이 활성화되면 녹색 "라이브 보기" 단어가 빨간색 "기록"으로 변경됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 수영 동작을 준비하고 추적합니다. 이 그림은 추적을 위한 비디오 이미지 시퀀스를 설정하는 데 도움이 되는 일련의 스크린샷을 보여줍니다. 비디오 시퀀스를 준비하기 위한 일반적인 프로토콜은 이 순서로 각 워크플로 메뉴를 여는 것입니다: 이미지 시퀀스 가져오기 | 시퀀스 정보 | 설정 이미지 | 조정 | 감지 및 추적 프로젝트 저장. 데이터 분석 창은 프로젝트 파일을 추적한 후에만 사용할 수 있습니다. (A) 트랙 워크플로 내에서 시퀀스를 소프트웨어로 가져온 후 열린 .avi(비디오) 파일을 보여 보겠습니다. (B) 설정 시퀀스 정보 창은 메모에 대한 장소를 제공하고, 배율을 설정/변경하며, 비디오 시퀀스에 대한 메타데이터를 확인합니다. 스케일 변경 에 대한 지침은 이 창에서 나와 카메라가 낮거나 올립니다(B)를 따라야 합니다. 이미지(C)에는 이미지 창 조정 설정이 표시됩니다. (D) 감지 및 추적 창의 검색 탭을 보여주는 스크린샷입니다. 웜 을 감지하는 것은 소프트웨어를 학습하는 데 사용되며 각 비디오 시퀀스에 대해 설정해야합니다. 원하는 경우 추가 검출 매개 변수를 여기에서 설정할 수 있습니다. (E) 수영 동작 추적 에 권장되는 설정이 있는 감지 및 추적 창의 추적 탭의 스크린샷입니다. 이것은 비디오 시퀀스를 설정하는 마지막 단계입니다. 프로젝트 저장 창을 사용하여 시퀀스를 프로젝트로 저장합니다. 각 비디오 시퀀스에 대해 이러한 단계를 반복합니다. 설정을 구성으로 저장하여 워크로드를 줄이고 모든 시퀀스가 동일하게 처리되도록 할 수 있습니다(도시되지 않음). 분석을 위해 프로젝트 파일을 추적하려면 일괄 처리 워크플로로 이동합니다. (F) 일괄 처리 워크플로플로로 이동하는 데 사용되는 아이콘을 표시하고(G)는 배치 처리 창을 표시하고 추가 및 시작 단추를 강조 표시하고 추적된 프로젝트 파일의 예상 모양을 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 수영 동작 분석. 프로젝트 파일을 추적한 후 [File | 사용하여 열 수 있습니다. 프로젝트 열기]. 웜은 (A)에 표시된 대로 녹색으로 나타납니다. 비디오를 스크러빙하면 예상대로 처리된 비디오가 스크러빙하는 동안 녹색 강조 표시가 사라집니다. 데이터 분석 및 플롯 창은 데이터 분석 워크플로 항목에서 열립니다. (B)는 위치 뷰가 열린 데이터 분석 및 플롯 창을 보여 주며(기본값), 모든 트랙이 강조 표시됩니다. 데이터 포인트 아래에는 강조 표시된 각 웜에 대해 기록된 트랙을 보여주는 플롯이 있습니다. 트랙 요약 분석은 분당 계산된 회전에 사용됩니다. (C-D)는 트랙 요약 보고서 및 내보내기 세부 정보를 표시합니다. (E-F) 스프레드시트에 트랙 요약과 분당 회전을 계산하는 방법, 이 분석기에서 측정된 출력을 표시합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
방사형 운동:
이 분석의 해상도는 시간 변수를 변경하여 쉽게 제어할 수 있습니다. 시간의 길이를 증가하면 심한 표현형을 가진 동물 간의 차이를 쉽게 관찰할 수 있으므로 미묘한 차이를 식별할 수 있습니다. 그러나, 이 분석이 변위를 측정하기 때문에, 분석 시간이 너무 길어지면, N2와 같은 정상적인 운동성을 가진 동물은 판의 가장자리로 이동하여, 행동을 포기하는 것은 역추적으로 이어질 것이다. 이렇게 하면 이동 거리 측정이 인위적으로 줄어듭니다. 동물이 접시에 고르게 분산됨에 따라 너무 긴 기간은 균주, 특히 덜 심한 운동 표현형을 가진 동물 들 간의 차이가 사라질 수 있습니다. 시간 변수를 줄이면 더 많은 활성 웜이 플레이트의 가장자리를 찾는 것을 방지할 수 있습니다. 이 방법은 각 웜에 대해 이동한 총 거리를 추적하지 않지만 각 웜에 대해 이동한 거리를 플레이트 중심에서 선형 거리로 압축합니다. 따라서 개별 웜의 총 트랙 길이를 기록하는 방법보다 본질적으로 덜 강력합니다. 그러나, 방사형 운동 분석은 아주 작은 연구원 훈련을 필요로 하고, 대부분의 벌레 실험실에서 일반적으로 유효한 상대적으로 적당한 시약을 사용하고, 중요하고 재현가능한 결과를 생성하기에 충분히 민감합니다. 자동화된 비디오 추적을 선호하는 랩의 경우 크롤링 움직임을 추적하고 분석하기 위해 이전에 여러 가지 방법이 설립되었거나 이 백서의 수영 분석에 사용되는 소프트웨어 매개 변수를 변경하여 크롤링 감지 및 분석을 허용할 수 있습니다.
이 실험은 일반적으로 복제당 30-40 개의 웜 세트를 통해 30-40 개의 웜 세트를 통해 세 쌍둥이 독립적 인 복제에서 수행됩니다. 각 복제는 플레이트당 15-20 개의 웜이있는 두 개의 서로 다른 100mm 또는 150mm 플레이트로 분할됩니다. 플레이트당 권장되는 것보다 더 많은 웜을 사용하면 효율적으로 점수를 매기기가 어려울 수 있습니다. 총 90+ 점수는 온증, 보통 또는 심한 운동 장애에 대한 중요성을 확립하기에 충분히 전원이 공급됩니다. 득점된 균주 사이의 타이밍과 일치하는 것은 정확성과 재현성에 필수적입니다. 30분은 일반적으로 야생형 웜에 비해 인간 돌연변이 TDP-43을 발현하는 형질균과 같은 중등도에서 중증 표현형 사이의 차이를 확립할 만큼 충분히 길다(도 4). 시간 변수가 연장될 경우 플레이트 크기를 100mm에서 150mm로 늘리는 것이 좋습니다. 온도 및 습도와 같은 환경 적 요인은 일반적으로 주변 실온에서 수행되는이 분석에 영향을 줄 수 있으므로 복제본을 비교할 때 항상 야생 유형 (N2) 제어를 사용하는 것이 중요합니다. 또한, 이 분석은 액체 (스래싱)에서 정상적인 수영 동작을 나타내지 않는 일부 균주의 운동성을 측정할 수 있어 수영 분석에 유용한 보완이 됩니다.
수영 분석:
웜 수영의 추적 및 분석을 자동화하기 위해 이미징 및 수집 시스템을 사용하면 엄격하고 편견없는 데이터를 얻을 수 있습니다. 그러나 실험의 초기 설정 중에 샘플 간에 제어해야 하는 몇 가지 요인이 있습니다. 여기에는 녹화를 시작하기 전에 액체에 적응하는 시간, 주변 조건 (예 : 온도, 습도), 일관된 빛 및 기록 설정이 포함됩니다. 녹화 단계에서는 플레이트 간의 가변성을 줄이는 데 도움이 되는 몇 가지 기능이 있습니다. 여기에는 통합 된 트랙 장착 카메라와 플레이트 사이에 비디오를 일관되게 만드는 밝은 필드 스테이지, 녹화 하는 동안 반사, 눈부심 및 공기 움직임을 방지하는 무대 주변의 차폐, 웜을 안정적으로 감지하고 비디오 후처리에서 트랙을 수동으로 보정 할 수있는 강력한 소프트웨어 패키지가 포함됩니다. 이 프로토콜에서는 웜이 있는 35mm 플레이트의 비디오가 1분 동안 녹화된 다음 소프트웨어 패키지를 사용하여 처리됩니다. 처리 후 트랙의 수동 보정을 통해 추적 오류를 혼동하지 않고 웜 동작이 정확하게 기록되도록 합니다. 회전 수 및 트랙 기간 데이터는 분당 회전을 최종 판독으로 결정하는 데 사용됩니다. 재현성을 보장하기 위해 40-50마리의 동물이 득점된 최소 3개의 독립적인 복제 실험을 통해 데이터를 수집하여 120-150마리의 최종 동물 수를 달성합니다. 이 숫자는 제어 웜에서 수영 행동의 작은 차이를 구별하기에 충분하다. 일부 벌레는 수영 에세이에 의해 캡처 너무 심각한 모터 적자가있다. 예를 들어, 예상 스래싱 반응을 수행하는 대신 액체 중간 컬에 배치된 동물이 이러한 움직임을 정확하게 기록하지 않으며 방사형 운동과 같은 다른 움직임 분석이 이러한 운동 결함을 더 잘 포착할 수 있습니다. 제공된 프로토콜은 시판되는 이미징 시스템(자세한 내용은 재료 표 참조)을 사용하지만 다른 웜 추적 시스템은 유사한 유틸리티를 제공할 수 있으며 일부는 오픈 소스12입니다. 이전에 게시된 메서드는 웜 스래싱13의 수동 점수를 설명합니다. 자동화된 분석은 각 개별 웜에 대해 여러 가지 메트릭을 생성하지만 분당 스래시로 측정되는 신체 굽힘 감지는 실험과 트랙 간에 일관된 결과를 제공하여 기존의 웜 스래시 점수와 잘 어우러져 있습니다.
공개
저자는 공개가 없다고 선언합니다.
감사의 말
우리는 유용한 의견과 제안에 대한 검토자에게 감사드립니다. 우리는 뛰어난 기술 지원을 알린 색스턴, 브랜든 헨더슨, 제이드 계단 에 감사드립니다. 우리는 브라이언 크래머와 레베카 코이 이러한 애사를 개발하는 데 도움을 주셔서 감사합니다. 이 자료는 VA Puget 사운드 헬스케어 시스템의 자원과 시설을 지원하는 작업의 결과입니다. 이 작품은 미국 (미국)의 보조금에 의해 지원되었다 재향 군인 업무부 (VA) 생물 의학 실험실 연구 개발 서비스 [N.F.L.에 공로 검토 보조금 #I01BX004044]
자료
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
참고문헌
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유