Method Article
Évaluation de l’insuffisance motrice dans les modèles C. elegans de la sclérose latérale amyotrophique
Dans cet article
Résumé
Ce protocole décrit deux tests sensibles pour discriminer les déficiences motrices légères, modérées et sévères dans les modèles C. elegans de sclérose latérale amyotrophique, avec une utilité générale pour les souches de C. elegans , avec une motilité altérée.
Résumé
La maladie neurodégénérative de la sclérose latérale amyotrophique (SLA) présente une perte progressive des motoneurones accompagnée d’une faiblesse musculaire et d’une déficience motrice qui s’aggrave avec le temps. Bien que des progrès considérables aient été réalisés dans la détermination des facteurs génétiques de la SLA pour un sous-ensemble de patients, la majorité des cas ont une étiologie inconnue. De plus, les mécanismes sous-jacents au dysfonctionnement et à la dégénérescence des motoneurones ne sont pas bien compris; par conséquent, il est toujours nécessaire d’élaborer et de caractériser des modèles représentatifs pour étudier ces processus. Caenorhabditis elegans peut adapter son mouvement aux contraintes physiques de son environnement, avec deux paradigmes de mouvement primaires étudiés dans un environnement de laboratoire: ramper sur une surface solide et nager dans un liquide. Ceux-ci représentent une interaction complexe entre la sensation, les motoneurones et les muscles. Les modèles de la SLA de C. elegans peuvent présenter une déficience dans l’un ou l’autre de ces paradigmes de mouvement ou dans les deux. Ce protocole décrit deux tests sensibles pour évaluer la motilité chez C. elegans : un test de locomotion radiale optimisé mesurant le crawl sur une surface solide et une méthode automatisée de suivi et d’analyse de la nage dans le liquide (thrashing). En plus de la caractérisation de l’insuffisance motrice de base des modèles de SLA, ces essais peuvent détecter la suppression ou l’amélioration des phénotypes à partir d’interventions génétiques ou de petites molécules. Ainsi, ces méthodes ont une utilité pour étudier les modèles de SLA et toute souche de C. elegans qui présente une motilité altérée.
Introduction
La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative débilitante liée au vieillissement qui a un impact particulier sur les motoneurones. La maladie se caractérise par une perte de motoneurones dans le cerveau et la moelle épinière et une déficience motrice progressive. Il en résulte une incapacité fonctionnelle majeure et un décès prématuré, généralement dans les 3 à 5 ans suivant le diagnostic1. Des mutations dans au moins 38 gènes peuvent causer la SLA; cependant, la plupart des patients atteints de SLA accumulent des inclusions ubiquitinées de la protéine TDP-43 comme pathologie primaire dans les neurones et les cellules gliales2,3,4. Un certain nombre de modèles animaux ont été développés pour étudier les mécanismes sous-jacents causant ou contribuant à la SLA in vivo (examinés en 5). Chez C. elegans, ces modèles incluent des mutations génétiques de perte de fonction chez les homologues des gènes responsables de la SLA ou l’expression transgénique des gènes humains de la SLA. La modélisation de la SLA chez C. elegans présente de nombreux avantages. C. elegans est un animal simple et traitable avec un système nerveux différencié, des paradigmes comportementaux bien caractérisés et une homologie génétique considérable chez l’homme6,7. De nombreux outils existent pour travailler avec C. elegans, y compris des capacités robustes d’édition du génome, des rapporteurs fluorescents in vivo de la neurodégénérescence, des paradigmes de criblage de l’ARNi, une génétique traitable et des tests comportementaux et phénotypiques établis. Les modèles de la SLA de C. elegans récapitulent des aspects de la maladie humaine, y compris l’accumulation de protéines insolubles, la neurodégénérescence et la mort prématurée8,9. En outre, un dysfonctionnement moteur avec perturbation des comportements de rampe et de natation est présent dans de nombreux modèles de SLA de C. elegans.
Ce protocole décrit deux méthodes pour caractériser les phénotypes moteurs de C. elegans : le test de locomotion radiale pour évaluer le crawl sur une surface solide et l’évaluation de la nage dans le liquide (thrashing) à l’aide du suivi et de l’analyse automatisés WormLab. Ces méthodes sensibles pour caractériser les déficits moteurs permettent des comparaisons de gravité et offrent des outils pour mesurer la suppression et l’amélioration des phénotypes moteurs. Le test de locomotion radiale quantifie les différences de motilité rampante (mouvement sinusoïdal sur une surface solide) parmi les populations de vers. Ce test tire parti du comportement d’exploration naturel non stimulé de C. elegans en plaçant les vers à un seul endroit sur une plaque et en marquant leur emplacement final après une période de temps donnée10. Alternativement, nager dans des tests liquides (thrashing) compte les courbures corporelles des vers individuels sur une période de temps définie. Le comptage manuel des courbures du corps par l’œil humain prend beaucoup de temps et présente généralement une variabilité considérable entre les expérimentateurs. L’utilisation du suivi et de l’analyse automatisés assistés par ordinateur peut éliminer une grande partie de cette variabilité. En plus de la caractérisation de l’insuffisance motrice de base des modèles de SLA, les essais de locomotion radiale et de natation peuvent détecter la modulation de phénotypes locomoteurs distincts à partir d’interventions génétiques ou de petites molécules. Ces méthodes sont utiles pour étudier les modèles de SLA et toute souche de C. elegans qui présente une motilité altérée.
Protocole
1. Essai de locomotion radiale
- Préparer des boîtes de Petri de 100 mm ou 150 mm de diamètre à moitié pleines de milieux de croissance de nématodes (NGM) et ensemencées avec une pelouse uniforme de bactéries OP50 pour couvrir toute la surface de la gélose.
- Retournez les plaques d’essai NGM à l’envers et étiquetez le fond avec un identificateur pour les souches de C. elegans à doser, 2 plaques par souche (Figure 1A).
- Faites un petit point avec le marqueur au centre de la plaque à l’envers (Figure 1A).
- Lorsque vous travaillez avec un microscope à dissection, transférez 15 à 20 vers appariés échelonnés11 au centre de la plaque d’essai directement au-dessus du point central (visible à travers le NGM) à l’aide d’un pic à fil de platine (Figure 1B).
REMARQUE: Essayez de transférer tous les vers en même temps ou le plus rapidement possible.- Réglez une minuterie pendant 30 minutes après que les vers sont placés au centre de la plaque. Remettez le couvercle sur la plaque et mettez-le de côté (Figure 1C).
- Continuez à transférer les vers jusqu’à ce que toutes les souches soient sur les plaques d’essai désignées, en notant approximativement combien de temps il faut pour transférer entre les plaques (visez ~ 1 min entre les plaques). Conservez toutes les plaques dans le même ordre qu’elles ont été configurées.
- Après 30 min, commencez à marquer la première assiette.
- Retirez le couvercle et placez la plaque face cachée sous le microscope à dissection, de sorte que l’arrière étiqueté de la plaque soit tourné vers le haut et que la gélose NGM se trouve entre la ligne de visée et les vers. La plaque sera à l’envers par rapport à l’utilisation normale.
- Ajustez la mise au point du microscope jusqu’à ce que les vers soient visibles à travers la gélose.
- À l’aide d’un stylo à pointe de feutre de couleur différente à partir du point central, placez un petit point à l’emplacement de chaque ver - suivez les traces du ver à travers la pelouse bactérienne pour trouver les animaux les plus distaux.
- Vérifiez le bord de la plaque car certains vers peuvent s’y retrouver. Comptez et enregistrez également le nombre de vers dans le point central (Figure 1D).
- Continuez à marquer toutes les plaques d’essai dans l’ordre, de sorte que toutes les plaques aient 30 minutes de temps d’activité, en prenant soin de tenir compte du temps qu’il a fallu pour installer la plaque. Ensuite, effectuez des mesures manuelles ou numériques comme décrit aux étapes 1.8 ou 1.9.
- Effectuez des mesures manuelles à l’aide d’une règle.
- Utilisez une règle pour mesurer en mm la distance entre le point central et les marques d’emplacement finales pour chaque ver et enregistrez la distance. Pour vous aider à suivre les progrès pendant la notation, étiquetez le premier point marqué avec une petite ligne de marquage.
- Enregistrez les données de longueur pour chaque point consécutivement en faisant pivoter la plaque dans le sens des aiguilles d’une montre (Figure 1E).
- Effectuez des mesures numériques à l’aide d’un scanner et d’ImageJ.
- À l’aide d’un scanner à plat, scannez l’arrière de la ou des plaques d’essai à côté d’une règle (nombres faisant face à la surface de balayage) (Figure 2A).
- Ouvrez l’image de la plaque numérisée dans ImageJ ou un programme similaire.
REMARQUE: ImageJ est un logiciel de traitement d’image gratuit basé sur Java hébergé par le NIH. - Cliquez sur l’outil Ligne droite , puis tracez une ligne reliant les points de 1 cm et 2 cm sur l’image numérisée de la règle (Figure 2B).
REMARQUE: Maintenez la touche Maj de l’ordinateur enfoncée pour forcer la ligne à l’angle de 45 ° le plus proche. - Accédez au menu Analyser et utilisez-le pour définir l’échelle (Analyser | Définir l’échelle) (Figure 2C).
- Entrez la distance connue (10) et les unités de longueur (mm) dans les zones appropriées, n’ajustez pas la distance en nombre de pixels. Cochez Global pour appliquer la même échelle à toutes les images analysées dans chaque session ImageJ ; sinon, définissez l’échelle de chaque image à l’ouverture (Figure 2D). Cliquez sur OK.
REMARQUE: Les étapes 1.9.2 à 1.9.5 sont effectuées pour définir l’échelle de mesure. Les mesures de cette image relieront désormais automatiquement la longueur des lignes à la relation pixel:longueur définie. Les images numérisées à 300 dpi auront une relation approximative de 11,8 pixels par mm. - Utilisez l’outil Pinceau pour marquer juste au-dessus du premier point à marquer.
REMARQUE: Il s’agit d’un indicateur visuel pour le premier ver marqué. - Utilisez l’outil Ligne droite pour tracer une ligne entre le point central et le premier point de données du ver.
- Cliquez sur la touche M du clavier pour mesurer la distance. Vous pouvez également accéder au menu Analyser et choisir Mesure (Analyser | Mesure). Dans les deux cas, la mesure apparaîtra dans une nouvelle fenêtre; cette fenêtre collectera toutes les mesures par image.
- En gardant le point central constant, déplacez l’extrémité de la ligne touchant le premier point de ver vers le point de ver suivant, dans le sens des aiguilles d’une montre, puis cliquez sur la touche M pour mesurer.
- Continuez à mesurer chaque point dans le sens des aiguilles d’une montre jusqu’à ce que tous les points soient marqués.
-
Copiez et collez les données de mesure de longueur dans une feuille de calcul pour les enregistrer. Ensuite, répétez le processus pour chaque image de plaque numérisée.
REMARQUE : Les étapes 1.9.6 à 1.9.11 mesurent les valeurs de déplacement du ver (Figure 2E-F).
- Effectuer une analyse statistique.
- Combinez les réplications au sein d’une seule expérience afin qu’un nombre total de vers marqués se situe entre 30 et 40 vers.
- Effectuez des réplications expérimentales indépendantes à différents jours et avec des populations indépendantes de vers pour aboutir à 3 répliques expérimentales indépendantes.
- Analysez les données à l’aide d’analyses statistiques appropriées telles que le test t de Student pour 2 souches ou l’ANOVA à 1 voie pour trois souches ou plus.
2. Essai de natation analysé par ordinateur
REMARQUE : ce protocole contient des instructions détaillées pour le système matériel et logiciel WormLab disponible dans le commerce (voir tableau des matériaux). Cependant, le flux de travail peut être appliqué à d’autres systèmes de dosage de natation analysés par ordinateur.
- Configuration et enregistrement de vidéos.
- Soulevez le blindage sur le matériel d’imagerie (Figure 3) et vérifiez que la hauteur de la caméra est définie à l’emplacement prévu.
REMARQUE: La hauteur optimale pour capturer les vers sur une plaque de 35 mm est telle que le troisième de l’alésage de vis fileté inférieur est visible sous le support de montage réglable de la caméra, mais aucun trou de montage supplémentaire n’est visible au-dessus de l’alésage de la vis (environ 30,5 cm au-dessus de la scène) (Figure 3C). Cela se traduira par un rapport de capture de 11,43 μm/pixel. Envisagez d’ajouter un indicateur de « hauteur correcte » afin que cela soit plus facile à confirmer avant de commencer le test. Voir l’étape de protocole 2.18 pour tenir compte des réglages de hauteur. - Ouvrez le logiciel associé (Figure supplémentaire 1A).
- Cliquez sur l’icône Capture vidéo (film avec un triangle pointant vers la droite au milieu) pour ouvrir une nouvelle fenêtre Capture vidéo . La caméra sera dans la vue en direct, mais l’écran sera noir (Figure supplémentaire 1B).
- Appuyez sur le bouton du gradateur et tournez-le dans le sens des aiguilles d’une montre pour régler la lumière.
REMARQUE: Le bouton de gradation se trouve sur la scène du système d’imagerie près de la source de lumière en champ lumineux. L’écran d’affichage en direct de Video Capture passera du noir à l’illuminé. - De retour dans la fenêtre Capture vidéo , cliquez sur l’onglet Paramètres , ajustez comme suit: Mode vidéo: 2456 x 2052_Mono8, Fréquence d’images: 14, Sortie: monochrome, Exposition: 0.00300 s, Gain: 1 dB , Gamma: 1, Rotation 180 (vérifier).
- Revenez à l’onglet Capture . Sélectionnez le dossier d’enregistrement (Figure supplémentaire 1B).
REMARQUE: C’est là que tous les enregistrements et fichiers de projet seront stockés. Créez des dossiers uniques pour les expériences individuelles afin de garder les données organisées. - Attribuez un nom de fichier en le saisissant dans la zone de texte Préfixe de fichier .
REMARQUE: Le logiciel ajoutera automatiquement un nombre progressif à la fin du préfixe au format « 0001 ». Il est conseillé d’avoir un schéma de dénomination cohérent pour les fichiers tels que: « YYYYMMDD_treatmentName_rep#_ ». - Définissez les autres paramètres de capture comme suit : Tampon : 128 images (par défaut), Durée (à cocher) : 00 h:01min:00 s. Ignorez ou désactivez d’autres paramètres dans cet onglet.
- Placez la plaque de dosage, le couvercle vers le haut, sur la scène de l’appareil et centrez-la dans l’écran capture vidéo ; retirez le couvercle.
REMARQUE: Préparez les plaques d’essai à l’avance. Chaque plaque est constituée d’une boîte de Petri de 35 mm à peu près à moitié pleine de NGM non ensemencé (pas de pelouse bactérienne). - Utilisez une micropipette pour laver les vers synchronisés 11 dans 1 mL de M9 sur la plaque d’essai - visez environ 50 vers (Figure 3D). Faites doucement tourbillonner la plaque pour amener les animaux au centre ou utilisez une micropipette pour ajouter quelques gouttes de M9 pour séparer les animaux (Figure 3E). Réglez une minuterie pendant 60 s pour permettre aux vers de s’acclimater à la natation.
REMARQUE: La plaque ne sera pas visible à 100% à l’écran. Les animaux ne sont pas suivis avec précision lorsqu’ils se chevauchent. - Pendant le compte à rebours, réglez manuellement la mise au point de l’appareil photo en tournant la bague de mise au point sur le corps de l’objectif de l’appareil photo tout en regardant l’écran (Figure 3F). Il est possible de zoomer sur les vers à l’aide d’une souris à molette de défilement permettant une mise au point plus précise.
- Après avoir réglé la mise au point, ajustez le bouton lumineux de manière à ce que l’écran soit aussi lumineux que possible sans surexposition (apparaît sous forme de pixels rouges à l’écran).
- Après 60 s, appuyez sur le bouton Enregistrer .
REMARQUE: La vidéo passera de la vue en direct à l’enregistrement et une minuterie sera visible. Une fois la capture terminée, l’écran Capture vidéo revient à la vue en direct (Figure supplémentaire 1B). - Retirez la plaque après l’enregistrement et configurez la plaque suivante. Renommez le préfixe si nécessaire. Lavez les vers dans la plaque d’essai, incubez pendant 60 s et enregistrez chaque traitement.
- Après avoir terminé tous les enregistrements d’une expérience, fermez tous les onglets vidéo ouverts et éteignez la source lumineuse en appuyant sur le bouton du gradateur.
- Fermez la fenêtre Capture vidéo en cliquant sur le bouton x rouge dans le coin supérieur droit de la fenêtre; Vous pouvez également fermer l’intégralité du progiciel et le rouvrir.
- Préparez des vidéos pour le suivi.
- Dans le menu de la barre latérale Workflow , sélectionnez le premier bouton de ce menu, Importer la séquence d’images, puis recherchez et double-cliquez sur une vidéo. La vidéo s’ouvrira dans la fenêtre du milieu (Figure supplémentaire 2A).
REMARQUE: L’affichage par défaut du logiciel est le menu latéral Workflow ; ce menu est également accessible via le menu déroulant supérieur de la vue sous Affichage [Afficher | Flux de travail]. Le menu Workflow comporte plusieurs options d’affichage ; la vue Piste est appropriée à ce stade du protocole. Si le bouton Définir les informations de séquence n’est pas visible dans le menu, il ne s’agit pas de la vue correcte. Tout d’abord, regardez en bas du menu et vérifiez que l’onglet Workflow est actif, puis vérifiez que la vue Piste est active en cliquant sur l’icône Piste . L’emplacement des menus dans la fenêtre dépend de la taille du moniteur et de l’emplacement des autres menus ouverts. Les menus peuvent être déplacés par glisser-déposer, redimensionnés et fermés. La plupart des menus peuvent également être ouverts via le menu déroulant Affichage . - Dans le menu Workflow, sélectionnez Définir les informations de séquence (Figure supplémentaire 2B). Dans la nouvelle fenêtre de menu, vérifiez le schéma de dénomination, ajoutez des notes et validez les métadonnées.
- Vérifiez que la mise à l’échelle est correctement définie ; Échelle: 11,43 μm / pixel et Measure se remplira automatiquement car 1000 μm est de 87 pixels. Si la hauteur de la caméra a été ajustée différemment de celle prescrite ici, suivez les instructions de ce menu pour mettre à jour l’échelle. Cliquez sur le bouton Enregistrer .
- Dans le menu Workflow, sélectionnez Ajuster l’image, et un nouveau menu contextuel appelé Réglages de l’image s’ouvre (Figure supplémentaire 2C). Sélectionnez Vers sombres sur fond clair (champ lumineux).
- Ajustez des paramètres supplémentaires. Les paramètres de traitement d’image recommandés sont les suivants : Lissage d’arrière-plan : 10, Lissage gaussien : 5, Trous de remplissage : 2, Filtre de petit objet : 0 et ignorer la segmentation dérivée intégrale.
- Ajustez le niveau de seuil de sorte que les animaux soient complètement remplis de vert mais toujours distincts de l’arrière-plan. Cliquez sur Appliquer.
REMARQUE: Il est permis de ramasser certains objets qui ne sont pas des vers. - Dans le menu Workflow , sélectionnez Détecter et suivre (Figure supplémentaire 2D).
REMARQUE: Un menu apparaîtra sur le côté de la vidéo avec 3 onglets: Détection, Suivi et Réparation. Le curseur ressemblera à un doigt pointé au-dessus de l’affichage vidéo. Vous pouvez également cliquer sur l’icône Sélectionner (flèche du curseur) dans le menu des icônes en haut à gauche du logiciel.- Utilisez l’outil de sélection de doigts pour sélectionner 3 à 7 vers et cliquez sur le bouton Détecter les vers dans l’onglet Détection .
REMARQUE: Cette sélection aide le logiciel à identifier avec précision les vers pour des conditions données et doit être effectuée pour chaque vidéo. Après quelques secondes, la plupart des vers seront surlignés en vert et auront un numéro en jaune. Les vers qui se touchent ou qui se recroquevillent ne seront probablement pas mis en évidence; cependant, le programme les trouvera très probablement lors du suivi. Il existe une option pour ajuster les paramètres de détection; cependant, les valeurs par défaut fonctionnent bien dans la plupart des conditions. Si des ajustements sont apportés aux paramètres de détection, assurez-vous d’être cohérent entre les échantillons et les répliques.
- Utilisez l’outil de sélection de doigts pour sélectionner 3 à 7 vers et cliquez sur le bouton Détecter les vers dans l’onglet Détection .
- Toujours dans la fenêtre Détecter et suivre , accédez à l’onglet Suivi (Figure supplémentaire 2E). Dans la case Paramètres de suivi (Tracking Parameters check Use backtracking), décochez la case Track worms (Suivre les vers) sur le bord de l’image.
- Définissez l’hypothèse Max suivie sur 5. Réglez le mode Suivi sur Natation.
REMARQUE: Le paramètre d’hypothèse suivie Max ajuste le nombre de traces de vers potentielles qu’un seul ver à chenilles est autorisé à avoir et donne au programme une certaine marge de manœuvre dans la précision de suivre un seul ver sans perdre la trace de celui-ci. 5 est un bon cadre pour nager. - Accédez à la section Paramètres avancés et définissez les éléments suivants : Les vers Frames peuvent toucher la frontière : 50, Les vers Frames peuvent se chevaucher : 500, Tolérance de position : 0,50, Tolérance de forme : 0,50. Enregistrez ces paramètres et déployez-les pour toutes les vidéos d’une expérience (et au-delà) en les enregistrant en tant que configuration.
REMARQUE: Le filtrage de piste n’est pas recommandé et peut facilement être effectué en post-traitement, laissez-le. - Accédez à Configuration Manager (icône d’engrenage) dans le menu d’icônes en haut à gauche. Lorsque vous cliquez dessus, le menu latéral de Configuration Manager s’ouvre. Ensuite, cliquez sur l’icône Enregistrer (engrenage +), donnez un nom et une description à cette configuration, puis cliquez sur le bouton OK .
- Pour accéder à cette configuration à l’avenir, ouvrez le menu Configuration , sélectionnez la configuration souhaitée et cliquez sur l’icône Charger (flèche d’engrenage vers le haut). Ajoutez ensuite des informations de séquence, affinez éventuellement le niveau de seuil et sélectionnez les vers à détecter. Tous les autres paramètres seront les mêmes.
- Dans le menu Workflow , cliquez sur Enregistrer le projet, vérifiez l’emplacement d’enregistrement et ajoutez un nom de fichier projet (faire correspondre le nom du fichier projet au nom de la vidéo contribue à la continuité). Fermez la vidéo.
Remarque : Ces projets sont enregistrés avec le type de fichier .wpr. - Répétez l’opération pour toutes les vidéos : Importer la séquence d’images (2.18), Charger la configuration enregistrée (2.28.1), ajuster le seuil (2.23), définir les informations de séquence (2.19), détecter les vers (2.24.1), enregistrer le projet (2.29), fermer la vidéo.
- Suivre les vidéos
- Pour suivre les fichiers du projet, accédez au menu Workflow et cliquez sur l’icône Batch (dossier contenant les pages de vers) (Figure supplémentaire 2F).
REMARQUE : Le panneau Traitement par lots s’affiche (Figure supplémentaire 2G). Parfois, il est masqué mais accessible tout en bas du menu Batch Workflow ; la fenêtre devra peut-être être agrandie pour la voir. - Cliquez sur le bouton Ajouter sous la section Sélection de fichier de ce menu Traitement par lots . Naviguez jusqu’à et sélectionnez tous les fichiers de projet (.wpr) à traiter, cliquez sur Ouvrir.
REMARQUE: Le menu Traitement par lots se remplit avec le chemin d’accès au fichier sélectionné, un indicateur d’état et une barre de progression grise pour chaque fichier. - Cliquez sur l’icône Démarrer (bouton de lecture). Notez l’indicateur de progression vert sur le premier fichier. Autorisez le traitement de tous les fichiers. Lorsque tous les fichiers sont lus comme terminés (vert), le logiciel peut être fermé (Figure supplémentaire 2G).
- Si un fichier de projet est bloqué, envisagez d’exécuter le fichier raccroché par lui-même, cela résout généralement le problème. Si cela ne résout pas le problème, ouvrez le fichier projet, supprimez les vers sélectionnés (menu Détecter et suivre ) et resélectionnez à partir d’un nouvel ensemble de formation. Retraitez ensuite le fichier projet.
- Pour suivre les fichiers du projet, accédez au menu Workflow et cliquez sur l’icône Batch (dossier contenant les pages de vers) (Figure supplémentaire 2F).
- Réparation des pistes (recommandé)
REMARQUE: La réparation des pistes peut augmenter la précision des pistes. Les correctifs courants consistent à combiner des pistes qui appartiennent clairement au même ver que celui vu par l’œil humain, à supprimer des pistes qui ne sont pas précises ou qui ne capturent pas de données réelles sur les vers, et à diviser les pistes qui sont mal représentées parce que les vers se touchent (supprimez la mauvaise section et combinez les pistes avant et après la mauvaise section si possible).- Ouvrez le logiciel et ouvrez un fichier projet [Fichier | Open Project] d’intérêt. Cliquez sur Ouvrir et cliquez sur Oui pour utiliser ce fichier. Attendez que le filtre temporel se charge. La vidéo traitée sera à l’écran; les vers seront surlignés en vert et soulignés en jaune. Utilisez le lecteur vidéo pour parcourir ou lire la vidéo.
- Dans le menu Workflow , sélectionnez Détecter et suivre (Figure supplémentaire 2D). Basculez vers l’onglet Réparation . Activez le curseur Sélecteur en cliquant sur l’icône de l’outil Sélecteur (flèche du curseur). Parcourez la vidéo, recherchez et sélectionnez une piste de ver, puis utilisez le menu de réparation pour créer la modification souhaitée.
REMARQUE: Pour résoudre stratégiquement la plupart des problèmes rapidement, zoomez de manière à ce qu’environ 1/6ème de la plaque soit visible, commencez par la zone entourant la piste n ° 1. Parcourez rapidement la vidéo en vérifiant les vers qui apparaissent mystérieusement de nulle part, les pistes où les chiffres changent ou les vers qui se heurtent les uns aux autres, en les éditant au fur et à mesure que les problèmes surviennent. Suivez les vers dans l’ordre numérique à partir de la position de départ. Frottez d’avant en arrière pour suivre chaque ver si nécessaire jusqu’à ce que toute la plaque soit réparée. Portez une attention particulière aux bords de la plaque; souvent, de faux vers apparaissent dans l’ombre des bords des plaques.
- Analyse des données
- Dans le menu Workflow , sélectionnez Analyser les données (Figure supplémentaire 3A).
REMARQUE : Une nouvelle fenêtre nommée Analyse et traçage des données s’affiche (Figure supplémentaire 3B). Cette fenêtre offre de nombreuses façons d’évaluer et d’afficher les données de déplacement de la population de vers d’un fichier de projet spécifique. La plupart de ces analyses permettent de sélectionner des vers spécifiques, multiples ou tous les vers à partir d’une vidéo donnée, ce qui permet de tracer les informations de piste de différentes manières. - Pour analyser le nombre de tours, accédez au résumé de la piste [Position et vitesse | Résumé de la piste] (Figure supplémentaire 3C). Utilisez le bouton Exporter en bas à droite pour exporter des données dans un format lisible par feuille de calcul (.csv), choisissez un chemin d’accès à l’emplacement souhaité de la feuille de calcul, y compris en la renommant en quelque chose de mémorable. Les paramètres par défaut sont un bon choix (Figure supplémentaire 3D).
- Collez ces données, ainsi que tout autre jeu de données de projet pertinent, dans un classeur de feuille de calcul consolidé (figure supplémentaire 3E).
- Utilisez le nombre de virages et la durée de la piste pour calculer les virages par minute pour chaque piste à l’aide des fonctions de tableur (=tours/durée de la piste * 60) ou utilisez une mesure différente selon vos besoins (Figure supplémentaire 3F).
REMARQUE: Les tours par minute capturent des informations très similaires à celles d’un test de battement manuel qui est une mesure largement utilisée de l’activité dans le liquide, mais il existe de nombreuses options, et il est tout à fait possible qu’une mesure différente puisse identifier d’autres données intéressantes pour un traitement ou une comparaison donnée. - Si vous le souhaitez, filtrez la taille du ver, la durée de la piste et/ou d’autres mesures choisies à l’aide d’outils de mise en forme conditionnelle pour mettre en évidence les pistes à supprimer si elles sont potentiellement confondantes. Maintenir un traitement cohérent des données entre les traitements et les réplications.
- Analysez les données à l’aide d’analyses statistiques appropriées telles que le test t de Student pour 2 souches ou l’ANOVA à 1 voie pour 3 souches ou plus. Effectuer des réplications expérimentales indépendantes à différents jours et avec des populations indépendantes de vers pour au moins 3 répliques expérimentales indépendantes.
- Dans le menu Workflow , sélectionnez Analyser les données (Figure supplémentaire 3A).
Résultats
Les tests de locomotion radiale et de natation offrent une détection sensible de la déficience de la motilité (figure 4 et figure 5). Pour étudier les mécanismes sous-jacents au TDP-43 pathologique dans la SLA, des modèles de C. elegans ont été développés qui expriment le TDP-43 humain de type sauvage ou mutant de la SLA de manière pan-neuronale. Ces animaux présentent des caractéristiques moléculaires et cellulaires qui rappellent la SLA, y compris un dysfonctionnement moteur9. Il est important de noter qu’ils présentent une altération modérée de la motilité avec l’expression de TDP-43 humain de type sauvage et une altération plus grave de la motilité chez les animaux exprimant le TDP-43 mutant de la SLA en utilisant à la fois la locomotion radiale et des tests de natation. Certains animaux mutants ou transgéniques auront plus de difficultés à ramper qu’à nager, ou vice versa. En utilisant deux tests de motilité différents, une image plus claire des différences phénotypiques entre les souches est obtenue.
Locomotion radiale
Lorsqu’il est placé sur une assiette d’agar ensemencée, C. elegans explore son environnement, y compris à la recherche des limites de sa source de nourriture. Les tests de locomotion radiale sont un moyen de tirer parti de ce comportement en tant que mesure de la forme physique. En analysant le comportement locomoteur (ramper sur une surface solide) de manière contrôlée et quantifiable, le test locomoteur radial offre un outil simple et efficace pour évaluer la gravité des déficits moteurs et d’autres phénotypes liés au moteur. Les essais de locomotion radiale saisissent les différences de motilité chez les vers modèles de SLA modérément ou gravement altérés et offrent une base de référence pour comparer la modulation des phénotypes de motilité ou les changements de motilité avec l’âge (Figure 6). Cette stratégie peut être appliquée pour quantifier le comportement d’exploration de toute souche qui a modifié le mouvement des vers de type sauvage (N2) ou de contrôle. Cependant, cette méthode peut ne pas être un bon choix pour évaluer les animaux incapables de ramper normalement, tels que les mutants à rouleaux ou les animaux paralysés. En règle générale, les vers de type sauvage présentent un déplacement moyen compris entre 200 et 300 μm/min lorsqu’ils sont soulevés et testés à 20 °C. Les exemples de données présentés à la figure 4 montrent les résultats attendus comparant N2, deux souches transgéniques différentes exprimant le TDP-43 humain de type sauvage avec un phénotype léger [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] ou phénotype plus fort [TDP-43(WT-modéré), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], une souche transgénique exprimant le TDP-43 humain mutant avec un phénotype sévère [TDP-43(M337V), CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), et une souche transgénique exprimant une autre protéine associée à une maladie neurodégénérative, tau humain de type sauvage [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. Les deux souches exprimant le TDP-43 de type sauvage ont des degrés de déficience différents détectés par la locomotion radiale. Le TDP-43 (WT-low) n’est pas significativement différent du N2, tandis que le TDP-43 (WT-high) présente de nettes différences de motilité. Les souches TDP-43 (M337V) et tau (WT) ont des déficiences plus graves de la motilité.
Essai de natation
C. elegans se livre à des mouvements stéréotypés de natation (battement) lorsqu’ils sont immergés dans un liquide. Immédiatement après la submersion, les vers commencent à plier la tête et la queue l’un vers l’autre avec un angle de courbure d’environ 45 °, le sommet de l’angle étant le point médian du ver. Les vers alternent la flexion dans les directions ventrale et dorsale. Un thrash, tel que mesuré par le logiciel, représente le mouvement de passage d’un angle de courbure droit à un angle de courbure du corps de 20° ou plus, quelle que soit la directionnalité (le seuil d’angle peut être ajusté après le post-traitement dans la fenêtre Analyse et traçage [Workflow | Analyser les | de données | de la forme du corps | d’angle de flexion | à mi-parcours Seuil d’amplitude : # degrés]. Le test de natation décrit ici utilise un suivi et une analyse automatisés sur ordinateur pour fournir une notation impartiale de l’activité de natation. On s’attend à ce que les vers de type sauvage (N2) produisent en moyenne entre 150 et 200 battements par minute lorsqu’ils sont élevés et enregistrés à 20 °C. Les exemples de données présentés à la figure 5 montrent les résultats attendus comparant N2, deux souches transgéniques différentes exprimant le TDP-43 humain de type sauvage avec un phénotype léger [TDP-43(WT-mild), CK402 (bkIs402[Psnb-1::TDP-43; Pmyo-3::GFP])] ou phénotype plus fort [TDP-43(WT-modéré), CK410 (bkIs402[Psnb-1::TDP-43; Pmyo-2::GFP])], et une souche transgénique exprimant une autre protéine associée à une maladie neurodégénérative, tau humain de type sauvage [tau(WT), CK144 (bkIs144[Paex-3::tau(4R1N); Pmyo-2::GFP])]. La souche transgénique exprimant le mutant de la SLA TDP-43 [TDP-43(M337V)] ne se jette pas dans le liquide, et elle est donc indiquée sur le graphique comme ND (pas de données). Ce test peut discriminer différents phénotypes que le test de locomotion radiale illustré à la figure 4. Par exemple, dans le test de locomotion radiale (figure 4), le TDP-43 (WT-low) n’était pas significativement différent du N2. Cependant, dans le test de natation (figure 5), le TDP-43 (WT-low) et le TDP-43 (WT-high) sont significativement différents du N2, ainsi que significativement différents l’un de l’autre. De plus, bien que le TDP-43 (M337V) et le tau (WT) aient de graves déficiences rampantes par locomotion radiale (Figure 4), seul le tau(WT) est capable de battre suffisamment pour être suivi par le logiciel (Figure 5). Les animaux TDP-43(M337V) sont incapables de battre, et l’analyse logicielle ne détecte ni ne suit ces vers avec précision. Ainsi, les données sur ces vers n’ont pas été collectées (ND, pas de données).
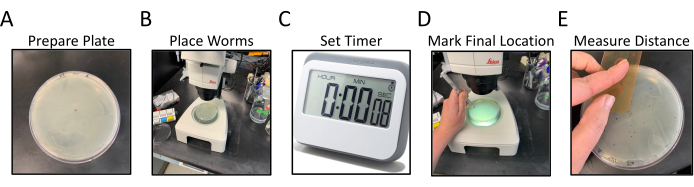
Figure 1 : Flux de travail du test de locomotion radiale. Les panneaux A-E montrent les étapes généralisées du test de locomotion radiale. Les étapes sont les suivantes: (A) Les plaques NGM, avec OP50 ensemencé sur les bords, sont préparées en étiquetant et en marquant le point central, (B) les vers sont placés au centre de la gélose comme marqué par le point central, (C) les vers sont autorisés à se déplacer librement pendant un certain temps, (D) la plaque est retournée de bas en haut et l’emplacement final de chaque ver est marqué dans une couleur différente de celle du point central, (E) La distance entre le point central et chaque emplacement final du ver est mesurée à la main ou numériquement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
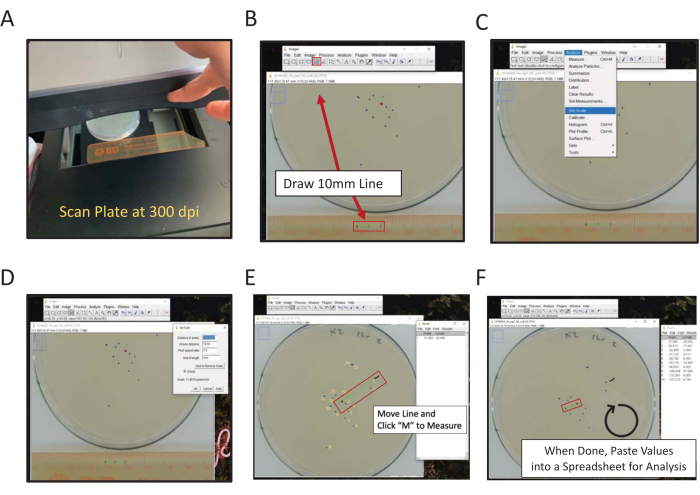
Figure 2 : Mesure numérique de l’emplacement final à l’aide d’ImageJ. Les mesures de distance par rapport au centre peuvent être mesurées à la main ou numériquement, pour mesurer numériquement à l’aide d’ImageJ (A) balayage arrière de la plaque avec une règle dans le cadre. (B) Dessinez une longueur connue à l’aide de l’outil Ligne. (C) Utilisez la longueur connue dessinée en (B) pour définir l’échelle [Analyser | Définir l’échelle...]. (D) Utilisez l’outil Ligne pour tracer une ligne du point central à une marque d’emplacement finale, répétez pour chaque marque. (E) Une ligne de pinceau marquant la première marque mesurée aide à la notation (ligne noire ondulée près de la marque 1). Les repères finaux sont numérotés en jaune pour illustrer la directionnalité de la notation. (F) Les mesures sont enregistrées dans la fenêtre Résultats. Enregistrez les résultats ailleurs pour une analyse statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Réglages des matériaux et du matériel pour l’utilisation du logiciel. (A) Matériaux utilisés pour le test de natation assisté par logiciel. (B) Configuration générale du logiciel et du matériel nécessaire, notez que le boîtier est en position surélevée. (C) La hauteur du support de montage de l’objectif peut être ajustée. Cette image montre la piste réglable et un indicateur de bande marquant la hauteur préférée pour effectuer des tests de natation. Il est nécessaire d’ajuster la lumière du champ lumineux et la mise au point de la caméra avant l’enregistrement. (D) Une plaque d’essai de 35 mm est placée sur la scène, des animaux en M9 sont ajoutés à la plaque et une minuterie de 1 min est démarrée. (E) Il est parfois avantageux de faire tourbillonner doucement la plaque pour rapprocher les vers du centre - observez l’emplacement sur l’écran de capture en direct; Alternativement, quelques gouttes de M9 d’un pipetteur peuvent être utilisées pour séparer les vers. (F) Réglez la bague de mise au point sur l’objectif de l’appareil photo, observez les vers sur l’écran pour déterminer la mise au point optimale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
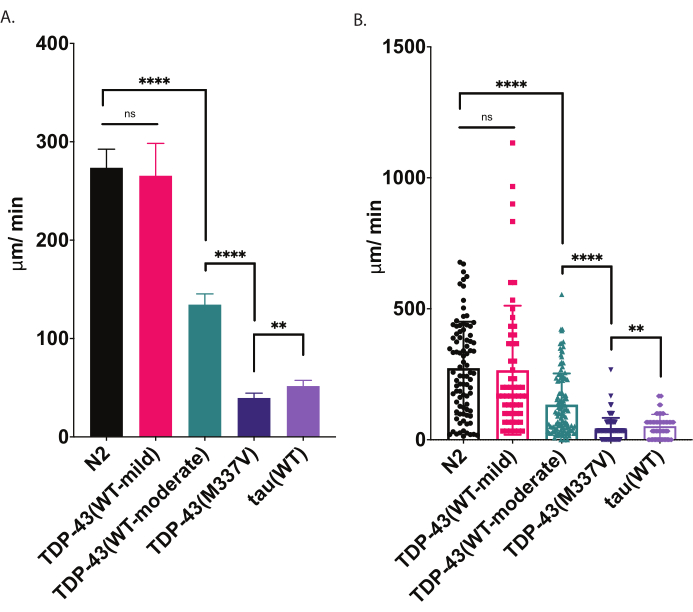
Figure 4 : Les essais de locomotion radiale détectent des différences de vitesse de rampement. La dispersion non stimulée des larves L4 au stade du développement a été mesurée à l’aide du test de locomotion radiale décrit ci-dessus et représentée graphiquement en μm/min parcouru (A-B). Les mêmes données tracées en (A) et (B) démontrent deux présentations graphiques différentes possibles. En (A), les données sont affichées sous forme de graphique à barres, ce qui rend les différences relatives entre les souches plus claires. En (B), le déplacement final de chaque ver est dessiné dans le graphique, ce qui permet de mieux visualiser la variation au sein de la population. Pour évaluer la signification parmi les souches testées, une analyse unidirectionnelle de la variance (ANOVA) avec le test de comparaison multiple de Tukey a été utilisée. **p=0,0022, ****p<0,0001, ns=non significatif. TDP-43 (M337V) et tau (WT) sont également significativement différents de N2, p<0.0001. Les barres d’erreur en (A) sont l’erreur-type de la moyenne (SEM) et en (B) sont l’écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
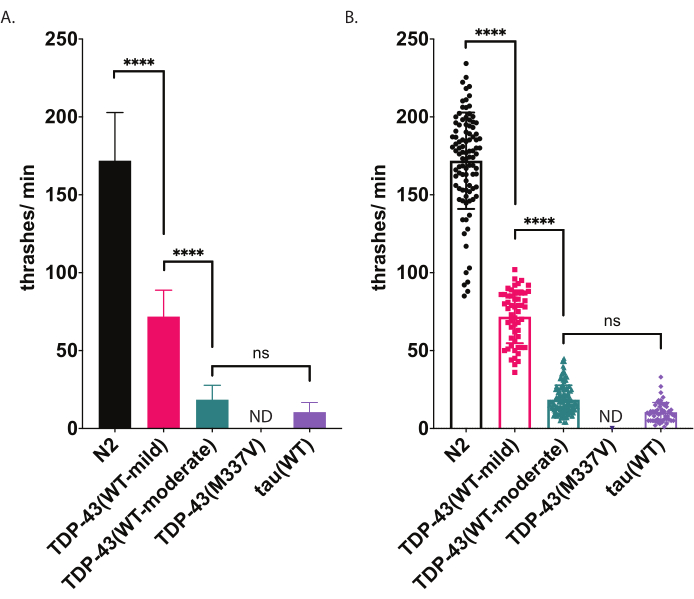
Figure 5 : Les essais de natation détectent des différences de battement dans le liquide. Les taux de nage (fréquence de battement ou d’ondulation dans le liquide) ont été mesurés à l’aide d’une notation et d’une analyse assistées par ordinateur non biaisées décrites ci-dessus et représentées graphiquement sous forme de battements/min (A-B). Mêmes données tracées en (A) et (B). Dans (A), les données sont représentées sous forme de graphique à barres, ce qui rend les différences relatives entre les souches plus faciles à voir. Dans (B), les données de chaque ver individuel noté sont tracées dans le graphique, ce qui permet de mieux visualiser la variation au sein de la population. Pour évaluer la signification parmi les souches testées, une analyse unidirectionnelle de la variance (ANOVA) avec le test de comparaison multiple de Tukey a été utilisée. p<0,0001, ns=non significatif. TDP-43 (WT-modéré) et tau (WT) sont également significativement différents de N2, p<0,0001.Les barres d’erreur dans (A) sont l’erreur type de la moyenne (SEM) et dans (B) sont l’écart type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
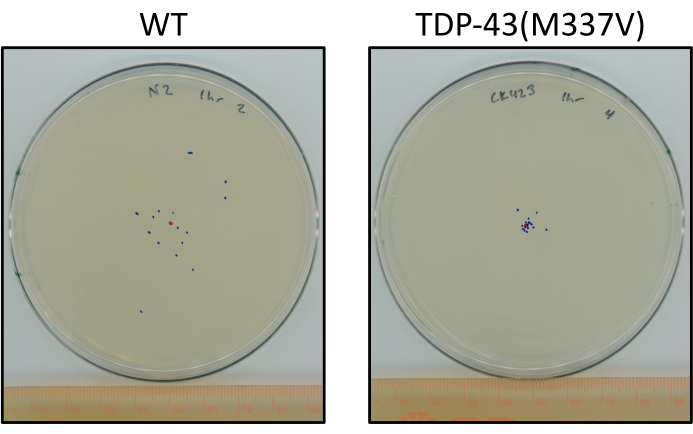
Figure 6 : Les vers TDP-43 mutants voyagent moins que les vers de type sauvage. Plaques montrant une différence représentative dans l’emplacement final de l’étagé L4 N2 (type sauvage) et du TDP-43 (M337V) (CK423 (bkIs423[Psnb-1::TDP-43; Pmyo-2::GFP]), une souche exprimant le TDP-43 humain mutant avec une fonction motrice gravement altérée après 1 heure de rampement non stimulé à température ambiante. Les plaques sont marquées d’un point rouge pour le point central et de points bleus pour l’emplacement final des animaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Enregistrement du comportement de nage à l’aide du logiciel d’imagerie et de suivi. (A) Le flux de travail de suivi et l’emplacement de l’icône de capture vidéo. (B) La fenêtre Capture vidéo s’affiche en mode Live View et les aspects les plus importants sont mis en évidence. Les mots verts « Live view » se transformeront en « Enregistrement » rouge lorsque le bouton d’enregistrement sera activé. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Préparation et suivi du comportement de nage. Cette figure montre une série de captures d’écran pour aider à configurer une séquence d’images vidéo pour le suivi. Le protocole général pour la préparation d’une séquence vidéo consiste à ouvrir chaque menu de flux de travail dans l’ordre suivant : Importer une séquence d’images | Définir les informations de séquence | Ajuster la | de l’image Détecter et suivre | Enregistrer le projet. La fenêtre Analyser les données ne peut être utilisée qu’après le suivi d’un fichier projet. (A) affiche un fichier .avi (vidéo) ouvert après l’importation de la séquence dans le logiciel à partir du flux de travail Track . (B) La fenêtre Définir les informations de séquence fournit un emplacement pour les notes, définir/modifier l’échelle et vérifier les métadonnées d’une séquence vidéo. Les instructions pour changer l’échelle se trouvent dans cette fenêtre et doivent être suivies lorsque la caméra est abaissée ou relevée (B). L’image (C) affiche les paramètres de la fenêtre Ajuster l’image . (D) Capture d’écran montrant l’onglet de détection de la fenêtre Détecter et suivre . La détection des vers est utilisée pour entraîner le logiciel et doit être définie pour chaque séquence vidéo. Des paramètres de détection supplémentaires peuvent être définis ici si vous le souhaitez. (E) Capture d’écran de l’onglet Suivi de la fenêtre Détecter et suivre avec les paramètres recommandés pour suivre le comportement de natation. Il s’agit de la dernière étape de la configuration d’une séquence vidéo. Enregistrez la séquence en tant que projet à l’aide de la fenêtre Enregistrer le projet . Répétez ces étapes pour chaque séquence vidéo. Les paramètres peuvent être enregistrés en tant que configuration pour réduire la charge de travail et garantir que toutes les séquences sont traitées de la même manière (non affichées). Pour suivre les fichiers de projet à des fins d’analyse, accédez au flux de travail par lots . (F) affiche l’icône utilisée pour accéder au flux de travail Batch et (G) affiche la fenêtre de traitement par lots, met en surbrillance les boutons d’ajout et de démarrage et affiche l’apparence attendue d’un fichier projet qui a été suivi. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Analyse du comportement de nage. Une fois qu’un fichier de projet a été suivi, il peut être ouvert à l’aide de [Fichier | Ouvrir le projet]. Les vers apparaîtront en vert comme indiqué dans (A). Le nettoyage de la vidéo offre une vérification rapide que la vidéo traitée comme prévu, la surbrillance verte disparaîtra pendant le nettoyage. La fenêtre Analyse et traçage des données s’ouvre à partir de l’élément de flux de travail Analyser les données . (B) affiche la fenêtre Analyse des données et traçage avec la vue Position ouverte (par défaut), toutes les pistes sont mises en surbrillance. Sous les points de données se trouve un graphique montrant la piste enregistrée pour chaque ver mis en surbrillance. L’analyse sommaire de la piste est utilisée pour calculer les virages par minute. (C-D) afficher le rapport de synthèse de la piste et les détails de l’exportation. (E-F) montrer le résumé de la piste dans une feuille de calcul et comment calculer les tours par minute, la sortie mesurée dans ce test. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Locomotion radiale :
La résolution de ce test est facilement contrôlée en modifiant la variable de temps. L’augmentation de la durée facilite l’observation des différences entre les animaux présentant des phénotypes sévères, identifiant ainsi des différences subtiles. Cependant, comme ce test mesure le déplacement, si le temps de dosage est prolongé trop longtemps, les animaux ayant une motilité normale, tels que N2, se déplaceront jusqu’aux bords de la plaque et le comportement de recherche de nourriture entraînera un retour en arrière. Cela diminuera artificiellement la mesure de la distance parcourue. Des périodes trop longues peuvent entraîner la disparition des différences entre les souches, en particulier entre les animaux ayant des phénotypes moteurs moins sévères, car les animaux se dispersent uniformément dans la plaque. Raccourcir la variable de temps empêchera les vers plus actifs de trouver les bords de la plaque. Cette méthode ne suit pas la distance totale parcourue pour chaque ver, mais comprime la distance parcourue pour chaque ver dans une distance linéaire du centre de la plaque. En tant que tel, il est intrinsèquement moins robuste qu’une méthode qui enregistre la longueur totale de la piste des vers individuels. Cependant, le test de locomotion radiale nécessite très peu de formation de chercheur, utilise des réactifs relativement abordables qui sont couramment disponibles dans la plupart des laboratoires de vers, et est suffisamment sensible pour produire des résultats significatifs et reproductibles. Pour les laboratoires qui préfèrent le suivi vidéo automatisé, plusieurs méthodes ont déjà été établies pour suivre et analyser les mouvements de crawl12, ou les paramètres logiciels utilisés pour le test de natation dans ce document pourraient être modifiés pour permettre la détection et l’analyse du crawl.
Cette expérience est généralement réalisée en répliques indépendantes triples, avec un ensemble de 30 à 40 vers par réplique. Chaque réplique est divisée sur deux plaques différentes de 100 mm ou 150 mm, avec 15 à 20 vers par plaque. L’utilisation de plus de vers que recommandé par plaque peut rendre difficile la notation efficace. Un nombre total de plus de 90 est suffisamment puissant pour établir la signification d’une déficience motrice légère, modérée ou sévère. Être cohérent avec le timing entre les souches notées est essentiel pour la précision et la reproductibilité. 30 minutes sont généralement assez longues pour établir des différences entre les phénotypes modérés à sévères tels que les souches transgéniques exprimant le TDP-43 mutant humain par rapport aux vers de type sauvage (Figure 4). Si la variable de temps est prolongée, il est conseillé d’augmenter également la taille de la plaque de 100 mm à 150 mm. Des facteurs environnementaux tels que la température et l’humidité peuvent affecter ce test, qui est généralement effectué à température ambiante ambiante ambiante, il est donc important de toujours utiliser un contrôle de type sauvage (N2) lors de la comparaison entre les réplicats. De plus, ce test peut mesurer la motilité de certaines souches qui ne présentent pas un comportement de nage normal dans le liquide (battement), ce qui en fait un complément utile au test de natation.
Essai de natation:
L’utilisation du système d’imagerie et d’acquisition pour automatiser le suivi et l’analyse de la nage des vers permet d’obtenir des données rigoureuses et impartiales. Cependant, plusieurs facteurs lors de la configuration initiale de l’expérience doivent être contrôlés entre les échantillons. Ceux-ci comprennent le temps d’acclimatation au liquide avant de commencer l’enregistrement, les conditions ambiantes (c.-à-d. température, humidité) et des paramètres de lumière et d’enregistrement constants. Sur la scène de l’enregistrement, plusieurs caractéristiques aident à réduire la variabilité entre les plaques. Il s’agit notamment d’une caméra intégrée montée sur piste et d’une scène en champ lumineux qui rend l’enregistrement vidéo cohérent entre les plaques, d’un blindage autour de la scène qui empêche les reflets, l’éblouissement et les mouvements d’air pendant l’enregistrement, ainsi que d’un progiciel robuste qui détecte de manière fiable les vers et permet la correction manuelle des pistes en post-traitement vidéo. Dans ce protocole, les vidéos d’une plaque de 35 mm avec des vers sont enregistrées pendant 1 minute, puis traitées à l’aide du progiciel. Après le traitement, la correction manuelle des pistes garantit que les comportements des vers sont enregistrés avec précision sans erreurs de suivi confondantes. Les données de nombre de tours et de durée de piste sont utilisées pour déterminer les virages par minute en tant que lecture finale. Pour assurer la reproductibilité, les données sont collectées sur un minimum de 3 expériences répliquées indépendantes, chacune avec 40 à 50 animaux notés, pour atteindre un nombre final combiné d’animaux 120-150. Ce nombre est suffisant pour distinguer les petites différences de comportement de nage des vers témoins. Certains vers ont des déficits moteurs trop graves pour être capturés par des tests de natation. Par exemple, si les animaux placés dans une boucle de milieu liquide au lieu d’effectuer la réponse de battement attendue, ce test n’enregistrera pas ces mouvements avec précision et un autre test de mouvement, tel que la locomotion radiale, peut mieux capturer ces défauts de motilité. Le protocole fourni utilise un système d’imagerie disponible dans le commerce (voir le tableau des matériaux pour plus de détails), mais d’autres systèmes de suivi des vers peuvent fournir une utilité similaire, certains étant open source12. Les méthodes publiées précédemment décrivent la notation manuelle du thrashing de vers13. Alors que l’analyse automatisée produit un certain nombre de mesures pour chaque ver individuel, la détection des courbures du corps, mesurée en battements par minute, fournit des résultats cohérents entre les expériences et suit bien avec la notation conventionnelle des battements de vers à l’œil.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucune divulgation.
Remerciements
Nous remercions les évaluateurs pour leurs commentaires et suggestions utiles. Nous remercions Aleen Saxton, Brandon Henderson et Jade Stair pour leur assistance technique exceptionnelle. Nous remercions Brian Kraemer et Rebecca Kow pour leur aide dans l’élaboration de ces essais. Ce matériel est le résultat d’un travail soutenu par des ressources et de l’utilisation des installations du système de soins de santé VA Puget Sound. Ce travail a été soutenu par une subvention des États-Unis (U.S.) Service de recherche et de développement de laboratoire biomédical du ministère des Anciens Combattants (VA) [Subvention d’examen du mérite #I01BX004044 à la N.F.L.]
matériels
| Name | Company | Catalog Number | Comments |
| C. elegans | Caenorhabditis Genetics Center (CGC) | - | Aquire your strains as desired, N2 is a useful control strain |
| Disposable pasteur pipets, borosilicate glass | VWR | 14673-010 | Glass pipet used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Disposable petri dishes, 35x10mm | VWR | 10799-192 | Assay plates for WormLab Imaging System |
| Disposable petri dishes, 60x15mm | VWR | 25384-090 | Stock plates for worms |
| Disposable petri dishes, 100x15mm | VWR | 25384-302 | Standard radial locomotion assay plate |
| Disposable petri dishes, 150x15mm | VWR | 25384-326 | Longer time frame radial locomotion assay plate |
| Dissecting microscope | Leica | M80 | Scope for maintaining worms and setting up radial locomotion assays |
| Fine-tipped markers | VWR | 52877-810 | Need at least 2 colors for radial locomotion assays. Fine tips required for accuracy. |
| Flatbed Scanner | Amazon | Epson Perfection V850 | Optional for radial locomotion assay. Protocol assumes a resolution of 300dpi, most scanners would work fine |
| ImageJ | NIH | - | Optional free software provided by the NIH - https://imagej.nih.gov/ij/ |
| M9 buffer | VWR | IC113037012 | Medium used for swimming assay. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| NGM (Nematode Growth Medium) | VWR | 76347-412 | Medium used to cultivate C. elegans. Can be made from scratch, see WormBook: Maintenance of C. elegans |
| OP50 bacteria | Caenorhabditis Genetics Center (CGC) | OP50 | Primary food source for C. elegans |
| p1000 pipettor | VWR | 76207-552 | Pipettor, used in swimming assay |
| p1000 tips | VWR | 83007-384 | Tips for pipettor, used in swimming assay |
| Platinum wire, 0.2032mm diameter | VWR | BT136585-5M | Fine gauge platinum wire used to create worm pick - hold glass pipette in one hand and ~1" of platinum wire (held by pliers) in the other over a flame to join. |
| Ruler | VWR | 56510-001 | Need to score radial locomotion assays |
| WormLab Imaging System | MBF Bioscience | WormLab | The Imaging System includes WormLab hardware (bright field stage, camera, and housing) and WormLab software. https://www.mbfbioscience.com/wormlab-imaging-system |
Références
- Wijesekera, L. C., Leigh, P. N. Amyotrophic lateral sclerosis. Orphanet Journal of Rare Diseases. 4, 3 (2009).
- Arai, T., et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and Biophysical Research Communication. 351 (3), 602-611 (2006).
- Neumann, M., et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 314 (5796), 130-133 (2006).
- Mejzini, R., et al. ALS genetics, mechanisms, and therapeutics: Where are we now. Frontiers in Neuroscience. 13, 1310 (2019).
- Tan, R. H., Ke, Y. D., Ittner, L. M., Halliday, G. M. ALS/FTLD: Experimental models and reality. Acta Neuropathologica. 133 (2), 177-196 (2017).
- Kim, W., Underwood, R. S., Greenwald, I., Shaye, D. D. OrthoList 2: A new comparative genomic analysis of human and Caenorhabditis elegans genes. Genetics. 210 (2), 445-461 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of the Royal Society of London B: Biological Sciences. 314 (1165), 1 (1986).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models and Mechanisms. 13 (10), (2020).
- Liachko, N. F., Guthrie, C. R., Kraemer, B. C. Phosphorylation promotes neurotoxicity in a Caenorhabditis elegans model of TDP-43 proteinopathy. Journal of Neuroscience. 30 (48), 16208-16219 (2010).
- Robatzek, M., Thomas, J. H. Calcium/calmodulin-dependent protein kinase II regulates Caenorhabditis elegans locomotion in concert with a G(o)/G(q) signaling network. Genetics. 156 (3), 1069-1082 (2000).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2013).
- Ringstad, N., Horvitz, B., Koelle, M., Hart, A. C. . WormBook. , 1551 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon