Method Article
使用无细胞系统快速表征遗传部分
摘要
表征良好的遗传部分对于设计新的遗传回路是必要的。在这里,我们描述了一种用于快速表征遗传部分的经济高效、高通量的方法。我们的方法通过结合无细胞裂解物、避免克隆的线性DNA和声学液体处理来提高通量并减少反应体积,从而降低成本和时间。
摘要
表征和编目遗传部分对于设计有用的遗传回路至关重要。具有特征明确的部分可以微调遗传回路,从而使其功能产生可预测的结果。随着合成生物学作为一个领域的发展,在微生物中实施的遗传回路出现了爆炸式增长,以执行与传感、代谢改变和细胞计算相关的功能。在这里,我们展示了一种快速且具有成本效益的方法来表征遗传部分。我们的方法利用内部制备的无细胞裂解物作为培养基,通过报告蛋白的表达来评估部分。模板DNA是使用廉价的引物通过PCR扩增制备的,以将变异部分添加到报告基因中,并将模板作为线性DNA添加到反应中,而无需克隆。可以通过这种方式添加的部分包括启动子、算子、核糖体结合位点、绝缘体和终止子。这种方法与声学液体处理器和 384 孔板相结合,允许用户在一天内对遗传部分进行高通量评估。相比之下,基于细胞的筛选方法需要耗时的克隆,并且由于过夜培养和培养密度归一化步骤,测试时间更长。此外,在无细胞裂解物中工作允许用户通过添加精确浓度的外源性成分和 DNA 来更严格地控制表达条件。从无细胞筛选中获得的结果可以直接用于无细胞系统的应用,或者在某些情况下,作为预测整个细胞功能的一种方式。
引言
合成生物学的核心工作是开发包含特征良好的部分的遗传工具包,可用于构建遗传回路1,当部署在微生物或无细胞裂解物中时,该回路执行有用的功能。这种遗传回路获得牵引力的领域是传感2,3,4,人类表现5,6,生物燃料7,8,材料生产9,10和蜂窝计算11。已经建立了标准化遗传部分的登记处12,将新的和现有的部分分类为诸如启动子,算子,编码序列和终止子等类别,仅举几例。诸如iGEM(国际基因工程机器)竞赛13之类的努力有助于表征和编目这些遗传部分。已经开发了许多方法来促进将这些部分快速组装成有用的遗传回路14,15。甚至已经开发了软件,将表征良好的部件自动组合成电路,以实现所需的功能16。然而,具有可预测功能的有用遗传回路的组装依赖于遗传工具包包含特征良好的遗传部分的假设。由于这些工具包对合成生物学发展的必要性,已经描述了许多努力,以更好地编目电路和零件,并具有适当的表征数据17,18,19,20,21。
表征遗传成分的一种方法是利用无细胞蛋白质合成(CFPS)系统,其重建细胞功能,如转录和体外翻译22。多项研究表明,CFPS在遗传组件原型制作方面具有潜力23,24,25,26,27,28,29,30,31,32 无论是直接应用于无细胞系统还是预测细胞中遗传构建体的功能,例如文库中部分的相对活性 29、代谢途径优化27、细胞负荷30。与这些研究强调的细胞相比,在CFPS中进行原型设计的优势包括避免耗时的克隆,精确控制DNA和其他反应组分的浓度,以及轻松混合和匹配多个DNA构建体的能力。当使用线性DNA模板时,避免克隆的优势尤其明显,这使得新构建体可以通过体外方法组装,需要数小时而不是33天。仅通过移液即可操纵DNA构建体和其他组分的浓度,通过实现由液体处理机器人驱动的高通量实验,该方法更具吸引力34,35。虽然已经报道了使用CFPS进行原型设计的成功,但重要的是要注意,CFPS结果在什么情况下可以可靠地预测细胞的功能还有待观察。
在这里,我们提出了一种CFPS原型设计方法,该方法强调了与传统的基于细胞的方法相比在速度,吞吐量和成本方面的优势。该方法源自我们之前的工作,我们使用CFPS快速表征由转录因子TetR 32调控的T7启动子变体库,显着扩展了当时文献中可用的少数调节T7启动子变体36,37。此后,其他人进一步扩大了此类促进剂的范围38.在我们的方法中,通过使用PCR通过引物扩增模板DNA来加速遗传构建组装,引物将变异遗传部分添加到报告基因中。384孔板中的声学液体处理用于提高通量并减少所需材料体积。以前的工作已经证明,在明显较低的体积39,40 下成功使用了声学液体处理,其可变性与大体积41的手动移液相当。除该方法外,我们还提供故障排除信息,并评估潜在的成本和时间节省。请注意,虽然我们在这里包括基于Sun等人42 的生产无细胞裂解物的方案,但许多其他商业试剂盒和方案43,44 也应该有效。同样,虽然我们演示了表征启动子变体32的方法,但其他部分可以通过PCR扩增互换,例如核糖调节剂,核糖体结合位点(RBS),绝缘体,蛋白质标签和终止子。我们希望这种方法可以帮助合成生物学界继续增加表征部件的数量,以组装具有有用功能的可预测遗传回路。
研究方案
1. 细胞提取物的制备
- 培养基的制备
- 对于 2xYT 培养基:将 16 g 胰蛋白胨、10 g 酵母提取物和 5 g NaCl 加入 900 mL 去离子水中,并用 5 M NaOH 将 pH 值调节至 7.0。使用去离子水将溶液体积提高至1L,并高压灭菌或过滤器灭菌。或者,购买 2xYT 介质。
- 对于S30B缓冲液:在2L去离子水中制备14mM Mg-谷氨酸,60 mM K-谷氨酸和5 mM Tris的溶液。使用2M Tris将pH调节至8.2,高压灭菌,并储存在4°C。 使用前加入二硫苏糖醇(DTT)至终浓度为1mM,以完成溶液。
- 细胞的制备
- 将大肠杆菌BL21(DE3)Rosetta2细胞或其他选择的细胞系(参见Cole等人44最近的综合综述)划到LB(溶原肉汤)琼脂平板上,并在37°C下孵育10-14小时。
- 使用单个 大肠杆菌 菌落在 10 mL 培养管中接种 3 mL 2xYT 培养基。将该管在37°C下以250rpm振荡孵育8小时。
- 使用 3 mL 培养物中的 50 μL 在 500 mL 烧瓶中接种 50 mL 2xYT 培养基。将该烧瓶在37°C下以250rpm振荡孵育8小时。
- 使用来自 50 mL 培养物的 7.5 mL 接种四个装有 0.75 L 2xYT 培养基的 4 L 挡板烧瓶中的每一个。将这些烧瓶在37°C下以220rpm振荡孵育,直到它们在大约3-4小时后达到600nm处的光密度为2至4。
- 通过将它们转移到1L容器中并在4°C下以5,000× g 离心12分钟,从每个烧瓶中收获细胞。 通过将上清液倒入废物容器中来丢弃。
- 用 150 mL 冰冷的 S30B 缓冲液洗涤每个细胞沉淀,使用移液管将其完全重悬以破坏细胞团,然后通过以 5,000 x g 离心 12 分钟再次收集细胞。弃去上清液。
- 在 40 mL 冰冷的 S30B 缓冲液中再次洗涤每个细胞沉淀,方法是完全重悬并使用移液管破坏细胞团。将细胞转移到预先称重的50mL锥形管中,并在4°C下以2,000× g 离心8分钟再次收集细胞。 通过倾析丢弃上清液。
- 称量湿细胞颗粒。通过将试管直接放入液氮中并储存在-80°C来快速冷冻细胞沉淀。
- 细胞裂解
- 在冰上解冻细胞沉淀。
- 通过涡旋将每个细胞沉淀重悬于每 1 g 细胞沉淀的 1.4 mL S30B 缓冲液中。
- 通过法国压力池在640psi的4°C下裂解细胞。 将裂解物收集在冰上的微量离心管中,并在裂解后立即每 1 mL 裂解物加入 3 μL 1 M DTT。
注意:最好用小金属棒敲击法国压榨阀,以保持均匀的压力并避免压力突然下降。 - 通过在4°C下以30,000× g 离心30分钟来清除裂解物,并在将上清液移液到新的冰冷微量离心管后弃去沉淀,注意不要破坏沉淀。
- 将上清液在4°C下以30,000× g 离心30分钟。 将所得上清液移液到冰冷的微量离心管中。丢弃颗粒。
- 将上清液在37°C水浴中孵育1小时。
- 通过在4°C下以15,000× g 离心15分钟来清除上清液,并将所得上清液转移到冰冷的微量离心管中,注意不要破坏沉淀。
- 将上清液在4°C下以15,000× g 第二次离心15分钟,并将所得上清液转移到冰冷的微量离心管中,注意不要破坏任何剩余的沉淀。
- 将 100 μL 等分试样的上清液分配到 1.5 mL 微量离心管中,并通过直接放入液氮中快速冷冻它们。将上清液储存在-80°C。
2. 线性模板制备
- 底漆设计
- 选择核心序列作为PCR模板。至少包括报告序列,例如sfGFP(超级文件夹绿色荧光蛋白),LacZ或菠菜适配体。包括将跨筛选变体固定的其他部件,例如终止器、启动器或 RBS,视设计而定。
注意:在无细胞系统中从线性DNA表达并不总是需要包含终止子。 - 对于正向引物,选择至少20 bp,与核心序列的5'端匹配为引物的3'端。如果将部分添加到构建体的 5' 端,请设计引物 5' 端的其余部分,以通过 PCR 扩增将感兴趣的遗传部分添加到核心序列中(图 1A 和 图 2)。
注意:由于~60 bp以上的引物经常成本急剧增加,因此可以设计多个重叠引物来添加更长的序列或多个部分。虽然在单个PCR反应中可以使用多个引物,但建议进行多轮PCR。 - 对于反向引物,选择至少 20 bp 以匹配核心序列的 3' 端作为引物的 3' 端。如果将部分添加到构建体的 3' 端,请设计引物 5' 端的其余部分,以通过 PCR 扩增将感兴趣的遗传部分添加到核心序列中(图 1A 和 图 2)。确保反向底漆的退火温度在整个正向底漆退火温度的5°C以内。
- 选择核心序列作为PCR模板。至少包括报告序列,例如sfGFP(超级文件夹绿色荧光蛋白),LacZ或菠菜适配体。包括将跨筛选变体固定的其他部件,例如终止器、启动器或 RBS,视设计而定。
- 线性模板放大
- 根据核心序列的数量确定要进行的PCR反应的数量,并使用 表1计算所需的每种组分的量。
- 根据表1制备预混液并将其储存在冰上。将30或40μL预混液(见表1)分装到确定数量的PCR管中,并在5μM下向适当标记的PCR管中加入10μL每种可变引物(即编码部件变化的引物,见表1)。
- 将PCR管放入热循环仪中并运行以下PCR程序:98°C3分钟;30次循环,98°C持续15秒,XX°C持续20秒,72°C为YY分钟;最终在72°C下延伸10分钟。然后,将反应保持在4°C。
其中,XX表示退火温度较低的引物的退火温度,YY表示根据制造商对所用高保真聚合酶的建议为扩增子长度计算的延伸时间。根据需要针对不同的引物和/或模板优化这些条件。 - (可选)加入 1 μL DpnI 限制性内切酶以消化原始模板。将反应在37°C孵育1小时。仅当原始模板是质粒DNA时,才执行此步骤。
- 通过凝胶电泳分析每种PCR产物的5 μL。使用1%琼脂糖凝胶在180V下分离产品20分钟。检查正确的条带尺寸,该尺寸会随着所选的磁芯序列和添加部件的长度而变化。
- 使用商业PCR纯化试剂盒或通过首选的PCR纯化方法纯化线性模板。如果凝胶电泳分析存在多个条带,请根据制造商的建议优化PCR条件或使用商业凝胶提取试剂盒纯化正确的分子量条带。
- 使用分光光度计定量每个DNA模板。通过检查 260 nm/280 nm 比率约为 1.8 来评估 DNA 模板质量。
- (可选)再次使用1%琼脂糖凝胶在180V下分离DNA模板的一部分20分钟,并确保在模板纯化过程中去除任何不需要的条带。
- 立即使用纯化的DNA模板或储存在-20°C。
3. 纯化蛋白质制备
- 蛋白表达
- 对于要表达的每种蛋白质,组装适当的表达构建体。密码子优化基因以在 大肠杆菌中表达。通过首选质粒组装方法将基因插入pET-22b表达载体或其他适当的表达载体中。将表达质粒转化为BL21(DE3)Rosetta2表达细胞或其他合适的细胞系。
- 对于每种蛋白质,使用单个菌落在 10 mL 培养管中接种 3 mL LB 培养基。将这些管在37°C下以250rpm振荡孵育过夜。
- 用 1 mL 过夜培养物接种含有 750 mL LB 培养基的 2 L 烧瓶。将这些烧瓶在37°C下以250rpm振荡孵育,直到它们达到0.6-1.0的OD600 。
- 通过向每个烧瓶中加入0.75mL的1M异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)的水来诱导蛋白质表达,并继续在37°C下以250rpm振荡孵育这些烧瓶4小时。
- 使用1L离心瓶从每个烧瓶中收获细胞,以5,000× g 离心12分钟。弃去上清液。
- 将沉淀转移到 50 mL 锥形管中并称量每个颗粒。将细胞在液氮中快速冷冻并储存在-80°C或继续步骤3.2。
注意:此步骤预计每 0.75 mL 会产生 2-5 g 细胞。
- 镍亲和柱色谱纯化蛋白质
- 通过组合 50 mM Tris-Cl、500 mM NaCl 和 5 mM 咪唑制备裂解缓冲液。调节至 pH 8.0。
- 通过混合50 mM Tris-Cl,500 mM NaCl和25 mM咪唑来制备洗涤缓冲液。调节至 pH 8.0。
- 通过组合 50 mM Tris-Cl、500 mM NaCl 和 250 mM 咪唑制备洗脱缓冲液。调节至 pH 8.0。
- 通过结合 50 mM NaHPO4、100 mM NaCl 和 2% DMSO 制备透析缓冲液。调节至 pH 7.5。
- 通过将试管放入室温水中来解冻细胞沉淀。每 1 g 细胞沉淀加入 5 mL 裂解缓冲液,并通过涡旋重悬。
- 通过超声处理裂解细胞。分离细胞匀浆,使每 50 mL 锥形管不超过 30 mL,并将每个管保持在冰上。使用超声仪和直径为 0.16 cm 的探头裂解细胞,分 15 秒,中断 30 秒,10 次。
注意:避免起泡,因为这会使蛋白质变性。通过在超声仪尖端运行时至少 2/3 浸没在裂解物中,可以避免泡沫的形成。除超声处理外,还可以使用其他细胞裂解方法44。 - 通过在4°C下以15,000× g 离心30分钟来清除裂解物,并将上清液放入新的50mL锥形管中。
- 每 5 mL 上清液加入 1 mL 镍-次氮基三乙酸 (Ni-NTA) 树脂。将细胞裂解物/Ni-NTA 浆液分开,使每 50 mL 锥形管不超过 36 mL。在4°C下以10rpm在管旋转器上孵育1小时。
- 通过将细胞裂解物/Ni-NTA 浆液倒入 2 mL 床体积色谱柱中来加载树脂,如果需要进一步分析,请收集洗脱液,否则丢弃。用10个树脂床体积的洗涤缓冲液洗涤树脂。
- 通过向色谱柱中加入三个树脂床体积的洗脱缓冲液来收集蛋白质,并使用离心浓缩器将体积浓缩至1.5 mL,每种蛋白质具有适当的分子量截止膜。
- 在4°C下将蛋白质透析到2L透析缓冲液上1小时。在4°C下再次将蛋白质与2L透析缓冲液透析过夜。
- 使用蛋白质的摩尔消光系数和280nm处的吸光度来量化蛋白质。通过使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质来分析蛋白质的纯度。将蛋白质储存在-80°C。
4. 无细胞蛋白质合成
- CFPS反应混合物的制备
- 按照Sun等人42中的氨基酸溶液制备,能量溶液制备和缓冲液制备步骤制备补充剂混合物。单独储存或在-80°C下以等分试样混合储存。确保最终浓度与Sun等人42 在TX-TL反应的实验执行部分中描述的浓度相匹配。
- 制备添加剂以保护线性DNA不被降解。如果使用 GamS33,45,请通过上述第 3 节中的步骤进行准备,或从商业供应商处获取;对于其他方法,请查看相应的文献46,47,48。或者,使用不需要添加剂的CFPS系统49。
- 使用上述第 3 节中的步骤制备 T7 聚合酶、阻遏蛋白和其他添加剂,或从商业供应商处获取。
- 确定要执行的CFPS反应的数量,并使用 表2计算所需的每种组分的量。修改组分的浓度,包括根据需要添加或去除组分,并调整水量,使每种反应混合物的最终体积始终为 10 μL。同样,根据需要修改预混液,以便通过声学液体处理来分配其他组分(请参阅 "讨论 "部分)。
- 在冰上解冻所有组分,并通过混合上述计算的每种组分来制备预混液。用移液器彻底混合所有成分。注意避免沉淀,特别是氨基酸混合物。将预混液放在冰上。
- 在冰上冷却 384 孔板,并将预混液以 9 μL 等分试样分配到每个孔中。
注意:可以通过声学液体处理来分配这些组件,但应注意确保正确分配(有关故障排除,请参阅 讨论 部分)。
- 通过声学液体处理分配其他成分
- 计算所有CFPS反应所需的阻遏蛋白(和其他可选成分)的量。
- 在冰上解冻阻遏蛋白,并将其分配到声学液体处理源板或其他适当的板中。确保包括所用源板类型所需的适当死体积。
- 通过液体处理器将 1 μL 体积的阻遏蛋白分配到适当的孔中。有关分发故障排除的详细信息,请参阅 讨论 部分。
- 标准曲线
- 在平板上包括纯化报告基因的连续稀释液(参见蛋白质纯化第3节)41 或适当的化学标准品50,以便将结果与其他研究和其他实验室进行比较。选择适合所用报告基因的浓度范围和实验的预期表达范围。
- 运行 CFPS 反应
- 将酶标仪预热至30°C。 将酶标仪设置为以适合核心序列中使用的报告器的设置读取,而无需摇晃步骤。
注意:虽然这里使用30°C,但29°C和37°C也是常用的,并且适用于此协议。其他温度可能是替代无细胞反应制剂的首选。对于读取间隔,10 分钟足以为此处提供的代表性数据实现良好的分辨率;然而,其他分辨率可能更好,具体取决于报告蛋白和特定的CFPS配方。 - (可选)首先运行测试反应以设置适当的增益或灵敏度设置,以捕获荧光变化而不会溢出信号。
- 用不透水的塑料密封盖密封 384 孔板以防止蒸发。如果可能,在仪器上设置1°C垂直温度梯度以限制密封件上的冷凝。将 384 孔板放在板架上并开始读取。
- 将酶标仪预热至30°C。 将酶标仪设置为以适合核心序列中使用的报告器的设置读取,而无需摇晃步骤。
结果
为了证明我们方法的实用性,我们展示了描述 tetO 序列与T7启动子的接近对T7 RNAP驱动表达调节的影响的结果。完整的结果及其含义可以在McManus等人的工作中找到32。 工作流如图 1 所示。通过PCR扩增sfGFP报告基因制备了15个线性模板,仅在T7启动子相对于 tetO 序列的距离上有所不同,引物旨在添加每个启动子变体(图2),如协议第2节所述。按照方案制备CFPS反应组分和反应物。使用声学液体处理器从每个模板滴定12种不同浓度的TetR蛋白,一式三份测量sfGFP的表达。在每个模板和15个模板36个CFPS反应下,对整组T7-tetO 组合总共进行了540次反应。整个评估是在两个读板器中的两个板上进行的。对该数据的分析表明,T7 RNAP 从 T7 转录本开始向下调 T7 驱动的表达,向下均匀地向下调 13 bp(图 3)。这一结果通过描述其他阻遏因子有效抑制T7的推定窗口,对可调控T7驱动基因电路的未来设计具有重要意义。将此处描述的方案结果与传统克隆制备的DNA进行比较,发现格式之间的TetR抑制程度存在很小但统计学上的显着差异。我们假设TetR与载体DNA的非特异性结合可以解释观察到的差异。实验结果表明,将线性载体DNA添加到与线性模板DNA的反应中可将差异降低到非统计学意义,尽管它不排除其他因素的贡献,例如线性与圆形格式的DNA螺旋周期性差异,这反过来可能会影响TetR结合。根据应用的不同,线性模板的使用可能需要额外的验证。
我们进一步包括有关使用声学液体处理进行精确分配的潜在问题的代表性数据(图4)。使用含有 0.25 mM 柠檬黄染料的 pH 7.4 的 1x 磷酸盐缓冲盐水 (PBS) 溶液来评估对声学液体处理器进行编程以分配体积 >1 μL 的两种方法。液体分配后,将目标板密封并以1,500×g离心1分钟,并用读板器测量425nm处的吸光度。显示了九个实验的代表性结果,并表明当将5 μL转印分成单独的1 μL分液时,在八个目标孔系列中的分液更加一致。基于这些观察结果,建议将>1 μL的转印分解为≤1 μL的多次转印。有关对协议的这一重要方面进行故障排除的更多详细信息,请参阅 讨论 部分。
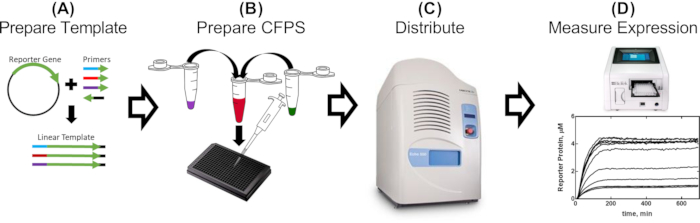
图 1:用于评估无细胞提取物中启动子部分的单日工作流程。 (A)使用含有待评估遗传部分的引物对报告基因进行PCR扩增(2-5小时)。(B)按照协议中详细说明制备无细胞反应混合物,并用PCR扩增的模板(30分钟)分配到384孔板中。(C)声学液体处理用于分配其他成分,其中可以包括阻遏蛋白,效应分子和任何其他条件效应物(10分钟)。(D)在读板器中测量每个反应的报告蛋白表达(2-16小时,取决于CFPS配方和构建体)。 请点击此处查看此图的大图。
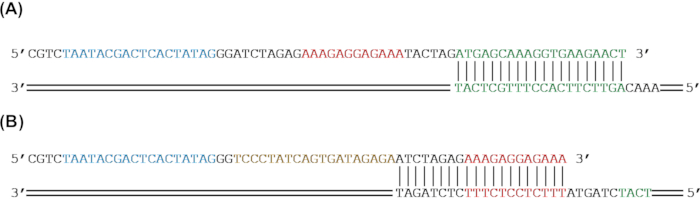
图 2:通过 PCR 扩增将遗传部分添加到报告基因的引物设计。 (A)sfGFP报告基因(绿色)将被扩增,通过PCR添加RBS(红色)和T7启动子(蓝色)。(B)sfGFP(绿色)和RBS(红色)将被扩增,以通过PCR添加tetO序列(金)和T7启动子(蓝色)。请点击此处查看此图的大图。
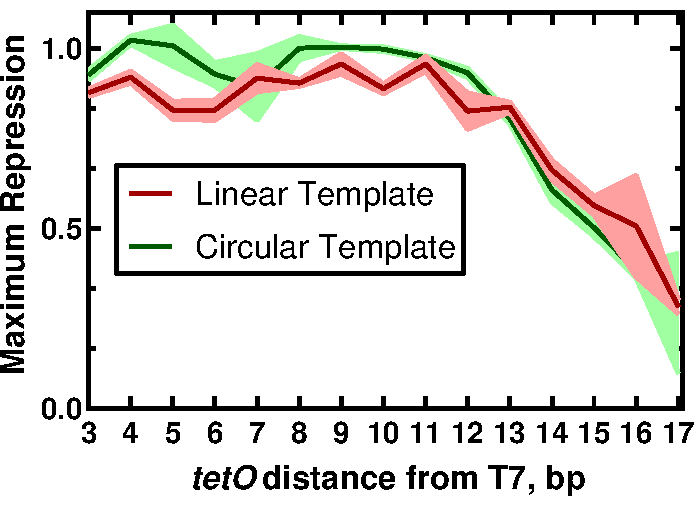
图 3: tetO 位置对 T7 驱动表达调节的影响。 线性和圆形模板的最大抑制值归一化为 tetO 位置的函数。迹线表示三个重复的平均值和标准偏差。该图是根据知识共享CC-BY许可从McManus等人32 修改而来的。 请点击此处查看此图的大图。
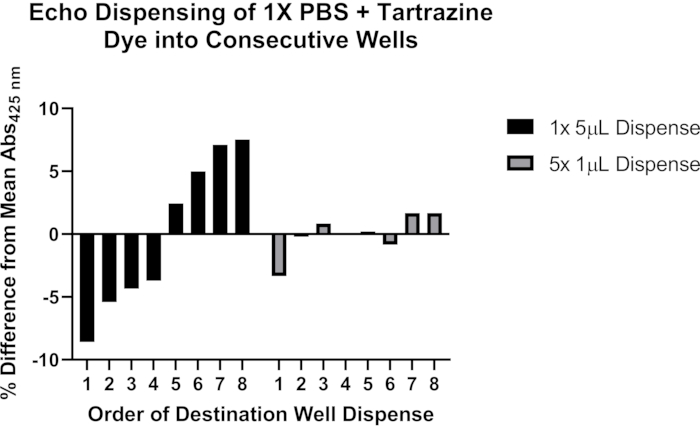
图 4:使用柠檬黄染料验证声学液体处理器的液体分配。 黑条表示使用单个编程命令将 5 μL 柠檬黄溶液从单个来源孔分配到 384 孔板的八个连续目标孔中的每一个中。灰色条表示使用单个编程命令将 1 μL 从单个源孔中分配到八个连续目标孔中的每一个孔中,然后重复此步骤四次,在每个目标孔中总共分配 5 μL。 请点击此处查看此图的大图。
| 组件名称 | 1 次反应的体积 (μL) | 体积为 X 次反应的 110% (μL) |
| Q5 PCR预混料 | 25 | |
| 水 | 4 | |
| 模板 (1–3 纳克/μL) | 1 | |
| (如果固定1)正向底漆 (5 μM) | 0 或 10 | |
| (如果固定1)反向底漆 (5 μM) | 0 或 10 | |
| 预混液总计: | 30 或 40 | |
| (如果变速为 1)正向底漆 (5 μM) | 0 或 10 | |
| (如果变速为 1)反向底漆 (5 μM) | 0 或 10 |
表1:PCR反应试剂制备工作表。 用户可以根据预期的反应次数填写最右边列中的值。 1可变引物包含要添加到PCR反应中的特定部分,可以是正向引物,反向引物或两者兼而有之。固定引物不添加部分,可以是正向引物或反向引物,但不能两者兼而有之。
| 组件名称 | 1 次反应的体积 (μL) | 体积为 X 次反应的 110% (μL) |
| 细胞提取物 | 4.2 | |
| 补充组合 | 3.3 | |
| GamS 蛋白 (207 μM) | 0.15 | |
| 模板 DNA (20 nM) | 1 | |
| T7 聚合酶 (13 毫克/毫升) | 0.12 | |
| 水 | 0.73(此数字可能会有所不同) | |
| 预混液总计: | 9 | |
| 阻遏蛋白: | 1 |
表2:用于制备CFPS反应试剂的工作表。 用户可以根据预期的反应次数填写最右边列中的值。
补充表。请按此下载此表格。
讨论
这里描述的方案提供了一种经济高效且快速的方法,通过CFPS表达报告蛋白来筛选遗传部分。表征良好的遗传部分对于设计具有有用功能的可预测遗传回路至关重要。这种方法通过消除在活细胞中工作的要求来提高通量并减少筛选新遗传部分所需的时间,同时通过保留细胞裂解物中蛋白质表达的代谢过程来保留反映细胞环境的功能。我们的方案可以在收到引物后1天内进行(~2.5-6小时用于反应制备,2-16小时用于CFPS反应; 图1),而传统克隆至少需要3天(构建体组装和转化、克隆序列验证和细胞培养评估各1天)。我们进一步估计,使用线性DNA的每个构建体的成本大约是传统克隆的三分之一(78美元对237美元; 补充表1)方法。商业合成服务目前报价至少需要4个工作日,具体取决于规模,但如果直接在CFPS中筛选线性片段,它们的成本与我们的方法相似(78美元对91美元);我们尚未验证这种方法。与模板DNA的生成相比,使用CFPS评估部分的成本很小(0.05美元/反应22 美元,每个模板78美元),但应该注意的是,散装试剂和裂解设备的启动成本至少为数千美元。使用声学液体处理器仅略微降低了成本,可实现低至 0.5 μL40 的更小体积;更显着的优点是减少了制备反应的时间(~10分钟与长达1小时,取决于反应的数量),特别是在制备大量反应时会引起制备的反应在孵育前长时间放置的担忧。
虽然快速且具有成本效益,但CFPS原型何时充分预测 体内 功能的局限性仍有待观察。例如,由于在CFPS系统生产过程中去除宿主基因组,因此不会检测到与基因组DNA的任何交叉反应。此外,CFPS中的组分浓度可能比细胞51低1-2个数量级,由于不同的大分子拥挤条件,这可能会影响某些部件的行为。此外,线性DNA预测 体内 功能的能力可能受到限制,例如当DNA二级结构起重要作用时。最后一个限制是,在测试函数之前,构造不会经过序列验证。在某些情况下,所表征的零件实际上与预期的理论顺序不一致。所有这些限制都可以通过在预期的 体内 应用中验证通过该方法筛选的部件的子集来缓解。
我们最初开发这种方法是为了研究改变操作员位置对杂交T7-tetO 启动子的影响32。我们在这里以更通用的格式介绍了协议,以便它们可以应用于启动子、算子、核糖体结合序列、绝缘体和终止子。这些遗传部分可以通过PCR添加到报告基因的5'或3'末端,使用每种设计的引物,从而消除了合成或克隆每个变体进行测试的需要。所得PCR产物用作模板DNA,用于通过报告蛋白的表达进行评估。在我们的工作中,这里提供的亲和纯化方案用于TetR和GamS。相同的程序可用于表达和纯化其他阻遏因子、激活剂、聚合酶、西格玛因子以及与感兴趣的遗传部分同源的其他蛋白质,尽管可能需要对所表达的所需蛋白质进行修饰。将这些蛋白质纯化和滴定为CFPS反应,可以更详细地表征特定的遗传部分。最后,存在许多替代的CFPS协议,每个协议都应该适用于方法的零件筛选部分。例如,我们在此协议中不包括透析步骤,其他人发现透析步骤对于天然细菌启动子22的表达很重要。改变CFPS潜在成分的浓度也是可能的。液体处理的使用通过增加吞吐量和减少所需材料来增强测试各种条件的能力34,35.
可能需要进行大量故障排除的一个领域是声学液体处理器的优化。声学液体处理器分配应针对要转移的每个组分进行优化,强烈建议在收集数据之前运行控制以验证适当的分布和可重复性。理想的源板类型和液体类别设置将取决于要分配的特定液体及其成分。不建议使用胺包被的板来分配DNA,因为胺包衣可能与DNA相互作用。还应该注意的是,分配更高浓度的某些组分的能力可能取决于声学液体处理器模型。可以通过将测试液体转移到箔板密封上来进行,以可视化成功的液滴形成;但是,该测试提供的信息有限,来自不同设置的液滴可能看起来相同。使用水溶性染料(如柠檬黄)可用于更准确地验证在给定设置或工作流程下分配的正确体积(参见 代表性结果)。液体转移的最佳编程也会影响所生成数据的准确性和一致性;对于从一个来源孔到一个目标孔的>1 μL转移,我们发现应编程≤1 μL的顺序转移,以减少系统孔间变异性(图4)。最后,理论和实际源井死体积可能会有很大差异,具体取决于源板类型、液体类别设置和特定液体的成分;在运行程序之前,使用声学液体处理器测量功能评估孔体积可能有助于衡量仪器测量特定液体的准确度。
当比较不同用户、材料批次、读板器和实验室之间的结果时,CFPS 反应性能可能会有所不同41.对于在原型设计遗传回路时需要进行此类比较的情况,我们建议在每个反应板中包括具有标准组成型启动子的内部对照反应,以帮助标准化实验设置的结果。DNA制备方法也可以主要促进CFPS活性;建议包括乙醇沉淀步骤。此外,最佳反应组合物可以随提取物34的批次而变化。特别是最佳谷氨酸镁和谷氨酸钾浓度已被证明随批次42 或使用的启动子或报告蛋白24而变化。应通过筛选每个遗传构建体和每种细胞提取物制备的每种组分的几种浓度来优化这些组分的浓度,以确定蛋白质表达的最佳条件。最后,一致的CFPS反应性能的最佳实践包括彻底混合、仔细移液以及每种试剂组分制备的一致性。
除了表征单个零件之外,还可以使用相同的方法筛选形成复杂电路的零件组合,例如逻辑电路16或振荡器52,53。该方法还可用于筛选和优化生物传感器,以应用于流行病学诊断54,55,56,57或危害检测和定量3,58,59。人工智能驱动技术(如主动学习34)的应用也可以与该方法的高通量性质相结合,以推动对复杂生物设计空间的快速探索。最终,我们设想这种方法支持合成生物学中新基因设计的加速开发时间。
披露声明
RMM拥有Tierra Biosciences的财务股份,Tierra Biosciences是一家利用无细胞技术(如本文中描述的技术)进行蛋白质表达和筛选的私人公司。
其他作者没有什么可透露的。
致谢
这项工作是由国防部长办公室的科学技术促进应用研究优先事项计划实现的。我们感谢Scott Walper(海军研究实验室)提供所使用的sfGFP库存,并感谢Zachary Sun和Abel Chiao(Tierra Biosciences)就无细胞系统的原型设计和声学液体处理的相关故障排除进行了富有成效的讨论。
材料
| Name | Company | Catalog Number | Comments |
| 2x YT medium | Sigma-Aldrich | Y2377-250G | Alternative to making 2xYT media |
| Agar | Bacto | 214010 | For plating cells |
| Chromatography column (5 cm diameter) | BIO-RAD | 731-1550 | Used for protein purification. |
| Destination plate | Thermo Scientific Nunc plate | 142761 | For CFPS reactions |
| DMSO | Sigma-Aldrich | D2650 | For dialysis buffer |
| DpnI | NEB | R0176L | For digestion of plasmid templates |
| DTT | Roche | 20871723 | S30 Buffer B |
| E. coli BL21(DE3) Rosetta2 | Novagen | 70954 | Cell line used for production of lysate and purified proteins |
| Echo acoustic liquid handler | Labcyte | 525 | Acoustic liquid handler |
| French pressure cell | Thermo Spectronic | FA-078 | For lysing cells for CFPS |
| Imidazole | Sigma-Aldrich | 56750 | For buffers |
| Impermeable plastic sealable lid | Thermo | 232702 | Plate seal |
| IPTG | RPI | I56000-25.0 | Used for protein induction. |
| K-Glu | Sigma-Aldrich | g1501-500G | S30 Buffer B |
| Labcyte Echo source plate | Labcyte | PL-05525 | For use with Echo acoustic liquid handler |
| Mg-Glu | Sigma-Aldrich | 49605-250G | S30 Buffer B |
| NaCl | Sigma-Aldrich | S7653-250G | For buffers |
| NaHPO4 | Sigma-Aldrich | 71505 | For dialysis buffer |
| NaOH | Mallinckrodt Chemicals | 7708-10 | For making 2xYT media. Currently not produced by Mallinckrodt. Alternate: Sigma-Aldrich S0899 |
| Ni-NTA resin | Invitrogen | R901-15 | For production of purified proteins |
| PCR H2O | Ambion | AM9937 | PCR of linear templates |
| Plate Reader | BioTek | H10 | Plate reader used |
| Q5 PCR Master Mix | NEB | M0494S | PCR of linear templates |
| QIAquick Gel Extraction Kit | Qiagen | 28606 | PCR of linear templates |
| QIAquick PCR Purification Kit | Qiagen | 28004 | PCR of linear templates |
| QSonica Ultrasonic Processor | Qsonica | Q700 | Cell disruption during protein purification |
| RTS Amino Acid Sampler | biotechrabbit | BR1401801 | Updated supplier from Sun et al. |
| Tris | MP | 819623 | S30 Buffer B |
| Tris-Cl | Sigma-Aldrich | T5941 | For buffers |
| Tryptone | Fluka | T7293 | For making 2xYT media |
| Yeast Extract | Bacto | 212750 | For making 2xYT media |
参考文献
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nature Reviews. Molecular Cell Biology. 10 (6), 410-422 (2009).
- Saltepe, B., Kehribar, E. &. #. 3. 5. 0. ;., Su Yirmibeşoǧlu, S. S., Şafak Şeker, U. &. #. 2. 1. 4. ;. Cellular biosensors with engineered genetic circuits. ACS Sensors. 3 (1), 13-26 (2018).
- Bereza-Malcolm, L. T., Mann, G., Franks, A. E. Environmental sensing of heavy metals through whole cell microbial biosensors: A synthetic biology approach. ACS Synthetic Biology. 4 (5), 535-546 (2015).
- Mimee, M., et al. An ingestible bacterial-electronic system to monitor gastrointestinal health. Science. 360 (6391), 915-918 (2018).
- Isabella, V. M., et al. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nature Biotechnology. 36 (9), 857-867 (2018).
- Healy, C. P., Deans, T. L. Genetic circuits to engineer tissues with alternative functions. Journal of Biological Engineering. 13, 39 (2019).
- Kaushik, A., Tiwari, S., Dev Jayant, R., Marty, A., Nair, M. Towards detection and diagnosis of Ebola virus disease at point-of-care. Biosensors and Bioelectronics. 75, 254-272 (2016).
- Jagadevan, S., et al. Recent developments in synthetic biology and metabolic engineering in microalgae towards biofuel production. Biotechnology for Biofuels. 11, 185 (2018).
- Keating, K. W., Young, E. M. Synthetic biology for bio-derived structural materials. Current Opinion in Chemical Engineering. 24, 107-114 (2019).
- Smanski, M. J., et al. Synthetic biology to access and expand nature's chemical diversity. Nature Reviews Microbiology. 14 (3), 135-149 (2016).
- Xiang, Y., Dalchau, N., Wang, B. Scaling up genetic circuit design for cellular computing: advances and prospects. Natural Computing. 17 (4), 833-853 (2018).
- Galdzicki, M., Rodriguez, C., Chandran, D., Sauro, H. M., Gennari, J. H. Standard biological parts knowledgebase. PLoS One. 6 (2), 17005 (2011).
- Kelwick, R., Bowater, L., Yeoman, K. H., Bowater, R. P. Promoting microbiology education through the iGEM synthetic biology competition. FEMS Microbiology Letters. 362 (16), (2015).
- Torella, J. P., et al. Unique nucleotide sequence-guided assembly of repetitive DNA parts for synthetic biology applications. Nature Protocols. 9 (9), 2075-2089 (2014).
- Halleran, A. D., Swaminathan, A., Murray, R. M. Single day construction of multigene circuits with 3G assembly. ACS Synthetic Biology. 7 (5), 1477-1480 (2018).
- Nielsen, A. K., et al. Genetic circuit design automation. Science. 352 (6281), (2016).
- Canton, B., Labno, A., Endy, D. Refinement and standardization of synthetic biological parts and devices. Nature Biotechnology. 26 (7), 787-793 (2008).
- Boehm, C. R., Bock, R. Recent advances and current challenges in synthetic biology of the plastid genetic system and metabolism. Plant Physiology. 179 (3), 794-802 (2019).
- Takahashi, M. K., et al. Characterizing and prototyping genetic networks with cell-free transcription-translation reactions. Methods. 86, 60-72 (2015).
- Chappell, J., Watters, K. E., Takahashi, M. K., Lucks, J. B. A renaissance in RNA synthetic biology: New mechanisms, applications and tools for the future. Current Opinion in Chemical Biology. 28, 47-56 (2015).
- Endy, D. Foundations for engineering biology. Nature. 438 (7067), 449-453 (2005).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: an expanded repertoire of applications. Nat. Reviews. Genetics. 21 (3), 151-170 (2020).
- Dopp, J. L., Rothstein, S. M., Mansell, T. J., Reuel, N. F. Rapid prototyping of proteins: Mail order gene fragments to assayable proteins within 24 hours. Biotechnology and Bioengineering. 116 (3), 667-676 (2019).
- Garamella, J., Marshall, R., Rustad, M., Noireaux, V. The all E. coli TX-TL toolbox 2.0: A platform for cell-free synthetic biology. ACS Synthetic Biology. 5 (4), 344-355 (2016).
- Kopniczky, M. B., et al. Cell-free protein synthesis as a prototyping platform for mammalian synthetic biology. ACS Synthetic Biology. 9 (1), 144-156 (2020).
- Kelwick, R., et al. Cell-free prototyping strategies for enhancing the sustainable production of polyhydroxyalkanoates bioplastics. Synthetic Biology. 3 (1), (2018).
- Karim, A. S., et al. In vitro prototyping and rapid optimization of biosynthetic enzymes for cell design. Nature Chemical Biology. 16 (8), 912-919 (2020).
- Takahashi, M. K., et al. Rapidly characterizing the fast dynamics of RNA genetic circuitry with cell-free Transcription-Translation (TX-TL) systems. ACS Synthetic Biology. 4 (5), 503-515 (2015).
- Chappell, J., Jensen, K., Freemont, P. S. Validation of an entirely in vitro approach for rapid prototyping of DNA regulatory elements for synthetic biology. Nucleic Acids Research. 41 (5), 3471-3481 (2013).
- Borkowski, O., et al. Cell-free prediction of protein expression costs for growing cells. Nature Communications. 9 (1), 1457 (2018).
- Dudley, Q. M., Karim, A. S., Nash, C. J., Jewett, M. C. In vitro prototyping of limonene biosynthesis using cell-free protein synthesis. Metabolic Engineering. 61, 251-260 (2020).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- Sun, Z. Z., Yeung, E., Hayes, C. A., Noireaux, V., Murray, R. M. Linear DNA for rapid prototyping of synthetic biological circuits in an escherichia coli based TX-TL cell-free system. ACS Synthetic Biology. 3 (6), 387-397 (2014).
- Borkowski, O., et al. Large scale active-learning-guided exploration for in vitro protein production optimization. Nature Communications. 11 (1), 1872 (2020).
- Caschera, F., et al. High-throughput optimization cycle of a cell-free ribosome assembly and protein synthesis system. ACS Synthetic Biology. 7 (12), 2841-2853 (2018).
- Iyer, S., Karig, D. K., Norred, S. E., Simpson, M. L., Doktycz, M. J. Multi-input regulation and logic with T7 promoters in cells and cell-free systems. PLoS One. 8 (10), 78442 (2013).
- Karig, D. K., Iyer, S., Simpson, M. L., Doktycz, M. J. Expression optimization and synthetic gene networks in cell-free systems. Nucleic Acids Research. 40 (8), 3763-3774 (2012).
- Jung, J. K., et al. Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnology. 38 (12), 1451-1459 (2020).
- Bailey, J., Eggenstein, E., Lesnick, J. Miniaturization and rapid processing of TXTL reactions using acoustic liquid handling. Labcyte Technical Note. , 1-12 (2018).
- Marshall, R., Garamella, J., Noireaux, V., Pierson, A. High-throughput microliter-sized cell-free transcription-translation reactions for synthetic biology applications using the echo 550 liquid handler. Labcyte Application Note. , 1-6 (2018).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Dopp, J. L., Tamiev, D. D., Reuel, N. F. Cell-free supplement mixtures: Elucidating the history and biochemical utility of additives used to support in vitro protein synthesis in E. coli extract. Biotechnology Advances. 37 (1), 246-258 (2019).
- Cole, S. D., Miklos, A. E., Chiao, A. C., Sun, Z. Z., Lux, M. W. Methodologies for preparation of prokaryotic extracts for cell-free expression systems. Synthetic and Systems Biotechnology. 5 (4), 252-267 (2020).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of Biotechnology. 110 (3), 257-263 (2004).
- Marshall, R., Maxwell, C. S., Collins, S. P., Beisel, C. L., Noireaux, V. Short DNA containing χ sites enhances DNA stability and gene expression in E. coli cell-free transcription-translation systems. Biotechnology and Bioengineering. 114 (9), 2137-2141 (2017).
- Yim, S. S., Johns, N. I., Noireaux, V., Wang, H. H. Protecting linear DNA templates in cell-free expression systems from diverse bacteria. ACS Synthetic Biology. 9 (10), 2851-2855 (2020).
- Zhu, B., et al. Increasing cell-free gene expression yields from linear templates in Escherichia coli and Vibrio natriegens extracts by using DNA-binding proteins. Biotechnology and Bioengineering. 117 (12), 3849-3857 (2020).
- Tuckey, C., Asahara, H., Zhou, Y., Chong, S. Protein synthesis using a reconstituted cell-free system. Current Protocols in Molecular Biology. 108, 1-22 (2014).
- Hoffman, R. A., Wang, L., Bigos, M., Nolan, J. P. NIST/ISAC standardization study: Variability in assignment of intensity values to fluorescence standard beads and in cross calibration of standard beads to hard dyed beads. Cytometry. Part A. 81 (9), 785-796 (2012).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical Review Letters. 106 (4), 048104 (2011).
- Rossi, N. A., Dunlop, M. J. Making waves with synthetic oscillators. Cell Systems. 6 (4), 406-407 (2018).
- Niederholtmeyer, H., et al. Rapid cell-free forward engineering of novel genetic ring oscillators. eLife. 4, 09771 (2015).
- Chang, H., Voyvodic, P. L., Structurale, C. D. B. Microbially derived biosensors for diagnosis, monitoring and epidemiology. Microbial Biotechnology. 10 (5), 1031-1035 (2017).
- Pardee, K., et al. low-cost detection of Zika virus using programmable biomolecular components. Cell. 165 (5), 1255-1266 (2016).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Liu, X., Germaine, K. J., Ryan, D., Dowling, D. N. Whole-cell fluorescent biosensors for bioavailability and biodegradation of polychlorinated biphenyls. Sensors. 10 (2), 1377-1398 (2010).
- Gautam, P., Suniti, S., Amrita, K., Madathil, D., Nair, B. A Review on Recent Advances in Biosensors for Detection of Water Contamination. International Journal of Environmental Sciences. 2 (3), 1565-1574 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。