Method Article
무세포 시스템을 사용한 유전 부분의 신속한 특성 분석
요약
잘 특성화 된 유전 부분은 새로운 유전 회로의 설계에 필요합니다. 여기에서는 유전 부분을 신속하게 특성화하기 위한 비용 효율적이고 처리량이 높은 방법을 설명합니다. 당사의 방법은 무세포 용해물, 복제를 방지하기 위한 선형 DNA, 처리량을 늘리고 반응량을 줄이기 위한 음향 액체 처리를 결합하여 비용과 시간을 줄입니다.
초록
유전 부분을 특성화하고 분류하는 것은 유용한 유전 회로의 설계에 매우 중요합니다. 잘 특성화 된 부품을 사용하면 유전 회로를 미세 조정할 수 있으므로 기능이 예측 가능한 결과를 얻을 수 있습니다. 합성 생물학이 한 분야로 성장함에 따라 감지, 대사 변경 및 세포 컴퓨팅과 관련된 기능을 실행하기 위해 미생물에 구현 된 유전 회로가 폭발적으로 증가했습니다. 여기에서는 유전 적 부분을 특성화하는 신속하고 비용 효율적인 방법을 보여줍니다. 당사의 방법은 리포터 단백질의 발현을 통해 부분을 평가하기 위한 배지로 자체 준비된 무세포 용해물을 활용합니다. 주형 DNA는 리포터 유전자에 변이체 부분을 추가하기 위해 저렴한 프라이머를 사용하는 PCR 증폭에 의해 제조되며, 주형은 클로닝없이 선형 DNA로서 반응에 추가됩니다. 이러한 방식으로 첨가될 수 있는 부품은 프로모터, 오퍼레이터, 리보솜 결합 부위, 절연체 및 터미네이터를 포함한다. 이 접근 방식은 음향 액체 처리기 및 384웰 플레이트의 통합과 결합되어 사용자가 하루 만에 유전 부품의 고처리량 평가를 수행할 수 있도록 합니다. 이에 비해 세포 기반 스크리닝 접근법은 시간이 많이 소요되는 클로닝이 필요하며 야간 배양 및 배양 밀도 정규화 단계로 인해 검사 시간이 더 깁니다. 또한 무세포 용해물에서 작업하면 사용자가 정확한 농도로 외인성 성분과 DNA를 추가하여 발현 조건을 보다 엄격하게 제어할 수 있습니다. 무세포 스크리닝에서 얻은 결과는 무세포 시스템의 응용 분야에 직접 사용하거나 경우에 따라 전체 세포의 기능을 예측하는 방법으로 사용할 수 있습니다.
서문
합성 생물학의 핵심 노력은 미생물 또는 무세포 용해물에 배치될 때 유용한 기능을 수행하는 유전 회로1를 구성하는 데 사용할 수 있는 잘 특성화된 부품을 포함하는 유전 도구 키트를 개발하는 것입니다. 이러한 유전 회로가 견인력을 얻은 영역은 감지 2,3,4, 인간의 성능 5,6, 바이오 연료 7,8, 재료 생산 9,10 및 셀룰러 컴퓨팅 11입니다. 표준화된 유전 부분의 레지스트리가 설립되었다12 새로운 부분과 기존 부분을 프로모터, 오퍼레이터, 코딩 서열 및 터미네이터와 같은 범주로 분류하기 위해, 단지 몇 가지만 예를 들자면. iGEM(International Gennetically Engineered Machines) 대회13와 같은 노력은 이러한 유전적 부분을 특성화하고 분류하는 데 중요한 역할을 했습니다. 이들 부분들을 유용한 유전 회로(14, 15)로 신속하게 조립하는 것을 용이하게 하기 위해 많은 방법들이 개발되었다. 소프트웨어는 심지어 원하는 기능을 달성하는 회로로 잘 특성화 된 부품의 구성을 자동화하기 위해 개발되었습니다16. 그러나 예측 가능한 기능을 가진 유용한 유전 회로의 조립은 유전 도구 키트에 잘 특성화 된 유전 부분이 포함되어 있다는 가정에 근거합니다. 합성 생물학의 발전을 향한 이러한 도구 키트의 필요성으로 인해 적절한 특성화 데이터를 가진 회로 및 부품을 더 잘 분류하기 위한 수많은 노력이 설명되었습니다 17,18,19,20,21.
유전적 성분을 특성화하는 한 가지 접근법은 생체외 전사 및 번역과 같은 세포 기능을 재구성하는 무세포 단백질 합성(CFPS) 시스템을 사용하는 것이다 22. 여러 연구에서 유전자 구성 요소 23,24,25,26,27,28,29,30,31,32 를 프로토타이핑하기 위한 CFPS의 잠재력을 입증했습니다. 무세포 시스템에 직접 적용하거나 라이브러리 내 부분의 상대적 활성과 같은 세포에서 유전 구조의 기능을 예측 하기 위한 29 , 대사 경로 최적화27, 및 세포 부담30. 이러한 연구에서 강조된 세포 대비 CFPS에서 프로토타이핑의 이점에는 시간 소모적인 클로닝 방지, DNA 및 기타 반응 성분의 농도에 대한 정밀한 제어, 여러 DNA 구조를 쉽게 혼합 및 일치시킬 수 있는 기능이 포함됩니다. 클로닝 방지의 이점은 선형 DNA 주형을 사용할 때 특히 분명하며, 이를 통해33일이 아닌 몇 시간이 걸리는 시험관내 방법으로 새로운 구축물을 조립할 수 있습니다. 단순히 피펫팅에 의해 DNA 구축물 및 기타 성분의 농도를 조작할 수 있는 능력은 액체 취급 로봇(34,35)에 의해 구동되는 고처리량 실험을 가능하게 함으로써 접근법을 더욱 매력적으로 만든다. 프로토타이핑에 CFPS를 사용한 성공이 보고되었지만 CFPS 결과가 세포의 기능을 안정적으로 예측할 수 있는 컨텍스트에서 두고 봐야 한다는 점에 유의하는 것이 중요합니다.
여기에서는 기존 셀 기반 접근 방식에 비해 속도, 처리량 및 비용의 이점을 강조하는 CFPS 프로토타이핑 방법을 제시합니다. 이 접근법은 CFPS를 사용하여 전사 인자 TetR32에 의해 조절되는 T7 프로모터 변이체 라이브러리를 신속하게 특성화하여 당시문헌 36,37에서 사용 가능한 소수의 조절된 T7 프로모터 변이체를 크게 확장한 이전 연구에서 파생되었습니다. 다른 사람들은 그 이후로 그러한 발기인(38)의 범위를 더욱 확장시켰다. 우리의 방법에서, 유전자 구성 어셈블리는 PCR을 사용하여 리포터 유전자에 변이 유전 부분을 추가하는 프라이머를 통해 주형 DNA를 증폭함으로써 가속화됩니다. 384웰 플레이트의 음향 액체 처리는 처리량을 늘리고 필요한 재료의 양을 줄이는 데 사용됩니다. 이전 연구는 더 큰 부피41의 수동 피펫팅에 필적하는 가변성으로 상당히 낮은 부피39,40에서 음향 액체 처리의 성공적인 사용을 입증했습니다. 이 방법 외에도 문제 해결 정보와 잠재적 비용 및 시간 절약에 대한 평가를 제공합니다. Sun et al.42를 기반으로 한 무세포 용해물을 생산하기 위한 프로토콜이 여기에 포함되어 있지만 수많은 다른 상용 키트 및 프로토콜(43,44)도 작동해야 합니다. 유사하게, 프로모터 변이체32의 특성화를 위한 방법을 입증하는 동안, 다른 부분은 PCR 증폭에 의해 교환될 수 있으며, 예를 들어 리보레귤레이터, 리보솜 결합 부위 (RBS), 절연체, 단백질 태그, 및 터미네이터. 우리는 이 방법론이 합성 생물학 커뮤니티가 유용한 기능을 가진 예측 가능한 유전 회로의 조립을 위한 특성화된 부품의 수를 계속 늘리는 데 도움이 되기를 바랍니다.
프로토콜
1. 세포 추출물의 제조
- 미디어 준비
- 2xYT 배지의 경우: 트립톤 16g, 효모 추출물 10g 및 NaCl 5g을 탈이온수 900mL에 넣고 5M NaOH로 pH를 7.0으로 조정합니다. 탈이온수와 오토클레이브 또는 필터 멸균을 사용하여 용액 부피를 1L로 높입니다. 또는 2xYT 미디어를 구입하십시오.
- S30B 완충액의 경우: 2L의 탈이온수에 14mM Mg-글루타메이트, 60mM K-글루타메이트 및 5mM 트리스의 용액을 준비합니다. 2M 트리스를 사용하여 pH를 8.2로 조정하고 오토클레이브하고 4°C에서 보관합니다. 사용 직전에 최종 농도 1mM에 디티오트레이톨(DTT)을 첨가하여 용액을 완성합니다.
- 세포의 준비
- 줄무늬 대장균 BL21(DE3) Rosetta2 세포 또는 기타 선택된 세포주(최근 포괄적인 검토는 Cole et al.44 참조)를 LB(Lysogeny Broth) 한천 플레이트에 넣고 37°C에서 10-14시간 동안 배양합니다.
- 단일 대장균 콜로니를 사용하여 10mL 배양 튜브에 3mL의 2xYT 배지를 접종합니다. 이 튜브를 37 ° C에서 250 rpm에서 8 시간 동안 흔들면서 배양합니다.
- 3mL 배양액에서 50μL를 사용하여 500mL 플라스크에 2xYT 배지 50mL를 접종합니다. 이 플라스크를 37°C에서 250rpm에서 8시간 동안 진탕하면서 배양합니다.
- 50mL 배양물에서 7.5mL를 사용하여 0.75L의 2xYT 배지가 포함된 4개의 4L 배플 플라스크를 각각 접종합니다. 이들 플라스크를 대략 3 내지 4 시간 후, 2 내지 4의 600 nm에서 광학 밀도에 도달할 때까지 220 rpm에서 진탕하면서 37°C에서 인큐베이션한다.
- 세포를 1L 용기로 옮기고 5,000 x g 에서 4°C에서 12분 동안 원심분리하여 각 플라스크에서 세포를 수확합니다. 상청액을 폐기 용기에 디캔팅하여 폐기하십시오.
- 각 세포 펠릿을 피펫을 사용하여 완전히 재현탁시켜 150mL의 얼음처럼 차가운 S30B 완충액으로 세척하여 세포 덩어리를 방해한 다음 5,000 x g 에서 12분 동안 원심분리하여 세포를 다시 수집합니다. 상청액을 폐기하십시오.
- 각 세포 펠릿을 완전히 재현탁하고 피펫을 사용하여 세포 덩어리를 방해하여 얼음처럼 차가운 S30B 버퍼 40mL에서 다시 세척합니다. 세포를 미리 칭량된 50mL 원뿔형 튜브로 옮기고 4°C에서 8분 동안 2,000 x g 에서 원심분리하여 세포를 다시 수집합니다. 디캔팅하여 상청액을 버립니다.
- 습식 셀 펠릿의 무게를 잰다. 튜브를 액체 질소에 직접 넣어 세포 펠릿을 급속 동결하고 -80 ° C에서 보관하십시오.
- 세포 용해
- 얼음에서 세포 펠릿을 해동합니다.
- 각 세포 펠릿을 와동에 의해 세포 펠릿 1g당 S30B 완충액 1.4mL에 재현탁시킨다.
- 세포를 4°C에서 640 psi에서 프렌치 압력 전지로 용해시킨다. 얼음 위의 미세 원심분리 튜브에서 용해물을 수집하고 용해 직후 용해물 1mL당 1M DTT 3μL를 추가합니다.
알림: 균일한 압력을 유지하고 갑작스러운 압력 강하를 방지하기 위해 작은 금속 막대로 프렌치 프레스 릴리스 밸브를 두드리는 것이 가장 좋습니다. - 4°C에서 30분 동안 30,000 x g 에서 원심분리하여 용해물을 제거하고 펠릿을 방해하지 않도록 주의하면서 상청액을 새로운 얼음처럼 차가운 미세 원심분리 튜브에 피펫팅한 후 펠릿을 버립니다.
- 상청액을 4°C에서 30분 동안 30,000 x g 에서 두 번째로 원심분리한다. 생성된 상청액을 얼음처럼 차가운 미세 원심분리 튜브에 피펫팅합니다. 펠릿을 폐기하십시오.
- 상청액을 37°C 수조에서 1시간 동안 인큐베이션한다.
- 4°C에서 15분 동안 15,000 x g 에서 원심분리하여 상청액을 제거하고 생성된 상청액을 펠릿을 방해하지 않도록 주의하면서 얼음처럼 차가운 미세 원심분리 튜브로 옮깁니다.
- 상청액을 4°C에서 15분 동안 15,000 x g 에서 두 번째로 원심분리하고 생성된 상청액을 얼음처럼 차가운 미세 원심분리 튜브로 옮기고 남아 있는 펠릿을 방해하지 않도록 주의합니다.
- 100μL 분취량의 상청액을 1.5mL 미세 원심분리 튜브에 분배하고 액체 질소에 직접 넣어 급속 냉동합니다. 상청액을 -80°C에서 보관한다.
2. 선형 템플릿 준비
- 프라이머 디자인
- 코어 서열을 PCR 템플릿으로 선택합니다. 최소한 sfGFP(슈퍼폴더 녹색 형광 단백질), LacZ 또는 시금치 압타머와 같은 리포터 서열을 포함합니다. 디자인에 적합한 종결자, 프로모터 또는 RBS와 같이 선별된 변형에 걸쳐 고정될 다른 부품을 포함합니다.
참고: 무세포 시스템에서 선형 DNA의 발현을 위해 터미네이터를 포함할 필요가 항상 필요한 것은 아닙니다. - 순방향 프라이머의 경우, 코어 서열의 5' 말단과 프라이머의 3' 말단과 일치하는 최소 20bp를 선택하십시오. 구조체의 5' 말단에 부분을 추가하는 경우, PCR 증폭을 통해 코어 서열에 관심 있는 유전적 부분을 추가하도록 프라이머의 5' 말단의 나머지 부분을 설계합니다(그림 1A 및 그림 2).
참고: ~60bp 이상의 프라이머는 종종 비용이 급격히 증가하기 때문에 더 긴 서열 또는 여러 부분을 추가하도록 여러 개의 겹치는 프라이머를 설계할 수 있습니다. 단일 PCR 반응에 여러 프라이머를 사용할 수 있지만 여러 차례의 PCR을 수행하는 것이 좋습니다. - 역 프라이머의 경우 코어 서열의 20' 말단과 일치하도록 최소 3bp를 프라이머의 3' 말단으로 선택하십시오. 구조체의 3' 말단에 부분을 추가하는 경우 PCR 증폭을 통해 관심 있는 유전적 부분을 코어 서열에 추가하도록 프라이머의 5' 말단의 나머지 부분을 설계합니다(그림 1A 및 그림 2). 역방향 프라이머의 어닐링 온도가 전체 순방향 프라이머의 어닐링 온도의 5°C 이내인지 확인하십시오.
- 코어 서열을 PCR 템플릿으로 선택합니다. 최소한 sfGFP(슈퍼폴더 녹색 형광 단백질), LacZ 또는 시금치 압타머와 같은 리포터 서열을 포함합니다. 디자인에 적합한 종결자, 프로모터 또는 RBS와 같이 선별된 변형에 걸쳐 고정될 다른 부품을 포함합니다.
- 선형 템플릿 증폭
- 코어 서열의 수를 기준으로 수행할 PCR 반응의 수를 결정하고 표 1을 사용하여 필요한 각 성분의 양을 계산합니다.
- 표 1에 따라 마스터 믹스를 준비하고 얼음 위에 보관하십시오. 마스터 믹스의 분취량 30 또는 40 μL(표 1 참조)를 결정된 수의 PCR 튜브에 넣고 5μM에서 각 가변 프라이머(즉, 부분 변경을 코딩하는 프라이머, 표 1 참조)를 10μL를 적절하게 표지된 PCR 튜브에 추가합니다.
- PCR 튜브를 써모사이클러에 넣고 다음 PCR 프로그램을 실행합니다: 3분 동안 98°C; 15 초 동안 98 °C, 20 초 동안 XX °C, YY 분 동안 72 °C의 30 사이클; 72 ° C에서 10 분 동안 최종 연장. 이어서, 반응물을 4°C로 유지한다.
여기서, XX는 어닐링 온도가 더 낮은 프라이머에 대한 어닐링 온도를 나타내고, YY는 사용된 고충실도 중합효소에 대한 제조자의 권고에 기초하여 앰플리콘의 길이에 대해 계산된 연장 시간을 나타낸다. 다양한 프라이머 및/또는 템플릿에 대해 필요에 따라 이러한 조건을 최적화합니다. - (선택 사항) 1μL의 DpnI 제한 효소를 추가하여 원래 주형을 소화합니다. 반응물을 37°C에서 1시간 동안 인큐베이션한다. 원래 주형이 플라스미드 DNA인 경우에만 이 단계를 수행하십시오.
- 겔 전기영동으로 각 PCR 산물 5μL를 분석합니다. 180V에서 20 분 동안 1 % 아가 로스 겔을 사용하여 제품을 분리하십시오. 선택한 코어 시퀀스와 추가된 부품의 길이에 따라 달라지는 올바른 밴드 크기를 확인합니다.
- 선형 주형을 상용 PCR 정제 키트를 사용하거나 바람직한 PCR 클린업 방법에 의해 정제한다. 겔 전기영동 분석에 의해 여러 밴드가 존재하는 경우 PCR 조건을 최적화하거나 제조업체의 권장 사항에 따라 상용 겔 추출 키트를 사용하여 올바른 분자량 밴드를 정제합니다.
- 분광 광도계를 사용하여 각 DNA 주형을 정량화합니다. 260nm/280nm 비율이 약 1.8인지 확인하여 DNA 주형 품질을 평가합니다.
- (선택 사항) 180V에서 20분 동안 1% 아가로스 겔을 사용하여 DNA 주형의 일부를 다시 분리하고, 주형 정제 동안 임의의 원치 않는 밴드가 제거되었는지 확인하였다.
- 정제된 DNA 주형을 즉시 사용하거나 -20°C에서 보관하십시오.
3. 정제 된 단백질 제제
- 단백질 발현
- 발현될 각 단백질에 대해, 적절한 발현 작제물을 조립한다. 코돈-대장 균에서 발현을 위해 유전자를 최적화한다. 바람직한 플라스미드 조립 방법을 통해 pET-22b 발현 벡터 또는 다른 적절한 발현 벡터 내로 유전자를 삽입한다. 발현 플라스미드를 BL21(DE3) Rosetta2 발현 세포 또는 다른 적절한 세포주로 형질전환시킨다.
- 각 단백질에 대해 단일 콜로니를 사용하여 10mL 배양 튜브에 3mL의 LB 배지를 접종합니다. 이 튜브를 37°C에서 250rpm으로 밤새 흔들면서 배양합니다.
- 750mL의 LB 배지가 들어있는 2L 플라스크에 1mL의 하룻밤 배양물을 접종합니다. 이 플라스크를 37°C에서 250rpm에서 진탕하면서 0.6-1.0의 OD600 에 도달할 때까지 배양합니다.
- 각 플라스크에 물 중 0.75mL의 1M 이소프로필β-D-1-티오갈락토피라노사이드(IPTG)를 첨가하여 단백질 발현을 유도하고 이들 플라스크를 37°C에서 250rpm에서 4시간 동안 진탕하면서 계속 배양합니다.
- 1L 원심분리기 병을 사용하여 5,000 x g 에서 12분 동안 원심분리하여 각 플라스크에서 세포를 수확합니다. 상청액을 폐기하십시오.
- 펠릿을 50mL 원뿔형 튜브로 옮기고 각 펠릿의 무게를 잰다. 세포를 액체 질소에서 급속 동결하고 -80 °C에서 보관하거나 3.2 단계로 진행합니다.
참고: 0.75mL당 2-5g의 세포가 이 단계에서 발생할 것으로 예상됩니다.
- 니켈 친화성 컬럼 크로마토그래피에 의한 단백질 정제
- 50 mM Tris-Cl, 500 mM NaCl, 및 5 mM 이미다졸을 조합하여 용해 완충액을 준비한다. pH 8.0으로 조정하십시오.
- 50 mM Tris-Cl, 500 mM NaCl, 및 25 mM 이미다졸을 조합하여 세척 완충액을 준비한다. pH 8.0으로 조정하십시오.
- 50 mM Tris-Cl, 500 mM NaCl 및 250 mM 이미다졸을 조합하여 용출 완충액을 준비한다. pH 8.0으로 조정하십시오.
- 50 mM NaHPO4, 100 mM NaCl, 및 2% DMSO를 조합하여 투석 완충액을 준비한다. pH 7.5로 조정하십시오.
- 튜브를 실온의 물에 넣어 셀 펠릿을 해동합니다. 세포 펠릿 1g 당 용해 완충액 5mL를 추가하고 와동하여 재현탁합니다.
- 초음파 처리로 세포를 용해시킵니다. 50mL 원추형 튜브 당 30mL 이하가되도록 세포 균질 액을 분리하고 각 튜브를 얼음 위에 보관하십시오. 직경 0.16cm의 프로브가 있는 초음파 처리기를 사용하여 세포를 30초 동안 10회 중단한 15초 라운드로 용해시킵니다.
알림: 거품이 생기면 단백질이 변성되므로 피하십시오. 거품의 형성은 초음파 처리기 팁이 작동하는 동안 용해물에 적어도 2/3 잠긴 상태로 유지함으로써 피할 수 있습니다. 초음파 처리 외에 세포 용해의 다른 방법도 가능합니다44. - 4°C에서 30분 동안 15,000 x g 에서 원심분리하여 용해물을 제거하고 상청액을 새로운 50mL 원뿔형 튜브에 넣습니다.
- 상청액 1mL당 니켈-니트릴로트리아세트산(Ni-NTA) 수지 5mL를 추가합니다. 50mL 원추형 튜브당 36mL 이하가 되도록 세포 용해물/Ni-NTA 슬러리를 나눕니다. 튜브 회전 장치에서 4 ° C에서 10 rpm으로 1 시간 동안 배양합니다.
- 세포 용해물/Ni-NTA 슬러리를 2mL 베드 부피 크로마토그래피 컬럼에 디캔팅하여 수지를 로드하고 추가 분석을 위해 필요한 경우 용리액을 수집하고, 그렇지 않으면 폐기합니다. 10 레진 베드 부피의 세척 완충액으로 수지를 세척하십시오.
- 컬럼에 용출 완충액의 3개의 레진베드 부피를 첨가하여 단백질을 수집하고 각 단백질에 대해 적절한 분자량 차단 멤브레인이 있는 원심 농축기를 사용하여 부피를 1.5 mL로 농축합니다.
- 단백질을 4°C에서 1시간 동안 2L의 투석 완충액에 대해 투석합니다. 단백질을 4°C에서 밤새 투석 완충액 2 L에 대해 다시 투석한다.
- 몰 흡광 계수와 280nm에서의 흡광도를 사용하여 단백질을 정량화합니다. 단백질을 분리하여 순도를 분석한 후 소듐 도데실 설페이트 폴리아크릴아미드 겔 전기영동(SDS-PAGE)을 이용하였다. 단백질을 -80°C에서 보관한다.
4. 무세포 단백질 합성
- CFPS 반응 혼합물의 제조
- Sun et al.42의 아미노산 용액 준비, 에너지 용액 준비 및 완충액 준비 단계에 따라 보충제 믹스를 준비하십시오. 따로 보관하거나 -80°C에서 분취량으로 조합하여 보관하십시오. 최종 농도가 TX-TL 반응의 실험 실행 섹션에서 Sun et al.42 에 설명된 농도와 일치하는지 확인합니다.
- 선형 DNA가 분해되지 않도록 보호하기 위해 첨가제를 준비하십시오. GamS33,45를 사용하는 경우 위 섹션 3의 단계를 통해 준비하거나 상용 공급업체로부터 받으십시오. 다른 접근법에 대해서는 해당 문헌46,47,48을 확인하십시오. 대안적으로, 첨가제(49)를 필요로 하지 않는 CFPS 시스템을 사용한다.
- 위의 섹션 7의 단계를 사용하여 T3 중합효소, 억제 단백질 및 기타 첨가제를 준비하거나 상업용 공급업체에서 구하십시오.
- 수행할 CFPS 반응의 수를 결정하고 표 2를 사용하여 필요한 각 성분의 양을 계산합니다. 필요에 따라 성분을 추가하거나 제거하는 것을 포함하여 성분의 농도를 수정하고 각 반응 혼합물의 최종 부피가 항상 10μL가 되도록 물의 양을 조정합니다. 마찬가지로, 마스터 믹스를 수정하여 원하는 대로 음향 액체 처리로 다른 구성 요소를 쉽게 분배할 수 있도록 합니다( 토론 섹션 참조).
- 얼음에서 모든 성분을 해동하고 위에서 계산한 대로 각 성분을 혼합하여 마스터 믹스를 준비합니다. 피펫으로 모든 성분을 철저히 혼합하십시오. 특히 아미노산 혼합물의 경우 강수량을 피하기 위해 세심한주의를 기울이십시오. 마스터 믹스를 얼음 위에 보관하십시오.
- 얼음 위에서 384웰 플레이트를 식히고 마스터 믹스를 9μL 분취량으로 각 웰에 분배합니다.
참고: 음향 액체 취급으로 이러한 구성 요소를 분배할 수 있지만 적절한 분배를 위해 주의를 기울여야 합니다(문제 해결을 위한 토론 섹션 참조).
- 음향 액체 취급에 의한 추가 구성 요소 분배
- 모든 CFPS 반응에 필요한 억제 단백질(및 기타 선택적 성분)의 양을 계산합니다.
- 억제기 단백질을 얼음에서 해동하고 음향 액체 취급 소스 플레이트 또는 기타 적절한 플레이트에 분배합니다. 사용된 소스 플레이트 유형에 필요한 적절한 양의 데드 볼륨이 포함되어 있는지 확인하십시오.
- 1 μL 부피의 리프레서 단백질을 액체 처리기를 통해 적절한 웰에 분배합니다. 배포 문제 해결에 대한 자세한 내용은 토론 섹션을 참조하십시오.
- 표준 곡선
- 정제된 리포터의 연속 희석액(단백질 정제는 섹션 3 참조)41 또는 적절한 화학 표준물질50을 플레이트에 포함하여 다른 연구 및 다른 실험실과 결과를 비교할 수 있습니다. 실험의 사용된 리포터 및 예상 발현 범위에 적합한 농도 범위를 선택한다.
- CFPS 반응 실행
- 플레이트 리더를 30°C로 예열합니다. 플레이트 리더가 흔들림 없이 코어 시퀀스에 사용된 리포터에 적합한 설정에서 읽도록 설정합니다.
참고: 여기에서는 30°C가 사용되지만 29°C 및 37°C도 일반적으로 사용되며 이 프로토콜과 잘 작동합니다. 다른 온도는 대안적인 무세포 반응 제제에 바람직할 수 있다. 읽기 간격의 경우 여기에 제시된 대표 데이터에 대한 좋은 해상도를 달성하기에 10분이면 충분합니다. 그러나 다른 해상도는 리포터 단백질 및 특정 CFPS 레시피에 따라 더 나을 수 있습니다. - (선택 사항) 먼저 테스트 반응을 실행하여 신호 오버플로 없이 형광의 변화를 포착하기 위한 적절한 게인 또는 감도 설정을 설정합니다.
- 증발을 방지하기 위해 384웰 플레이트를 불침투성 플라스틱 밀봉 가능한 뚜껑으로 밀봉합니다. 가능하면 기기에서 1°C 수직 온도 구배를 설정하여 씰의 응결을 제한하십시오. 384웰 플레이트를 플레이트 홀더에 놓고 읽기를 시작합니다.
- 플레이트 리더를 30°C로 예열합니다. 플레이트 리더가 흔들림 없이 코어 시퀀스에 사용된 리포터에 적합한 설정에서 읽도록 설정합니다.
결과
우리 방법의 유용성을 입증하기 위해, T7 RNAP 구동 발현의 조절에 대한 T7 프로모터에 대한 tetO 서열의 근접성의 효과를 설명하는 결과를 제시한다. 전체 결과와 그 의미는 McManus et al.32의 작업에서 찾을 수 있습니다. 워크플로는 그림 1에 설명되어 있습니다. tetO 서열에 대한 T7 프로모터의 거리에서만 변하는 15개의 선형 템플릿을 프로토콜의 섹션 2에 설명된 대로 각 프로모터 변이체(그림 2)를 추가하도록 설계된 프라이머로 sfGFP 리포터를 PCR 증폭하여 제조했습니다. CFPS 반응 성분 및 반응은 프로토콜에 따라 제조하였다. sfGFP의 발현은 음향 액체 처리기를 사용하여 12가지 농도의 TetR 단백질을 삼중으로 적정하여 각 주형에서 측정했습니다. 템플릿 당 36 개의 CFPS 반응 및 15 개의 템플릿에서, T7-tetO 조합의 전체 세트에 대해 총 540 개의 반응이 수행되었다. 전체 평가는 2 개의 플레이트 리더에서 2 개의 플레이트에 대해 수행되었습니다. 이 데이터를 분석한 결과, T7 RNAP는 T7 전사체의 시작부터 13bp 다운스트림까지 T7 기반 발현을 동일하게 하향조절하는 것으로 나타났습니다(그림 3). 이 결과는 다른 억제 자에 의한 T7의 효과적인 억제를위한 추정 창을 설명함으로써 조절 가능한 T7 구동 유전자 회로의 미래 설계에 영향을 미칩니다. 여기에 설명된 프로토콜의 결과와 전통적인 클로닝으로 제조된 DNA를 비교한 결과, 형식 간의 TetR 억제 정도에서 작지만 통계적으로 유의미한 차이가 나타났습니다. 우리는 벡터 DNA에 대한 TetR의 비특이적 결합이 관찰 된 차이를 설명 할 수 있다고 가정했다. 실험 결과는 선형 주형 DNA를 사용한 반응에 선형 벡터 DNA를 첨가하면 비통계적 유의성에 대한 차이가 감소하는 것으로 나타났지만, 선형 대 원형 형식에 대한 DNA 나선의 주기성 차이와 같은 다른 요인의 기여를 배제하지는 않았으며, 이는 차례로 TetR 결합에 영향을 미칠 수 있습니다. 응용 프로그램에 따라 선형 템플릿을 사용하려면 추가 검증이 필요할 수 있습니다.
음향 액체 취급을 사용한 정확한 분주와 관련된 잠재적 문제에 대한 대표 데이터도 포함되어 있습니다(그림 4). 0.25mM 타르트라진 염료를 함유하는 pH 7.4의 1x 인산염 완충 식염수(PBS) 용액을 사용하여 부피 >1μL를 분배하기 위해 음향 액체 처리기를 프로그래밍하는 두 가지 방법을 평가했습니다. 액체 분주 후, 대상 플레이트를 밀봉하고, 1,500 x g에서 1분 동안 원심분리하고, 플레이트 리더로 425nm에서의 흡광도를 측정하였다. 9개의 실험의 대표적인 결과가 나타나며, 5 μL 전사가 별도의 1 μL 분주로 분할될 때 일련의 8개의 목적지 웰에 걸쳐 보다 일관된 분주를 입증합니다. 이러한 관찰에 따르면 >1 μL의 전사를 ≤1 μL의 다중 전사로 나누는 것이 좋습니다. 프로토콜의 이 중요한 측면 문제 해결에 대한 자세한 내용은 토론 섹션을 참조하십시오.
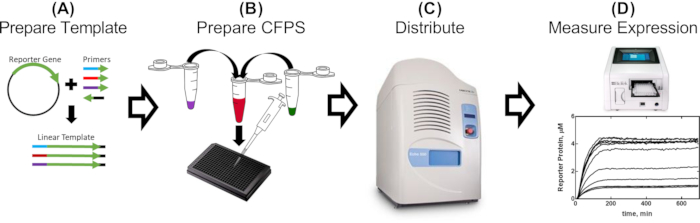
그림 1: 무세포 추출물의 프로모터 부분 평가를 위한 1일 워크플로우. (A) 리포터는 평가할 유전 부위를 포함하는 프라이머를 사용하여 PCR 증폭됩니다 (2-5 시간). (B) 무세포 반응 믹스를 프로토콜에 자세히 설명된 대로 제조하고 PCR 증폭 주형을 사용하여 384웰 플레이트에 분배합니다(30분). (C) 음향 액체 취급은 억제 단백질, 이펙터 분자 및 기타 조건부 이펙터를 포함할 수 있는 추가 구성 요소를 분배하는 데 사용됩니다(10분). (d) 각 반응으로부터의 리포터 단백질 발현은 플레이트 판독기에서 측정된다 (CFPS 레시피 및 작제물에 따라 2-16 h). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
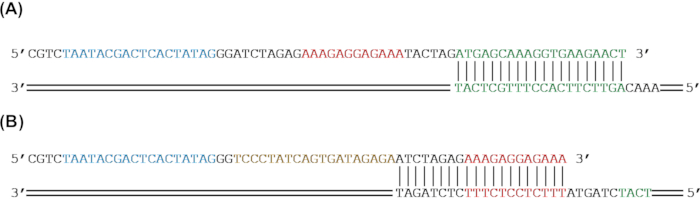
그림 2: PCR 증폭에 의해 리포터 유전자에 유전 부분을 추가하기 위한 프라이머 디자인. (A) sfGFP 리포터 유전자(녹색)를 PCR에 의해 RBS(적색)와 T7 프로모터(청색)를 추가로 증폭한다. (b) sfGFP(녹색)와 RBS(적색)를 PCR에 의해 tetO 서열(금색) 및 T7 프로모터(청색)를 추가로 증폭한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
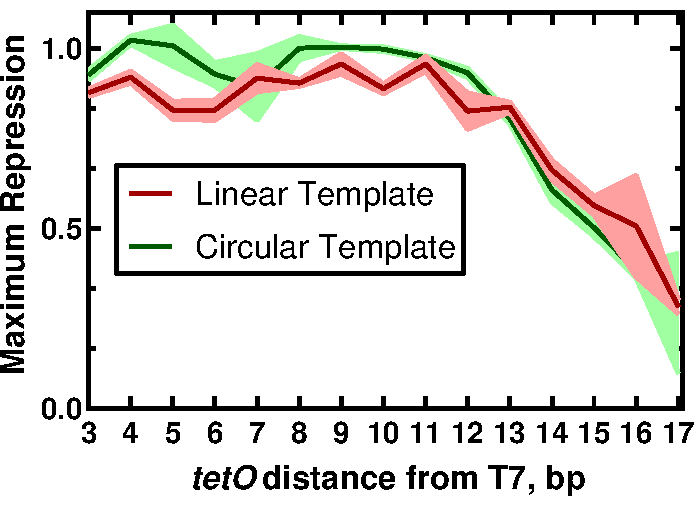
그림 3: tetO 위치가 T7 기반 표현식의 조절에 미치는 영향. 선형 및 원형 템플릿에 대한 정규화된 최대 억제 값을 tetO 위치의 함수로 지정합니다. 트레이스는 세 번의 반복실험에 대한 평균 및 표준 편차를 나타냅니다. 이 그림은 크리에이티브 커먼즈 CC-BY 라이선스에 따라 McManus et al.32 에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
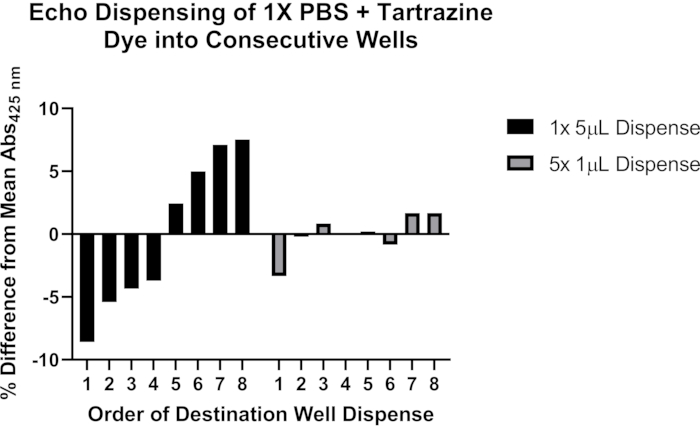
그림 4: 타트라진 염료를 사용하여 음향 액체 처리기로 액체 분주를 검증합니다. 검은색 막대는 단일 프로그래밍 명령을 사용하여 단일 소스 웰에서 384웰 플레이트의 8개의 연속 대상 웰 각각에 5μL의 타르트라진 용액을 분주하는 것을 나타냅니다. 회색 막대는 단일 프로그래밍 명령을 사용하여 단일 공급원 웰에서 8개의 연속적인 대상 웰 각각으로 1μL를 분주한 다음 각 목적지 웰에서 총 5μL에 대해 이 단계를 4회 반복하는 것을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 구성 요소 이름 | 1 반응용 부피(μL) | X 반응 수의 110 %에 대한 부피 (μL) |
| Q5 PCR 프리믹스 | 25 | |
| 물 | 4 | |
| 템플릿 (1–3 ng/μL) | 1 | |
| (고정된 경우 1) 포워드 프라이머 (5 μM) | 0 또는 10 | |
| (고정된 경우 1) 리버스 프라이머 (5 μM) | 0 또는 10 | |
| 마스터 믹스 합계: | 30 또는 40 | |
| (변수1인 경우) 포워드 프라이머 (5 μM) | 0 또는 10 | |
| (변수1인 경우) 리버스 프라이머 (5 μM) | 0 또는 10 |
표 1: PCR 반응용 시약 준비를 위한 워크시트. 맨 오른쪽 열의 값은 의도한 반응 수에 따라 사용자가 채울 수 있습니다. 1 가변 프라이머는 PCR 반응에 첨가되는 특정 부분을 포함하며, 정방향 프라이머, 역방향 프라이머, 또는 둘 다일 수 있다. 고정 프라이머는 부품을 추가하지 않으며 정방향 프라이머 또는 역방향 프라이머가 될 수 있지만 둘 다 될 수는 없습니다.
| 구성 요소 이름 | 1 반응용 부피(μL) | X 반응 수의 110 %에 대한 부피 (μL) |
| 세포 추출물 | 4.2 | |
| 보충제 믹스 | 3.3 | |
| 감스 단백질 (207 μM) | 0.15 | |
| 주형 DNA (20 nM) | 1 | |
| T7 중합 효소 (13 밀리그램 / mL) | 0.12 | |
| 물 | 0.73(이 숫자는 다를 수 있음) | |
| 마스터 믹스 합계: | 9 | |
| 억제 단백질: | 1 |
표 2: CFPS 반응용 시약 준비를 위한 워크시트. 맨 오른쪽 열의 값은 의도한 반응 수에 따라 사용자가 채울 수 있습니다.
보충 테이블. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 프로토콜은 CFPS에 의한 리포터 단백질의 발현을 통해 유전자 부분을 스크리닝하는 비용 효율적이고 신속한 수단을 제공합니다. 잘 특성화 된 유전 부분은 유용한 기능을 가진 예측 가능한 유전 회로의 설계에 중요합니다. 이 방법론은 세포 용해물에서 단백질 발현의 대사 과정을 유지하여 세포 환경을 반영하는 기능을 유지하면서 살아있는 세포에서 작동해야 하는 요구 사항을 제거하여 처리량을 늘리고 새로운 유전 부분을 스크리닝하는 데 필요한 시간을 줄입니다. 당사의 프로토콜은 프라이머 수령 후 1일 이내에 수행할 수 있습니다(반응 준비의 경우 ~2.5-6시간, CFPS 반응의 경우 2-16시간; 도 1), 전통적인 클로닝의 경우 최소 3일(구축물 조립 및 형질전환, 클론의 서열 검증, 및 평가를 위한 세포의 배양을 위해 각각 1일)과 비교하였다. 또한 선형 DNA를 사용하는 구조물당 비용은 기존 클로닝의 약 1/3이라고 추정합니다($78 대 $237; 보충표 1) 방법. 상업용 합성 서비스는 현재 규모에 따라 영업일 기준 최소 4일을 인용하지만 선형 조각을 CFPS에서 직접 스크리닝하는 경우 당사 방법과 유사한 비용이 듭니다($78 대 $91). 이 접근 방식을 확인하지 않았습니다. CFPS로 부품을 평가하는 데 드는 비용은 템플릿 DNA 생성에 비해 적지만($0.05/반응22 대 템플릿당 $78), 벌크 시약 및 용해 장비의 시작 비용은 최소 수천 달러입니다. 음향 액체 처리기를 사용하면 0.5 μL40까지 더 작은 부피를 가능하게하여 비용이 약간만 향상됩니다. 더 중요한 이점은 반응 준비 시간이 단축된다는 것입니다 (반응 수에 따라 ~ 10 분 대 최대 1 시간), 특히 많은 수의 반응을 준비 할 때 배양 전에 준비된 반응에 대한 우려가 제기됩니다.
빠르고 비용 효율적이지만 CFPS 프로토타이핑이 생체 내 기능을 적절하게 예측하는 시기에 대한 한계는 여전히 남아 있습니다. 예를 들어, 게놈 DNA와의 교차 반응은 CFPS 시스템의 생산 동안 숙주 게놈의 제거로 인해 검출되지 않을 것이다. 또한, 성분 농도는 세포(51)에서보다 CFPS에서 1-2배 더 낮을 수 있으며, 이는 상이한 거대분자 밀집 조건의 결과로서 일부 부품의 거동에 영향을 미칠 가능성이 있다. 또한, 생체 내 기능을 예측하는 선형 DNA의 능력은 예를 들어 DNA 2차 구조가 중요한 역할을 하는 경우 제한될 수 있다. 마지막 제한 사항은 함수를 테스트하기 전에 구문이 시퀀스 확인되지 않는다는 것입니다. 특성화 된 부분이 실제로 의도 된 이론적 순서와 정렬되지 않는 경우가있을 수 있습니다. 이러한 모든 제한은 의도된 생체내 적용에서 이 방법에 의해 스크리닝된 부품의 서브세트를 검증함으로써 완화될 수 있다.
우리는 원래 하이브리드 T7-tetO 프로모터32에 대한 작업자 위치 변경의 효과를 조사하기 위해 이 방법론을 개발했습니다. 우리는 프로모터, 오퍼레이터, 리보솜 결합 서열, 절연체 및 터미네이터에 적용될 수 있도록 보다 일반적인 형식으로 프로토콜을 제시했습니다. 이러한 유전적 부분은 각 설계에 대한 프라이머를 사용하는 PCR에 의해 리포터 유전자의 5ʹ 또는 3ʹ 말단에 추가될 수 있으므로 테스트를 위한 각 변이체의 합성 또는 클로닝이 필요하지 않습니다. 생성된 PCR 산물은 리포터 단백질의 발현을 통한 평가를 위한 주형 DNA 역할을 합니다. 우리의 작업에서, 여기에 제공된 친화성 정제 프로토콜은 TetR 및 GamS에 사용되었다. 다른 억제 인자, 활성화 제, 중합 효소, 시그마 인자 및 관심있는 유전 적 부분에 대한 다른 단백질의 발현 및 정제에 동일한 절차를 사용할 수 있지만, 원하는 단백질이 발현되기 위해서는 변형이 필요할 수 있습니다. 이러한 단백질을 CFPS 반응으로 정제 및 적정하면 특정 유전적 부분의 보다 자세한 특성 분석이 가능합니다. 마지막으로, 수많은 대체 CFPS 프로토콜이 존재하며 각 프로토콜은 방법론의 부품 스크리닝 부분에 적합해야 합니다. 예로서, 우리는 이 프로토콜에 투석 단계를 포함하지 않으며, 다른 사람들은 천연 박테리아 프로모터22로부터의 발현에 대해 중요한 것으로 밝혀졌다. CFPS의 기본 구성 성분의 농도를 변경하는 것도 가능합니다. 액체 취급을 사용하면 처리량을 늘리고 필요한 재료를 줄임으로써 무수한 조건을 테스트하는 능력이 향상됩니다34,35.
상당한 문제 해결이 필요할 수 있는 한 가지 영역은 음향 액체 처리기의 최적화입니다. 음향 액체 처리기 디스펜싱은 이송되는 각 구성 요소에 맞게 최적화되어야 하며 데이터를 수집하기 전에 적절한 분포 및 재현성을 확인하기 위해 제어를 실행하는 것이 좋습니다. 이상적인 소스 플레이트 유형과 액체 등급 설정은 분배할 특정 액체와 그 구성 요소에 따라 다릅니다. 아민 코팅이 DNA와 상호 작용할 수 있으므로 아민 코팅 플레이트를 사용하여 DNA를 분배하는 것은 권장되지 않습니다. 또한, 특정 성분의 더 높은 농도를 분배하는 능력은 음향 액체 핸들러 모델에 의존할 수 있다는 점에 유의해야 한다. 성공적인 액적 형성을 시각화하기 위해 호일 플레이트 씰에 분주하여 테스트 액체 이송을 수행할 수 있습니다. 그러나 이 테스트는 제한된 정보를 제공하며 다른 설정의 물방울이 동일하게 나타날 수 있습니다. 타르트라진과 같은 수용성 염료의 사용은 주어진 설정 또는 워크플로우에서 정확한 부피가 분배되는지 보다 정확하게 확인하는 데 사용될 수 있습니다( 대표 결과 참조). 액체 이송의 최적 프로그래밍은 생성 된 데이터의 정확성과 일관성에도 영향을 줄 수 있습니다. 하나의 소스 웰에서 하나의 목적지 웰로의 >1μL 전사의 경우, 체계적 웰 간 변동성을 줄이기 위해 ≤1μL의 순차적 이송을 프로그래밍해야 한다는 것을 발견했습니다(그림 4). 마지막으로, 이론적 및 실제 소스 우물 죽은 부피는 소스 플레이트 유형, 액체 등급 설정 및 특정 액체의 구성 요소에 따라 크게 달라질 수 있습니다. 음향 액체 처리기 측량 기능을 사용하여 프로그램을 실행하기 전에 웰 부피를 평가하면 기기가 특정 액체를 얼마나 정확하게 측정할 수 있는지 측정하는 데 도움이 될 수 있습니다.
CFPS 반응 성능은 상이한 사용자, 재료의 배치, 플레이트 리더 및 실험실(41) 간의 결과를 비교할 때 변할 수 있다. 유전자 회로를 프로토타이핑하는 동안 이러한 비교가 필요한 경우, 실험 설정 전반에 걸쳐 결과를 정규화하는 데 도움이 되도록 각 반응 플레이트에 표준 구성 프로모터가 있는 내부 제어 반응을 포함하는 것이 좋습니다. DNA 준비 방법은 또한 CFPS 활성에 크게 기여할 수 있습니다. 에탄올 침전 단계를 포함하는 것이 좋습니다. 또한, 최적의 반응 조성은 추출물(34)의 배치에 의해 달라질 수 있다. 최적의 마그네슘 글루타메이트 및 칼륨 글루타메이트 농도는, 특히, 배치(42 ) 또는 사용된 프로모터 또는 리포터 단백질(24)에 의해 변하는 것으로 나타났다. 이러한 성분의 농도는 단백질 발현을 위한 최적 조건을 결정하기 위해 유전자 구축물 당 및 세포 추출물 제제당 각 성분의 여러 농도에 걸쳐 스크리닝함으로써 최적화되어야 합니다. 마지막으로, 일관된 CFPS 반응 성능을 위한 모범 사례에는 철저한 혼합, 신중한 피펫팅 및 각 시약 성분 준비의 일관성이 포함됩니다.
개별 부품의 특성화 외에도, 논리 회로(16) 또는 발진기(52, 53)와 같은 복잡한 회로를 형성하는 부품의 조합을 스크리닝하기 위해 동일한 방법이 사용될 수 있다. 이 방법은 역학 진단 54,55,56,57 또는 위험 감지 및 정량화3,58,59의 응용 분야를위한 바이오 센서를 스크리닝하고 최적화하는 데에도 적용 할 수 있습니다. 능동 학습(34)과 같은 AI 기반 기술의 적용은 또한 복잡한 생물학적 설계 공간의 신속한 탐색을 구동하기 위해 이 방법의 고처리량 특성과 결합될 수 있다. 궁극적으로, 우리는 합성 생물학에서 새로운 유전자 디자인의 개발 시간을 가속화하는 이 접근 방식을 구상하고 있습니다.
공개
RMM은 단백질 발현 및 스크리닝을 위해 이 기사에서 설명한 것과 같은 무세포 기술을 사용하는 민간 회사인 Tierra Biosciences에 재정적 지분을 보유하고 있습니다.
다른 저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 국방부 장관실의 과학 기술 우선 순위 발전 응용 연구 프로그램에 의해 가능했습니다. 사용된 sfGFP의 재고를 제공한 Scott Walper(해군 연구소)와 무세포 시스템을 사용한 프로토타이핑 및 음향 액체 취급의 관련 문제 해결과 관련된 유익한 토론을 해주신 Zachary Sun과 Abel Chiao(Tierra Biosciences)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2x YT medium | Sigma-Aldrich | Y2377-250G | Alternative to making 2xYT media |
| Agar | Bacto | 214010 | For plating cells |
| Chromatography column (5 cm diameter) | BIO-RAD | 731-1550 | Used for protein purification. |
| Destination plate | Thermo Scientific Nunc plate | 142761 | For CFPS reactions |
| DMSO | Sigma-Aldrich | D2650 | For dialysis buffer |
| DpnI | NEB | R0176L | For digestion of plasmid templates |
| DTT | Roche | 20871723 | S30 Buffer B |
| E. coli BL21(DE3) Rosetta2 | Novagen | 70954 | Cell line used for production of lysate and purified proteins |
| Echo acoustic liquid handler | Labcyte | 525 | Acoustic liquid handler |
| French pressure cell | Thermo Spectronic | FA-078 | For lysing cells for CFPS |
| Imidazole | Sigma-Aldrich | 56750 | For buffers |
| Impermeable plastic sealable lid | Thermo | 232702 | Plate seal |
| IPTG | RPI | I56000-25.0 | Used for protein induction. |
| K-Glu | Sigma-Aldrich | g1501-500G | S30 Buffer B |
| Labcyte Echo source plate | Labcyte | PL-05525 | For use with Echo acoustic liquid handler |
| Mg-Glu | Sigma-Aldrich | 49605-250G | S30 Buffer B |
| NaCl | Sigma-Aldrich | S7653-250G | For buffers |
| NaHPO4 | Sigma-Aldrich | 71505 | For dialysis buffer |
| NaOH | Mallinckrodt Chemicals | 7708-10 | For making 2xYT media. Currently not produced by Mallinckrodt. Alternate: Sigma-Aldrich S0899 |
| Ni-NTA resin | Invitrogen | R901-15 | For production of purified proteins |
| PCR H2O | Ambion | AM9937 | PCR of linear templates |
| Plate Reader | BioTek | H10 | Plate reader used |
| Q5 PCR Master Mix | NEB | M0494S | PCR of linear templates |
| QIAquick Gel Extraction Kit | Qiagen | 28606 | PCR of linear templates |
| QIAquick PCR Purification Kit | Qiagen | 28004 | PCR of linear templates |
| QSonica Ultrasonic Processor | Qsonica | Q700 | Cell disruption during protein purification |
| RTS Amino Acid Sampler | biotechrabbit | BR1401801 | Updated supplier from Sun et al. |
| Tris | MP | 819623 | S30 Buffer B |
| Tris-Cl | Sigma-Aldrich | T5941 | For buffers |
| Tryptone | Fluka | T7293 | For making 2xYT media |
| Yeast Extract | Bacto | 212750 | For making 2xYT media |
참고문헌
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nature Reviews. Molecular Cell Biology. 10 (6), 410-422 (2009).
- Saltepe, B., Kehribar, E. &. #. 3. 5. 0. ;., Su Yirmibeşoǧlu, S. S., Şafak Şeker, U. &. #. 2. 1. 4. ;. Cellular biosensors with engineered genetic circuits. ACS Sensors. 3 (1), 13-26 (2018).
- Bereza-Malcolm, L. T., Mann, G., Franks, A. E. Environmental sensing of heavy metals through whole cell microbial biosensors: A synthetic biology approach. ACS Synthetic Biology. 4 (5), 535-546 (2015).
- Mimee, M., et al. An ingestible bacterial-electronic system to monitor gastrointestinal health. Science. 360 (6391), 915-918 (2018).
- Isabella, V. M., et al. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nature Biotechnology. 36 (9), 857-867 (2018).
- Healy, C. P., Deans, T. L. Genetic circuits to engineer tissues with alternative functions. Journal of Biological Engineering. 13, 39 (2019).
- Kaushik, A., Tiwari, S., Dev Jayant, R., Marty, A., Nair, M. Towards detection and diagnosis of Ebola virus disease at point-of-care. Biosensors and Bioelectronics. 75, 254-272 (2016).
- Jagadevan, S., et al. Recent developments in synthetic biology and metabolic engineering in microalgae towards biofuel production. Biotechnology for Biofuels. 11, 185 (2018).
- Keating, K. W., Young, E. M. Synthetic biology for bio-derived structural materials. Current Opinion in Chemical Engineering. 24, 107-114 (2019).
- Smanski, M. J., et al. Synthetic biology to access and expand nature's chemical diversity. Nature Reviews Microbiology. 14 (3), 135-149 (2016).
- Xiang, Y., Dalchau, N., Wang, B. Scaling up genetic circuit design for cellular computing: advances and prospects. Natural Computing. 17 (4), 833-853 (2018).
- Galdzicki, M., Rodriguez, C., Chandran, D., Sauro, H. M., Gennari, J. H. Standard biological parts knowledgebase. PLoS One. 6 (2), 17005 (2011).
- Kelwick, R., Bowater, L., Yeoman, K. H., Bowater, R. P. Promoting microbiology education through the iGEM synthetic biology competition. FEMS Microbiology Letters. 362 (16), (2015).
- Torella, J. P., et al. Unique nucleotide sequence-guided assembly of repetitive DNA parts for synthetic biology applications. Nature Protocols. 9 (9), 2075-2089 (2014).
- Halleran, A. D., Swaminathan, A., Murray, R. M. Single day construction of multigene circuits with 3G assembly. ACS Synthetic Biology. 7 (5), 1477-1480 (2018).
- Nielsen, A. K., et al. Genetic circuit design automation. Science. 352 (6281), (2016).
- Canton, B., Labno, A., Endy, D. Refinement and standardization of synthetic biological parts and devices. Nature Biotechnology. 26 (7), 787-793 (2008).
- Boehm, C. R., Bock, R. Recent advances and current challenges in synthetic biology of the plastid genetic system and metabolism. Plant Physiology. 179 (3), 794-802 (2019).
- Takahashi, M. K., et al. Characterizing and prototyping genetic networks with cell-free transcription-translation reactions. Methods. 86, 60-72 (2015).
- Chappell, J., Watters, K. E., Takahashi, M. K., Lucks, J. B. A renaissance in RNA synthetic biology: New mechanisms, applications and tools for the future. Current Opinion in Chemical Biology. 28, 47-56 (2015).
- Endy, D. Foundations for engineering biology. Nature. 438 (7067), 449-453 (2005).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: an expanded repertoire of applications. Nat. Reviews. Genetics. 21 (3), 151-170 (2020).
- Dopp, J. L., Rothstein, S. M., Mansell, T. J., Reuel, N. F. Rapid prototyping of proteins: Mail order gene fragments to assayable proteins within 24 hours. Biotechnology and Bioengineering. 116 (3), 667-676 (2019).
- Garamella, J., Marshall, R., Rustad, M., Noireaux, V. The all E. coli TX-TL toolbox 2.0: A platform for cell-free synthetic biology. ACS Synthetic Biology. 5 (4), 344-355 (2016).
- Kopniczky, M. B., et al. Cell-free protein synthesis as a prototyping platform for mammalian synthetic biology. ACS Synthetic Biology. 9 (1), 144-156 (2020).
- Kelwick, R., et al. Cell-free prototyping strategies for enhancing the sustainable production of polyhydroxyalkanoates bioplastics. Synthetic Biology. 3 (1), (2018).
- Karim, A. S., et al. In vitro prototyping and rapid optimization of biosynthetic enzymes for cell design. Nature Chemical Biology. 16 (8), 912-919 (2020).
- Takahashi, M. K., et al. Rapidly characterizing the fast dynamics of RNA genetic circuitry with cell-free Transcription-Translation (TX-TL) systems. ACS Synthetic Biology. 4 (5), 503-515 (2015).
- Chappell, J., Jensen, K., Freemont, P. S. Validation of an entirely in vitro approach for rapid prototyping of DNA regulatory elements for synthetic biology. Nucleic Acids Research. 41 (5), 3471-3481 (2013).
- Borkowski, O., et al. Cell-free prediction of protein expression costs for growing cells. Nature Communications. 9 (1), 1457 (2018).
- Dudley, Q. M., Karim, A. S., Nash, C. J., Jewett, M. C. In vitro prototyping of limonene biosynthesis using cell-free protein synthesis. Metabolic Engineering. 61, 251-260 (2020).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- Sun, Z. Z., Yeung, E., Hayes, C. A., Noireaux, V., Murray, R. M. Linear DNA for rapid prototyping of synthetic biological circuits in an escherichia coli based TX-TL cell-free system. ACS Synthetic Biology. 3 (6), 387-397 (2014).
- Borkowski, O., et al. Large scale active-learning-guided exploration for in vitro protein production optimization. Nature Communications. 11 (1), 1872 (2020).
- Caschera, F., et al. High-throughput optimization cycle of a cell-free ribosome assembly and protein synthesis system. ACS Synthetic Biology. 7 (12), 2841-2853 (2018).
- Iyer, S., Karig, D. K., Norred, S. E., Simpson, M. L., Doktycz, M. J. Multi-input regulation and logic with T7 promoters in cells and cell-free systems. PLoS One. 8 (10), 78442 (2013).
- Karig, D. K., Iyer, S., Simpson, M. L., Doktycz, M. J. Expression optimization and synthetic gene networks in cell-free systems. Nucleic Acids Research. 40 (8), 3763-3774 (2012).
- Jung, J. K., et al. Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnology. 38 (12), 1451-1459 (2020).
- Bailey, J., Eggenstein, E., Lesnick, J. Miniaturization and rapid processing of TXTL reactions using acoustic liquid handling. Labcyte Technical Note. , 1-12 (2018).
- Marshall, R., Garamella, J., Noireaux, V., Pierson, A. High-throughput microliter-sized cell-free transcription-translation reactions for synthetic biology applications using the echo 550 liquid handler. Labcyte Application Note. , 1-6 (2018).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Dopp, J. L., Tamiev, D. D., Reuel, N. F. Cell-free supplement mixtures: Elucidating the history and biochemical utility of additives used to support in vitro protein synthesis in E. coli extract. Biotechnology Advances. 37 (1), 246-258 (2019).
- Cole, S. D., Miklos, A. E., Chiao, A. C., Sun, Z. Z., Lux, M. W. Methodologies for preparation of prokaryotic extracts for cell-free expression systems. Synthetic and Systems Biotechnology. 5 (4), 252-267 (2020).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of Biotechnology. 110 (3), 257-263 (2004).
- Marshall, R., Maxwell, C. S., Collins, S. P., Beisel, C. L., Noireaux, V. Short DNA containing χ sites enhances DNA stability and gene expression in E. coli cell-free transcription-translation systems. Biotechnology and Bioengineering. 114 (9), 2137-2141 (2017).
- Yim, S. S., Johns, N. I., Noireaux, V., Wang, H. H. Protecting linear DNA templates in cell-free expression systems from diverse bacteria. ACS Synthetic Biology. 9 (10), 2851-2855 (2020).
- Zhu, B., et al. Increasing cell-free gene expression yields from linear templates in Escherichia coli and Vibrio natriegens extracts by using DNA-binding proteins. Biotechnology and Bioengineering. 117 (12), 3849-3857 (2020).
- Tuckey, C., Asahara, H., Zhou, Y., Chong, S. Protein synthesis using a reconstituted cell-free system. Current Protocols in Molecular Biology. 108, 1-22 (2014).
- Hoffman, R. A., Wang, L., Bigos, M., Nolan, J. P. NIST/ISAC standardization study: Variability in assignment of intensity values to fluorescence standard beads and in cross calibration of standard beads to hard dyed beads. Cytometry. Part A. 81 (9), 785-796 (2012).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical Review Letters. 106 (4), 048104 (2011).
- Rossi, N. A., Dunlop, M. J. Making waves with synthetic oscillators. Cell Systems. 6 (4), 406-407 (2018).
- Niederholtmeyer, H., et al. Rapid cell-free forward engineering of novel genetic ring oscillators. eLife. 4, 09771 (2015).
- Chang, H., Voyvodic, P. L., Structurale, C. D. B. Microbially derived biosensors for diagnosis, monitoring and epidemiology. Microbial Biotechnology. 10 (5), 1031-1035 (2017).
- Pardee, K., et al. low-cost detection of Zika virus using programmable biomolecular components. Cell. 165 (5), 1255-1266 (2016).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Liu, X., Germaine, K. J., Ryan, D., Dowling, D. N. Whole-cell fluorescent biosensors for bioavailability and biodegradation of polychlorinated biphenyls. Sensors. 10 (2), 1377-1398 (2010).
- Gautam, P., Suniti, S., Amrita, K., Madathil, D., Nair, B. A Review on Recent Advances in Biosensors for Detection of Water Contamination. International Journal of Environmental Sciences. 2 (3), 1565-1574 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유