Method Article
Быстрая характеристика генетических частей с помощью бесклеточных систем
В этой статье
Резюме
Хорошо охарактеризованные генетические части необходимы для разработки новых генетических схем. Здесь мы описываем экономически эффективный, высокопроизводительный метод быстрой характеристики генетических частей. Наш метод сокращает затраты и время за счет объединения бесклеточных лизатов, линейной ДНК, чтобы избежать клонирования, и обработки акустической жидкости для увеличения пропускной способности и уменьшения объемов реакции.
Аннотация
Характеристика и каталогизация генетических частей имеют решающее значение для разработки полезных генетических схем. Наличие хорошо охарактеризованных частей позволяет точно настроить генетические схемы, так что их функция приводит к предсказуемым результатам. С ростом синтетической биологии как области произошел взрыв генетических схем, которые были реализованы в микробах для выполнения функций, относящихся к зондированию, метаболическим изменениям и клеточным вычислениям. Здесь мы показываем быстрый и экономически эффективный метод характеристики генетических частей. Наш метод использует бесклеточный лизат, приготовленный собственными силами в качестве среды для оценки частей посредством экспрессии репортерного белка. Шаблон ДНК получают путем амплификации ПЦР с использованием недорогих праймеров для добавления вариантных частей к репортерскому гену, а шаблон добавляют в реакцию в виде линейной ДНК без клонирования. Части, которые могут быть добавлены таким образом, включают промоутеры, операторы, сайты связывания рибосом, изоляторы и терминаторы. Такой подход в сочетании с включением акустического жидкостного погрузчика и плит на 384 скважины позволяет пользователю проводить высокопроизводительные оценки генетических деталей за один день. Для сравнения, клеточные подходы к скринингу требуют трудоемкого клонирования и имеют более длительное время тестирования из-за ночных этапов нормализации культуры и плотности культуры. Кроме того, работа в бесклеточном лизате позволяет пользователю более жестко контролировать условия экспрессии путем добавления экзогенных компонентов и ДНК в точных концентрациях. Результаты, полученные в результате бесклеточного скрининга, могут быть использованы непосредственно в приложениях бесклеточных систем или, в некоторых случаях, как способ прогнозирования функции в целых клетках.
Введение
Основные усилия синтетической биологии заключаются в разработке наборов генетических инструментов, содержащих хорошо охарактеризованные части, которые могут быть использованы для построения генетических схем1, которые выполняют полезные функции при развертывании в микробах или бесклеточных лизатах. Области, в которых такие генетические схемы набрали обороты: зондирование 2,3,4, производительность человека 5,6, биотопливо 7,8, производство материалов 9,10 и клеточные вычисления11. Реестры стандартизированных генетических частей были созданы12 для каталогизации новых и существующих частей по категориям, таким как промоутеры, операторы, кодирующие последовательности и терминаторы, и это лишь некоторые из них. Такие усилия, как iGEM (международный конкурс генетически модифицированных машин)13, сыграли важную роль в характеристике и каталогизации этих генетических частей. Было разработано много методов, облегчающих быструю сборку этих деталей в полезные генетическиесхемы 14,15. Программное обеспечение даже было разработано для автоматизации композиции хорошо охарактеризованных частей в схемы, которые достигают желаемой функции16. Однако сборка полезных генетических схем с предсказуемыми функциями основывается на предположении, что наборы генетических инструментов содержат хорошо охарактеризованные генетические части. Из-за необходимости этих наборов инструментов для развития синтетической биологии были описаны многочисленные усилия по улучшению каталогизации схем и деталей с соответствующими характеристиками 17,18,19,20,21.
Один из подходов к характеристике генетических компонентов использует бесклеточные системы синтеза белка (CFPS), которые воссоздают клеточные функции, такие как транскрипция и трансляция ex vivo22. Несколько исследований продемонстрировали потенциал CFPS для прототипирования генетических компонентов 23,24,25,26,27,28,29,30,31,32, будь то для прямого применения в бесклеточных системах или для прогнозирования функции генетических конструкций в клетках, таких как относительная активность частей в библиотеке 29 , оптимизация метаболического пути27 и клеточной нагрузки30. Преимущества прототипирования в CFPS по сравнению с клетками, подчеркнутые этими исследованиями, включают в себя избежание трудоемкого клонирования, точный контроль над концентрацией ДНК и других компонентов реакции и способность легко смешивать и сопоставлять несколько конструкций ДНК. Преимущество избегания клонирования особенно очевидно при использовании линейных шаблонов ДНК, что позволяет собирать новые конструкции методами in vitro, которые занимают часы вместо33 дней. Возможность манипулировать концентрацией конструкций ДНК и других компонентов просто путем пипетирования делает этот подход еще более привлекательным, позволяя проводить эксперименты с высокой пропускной способностью на основе роботов для обработки жидкостей34,35. Хотя сообщалось об успехах использования CFPS для прототипирования, важно отметить, что еще предстоит увидеть, в каких контекстах результаты CFPS могут надежно предсказать функциональность в клетках.
Здесь мы представляем метод прототипирования CFPS, который подчеркивает преимущества в скорости, пропускной способности и стоимости по сравнению с традиционными подходами на основе ячеек. Этот подход основан на нашей предыдущей работе, где мы использовали CFPS для быстрой характеристики библиотеки вариантов промотора T7, регулируемых фактором транскрипции TetR32, значительно расширяя небольшую горстку регулируемых вариантов промотора T7, которые были доступны в литературе в то время36,37. С тех пор другие еще больше расширили круг таких промоутеров38. В нашем методе сборка генетической конструкции ускоряется с помощью ПЦР для амплификации шаблонной ДНК с помощью праймеров, которые добавляют вариантные генетические части к гену-репортеру. Акустическая обработка жидкости в 384-скважинных плитах используется для увеличения пропускной способности и уменьшения объема необходимых материалов. Предыдущая работа продемонстрировала успешное использование акустической обработки жидкостей при значительно меньших объемах39,40 с изменчивостью, сопоставимой с ручным пипетированием больших объемов41. В дополнение к методу, мы предоставляем информацию об устранении неполадок и оценку потенциальных затрат и экономии времени. Обратите внимание, что, хотя мы включаем здесь протокол для производства бесклеточных лизатов на основе Sun et al.42, многие другие коммерческие наборы и протоколы43,44 также должны работать. Аналогичным образом, в то время как мы демонстрируем метод характеристики вариантовпромотора 32, другие части могут быть заменены амплификацией ПЦР, такие как риборегуляторы, сайты связывания рибосом (RBS), изоляторы, белковые метки и терминаторы. Мы надеемся, что эта методология может помочь сообществу синтетической биологии продолжать увеличивать количество характерных деталей для сборки предсказуемых генетических цепей с полезной функцией.
протокол
1. Приготовление клеточного экстракта
- Подготовка СМИ
- Для среды 2xYT: добавьте 16 г триптона, 10 г дрожжевого экстракта и 5 г NaCl до 900 мл деионизированной воды и отрегулируйте рН до 7,0 с 5 М NaOH. Увеличьте объем раствора до 1 л с помощью деионизированной воды и автоклава или фильтра стерилизуют. Кроме того, можно приобрести носители 2xYT.
- Для буфера S30B: Приготовьте раствор из 14 мМ Mg-глутамата, 60 мМ K-глутамата и 5 мМ Tris в 2 л деионизированной воды. Используйте 2 M Tris для регулировки pH до 8,2, автоклав и храните при 4 °C. Завершите раствор добавлением дитиотрейтола (DTT) до конечной концентрации 1 мМ непосредственно перед использованием.
- Подготовка клеток
- Полоса клеток Escherichia coli BL21(DE3) Rosetta2 или другой клеточной линии выбора (см. Cole et al.44 для недавнего всестороннего обзора) на агаровой пластине LB (Lysogeny Broth) и инкубация при 37 °C в течение 10-14 ч.
- Используйте одну колонию кишечной палочки для прививки 3 мл среды 2xYT в культуральной трубке объемом 10 мл. Инкубируют эту трубку при 37 °C с встряхиванием при 250 об/мин в течение 8 ч.
- Используйте 50 мкл из культуры 3 мл для прививки 50 мл среды 2xYT в колбу объемом 500 мл. Инкубируют эту колбу при 37 °C с встряхиванием при 250 об/мин в течение 8 ч.
- Используйте 7,5 мл из культуры 50 мл, чтобы привить каждую из четырех 4-литровых сбитых колб, содержащих 0,75 л среды 2xYT. Инкубируют эти колбы при 37 °C с встряхиванием при 220 об/мин до тех пор, пока они не достигнут оптической плотности при 600 нм от 2 до 4, примерно через 3-4 ч.
- Соберите клетки из каждой колбы, переместив их в контейнеры объемом 1 л и центрифугируя при 5000 х г в течение 12 мин при 4 °C. Выбросьте супернатант, декантируя его в контейнер для отходов.
- Промыть каждую ячейку гранулой 150 мл ледяного буфера S30B, полностью повторно развернув их с помощью пипетки, чтобы разрушить клеточную массу, а затем снова собрать клетки центрифугированием при 5000 х г в течение 12 мин. Выбросьте супернатант.
- Снова промыть каждую ячейку гранулы в 40 мл ледяного буфера S30B, полностью повторно развернув их и разрушив клеточную массу с помощью пипетки. Переложите ячейки в предварительно взвешенные конические трубки объемом 50 мл и снова соберите клетки центрифугированием при 2000 х г в течение 8 мин при 4 °C. Отбросьте супернатант путем декантирования.
- Взвесьте влажные ячейки гранул. Мгновенно заморозьте гранулы клеток, поместив трубки непосредственно в жидкий азот и храня при -80 °C.
- Лизис клеток
- Разморозьте гранулы клеток на льду.
- Повторно суспендировать каждую ячейку гранулы в 1,4 мл буфера S30B на 1 г ячейки гранулы путем вихря.
- Лизируйте ячейки французской ячейкой давления при 640 фунтов на квадратный дюйм при 4 °C. Соберите лизат в микроцентрифужные трубки на льду и добавьте 3 мкл 1 М DTT на 1 мл лизата сразу после лизиса.
ПРИМЕЧАНИЕ: Лучше всего использовать французский пресс-клапан с небольшим металлическим стержнем, чтобы поддерживать равномерное давление и избегать резких перепадов давления. - Очистите лизат центрифугированием при 30 000 х г в течение 30 мин при 4 °C и выбросьте гранулу после пипетки супернатанта в новую ледяную микроцентрифужную трубку, заботясь о том, чтобы не нарушить гранулу.
- Центрифугируйте супернатант во второй раз при 30 000 х г в течение 30 мин при 4 °C. Пипетка полученного супернатанта в ледяную микроцентрифужную трубку. Выбросьте гранулу.
- Высиживать супернатант на водяной бане при температуре 37 °C в течение 1 ч.
- Очистите супернатант центрифугированием при 15 000 х г в течение 15 мин при 4 °C и перенесите полученный супернатант в ледяную микроцентрифужную трубку, следя за тем, чтобы не нарушить гранулу.
- Центрифугируйте супернатант во второй раз при 15 000 х г в течение 15 мин при 4 °C и перенесите полученный супернатант в ледяную микроцентрифужную трубку, стараясь не нарушить оставшуюся гранулу.
- Распределите супернатант в аликвотах по 100 мкл в микроцентрифужные трубки объемом 1,5 мл и заморозьте их, поместив непосредственно в жидкий азот. Храните супернатант при -80 °C.
2. Линейная подготовка шаблона
- Конструкция грунтовки
- Выберите основную последовательность в качестве шаблона ПЦР. Включите как минимум репортерную последовательность, такую как sfGFP (суперпапка Зеленый флуоресцентный белок), LacZ или аптамер шпината. Включите другие части, которые будут исправлены в экранированных вариантах, таких как терминаторы, промоутеры или RBS, в зависимости от дизайна.
ПРИМЕЧАНИЕ: Включение терминатора не всегда требуется для экспрессии из линейной ДНК в бесклеточных системах. - Для прямых праймеров выберите минимум 20 bp, соответствующий 5ʹ концу основной последовательности в качестве 3ʹ конца праймера. При добавлении частей к 5-дюймовому концу конструкции спроектируйте оставшуюся часть 5-дюймового конца праймера, чтобы добавить генетические части, представляющие интерес, в основную последовательность с помощью амплификации ПЦР (рисунок 1A и рисунок 2).
ПРИМЕЧАНИЕ: Поскольку грунтовки выше ~ 60 bp часто значительно увеличиваются в стоимости, несколько перекрывающихся грунтовок могут быть спроектированы для добавления более длинных последовательностей или нескольких частей. В то время как несколько праймеров могут быть использованы в одной реакции ПЦР, рекомендуется выполнить несколько раундов ПЦР. - Для обратных праймеров выберите минимум 20 bp, чтобы соответствовать 3′-концу основной последовательности как 3ʹ концу праймера. При добавлении частей к 3'-концу конструкции спроектируйте оставшуюся часть 5-дюймового конца праймера, чтобы добавить генетические части, представляющие интерес, к основной последовательности с помощью амплификации ПЦР (рисунок 1A и рисунок 2). Убедитесь, что температура отжига обратной грунтовки находится в пределах 5 °C от температуры отжига всей прямой грунтовки.
- Выберите основную последовательность в качестве шаблона ПЦР. Включите как минимум репортерную последовательность, такую как sfGFP (суперпапка Зеленый флуоресцентный белок), LacZ или аптамер шпината. Включите другие части, которые будут исправлены в экранированных вариантах, таких как терминаторы, промоутеры или RBS, в зависимости от дизайна.
- Линейное усиление шаблона
- Определите количество реакций ПЦР, которые должны быть выполнены, на основе количества последовательностей ядра и рассчитайте количество каждого необходимого компонента, используя таблицу 1.
- Подготовьте мастер-микс согласно таблице 1 и храните его на льду. Aliquot 30 или 40 мкл (см. Таблицу 1) основной смеси в определенное число пробирок ПЦР и добавляют 10 мкл каждого переменного праймера (т.е. праймеров, кодирующих изменение детали, см. Таблицу 1) при 5 мкМ к соответствующим маркированным пробиркам ПЦР.
- Поместите трубки ПЦР в термоциклер и запустите следующую программу ПЦР: 98 °C в течение 3 мин; 30 циклов при 98 °C в течение 15 с, XX °C в течение 20 с, 72 °C для YY мин; окончательное наращивание при 72 °C в течение 10 мин. Затем проведите реакцию при 4 °C.
Где XX представляет температуру отжига грунтовки с более низкой температурой отжига, а YY представляет время растяжения, рассчитанное для длины ампликона на основе рекомендаций производителя для используемой высокоточной полимеразы. Оптимизируйте эти условия по мере необходимости для различных грунтовок и/или шаблонов. - (Необязательно) Добавьте 1 мкл фермента рестрикции DpnI для переваривания исходного шаблона. Инкубируют реакцию при 37 °C в течение 1 ч. Выполняйте этот шаг только в том случае, если исходным шаблоном является плазмидная ДНК.
- Анализируйте 5 мкл каждого продукта ПЦР методом гелевого электрофореза. Отделите средство с помощью 1% агарозного геля при 180 В в течение 20 мин. Проверьте правильный размер полосы, который будет варьироваться в зависимости от выбранной последовательности ядра и длины добавленных частей.
- Очистите линейный шаблон с помощью коммерческого набора для очистки ПЦР или предпочтительным методом очистки ПЦР. Если при анализе электрофореза геля присутствовало несколько полос, либо оптимизируйте условия ПЦР, либо очистите правильные молекулярно-весовые полосы с помощью коммерческого набора для экстракции геля в соответствии с рекомендацией производителя.
- Количественно оцените каждый шаблон ДНК с помощью спектрофотометра. Оцените качество шаблона ДНК, проверив, что соотношение 260 нм/280 нм составляет примерно 1,8.
- (Необязательно) Снова отделите часть шаблона ДНК, используя 1% агарозный гель при 180 В в течение 20 минут и убедитесь, что все нежелательные полосы были удалены во время очистки шаблона.
- Немедленно используйте очищенные шаблоны ДНК или храните при -20 °C.
3. Очищенный белковый препарат
- Экспрессия белка
- Для каждого экспрессируемого белка соберите соответствующую конструкцию экспрессии. Кодон-оптимизация гена для экспрессии у E. coli. Вставьте ген в вектор экспрессии pET-22b или другой соответствующий вектор экспрессии с помощью предпочтительного метода сборки плазмид. Преобразуйте плазмиду экспрессии в клетки экспрессии BL21(DE3) Rosetta2 или другую соответствующую клеточную линию.
- Для каждого белка используйте одну колонию для прививки 3 мл среды LB в культуральной трубке объемом 10 мл. Инкубируйте эти трубки при 37 °C с встряхиванием при 250 об/мин в течение ночи.
- Инокулируют колбу объемом 2 л, содержащую 750 мл среды LB, 1 мл ночной культуры. Инкубируют эти колбы при 37 °C с встряхиванием при 250 об/мин до тех пор, пока они не достигнут OD600 0,6-1,0.
- Индуцируют экспрессию белка путем добавления 0,75 мл 1 М изопропил β-D-1-тиогалакопиранозида (IPTG) в воде в каждую колбу и продолжают инкубировать эти колбы при 37 °C с встряхиванием при 250 об/мин в течение 4 ч.
- Соберите клетки из каждой колбы, используя бутылку центрифуги объемом 1 л, путем центрифугирования при 5000 х г в течение 12 мин. Выбросьте супернатант.
- Переложите гранулы в коническую трубку объемом 50 мл и взвесьте каждую гранулу. Во вспышке заморозьте клетки в жидком азоте и храните их при -80 °C или переходите к этапу 3.2.
ПРИМЕЧАНИЕ: Ожидается, что на этом этапе будет получено 2-5 г клеток на 0,75 мл.
- Очистка белка с помощью колоночной хроматографии с аффинности никеля
- Подготовьте буфер лизиса, объединив 50 мМ Tris-Cl, 500 мМ NaCl и 5 мМ имидазола. Отрегулируйте pH 8.0.
- Подготовьте промывочный буфер, объединив 50 мМ Tris-Cl, 500 мМ NaCl и 25 мМ имидазола. Отрегулируйте pH 8.0.
- Подготовьте буфер элюирования, объединив 50 мМ Tris-Cl, 500 мМ NaCl и 250 мМ имидазола. Отрегулируйте pH 8.0.
- Подготовьте диализный буфер, комбинируя 50 мМ NaHPO4, 100 мМ NaCl и 2% DMSO. Отрегулируйте pH 7,5.
- Разморозьте гранулы клеток, поместив трубки в воду комнатной температуры. Добавляют 5 мл лизисного буфера на 1 г клеточной гранулы и повторно суспендируют путем вихря.
- Лизируйте клетки ультразвуком. Отделите гомогенат ячейки так, чтобы на коническую трубку 50 мл приходилось не более 30 мл, и держите каждую трубку на льду. Лизируйте клетки с помощью ультразвукового аппарата с зондом диаметром 0,16 см в раундах 15 с с разрывами 30 с, 10 раз.
ПРИМЕЧАНИЕ: Избегайте пенообразования, так как это денатурирует белок. Образования пены можно избежать, если держать наконечник ультразвукового аппарата по крайней мере на 2/3 погруженным в лизат во время его работы. Возможны и другие методы лизиса клеток, кроме обработки ультразвуком44. - Очистите лизат центрифугированием при 15 000 х г в течение 30 мин при 4 °C и поместите супернатант в новую коническую трубку объемом 50 мл.
- Добавьте 1 мл никель-нитрилотриаценовой кислоты (Ni-NTA) смолы на каждые 5 мл надосадочного вещества. Разделите клеточный лизат/Ni-NTA суспензию так, чтобы на коническую трубку объемом 50 мл приходилось не более 36 мл. Инкубировать при 4 °C на трубчатом ротаторе при 10 об/мин в течение 1 ч.
- Загрузите смолу путем декантирования клеточного лизата / Ni-NTA суспензии в столб хроматографии с объемом 2 мл и соберите элюант, если это необходимо для дальнейшего анализа, в противном случае выбросьте. Промыть смолу с 10 объемами промывочного слоя слоя.
- Соберите белок, добавив три объема смоляного слоя буфера элюирования в колонку и сконцентрируйте объем до 1,5 мл с использованием центробежного концентратора с соответствующей молекулярной массой отсечной мембраны для каждого белка.
- Диализ белка против 2 л диализного буфера при 4 °C в течение 1 ч. Снова диализуйте белок против 2 л диализного буфера в течение ночи при 4 °C.
- Количественно оцените белок, используя его коэффициент молярного вымирания и поглощение при 280 нм. Проанализируйте белок на чистоту, разделив его с помощью электрофореза додецилсульфата натрия полиакриламидного геля (SDS-PAGE). Хранить белок при -80 °C.
4. Бесклеточный синтез белка
- Приготовление реакционной смеси ХФПС
- Приготовьте смесь добавок, выполнив этапы приготовления раствора аминокислот, приготовления энергетического раствора и буферного приготовления в Sun et al.42. Хранить отдельно или в сочетании при -80 °C в аликвотах. Убедитесь, что конечные концентрации соответствуют тем, которые описаны в Sun et al.42 в разделе «Экспериментальное выполнение реакции TX-TL».
- Приготовьте добавку для защиты линейной ДНК от деградации. Если вы используете GamS33,45, подготовьтесь с помощью шагов, описанных в разделе 3 выше, или получите от коммерческого поставщика; для других подходов проверьте соответствующую литературу 46,47,48. В качестве альтернативы можно использовать систему CFPS, которая не требует присадок49.
- Получают Т7-полимеразу, белки-репрессоры и другие добавки, используя этапы, описанные в разделе 3 выше, или получают от коммерческого поставщика.
- Определите количество реакций CFPS, которые должны быть выполнены, и рассчитайте количество каждого необходимого компонента, используя таблицу 2. Модифицируйте концентрации компонентов, включая добавление или удаление компонентов по мере необходимости, и регулируйте количество воды таким образом, чтобы конечный объем каждой реакционной смеси всегда составлял 10 мкл. Аналогичным образом, модифицируйте мастер-микс, чтобы облегчить дозирование других компонентов путем обработки акустической жидкости по желанию (см. раздел «Обсуждение »).
- Разморозьте все компоненты на льду и приготовьте мастер-микс, перемешав каждый компонент, как рассчитано выше. Тщательно перемешайте все компоненты пипеткой. Обратите пристальное внимание, чтобы избежать осаждения, особенно для аминокислотной смеси. Держите мастер-микс на льду.
- Охладите 384-луночную пластину на льду и распределите мастер-микс в 9 мкл аликвот в каждую лунку.
ПРИМЕЧАНИЕ: Эти компоненты можно распределить путем обработки акустической жидкости, хотя следует позаботиться о том, чтобы обеспечить надлежащее дозирование (см. раздел Обсуждение для устранения неполадок).
- Распределение дополнительных компонентов при обработке акустической жидкости
- Рассчитайте количество белка-репрессора (и других дополнительных компонентов), необходимое для всех реакций CFPS.
- Разморозьте белок репрессора на льду и распределите его в акустическую пластину источника жидкости или другую соответствующую пластину. Убедитесь, что включено соответствующее количество мертвого объема, необходимого для типа используемой исходной пластины.
- Распределите белок-репрессор в объемах 1 мкл в соответствующие скважины через жидкостный обработчик. Дополнительные сведения об устранении неполадок при распространении см. в разделе Обсуждение .
- Стандартные кривые
- Включите последовательное разбавление очищенного репортера (см. раздел 3 для очистки белка)41 или соответствующий химический стандарт50 на пластине, чтобы обеспечить сравнение результатов с другими исследованиями и другими лабораториями. Выберите диапазон концентраций, соответствующий используемому репортеру, и ожидаемый диапазон выражения экспериментов.
- Запуск реакций CFPS
- Предварительно прогрейте пластинчатый считыватель до 30 °C. Настройте устройство чтения пластин на чтение в настройках, соответствующих репортеру, используемому в основной последовательности, без шагов встряхивания.
ПРИМЕЧАНИЕ: В то время как здесь используется 30 ° C, 29 ° C и 37 ° C также широко используются и хорошо работают с этим протоколом. Другие температуры могут быть предпочтительными для альтернативных бесклеточных реакционных препаратов. Для интервалов чтения 10 минут достаточно для достижения хорошего разрешения для репрезентативных данных, представленных здесь; однако другие разрешения могут быть лучше в зависимости от репортерного белка и конкретного рецепта CFPS. - (Необязательно) Сначала запустите тестовую реакцию, чтобы установить соответствующую настройку усиления или чувствительности для фиксации изменения флуоресценции без переполнения сигнала.
- Запечатайте 384-луночную пластину непроницаемой пластиковой герметичной крышкой для предотвращения испарения. Если возможно, на приборе установите вертикальный градиент температуры 1 °C для ограничения конденсации на уплотнении. Поместите 384-луночную пластину на держатель пластины и начните чтение.
- Предварительно прогрейте пластинчатый считыватель до 30 °C. Настройте устройство чтения пластин на чтение в настройках, соответствующих репортеру, используемому в основной последовательности, без шагов встряхивания.
Результаты
Чтобы продемонстрировать полезность наших методов, мы представляем результаты, которые описывают влияние близости последовательности тетО к промотору Т7 на регуляцию экспрессии, управляемой T7 RNAP. Полные результаты и их последствия можно найти в работе McManus et al.32. Рабочий процесс описан на рисунке 1. Пятнадцать линейных шаблонов, варьирующихся только на расстоянии промотора T7 относительно последовательности тетО , были подготовлены методом ПЦР-амплифицирующего репортер sfGFP праймерами, предназначенными для добавления каждого варианта промотора (рисунок 2), как описано в разделе 2 протокола. Реакционные компоненты и реакции CFPS были приготовлены в соответствии с протоколом. Экспрессию sfGFP измеряли из каждого шаблона с титрованием 12 различных концентраций белка TetR в трех экземплярах с использованием акустического жидкостного обработчика. При 36 реакциях CFPS на шаблон и 15 шаблонах было выполнено в общей сложности 540 реакций для всего набора комбинаций T7-tetO . Вся оценка проводилась на двух пластинах в двух пластинчатых считывателях. Анализ этих данных показал, что T7 RNAP понижает экспрессию, управляемую T7, в равной степени до 13 bp вниз по течению от начала транскрипта T7 (рисунок 3). Этот результат имеет значение для будущего проектирования регулируемых генных цепей, управляемых Т7, описывая предполагаемое окно для эффективного подавления Т7 другими репрессорами. Сравнение результатов описанного здесь протокола с ДНК, полученной путем традиционного клонирования, выявило небольшую, но статистически значимую разницу в степени подавления TetR между форматами. Мы предположили, что неспецифическое связывание TetR с векторной ДНК может объяснить наблюдаемую разницу. Экспериментальные результаты показали, что добавление линейной векторной ДНК к реакциям с линейной шаблонной ДНК уменьшало разницу до нестатистической значимости, хотя это не исключало вклада других факторов, таких как различия в периодичности спирали ДНК для линейных и круговых форматов, что, в свою очередь, могло повлиять на связывание TetR. В зависимости от приложения использование линейного шаблона может потребовать дополнительной проверки.
Кроме того, мы приводим репрезентативные данные о потенциальных проблемах с точным дозированием с использованием акустической обработки жидкостей (рисунок 4). Раствор 1x фосфатного буферного физиологического раствора (PBS), рН 7,4, содержащий 0,25 мМ тартразинового красителя, был использован для оценки двух методов программирования акустического жидкого обработчика для дозирования объемов >1 мкл. После дозирования жидкости пластину назначения герметизировали и центрифугировали при 1 500 х г в течение 1 мин, а поглощение при 425 нм измеряли с помощью пластинчатого считывателя. Показаны репрезентативные результаты девяти экспериментов, которые демонстрируют более последовательное дозирование в серии из восьми целевых скважин, когда перенос 5 мкл разделен на отдельные дозы по 1 мкл. На основе этих наблюдений рекомендуется разбивать переносы >1 мкл на множественные переносы ≤1 мкл. Дополнительные сведения об устранении неполадок этого важного аспекта протокола см. в разделе Обсуждение .
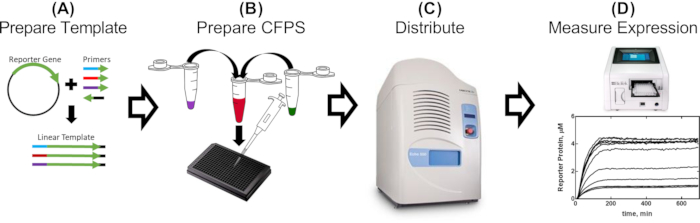
Рисунок 1: Однодневный рабочий процесс для оценки промоторных частей в бесклеточном экстракте. (А) Репортер амплифицируется ПЦР с использованием праймеров, содержащих генетические части, подлежащие оценке (2-5 ч). (B) Бесклеточную реакционную смесь готовят, как описано в протоколе, и распределяют в 384-луночную пластину с ПЦР-амплифицированными шаблонами (30 мин). (C) Акустическая обработка жидкости используется для распределения дополнительных компонентов, которые могут включать белки-репрессоры, молекулы-эффекторы и любые другие условные эффекторы (10 мин). (D) Экспрессия белка репортера от каждой реакции измеряется в пластинчатом считывателе (2-16 ч, в зависимости от рецептуры и конструкции CFPS). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
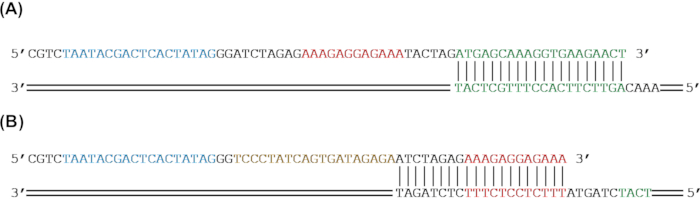
Рисунок 2: Дизайн праймера для добавления генетических частей к репортерному гену путем амплификации ПЦР. (A) Репортерный ген sfGFP (зеленый) будет амплифицирован для добавления RBS (красный) и промотора T7 (синий) с помощью ПЦР. (B) sfGFP (зеленый) и RBS (красный) будут усилены для добавления последовательности тетО (золото) и промотора T7 (синий) с помощью ПЦР. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
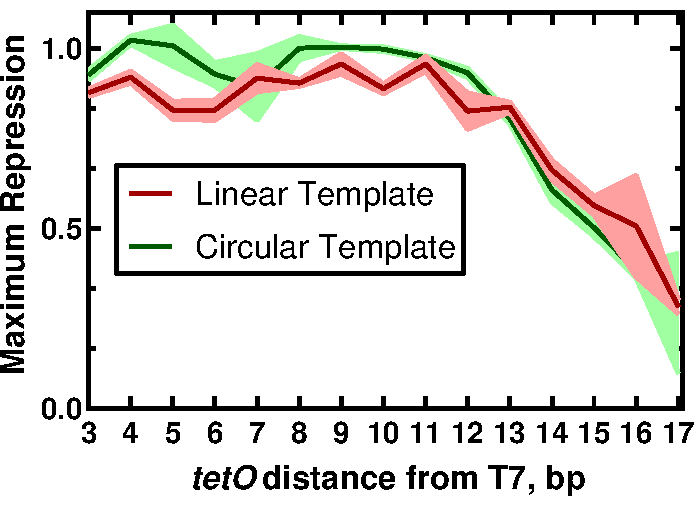
Рисунок 3: Влияние положения тетО на регуляцию выражения, управляемого Т7. Нормализованы максимальные значения подавления для линейного и кругового шаблона в зависимости от положения тетО . Трассировки представляют среднее и стандартное отклонения для трех реплик. Эта цифра была изменена из McManus et al.32 под лицензией Creative Commons CC-BY. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
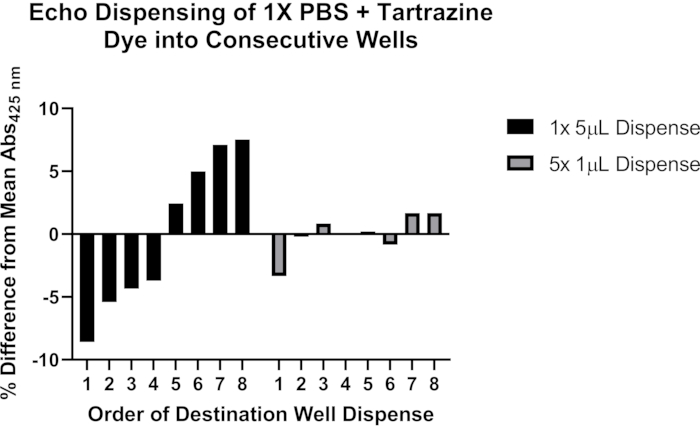
Рисунок 4: Использование тартразинового красителя для проверки дозирования жидкости с помощью акустического обработчика жидкости. Черные полосы указывают на дозирование 5 мкл раствора тартразина из одного источника скважины в каждую из восьми последовательных целевых скважин 384-луночной пластины с использованием одной команды программирования. Серые полосы указывают на дозирование 1 мкл из одного источника скважины в каждую из восьми последовательных целевых скважин с помощью одной команды программирования, а затем повторение этого шага четыре раза в общей сложности 5 мкл, дозируемых в каждой скважине назначения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя компонента | Объем для 1 реакции (мкл) | Объем для 110% от X числа реакций (мкл) |
| Премикс Q5 PCR | 25 | |
| Вода | 4 | |
| Шаблон (1–3 нг/мкл) | 1 | |
| (если исправлено1) Грунтовка форвардная (5 мкМ) | 0 или 10 | |
| (если исправлено1) Обратная грунтовка (5 мкМ) | 0 или 10 | |
| Мастер Микс Итого: | 30 или 40 | |
| (если переменная1) Грунтовка форвардная (5 мкМ) | 0 или 10 | |
| (если переменная1) Обратная грунтовка (5 мкМ) | 0 или 10 |
Таблица 1: Рабочий лист для приготовления реагентов для реакций ПЦР. Значения в крайнем правом столбце могут быть заполнены пользователями в зависимости от предполагаемого количества реакций. 1 См. Переменные праймеры содержат определенную часть, добавляемую в реакции ПЦР, и могут быть прямым праймером, обратным праймером или и тем, и другим. Фиксированные грунтовки не добавляют детали и могут быть прямой грунтовкой или обратной грунтовкой, но не обеими.
| Имя компонента | Объем для 1 реакции (мкл) | Объем для 110% от X числа реакций (мкл) |
| Экстракт клеток | 4.2 | |
| Смесь добавок | 3.3 | |
| Белок GamS (207 мкм) | 0.15 | |
| Шаблон ДНК (20 нМ) | 1 | |
| T7 полимераза (13 мг/мл) | 0.12 | |
| Вода | 0.73 (это число может отличаться) | |
| Мастер Микс Итого: | 9 | |
| Протеин-репрессор: | 1 |
Таблица 2: Рабочий лист для приготовления реагентов для реакций CFPS. Значения в крайнем правом столбце могут быть заполнены пользователями в зависимости от предполагаемого количества реакций.
Дополнительная таблица. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Протоколы, описанные здесь, обеспечивают экономически эффективные и быстрые средства для скрининга генетических частей посредством экспрессии репортерного белка CFPS. Хорошо охарактеризованные генетические части имеют решающее значение для разработки предсказуемых генетических схем с полезной функцией. Эта методология увеличивает пропускную способность и уменьшает время, необходимое для скрининга новых генетических частей, устраняя необходимость работы в живых клетках, сохраняя при этом функциональность, которая отражает клеточную среду, сохраняя метаболический процесс экспрессии белка в клеточном лизате. Наш протокол может быть выполнен через 1 день после приема праймеров (~2,5-6 ч для приготовления реакции, 2-16 ч для реакции CFPS; Рисунок 1), по сравнению с по меньшей мере 3 днями для традиционного клонирования (по 1 дню для сборки и преобразования конструкций, проверки последовательности клонов и культивирования клеток для оценки). Мы также оцениваем, что стоимость одной конструкции с использованием линейной ДНК составляет примерно одну треть традиционного клонирования (78 долларов США против 237 долларов США; Дополнительная таблица 1) методика. Коммерческие услуги синтеза в настоящее время котируют минимум 4 рабочих дня в зависимости от размера, хотя они будут иметь аналогичные затраты, чем наш метод, если линейные фрагменты будут отсеиваться непосредственно в CFPS ($78 против $91); мы не проверили этот подход. Стоимость оценки детали с CFPS невелика по сравнению с генерацией ДНК шаблона ($ 0,05 / реакция22 против $ 78 за шаблон), хотя следует отметить, что затраты на запуск объемных реагентов и лизисного оборудования составляют не менее нескольких тысяч долларов. Использование акустического жидкостного погрузчика лишь незначительно снижает затраты, позволяя уменьшить объемы до 0,5 мкл40; более существенным преимуществом является сокращение времени на подготовку реакций (~10 мин против 1 ч, в зависимости от количества реакций), особенно при подготовке большого количества реакций вызывает опасения по поводу подготовленной реакции, сидящей в течение длительного времени перед инкубацией.
Несмотря на быстроту и экономическую эффективность, ограничения на то, когда прототипирование CFPS адекватно предсказывает функцию in vivo , еще предстоит увидеть. Например, любая перекрестная реактивность с геномной ДНК не будет обнаружена из-за удаления генома хозяина во время производства системы CFPS. Кроме того, концентрации компонентов могут быть на 1-2 порядка ниже в CFPS, чем в клетках51, что, вероятно, повлияет на поведение некоторых частей в результате различных условий макромолекулярной скученности. Кроме того, способность линейной ДНК предсказывать функцию in vivo может быть ограничена, например, когда вторичная структура ДНК играет важную роль. Последнее ограничение заключается в том, что конструкции не проверяются последовательностью перед тестированием функций. Могут быть случаи, когда характеризуемая часть фактически не соответствует предполагаемой теоретической последовательности. Все эти ограничения могут быть смягчены путем проверки подмножества деталей, экранированных этим методом, в предполагаемом приложении in vivo .
Первоначально мы разработали эту методологию для исследования влияния изменения положения оператора на гибридные промоторы T7-tetO 32. Мы представили протоколы здесь в более общем формате, так что они могут быть применены к промоторам, операторам, последовательностям связывания рибосом, изоляторам и терминаторам. Эти генетические части могут быть добавлены к 5ʹ или 3ʹ концу репортерного гена с помощью ПЦР с использованием праймеров для каждой конструкции, устраняя необходимость синтеза или клонирования каждого варианта для тестирования. Полученные продукты ПЦР служат шаблонной ДНК для оценки через экспрессию репортерного белка. В нашей работе для TetR и GamS использовался приведенный здесь протокол аффинной очистки. Та же процедура может быть использована для экспрессии и очистки других репрессоров, активаторов, полимераз, сигма-факторов и других белков, родственных генетической части, представляющей интерес, хотя для экспрессии желаемого белка могут потребоваться модификации. Очистка и титрование этих белков в реакции CFPS позволяет более детально охарактеризовать конкретную генетическую часть. Наконец, существует множество альтернативных протоколов CFPS, и каждый из них должен поддаваться части методологии, касающейся скрининга частей. В качестве примера мы не включаем в этот протокол этап диализа, который, по мнению других, важен для экспрессии из нативных бактериальных промоторов22. Также возможно изменение концентраций основных составляющих компонентов CFPS. Использование обработки жидкостей повышает способность тестировать множество условий за счет увеличения пропускной способности и уменьшения требуемых материаловна 34,35.
Одной из областей, которая может потребовать значительного устранения неполадок, является оптимизация акустического обработчика жидкостей. Акустическое дозирование жидкости должно быть оптимизировано для каждого передаваемого компонента, и настоятельно рекомендуется запустить средства управления для проверки правильного распределения и воспроизводимости перед сбором данных. Идеальный тип исходной пластины и класс жидкости будут зависеть от конкретной жидкости, которая будет дозироваться, и ее компонентов. Не рекомендуется использовать пластины с аминным покрытием для дозирования ДНК, так как аминное покрытие может взаимодействовать с ДНК. Следует также отметить, что способность дозировать более высокие концентрации определенных компонентов может зависеть от модели акустической жидкости. Перенос испытательной жидкости может проводиться путем дозирования на уплотнение фольгированной пластины для визуализации успешного образования капель; однако этот тест предоставляет ограниченную информацию, и капли из разных настроек могут выглядеть одинаково. Использование водорастворимого красителя, такого как тартразин, может быть использовано для более точной проверки того, что правильный объем обходится без заданной настройки или рабочего процесса (см. Репрезентативные результаты). Оптимальное программирование переноса жидкости также может влиять на точность и согласованность генерируемых данных; для переноса >1 мкл из одной исходной скважины в одну скважину назначения мы обнаружили, что последовательные переносы ≤1 мкл должны быть запрограммированы для снижения систематической изменчивости скважины к скважине (рисунок 4). Наконец, теоретические и фактические объемы мертвых скважин могут резко варьироваться в зависимости от типа исходной пластины, настроек класса жидкости и компонентов конкретной жидкости; использование функции обследования акустической жидкости для оценки объемов скважины перед запуском программы может помочь оценить, насколько точно прибор способен измерять конкретную жидкость.
Эффективность реакции CFPS может варьироваться при сравнении результатов между различными пользователями, партиями материалов, считывателями пластин и лабораториями41. Для случаев, когда такие сравнения необходимы при прототипировании генетических схем, мы рекомендуем включать реакции внутреннего контроля со стандартными конститутивными промоторами в каждую реакционную пластину, чтобы помочь нормализовать результаты в экспериментальных установках. Метод получения ДНК также может в значительной степени способствовать активности CFPS; рекомендуется включить стадию осаждения этанола. Кроме того, оптимальный реакционный состав может варьироваться в зависимости от партии экстракта34. Было показано, что оптимальные концентрации глутамата магния и глутамата калия, в частности, варьируются в зависимости от партии42 или от используемого промоторного или репортерного белка24. Концентрации этих компонентов должны быть оптимизированы путем скрининга нескольких концентраций каждого компонента на генетическую конструкцию и на препарат экстракта клетки для определения оптимальных условий экспрессии белка. Наконец, наилучшие методы обеспечения стабильной реакционной реакции CFPS включают тщательное перемешивание, тщательное дозирование и консистенцию при приготовлении каждого компонента реагента.
Помимо характеристик отдельных частей, тот же метод может быть использован для экранирования комбинаций деталей, которые образуют сложные схемы, такие как логические схемы16 или генераторы 52,53. Этот метод также может быть применен для скрининга и оптимизации биосенсоров для применения в эпидемиологической диагностике 54,55,56,57 или обнаружении и количественной оценке опасности 3,58,59. Применение методов, управляемых ИИ, таких как активное обучение34, также может сочетаться с высокопроизводительным характером этого метода для быстрого исследования сложных биологических пространств проектирования. В конечном счете, мы предполагаем, что этот подход поддерживает ускоренное время разработки новых генетических конструкций в синтетической биологии.
Раскрытие информации
RMM имеет финансовую долю в Tierra Biosciences, частной компании, которая использует бесклеточные технологии, такие как описанные в этой статье, для экспрессии белка и скрининга.
Другим авторам нечего раскрывать.
Благодарности
Эта работа стала возможной благодаря программе прикладных исследований Управления министра обороны по продвижению приоритетов в области науки и техники. Мы благодарим Скотта Уолпера (Военно-морская исследовательская лаборатория) за предоставление запасов использованного sfGFP, а также Закари Сана и Абеля Чиао (Tierra Biosciences) за плодотворные дискуссии, связанные с прототипированием бесклеточных систем и связанными с этим устранением неполадок при обработке акустических жидкостей.
Материалы
| Name | Company | Catalog Number | Comments |
| 2x YT medium | Sigma-Aldrich | Y2377-250G | Alternative to making 2xYT media |
| Agar | Bacto | 214010 | For plating cells |
| Chromatography column (5 cm diameter) | BIO-RAD | 731-1550 | Used for protein purification. |
| Destination plate | Thermo Scientific Nunc plate | 142761 | For CFPS reactions |
| DMSO | Sigma-Aldrich | D2650 | For dialysis buffer |
| DpnI | NEB | R0176L | For digestion of plasmid templates |
| DTT | Roche | 20871723 | S30 Buffer B |
| E. coli BL21(DE3) Rosetta2 | Novagen | 70954 | Cell line used for production of lysate and purified proteins |
| Echo acoustic liquid handler | Labcyte | 525 | Acoustic liquid handler |
| French pressure cell | Thermo Spectronic | FA-078 | For lysing cells for CFPS |
| Imidazole | Sigma-Aldrich | 56750 | For buffers |
| Impermeable plastic sealable lid | Thermo | 232702 | Plate seal |
| IPTG | RPI | I56000-25.0 | Used for protein induction. |
| K-Glu | Sigma-Aldrich | g1501-500G | S30 Buffer B |
| Labcyte Echo source plate | Labcyte | PL-05525 | For use with Echo acoustic liquid handler |
| Mg-Glu | Sigma-Aldrich | 49605-250G | S30 Buffer B |
| NaCl | Sigma-Aldrich | S7653-250G | For buffers |
| NaHPO4 | Sigma-Aldrich | 71505 | For dialysis buffer |
| NaOH | Mallinckrodt Chemicals | 7708-10 | For making 2xYT media. Currently not produced by Mallinckrodt. Alternate: Sigma-Aldrich S0899 |
| Ni-NTA resin | Invitrogen | R901-15 | For production of purified proteins |
| PCR H2O | Ambion | AM9937 | PCR of linear templates |
| Plate Reader | BioTek | H10 | Plate reader used |
| Q5 PCR Master Mix | NEB | M0494S | PCR of linear templates |
| QIAquick Gel Extraction Kit | Qiagen | 28606 | PCR of linear templates |
| QIAquick PCR Purification Kit | Qiagen | 28004 | PCR of linear templates |
| QSonica Ultrasonic Processor | Qsonica | Q700 | Cell disruption during protein purification |
| RTS Amino Acid Sampler | biotechrabbit | BR1401801 | Updated supplier from Sun et al. |
| Tris | MP | 819623 | S30 Buffer B |
| Tris-Cl | Sigma-Aldrich | T5941 | For buffers |
| Tryptone | Fluka | T7293 | For making 2xYT media |
| Yeast Extract | Bacto | 212750 | For making 2xYT media |
Ссылки
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nature Reviews. Molecular Cell Biology. 10 (6), 410-422 (2009).
- Saltepe, B., Kehribar, E. Ş, Su Yirmibeşoǧlu, S. S., Şafak Şeker, U. Ö Cellular biosensors with engineered genetic circuits. ACS Sensors. 3 (1), 13-26 (2018).
- Bereza-Malcolm, L. T., Mann, G., Franks, A. E. Environmental sensing of heavy metals through whole cell microbial biosensors: A synthetic biology approach. ACS Synthetic Biology. 4 (5), 535-546 (2015).
- Mimee, M., et al. An ingestible bacterial-electronic system to monitor gastrointestinal health. Science. 360 (6391), 915-918 (2018).
- Isabella, V. M., et al. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nature Biotechnology. 36 (9), 857-867 (2018).
- Healy, C. P., Deans, T. L. Genetic circuits to engineer tissues with alternative functions. Journal of Biological Engineering. 13, 39(2019).
- Kaushik, A., Tiwari, S., Dev Jayant, R., Marty, A., Nair, M. Towards detection and diagnosis of Ebola virus disease at point-of-care. Biosensors and Bioelectronics. 75, 254-272 (2016).
- Jagadevan, S., et al. Recent developments in synthetic biology and metabolic engineering in microalgae towards biofuel production. Biotechnology for Biofuels. 11, 185(2018).
- Keating, K. W., Young, E. M. Synthetic biology for bio-derived structural materials. Current Opinion in Chemical Engineering. 24, 107-114 (2019).
- Smanski, M. J., et al. Synthetic biology to access and expand nature's chemical diversity. Nature Reviews Microbiology. 14 (3), 135-149 (2016).
- Xiang, Y., Dalchau, N., Wang, B. Scaling up genetic circuit design for cellular computing: advances and prospects. Natural Computing. 17 (4), 833-853 (2018).
- Galdzicki, M., Rodriguez, C., Chandran, D., Sauro, H. M., Gennari, J. H. Standard biological parts knowledgebase. PLoS One. 6 (2), 17005(2011).
- Kelwick, R., Bowater, L., Yeoman, K. H., Bowater, R. P. Promoting microbiology education through the iGEM synthetic biology competition. FEMS Microbiology Letters. 362 (16), (2015).
- Torella, J. P., et al. Unique nucleotide sequence-guided assembly of repetitive DNA parts for synthetic biology applications. Nature Protocols. 9 (9), 2075-2089 (2014).
- Halleran, A. D., Swaminathan, A., Murray, R. M. Single day construction of multigene circuits with 3G assembly. ACS Synthetic Biology. 7 (5), 1477-1480 (2018).
- Nielsen, A. K., et al. Genetic circuit design automation. Science. 352 (6281), (2016).
- Canton, B., Labno, A., Endy, D. Refinement and standardization of synthetic biological parts and devices. Nature Biotechnology. 26 (7), 787-793 (2008).
- Boehm, C. R., Bock, R. Recent advances and current challenges in synthetic biology of the plastid genetic system and metabolism. Plant Physiology. 179 (3), 794-802 (2019).
- Takahashi, M. K., et al. Characterizing and prototyping genetic networks with cell-free transcription-translation reactions. Methods. 86, 60-72 (2015).
- Chappell, J., Watters, K. E., Takahashi, M. K., Lucks, J. B. A renaissance in RNA synthetic biology: New mechanisms, applications and tools for the future. Current Opinion in Chemical Biology. 28, 47-56 (2015).
- Endy, D. Foundations for engineering biology. Nature. 438 (7067), 449-453 (2005).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: an expanded repertoire of applications. Nat. Reviews. Genetics. 21 (3), 151-170 (2020).
- Dopp, J. L., Rothstein, S. M., Mansell, T. J., Reuel, N. F. Rapid prototyping of proteins: Mail order gene fragments to assayable proteins within 24 hours. Biotechnology and Bioengineering. 116 (3), 667-676 (2019).
- Garamella, J., Marshall, R., Rustad, M., Noireaux, V. The all E. coli TX-TL toolbox 2.0: A platform for cell-free synthetic biology. ACS Synthetic Biology. 5 (4), 344-355 (2016).
- Kopniczky, M. B., et al. Cell-free protein synthesis as a prototyping platform for mammalian synthetic biology. ACS Synthetic Biology. 9 (1), 144-156 (2020).
- Kelwick, R., et al. Cell-free prototyping strategies for enhancing the sustainable production of polyhydroxyalkanoates bioplastics. Synthetic Biology. 3 (1), (2018).
- Karim, A. S., et al. In vitro prototyping and rapid optimization of biosynthetic enzymes for cell design. Nature Chemical Biology. 16 (8), 912-919 (2020).
- Takahashi, M. K., et al. Rapidly characterizing the fast dynamics of RNA genetic circuitry with cell-free Transcription-Translation (TX-TL) systems. ACS Synthetic Biology. 4 (5), 503-515 (2015).
- Chappell, J., Jensen, K., Freemont, P. S. Validation of an entirely in vitro approach for rapid prototyping of DNA regulatory elements for synthetic biology. Nucleic Acids Research. 41 (5), 3471-3481 (2013).
- Borkowski, O., et al. Cell-free prediction of protein expression costs for growing cells. Nature Communications. 9 (1), 1457(2018).
- Dudley, Q. M., Karim, A. S., Nash, C. J., Jewett, M. C. In vitro prototyping of limonene biosynthesis using cell-free protein synthesis. Metabolic Engineering. 61, 251-260 (2020).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045(2019).
- Sun, Z. Z., Yeung, E., Hayes, C. A., Noireaux, V., Murray, R. M. Linear DNA for rapid prototyping of synthetic biological circuits in an escherichia coli based TX-TL cell-free system. ACS Synthetic Biology. 3 (6), 387-397 (2014).
- Borkowski, O., et al. Large scale active-learning-guided exploration for in vitro protein production optimization. Nature Communications. 11 (1), 1872(2020).
- Caschera, F., et al. High-throughput optimization cycle of a cell-free ribosome assembly and protein synthesis system. ACS Synthetic Biology. 7 (12), 2841-2853 (2018).
- Iyer, S., Karig, D. K., Norred, S. E., Simpson, M. L., Doktycz, M. J. Multi-input regulation and logic with T7 promoters in cells and cell-free systems. PLoS One. 8 (10), 78442(2013).
- Karig, D. K., Iyer, S., Simpson, M. L., Doktycz, M. J. Expression optimization and synthetic gene networks in cell-free systems. Nucleic Acids Research. 40 (8), 3763-3774 (2012).
- Jung, J. K., et al. Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnology. 38 (12), 1451-1459 (2020).
- Bailey, J., Eggenstein, E., Lesnick, J. Miniaturization and rapid processing of TXTL reactions using acoustic liquid handling. Labcyte Technical Note. , 1-12 (2018).
- Marshall, R., Garamella, J., Noireaux, V., Pierson, A. High-throughput microliter-sized cell-free transcription-translation reactions for synthetic biology applications using the echo 550 liquid handler. Labcyte Application Note. , 1-6 (2018).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762(2013).
- Dopp, J. L., Tamiev, D. D., Reuel, N. F. Cell-free supplement mixtures: Elucidating the history and biochemical utility of additives used to support in vitro protein synthesis in E. coli extract. Biotechnology Advances. 37 (1), 246-258 (2019).
- Cole, S. D., Miklos, A. E., Chiao, A. C., Sun, Z. Z., Lux, M. W. Methodologies for preparation of prokaryotic extracts for cell-free expression systems. Synthetic and Systems Biotechnology. 5 (4), 252-267 (2020).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of Biotechnology. 110 (3), 257-263 (2004).
- Marshall, R., Maxwell, C. S., Collins, S. P., Beisel, C. L., Noireaux, V. Short DNA containing χ sites enhances DNA stability and gene expression in E. coli cell-free transcription-translation systems. Biotechnology and Bioengineering. 114 (9), 2137-2141 (2017).
- Yim, S. S., Johns, N. I., Noireaux, V., Wang, H. H. Protecting linear DNA templates in cell-free expression systems from diverse bacteria. ACS Synthetic Biology. 9 (10), 2851-2855 (2020).
- Zhu, B., et al. Increasing cell-free gene expression yields from linear templates in Escherichia coli and Vibrio natriegens extracts by using DNA-binding proteins. Biotechnology and Bioengineering. 117 (12), 3849-3857 (2020).
- Tuckey, C., Asahara, H., Zhou, Y., Chong, S. Protein synthesis using a reconstituted cell-free system. Current Protocols in Molecular Biology. 108, 1-22 (2014).
- Hoffman, R. A., Wang, L., Bigos, M., Nolan, J. P. NIST/ISAC standardization study: Variability in assignment of intensity values to fluorescence standard beads and in cross calibration of standard beads to hard dyed beads. Cytometry. Part A. 81 (9), 785-796 (2012).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical Review Letters. 106 (4), 048104(2011).
- Rossi, N. A., Dunlop, M. J. Making waves with synthetic oscillators. Cell Systems. 6 (4), 406-407 (2018).
- Niederholtmeyer, H., et al. Rapid cell-free forward engineering of novel genetic ring oscillators. eLife. 4, 09771(2015).
- Chang, H., Voyvodic, P. L., Structurale, C. D. B. Microbially derived biosensors for diagnosis, monitoring and epidemiology. Microbial Biotechnology. 10 (5), 1031-1035 (2017).
- Pardee, K., et al. low-cost detection of Zika virus using programmable biomolecular components. Cell. 165 (5), 1255-1266 (2016).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Liu, X., Germaine, K. J., Ryan, D., Dowling, D. N. Whole-cell fluorescent biosensors for bioavailability and biodegradation of polychlorinated biphenyls. Sensors. 10 (2), 1377-1398 (2010).
- Gautam, P., Suniti, S., Amrita, K., Madathil, D., Nair, B. A Review on Recent Advances in Biosensors for Detection of Water Contamination. International Journal of Environmental Sciences. 2 (3), 1565-1574 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены