Method Article
Genetik Parçaların Hücresiz Sistemlerle Hızlı Karakterizasyonu
Bu Makalede
Özet
İyi karakterize edilmiş genetik parçalar, yeni genetik devrelerin tasarımı için gereklidir. Burada, genetik parçaları hızlı bir şekilde karakterize etmek için uygun maliyetli, yüksek verimli bir yöntem açıklıyoruz. Yöntemimiz, hücresiz lizatları, klonlamayı önlemek için lineer DNA'yı ve verimi artırmak ve reaksiyon hacimlerini azaltmak için akustik sıvı işlemeyi birleştirerek maliyeti ve zamanı azaltır.
Özet
Genetik parçaların karakterize edilmesi ve kataloglanması, yararlı genetik devrelerin tasarımı için kritik öneme sahiptir. İyi karakterize edilmiş parçalara sahip olmak, genetik devrelerin ince ayarına izin verir, böylece işlevleri öngörülebilir sonuçlarla sonuçlanır. Sentetik biyolojinin bir alan olarak büyümesiyle birlikte, algılama, metabolik değişim ve hücresel hesaplama ile ilgili işlevleri yerine getirmek için mikroplarda uygulanan genetik devrelerde bir patlama olmuştur. Burada, genetik parçaları karakterize etmek için hızlı ve uygun maliyetli bir yöntem gösteriyoruz. Yöntemimiz, bir muhabir proteininin ekspresyonu yoluyla parçaları değerlendirmek için bir ortam olarak şirket içinde hazırlanan hücresiz lizatı kullanır. Şablon DNA, muhabir genine varyant parçaları eklemek için ucuz primerler kullanılarak PCR amplifikasyonu ile hazırlanır ve şablon, klonlama olmadan lineer DNA olarak reaksiyona eklenir. Bu şekilde eklenebilecek parçalar arasında promotörler, operatörler, ribozom bağlama bölgeleri, izolatörler ve sonlandırıcılar bulunur. Bu yaklaşım, akustik bir sıvı işleyicinin ve 384 kuyucuklu plakaların dahil edilmesiyle birleştiğinde, kullanıcının genetik parçaların yüksek verimli değerlendirmelerini tek bir günde gerçekleştirmesine olanak tanır. Buna karşılık, hücre bazlı tarama yaklaşımları zaman alıcı klonlama gerektirir ve gece kültürü ve kültür yoğunluğu normalleştirme adımları nedeniyle daha uzun test sürelerine sahiptir. Ayrıca, hücresiz lizatta çalışmak, kullanıcının eksojen bileşenlerin ve DNA'nın hassas konsantrasyonlarda eklenmesiyle ekspresyon koşulları üzerinde daha sıkı kontrol sahibi olmasını sağlar. Hücresiz taramadan elde edilen sonuçlar, doğrudan hücresiz sistemlerin uygulamalarında veya bazı durumlarda tüm hücrelerdeki işlevi tahmin etmenin bir yolu olarak kullanılabilir.
Giriş
Sentetik biyolojinin temel bir çabası, mikroplarda veya hücresiz lizatlarda konuşlandırıldığında yararlı işlevleri yerine getiren genetik devreleri1 oluşturmak için kullanılabilecek iyi karakterize edilmiş parçalar içeren genetik alet kitleri geliştirmektir. Bu tür genetik devrelerin çekiş kazandığı alanlar 2,3,4, insan performansı 5,6, biyoyakıtlar 7,8, malzeme üretimi 9,10 ve hücresel hesaplama 11'dir. Standartlaştırılmış genetik parçaların kayıtları, yeni ve mevcut parçaları promotörler, operatörler, kodlama dizileri ve sonlandırıcılar gibi kategorilere ayırmak için12 kurulmuştur. iGEM (uluslararası Genetiği Değiştirilmiş Makineler) yarışması13 gibi çabalar, bu genetik parçaların karakterize edilmesinde ve kataloglanmasında etkili olmuştur. Bu parçaların yararlı genetik devrelere hızlı bir şekilde monte edilmesini kolaylaştırmak için birçok yöntem geliştirilmiştir14,15. İyi karakterize edilmiş parçaların bileşimini, istenen bir işlevi elde eden devrelere otomatikleştirmek için bile geliştirilmiştir16. Bununla birlikte, öngörülebilir fonksiyonlara sahip yararlı genetik devrelerin montajı, genetik alet kitlerinin iyi karakterize edilmiş genetik parçalar içerdiği varsayımına dayanır. Bu alet kitlerinin sentetik biyolojinin ilerlemesine yönelik gerekliliği nedeniyle, uygun karakterizasyon verilerine sahip devreleri ve parçaları daha iyi kataloglamak için çok sayıda çaba 17,18,19,20,21 tanımlanmıştır.
Genetik bileşenleri karakterize etmeye yönelik bir yaklaşım, transkripsiyon ve translasyon ex vivo22 gibi hücresel fonksiyonları yeniden oluşturan hücresiz protein sentezi (CFPS) sistemlerinden yararlanır. Birçok çalışma, CFPS'nin genetik bileşenlerin prototiplenmesi için potansiyelini göstermiştir 23,24,25,26,27,28,29,30,31,32 Hücresiz sistemlerde doğrudan uygulamalar için veya bir kütüphanedeki parçaların göreceli aktivitesi gibi hücrelerdeki genetik yapıların işlevini tahmin etmek için olsun29 , metabolik yol optimizasyonu27 ve hücresel yük30. CFPS'de prototiplemenin bu çalışmalarla vurgulanan hücrelere karşı avantajları, zaman alıcı klonlamadan kaçınmayı, DNA ve diğer reaksiyon bileşenlerinin konsantrasyonu üzerinde hassas kontrol ve birden fazla DNA yapısını kolayca karıştırma ve eşleştirme yeteneğini içerir. Klonlamadan kaçınmanın avantajı, yeni yapıların33. gün yerine saatler süren in vitro yöntemlerle bir araya getirilmesini sağlayan lineer DNA şablonlarını kullanırken özellikle belirgindir. DNA yapılarının ve diğer bileşenlerin konsantrasyonunu sadece pipetleme yoluyla manipüle etme yeteneği, sıvı taşıma robotları34,35 tarafından desteklenen yüksek verimli deneylere olanak tanıyarak yaklaşımı daha da çekici hale getirir. Prototipleme için CFPS'yi kullanan başarılar bildirilmiş olsa da, CFPS sonuçlarının hücrelerdeki işlevselliği hangi bağlamlarda güvenilir bir şekilde tahmin edebileceğinin görülmeye devam ettiğini belirtmek önemlidir.
Burada, CFPS prototiplemesi için geleneksel hücre tabanlı yaklaşımlara kıyasla hız, verim ve maliyet avantajlarını vurgulayan bir yöntem sunuyoruz. Bu yaklaşım, transkripsiyon faktörü TetR32 tarafından düzenlenen T7 promotör varyantlarının bir kütüphanesini hızlı bir şekilde karakterize etmek için CFPS'yi kullandığımız önceki çalışmamızdan türetilmiştir ve o sırada literatürde bulunan küçük bir avuç düzenlenmiş T7 promotör varyantı üzerinde önemli ölçüde genişlemiştir36,37. Diğerleri, o zamandan beri, bu tür destekleyicilerin yelpazesini daha da genişletti38. Yöntemimizde, genetik yapı montajı, bir muhabir genine varyant genetik parçalar ekleyen primerler aracılığıyla şablon DNA'yı yükseltmek için PCR kullanılarak hızlandırılır. 384 delikli plakalarda akustik sıvı işleme, verimi artırmak ve gerekli malzemelerin hacmini azaltmak için kullanılır. Önceki çalışmalar, akustik sıvı işlemenin39,40 gibi önemli ölçüde daha düşük hacimlerde başarılı bir şekilde kullanıldığını ve daha büyük hacimlerin manuel pipetlenmesiyle karşılaştırılabilir değişkenlikgösterdiğini göstermiştir 41. Yönteme ek olarak, sorun giderme bilgileri ve potansiyel maliyet ve zaman tasarruflarının bir değerlendirmesini sağlıyoruz. Burada Sun ve ark.42'ye dayanan hücresiz lizatlar üretmek için bir protokol eklerken,43,44 numaralı diğer birçok ticari kit ve protokolün de çalışması gerektiğini unutmayın. Benzer şekilde, promotör varyantları32'nin karakterizasyonu için yöntemi gösterirken, ribozatörler, Ribozom Bağlanma Bölgeleri (RBS'ler), izolatörler, protein etiketleri ve sonlandırıcılar gibi diğer parçalar PCR amplifikasyonu ile değiştirilebilir. Bu metodolojinin, sentetik biyoloji topluluğunun, yararlı işlevli öngörülebilir genetik devrelerin montajı için karakterize edilen parçaların sayısını artırmaya devam etmesine yardımcı olabileceğini umuyoruz.
Protokol
1. Hücre ekstraktının hazırlanması
- Ortamın hazırlanması
- 2xYT ortam için: 900 mL deiyonize suya 16 g tripton, 10 g maya ekstresi ve 5 g NaCl ekleyin ve pH'ı 5 M NaOH ile 7.0'a ayarlayın. Deiyonize su ve otoklav veya filtre sterilizasyonu kullanarak çözelti hacmini 1 L'ye yükseltin. Alternatif olarak, 2xYT medya satın alabilirsiniz.
- S30B tamponu için: 2 L deiyonize suda 14 mM Mg-glutamat, 60 mM K-glutamat ve 5 mM Tris çözeltisi hazırlayın. PH'ı 8,2'ye ayarlamak, otoklav yapmak ve 4 °C'de saklamak için 2 M Tris kullanın. Kullanımdan hemen önce 1 mM'lik son konsantrasyona ditiyotreitol (DTT) ekleyerek çözeltiyi tamamlayın.
- Hücrelerin hazırlanması
- Streak Escherichia coli BL21 (DE3) Rosetta2 hücreleri veya tercih edilen diğer hücre hatları (yakın tarihli kapsamlı bir inceleme için Cole ve ark.44'e bakınız) bir LB (Lysogeny Broth) agar plakasına yerleştirin ve 10-14 saat boyunca 37 ° C'de inkübe edin.
- 10 mL'lik bir kültür tüpünde 3 mL 2xYT ortamını aşılamak için tek bir E. coli kolonisi kullanın. Bu tüpü 37 ° C'de 8 saat boyunca 250 rpm'de çalkalayarak inkübe edin.
- 500 mL'lik bir şişede 50 mL'lik 2xYT ortamını aşılamak için 3 mL kültürden 50 μL kullanın. Bu şişeyi 37 ° C'de 8 saat boyunca 250 rpm'de sallayarak inkübe edin.
- 0,75 L 2xYT ortamı içeren dört adet 4 L şaşkın şişenin her birini aşılamak için 50 mL kültürden 7,5 mL kullanın. Bu şişeleri, yaklaşık 3-4 saat sonra, 2 ila 4 nm 600 nm'lik bir optik yoğunluğa ulaşana kadar 220 rpm'de sallayarak 37 ° C'de inkübe edin.
- Hücreleri her şişeden 1 L kaplara aktararak ve 4 ° C'de 12 dakika boyunca 5.000 x g'de santrifüj yaparak toplayın. Süper natantı bir atık kabına boşaltarak atın.
- Her hücre peletini 150 mL buz gibi soğuk S30B tamponu ile yıkayın, hücre kütlesini bozmak için bir pipet kullanarak tamamen yeniden askıya alın ve ardından hücreleri 12 dakika boyunca 5.000 x g'de santrifüjleme ile tekrar toplayın. Süper natantı atın.
- Her hücre peletini 40 mL buz gibi soğuk S30B tamponunda tamamen yeniden askıya alarak ve bir pipet kullanarak hücre kütlesini bozarak tekrar yıkayın. Hücreleri önceden tartılmış 50 mL konik tüplere aktarın ve hücreleri 4 ° C'de 8 dakika boyunca 2.000 x g'de santrifüjleme ile tekrar toplayın. Süpernatantı dekantörle atın.
- Islak hücre peletlerini tartın. Tüpleri doğrudan sıvı azot içine yerleştirerek hücre peletlerini flaşla dondurun ve -80 ° C'de saklayın.
- Hücre lizisi
- Hücre topaklarını buz üzerinde çözün.
- Her hücre peletini vorteks yoluyla hücre peletinin 1 g'ı başına 1.4 mL S30B tamponunda yeniden askıya alın.
- Hücreleri 4 ° C'de 640 psi'de Fransız basınç hücresi ile lize edin. Lisatı buz üzerindeki mikrosantrifüj tüplerinde toplayın ve lizisten hemen sonra 1 mL lizat başına 3 μL 1 M DTT ekleyin.
NOT: Basıncı eşit tutmak ve basınçta ani düşüşleri önlemek için Fransız basın bülteni valfine küçük bir metal çubukla dokunmak en iyisidir. - Lisatı 4 ° C'de 30 dakika boyunca 30.000 x g'de santrifüjleme ile temizleyin ve süpernatantı yeni bir buz gibi mikro santrifüj tüpüne pipetledikten sonra peleti atın, peleti bozmamaya dikkat edin.
- Süpernatantı 4 ° C'de 30 dakika boyunca 30.000 x g'de ikinci kez santrifüj yapın. Elde edilen süpernatantı buz gibi soğuk bir mikrosantrifüj tüpüne pipetleyin. Peleti atın.
- Süpernatantı 37 ° C'lik bir su banyosunda 1 saat boyunca inkübe edin.
- Süpernatantı 4 ° C'de 15 dakika boyunca 15.000 x g'de santrifüjleme ile temizleyin ve elde edilen süpernatantı buz gibi soğuk bir mikrosantrifüj tüpüne aktarın, peleti bozmamaya dikkat edin.
- Süpernatantı 4 ° C'de 15 dakika boyunca 15.000 x g'de ikinci kez santrifüj edin ve elde edilen süpernatantı buz gibi soğuk bir mikrosantrifüj tüpüne aktarın, kalan peleti bozmamaya özen gösterin.
- Süpernatantı 100 μL alikotlarda 1,5 mL mikrosantrifüj tüplerine dağıtın ve doğrudan sıvı azot içine yerleştirerek flaşla dondurun. Süpernatantı -80 °C'de saklayın.
2. Doğrusal şablon hazırlama
- Astar tasarımı
- PCR şablonu olarak bir çekirdek dizisi seçin. En azından sfGFP (süper klasör Yeşil Floresan Proteini), LacZ veya Ispanak aptamer gibi bir muhabir dizisi ekleyin. Sonlandırıcılar, promotörler veya RBS'ler gibi taranan varyantlar arasında sabitlenecek diğer parçaları, tasarıma uygun şekilde dahil edin.
NOT: Hücresiz sistemlerde lineer DNA'dan ekspresyon için her zaman bir terminatörün dahil edilmesi gerekli değildir. - İleri astarlar için, astarın 3ʹ ucu olarak çekirdek dizisinin 5ʹ ucuyla eşleşen en az 20 bp seçin. Yapının 5′ ucuna parçalar ekliyorsanız, PCR amplifikasyonu yoluyla çekirdek dizisine ilgilenilen genetik parçaları eklemek için astarın 5ʹ ucunun geri kalanını tasarlayın (Şekil 1A ve Şekil 2).
NOT: ~ 60 bp'nin üzerindeki astarlar sıklıkla maliyette önemli ölçüde arttığından, daha uzun diziler veya birden fazla parça eklemek için üst üste binen birden fazla astar tasarlanabilir. Tek bir PCR reaksiyonunda birden fazla primer kullanılabilirken, birden fazla PCR turu yapılması önerilir. - Ters astarlar için, çekirdek dizinin 3′ ucunu astarın 3�� ucu olarak eşleştirmek için en az 20 bp seçin. Yapının 3′ ucuna parçalar ekliyorsanız, PCR amplifikasyonu yoluyla çekirdek dizisine ilgili genetik parçaları eklemek için astarın 5ʹ ucunun geri kalanını tasarlayın (Şekil 1A ve Şekil 2). Ters astarın tavlama sıcaklığının, tüm ileri astarın tavlama sıcaklığının 5 °C içinde olduğundan emin olun.
- PCR şablonu olarak bir çekirdek dizisi seçin. En azından sfGFP (süper klasör Yeşil Floresan Proteini), LacZ veya Ispanak aptamer gibi bir muhabir dizisi ekleyin. Sonlandırıcılar, promotörler veya RBS'ler gibi taranan varyantlar arasında sabitlenecek diğer parçaları, tasarıma uygun şekilde dahil edin.
- Doğrusal şablon amplifikasyonu
- Çekirdek dizilerinin sayısına göre gerçekleştirilecek PCR reaksiyonlarının sayısını belirleyin ve Tablo 1'i kullanarak gerekli her bileşenin miktarını hesaplayın.
- Ana karışımı Tablo 1'e göre hazırlayın ve buz üzerinde saklayın. Ana karışımın Aliquot 30 veya 40 μL'si (bakınız Tablo 1) belirlenen sayıda PCR tüpüne karışır ve uygun şekilde etiketlenmiş PCR tüplerine 5 μM'de her değişken astarın 10 μL'sini (yani, bir parça değişimini kodlayan primerler, bakınız Tablo 1) ekleyin.
- PCR tüplerini termosikler içine yerleştirin ve aşağıdaki PCR programını çalıştırın: 3 dakika boyunca 98 °C; 15 s için 98 °C, 20 s için XX °C, YY dk için 72 °C'lik 30 döngü; 10 dakika boyunca 72 °C'de son uzatma. Ardından, reaksiyonu 4 ° C'de tutun.
Burada, XX, daha düşük tavlama sıcaklığına sahip astar için tavlama sıcaklığını temsil eder ve YY, üreticinin kullanılan yüksek kaliteli polimeraz tavsiyelerine dayanarak amplikonun uzunluğu için hesaplanan uzatma süresini temsil eder. Bu koşulları farklı astarlar ve/veya şablonlar için gerektiği şekilde optimize edin. - (İsteğe bağlı) Orijinal şablonu sindirmek için 1 μL DpnI kısıtlama enzimi ekleyin. Reaksiyonu 1 saat boyunca 37 ° C'de inkübe edin. Bu adımı yalnızca orijinal şablon plazmid DNA'sı ise gerçekleştirin.
- Her PCR ürününün 5 μL'sini jel elektroforezi ile analiz edin. Ürünü 20 dakika boyunca 180 V'ta% 1'lik bir agaroz jeli kullanarak ayırın. Seçilen çekirdek dizisine ve eklenen parçaların uzunluğuna göre değişecek doğru bant boyutunu kontrol edin.
- Ticari bir PCR saflaştırma kiti kullanarak veya tercih edilen PCR temizleme yöntemiyle lineer şablonu saflaştırın. Jel elektroforez analizi ile birden fazla bant mevcutsa, PCR koşullarını optimize edin veya üreticinin tavsiyesine göre ticari bir jel ekstraksiyon kiti kullanarak doğru moleküler ağırlık bantlarını saflaştırın.
- Her DNA şablonunu bir spektrofotometre kullanarak sayısallaştırın. 260 nm / 280 nm oranının yaklaşık 1.8 olduğunu kontrol ederek DNA şablonunun kalitesini değerlendirin.
- (İsteğe bağlı) Yine, DNA şablonunun bir kısmını, 180 V'ta 20 dakika boyunca% 1'lik bir agaroz jeli kullanarak ayırın ve şablon saflaştırma sırasında istenmeyen bantların çıkarıldığından emin olun.
- Saflaştırılmış DNA şablonlarını hemen kullanın veya -20 ° C'de saklayın.
3. Saflaştırılmış protein preparatı
- Protein ekspresyonu
- Her proteinin ifade edilmesi için, uygun bir ifade yapısı oluşturun. E. coli'de ekspresyon için geni kodon ile optimize edin. Geni, tercih edilen plazmid montaj yöntemiyle bir pET-22b ekspresyon vektörüne veya başka bir uygun ekspresyon vektörüne yerleştirin. İfade plazmidini BL21 (DE3) Rosetta2 ekspresyon hücrelerine veya diğer uygun hücre çizgilerine dönüştürün.
- Her protein için, 10 mL'lik bir kültür tüpünde 3 mL LB ortamını aşılamak için tek bir koloni kullanın. Bu tüpleri gece boyunca 250 rpm'de sallayarak 37 ° C'de inkübe edin.
- 750 mL LB ortamı içeren 2 L'lik bir şişeyi, 1 mL gece kültürü ile aşılayın. Bu şişeleri 37 ° C'de 250 rpm'de sallayarak0.6-1.0 OD 600'e ulaşana kadar inkübe edin.
- Her şişeye suda 0.75 mL 1 M izopropil β-D-1-tiyogalaktopiranosid (IPTG) ekleyerek protein ekspresyonunu indükleyin ve bu şişeleri 37 ° C'de 4 saat boyunca 250 rpm'de çalkalayarak inkübe etmeye devam edin.
- Her şişedeki hücreleri, 1 L'lik bir santrifüj şişesi kullanarak, 12 dakika boyunca 5.000 x g'de santrifüjleme yaparak toplayın. Süper natantı atın.
- Peletleri 50 mL'lik konik bir tüpe aktarın ve her peleti tartın. Hücreleri sıvı azot içinde flaşla dondurun ve -80 ° C'de saklayın veya adım 3.2'ye geçin.
NOT: 0,75 mL başına 2-5 g hücrenin bu adımdan kaynaklanması beklenir.
- Nikel afinitesi kolon kromatografisi ile protein saflaştırma
- 50 mM Tris-Cl, 500 mM NaCl ve 5 mM imidazolü birleştirerek lizis tamponunu hazırlayın. pH 8.0'a ayarlayın.
- 50 mM Tris-Cl, 500 mM NaCl ve 25 mM imidazolü birleştirerek yıkama tamponunu hazırlayın. pH 8.0'a ayarlayın.
- 50 mM Tris-Cl, 500 mM NaCl ve 250 mM imidazolü birleştirerek elüsyon tamponunu hazırlayın. pH 8.0'a ayarlayın.
- 50 mM NaHPO4, 100 mM NaCl ve %2 DMSO'yu birleştirerek diyaliz tamponunu hazırlayın. pH 7.5'e ayarlayın.
- Tüpleri oda sıcaklığındaki suya yerleştirerek hücre peletlerini çözün. 1 g hücre peleti başına 5 mL lizis tamponu ekleyin ve vorteks yaparak yeniden askıya alın.
- Hücreleri sonikasyon ile lize edin. Hücre homojenatını, 50 mL konik tüp başına 30 mL'den fazla olmayacak şekilde ayırın ve her tüpü buz üzerinde tutun. 0.16 cm çapında bir problu bir sonicator kullanarak hücreleri 15 s turlarında 30 s molalarla, 10 kez lize edin.
NOT: Köpüklenmeden kaçının, çünkü bu proteini denatüre eder. Köpük oluşumu, sonikatör ucunu çalışırken lizata en az 2/3 batırılmış halde tutarak önlenebilir. Sonikasyonun yanı sıra diğer hücre lizisi yöntemleri de mümkündür44. - Lisatı 4 ° C'de 30 dakika boyunca 15.000 x g'de santrifüjleme ile temizleyin ve süpernatantı yeni bir 50 mL konik tüpe yerleştirin.
- Her 5 mL süpernatan için 1 mL nikel-nitrilotriasetik asit (Ni-NTA) reçinesi ekleyin. Hücre lizatı / Ni-NTA bulamacını, 50 mL konik tüp başına 36 mL'den fazla olmayacak şekilde bölün. 1 saat boyunca 10 rpm'de bir tüp rotatör üzerinde 4 ° C'de inkübe edin.
- Hücre lizatı / Ni-NTA bulamacını 2 mL yatak hacimli kromatografi sütununa boşaltarak reçineyi yükleyin ve daha fazla analiz için gerekirse elüantı toplayın, aksi takdirde atın. Reçineyi 10 reçine yatak hacmi yıkama tamponu ile yıkayın.
- Kolona üç reçine yatağı hacimli elüsyon tamponu ekleyerek proteini toplayın ve her protein için uygun moleküler ağırlıklı kesme membranına sahip bir santrifüjlü yoğunlaştırıcı kullanarak hacmi 1,5 mL'ye yoğunlaştırın.
- Proteini 2 L diyaliz tamponuna karşı 4 ° C'de 1 saat boyunca diyalize edin. Proteini 4 ° C'de gece boyunca 2 L diyaliz tamponuna karşı tekrar diyaliz edin.
- Molar yok olma katsayısını ve 280 nm'deki absorbansını kullanarak proteini sayısallaştırın. Proteini sodyum dodesil sülfat poliakrilamid jel elektroforezi (SDS-PAGE) kullanarak ayırarak saflık açısından analiz edin. Proteini -80 °C'de saklayın.
4. Hücresiz protein sentezi
- CFPS reaksiyon karışımının hazırlanması
- Sun ve ark.42'deki Amino Asit Çözeltisi Hazırlama, Enerji Çözeltisi Hazırlama ve Tampon Hazırlama adımlarını izleyerek Ek Karışımı hazırlayın. Ayrı ayrı veya -80 ° C'de birleştirilmiş olarak alikotlarda saklayın. Son konsantrasyonların, Sun ve ark.42'de Bir TX-TL Reaksiyonunun Deneysel Yürütülmesi bölümünde açıklananlarla eşleştiğinden emin olun.
- Lineer DNA'yı bozulmadan korumak için bir katkı maddesi hazırlayın. GamS33,45 kullanıyorsanız, yukarıdaki bölüm 3'teki adımları izleyerek hazırlanın veya ticari bir satıcıdan alın; diğer yaklaşımlar için, ilgili literatürü kontrol edin46,47,48. Alternatif olarak, katkı maddesi gerektirmeyen bir CFPS sistemi kullanın49.
- Yukarıdaki bölüm 3'teki adımları kullanarak T7 polimeraz, baskılayıcı proteinler ve diğer katkı maddelerini hazırlayın veya ticari bir satıcıdan alın.
- Gerçekleştirilecek CFPS reaksiyonlarının sayısını belirleyin ve Tablo 2'yi kullanarak gerekli her bileşenin miktarını hesaplayın. Gerektiğinde bileşenlerin eklenmesi veya çıkarılması da dahil olmak üzere bileşenlerin konsantrasyonlarını değiştirin ve su miktarını, her reaksiyon karışımının nihai hacmi her zaman 10 μL olacak şekilde ayarlayın. Benzer şekilde, diğer bileşenlerin akustik sıvı işleme ile istenildiği gibi dağıtılmasını kolaylaştırmak için ana karışımı değiştirin ( Tartışma bölümüne bakın).
- Tüm bileşenleri buz üzerinde çözün ve her bir bileşeni yukarıda hesaplandığı gibi karıştırarak bir ana karışım hazırlayın. Tüm bileşenleri pipetle iyice karıştırın. Özellikle amino asit karışımı için çökelmeyi önlemeye dikkat edin. Ana karışımı buz üzerinde tutun.
- 384 kuyucuklu bir plakayı buz üzerinde soğutun ve ana karışımı 9 μL aliquots halinde her bir oyuğa dağıtın.
NOT: Bu bileşenleri akustik sıvı işleme ile dağıtmak mümkündür, ancak doğru dağıtımın sağlanmasına özen gösterilmelidir (sorun giderme için Tartışma bölümüne bakın).
- Ek bileşenlerin akustik sıvı işleme ile dağıtımı
- Tüm CFPS reaksiyonları için gereken baskılayıcı protein miktarını (ve diğer isteğe bağlı bileşenler) hesaplayın.
- Baskılayıcı proteini buz üzerinde çözün ve akustik bir sıvı işleme kaynak plakasına veya başka bir uygun plakaya dağıtın. Kullanılan kaynak plaka tipi için gereken uygun ölü hacim miktarının dahil edildiğinden emin olun.
- Baskılayıcı proteini 1 μL hacimlerde sıvı işleyici aracılığıyla uygun kuyucuklara dağıtın. Dağıtım sorunlarını giderme hakkında daha fazla bilgi için, Tartışma bölümüne bakın.
- Standart eğriler
- Sonuçların diğer çalışmalar ve diğer laboratuvarlarla karşılaştırılmasını sağlamak için saflaştırılmış raportörün seri seyreltilmesini (protein saflaştırması için bakınız bölüm 3)41 veya plakaya uygun kimyasal standart50'yi ekleyin. Muhabirin kullandığı konsantrasyonlara ve deneylerin beklenen ifade aralığına uygun bir konsantrasyon aralığı seçin.
- CFPS reaksiyonlarını çalıştırma
- Plaka okuyucuyu önceden 30 °C'ye ısıtın. Plaka okuyucuyu, adımları sarsmadan çekirdek dizide kullanılan muhabire uygun ayarlarda okunacak şekilde ayarlayın.
NOT: Burada 30 °C kullanılırken, 29 °C ve 37 °C de yaygın olarak kullanılır ve bu protokolle iyi çalışır. Alternatif hücresiz reaksiyon preparatları için diğer sıcaklıklar tercih edilebilir. Okuma aralıkları için, burada sunulan temsili veriler için iyi bir çözünürlük elde etmek için 10 dakika yeterlidir; Bununla birlikte, muhabir proteinine ve belirli CFPS tarifine bağlı olarak diğer çözünürlükler daha iyi olabilir. - (İsteğe bağlı) Sinyal taşması olmadan floresandaki değişimi yakalamak üzere uygun kazanç veya hassasiyet ayarını ayarlamak için önce bir test reaksiyonu çalıştırın.
- Buharlaşmayı önlemek için 384 delikli plakayı geçirimsiz plastik sızdırmaz bir kapakla kapatın. Mümkünse, conta üzerindeki yoğuşmayı sınırlamak için cihaz üzerinde 1 °C'lik dikey bir sıcaklık gradyanı ayarlayın. 384 delikli plakayı plaka tutucuya yerleştirin ve okumaya başlayın.
- Plaka okuyucuyu önceden 30 °C'ye ısıtın. Plaka okuyucuyu, adımları sarsmadan çekirdek dizide kullanılan muhabire uygun ayarlarda okunacak şekilde ayarlayın.
Sonuçlar
Yöntemlerimizin faydasını göstermek için, tetO dizisinin T7 promotörüne yakınlığının T7 RNAP güdümlü ekspresyonunun düzenlenmesi üzerindeki etkilerini açıklayan sonuçlar sunuyoruz. Tam sonuçlar ve bunların etkileri McManus ve ark.32'nin çalışmalarında bulunabilir. İş akışı Şekil 1'de açıklanmıştır. Sadece T7 promotörünün tetO dizisine göre uzaklığında değişen on beş doğrusal şablon, protokolün 2. bölümünde açıklandığı gibi her bir promotör varyantını (Şekil 2) eklemek için tasarlanmış primerlerle sfGFP raporlayıcısının PCR-amplifikasyonu ile hazırlanmıştır. CFPS reaksiyon bileşenleri ve reaksiyonları protokol uyarınca hazırlanmıştır. SfGFP'nin ekspresyonu, her şablondan, akustik bir sıvı işleyici kullanılarak üçlü olarak, TetR proteininin 12 farklı konsantrasyonunun titrasyonuyla ölçüldü. Şablon başına 36 CFPS reaksiyonu ve 15 şablonda, tüm T7-tetO kombinasyonları seti için toplam 540 reaksiyon gerçekleştirildi. Tüm değerlendirme iki plaka okuyucuda iki plaka üzerinde gerçekleştirildi. Bu verilerin analizi, T7 RNAP'nin, T7 transkriptinin başlangıcından itibaren T7 güdümlü ekspresyonu, 13 bp aşağı akışa eşit derecede yukarı doğru düzenlediğini göstermiştir (Şekil 3). Bu sonuç, T7'nin diğer baskılayıcılar tarafından etkili bir şekilde bastırılması için varsayılan bir pencere tanımlayarak, düzenlenebilir T7 güdümlü gen devrelerinin gelecekteki tasarımı için etkilere sahiptir. Burada açıklanan protokolden elde edilen sonuçların geleneksel klonlama ile hazırlanan DNA ile karşılaştırılması, formatlar arasındaki TetR baskılanma derecesinde küçük ama istatistiksel olarak anlamlı bir fark ortaya koymuştur. TetR'nin vektör DNA'sına spesifik olmayan bağlanmasının gözlemlenen farkı açıklayabileceğini varsaydık. Deneysel sonuçlar, lineer vektör DNA'sının lineer şablon DNA ile reaksiyonlara eklenmesinin, farkı istatistiksel olmayan anlamlılığa indirgediğini, ancak doğrusal ve dairesel formatlar için DNA sarmalının periyodikliğindeki farklılıklar gibi diğer faktörlerin katkılarını dışlamadığını gösterdi. Uygulamaya bağlı olarak, doğrusal şablonun kullanımı ek doğrulama gerektirebilir.
Ayrıca, akustik sıvı elleçlemesi kullanılarak doğru dağıtım ile ilgili potansiyel sorunlar hakkında temsili veriler de ekliyoruz (Şekil 4). 0.25 mM tartrazin boyası içeren 1x fosfat tamponlu salin (PBS), pH 7.4 çözeltisi, hacimleri >1 μL'yi dağıtmak için akustik bir sıvı işleyiciyi programlamanın iki yöntemini değerlendirmek için kullanıldı. Sıvı dağıtımını takiben, hedef plaka 1 dakika boyunca 1.500 x g'de kapatıldı ve santrifüj edildi ve 425 nm'deki absorbans bir plaka okuyucu ile ölçüldü. Dokuz deneyin temsili sonuçları gösterilir ve 5 μL transferi ayrı 1 μL dağıtımlara bölündüğünde sekiz hedef kuyu serisi boyunca daha tutarlı dağıtım gösterir. Bu gözlemlere dayanarak, >1 μL'lik transferlerin ≤1 μL'lik çoklu transferlere bölünmesi önerilir. Protokolün bu önemli yönüyle ilgili sorunları giderme hakkında daha fazla ayrıntı için Tartışma bölümüne bakın.
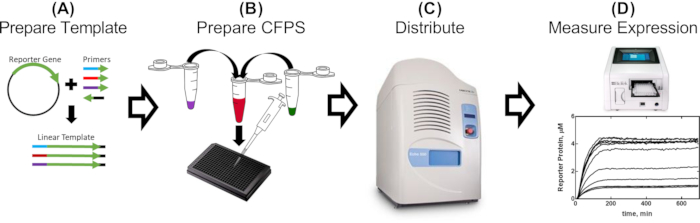
Şekil 1: Hücresiz ekstrakttaki promotör parçaların değerlendirilmesi için tek günlük iş akışı. (A) Bir muhabir, değerlendirilecek genetik parçaları içeren primerler kullanılarak PCR ile güçlendirilir (2-5 saat). (B) Hücresiz reaksiyon karışımı, protokolde ayrıntılı olarak açıklandığı gibi hazırlanır ve PCR ile güçlendirilmiş şablonlarla (30 dakika) 384 delikli bir plakaya dağıtılır. (C) Akustik sıvı elleçleme, baskılayıcı proteinleri, efektör molekülleri ve diğer koşullu efektörleri (10 dakika) içerebilen ek bileşenleri dağıtmak için kullanılır. (D) Her reaksiyondan gelen muhabir protein ekspresyonu bir plaka okuyucuda ölçülür (CFPS tarifine ve yapısına bağlı olarak 2-16 saat). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
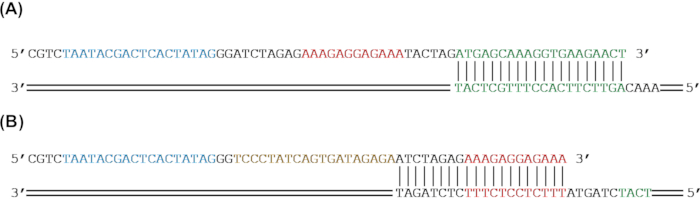
Şekil 2: PCR amplifikasyonu ile bir muhabir genine genetik parçalar eklemek için primer tasarım. (A) SfGFP muhabir geni (yeşil), PCR ile bir RBS (kırmızı) ve bir T7 promotörü (mavi) eklemek için güçlendirilecektir. (B) PCR ile bir tetO dizisi (altın) ve bir T7 promotörü (mavi) eklemek için sfGFP (yeşil) ve bir RBS (kırmızı) yükseltilecektir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
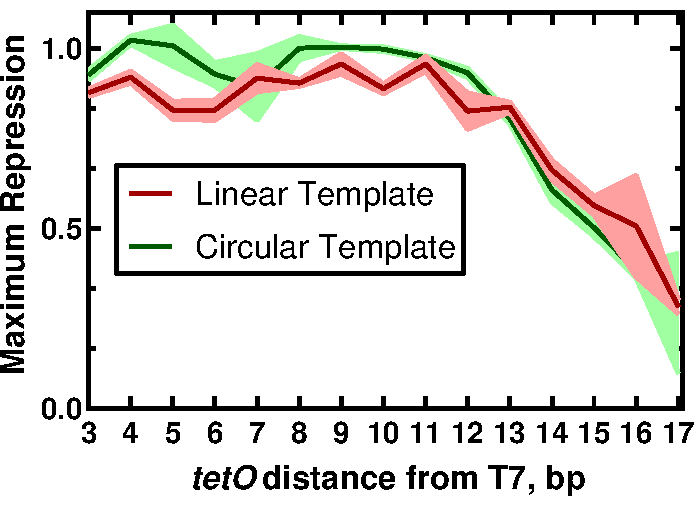
Şekil 3: TetO pozisyonunun T7 güdümlü bir ifadenin düzenlenmesi üzerindeki etkisi. TetO pozisyonunun bir fonksiyonu olarak doğrusal ve dairesel şablon için normalleştirilmiş maksimum basınç değerleri. İzler, üç replikanın ortalama ve standart sapmalarını temsil eder. Bu rakam McManus ve ark.32'den Creative Commons CC-BY lisansı altında değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
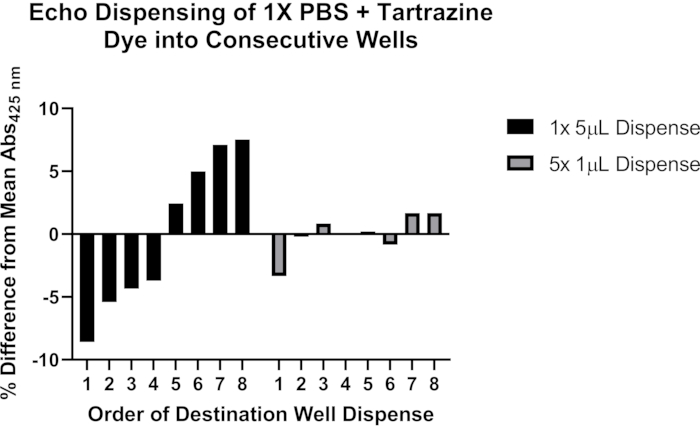
Şekil 4: Akustik bir sıvı işleyici ile sıvı dağıtımını doğrulamak için tartrazin boyası kullanma. Siyah çubuklar, tek bir programlama komutu kullanarak 384 kuyulu bir plakanın ardışık sekiz hedef kuyusunun her birine tek bir kaynaktan 5 μL tartrazin çözeltisinin dağıtıldığını gösterir. Gri çubuklar, tek bir programlama komutu kullanarak tek bir kaynaktan 1 μL'nin ardışık sekiz hedef kuyusunun her birine dağıtıldığını ve ardından bu adımın her bir hedef kuyusunda dağıtılan toplam 5 μL için dört kez tekrarlandığını gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Bileşen Adı | 1 reaksiyon için hacim (μL) | X reaksiyon sayısının %110'u için hacim (μL) |
| Q5 PCR Ön Karışımı | 25 | |
| Su | 4 | |
| Şablon (1–3 ng/μL) | 1 | |
| (düzeltilirse1) İleri Astar (5 μM) | 0 veya 10 | |
| (düzeltilirse1) Ters Astar (5 μM) | 0 veya 10 | |
| Ana Karışım Toplamı: | 30 veya 40 | |
| (değişken1 ise) İleri Astar (5 μM) | 0 veya 10 | |
| (değişken1 ise) Ters Astar (5 μM) | 0 veya 10 |
Tablo 1: PCR reaksiyonları için reaktiflerin hazırlanması için çalışma sayfası. En sağdaki sütundaki değerler, amaçlanan tepki sayısına bağlı olarak kullanıcılar tarafından doldurulabilir. 1 adet Değişken astarlar, PCR reaksiyonuna eklenecek belirli bir parça içerir ve ileri astar, ters astar veya her ikisi de olabilir. Sabit astarlar bir parça eklemez ve ileri astar veya ters astar olabilir, ancak her ikisi birden olamaz.
| Bileşen Adı | 1 reaksiyon için hacim (μL) | X reaksiyon sayısının %110'u için hacim (μL) |
| Hücre Özü | 4.2 | |
| Ek Karışım | 3.3 | |
| GamS Proteini (207 μM) | 0.15 | |
| Şablon DNA (20 nM) | 1 | |
| T7 Polimeraz (13 mg/mL) | 0.12 | |
| Su | 0.73 (bu sayı değişebilir) | |
| Ana Karışım Toplamı: | 9 | |
| Baskılayıcı Protein: | 1 |
Tablo 2: CFPS reaksiyonları için reaktiflerin hazırlanması için çalışma sayfası. En sağdaki sütundaki değerler, amaçlanan tepki sayısına bağlı olarak kullanıcılar tarafından doldurulabilir.
Tartışmalar
Burada açıklanan protokoller, CFPS tarafından bir muhabir proteininin ekspresyonu yoluyla genetik parçaları taramak için uygun maliyetli ve hızlı bir araç sağlar. İyi karakterize edilmiş genetik parçalar, yararlı işlevlere sahip öngörülebilir genetik devrelerin tasarımı için çok önemlidir. Bu metodoloji, canlı hücrelerde çalışma gereksinimini ortadan kaldırarak verimi arttırır ve yeni genetik parçaları taramak için gereken süreyi azaltırken, hücre lizatındaki protein ekspresyonunun metabolik sürecini koruyarak hücresel ortamı yansıtan işlevselliği korur. Protokolümüz, primerlerin alınmasından sonraki 1 gün içinde gerçekleştirilebilir (reaksiyon hazırlığı için ~ 2.5-6 saat, CFPS reaksiyonu için 2-16 saat; Şekil 1), geleneksel klonlama için en az 3 günle karşılaştırıldığında (yapı montajı ve dönüşümü, klonların dizi doğrulaması ve değerlendirme için hücrelerin kültürlenmesi için her biri 1 gün). Ayrıca, lineer DNA kullanan yapı başına maliyetin geleneksel klonlamanın kabaca üçte biri olduğunu tahmin ediyoruz (78 $ 'a karşı 237 $; Ek Tablo 1) Yöntemler. Ticari sentez hizmetleri şu anda boyuta bağlı olarak en az 4 iş günü teklif vermektedir, ancak doğrusal parçalar doğrudan CFPS'de taranırsa yöntemimize benzer maliyetlere sahip olacaklardır (78 $ 'a karşı 91 $); bu yaklaşımı doğrulamadık. CFPS ile bir parçayı değerlendirmenin maliyeti, şablon DNA'sının oluşturulmasına kıyasla küçüktür (şablon başına 0,05 $ / reaksiyon22 $ 'a karşı 78 $), ancak toplu reaktifler ve lizis ekipmanı için başlangıç maliyetlerinin en az birkaç bin dolar olduğu belirtilmelidir. Akustik bir sıvı işleyicinin kullanılması, 0,5 μL40'a kadar daha küçük hacimler sağlayarak maliyetleri yalnızca marjinal olarak artırır; daha önemli avantaj, reaksiyonları hazırlama süresinin azaltılmasıdır (reaksiyon sayısına bağlı olarak ~ 10 dakikaya karşı 1 saate kadar), özellikle çok sayıda reaksiyon hazırlanırken, inkübasyondan önce uzun süre oturan hazırlanmış reaksiyon endişelerini gündeme getirir.
Hızlı ve uygun maliyetli olmakla birlikte, CFPS prototiplemenin in vivo fonksiyonu yeterince öngördüğü zamanlardaki sınırlamalar görülmeye devam etmektedir. Örneğin, CFPS sisteminin üretimi sırasında konakçı genomunun çıkarılması nedeniyle genomik DNA ile herhangi bir çapraz reaktivite tespit edilmeyecektir. Ayrıca, bileşen konsantrasyonları, CFPS'de hücre51'den 1-2 kat daha düşük olabilir, bu da farklı makromoleküler kalabalıklaşma koşullarının bir sonucu olarak bazı parçaların davranışını etkileyebilir. Ayrıca, lineer DNA'nın in vivo fonksiyonu tahmin etme yeteneği, örneğin DNA ikincil yapısı önemli bir rol oynadığında, sınırlı olabilir. Son bir sınırlama, yapıların işlevleri test etmeden önce sıralı olarak doğrulanmamasıdır. Karakterize edilen parçanın aslında amaçlanan teorik diziyle aynı hizada olmadığı durumlar olabilir. Tüm bu sınırlamalar, amaçlanan in vivo uygulamada bu yöntemle taranan parçaların bir alt kümesinin doğrulanmasıyla hafifletilebilir.
Bu metodolojiyi başlangıçta operatör pozisyonunu değiştirmenin hibrit T7-tetO promotörleri üzerindeki etkilerini araştırmak için geliştirdik32. Protokolleri burada daha genel bir biçimde sunduk, böylece promotörlere, operatörlere, ribozom bağlama dizilerine, yalıtkanlara ve sonlandırıcılara uygulanabilirler. Bu genetik parçalar, her tasarım için primerler kullanılarak PCR ile muhabir geninin 5 veya 3 ʹ ucuna eklenebilir ve test etmek için her varyantın sentezlenmesi veya klonlanması ihtiyacını ortadan kaldırır. Elde edilen PCR ürünleri, bir muhabir proteininin ekspresyonu yoluyla değerlendirme için şablon DNA görevi görür. Çalışmamızda, burada sağlanan afinite saflaştırma protokolü TetR ve GamS için kullanılmıştır. Aynı prosedür, diğer baskılayıcıların, aktivatörlerin, polimerazların, sigma faktörlerinin ve diğer proteinlerin ekspresyonu ve saflaştırılması için kullanılabilir, ancak istenen proteinin eksprese edilmesi için modifikasyonlara ihtiyaç duyulabilir. Bu proteinlerin CFPS reaksiyonlarına saflaştırılması ve titrasyonlanması, belirli bir genetik parçanın daha ayrıntılı bir karakterizasyonunu sağlar. Son olarak, çok sayıda alternatif CFPS protokolü mevcuttur ve her biri metodolojinin parça tarama kısmına uygun olmalıdır. Örnek olarak, bu protokole, diğerlerinin doğal bakteri promotörlerinden ifade için önemli olduğunu bulduğu bir diyaliz adımını dahil etmiyoruz22. CFPS'nin altında yatan bileşen bileşenlerinin konsantrasyonlarını değiştirmek de mümkündür. Sıvı elleçleme kullanımı, verimi artırarak ve gerekli malzemeleri azaltarak sayısız koşulu test etme yeteneğini geliştirir34,35.
Önemli sorun giderme gerektirebilecek bir alan, akustik sıvı işleyicisinin optimizasyonudur. Akustik sıvı işleyici dağıtımı, aktarılan her bileşen için optimize edilmelidir ve veri toplamadan önce doğru dağıtımı ve tekrarlanabilirliği doğrulamak için kontrollerin çalıştırılması şiddetle tavsiye edilir. İdeal kaynak plaka tipi ve sıvı sınıfı ayarı, dağıtılacak spesifik sıvıya ve bileşenlerine bağlı olacaktır. Amin kaplama DNA ile etkileşime girebileceğinden, DNA'yı dağıtmak için amin kaplı plakaların kullanılması önerilmez. Ayrıca, belirli bileşenlerin daha yüksek konsantrasyonlarını dağıtma yeteneğinin akustik sıvı işleyici modeline bağlı olabileceği de belirtilmelidir. Başarılı damlacık oluşumunu görselleştirmek için bir folyo plakası contasına dağıtılarak bir test sıvısı transferi gerçekleştirilebilir; ancak, bu test sınırlı bilgi sağlar ve farklı ayarlardan gelen damlacıklar aynı görünebilir. Tartrazin gibi suda çözünür bir boyanın kullanılması, belirli bir ayar veya iş akışıyla doğru hacmin dağıtıldığını daha doğru bir şekilde doğrulamak için kullanılabilir (bkz. Sıvı transferlerinin optimum programlanması, üretilen verilerin doğruluğunu ve tutarlılığını da etkileyebilir; Bir kaynaktan bir varış noktasına >1 μL transferler için, ≤1 μL'nin sıralı transferlerinin sistematik kuyudan kuyuya değişkenliği azaltmak için programlanması gerektiğini bulduk (Şekil 4). Son olarak, teorik ve gerçek kaynak kuyusu ölü hacimleri, kaynak plaka tipine, sıvı sınıfı ayarına ve spesifik sıvının bileşenlerine bağlı olarak önemli ölçüde değişebilir; Bir programı çalıştırmadan önce kuyu hacimlerini değerlendirmek için akustik sıvı işleyici anket fonksiyonunu kullanmak, cihazın belirli bir sıvıyı ne kadar doğru ölçebildiğini ölçmeye yardımcı olabilir.
CFPS reaksiyon performansı, farklı kullanıcılar, malzeme grupları, plaka okuyucular ve laboratuvarlar arasındaki sonuçları karşılaştırırken değişebilir41. Genetik devrelerin prototipini oluştururken bu tür karşılaştırmaların gerekli olduğu durumlarda, deney düzenekleri arasında sonuçların normalleştirilmesine yardımcı olmak için her reaksiyon plakasına standart kurucu destekleyicilerle iç kontrol reaksiyonlarının dahil edilmesini öneririz. DNA hazırlama yöntemi de CFPS aktivitesine büyük ölçüde katkıda bulunabilir; Bir etanol çökeltme adımının dahil edilmesi önerilir. Ek olarak, optimum reaksiyon bileşimi, ekstrakt34 partisine göre değişebilir. Özellikle optimal magnezyum glutamat ve potasyum glutamat konsantrasyonlarının, parti42'ye veya kullanılan promotör veya raporlayıcı protein24 ile değiştiği gösterilmiştir. Bu bileşenlerin konsantrasyonları, protein ekspresyonu için en uygun koşulları belirlemek için genetik yapı başına ve hücre ekstresi hazırlığı başına her bileşenin birkaç konsantrasyonu taranarak optimize edilmelidir. Son olarak, tutarlı CFPS reaksiyon performansı için en iyi uygulamalar arasında kapsamlı karıştırma, dikkatli pipetleme ve her bir reaktif bileşeninin hazırlanmasında tutarlılık yer alır.
Tek tek parçaların karakterizasyonunun ötesinde, aynı yöntem, mantık devreleri16 veya osilatörler52,53 gibi karmaşık devreleri oluşturan parçaların kombinasyonlarını taramak için de kullanılabilir. Bu yöntem aynı zamanda epidemiyolojik teşhis54,55,56,57 veya tehlike tespiti ve nicelleştirme 3,58,59'daki uygulamalar için biyosensörlerin taranması ve optimize edilmesine de uygulanabilir. Aktif öğrenme34 gibi yapay zeka odaklı tekniklerin uygulanması, karmaşık biyolojik tasarım alanlarının hızlı bir şekilde araştırılmasını sağlamak için bu yöntemin yüksek verimli doğasıyla da eşleştirilebilir. Nihayetinde, sentetik biyolojide yeni genetik tasarımlar için hızlandırılmış gelişim sürelerini destekleyen bu yaklaşımı öngörüyoruz.
Açıklamalar
RMM, protein ekspresyonu ve taraması için bu makalede açıklananlar gibi hücresiz teknolojilerden yararlanan özel bir şirket olan Tierra Biosciences'ta finansal bir paya sahiptir.
Diğer yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Savunma Sekreteri'nin Bilim ve Teknoloji Önceliklerinin Geliştirilmesi için Uygulamalı Araştırma Programı Ofisi tarafından mümkün kılındı. Kullanılan sfGFP stoğunu sağladığı için Scott Walper'a (Deniz Araştırma Laboratuvarı) ve hücresiz sistemlerle prototipleme ve akustik sıvı işlemenin ilgili sorun giderme ile ilgili verimli tartışmalar için Zachary Sun ve Abel Chiao'ya (Tierra Biosciences) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2x YT medium | Sigma-Aldrich | Y2377-250G | Alternative to making 2xYT media |
| Agar | Bacto | 214010 | For plating cells |
| Chromatography column (5 cm diameter) | BIO-RAD | 731-1550 | Used for protein purification. |
| Destination plate | Thermo Scientific Nunc plate | 142761 | For CFPS reactions |
| DMSO | Sigma-Aldrich | D2650 | For dialysis buffer |
| DpnI | NEB | R0176L | For digestion of plasmid templates |
| DTT | Roche | 20871723 | S30 Buffer B |
| E. coli BL21(DE3) Rosetta2 | Novagen | 70954 | Cell line used for production of lysate and purified proteins |
| Echo acoustic liquid handler | Labcyte | 525 | Acoustic liquid handler |
| French pressure cell | Thermo Spectronic | FA-078 | For lysing cells for CFPS |
| Imidazole | Sigma-Aldrich | 56750 | For buffers |
| Impermeable plastic sealable lid | Thermo | 232702 | Plate seal |
| IPTG | RPI | I56000-25.0 | Used for protein induction. |
| K-Glu | Sigma-Aldrich | g1501-500G | S30 Buffer B |
| Labcyte Echo source plate | Labcyte | PL-05525 | For use with Echo acoustic liquid handler |
| Mg-Glu | Sigma-Aldrich | 49605-250G | S30 Buffer B |
| NaCl | Sigma-Aldrich | S7653-250G | For buffers |
| NaHPO4 | Sigma-Aldrich | 71505 | For dialysis buffer |
| NaOH | Mallinckrodt Chemicals | 7708-10 | For making 2xYT media. Currently not produced by Mallinckrodt. Alternate: Sigma-Aldrich S0899 |
| Ni-NTA resin | Invitrogen | R901-15 | For production of purified proteins |
| PCR H2O | Ambion | AM9937 | PCR of linear templates |
| Plate Reader | BioTek | H10 | Plate reader used |
| Q5 PCR Master Mix | NEB | M0494S | PCR of linear templates |
| QIAquick Gel Extraction Kit | Qiagen | 28606 | PCR of linear templates |
| QIAquick PCR Purification Kit | Qiagen | 28004 | PCR of linear templates |
| QSonica Ultrasonic Processor | Qsonica | Q700 | Cell disruption during protein purification |
| RTS Amino Acid Sampler | biotechrabbit | BR1401801 | Updated supplier from Sun et al. |
| Tris | MP | 819623 | S30 Buffer B |
| Tris-Cl | Sigma-Aldrich | T5941 | For buffers |
| Tryptone | Fluka | T7293 | For making 2xYT media |
| Yeast Extract | Bacto | 212750 | For making 2xYT media |
Referanslar
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nature Reviews. Molecular Cell Biology. 10 (6), 410-422 (2009).
- Saltepe, B., Kehribar, E. &. #. 3. 5. 0. ;., Su Yirmibeşoǧlu, S. S., Şafak Şeker, U. &. #. 2. 1. 4. ;. Cellular biosensors with engineered genetic circuits. ACS Sensors. 3 (1), 13-26 (2018).
- Bereza-Malcolm, L. T., Mann, G., Franks, A. E. Environmental sensing of heavy metals through whole cell microbial biosensors: A synthetic biology approach. ACS Synthetic Biology. 4 (5), 535-546 (2015).
- Mimee, M., et al. An ingestible bacterial-electronic system to monitor gastrointestinal health. Science. 360 (6391), 915-918 (2018).
- Isabella, V. M., et al. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nature Biotechnology. 36 (9), 857-867 (2018).
- Healy, C. P., Deans, T. L. Genetic circuits to engineer tissues with alternative functions. Journal of Biological Engineering. 13, 39 (2019).
- Kaushik, A., Tiwari, S., Dev Jayant, R., Marty, A., Nair, M. Towards detection and diagnosis of Ebola virus disease at point-of-care. Biosensors and Bioelectronics. 75, 254-272 (2016).
- Jagadevan, S., et al. Recent developments in synthetic biology and metabolic engineering in microalgae towards biofuel production. Biotechnology for Biofuels. 11, 185 (2018).
- Keating, K. W., Young, E. M. Synthetic biology for bio-derived structural materials. Current Opinion in Chemical Engineering. 24, 107-114 (2019).
- Smanski, M. J., et al. Synthetic biology to access and expand nature's chemical diversity. Nature Reviews Microbiology. 14 (3), 135-149 (2016).
- Xiang, Y., Dalchau, N., Wang, B. Scaling up genetic circuit design for cellular computing: advances and prospects. Natural Computing. 17 (4), 833-853 (2018).
- Galdzicki, M., Rodriguez, C., Chandran, D., Sauro, H. M., Gennari, J. H. Standard biological parts knowledgebase. PLoS One. 6 (2), 17005 (2011).
- Kelwick, R., Bowater, L., Yeoman, K. H., Bowater, R. P. Promoting microbiology education through the iGEM synthetic biology competition. FEMS Microbiology Letters. 362 (16), (2015).
- Torella, J. P., et al. Unique nucleotide sequence-guided assembly of repetitive DNA parts for synthetic biology applications. Nature Protocols. 9 (9), 2075-2089 (2014).
- Halleran, A. D., Swaminathan, A., Murray, R. M. Single day construction of multigene circuits with 3G assembly. ACS Synthetic Biology. 7 (5), 1477-1480 (2018).
- Nielsen, A. K., et al. Genetic circuit design automation. Science. 352 (6281), (2016).
- Canton, B., Labno, A., Endy, D. Refinement and standardization of synthetic biological parts and devices. Nature Biotechnology. 26 (7), 787-793 (2008).
- Boehm, C. R., Bock, R. Recent advances and current challenges in synthetic biology of the plastid genetic system and metabolism. Plant Physiology. 179 (3), 794-802 (2019).
- Takahashi, M. K., et al. Characterizing and prototyping genetic networks with cell-free transcription-translation reactions. Methods. 86, 60-72 (2015).
- Chappell, J., Watters, K. E., Takahashi, M. K., Lucks, J. B. A renaissance in RNA synthetic biology: New mechanisms, applications and tools for the future. Current Opinion in Chemical Biology. 28, 47-56 (2015).
- Endy, D. Foundations for engineering biology. Nature. 438 (7067), 449-453 (2005).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: an expanded repertoire of applications. Nat. Reviews. Genetics. 21 (3), 151-170 (2020).
- Dopp, J. L., Rothstein, S. M., Mansell, T. J., Reuel, N. F. Rapid prototyping of proteins: Mail order gene fragments to assayable proteins within 24 hours. Biotechnology and Bioengineering. 116 (3), 667-676 (2019).
- Garamella, J., Marshall, R., Rustad, M., Noireaux, V. The all E. coli TX-TL toolbox 2.0: A platform for cell-free synthetic biology. ACS Synthetic Biology. 5 (4), 344-355 (2016).
- Kopniczky, M. B., et al. Cell-free protein synthesis as a prototyping platform for mammalian synthetic biology. ACS Synthetic Biology. 9 (1), 144-156 (2020).
- Kelwick, R., et al. Cell-free prototyping strategies for enhancing the sustainable production of polyhydroxyalkanoates bioplastics. Synthetic Biology. 3 (1), (2018).
- Karim, A. S., et al. In vitro prototyping and rapid optimization of biosynthetic enzymes for cell design. Nature Chemical Biology. 16 (8), 912-919 (2020).
- Takahashi, M. K., et al. Rapidly characterizing the fast dynamics of RNA genetic circuitry with cell-free Transcription-Translation (TX-TL) systems. ACS Synthetic Biology. 4 (5), 503-515 (2015).
- Chappell, J., Jensen, K., Freemont, P. S. Validation of an entirely in vitro approach for rapid prototyping of DNA regulatory elements for synthetic biology. Nucleic Acids Research. 41 (5), 3471-3481 (2013).
- Borkowski, O., et al. Cell-free prediction of protein expression costs for growing cells. Nature Communications. 9 (1), 1457 (2018).
- Dudley, Q. M., Karim, A. S., Nash, C. J., Jewett, M. C. In vitro prototyping of limonene biosynthesis using cell-free protein synthesis. Metabolic Engineering. 61, 251-260 (2020).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- Sun, Z. Z., Yeung, E., Hayes, C. A., Noireaux, V., Murray, R. M. Linear DNA for rapid prototyping of synthetic biological circuits in an escherichia coli based TX-TL cell-free system. ACS Synthetic Biology. 3 (6), 387-397 (2014).
- Borkowski, O., et al. Large scale active-learning-guided exploration for in vitro protein production optimization. Nature Communications. 11 (1), 1872 (2020).
- Caschera, F., et al. High-throughput optimization cycle of a cell-free ribosome assembly and protein synthesis system. ACS Synthetic Biology. 7 (12), 2841-2853 (2018).
- Iyer, S., Karig, D. K., Norred, S. E., Simpson, M. L., Doktycz, M. J. Multi-input regulation and logic with T7 promoters in cells and cell-free systems. PLoS One. 8 (10), 78442 (2013).
- Karig, D. K., Iyer, S., Simpson, M. L., Doktycz, M. J. Expression optimization and synthetic gene networks in cell-free systems. Nucleic Acids Research. 40 (8), 3763-3774 (2012).
- Jung, J. K., et al. Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnology. 38 (12), 1451-1459 (2020).
- Bailey, J., Eggenstein, E., Lesnick, J. Miniaturization and rapid processing of TXTL reactions using acoustic liquid handling. Labcyte Technical Note. , 1-12 (2018).
- Marshall, R., Garamella, J., Noireaux, V., Pierson, A. High-throughput microliter-sized cell-free transcription-translation reactions for synthetic biology applications using the echo 550 liquid handler. Labcyte Application Note. , 1-6 (2018).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Dopp, J. L., Tamiev, D. D., Reuel, N. F. Cell-free supplement mixtures: Elucidating the history and biochemical utility of additives used to support in vitro protein synthesis in E. coli extract. Biotechnology Advances. 37 (1), 246-258 (2019).
- Cole, S. D., Miklos, A. E., Chiao, A. C., Sun, Z. Z., Lux, M. W. Methodologies for preparation of prokaryotic extracts for cell-free expression systems. Synthetic and Systems Biotechnology. 5 (4), 252-267 (2020).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of Biotechnology. 110 (3), 257-263 (2004).
- Marshall, R., Maxwell, C. S., Collins, S. P., Beisel, C. L., Noireaux, V. Short DNA containing χ sites enhances DNA stability and gene expression in E. coli cell-free transcription-translation systems. Biotechnology and Bioengineering. 114 (9), 2137-2141 (2017).
- Yim, S. S., Johns, N. I., Noireaux, V., Wang, H. H. Protecting linear DNA templates in cell-free expression systems from diverse bacteria. ACS Synthetic Biology. 9 (10), 2851-2855 (2020).
- Zhu, B., et al. Increasing cell-free gene expression yields from linear templates in Escherichia coli and Vibrio natriegens extracts by using DNA-binding proteins. Biotechnology and Bioengineering. 117 (12), 3849-3857 (2020).
- Tuckey, C., Asahara, H., Zhou, Y., Chong, S. Protein synthesis using a reconstituted cell-free system. Current Protocols in Molecular Biology. 108, 1-22 (2014).
- Hoffman, R. A., Wang, L., Bigos, M., Nolan, J. P. NIST/ISAC standardization study: Variability in assignment of intensity values to fluorescence standard beads and in cross calibration of standard beads to hard dyed beads. Cytometry. Part A. 81 (9), 785-796 (2012).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical Review Letters. 106 (4), 048104 (2011).
- Rossi, N. A., Dunlop, M. J. Making waves with synthetic oscillators. Cell Systems. 6 (4), 406-407 (2018).
- Niederholtmeyer, H., et al. Rapid cell-free forward engineering of novel genetic ring oscillators. eLife. 4, 09771 (2015).
- Chang, H., Voyvodic, P. L., Structurale, C. D. B. Microbially derived biosensors for diagnosis, monitoring and epidemiology. Microbial Biotechnology. 10 (5), 1031-1035 (2017).
- Pardee, K., et al. low-cost detection of Zika virus using programmable biomolecular components. Cell. 165 (5), 1255-1266 (2016).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Liu, X., Germaine, K. J., Ryan, D., Dowling, D. N. Whole-cell fluorescent biosensors for bioavailability and biodegradation of polychlorinated biphenyls. Sensors. 10 (2), 1377-1398 (2010).
- Gautam, P., Suniti, S., Amrita, K., Madathil, D., Nair, B. A Review on Recent Advances in Biosensors for Detection of Water Contamination. International Journal of Environmental Sciences. 2 (3), 1565-1574 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır