Method Article
基于莱萨特的无细胞系统中的代谢物分析液色谱耦合折射指数或质谱检测
摘要
协议描述了高性能液相色谱方法,以及用于研究复杂赖酸基无细胞系统代谢反应的折射指数或质谱检测。
摘要
工程细胞代谢目标生物合成可能需要广泛的设计-构建-测试-学习(DBTL)周期,因为工程师围绕细胞的生存要求工作。或者,在无细胞环境中执行 DBTL 循环可以加速此过程并缓解与主机兼容性的担忧。无细胞代谢工程 (CFME) 的一种很有前途的方法利用代谢活性粗细胞提取物作为生物制造和快速发现和原型化改性蛋白质和途径的平台。实现这些功能并优化 CFME 性能需要方法来描述基于 lysate 的无细胞平台的代谢体。即,分析工具对于监测目标代谢物转化的改进以及在操纵赖萨特代谢时对代谢通量的改变是必要的。在这里,使用高性能液相色谱 (HPLC) 以及光学或质谱检测的代谢物分析应用于 大肠杆 菌 S30 解变物的代谢物生产和通量特征。具体来说,本报告描述了使用折射指数检测 (RID) 为 HPLC 分析准备 CFME 解质样品,以量化中央代谢中间体和副产品的生成,将低成本基板(即葡萄糖)转化为各种高价值产品。此外,还介绍了通过反向相液相色谱加上串联质谱 (MS/MS) 来喂养 13个 C 标记葡萄糖的 CFME 反应中的代谢物转化分析,这是一种从起始材料中描述特定代谢物产量和溶解代谢通量的强大工具。总之,将这些分析方法应用于 CFME 解酶代谢,使这些系统能够作为执行更快或新颖代谢工程任务的替代平台。
引言
化学生产工程微生物的局限性可以通过在体外重新总结生物化学反应来解决,因为体外缺乏相互竞争的细胞生存功能。此外,开放反应环境(即没有细胞膜)更易于操作,与活细胞相比更容易监测。这种无细胞代谢工程(CFME)的基础概念通过重组代谢途径,将氢气和单体等有价值的化学物质与生产指标合成,其数量级高于微生物细胞工厂迄今提出的1、2、3 .然而,净化整个途径的方法目前受到时间和成本的限制。或者,无细胞代谢系统可以通过快速和廉价的方法从粗细胞提取物中提取,相对于整个路径重组4。保留在细胞提取物中的中央代谢可以补充能量基质(例如葡萄糖和酶同因子)和缓冲溶液中的盐,以产生超过24h5、6的中央代谢前体。在基于溶酶的CFME反应中加入外源酶,使葡萄糖在高滴答声4、6、7中转化为更有价值的化学物质的更复杂的生物转化。虽然由于细胞状代谢的复杂性,这些系统的产量往往会受到影响,但用于高产转化的解质蛋白体的独特方法已经并正在开发中。
在基于解质的无细胞系统中进行代谢转化的便利性,使得这些优秀的平台要么将化学制造完全移出细胞,要么在构建和测试这些设计之前,在活体2、9中构建和测试高吞吐量的新路径。无论是应用,监测代谢转化的工具,还是观察解质中代谢通量整体变化的工具,都是CFME进步不可或缺的一部分。高性能液相色谱 (HPLC) 可用于将 CFME 反应的化学成分与高分辨率分离,并可与光学或质谱探测器耦合,用于代谢物定量5、10。HPLC 的基本原则是,溶剂(即移动相)溶解并通过列泵送的分析物将与特定列包装材料(即静止相)11进行交互。根据其化学特性,这些分析在最终从静止相中分离并由移动相携带到探测器之前表现出不同的保留时间。本报告详细介绍了通过基于 HPLC 的方法利用 RID 和 MS/MS 检测对基于大肠杆菌的 CFME 反应进行制备和分析。
HPLC 耦合折射指数检测 (HPLC-RID) 是一种通常可快速识别中央代谢前体和最终产品的方法。简言之,RID 测量分析如何通过移动阶段12改变光的偏转。然后,通过与标准解决方案的 RID 信号进行比较,可以量化样本中与目标分析物对应的 RID 信号。在 CFME 应用中,这种检测模式最常用于 HPLC 列,该列基于大小排除和配体交换机制(离子介质分区色谱5、6、8、13)的组合将化合物分开。这种特殊的技术用于快速量化糖基的消耗,如葡萄糖,以及形成发酵产品,如精密,乳酸盐,富甲酸盐,醋酸盐和乙醇在溶酶为基础的CFME反应8。通过 HPLC 记录这些化合物的浓度变化对于阐明粗细胞提取物汇集中央代谢前体的潜力和了解在从溶酶6、8、14中的葡萄糖进行复杂代谢转换过程中,通路通量如何通过发酵通路重定向都很有用。大肠杆菌提取物中的开创性CFME研究证实,发酵化合物作为葡萄糖代谢的最终产物积累,在溶酶中也作为不需要的副产品发生,过度表达外源性酶6,15。有人建议,发酵代谢在再生共生物(即NAD(P)H和ATP)的氧化物等价物以维持糖解反应8方面起着必要的作用。因此,基于 HPLC 的光学检测方法旨在分离发酵产品,是执行各种基于解剖的 CFME 任务时有用且常用的工具。
CFME可以实施积累代谢最终产品,不是碳水化合物,有机酸,或酒精4。中间体的测量,消耗一样快,因为他们被合成可能也是可取的10。虽然 HPLC-RID 在成本和难度方面是可访问的,但这种方法受制于它仅根据保留时间区分代谢物的能力。当液相色谱与MS/MS检测(LC-MS/MS)16耦合时,可以分析更广泛的代谢物。通过这种方法,根据每个分子的质量和电荷特性,对移动相中的分析物进行电电和差分检测。了解代谢物的质量对电荷(m/z)比率和柱子上的保留时间,从而促进大多数代谢中间体和高分辨率16的最终产品的分离。这种检测技术还可以与纳米液体色谱相结合,后者提供更低的流速和样品注射量,从而能够更灵敏地检测复杂解化物背景17中的小分子。LC-MS/MS 可以与同位素标签一起应用,因为合并的标签会传递分析仪 m/z 值18的变化。从 CFME 反应中提取的时间点测量,辅以13C6葡萄糖基板,从而确定特别来自补充葡萄糖的最终或副产品。虽然这种同位素追踪方法尚未在CFME研究中普遍应用,但它是了解基于赖氨酸的CFME系统代谢转换的有力工具,特别是因为这些反应中的盐抗(即醋酸酯和谷氨酸)也作为次要基材19被催化。因此,利用这项技术可以全面了解溶酶中的葡萄糖代谢,而时至今日,这种新陈代谢还没有完全被理解。在此,协议详细说明了纳米液体色谱加上纳米电极电解 (nano ESI) MS/MS 的方法,可用于询问葡萄糖代谢的可能模型,特别是在大肠杆菌解剖中(图 1)。该模型是基于发酵途径和五氯苯甲酸酯通路活跃于大肠杆菌解析物中的报告,这些菌株来自富集介质5、6、8、14中生长的菌株。该技术还用于研究氨基酸的产生,因为目前关于裂解酶中葡萄糖的氨基酸解剖的知识仅限于一些例子,如芳香氨基酸7的合成。鉴于这些通路中最终产品和中间体(即有机酸、磷酸糖和氨基酸)的极性,这里使用了反相液相色谱。该技术通过从非极性静止阶段中分离出极地化合物。然后,这些化合物通过纳米 ESI 在负离子模式下电镀,从而允许检测至少一个负基本电荷的分析物,因此可用于检测酸性化合物。此技术用于分析葡萄糖衍生的13C 结合代谢物,并演示 LC-MS/MS 在了解溶酶中的葡萄糖代谢方面的作用。
研究方案
1. HPLC-RID 量化的开始、停止和处理时间过程 CFME 反应。
- 解冻之前准备 大肠杆菌 解冻,并准备在冰上的其他反应成分。
注:这里报告的溶酶来自 大肠杆菌 BL21DE3星生长在2xYPTG(1.8%葡萄糖)介质到中日志阶段。- 准备适当的过滤消毒量(0.20 μm 孔过滤器)S30 缓冲器(1 M Tris-OAc 调整为 pH 8.2,含冰川醋酸,1.4 M Mg(OAc)2和 6 M KOAc)。
- 在 S30 缓冲器中准备含有葡萄糖、谷氨酸盐、ATP、Coenzyme A、NAD®、Bis-Tris 缓冲器和磷酸二元体的能量组合。用于准备 CFME 反应的预期反应体积中的最终浓度为 100 mM 葡萄糖, 18 mM 谷氨酸镁、15 mM 谷氨酸铵、195 mM 谷氨酸钾、1 mM ATP、0.2 mM Coenzyme A、1 mM NAD+、150 mM Bis-Tris 和 10 mM 磷酸二元。
- 将 1.5 mL 微中心管中的组件组合在一起,准备最终反应与总解化蛋白 4.5 毫克/毫升。在这里,CFME 反应的编制与最终卷 50 μL 在三重时间点。将反应孵化为 37 °C,以备其各自的时间范围。
注意:快速工作,将溶酶作为反应组合的最后组成部分,以防止葡萄糖和谷氨酸盐的过早代谢反应。根据反应混合物在冰上孵育的时间,可以进行最少的葡萄糖消耗。 - 终止反应并处理样本以进行 HPLC-RID 分析。
- 要在适当的时间点终止三叶草反应,请立即在每个样本的最终反应体积中加入等量的 5% 三氯乙酸(即 50 μL 的 5% 三氯乙酸到 50 μL 反应)。将每个样品以2倍于反应量(即100微升)的无菌水稀释。
- 要重新概括时间零,在添加其他反应成分之前,将 5% 三氯乙酸的体积与总最终反应体积(即 50 μL)与解酯混合。这种酸化步骤在溶酶显著代谢葡萄糖之前沉淀它们。
- 将样品和离心机以 11,600 x g 的速度在台面微中心上涡流 5 分钟,并将含有有机分析剂的超分子转移到清洁管中。如果 HPLC 分析要在不同的一天进行,则将样品存储在 -20 °C。确保解冻冰上储存的样品,然后再进入下一步。
- 用 0.22 μm 孔隙过滤器过滤每个超高人。作为注射器的替代品,使用离心机管过滤器和离心机的超分子在16,300 x g 1分钟。
- 将每个过滤器转移到干净的 HPLC 玻璃瓶中。将小瓶加载到 HPLC 自动采样器托盘上。
- 为标准曲线生成准备样品。
- 准备所有溶解在 S30 缓冲器中的目标分析物的库存溶液,其含量均高于 CFME 反应中葡萄糖的起始浓度。在这里,准备了由150微米葡萄糖、精明、哺乳、富甲酸盐、醋酸盐和乙醇组成的库存溶液。从库存溶液中执行 1:1 (v/v) 串行稀释,以获得三重 50 μL 解决方案,最终浓度从 0 μM 到库存浓度(即 150 μM)不等。
- 用 50 微升 5% 三氯乙酸和 100 μL 无菌水稀释每个溶液。重复步骤 1.3.4-1.3.5。
注:每批样品运行标准曲线生成解决方案,确保代谢物浓度的准确量化。
2. 准备用于代谢物检测的 HPLC 系统。
- 在烟气罩下,用去离子化和过滤灭菌水制备消毒的 5mM 硫酸溶液。将 98% HPLC 级硫酸溶液的 +550 μL 加入 2 升水中,以准备 5 mM 硫酸。
注意:硫酸是一种危险的化学物质,在烟雾罩下使用适当的实验室 PPE 可防止吸入、皮肤接触和眼神交流。浓缩硫酸与水发生强烈反应,应直接添加到水中,而不是相反。储存在远离阳光直射的凉爽干燥区域,并遵循实验室设定的适当的废物处理措施。 - 将 2 L 瓶 5 mM 硫酸孵育在 HPLC 仪器旁边的水浴中。将水浴设置为 35 °C。 将带溶剂过滤器的管子放入溶剂瓶中,并将另一端连接到与泵模块一致的脱气器模块。
注:在安装柱子之前,用新准备的溶剂清除系统是良好的仪器处理实践。 - 将 HPLC 仪器与 HPLC 列配合RID 模块进行装备。如果没有柱式恒温器,将柱子放在 35 °C 水浴中。
- 在系统计算机上安装的色谱数据系统 (CDS) 软件中,准备 35 °C 的 RID 模块进行分析。
- 在 "查看" 菜单中,选择 "方法 "并运行 "控制视图"。右键单击 泵模块>方法。将流速设置为 0.55mL[min-1], 并选择 "开启 "按钮启动泵。
注:如果柱子在 HPLC 上配备之前已存储,则根据制造商的指示对列进行平衡后,将流量提升至0.55 mL/min -1。 - 右键单击与 RID模块>方法对应的面板。将 RI 探测器模块的温度设置为 35 °C,并选择 On 开始加热 RI 探测器模块。
- 右键单击面板 RID 模块>控制。使用 新鲜 溶剂时,选择 "清除参考单元" 至少 15 分钟,如果在此设置之前不同的溶剂流经 RI 探测器,则选择 1 小时。单击 "打开" 按钮。
注意:保持泵和 RI 探测器 打开 ,以实现在线图景的稳定基线。这受实验室温度波动的影响,可能需要长达 4 小时或更长时间。 在 样品加载之前,请将系统保持通宵。
- 在 "查看" 菜单中,选择 "方法 "并运行 "控制视图"。右键单击 泵模块>方法。将流速设置为 0.55mL[min-1], 并选择 "开启 "按钮启动泵。
3. 创建 CDS 中有机发酵产品的异位 HPLC 分离方法。
- 从菜单栏中,选择 方法>新方法。选择 方法>保存方法 作为 [方法名].M. 选择 方法>编辑整个方法>仪器/获取
- 在 二进制泵 选项卡内,将流量设置为 0.55 mL+min-1。在 溶剂下,选择与泵模块上的溶剂输入对应的字母,并将其设置为 100% 用于同位素化。将 压力限制 设置为 0 和 400 条,并输入 30 分钟作为 停止时间。
- 在取样器选项卡内,将注塑量设置为 50 μL。 在停止时间下选择"作为泵/无限制"选项。将绘图速度、弹射速度和绘图位置的高级辅助设置设置设置为 200 μL/min-1、200μL/min-1 和 -0.5 mm。
- 在RID选项卡内,将光学单位温度设置为 35 °C。 在信号下,选择信号获取和峰值宽>0.2分钟。选择作为泵/喷油器选项的停止时间。
- 在RID选项卡中的"高级"下,将模拟输出设置为 5% 零偏移和 500,000 nRIU 以进行衰减。选择信号极性的正选数和分析前自动零的"上"选项。
- 通过选择 方法>保存方法来保存方法。通过选择 方法>负载方法>[方法名]加载该方法。M.
4. 创建自动采样序列表,并启动 HPLC-RID 系统进行数据采集。
- 从菜单栏中,选择 序列>新序列模板。选择 序列>保存序列模板作为[序列序列板名]。S.
- 选择 序列>序列表。根据它们对自动采样器托盘的排列,在 Vial 和 示例名称下分别输入小瓶位置和样本名称对应的附加 "n" 行。从方法名称下拉菜单中选择第 3 步生成的方法,并将 50 μL 输入为每行的 Inj/Vial(每瓶注射)。
- 单击 "应用 "并通过选择 序列模板>"保存序列模板"来保存序列模板。通过选择 序列>负载序列模板> [序列温度板名]确保序列模板加载。S.
- 在实现在线图景的稳定基线后,右键单击面板 RID 模块>控制>关闭回收阀 ,引导溶剂流经 RID 探测器以浪费。要开始数据采集,请从菜单栏中选择 序列 、 序列>运行。
5. 运行后提取和分析数据。
- 从"查看"菜单中选择数据分析视图。从屏幕左侧的文件列表中查找序列文件名。在屏幕上的中心面板上,前往信号视图选择> RID 信号以查看示例色谱图。
- 从屏幕上的顶部面板中选择一排对应于高浓度标准示例的行。注意显示的色谱图上目标分析峰值的保留时间。与目标分析相对应的峰值将沿保留时间轴排列为葡萄糖、精明、乳酸盐、富甲酸盐、醋酸盐和乙醇(补充图1)。
注:色谱图上的第一个大峰值对应于三氯乙酸。其 RI 单元应在所有标准曲线样本中保持一致。通过将每个化合物作为单独的样本运行,验证每个目标分析的保留时间。 - 从标准和反应样本的色谱中提取每个目标分析的峰值区域。
- 辨别兴趣峰值是否由软件很好地集成。绘制红线作为每个峰值的基础,以获得曲线下的准确集成区域。如果自动集成失败(即红线为 askew),请从集成工具集中选择手动集成按钮,并手动绘制峰值基数以集成峰值区域。
注意:如果必须在一个样本中对目标分析执行手动集成,则在所有样本中保持一致并手动集成相同的分析。 - 从"常见工具集"中选择光标工具,单击正确集成的峰值。峰值区域和选定峰值的相应保留时间将作为屏幕底部面板上的表行进行突出显示。
- 要出口旺季,请选择 文件>出口>整合结果。
- 辨别兴趣峰值是否由软件很好地集成。绘制红线作为每个峰值的基础,以获得曲线下的准确集成区域。如果自动集成失败(即红线为 askew),请从集成工具集中选择手动集成按钮,并手动绘制峰值基数以集成峰值区域。
- 使用标准曲线对目标分析浓度进行量化。
- 绘图峰值区域值与电子表格中已知样本浓度。右键单击绘图数据, 添加趋势线>格式趋势线>显示图表上的方程。
- 在单独的电子表格中,使用标准曲线趋势线的方程将峰值区域值转换为每个样本中每个分析的浓度。计算数据可视化三倍体的平均峰值区域和标准错误值。
6. 开始、停止和处理时间过程同位素跟踪 LC-MS/MS 量化的 CFME 反应。
- 设置冰上每个时间点(时间零除外)的三倍反应,如 1.1-1.2 中所述。但是,在反应中使用最终浓度为 100 mM 13C6-葡萄糖,而不是葡萄糖。将反应孵化在 37 °C 下,用于 1 小时、2 小时和 3 小时。
- 要终止,闪光冻结液氮中的反应,并将它们储存在 -80 °C。 跳过此存储步骤进行当日分析。
注:三氯乙酸在通过LC-MS/MS检测某些中央碳代谢物时,没有用于阻止酸的干扰而引起的反应。相反,含有富美酸(第6.3步)的萃取溶剂用于沉淀代谢蛋白,因为富美酸的质量低于报告的MS/MS方法的检测限度。 - 准备 50 mL 的萃取溶剂。将 20 mL 的丙酮三醇、20 mL 甲醇和 10 mL 水(全部 LC-MS 级)与 50 mL 离心机管以及 0.199 mL 的甲基酸混合并混合,以制造 0.1 M 溶液。在萃取过程中将溶剂冷却到 4 °C,并在未使用时将溶剂存储在 -20 °C。
- 用于LC-MS/MS分析的处理样品
- 在分析当天,移液器将提取溶剂的等量(即 50 μL)输送到每个样品中。如果样品被冷冻,在样品完全解冻之前加入提取溶剂,以防止葡萄糖代谢的重新激活。在冰上执行所有样品处理步骤。
- 要重新概括时间零,移液器将提取溶剂的最终体积(即 50 μL)移液到适当的溶质体积,以达到反应中所需的最终浓度(即 50 μL 反应体积中的 4.5 毫克/毫升)。添加第 1.2 步中的其他反应组件。这种酸化步骤在溶酶显著代谢葡萄糖之前沉淀它们。
- 用轻柔的摇晃在冰上提取溶剂中的样品30分钟,然后以21,000 x g 离心15分钟,在4°C下将超高溶剂与沉淀蛋白分离。将 50 μL 的超高超零线转移到自动小瓶中,并将小瓶加载到 4 °C 自动采样器内的托盘上。将其余超高分子存储在 -20 °C 下,以便将来进行分析。
7. 建立LC系统进行LC-MS/MS分析。
- 在 950 mL 水中完全溶解 77.08 毫克醋酸铵和 50 mL 异丙醇,准备 1 升溶剂 A。准备1升溶剂B与650mL的丙酮三聚醇,300mL的水,和50mL的异丙酚以及77.08毫克醋酸铵。确保所有溶剂均为 LC-MS 等级。
- 将含有溶剂 A 和 B 的溶剂瓶连接到泵模块。以高流量清除系统,以消除/限制溶剂设备到 LC 系统期间可能发生的任何空气污染。
- 为系统配备 C18 反向相列(30 厘米柱长、75 μm 内径和 5 μm 颗粒直径)。通过流 100% 溶剂 B 并将列流向 LC-MS 系统,并缓慢向上流向溶剂 A 到 100%。
注:柱尖是内部使用微管拔拉器准备的,并装有压力电池和氦气。
8. 为与傅立更转换和离子陷阱质谱仪相连的LC系统创建LC-MS/MS数据采集和解释软件的方法。
- 打开"调子加号"软件以编辑 MS 方法的调谐文件。
- 从菜单栏上 的文件 ,打开一个预装的负模式调谐文件。
- 在菜单栏上选择 ScanMode, 然后选择 定义扫描窗口。将 Ion 陷阱和 Ft 的 Msn 的微扫描时间设置设置为 1 。
- 转到 Nano-ESI 源的设置,并将 喷雾电压 设置为 4 kV。调节,直到产生可接受的电喷雾;通常,可接受的电喷雾可以在2-5千伏范围内实现。
- 保存调谐文件。
- 使用仪器数据采集和解释软件的 设置向导 生成新的 LC 方法。打开 路线图>序列设置>巫师。由于这些方法不需要使用柱加热器,请跳过临时控制步骤。
- 在 流量梯度泵选项下,选择 多步。在下一个窗口中,插入 7 行,并将每行的流量设置为 0.1 mL/min-1。输入每行的以下参数:从 0-3 分钟起,提供 100% 溶剂 A:从3-9分钟开始,引入100%溶剂A到20%溶剂B的梯度:从9-19分钟开始,引入新的梯度,从20%溶剂B到100%溶剂B:从19-27分钟,保持在100%溶剂B:从27-28分钟开始,将梯度设置为100%溶剂A:从 28-44 分钟开始,通过保持 100% 溶剂 A 来冲洗和修复柱子,包括在运行完成后将流速降低到 0.03 mL+min-1 的最后一步,以便在 LC 未使用时保存溶剂。
- 将 采样器选项的默认设置>泵压力 作为 获取选项 ,并使用 默认采集时间 并使用 默认泵压力 选项。
- 通过从仪器设置窗口的侧边栏选择轨道疗法 Velos Pro MS 图标,创建 MS/MS 方法。
- 单击 数据依赖性 MS/MS >新方法。将 获取时间 设置为 LC 运行长度(即 44 分钟)、 段 到 1 和 扫描事件 到 11。对于"调谐文件",请从第 8.1 步中选择已编辑的文件。
注:第一个事件是使用傅立物转换 MS (FTMS) 进行 MS1 前体扫描。后续的 10 个事件将是 MS2 扫描,选择每个 MS2 碎片前体扫描中 10 个最强烈和最独特的离子。 - 对于事件 1,在扫描描述下设置分析器到FTMS和极性到负。在 MSn 设置下,使用 30,000的分辨率和 35 V. 集扫描范围到 50 m/z 的第一质量和 1800 m/z 的常规碰撞能量为最后质量捕获小分子。
- 对于事件 2 到 11,在 扫描描述 下设置 分析仪 离子 陷阱。选择 依赖性扫描 并单击 全球>动态排除>设置 ,然后选择 启用:设置 30 的重复持续时间和 120 的排除持续时间,以消除附近的重复扫描。
- 转到 扫描事件 设置,并将 从扫描事件确定为 1 的所有 MS2 事件(2 到 11)设置质量。要扫描前 10 个最强烈的离子,设置每个 MS2 扫描事件,以检测从1 到 10的最强烈的离子。因此,设置 事件 2 以检测1 作为 n 最强烈的离子,将事件 3 设置为检测 2,等等。
- 关闭设置窗口,并前往 文件>保存为 [Method_Name].meth. meth。
注:对于LC仪器和质谱仪的一般使用、维护和校准,请参阅制造商提供的操作说明和手册。
- 单击 数据依赖性 MS/MS >新方法。将 获取时间 设置为 LC 运行长度(即 44 分钟)、 段 到 1 和 扫描事件 到 11。对于"调谐文件",请从第 8.1 步中选择已编辑的文件。
9. 设置运行序列并启动 LC-MS/MS 运行。
- 使用 LC-MS/MS 系统的数据采集和解释软件设置运行序列。在 Roadmap >序列设置中,右键单击表以插入与示例一样多的行。对于每行,将 Inj Vol 设置为 5 μL,并将 位置 设置为小瓶在自动采样器托盘上的各自位置。将文件名输入为示例名称,并为运行结果设置所需的文件路径。
注:包含溶剂 A 的空白小瓶可在序列开始时运行,并在每组三重样品(每组时间点)之间运行以冲洗列。 - 要开始运行,请突出显示序列中的所有文件名称。从菜单栏中,选择 操作>运行序列>确定。
10. 合并文件并搜索关于MZmine 2.53的试探性注释。
- 打开 MZmine 并从第 9.1 步导入".raw"输出文件。从菜单栏中,选择 原始数据方法>原始数据导入。选择与样品对应的文件。
- 构建区分 MS1 和 MS2 扫描的峰值列表。从菜单栏,原始数据方法>功能检测>MS/MS峰值列表建设者。相关设置包括m/z 窗口设置为 0.01,时间窗口设置为运行长度。在设置的过滤器下,选择负极性,将中心作为频谱类型。
- 从菜单栏,去 功能列表方法>功能检测>峰值扩展器。将 m/z 容差 设置为 0.005 m/z 或 10 ppm, 将最低高度 设置为 1E3。这一步骤将创造完全充实的高峰。
- 删除重复的峰值。返回功能 列表方法>筛选>重复峰值过滤器。相关设置包括 m/z 公差 设置为 0.005 m/z 或 10 ppm,RT 容差 设置为 5 分钟。
- 要在类似数据文件(即三重反应的峰值)中对齐峰值,请返回到 功能列表方法>正常化>保留时间校准。请务必一起处理三重样品,并留出空白。相关设置包括 m/z 容差 设置为 0.005 m/z 或 10 ppm,RT 容差 设置为 3 分钟绝对(分钟), 最低标准强度 设置为 1E3。
- 按 m/z 对齐所有文件的峰值和从 功能列表方法>对齐> RANSAC 对齐器的保留时间。将 m/z 容差 设置为 0.005 m/z 或 10 ppm, 将 RT 容差 和 RT 容忍度分别设置 为 44 分钟和 39 分钟 ,RANSAC 迭代 设置为 0, 将最低点数 设置为 10%, 阈值设置 为 1。勾选选项 需要相同的充电状态。
- 对于在 功能列表方法>差距填充>峰值查找器的先前步骤中可能丢失的任何数据点,请正确。相关设置包括 强度容差 设置为 50%,m/z 容差设置为 0.005 m/z 或 10 ppm,RT 容差 设置为 3 分钟。启用 RT 校正。
11. 计算 13个C标记葡萄糖衍生代谢物的负模式质量,并在过滤数据中搜索这些分析物的m/z特征。
- 计算葡萄糖代谢中 13个 C 标记代谢物的质量,以便进行有针对性的搜索。
- 从化合物分子公式中的原子数和每个元素的单同位素质量20中计算每个目标化合物的单位素质量。
- 计算化合物的负模式质量 [M-H]- 从单位质量中减去 1 质子的质量 (1.007276 Da)。这是分子在电解过程中被剥离氢离子后,通过负模式MS检测检测到的质量。
- 从负模式质量,计算 13C结合代谢物的质量。在这里,计算了最大结合葡萄糖衍生 的13个C标签的同位素群。
- 使用 13个 C 标记代谢物的计算质量来搜索和注释 MZmine 结果中的 m/z 功能。对于每个可能的打击,使用以下方程计算质量错误 (ppm):
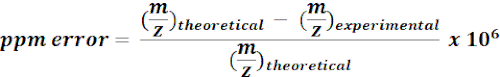
注:在当前分析中,具有< 15 ppm 质量误差的实验 m/z 值被视为假定注释。 - 手动检查质量浏览器上的假定注释的光谱,以确认注释。
- 打开 路线图>Qual浏览器。从工具栏,打开 原始文件 导入每个样本的原始MS数据。
- 在总离子色谱(上面板)上绘制一条线(即对应于假定注释)下的保留时间范围,以查看质量谱(下面板)。右键单击频谱并输入包含目标分析的 m/z 的一系列质量。检查假定注释是否具有明显高于噪声的峰值信号(补充图 2)。
- 计算每个时间点在生物复制中的平均峰值区域和正注释的标准误差。可视化数据(即在条形图上),以观察葡萄糖代谢的趋势。
结果
为了量化从葡萄糖中提取的普通发酵产品的无裂解细胞合成,从2xYPTG介质中生长的菌株中提取的裂解物作为主要碳源8喂养了100微米葡萄糖。反应在24小时时间里因蛋白质酸化而停止。含有丙烯酸酯、精洁、哺乳酸、富甲酸盐、醋酸盐和乙醇的过滤超分子被加载到配备RID模块的 HPLC 系统的汽车采样器模块中。以 1.17 μM 的速度过滤发酵最终产品和葡萄糖混合物的瓶, 2.34 μM、4.69 μM、9.38 μM、18.75 μM、37.50 μM、75 μM 和 S30 缓冲器中的 150 μM 浓度作为标准加载到仪器上。分析从 HPLC 列到 RID 都以等权论来阐释。1 至 150 μM 范围内的葡萄糖、稀释剂、乳酸盐、富甲酸盐、醋酸盐和乙醇的峰值可以通过 RID 解决。葡萄糖的峰值区域通过手动集成从RID数据中提取时间过程和标准曲线样本。提取的峰值区域为精洁,乳酸盐,富甲酸盐,醋酸盐和乙醇从自动集成信号。所有标准曲线(峰值区域与已知浓度)的 R2 值均>0.99,并且在此处使用的浓度范围内呈线性。
所有目标分析物的摩尔浓度是根据各自的标准曲线计算的。葡萄糖在反应的前3小时内被消耗,主要发酵到乳酸(图2A,B)。乙醇积累也显著发生在反应的前3小时内,并随后停止(图2C)。观察显著乳酸和乙醇生产与显著的葡萄糖消耗后3小时不是史无前例的,因为乳酸和乙醇生产途径允许再生1净摩尔NAD®从糖溶性NADH需要通过糖解持续葡萄糖消费(图1)。因此,乳酸和乙醇可被视为赖氨酸基无细胞葡萄糖代谢的主要发酵最终产品。醋酸盐最初作为S30缓冲剂的组成部分出现在反应中,在葡萄糖消耗减缓时,由于6小时后新陈代谢而意外积累(图2D)。这一结果表明,醋酸盐发酵不一定能使糖化快速通量在较早的时间点。同时,富甲酸盐和精洁物被合成为小发酵产品(图2E,F)。总之,该方法使大肠杆菌S30解糖中糖基质消耗和发酵产品形成的绝对定量化。
此处特别应用了用于剖析葡萄糖代谢的 MS 检测。从2xYPTG介质中生长的菌株中提取的乳糖作为碳源被喂食13C6-葡萄糖。CFME 反应在三重运行,为 0 小时、1 小时、2 小时和 3 小时。每个时间点的样品都加载在装有反向列的LC系统上,并耦合到傅立物转换和离子陷阱质谱仪。获得并加工了负离子模式光谱,以分析有机酸、磷酸糖和氨基酸。对属于中央碳代谢的13个C标记物种的计算理论质量进行了搜索,以识别具体的葡萄糖衍生化合物。根据大肠杆菌CFME中利用的源菌株栽培条件和先前关于活性通路的报告,这里假定溶酶蛋白组包括一个代谢网络,将葡萄糖送入糖解发酵、五聚磷酸盐通路,并可能还有氨基酸代谢5、6、7、8、14(图1)。因此,搜索范围缩小到这些通路的成员,其中16个代谢物包含葡萄糖衍生的13C标签被明确注释(补充表1)。
13C6-葡萄糖通过糖解被明显消耗,糖溶质中间丰度的波动(图3A-E)就证明了这一点。与 HPLC-RID 数据一致,葡萄糖累积到13C3乳酸盐,并在反应的前 3 小时内发酵到13C3- 苏奇酸盐(图 4A,B)。13C3-苏奇酸同位素的形成支持了提出的溶质葡萄糖代谢模型(图1),其中硫酸盐很可能由3碳磷酸磷酸酯(PEP)分子的碳化产生,而不是从2碳乙酰-CoA分子进入TCA周期。TCA周期的激活在以前的CFME研究中已经假设,但其他13个C标签的TCA中间体没有在这里检测到8,19,21。13C3- 阿斯酸合成然而发生在第一个h和消耗,加强了PEP直接转换为草醋酸盐的想法(图1,图6C)。这些数据反映了在富含葡萄糖的介质(2xYPTG)发酵生长过程中收获的源菌株中的溶酶蛋白。这将进一步暗示,其余不参与简洁生产的TCA酶形成氧化TCA分支(图1)。然而,没有检测到此通路中的代谢物,可能是因为添加到 CFME 反应中的高浓度谷氨酸,因为盐的对抗阻止了该分支的进展。
此外,HPLC-RID 数据还辅之以在 3 h 反应时间范围内缺乏13C2 醋酸盐检测,表明血糖至 3 h(图2B)中醋酸盐没有积聚。然而,醋酸盐,乙酰磷酸盐(乙酰-P)的直接前体积累,表明Pta-AckA通路的Pta手臂醋酸盐合成从乙酰-CoA是活跃的(图4C,D)。由于醋酸盐是反应中使用的S30缓冲剂的主要成分,因此13C2-乙酰-P至13C2-醋酸盐的AckA催化脱磷剂很可能不会在此时间范围内发生。
还观察到将13C6-葡萄糖衍生碳与糖磷酸盐6-磷糖酚(6PGL)、6-磷糖(6PG)、核糖-5-磷酸盐(Ru5P)和血脂-7-磷酸盐(S7P)合并(图5)。这些结果证实了五聚磷酸盐通路参与裂解葡萄糖代谢,并可能饲料13C9-酪氨酸合成,这是以前由蛋白酶研究建议的,同时也提供了13C5-异黄素生产(图6A,B)7的前体。这里没有观察到标记的苯丙氨酸和色氨酸,大多数必需氨基酸也没有观察到。然而,这并不完全令人惊讶,因为氨基酸解剖可能富集于赖氨酸从营养匮缺条件下生长的细胞或在静止阶段7,22。此外,迄今为止的数据表明,糖溶解和发酵的中间体被输送到共因子再生末端反应中, 这必须排除从甘油醛-3-磷酸盐,丙酮酸盐和乙酰-CoA(即甘氨酸,半胱氨酸,丝氨酸,丙氨酸,血管,黄氨酸,卵磷酸和赖氨酸)(图1)产生的许多氨基酸的合成。如前所述,在第一小时内就生产了13个C3-阿斯巴酸盐,而阿斯巴酸盐产生的13个C-结合氨基酸(即三氨基氨酸、异油氨酸、甲氨基苯丙胺和芦笋)则未被观测到,可能是因为葡萄糖衍生的阿斯巴酸盐参与发酵(图1,图6C)。最后,从谷氨酸中提取的标记谷氨酸和氨基酸的通量可能受到反应环境中高浓度谷氨酸的阻碍(图1)。
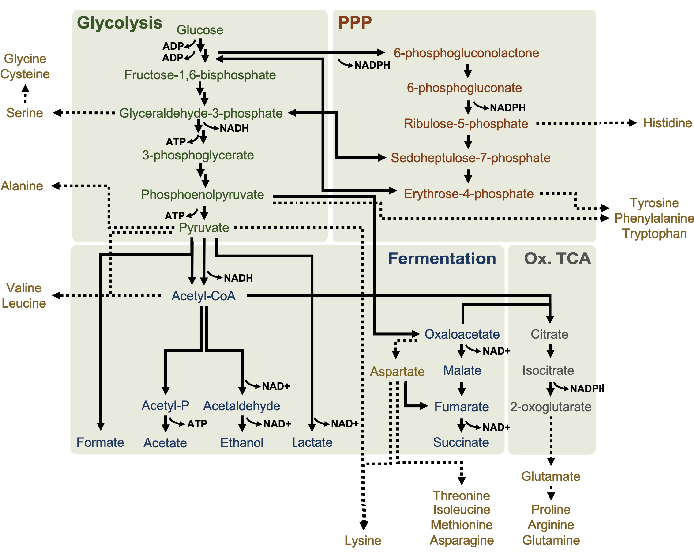
图1:大 肠杆菌 BL21DE3星衍生的溶酶的假定代谢模型,在高葡萄糖浓度下呈指数级增长。 以裂解剂为基础的CFME报告了糖解(绿色)、五聚磷酸盐通路(深橙色)和乙酰-CoA发酵通路(蓝色)的中间体和最终产品。精洁发酵的存在意味着氧化性 TCA 分支(灰色)的激活。解剖中的氨基酸解剖(黄金)定义不明确,此处对此进行了调查。 请单击此处查看此图的较大版本。
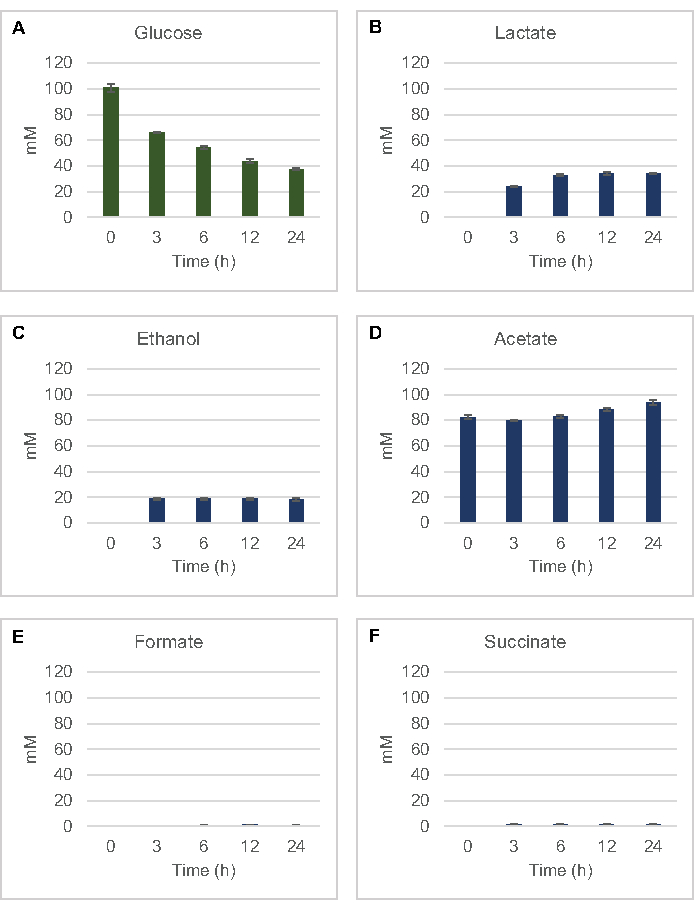
图2:用大肠杆菌粗提取物制备的CFME反应中葡萄糖消耗和发酵最终产品合成的HPLC-RID数据。 (A) 葡萄糖消耗和(B) 乳酸盐,(C ) 乙醇,(D) 醋酸盐 ,(E) 甲酸酯 , 以及(F) CFME 反应中的简洁生产监测超过 24 小时。以标准曲线量化的平均 mM 浓度和误差条 (SE) 表示 (n = 3)。请单击此处查看此图的较大版本。
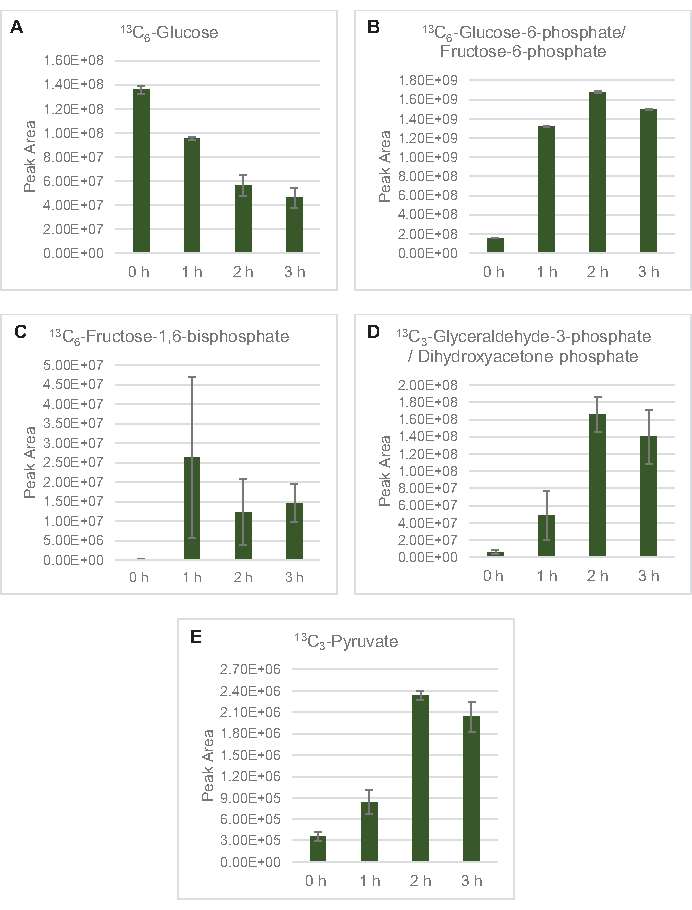
图3:大肠杆菌CFME中13C6-葡萄糖和13个C标签糖溶胶中间体的时间过程趋势。相对丰度(A) 13C6- 葡萄糖 ,(B) 13C6- 葡萄糖 -6 - 磷酸盐/果糖-6 -磷酸盐, (C) 13C6- 果糖-1,6-双磷酸盐 ,(D) 13C3- 甘油醛-3-磷酸盐/二氢氧乙酮磷酸盐, 和(E) 13C6- CFME 反应超过 3 小时的丙型苯丙酸酯。mzMINE 软件提取的原始峰值区域用于计算正注释的平均值和误差条 (SE) (n = 3)。请单击此处查看此图的较大版本。

图4:大肠杆菌CFME中13C6-葡萄糖发酵中中间体和最终产品的时间过程趋势。相对丰度(A) 13C3- 乳酸盐 ,(B) 13C3- 硫酸盐 ,(C) 13C2- 乙酰磷酸盐,(D) 13C2- 乙酰 - coa 在 CFME 反应超过 3 小时。mzMINE 软件提取的原始峰值区域用于计算正注释的平均值和误差条 (SE) (n = 3)。请单击此处查看此图的较大版本。
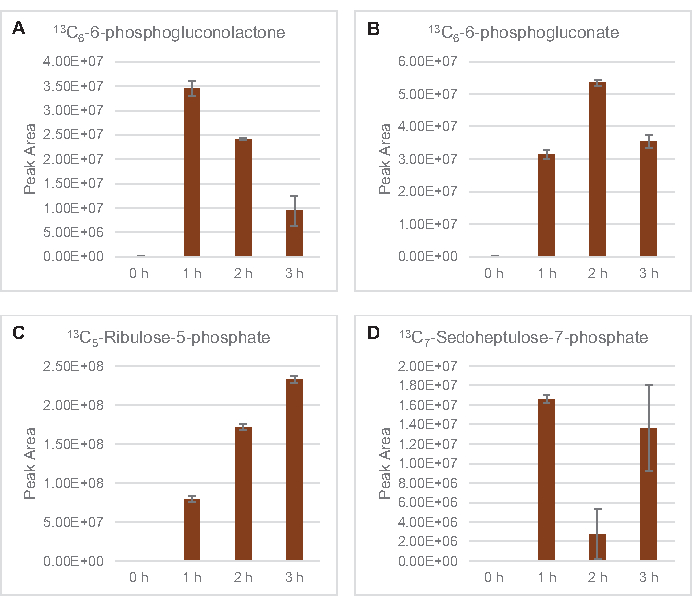
图5:大肠杆菌CFME中13C6-葡萄糖衍生五聚磷酸盐通路中间体的时间过程趋势。相对丰度(A) 13C6-6-磷氟乳酮 ,(B) 13C6 -6-磷糖酸盐 ,(C) 13C5-里布洛-5 磷酸盐 ,(D) 13C7- 血脂-7-磷酸盐超过 3h.mzMINE 软件提取的原始峰值区域用于计算正注释的平均值和误差条 (SE) (n = 3)。请单击此处查看此图的较大版本。
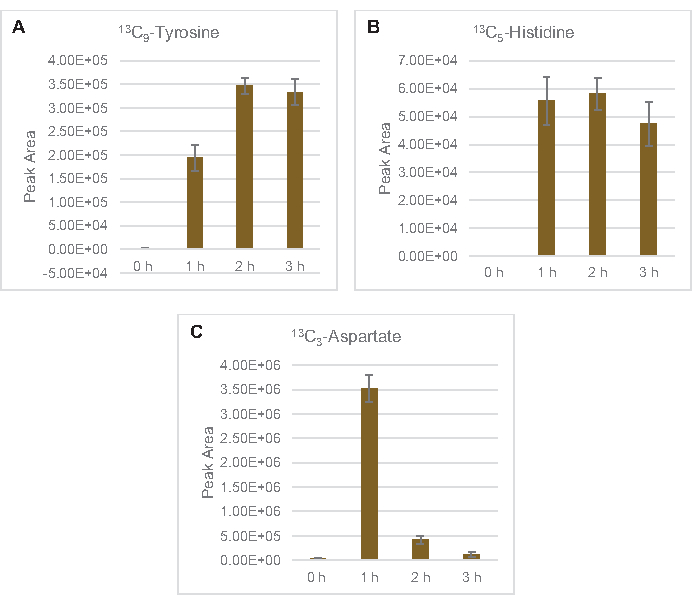
图6:大肠杆菌CFME中检测出13C6-葡萄糖衍生氨基酸的时间过程趋势。相对丰度(A) 13C9- 酪氨酸 ,(B) 13C5- 异黄素 ,(C) 13C3- 阿斯巴丁超过 3 小时。mzMINE 软件提取的原始峰值区域用于计算正注释的平均值和误差条 (SE) (n = 3)。请单击此处查看此图的较大版本。
补充图1:代表 HPLC-RID 色谱显示 CFME 反应中主要发酵产品的峰值,在 37 °C 下孵育为 24 小时。葡萄糖、精明、乳酸盐、富甲酸盐、醋酸盐和乙醇峰值在具有 5 mM 硫酸溶剂的同位素洗脱期间,在 HPLC 柱上的保留时间足以区分。 请点击这里下载此文件。
补充图2:代表质谱为13C标签代谢物,特别是(A)乳酸,(B)葡萄糖和(C)6磷糖酸盐(6PG)在CFME反应孵育在37°C为1小时 。请点击这里下载此文件。
补充表1:检测到的 13个C标记代谢物列表,保留时间(使用MZmine对齐样本),理论上完全 13个C标记的负模式m/z值,检测到的特征的m/z值,以及计算的质量错误。 请点击这里下载此表。
讨论
概述的 HPLC-RID 方法可用于成功量化糖基板消耗量,并随时间推移转化为赖沙特中央代谢的主要有机酸和酒精产品。此外,此协议采用单个移动相位的简单等同位素方法,需要最少的示例准备,并允许进行简单的有针对性的下游分析。HPLC-RID 方法测量的分析方法仅以保留时间为区分标准,因此它们与选定的柱树脂的相互作用。这里使用的 HPLC 列特别设计用于通过将大小排除和配体交换(即离子介导分区色谱)相结合来分离碳水化合物、有机酸和酒精。因此,上述方法有助于更有针对性地分析碳水化合物基质和葡萄糖发酵途径的最终产品,预计这些最终产品将主要促进和激励基于溶酶的生物转化8、15、21。但是,此协议不考虑细胞提取物中其他代谢通路的激活。采用其他色谱分离技术(即亲水相互作用色谱)、梯度脱粒方法、更复杂的样品制备(即分源化)和不同的光学探测器(如紫外光或蒸发光散射探测器)的管道可用于检测其他代谢物,如氨基酸和磷酸糖23、24 .或者,使用LC-MS/MS可以采用全球方法研究赖沙酸代谢。
描述的LC-MS/MS方法是测量和识别更广泛代谢物的单一工作流程。LC-MS/MS 是一种最先进的代谢分析工具,因为它具有通过保留时间和 m/z 比率(分辨率为16)来区分代谢物的灵敏度和能力。以中央碳代谢途径和氨基酸代谢为重点,实施了负模式MS/MS,以专门检测极地有机酸、磷酸糖和氨基酸。结合纳米液体色谱技术,该方法为检测复杂解化物背景17中的小分子提供了高灵敏度。然而,在分析基于溶酶的CFME代谢方面,描述的LC-MS/MS协议的一个限制是其50米/z的下检测极限,这排除了乙醇的测量,乙醇是溶酶葡萄糖代谢的主要产品,以及甲基醇,否则很容易被详细的HPPC-RID方法量化。与LC-MS/MS相比,HPLC-RID在成本和难度方面具有相对可访问性的其他优势。在后一点,故障排除LC-MS/MS方法在这里描述可能需要在质谱学的某种程度的专业知识。尽管如此,MS检测在RID上具有独特的吸引力,因为它可以进一步区分代谢体中标记的同位素,这是一种通过复杂的莱氨酸代谢网络18从补充基板理解碳运动的绝佳技术。此处应用了这种方法,通过补充 13C6葡萄糖的反应,并分析下游 13C 结合代谢物的相对丰度值。分析允许定义活性通路和非活动通路,支持先前报告的假设,并提供有关解析物代谢通量的新见解。也可以在具体分析的方法内进行修改。例如,可以与样品一起分析 13种 C 标记目标化合物的标准溶液,以便随着时间的推移实现葡萄糖衍生分子的绝对定量测量,并得出有关通量分布的结论。通过运行序列,调整为正模式检测,还可以在当前工作流中更好地检测带正电荷化合物。
两种方法的分析采样都方便自动化,确保高可重复性。此外,只要遵守适当的仪器处理做法和维护,就可以预期分析运行顺畅。在使用这些工具分析 CFME 反应时,应在采样的上游和下游做出更关键的考虑。在样品准备过程中,时间过程控制必须代表时间-零。在这里,蛋白质通过酸化沉淀在解质中,以阻止代谢反应。对于零时间样品,酸溶剂在加入含有葡萄糖的反应混合物之前与溶酶结合。与三氯乙酸化有效地确保葡萄糖不会在零时间代谢,如 HPLC-RID 数据(图 2)所示。虽然在报告的LC-MS/MS分析中进行了类似的淬火葡萄糖代谢程序,但在时间-零样品中检测到13个C标记代谢物,尽管与以后提取的样品相比,丰度值要低得多。此外,这些观察仅限于糖解中间体。数据表明,这些反应在酸化后保留了一定程度的糖溶剂活性,而提取溶剂是这种高度敏感的方法检测到的。然而,这一活动的程度应加以量化。先前的一项研究报告说,酸性萃取溶剂可能不足以淬火中间糖溶剂反应,但可以阻止大量的葡萄糖消耗10。虽然这还有待于在此使用的系统中进一步研究,但时间零和较晚时间点样本之间的相对丰度值的剧烈变化可以解释为葡萄糖代谢的趋势。然而,在类似的应用中,建议探索替代淬火方法,特别是获得绝对数量的代谢中间体10。此外,还应遵守下游软件分析过程中的良好做法。当手动集成来自 RID 信号的峰值区域以减少人为错误时,一致性至关重要。每当使用手动集成的峰值区域来量化样品中的代谢物浓度时,还应将手动集成应用于标准的峰值区域。在整个目标LC-MS/MS分析中,MZmine 分析的试探性注释应通过使用 MS 质量浏览器进行手动峰值检查来验证,并且 M/z 功能只有在计算的质量错误可以接受时才应注释。在这里,这些分析是手动执行为有限的一组目标,因为全面和强大的同位素搜索软件尚未确定。然而,这种搜索13C标签代谢物的自动化方法目前正在出现,并会简化更复杂的分析,如分析解析超越中央碳代谢25。
先进的液相色谱是分离复杂代谢混合物中小分子的一种坚固且广泛应用的方法。所述方法将此分离技术与折射指数或质谱检测相结合,以成功分析基于赖萨特的 CFME 反应中的代谢物转换。HPLC-RID 和 LC-MS/MS 是分析活性解析代谢的单独强大工具,可以进一步利用它们的互补性来解决每种技术的固有局限性。报告的方法使CFME的应用和发展,因为它们可以用来理解赖沙特代谢,监测有针对性的新陈代谢物转化的改进,并在操纵赖酸代谢时阐明新陈代谢通量的改变。
披露声明
作者宣称,他们不知道相互竞争的经济利益或其他利益冲突。
致谢
这项研究由美国能源部基因组科学计划、科学、生物和环境研究办公室赞助,作为植物微生物界面科学重点区域(http://pmi.ornl.gov)的一部分。橡树岭国家实验室由美国能源部的UT-Battelle有限责任公司管理,合同合同为DE-AC05-00OR22725。这份手稿由美国能源部DE-AC05-00OR22725合同有限责任公司UT-Battelle撰写。美国政府保留和出版商通过接受该文章出版,承认美国政府保留一个非排他性的、有偿的、不可撤销的、全世界范围内出版或复制本手稿出版形式或允许其他人为美国政府目的出版或复制该手稿的许可证。能源部将根据能源部公共访问计划(http://energy.gov/downloads/doe-public-access-plan)为公众提供获得这些联邦赞助研究成果的机会。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
参考文献
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。