Method Article
الكروماتوغرافيا السائلة إلى جانب مؤشر الانكسار أو الكشف الطيفي الكتلي لتنميط المستقلب في الأنظمة الخالية من الخلايا القائمة على Lysate
In This Article
Summary
تصف البروتوكولات أساليب الكروماتوغرافيا السائلة عالية الأداء إلى جانب مؤشر الانكسار أو الكشف الطيفي الكتلي لدراسة التفاعلات الأيضية في الأنظمة المعقدة الخالية من الخلايا القائمة على اليسات.
Abstract
يمكن أن تتطلب هندسة التمثيل الغذائي الخلوي لعملية التمثيل الحيوي المستهدفة دورات واسعة النطاق لتصميم وبناء واختبار التعلم (DBTL) حيث يعمل المهندس حول متطلبات بقاء الخلية. بدلا من ذلك، تنفيذ دورات DBTL في بيئات خالية من الخلايا يمكن تسريع هذه العملية وتخفيف المخاوف مع التوافق المضيف. نهج واعد لهندسة التمثيل الغذائي الخالية من الخلايا (CFME) يستفيد من مستخلصات الخلايا الخام النشطة استقلابيا كمنصات للكتلة الحيوية واكتشاف البروتينات المعدلة والمسارات والنماذج الأولية بسرعة. تحقيق هذه القدرات وتحسين أداء CFME يتطلب أساليب لتوصيف المستقلب من منصات خالية من الخلايا القائمة على lysate. أي أن الأدوات التحليلية ضرورية لرصد التحسينات في تحويلات المستقلب المستهدفة وفي توضيح التعديلات على تدفق المستقلب عند التلاعب في عملية التمثيل الغذائي لليسات. هنا، تم تطبيق تحليلات المستقلب باستخدام الكروماتوغرافيا السائلة عالية الأداء (HPLC) إلى جانب الكشف الطيفي البصري أو الكتلي لتوصيف إنتاج المستقلب وتدفقه في lysates E. coli S30. وعلى وجه التحديد، يصف هذا التقرير إعداد عينات من تحللات CFME لتحليلات HPLC باستخدام الكشف عن مؤشر الانكسار (RID) لتحديد توليد وسيطة التمثيل الغذائي المركزية والمنتجات الثانوية في تحويل الركائز منخفضة التكلفة (أي الجلوكوز) إلى مختلف المنتجات ذات القيمة العالية. كما يتم تقديم تحليل تحويل المستقلب في ردود فعل CFME التي تتغذى على 13الجلوكوز C المسمى من خلال الكروماتوغرافيا السائلة عكس المرحلة إلى جانب قياس الطيف الكتلي جنبا إلى جنب (MS / MS)، أداة قوية لوصف غلة المستقلب محددة وتدفق الأيض lysate من مواد البداية. بالإجمال, تطبيق هذه الأساليب التحليلية لSMEME lysate الأيض تمكن من التقدم في هذه النظم كمنصات بديلة لتنفيذ أسرع أو المهام الهندسية الأيضية الجديدة.
Introduction
يمكن معالجة القيود المفروضة على الميكروبات الهندسية للإنتاج الكيميائي من خلال تلخيص التفاعلات الكيميائية الحيوية في المختبر حيث تكون وظائف البقاء الخلوية المتنافسة غائبة1. وعلاوة على ذلك، فإن بيئة التفاعل المفتوح (أي عدم وجود غشاء الخلية) أكثر قابلية للتلاعب ويسهل مراقبتها مقارنة بالخلايا الحية. وقد تجلى هذا المفهوم التأسيسي للهندسة الأيضية الخالية من الخلايا (CFME) بأناقة من خلال إعادة تشكيل مسارات التمثيل الغذائي لتجميع المواد الكيميائية القيمة مثل الهيدروجين وmonuterpenes مع مقاييس الإنتاج التي هي أوامر من حجم أعلى مما قدم في مصانع الخلايا الميكروبية حتى الآن1،2،3 . بيد أن طرق تنقية مسارات كاملة مقيدة حاليا بالوقت والتكلفة. بدلا من ذلك، يمكن اشتقاق أنظمة التمثيل الغذائي الخالية من الخلايا من مستخلصات الخلايا الخام من خلال طرق سريعة وغير مكلفة بالنسبة لإعادة تشكيل المسار بأكمله4. الأيض المركزي الذي يتم الاحتفاظ به في مقتطفات الخلية يمكن أن تستكمل مع ركائز الطاقة (على سبيل المثال، الجلوكوز والعوامل الانزيمية) والأملاح في حلول عازلة لتوليد السلائف الأيضية المركزية لأكثر من 24 ساعة5،6. إضافة الإنزيمات الخارجية إلى تفاعل CFME القائم على التحلل يسمح بتحولات بيولوجية أكثر تعقيدا للجلوكوز إلى مواد كيميائية أكثر قيمة في تيترزعالية 4و6و7. على الرغم من أن العائد يميل إلى أن يتعرض للخطر في هذه النظم بسبب تعقيدها الأيضي الشبيه بالخلايا ، إلا أن الطرق الفريدة لتنظيم بروتيوم اليسات لتحويل الغلة الأعلى كانت ويجري تطويرها7و8.
سهولة تنفيذ التحولات الأيضية في أنظمة خالية من الخلايا القائمة على اللذات يجعل هذه المنصات الممتازة إما لنقل التصنيع الكيميائي خارج الخلية تماما أو لنماذج مسارات جديدة مع الإنتاجية العالية قبل بناء واختبار هذه التصاميم في الجسم الحي2،9. بالنسبة لأي من التطبيقين ، فإن أدوات مراقبة التحويلات الأيضية أو مراقبة التعديلات الإجمالية على التدفق الأيضي في الlysates هي جزء لا يتجزأ من تقدم CFME. يمكن استخدام الكروماتوغرافيا السائلة عالية الأداء (HPLC) لفصل المكونات الكيميائية لتفاعلات CFME بدقة عالية ويمكن أن تقترن بكاشفات بصرية أو طيفية واسعة لقياس كمية المستقلب5و10. المبدأ الأساسي ل HPLC هو أن التحليلات المذابة في المذيبات (أي مرحلة الجوال) وضخها من خلال عمود تتفاعل مع مواد التعبئة عمود معين (أي المرحلة الثابتة)11. اعتمادا على خصائصها الكيميائية، تظهر هذه التحليلات أوقات استبقاء متفاوتة قبل أن يتم في نهاية المطاف إخراجها من المرحلة الثابتة وحملها من قبل المرحلة المتنقلة إلى كاشف. يفصل هذا التقرير إعداد وتحليل ردود فعل CFME المستندة إلى الإشريكية القولونية من خلال الأساليب المستندة إلى HPLC التي تستفيد من اكتشاف RID وMS/MS.
HPLC مقرونة الكشف عن مؤشر الانكسار (HPLC-RID) هو وسيلة يمكن الوصول إليها عموما لتحديد بسرعة السلائف الأيضية المركزية والمنتجات النهائية. باختصار، يقيس RID كيفية تحليل تغيير انحراف الضوء عن طريق المرحلة المتنقلة12. يمكن بعد ذلك قياس إشارات RID المقابلة لل تحليل الهدف في العينات من خلال المقارنات مع إشارات RID للحلول القياسية. في تطبيقات CFME ، تم استخدام هذا النمط من الكشف الأكثر شيوعا مع أعمدة HPLC التي تفصل المركبات استنادا إلى مزيج من استبعاد الحجم وآليات التبادل ليغاند ، أو الكروماتوغرافيا القسم الأيوني5،6،8،13. وتستخدم هذه التقنية خاصة لتحديد استهلاك ركائز السكر بسرعة مثل الجلوكوز، فضلا عن تشكيل منتجات التخمير مثل succinate, lactate, formate, خلات, والإيثانول في ردود الفعل CFME القائم على اليستات8. تسجيل تغييرات تركيز هذه المركبات عبر HPLC كان مفيدا لتوضيح إمكانات مستخلصات الخلايا الخام لتجميع السلائف الأيضية المركزية وفهم كيفية إعادة توجيه تدفق المسار من خلال مسارات التخمير خلال التحويلات الأيضية المعقدة من الجلوكوز في اللواسير6و8و14. تؤكد دراسات CFME المنوية في مقتطفات خلايا الإشريكية القولونية أن مركبات التخمير تتراكم كمنتجات نهاية لحفز الجلوكوز وتحدث أيضا كمنتجات الثانوية غير المرغوب فيها في اليسات التي تفرط في التعبير عن الإنزيمات الخارجية6،15. ويقترح أن الأيض التخميري يلعب دورا ضروريا في تجديد مكافئات الأكسدة من العوامل المساعدة (أي NAD(P)H و ATP) للحفاظ على ردود الفعل الجليكوليكية8. ومن ثم، فإن طريقة الكشف البصري المستندة إلى HPLC والمصممة لفصل منتجات التخمير هي أداة مفيدة ومطبقة بشكل شائع عند تنفيذ مختلف مهام CFME القائمة على اليسيد.
يمكن تنفيذ CFME لتجميع المنتجات النهائية الأيضية التي ليست الكربوهيدرات والأحماض العضوية، أو الكحول4. قياس الوسيطة التي تستهلك بأسرع ما يتم توليفها قد يكون أيضا مرغوبافيه 10. في حين يمكن الوصول إلى HPLC-RID من حيث التكلفة والصعوبة ، فإن هذه الطريقة مقيدة بقدرتها على التمييز بين المستقلبات فقط استنادا إلى وقت الاحتفاظ. ويمكن تحليل مجموعة أوسع من الأيض عندما يقترن الكروماتوغرافيا السائلة إلى الكشف MS / MS (LC-MS / MS)16. بهذه الطريقة، يتم تأين التحليلات في مرحلة الهاتف المحمول والكشف عنها بشكل تفاضلي استنادا إلى كتلة كل جزيء وخصائص الشحن. معرفة كل من نسبة كتلة إلى تهمة المستقلب (م / ض) ووقت الاحتفاظ على العمود وبالتالي يسهل فصل معظم وسيطة الأيض والمنتجات النهائية مع ارتفاع القرار16. ويمكن أيضا أن يقترن هذا الأسلوب الكشف إلى الكروماتوغرافيا نانو السائل، الذي يوفر معدلات تدفق أقل بكثير وحجم حقن العينة، مما يسمح للكشف أكثر حساسية من جزيئات صغيرة في الخلفية lysate المعقدة17. يمكن إضافة إلى ذلك تطبيق LC-MS/MS مع وضع العلامات النظيرية نظرا لأن التسميات المدمجة تضفي تغييرات على قيم m/z الخاصة بالنواقل18. قياسات Timepoint المستخرجة من رد فعل CFME تكملها 13C6-الجلوكوز الركيزة وبالتالي يمكن تحديد نهاية أو المنتجات الثانوية المستمدة خصيصا من الجلوكوز المكمل. على الرغم من أن هذه الطريقة تتبع النظائر لم تطبق بعد عادة في دراسات CFME، بل هو أداة قوية لفهم التحويلات الأيضية في نظم CFME القائمة على اللستات، وتحديدا منذ مكافحة الملح (أي خلات والغلوتامات) في هذه التفاعلات هي أيضا استقلاب كركائز ثانوية19. وبالتالي فإن الاستفادة من هذه التقنية يمكن أن ترسم صورة شاملة لعملية التمثيل الغذائي للجلوكوز في اليات ، والتي حتى يومنا هذا غير مفهومة تماما. هنا، البروتوكول تفاصيل طريقة للكروماتوغرافيا نانو السائل إلى جانب تأين نانويدروسبراي (نانو ESI) MS / MS التي يمكن استخدامها لاستجواب نموذج ممكن من التمثيل الغذائي الجلوكوز، وتحديدا في lysates القولونية (الشكل 1). ويستند النموذج على تقارير من مسارات التخمير ومسار فوسفات البنتوس يجري نشطة في lysates القولونية المستمدة من سلالات نمت في وسائل الإعلام الغنية5,6,8,14. وتستخدم هذه التقنية بالإضافة إلى ذلك للتحقيق في إنتاج الأحماض الأمينية منذ المعرفة الحالية على استقلاب الأحماض الأمينية من الجلوكوز في اللحامات يقتصر على عدد قليل من الأمثلة مثل تخليق الأحماض الأمينية العطرية7. ونظرا للطبيعة القطبية في الغالب للمنتجات النهائية والمتوسطة في هذه المسارات (أي الأحماض العضوية وفوسفات السكر والأحماض الأمينية)، تم استخدام الكروماتوغرافيا السائلة على مراحل عكسية هنا. هذه التقنية تفصل المركبات القطبية عن طريق الإلتواء من مرحلة ثابتة غير قطبية. ثم تأينت هذه المركبات بواسطة نانو ESI في وضع الأيونات السالبة مما يسمح بالكشف عن التحليلات بشحنة أولية سلبية واحدة على الأقل وبالتالي فهي مفيدة للكشف عن المركبات الحمضية. وتستخدم هذه التقنية هنا لتحليل الجلوكوز المستمدة من 13C-دمج الأيض ويوضح فائدة LC-MS/ MS لفهم استقلاب الجلوكوز في التحلل.
Protocol
1. بدء ووقف ومعالجة وقت الدورة CFME ردود الفعل ل HPLC-RID القياس الكمي.
- ذوبان أعدت سابقا lysates القولونية وإعداد بقية مكونات التفاعل على الجليد.
ملاحظة: تم اشتقاق اللستات المبلغ عنها هنا من E. coli BL21DE3-Star التي نمت في وسائط 2xYPTG (1.8٪ جلوكوز) إلى مرحلة منتصف السجل.- إعداد حجم مناسب من مرشح تعقيم (0.20 ميكرومتر مرشح المسام) S30 العازلة (1 M تريس-OAc تعديلها إلى درجة الحموضة 8.2 مع حمض الخليك الجليدي, 1.4 M ملغ (OAc)2, و 6 M KOAc).
- إعداد مزيج الطاقة التي تحتوي على الجلوكوز، أملاح الغلوتامات، ATP، انزيم A، NAD +، بيس تريس العازلة، وفوسفات ديبوتاسيوم في المخزن المؤقت S30. التركيزات النهائية في حجم التفاعل المطلوب المستخدمة لإعداد ردود فعل CFME هنا كانت 100 mM الجلوكوز، 18 مليون غلوتامات المغنيسيوم، 15 مليون غلوتامات الأمونيوم، 195 مليون غلوتامات البوتاسيوم، 1 مليون ATP، 0.2 مليون إنزيم A، 1 mM NAD+، 150 mM Bis-Tris، و 10 mm ديبوتاسيوم فوسفات.
- الجمع بين المكونات في أنابيب الطرد المركزي الدقيق 1.5 مل لإعداد ردود الفعل النهائية مع 4.5 ملغ / مل من البروتين الكلى ليسات. هنا، تم إعداد ردود فعل CFME مع المجلدات النهائية من 50 ميكرولتر في ثلاثية لكل نقطة زمنية. احتضان ردود الفعل عند 37 درجة مئوية للأطر الزمنية لكل منها.
ملاحظة: العمل بسرعة وإضافة ليسات كعنصر نهائي من مزيج رد الفعل لمنع ردود الفعل الأيضية المبكرة مع الجلوكوز وأملاح الغلوتامات. يمكن أن يحدث الحد الأدنى من استهلاك الجلوكوز اعتمادا على مدة احتضان خلطات التفاعل على الجليد. - إنهاء ردود الفعل ومعالجة العينات لتحليل HPLC-RID.
- لإنهاء ردود الفعل ثلاثية الليكات في النقاط الزمنية المناسبة، قم على الفور بإضافة حجم متساو من حمض ثلاثي كلورو كلور تيك بنسبة 5٪ إلى حجم التفاعل النهائي لكل عينة (أي 50 ميكرولتر من حمض ثلاثي الكلور 5٪ إلى تفاعل 50 ميكرولتر). تمييع كل عينة بالماء العقيم عند 2x حجم التفاعل (أي 100 ميكرولتر).
- لتلخيص الوقت صفر، اخلطي نفس الحجم من حمض ثلاثي الكلور 5٪ مثل إجمالي حجم التفاعل النهائي (أي 50 ميكرولتر) مع اللذج قبل إضافة بقية مكونات التفاعل. هذه الخطوة التحمض يعجل الانزيمات ليسات قبل أن استقلاب الجلوكوز بشكل كبير.
- دوامة العينات والطرد المركزي على جهاز الطرد المركزي على مقاعد البدلاء في 11600 × ز لمدة 5 دقائق ونقل النافورات التي تحتوي على التحليلات العضوية لتنظيف الأنابيب. تخزين العينات في -20 درجة مئوية إذا كان تحليل HPLC أن تجرى في يوم مختلف. تأكد من إذابة العينات المخزنة على الجليد قبل الانتقال إلى الخطوة التالية.
- تصفية كل supernatant مع مرشح المسام 0.22 ميكرومتر. كبديل للمحاقن، استخدم مرشحات أنبوب الطرد المركزي والطرد المركزي الناسخات الفائقة عند 16,300 × غرام لمدة دقيقة واحدة.
- نقل كل filtrate إلى قارورة زجاجية HPLC نظيفة. قم بتحميل قوارير على علبة الطوابع التلقائية HPLC.
- إعداد عينات لتوليد منحنى القياسية.
- إعداد حل الأسهم من جميع التحليلات المستهدفة المذابة في المخزن المؤقت S30 بكميات متساوية فوق تركيز الجلوكوز في البداية في ردود فعل CFME. هنا، تم إعداد محلول مخزون يتكون من الجلوكوز 150 ميكرومتر، سكرينات، لاكتات، رفيق، خلات، والإيثانول. تنفيذ 1:1 (v/v) المخففات التسلسلية من محلول المخزون للحصول على حلول ثلاثية البلورات 50 ميكرولتر بتركيزات نهائية تتراوح بين 0 ميكرومتر لتركيز المخزون (أي 150 ميكرومتر).
- تمييع كل حل مع 50 ميكرولتر من حمض ثلاثي كلورو كلور تيك 5٪ و 100 ميكرولتر من الماء العقيم. كرر الخطوات 1.3.4-1.3.5.
ملاحظة: تشغيل حلول لتوليد منحنى القياسية مع كل دفعة من العينات لضمان كمية دقيقة من تركيزات المستقلب.
2. إعداد نظام HPLC للكشف عن المستقلب.
- تحت غطاء الدخان، قم بإعداد محلول حمض الكبريتيك المعقم 5 M من الماء المعقم deionized وتصفية. إضافة ~ 550 ميكرولتر من محلول حمض الكبريتيك 98٪ HPLC الصف إلى 2 لتر من الماء لإعداد حمض الكبريتيك 5 MM.
تنبيه: حمض الكبريتيك مادة كيميائية خطرة، والعمل تحت غطاء الدخان مع مختبر مناسب PPE يمنع استنشاق، ملامسة الجلد، والاتصال بالعين. حمض الكبريتيك المركز يتفاعل بقوة مع الماء وينبغي إضافته مباشرة إلى الماء، وليس العكس. يحفظ في منطقة باردة وجافة بعيدا عن أشعة الشمس المباشرة ويتبع تدابير التخلص المناسبة من النفايات التي وضعها المختبر. - احتفظ بزجاجة 2 لتر من حمض الكبريتيك 5 MM المحتضنة في حمام مائي بجوار أداة HPLC. تعيين حمام الماء إلى 35 درجة مئوية. وضع أنابيب مع مرشح المذيبات في زجاجة المذيبات وإرفاق الطرف الآخر لوحدة ديجاسير تمشيا مع وحدة المضخة.
ملاحظة: تطهير النظام مع المذيبات الطازجة قبل تثبيت العمود هو ممارسة التعامل مع أداة جيدة. - تجهيز أداة HPLC مع العمود HPLC تمشيا مع وحدة RID. ضع العمود في حمام الماء 35 درجة مئوية إذا لم يكن منظم الحرارة العمود متوفرا.
- إعداد وحدة RID للتحليل عند 35 درجة مئوية في برنامج نظام بيانات الكروماتوغرافيا (CDS) المثبت على كمبيوتر النظام.
- في القائمة عرض، حدد الأسلوب ثم قم بتشغيل طريقة عرض التحكم. انقر بزر الماوس الأيمن على وحدة المضخة > الأسلوب. تعيين معدل التدفق إلى 0.55 مل·دقيقة-1 وحدد الزر تشغيل لبدء المضخة.
ملاحظة: إذا كان العمود في التخزين قبل أن يتم تجهيزه على HPLC، قم بزيادة معدل التدفق إلى 0.55مل·دقيقة-1 بعد إعادة توازن العمود باتباع إرشادات الشركة المصنعة. - انقر بزر الماوس الأيمن على لوحة المقابلة للوحدة RID > الأسلوب. تعيين درجة حرارة وحدة كاشف RI إلى 35 درجة مئوية وحدد تشغيل لبدء الاحماء وحدة كاشف RI.
- انقر بزر الماوس الأيمن على لوحة RID وحدة التحكم >. حدد تشغيل للخلية المرجعية للتطهير لمدة 15 دقيقة على الأقل عند استخدام مذيب جديد أو ساعة واحدة إذا تدفقت مذيبات مختلفة من خلال كاشف RI قبل هذا الإعداد. انقر على زر التشغيل.
ملاحظة: حافظ على المضخة وكاشف RI على لتحقيق خط أساس مستقر على مؤامرة على الانترنت. ويتأثر ذلك بتقلبات درجة الحرارة في المختبر ويمكن أن يستغرق ما يصل إلى 4 ساعة أو أكثر. حافظ على النظام في حالة تشغيل طوال الليل قبل تحميل العينة.
- في القائمة عرض، حدد الأسلوب ثم قم بتشغيل طريقة عرض التحكم. انقر بزر الماوس الأيمن على وحدة المضخة > الأسلوب. تعيين معدل التدفق إلى 0.55 مل·دقيقة-1 وحدد الزر تشغيل لبدء المضخة.
3. خلق طريقة لفصل HPLC isocratic من منتجات التخمير العضوي في CDS.
- من شريط القوائم، حدد أسلوب > أسلوب جديد. حدد أسلوب > حفظ الأسلوب ك [MethodName].M. حدد الأسلوب > تحرير الأسلوب بأكمله > الصك/الاستحواذ
- ضمن علامة التبويب مضخة ثنائية، تعيين تدفق إلى 0.55 مل·دقيقة-1. تحت المذيبات، حدد الحرف المقابل لإدخال المذيبات على وحدة المضخة وتعيينه إلى 100٪ لل elution isocratic. تعيين حدود الضغط إلى 0 و 400 شريط وإدخال 30 دقيقة كما Stoptime.
- ضمن علامة التبويب العينات، قم بتعيين حجم الحقن إلى 50 ميكرولتر. حدد الخيار As Pump/No Limit ضمن وقت التوقف. تعيين إعدادات Auxillary المتقدمة لسرعة السحب، سرعة القذف، ورسم الموقف إلى 200 μL·min-1،200 μL·min-1،و-0.5 مم.
- ضمن علامة التبويب RID، قم بتعيين درجة حرارة الوحدة البصرية إلى 35 درجة مئوية. ضمن إشارة، حدد الحصول على الإشارة و >0.2 دقيقة ل Peakwidth. حدد الخيار ك مضخة/حاقن لوقت الإيقاف.
- ضمن متقدمة ضمن علامة التبويب RID، تعيين الإخراج التمثيلي إلى 5٪ صفر إزاحة و 500,000 nRIU للتوهين. حدد الخيار الإيجابي لقطبية الإشارة والخيار تشغيل ل الصفر التلقائي قبل التحليل.
- حفظ الأسلوب عن طريق تحديد أسلوب > حفظ الأسلوب. تحميل الأسلوب عن طريق تحديد أسلوب > تحميل الأسلوب > [MethodName]. م.
4. إنشاء جدول تسلسل للاختام التلقائي وبدء تشغيل نظام HPLC-RID للحصول على البيانات.
- من شريط القوائم، حدد تسلسل > قالب تسلسل جديد. حدد تسلسل > حفظ قالب التسلسل ك [تسلسل تيمبليتنام]. S.
- حدد جدول تسلسل >. إلحاق 'ن' الصفوف المقابلة لقوارير 'ن'، ثم وضع قارورة الإدخال وأسماء العينة تحت اسم القارورة وعينة،على التوالي، وفقا لترتيبها على علبة autosampler. حدد الأسلوب الذي تم إنشاؤه في الخطوة 3 من القائمة المنسدلة اسم الأسلوب وإدخال 50 ميكرولتر ك Inj/Vial (Injection per Vial) لكل صف.
- انقر فوق تطبيق قالب التسلسل وحفظه عن طريق تحديد قالب التسلسل > حفظ قالب التسلسل. تأكد من تحميل قالب التسلسل عن طريق تحديد تسلسل > قالب تسلسل التحميل > [SequenceTemplateName]. S.
- بعد تحقيق خط أساس مستقر على المؤامرة على الانترنت، انقر بزر الماوس الأيمن على لوحة وحدة RID > التحكم > إيقاف صمام إعادة التدوير لتوجيه تدفق المذيبات من خلال كاشف RID إلى النفايات. لبدء اكتساب البيانات، حدد التسلسل من شريط القوائم، > التسلسل تشغيل.
5. استخراج وتحليل البيانات بعد التشغيل.
- حدد طريقة عرض تحليل البيانات من القائمة عرض. حدد موقع اسم ملف التسلسل من قائمة الملفات على الجانب الأيسر من الشاشة. على اللوحة المركزية على الشاشة، انتقل إلى تحديد عرض الإشارة > إشارة RID لعرض عينات الكروماتوجرامات.
- حدد صفا مطابقا لعينة قياسية عالية التركيز من اللوحة العلوية على الشاشة. يحيط علما أوقات الاحتفاظ لهذه القمم التحليلية الهدف على الكروماتوجرام المعروضة. سيتم ترتيب القمم المقابلة للناحات المستهدفة على طول محور وقت الاحتفاظ مثل الجلوكوز ، النجدة ، اللاكتات ، الفورمات ، خلات ، والإيثانول (الشكل التكميلي 1).
ملاحظة: أول ذروة كبيرة على الكروماتوجرام يتوافق مع حمض ثلاثي الكلور. يجب أن تكون وحدات RI الخاصة به متسقة عبر جميع عينات المنحنى القياسية. التحقق من صحة وقت الاحتفاظ لكل تحليل الهدف عن طريق تشغيل كل مركب كعينة منفصلة. - استخراج مناطق الذروة لكل تحليل الهدف من الكروماتوجرامات من المعايير وعينات رد الفعل.
- تمييز ما إذا كانت القمم من الفائدة متكاملة بشكل جيد من قبل البرنامج. رسم الخط الأحمر كقاعدة لكل قمة للحصول على منطقة متكاملة بدقة تحت المنحنى. إذا فشل التكامل التلقائي (أي الخط الأحمر هو askew)، حدد زر التكامل اليدوي من مجموعة أدوات التكامل وارسم قاعدة الذروة يدويا لدمج منطقة الذروة.
ملاحظة: إذا كان يجب إجراء تكامل يدوي من أجل تحليل هدف في عينة واحدة، الاحتفاظ متناسقة و يدويا دمج التحليل نفسه عبر كافة العينات. - حدد أداة Cursor من مجموعة الأدوات المشتركة للنقر على القمم المتكاملة بشكل صحيح. سيتم تمييز منطقة الذروة ووقت الاحتفاظ المقابل للذروة المحددة كصف جدول على اللوحة السفلية للشاشة.
- لتصدير مناطق الذروة، حدد نتائج تكامل تصدير > > الملف.
- تمييز ما إذا كانت القمم من الفائدة متكاملة بشكل جيد من قبل البرنامج. رسم الخط الأحمر كقاعدة لكل قمة للحصول على منطقة متكاملة بدقة تحت المنحنى. إذا فشل التكامل التلقائي (أي الخط الأحمر هو askew)، حدد زر التكامل اليدوي من مجموعة أدوات التكامل وارسم قاعدة الذروة يدويا لدمج منطقة الذروة.
- تحديد تركيزات التحليل المستهدف باستخدام المنحنيات القياسية.
- قيم منطقة ذروة الرسم مقابل التركيزات المعروفة للعينات في جدول البيانات. انقر بزر الماوس الأيمن على البيانات المرسومة، إضافة خط الاتجاه > تنسيق خط الاتجاه > عرض المعادلة على الرسم البياني.
- في جدول بيانات منفصل، استخدم معادلات خطوط الاتجاه القياسية للمنحنى لتحويل قيم منطقة الذروة إلى تركيزات لكل تحليل من كل عينة. حساب متوسط مناطق الذروة وقيم الخطأ القياسية عبر ثلاث نسخ لتصور البيانات.
6- بدء ووقف ومعالجة النظائر الزمنية التي تتبع تفاعلات CFME من أجل القياس الكمي ل LC-MS/MS.
- إعداد ردود الفعل ثلاثية الفرات في كل نقطة زمنية (باستثناء الوقت صفر) على الجليد كما هو موضح في 1.1-1.2. ومع ذلك، بدلا من الجلوكوز، استخدم تركيز نهائي من 100 م م 13C6-الجلوكوز في ردود الفعل. احتضان ردود الفعل عند 37 درجة مئوية لمدة ساعة و2 ساعة و3 ح.
- لإنهاء، فلاش تجميد ردود الفعل في النيتروجين السائل وتخزينها في -80 درجة مئوية. تخطي خطوة التخزين هذه للتحليل في نفس اليوم.
ملاحظة: لم يستخدم حمض ثلاثي كلورو ستيك لوقف التفاعلات بسبب التداخل من الحمض عند اكتشاف بعض الأيضات الكربونية المركزية عبر LC-MS/MS. بدلا من ذلك، تم استخدام مذيبات الاستخراج التي تحتوي على حمض الفورميك (الخطوة 6.3) لتسريع البروتينات الأيضية لأن كتلة حمض الفورميك أقل من حد الكشف عن طريقة MS/MS المبلغ عنها. - إعداد 50 مل من المذيبات استخراج. الجمع بين دوامة 20 مل من أسيتونيتريل, 20 مل من الميثانول, و 10 مل من الماء (جميع LC-MS الصف) في أنبوب الطرد المركزي 50 مل جنبا إلى جنب مع 0.199 مل من حمض الفورميك لجعل حل 0.1 M. قم بتبريد المذيب إلى 4 درجات مئوية أثناء الاستخراج وتخزين المذيب عند -20 درجة مئوية عندما لا يكون قيد الاستخدام.
- معالجة عينات لتحليل LC-MS/MS
- في يوم التحليل، ماصة حجم معادل للمذيب استخراج (أي 50 ميكرولتر) لكل عينة. إذا تم تجميد العينات، إضافة المذيبات استخراج قبل العينات ذوبان تماما لمنع إعادة تنشيط التمثيل الغذائي الجلوكوز. تنفيذ كافة خطوات معالجة العينة على الجليد.
- لتلخيص الوقت صفر، ماصة الحجم النهائي للمذيبات استخراج (أي 50 ميكرولتر) إلى حجم مناسب من lysate للتركيز النهائي المطلوب في رد الفعل (أي، من 4.5 ملغم / مل في حجم رد فعل 50 ميكرولتر). إضافة باقي مكونات التفاعل كما في الخطوة 1.2. هذه الخطوة التحمض يعجل الانزيمات ليسات قبل أن استقلاب الجلوكوز بشكل كبير.
- احتضان العينات في استخراج المذيبات على الجليد لمدة 30 دقيقة مع اهتزاز لطيف، ثم الطرد المركزي العينات في 21،000 × غرام لمدة 15 دقيقة في 4 درجة مئوية لفصل supernatant من البروتين عجلت. نقل 50 ميكرولتر من supernatant إلى قوارير autosampler وتحميل قوارير على صينية داخل autosampler 4 درجة مئوية. تخزين بقية supernatant في -20 درجة مئوية للتحليلات المستقبلية.
7. إعداد نظام LC لتحليل LC-MS/MS.
- إعداد 1 لتر من المذيبات A عن طريق حل تماما 77.08 ملغ من خلات الأمونيوم في 950 مل من الماء و 50 مل من الأيزوبروبانول. إعداد 1 لتر من المذيبات B مع 650 مل من أسيتونيتريل، 300 مل من الماء، و 50 مل من الأيزوبروبانول جنبا إلى جنب مع 77.08 ملغ من خلات الأمونيوم. تأكد من أن جميع المذيبات هي LC-MS الصف.
- قم بتوصيل الزجاجات المذيبة التي تحتوي على المذيبات A و B بوحدة المضخة. تطهير النظام بمعدل تدفق مرتفع لإزالة / الحد من أي تلوث الهواء التي قد تكون حدثت أثناء معدات المذيبات لنظام LC.
- تجهيز النظام بعمود C18 معكوس المرحلة (طول عمود 30 سم، قطر داخلي 75 ميكرومتر، وقطر جسيم 5 ميكرومتر). قم بتكذيب العمود على نظام LC-MS عن طريق التدفق بنسبة 100٪ من المذيبات B والتدفق ببطء حتى المذيبات A إلى 100٪.
ملاحظة: تم إعداد نصائح العمود في المنزل باستخدام سحب micropipette ومعبأة مع خلايا الضغط والهيليوم.
8. إنشاء طريقة على LC-MS / MS الحصول على البيانات وتفسير البرمجيات لنظام LC مرتبطة فورييه تحويل والأيون فخ الطيف الشامل.
- افتح برنامج Tune Plus لتحرير ملف لحن لأسلوب MS.
- من الملف على شريط القوائم، افتح ملف لحن الوضع السالب المثبت مسبقا.
- حدد ScanMode على شريط القوائم، ثم حدد تعريف نافذة المسح الضوئي. تعيين إعداد الوقت ميكروسكان ل MSn إلى 1 لكل من فخ أيون و FT.
- انتقل إلى إعدادات مصدر نانو-ESI وتعيين رذاذ الجهد إلى 4 كيلو فولت. تعديل هذا حتى يتم إنشاء الكهروسبراي مقبولة؛ عادة، يمكن تحقيق الرذاذ الكهربائي مقبولة ضمن نطاق 2-5 كيلو فولت.
- حفظ ملف اللحن.
- إنشاء طريقة LC جديدة باستخدام معالج الإعداد من الحصول على البيانات الصك وتفسير البرمجيات. فتح مخطط > تسلسل إعداد > المعالج. نظرا لأن هذه الطرق لا تتطلب استخدام سخان عمود، تخطي خطوة التحكم المؤقت.
- ضمن خيارات مضخة الانحدار التدفق، حدد Multistep. في النافذة التالية، أدخل 7 أسطر وحدد معدل التدفق لكل صف إلى 0.1 مل·دقيقة-1. إدخال المعلمات التالية لكل صف: من 0-3 دقيقة، وتقديم 100٪ المذيبات A؛ من 3-9 دقيقة، وإدخال التدرج من 100٪ المذيبات A إلى 20٪ المذيبات B. من 9-19 دقيقة، وإدخال تدرج جديد من 20٪ المذيبات B إلى 100٪ المذيبات B؛ من 19-27 دقيقة، عقد في 100٪ المذيبات B؛ من 27-28 دقيقة، تعيين الانحدار مرة أخرى إلى 100٪ المذيبات A؛ من 28-44 دقيقة، وشطف وإعادة تكييف العمود لأشواط لاحقة عن طريق عقد في 100٪ المذيبات A. وتشمل خطوة أخيرة لخفض معدل التدفق إلى 0.03 مل·دقيقة-1 عند الانتهاء من تشغيل للحفاظ على المذيبات عندما LC غير قيد الاستخدام.
- تطبيق الإعدادات الافتراضية لخيارات العينات > ضغط المضخة كخيار الاستحواذ واستخدام الافتراضي اقتناء الوقت واستخدام خيارات ضغط المضخة الافتراضية.
- إنشاء أسلوب MS/MS عن طريق تحديد رمز Orbitrap Velos Pro MS من الشريط الجانبي على إطار إعداد الجهاز.
- انقر على أسلوب جديد > البيانات التابعة MS / MS. تعيين وقت اكتساب طول تشغيل LC (أي 44 دقيقة) ، مقطع إلى 1 ، وأحداث المسح الضوئي إلى 11. بالنسبة إلى Tune File، حدد الملف المحرر من الخطوة 8.1.
ملاحظة: الحدث الأول هو فحص السلائف MS1 باستخدام MS تحويل فورييه (FTMS). الأحداث العشر التالية ستكون فحوصات MS2 التي تختار الأيونات العشرة الأكثر كثافة وفريدة في كل فحص للسلائف للتجزئة MS2. - للحدث 1، تحت مسح الوصف تعيين محلل إلى FTMS والقطبية إلى السلبية. تحت إعدادات MSn، استخدم دقة 30,000 وطاقة تصادم طبيعية من 35 V. تعيين نطاقات المسح الضوئي إلى 50 م/ض للكتلة الأولى و 1800 م/ض للكتلة الأخيرة لالتقاط جزيئات صغيرة.
- للأحداث من 2 إلى 11، ضمن مسح الوصف تعيين محلل إلى اعتراض أيون. حدد المسح التابع وانقر على إعدادات > استبعاد ديناميكي > العمومي وحدد تمكين; تعيين مدة تكرار 30 s ومدة استبعاد 120 s للقضاء على تكرار المسح الضوئي في القرب.
- انتقل إلى إعدادات "الحدث المسح الضوئي" وتعيين الكتلة المحددة من "حدث المسح الضوئي" إلى 1 لكافة أحداث MS2 (2 إلى 11). لمسح أعلى 10 الأيونات الأكثر كثافة، تعيين كل حدث مسح MS2 للكشف عن نth الأكثر كثافة أيون من 1st إلى10 th. لذلك، تعيين الحدث 2 للكشف عن 1 كion الأكثر كثافة n، الحدث 3 للكشف عن 2، وهكذا.
- أغلق إطار الإعداد ثم انتقل إلى ملف > حفظ باسم [Method_Name].meth.
ملاحظة: للاستخدام العام، والصيانة، ومعايرة أداة LC ومطياف الكتلة، راجع تعليمات التشغيل والكتيبات التي توفرها الشركة المصنعة.
- انقر على أسلوب جديد > البيانات التابعة MS / MS. تعيين وقت اكتساب طول تشغيل LC (أي 44 دقيقة) ، مقطع إلى 1 ، وأحداث المسح الضوئي إلى 11. بالنسبة إلى Tune File، حدد الملف المحرر من الخطوة 8.1.
9. إعداد تسلسل تشغيل وبدء تشغيل LC-MS/MS.
- إعداد تسلسل تشغيل باستخدام برنامج الحصول على البيانات والتفسير الخاص بنظام LC-MS/MS. ضمن Roadmap > إعداد التسلسل، انقر بزر الماوس الأيمن فوق الجدول لإدراج صفوف كثيرة مثل العينات. لكل صف، قم بتعيين Inj Vol إلى 5 ميكرولتر والموضع إلى موضع القارورة المعني على صينية الطوابع التلقائية. إدخال أسماء الملفات كأسماء عينة وتعيين مسار الملف المطلوب لنتائج التشغيل.
ملاحظة: يمكن تشغيل قوارير فارغة تحتوي على المذيبات A في بداية التسلسل وبين كل مجموعة من عينات ثلاثية (كل مجموعة من النقاط الزمنية) لشطف العمود. - لبدء التشغيل، تمييز كافة أسماء الملفات في التسلسل. من شريط القوائم، حدد الإجراءات > تشغيل التسلسل > موافق.
10. دمج الملفات والبحث عن التعليقات التوضيحية المؤقتة على MZmine 2.53.
- افتح MZmine واستورد ملفات الإخراج '.raw' من الخطوة 9.1. من شريط القوائم، حدد أساليب البيانات الخام > استيراد البيانات الخام. حدد الملفات المطابقة للعينات.
- إنشاء قائمة القمم التي تميز بين MS1 وMS2 بمسح. من شريط القوائم، أساليب البيانات الخام > ميزة الكشف > MS / MS Peaklist منشئ. تتضمن الإعدادات ذات الصلة m/z إطار تعيين إلى 0.01 و إطار الوقت تعيين إلى طول التشغيل. ضمن مجموعة المرشحات، حدد سالبا كالقطبية و Centroided كنوع الطيف.
- من شريط القوائم، انتقل إلى أساليب قائمة الميزات > ميزة الكشف > الموسع الذروة. تعيين m/z التسامح إلى 0.005 م / ض أو 10 ppm والحد الأدنى للارتفاع إلى 1E3. هذه الخطوة سوف تخلق قمم مجسدة بالكامل.
- إزالة القمم المكررة. العودة إلى "أساليب قائمة الميزات" > تصفية > "تصفية الذروة المكررة". تتضمن الإعدادات ذات الصلة مجموعة تفاوت m/z إلى 0.005 م/ض أو 10 صفحة في الدقيقة ومجموعة تفاوت RT إلى 5 دقائق.
- لمحاذاة القمم داخل ملفات البيانات المماثلة (أي تلك الخاصة بتفاعلات ثلاثية القوائم)، عد إلى أساليب قائمة الميزات > التطبيع > معايرة وقت الاحتفاظ. تأكد من معالجة عينات ثلاثية الخلايا معا وترك الفراغات. تتضمن الإعدادات ذات الصلة m/z Tolerance تعيين إلى 0.005 م/ض أو 10 صفحة في الدقيقة، تعيين تفاوت RT إلى 3 دقائق مطلقة (دقيقة)، والحد الأدنى للكثافة القياسية المحددة إلى 1E3.
- محاذاة القمم من كافة الملفات بواسطة m/z ووقت الاستبقاء من "أساليب قائمة الميزات" > المحاذاة > محاذاة RANSAC. تعيين التسامح m/z إلى 0.005 م/ض أو 10 جزء في المليون، التسامح RT والتسامح RT بعد التصحيح إلى 44 و 39 دقيقة، على التوالي، RANSAC التكرارات إلى 0، الحد الأدنى لعدد النقاط إلى 10٪، وقيمة العتبة إلى 1. حدد الخيار تتطلب نفس حالة الشحن.
- تصحيح أي نقاط البيانات التي قد تكون فقدت في الخطوات السابقة في "أساليب قائمة الميزات" > ملء الفجوة > الباحث الذروة. تتضمن الإعدادات ذات الصلة تعيين تفاوت الكثافة إلى 50٪، وتعيين تفاوت m/z إلى 0.005 م/ض أو 10 صفحة في الدقيقة، وتعيين تفاوت RT إلى 3 دقائق. تمكين تصحيح RT.
11. حساب كتل الوضع السلبي من 13الأيض C المسمى الجلوكوز المستمدة والبحث عن ملامح م / ض من هذه التحليلات في البيانات المصفاة.
- حساب الجماهير من 13الأيض C المسمى من استقلاب الجلوكوز للبحث المستهدف.
- حساب كتلة أحادية النظائر لكل مركب الهدف من عدد الذرات في التركيبة الجزيئية للمجمع والجماهير أحادية النظائر لكل عنصر20.
- حساب كتلة الوضع السلبي للمجمع [M-H]- عن طريق طرح كتلة بروتون واحد (1.007276 دا) من الكتلة أحادية النظائر. هذه هي الكتلة التي تم اكتشافها عن طريق اكتشاف MS الوضع السلبي بعد تجريد الجزيئات من أيون الهيدروجين أثناء التأين.
- من كتلة الوضع السلبي، وحساب كتلة من 13C-دمج المستقلب. هنا، تم حساب كتل من الاوتوبولوغات التي تتضمن إلى أقصى حد الجلوكوز المستمدة من 13C-التسميات.
- استخدام الجماهير المحسوبة من 13الأيض C المسمى للبحث والتعليق على ميزات م / ض من نتائج MZmine. لكل ضربة ممكنة، حساب الخطأ الشامل (ppm) باستخدام المعادلة التالية:
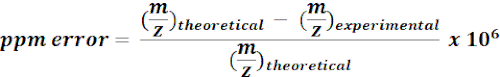
ملاحظة: قيم m/z التجريبية مع <15 ppm خطأ كتلة اعتبرت التعليقات التوضيحية المفترضة في التحليل الحالي. - تحقق يدويا من أطياف التعليقات التوضيحية المفترضة على متصفح الجودة لتأكيد التعليقات التوضيحية.
- فتح خارطة الطريق > Qual Browser. من شريط الأدوات، افتح Raw File لاستيراد بيانات MS الأولية لكل عينة.
- رسم خط تحت النطاق المطلوب من أوقات الاحتفاظ (أي المقابلة للشرح المفترض) على مجموع اللوني الأيون (اللوحة العليا) لعرض طيف كتلة (اللوحة السفلية). انقر بزر الماوس الأيمن على الطيف وإدخال مجموعة من الكتل التي تشمل m/z الخاص بالنطاق التحليلي المستهدف. تحقق ما إذا كانت الشروح المفترضة لها إشارات ذروة متميزة أعلى بشكل ملحوظ من الضوضاء(الشكل التكميلي 2).
- حساب متوسط مناطق الذروة والأخطاء القياسية للتعليقات التوضيحية الإيجابية عبر التكرارات البيولوجية لكل نقطة زمنية. تصور البيانات (أي على الرسم البياني شريط) لمراقبة الاتجاهات في التمثيل الغذائي الجلوكوز.
النتائج
لقياس التركيب الخالي من الخلايا القائم على الييسات لمنتجات التخمير الشائعة من الجلوكوز ، تم تغذية اليسات المشتقة من السلالات المزروعة في وسائط 2xYPTG 100 ميكرومتر من الجلوكوز كمصدر كربون أساسي8. توقفت ردود الفعل على مدى 24 ساعة دورة الوقت عن طريق تحمض البروتين. تم تحميل النباتات الفائقة المصفاة التي تحتوي على بيروفاتي، سكرينات، لاكتات، رفيقة، خلات، والإيثانول المنتجة من تقويض الجلوكوز على وحدة autosampler من نظام HPLC مجهزة وحدة RID. قوارير مع خليط من المنتجات النهائية التخمير والجلوكوز في 1.17 ميكرومتر، 2.34 ميكرومتر، 4.69 ميكرومتر، 9.38 ميكرومتر، 18.75 ميكرومتر، 37.50 ميكرومتر، 75 ميكرومتر، و150 ميكرومتر تم تحميل تركيزات في المخزن المؤقت S30 على الجهاز كمقاييس. تم تحرير التحليلات متساوية الانتظام من عمود HPLC إلى RID. يمكن حل قمم الجلوكوز والسكرينات واللاكتات والفورمات وخلات والإيثانول ضمن نطاق 1 إلى 150 ميكرومتر عن طريق RID. تم اشتقاق مناطق الذروة للجلوكوز عن طريق التكامل اليدوي من بيانات RID للدورة الزمنية وعينات المنحنى القياسية. تم أخذ مناطق الذروة المستخرجة للسكونات واللاكتات والفورمات وخلات والإيثانول من إشارات متكاملة تلقائيا. جميع المنحنيات القياسية (منطقة الذروة مقابل التركيز المعروف) كان R2 القيم >0.99 وكانت خطية في جميع أنحاء مجموعة من التركيزات المستخدمة هنا.
تم حساب تركيزات المول لجميع التحليلات المستهدفة من منحنيات قياسية لكل منها. استهلكت الجلوكوز في غضون 3 ساعة الأولى من رد الفعل والمخمرة أساسا إلى اللاكتات (الشكل 2A, ب). كما حدث تراكم الإيثانول بشكل كبير في غضون أول 3 ساعة من التفاعل وتوقف بعد ذلك(الشكل 2C). لم تكن ملاحظة إنتاج اللاكتات والإيثانول الكبير مع استهلاك الجلوكوز الكبير بعد 3 ساعة غير مسبوقة لأن مسارات إنتاج اللاكتات والإيثانول تسمح بتجديد 1 صافي مول NAD + من NADH الجليكوليك المطلوب لاستمرار استهلاك الجلوكوز من خلال انحلال الجليكوليسيس(الشكل 1). وبالتالي يمكن اعتبار اللاكتات والإيثانول كالمنتجات النهائية الرئيسية للتخمير في عملية التمثيل الغذائي للجلوكوز الخالي من الخلايا القائمة على الليستات. خلات كان حاضرا في البداية في ردود الفعل كعنصر من العازلة S30 وتراكمت بشكل غير متوقع فقط بسبب التمثيل الغذائي بعد 6 ح عندما تباطأ استهلاك الجلوكوز(الشكل 2D). وتشير هذه النتيجة إلى أن تخمير خلات لا تمكن بالضرورة تدفق الجليكوليك السريع في النقاط الزمنية السابقة. وفي الوقت نفسه، تم تصنيعها formate و succinate كمنتجات التخمير طفيفة (الشكل 2E، واو). وإجمالا، مكنت هذه الطريقة من التحديد الكمي المطلق لاستنفاد ركائز السكر وتشكيل المنتجات المخمرة في lysates E. coli S30.
تم تطبيق الكشف عن مرض التصلب العصبي المتعدد لملف تعريف استقلاب الجلوكوز lysate على وجه التحديد هنا. تم تغذية اليسات المشتقة من السلالات التي تزرع في وسائل الإعلام 2xYPTG 13C6-الجلوكوز كمصدر للكربون. تم تشغيل ردود فعل CFME في ثلاثية ل0 ساعة، 1 ساعة، 2 ساعة، و 3 ساعة. تم تحميل عينات من كل نقطة زمنية على نظام LC مجهز بعمود معكوس المرحلة واقترن بمطيافات كتلة فخ فورييه والأيونات. تم الحصول على أطياف وضع الأيونات السلبية ومعالجتها لتحليل الأحماض العضوية وفوسفات السكر والأحماض الأمينية. وتم البحث في الكتل النظرية المحسوبة من 13نوعا تحمل علامة C تنتمي إلى عملية التمثيل الغذائي المركزي للكربون لتحديد المركبات المشتقة من الجلوكوز على وجه التحديد. استنادا إلى ظروف زراعة سلالة المصدر المستخدمة والتقارير السابقة من المسارات النشطة في E. coli CFME ، يفترض هنا أن بروتيوم التحلل يتكون من شبكة التمثيل الغذائي التي تغذي الجلوكوز في التخمير الجليكوليك ، ومسار فوسفات البنتوس ، وربما أنبوليز الأحماض الأمينية5،6،7،8،14 ( الشكل1). لذلك، تم تضييق نطاق البحث إلى أعضاء هذه المسارات، منها 16 المستقلبات التي تتضمن التسميات C 13المشتقة من الجلوكوز كانت مشروحة بشكل لا لبس فيه (الجدول التكميلي 1).
13 C6-الجلوكوز استهلكت بشكل ملحوظ من خلال انحلال الجليكوليسيس، كما يتضح من التقلبات في وفرة المتوسطة الجليكوليكية (الشكل 3A-ه). بما يتفق مع بيانات HPLC-RID، تراكمت الجلوكوز إلى 13C3-lactateوتم أيضا المخمرة إلى 13C3-succinateضمن أول 3 ساعة من رد الفعل ( الشكل4A،B). تشكيل 13C3-succinate isotopologue يدعم النموذج المقترح من استقلاب الجلوكوز ليسات(الشكل 1)،حيث من المرجح أن يتم إنشاء succinate عن طريق الكربوكسيليكيشن من جزيء فوسفوينولبيروفات (PEP) 3-الكربون وليس من دخول جزيء أسيتيل-CoA الكربون 2 إلى دورة TCA. وقد افترض تفعيل دورة TCA في دراسات CFME السابقة، ولكن لم يتم الكشف عن غيرها من 13وسيطة C المسمى من TCA هنا8،19،21. 13 C3-aspartate التوليف ومع ذلك حدث داخل ح الأولى، وكان المستهلكة، وتعزيز فكرة أن يتم تحويل PEP مباشرة إلى oxaloacetate (الشكل 1، الشكل 6C). تعكس البيانات بروتيوم الليسات من سلالات المصدر التي يتم حصادها أثناء النمو المخمر على الوسائط الغنية بالجلوكوز (2xYPTG). وهذا يعني كذلك أن بقية الإنزيمات TCA لا تشارك في إنتاج succinate تشكل فرع TCA التأكسدي(الشكل 1). ومع ذلك، لم يتم الكشف عن أي من الأيضات في هذا المسار، ربما لأن تركيزات عالية من الغلوتامات المضافة إلى رد فعل CFME كك المضادة للملح تمنع تطور هذا الفرع.
وتستكمل بيانات HPLC-RID بالإضافة إلى ذلك بعدم وجود 13C2 -خلاتالكشف ضمن الإطار الزمني رد فعل 3 ساعة مما يشير إلى عدم تراكم خلات من الجلوكوز تصل إلى 3 ح (الشكل 2B). ومع ذلك، فإن السلائف المباشرة للخلات، أسيتيل-فوسفات (أسيتيل-P)، المتراكمة، مما يشير إلى أن الذراع PTA من مسار Pta-AckA لتوليف خلات من أسيتيل-CoA نشط (الشكل 4C،D). وAckA حفاز dephosphorylation من 13C2-أسيتيل-P إلى 13C2 -خلاتمن المرجح أن لا يحدث ضمن هذا الإطار الزمني بسبب خلات كونها عنصرا رئيسيا من العازلة S30 المستخدمة في ردود الفعل (الشكل 1, الشكل 2B).
كما لوحظ إدماج 13C6-الكربونات المشتقة من الجلوكوز في فوسفات السكر 6-فوسفوجلوكولاتون (6PGL)، 6-فوسفوجلوكونات (6PG)، ريبولوز-5-فوسفات (Ru5P)، وsedoheptulose-7-فوسفات (S7P) لوحظ أيضا(الشكل 5). هذه النتائج تؤكد مشاركة مسار فوسفات البنتوس في استقلاب الجلوكوز ليسات ويغذي على الأرجح 13C9-التيروزين التوليف، الذي اقترح من قبل دراسة بروتيوميك، في حين توفر أيضا مقدمة لإنتاج 13C5-histidine (الشكل 6A، B)7. لم يتم ملاحظة فينيلالاناين والتربتوفان المسمى هنا ، ولم يكن معظم الأحماض الأمينية الأساسية. ومع ذلك، هذا ليس من المستغرب تماما منذ استقلاب الأحماض الأمينية من المرجح أن تكون غنية في ال ليسات المستمدة من الخلايا التي تزرع في ظروف المتعطشة للمغذيات أو في المرحلة الثابتة7،22. وعلاوة على ذلك، تشير البيانات حتى الآن إلى أن وسيطات التحليل الجليكوليسيس والتخمير يتم توجيهها نحو عامل مساعد لتجديد ردود الفعل النهائية، التي يجب أن تحول دون توليف العديد من الأحماض الأمينية المستمدة من الجليسيراتالدهيدي-3-الفوسفات، بيروفاتي، وأسيتيل-CoA (أي، الجليسين، السيستين، سيرين، ألانين، فالين، الليسين، والليسين) (الشكل 1). كما ذكر, 13C3-aspartate تم إنتاجها في غضون الساعة الأولى, في حين اشتقاق الأسبارتات 13C-دمج الأحماض الأمينية (أي, ثريونين, إيسولوسين, ميثيونين, والهليونين) لم يلاحظ ربما لأن الأسبارتات المشتقة من الجلوكوز يشارك في التخمير (الشكل 1, الشكل 6C). وأخيرا، قد يكون التدفق نحو الغلوتامات والأحماض الأمينية المشتقة من الغلوتامات قد أعاقه ارتفاع مستويات الغلوتامات في بيئة التفاعل(الشكل 1).
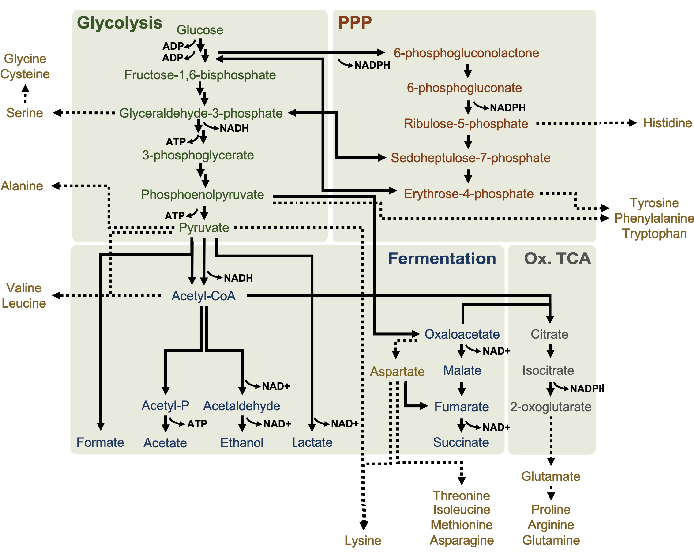
الشكل 1:نموذج التمثيل الغذائي المفترض من اللستات المستمدة من E. coli BL21DE3-Star تنمو أضعافا مضاعفة في تركيزات الجلوكوز العالية. الوسيطة والمنتجات النهائية من انحلال الجليكوليسيس (الأخضر), وقد تم الإبلاغ عن مسار فوسفات البنتوس (البرتقالي الداكن), ومسارات التخمير (الأزرق) من أسيتيل-CoA في CFME القائم على التحلل. وجود التخمير succinate يعني تفعيل فرع TCA التأكسدي (رمادي). استقلاب الأحماض الأمينية (الذهب) في اليزحات ليست محددة جيدا ويتم التحقيق هنا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
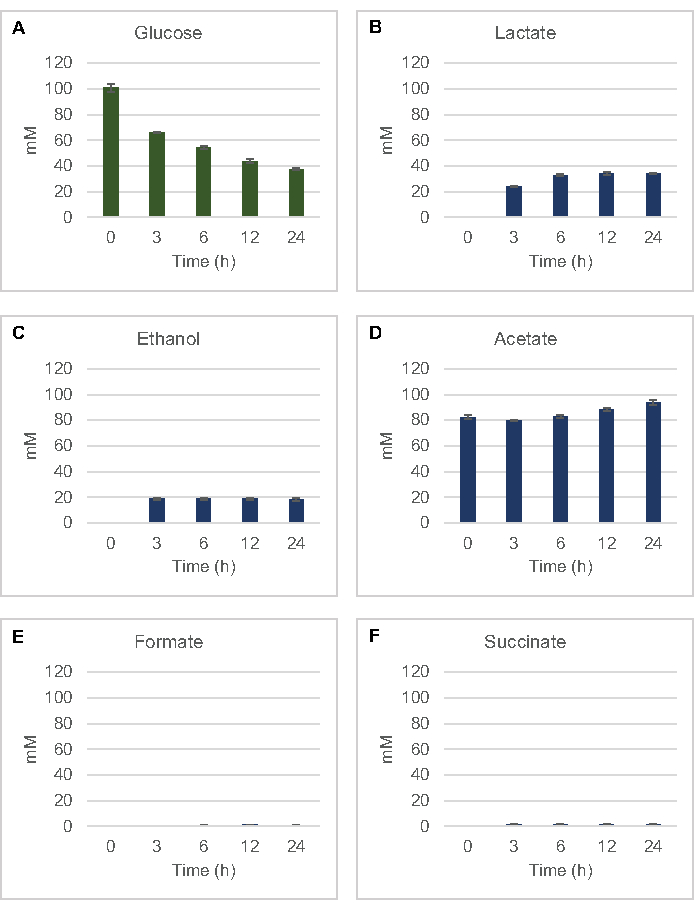
الشكل 2: HPLC-RID البيانات لاستهلاك الجلوكوز والتخمير نهاية المنتج التوليف في ردود فعل CFME أعدت مع مقتطفات الخام كولاي. (أ) استهلاك الجلوكوز و (ب) اللاكتات، (C) الإيثانول، (D) خلات، (ه) formate، و (F) تم رصد إنتاج العصارة في ردود فعل CFME أكثر من 24 ح. يتم عرض متوسط تركيزات mM وأشرطة الخطأ (SE) التي تم قياسها كميا مع المنحنيات القياسية (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
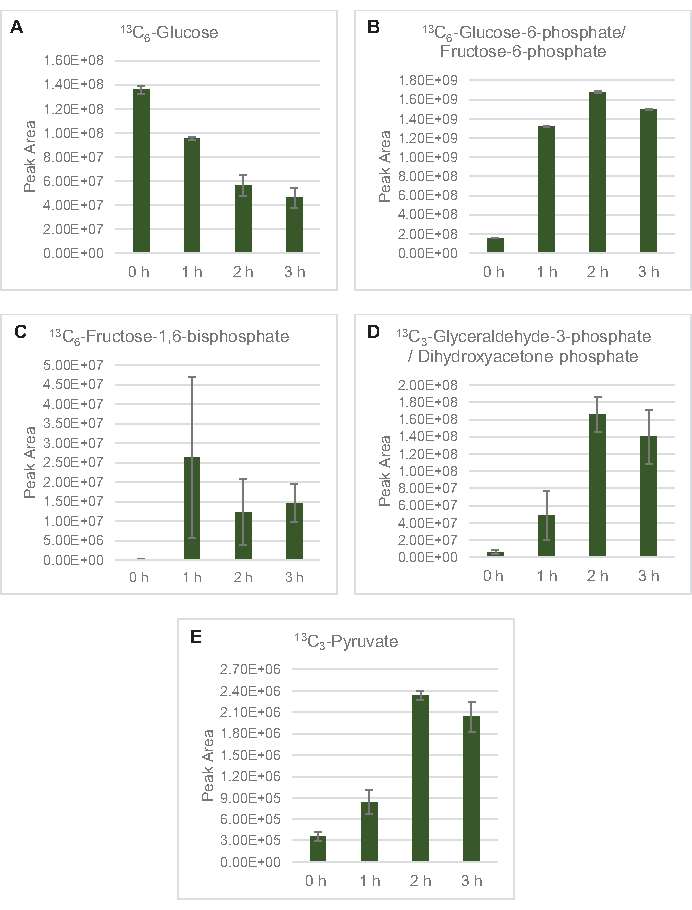
الشكل 3: اتجاهات الدورة الزمنية من 13C6-الجلوكوز و 13C-المسمى وسيطة الجليكوليك في E. القولونية lysate CFME. وفرة نسبية من (أ) 13C6-الجلوكوز، (ب) 13C6-الجلوكوز-6-فوسفات/فركتوز-6-فوسفات،(C) 13C6-فركتوز-1،6-بيسفوسفات، (D) 13C3-glyceraldehyde-3-فوسفات/ديهيدروكسياسيتون فوسفات، و (E) 13C6 -pyruvate في ردود فعل CFME أكثر من 3 ساعة. واستخدمت مناطق الذروة الخام المستخرجة من قبل برنامج mzMINE لحساب المتوسطات وأشرطة الخطأ (SE) للتعليقات التوضيحية الإيجابية (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: اتجاهات الدورة الزمنية للوسطاء والمنتجات النهائية في 13C6-تخمير الجلوكوز في E. coli lysate CFME. وفرة نسبية من (أ) 13C3-lactate، (B) 13C3-succinate، (C) 13C2-أسيتيل-فوسفات، و (D) 13C2-أسيتيل-CoA في ردود فعل CFME أكثر من 3 ساعة. واستخدمت مناطق الذروة الخام المستخرجة من قبل برنامج mzMINE لحساب المتوسطات وأشرطة الخطأ (SE) للتعليقات التوضيحية الإيجابية (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
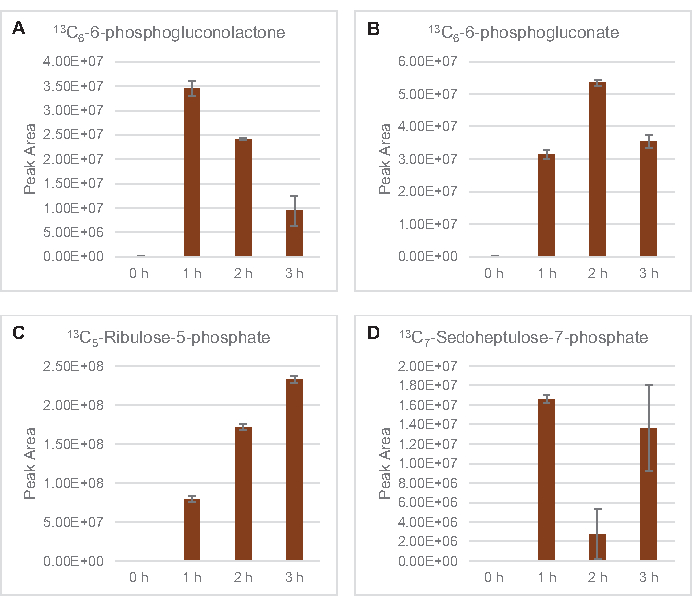
الشكل 5: اتجاهات الدورة الزمنية من 13C6-الجلوكوز المشتقة بينتوس الفوسفات مسار وسيطة في E. القولونية lysate CFME. وفرة نسبية من (أ) 13C6-6-phosphogluconolactone، (B) 13C6-6-phosphogluconate، (C) 13C5-ribulose-5-الفوسفات، و (D) 13C7-sedoheptulose-7-فوسفات أكثر من 3 ح. واستخدمت مناطق الذروة الخام المستخرجة من قبل برنامج mzMINE لحساب المتوسطات وأشرطة الخطأ (SE) للتعليقات التوضيحية الإيجابية (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
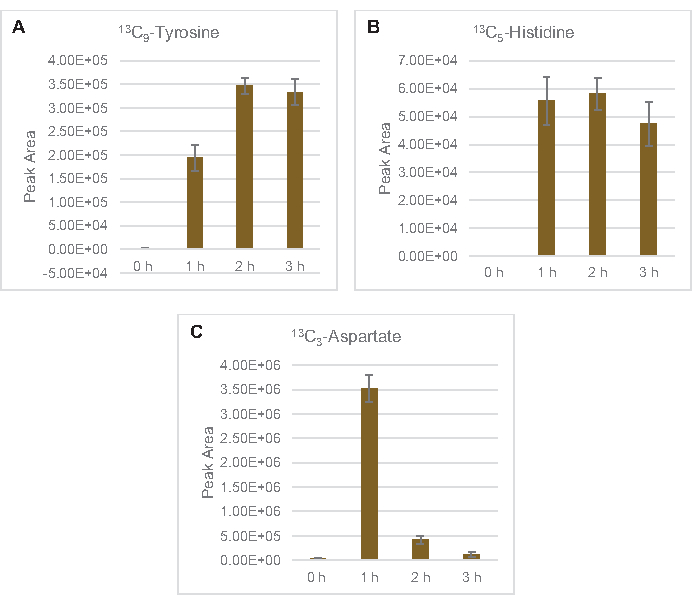
الشكل 6: اتجاهات الدورة الزمنية للكشف عن 13C6-الجلوكوز المستمدة من الأحماض الأمينية في E. القولونية lysate CFME. وفرة نسبية من (أ) 13C9-التيروزين، (ب) 13C5-histidine، و (C) 13C3-aspartate أكثر من 3 ح. واستخدمت مناطق الذروة الخام المستخرجة من قبل برنامج mzMINE لحساب المتوسطات وأشرطة الخطأ (SE) للتعليقات التوضيحية الإيجابية (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1:الرسم اللوني التمثيلي HPLC-RID الذي يظهر قمم للمنتجات التخميرية الرئيسية في تفاعل CFME المحتضن عند 37 درجة مئوية لمدة 24 ساعة. الجلوكوز، succinate، اللاكتات، formate، خلات، وذرى الإيثانول يمكن تمييزها بما فيه الكفاية من خلال أوقات الاحتفاظ بها على عمود HPLC خلال elution isocratic مع 5 M حمض الكبريتيك المذيبات. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 2:أطياف الكتلة التمثيلية لنواتج الأيض المسماة ب 13C، وتحديدا (A) اللاكتات،(B) الجلوكوز، و (C) 6-phosphogluconate (6PG) في رد فعل CFME المحتضن عند 37 درجة مئوية لمدة ساعة واحدة. الرجاء النقر هنا لتحميل هذا الملف.
الجدول التكميلي 1:قائمة بالمييضات المكتشفة التي تحمل علامةC، وأوقات الاحتفاظ (المحاذاة عبر العينات باستخدام MZmine)، والنظرية الكاملة 13قيمة وضع M/z سالبة تحمل علامة C، وقيم m/z للميزات المكتشفة، وأخطاء الكتلة المحسوبة. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
ويمكن استخدام نهج HPLC-RID المبينة لقياس استهلاك ركائز السكر بنجاح والتحويلات اللاحقة إلى الأحماض العضوية الرئيسية ومنتجات الكحول من التمثيل الغذائي المركزي lysate مع مرور الوقت. وعلاوة على ذلك، يستخدم هذا البروتوكول طريقة بسيطة متساوية التحمل باستخدام مرحلة واحدة متنقلة، ويتطلب الحد الأدنى من إعداد العينة، ويسمح بتحليل بسيط موجه في المصب. يتم تمييز التحليلات التي تقاس بطريقة HPLC-RID فقط بأوقات الاحتفاظ بها ، وبالتالي تفاعلاتها مع راتنج العمود المحدد. تم تصميم عمود HPLC المستخدمة هنا بشكل خاص لفصل الكربوهيدرات والأحماض العضوية والكحول من خلال الجمع بين حجم الاستبعاد وتبادل ليغاند (أي، الكروماتوغرافيا التقسيم الأيونية). الطريقة الموصوفة هي، لذلك، مفيدة لتحليل أكثر استهدافا من ركائز الكربوهيدرات واختيار المنتجات النهائية من مسارات تخمير الجلوكوز التي من المتوقع أن تسهل في المقام الأول وتنشيط التحولات الحيوية القائمة على اليسات8،15،21. ومع ذلك، لا يفسر هذا البروتوكول تنشيط المسارات الأيضية الأخرى في مقتطفات الخلية. يمكن استخدام خطوط الأنابيب التي تستخدم تقنيات فصل الكروماتوغرافيا الأخرى (أي كروماتوغرافيا التفاعل الهيدروفيلي) وطرق التحريج المتدرجة وإعداد العينة الأكثر تعقيدا (أي اشتقاقها) وأجهزة الكشف البصرية المختلفة (مثل الأشعة فوق البنفسجية أو كاشفات تشتت الضوء التبخري) للكشف عن الأيضات الأخرى مثل الأحماض الأمينية وفوسفات السكر23و24 . بدلا من ذلك، يمكن اتباع نهج عالمي لدراسة التمثيل الغذائي ليسات باستخدام LC-MS/MS.
طريقة LC-MS/MS الموصوفة هي سير عمل واحد لقياس وتحديد نطاق أوسع من الأيض. LC-MS/MS هي أداة تحليلية حديثة لتحديد ملامح الأيض بسبب حساسيتها وقدرتها على تمييز الأيض حسب وقت الاحتفاظ ونسب m/z مع دقة عالية16. مع التركيز على مسارات الأيض الكربون المركزية واستقلاب الأحماض الأمينية، تم تنفيذ الوضع السلبي MS / MS للكشف على وجه التحديد الأحماض العضوية القطبية، فوسفات السكر، والأحماض الأمينية. إلى جانب تقنية الكروماتوغرافيا نانو السائل، ويوفر الأسلوب حساسية عالية للكشف عن جزيئات صغيرة في خلفية lysate المعقدة17. من حيث التنميط القائم على استقلاب CFME القائم على الليسات ، ومع ذلك ، فإن الحد من بروتوكول LC-MS / MS الموصوف هو الحد الأدنى للكشف عن 50 م / ض ، مما يحول دون قياس الإيثانول ، وهو منتج رئيسي في استقلاب الجلوكوز في اللحيث ، وكذلك الفورمات ، والتي يتم قياسها بسهولة بطريقة HPLC-RID التفصيلية. بالمقارنة مع LC-MS/MS، يتمتع HPLC-RID بميزة إضافية تتمثل في إمكانية الوصول النسبي من حيث التكلفة والصعوبة. إلى النقطة الأخيرة، استكشاف الأخطاء وإصلاحها طريقة LC-MS/MS الموصوفة هنا قد تتطلب درجة معينة من الخبرة في قياس الطيف الكتلي. ومع ذلك، فإن الكشف عن مرض التصلب العصبي المتعدد له تطبيقات جذابة بشكل فريد على RID حيث يمكنه بالإضافة إلى ذلك تمييز النظائر المسماة في الأيض، وهي تقنية ممتازة لفهم حركة الكربون من الركائز التكميلية من خلال شبكة التمثيل الغذائي المعقدة lysate18. تم تطبيق مثل هذا النهج هنا عن طريق استكمال ردود الفعل مع 13C6-الجلوكوز وتحليل قيم وفرة النسبية من المصب 13C-دمج الأيض. سمح التحليل بتعريف المسارات النشطة وغير النشطة ، ودعم الافتراضات المبلغ عنها سابقا وتقديم رؤى جديدة حول التدفق الأيضي في الlysates. ويمكن أيضا إجراء تعديلات في إطار طريقة لإجراء تحليلات محددة. على سبيل المثال، يمكن تحليل الحلول القياسية ل 13 مركبا مستهدفا تحمل علامة C إلى جانب عينات لتحقيق قياسات كميةمطلقة للجزيئات المشتقة من الجلوكوز بمرور الوقت والتوصل إلى استنتاجات حول توزيعات التدفق. يمكن أيضا تمكين الكشف الأفضل عن المركبات المشحونة إيجابيا داخل سير العمل الحالي عن طريق تشغيل التسلسلات مع ملفات .meth التي تم تعديلها للكشف عن الوضع الإيجابي.
22 - وأخذ العينات التحليلية في كلتا الطريقتين الموصوفتين آلي بشكل ملائم، مما يضمن إمكانية استنساخ عالية. وعلاوة على ذلك، يمكن توقع إجراء عمليات تحليل سلسة ما دامت الممارسات السليمة لمعالجة الأجهزة وصيانتها تتم ملاحظتها. وعند استخدام هذه الأدوات لتحليل ردود فعل الCFME، ينبغي وضع اعتبارات أكثر أهمية في المنبع والمصب النهائي لأخذ العينات. أثناء إعداد العينة، من المهم أن تكون عناصر التحكم في الدورة الزمنية ممثلة للوقت صفر. هنا، تم التعجيل البروتينات في اللحوات عن طريق التحمض لوقف ردود الفعل الأيضية. بالنسبة للعينات ذات الوقت صفر، تم دمج المذيب الحمضي مع اليات قبل إضافة مزيج التفاعل الذي يحتوي على الجلوكوز. الحموضة مع حمض ثلاثي الكلور يضمن بشكل فعال أن الجلوكوز لا يتم استقلاب في الوقت صفر، كما هو مبين في بيانات HPLC-RID(الشكل 2). وفي حين تم إجراء إجراء مماثل لإرواء استقلاب الجلوكوز في تحليل LC-MS/MS المبلغ عنه، تم الكشف عن 13مستقلبات تحمل علامة C في عينات صفرية زمنية، وإن كان ذلك بقيم وفرة منخفضة بشكل ملحوظ مقارنة بالعينات المستخرجة في النقاط الزمنية اللاحقة. وعلاوة على ذلك، اقتصرت هذه الملاحظات على وسيطات تحلل الجليكوليسيس. وتشير البيانات إلى أن ردود الفعل تحتفظ بدرجة ما من النشاط الجليكوليك بعد التحمض مع مذيب الاستخراج الذي يتم اكتشافه من خلال هذه الطريقة الحساسة للغاية. غير أنه ينبغي تحديد حجم هذا النشاط كميا. وذكرت دراسة سابقة أن المذيبات استخراج الحمضية قد لا تروي بما فيه الكفاية ردود الفعل الجليكوليك المتوسطة ولكن يمكن أن تتوقف عن استهلاك الجلوكوز كبيرة10. في حين أن هذا لا يزال يتعين مواصلة التحقيق في النظام المستخدم هنا، يمكن تفسير التغيرات الجذرية في قيم الوفرة النسبية بين عينات الوقت صفر ونقطة زمنية لاحقة على أنها اتجاهات في استقلاب الجلوكوز. استكشاف طرق التبريد البديلة، ومع ذلك، ينصح في تطبيقات مماثلة، وتحديدا للحصول على كميات مطلقة من وسيطة الأيض10. وعلاوة على ذلك، ينبغي أيضا مراعاة الممارسات الجيدة أثناء تحليلات البرامجيات في نهاية المرحلة النهائية. الاتساق أمر حتمي عند دمج مناطق الذروة يدويا من إشارات RID للحد من الخطأ البشري. وينبغي أيضا تطبيق التكامل اليدوي على مناطق الذروة من المعايير كلما تستخدم مناطق الذروة المتكاملة يدويا لتحديد تركيزات المستقلب في العينات. في جميع أنحاء تحليل LC-MS/MS المستهدف، يجب التحقق من صحة التعليقات التوضيحية المؤقتة من تحليل MZmine عن طريق التحقق من الذروة اليدوي باستخدام مستعرض جودة MS، ويجب أن تكون ميزات m/z مشروحة فقط عندما تكون الأخطاء الجماعية المحسوبة مقبولة. وفي هذا الهنا، أجريت هذه التحليلات يدويا لمجموعة محدودة من الأهداف نظرا لعدم وضع برامج حاسوبية شاملة وقوية للبحث عن النظائر. ومع ذلك ، فإن مثل هذه الأساليب الآلية للبحث عن 13المستقلبات المسمى C آخذة في الظهور حاليا ومن شأنها تبسيط التحليلات الأكثر تعقيدا أيضا ، مثل تنميط التحلل خارج استقلاب الكربون المركزي25.
الكروماتوغرافيا السائلة المتقدمة هي طريقة قوية وتطبيقها على نطاق واسع لفصل جزيئات صغيرة في خليط الأيضالمعقدة 11. الأساليب الموصوفة زوجين هذه التقنية الفصل مع مؤشر الانكسار أو الكشف الطيفي الشامل لتحليل بنجاح تحويلات المستقلب في ردود الفعل CFME القائمة على التحلل. HPLC-RID و LC-MS/MS هي أدوات قوية بشكل فردي لتحديد التمثيل الغذائي النشط لليسيد، ويمكن الاستفادة من تكاملها لمعالجة القيود المتأصلة في كل تقنية. الأساليب المبلغ عنها تمكين تطبيق وتطوير CFME كما يمكن استخدامها لفهم التمثيل الغذائي lysate, رصد التحسينات في التحويلات المستقلب المستهدفة, وتوضيح التعديلات على تدفق المستقلب عند التلاعب التمثيل الغذائي lysate.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية متنافسة معروفة أو أي تضارب آخر في المصالح.
Acknowledgements
وقد تم رعاية هذا البحث من قبل برنامج العلوم الجينومية، وزارة الطاقة الأميركية، مكتب العلوم والبيولوجية والبحوث البيئية، كجزء من منطقة التركيز العلمي واجهات الميكروبات النباتية (http://pmi.ornl.gov). يتم إدارة مختبر أوك ريدج الوطني من قبل UT-Battelle، ذ.م.م، لوزارة الطاقة الأمريكية بموجب عقد DE-AC05-00OR22725. وقد تم تأليف هذه المخطوطة من قبل UT-Battelle، ذ م م بموجب العقد DE-AC05-00OR22725 مع وزارة الطاقة الأمريكية. تحتفظ حكومة الولايات المتحدة بالناشر، بقبوله نشر المقال، يقر بأن حكومة الولايات المتحدة تحتفظ بترخيص عالمي غير حصري ومدفوع الأجر وغير قابل للإلغاء لنشر أو إعادة إنتاج الشكل المنشور من هذه المخطوطة، أو السماح للآخرين بذلك، لأغراض حكومة الولايات المتحدة. وستوفر وزارة الطاقة للجمهور إمكانية الوصول إلى هذه النتائج من البحوث التي ترعاها الحكومة الاتحادية وفقا لخطة الوصول العام لوزارة الطاقة (http://energy.gov/downloads/doe-public-access-plan).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
References
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved