Method Article
Cromatografía líquida acoplada a la detección de índice de refracción o espectrometría de masas para perfiles de metabolitos en sistemas libres de células basados en lisato
En este artículo
Resumen
Los protocolos describen métodos de cromatografía líquida de alto rendimiento acoplados al índice de refracción o a la detección espectrométrica de masas para estudiar reacciones metabólicas en sistemas complejos libres de células basados en lisato.
Resumen
La ingeniería del metabolismo celular para la biosíntesis dirigida puede requerir extensos ciclos de diseño-construcción-prueba-aprendizaje (DBTL) a medida que el ingeniero trabaja en torno a los requisitos de supervivencia de la célula. Alternativamente, llevar a cabo ciclos DBTL en entornos libres de células puede acelerar este proceso y aliviar las preocupaciones con la compatibilidad del host. Un enfoque prometedor para la ingeniería metabólica libre de células (CFME) aprovecha los extractos de células crudas metabólicamente activos como plataformas para la biofabricación y para descubrir y crear rápidamente prototipos de proteínas y vías modificadas. La realización de estas capacidades y la optimización del rendimiento de CFME requieren métodos para caracterizar el metaboloma de las plataformas libres de células basadas en lisato. Es decir, las herramientas analíticas son necesarias para monitorear las mejoras en las conversiones de metabolitos dirigidos y para dilucidar las alteraciones en el flujo de metabolitos al manipular el metabolismo del lisato. Aquí, se aplicaron análisis de metabolitos utilizando cromatografía líquida de alto rendimiento (HPLC) junto con detección óptica o espectrométrica de masas para caracterizar la producción y el flujo de metabolitos en los lisatos de E. coli S30. Específicamente, este informe describe la preparación de muestras de lisatos cfme para análisis de HPLC utilizando detección de índice de refracción (RID) para cuantificar la generación de intermedios metabólicos centrales y subproductos en la conversión de sustratos de bajo costo (es decir, glucosa) a varios productos de alto valor. También se presenta el análisis de la conversión de metabolitos en reacciones CFME alimentadas con 13glucosas marcadas en C a través de cromatografía líquida de fase inversa acoplada a espectrometría de masas en tándem (MS / MS), una poderosa herramienta para caracterizar rendimientos específicos de metabolitos y flujo metabólico de lisato a partir de materiales de partida. En conjunto, la aplicación de estos métodos analíticos al metabolismo del lisato CFME permite el avance de estos sistemas como plataformas alternativas para ejecutar tareas de ingeniería metabólica más rápidas o novedosas.
Introducción
Las limitaciones en la ingeniería de microbios para la producción química pueden abordarse recapitulando reacciones bioquímicas in vitro donde las funciones de supervivencia celular competidoras están ausentes1. Además, el entorno de reacción abierto (es decir, la ausencia de una membrana celular) es más susceptible de manipulación y es más fácil de monitorear en comparación con las células vivas. Este concepto fundamental de ingeniería metabólica libre de células (CFME) ha sido elegantemente demostrado por la reconstitución de vías metabólicas para sintetizar productos químicos valiosos como el hidrógeno y los monoterpenos con métricas de producción que son órdenes de magnitud más altas que las presentadas en las fábricas de células microbianas hasta ahora1,2,3 . Los métodos para purificar vías enteras, sin embargo, están actualmente limitados por el tiempo y el costo. Alternativamente, los sistemas metabólicos libres de células pueden derivarse de extractos de células crudas a través de métodos rápidos y económicos en relación con la reconstitución de toda la vía4. El metabolismo central que se retiene en los extractos celulares se puede complementar con sustratos energéticos (por ejemplo, glucosa y cofactores enzimáticos) y sales en soluciones tamponadas para generar precursores metabólicos centrales durante más de 24 h5,6. La adición de enzimas exógenas a la reacción CFME basada en lisato permite bio-transformaciones más complejas de glucosa en sustancias químicas más valiosas a títulos altos4,6,7. Aunque el rendimiento tiende a verse comprometido en estos sistemas debido a su complejidad metabólica similar a la de las células, se han desarrollado y se están desarrollando métodos únicos para curar proteomas de lisato para una mayor conversión de rendimiento7,8.
La facilidad de llevar a cabo transformaciones metabólicas en sistemas libres de células basados en lisato hace que estas plataformas sean excelentes para mover la fabricación de productos químicos fuera de la célula por completo o para crear prototipos de nuevas vías con alto rendimiento antes de construir y probar estos diseños in vivo2,9. Para cualquiera de las aplicaciones, las herramientas para monitorear las conversiones metabólicas u observar alteraciones generales del flujo metabólico en los lisados son parte integral del avance de CFME. La cromatografía líquida de alto rendimiento (HPLC) se puede utilizar para separar los componentes químicos de las reacciones CFME con alta resolución y se puede acoplar a detectores ópticos o espectrométricos de masas para la cuantificación de metabolitos5,10. El principio subyacente de la HPLC es que los analitos disueltos en un disolvente (es decir, la fase móvil) y bombeados a través de una columna interactuarán con el material específico de embalaje de la columna (es decir, la fase estacionaria)11. Dependiendo de sus propiedades químicas, estos analitos exhiben tiempos de retención variables antes de que finalmente sean eluidos de la fase estacionaria y llevados por la fase móvil a un detector. Este informe detalla la preparación y el análisis de las reacciones CFME basadas en lisato de E. coli a través de métodos basados en HPLC que aprovechan la detección de RID y MS / MS.
HpLC acoplado a la detección de índice de refracción (HPLC-RID) es un método generalmente accesible para identificar rápidamente precursores metabólicos centrales y productos finales. Brevemente, RID mide cómo los analitos cambian la deflexión de la luz por la fase móvil12. Las señales RID correspondientes a analitos objetivo en muestras se pueden cuantificar mediante comparaciones con señales RID de soluciones estándar. En aplicaciones CFME, este modo de detección se ha utilizado más comúnmente con columnas de HPLC que separan compuestos en función de una combinación de mecanismos de exclusión de tamaño e intercambio de ligandos, o cromatografía de partición moderada poriones 5,6,8,13. Esta técnica en particular se utiliza para cuantificar rápidamente el consumo de sustratos de azúcar como la glucosa, así como la formación de productos de fermentación como succinato, lactato, formiato, acetato y etanol en reacciones CFME a base de lisato8. El registro de los cambios de concentración de estos compuestos a través de HPLC ha sido útil tanto para dilucidar el potencial de los extractos de células crudas para agrupar precursores metabólicos centrales como para comprender cómo se redirige el flujo de vías a través de vías fermentativas durante las conversiones metabólicas complejas de glucosa en lisados6,8,14. Los estudios seminales de CFME en extractos de células de E. coli confirman que los compuestos de fermentación se acumulan como productos finales del catabolismo de la glucosa y también ocurren como subproductos no deseados en lisados que sobreexpresan enzimas exógenas6,15. Se sugiere que el metabolismo fermentativo desempeña un papel necesario en la regeneración de equivalentes redox de cofactores (es decir, NAD(P)H y ATP) para mantener las reacciones glucolíticas8. Por lo tanto, un método de detección óptica basado en HPLC diseñado para separar los productos de fermentación es una herramienta útil y comúnmente aplicada cuando se ejecutan varias tareas cfME basadas en lisato.
CFME se puede implementar para acumular productos finales metabólicos que no son carbohidratos, ácidos orgánicos o alcoholes4. La medición de los intermedios que se consumen tan rápido como se sintetizan también puede ser deseable10. Si bien HPLC-RID es accesible en términos de costo y dificultad, este método está limitado por su capacidad de distinguir solo metabolitos en función del tiempo de retención. Se puede analizar una gama más amplia de metabolitos cuando la cromatografía líquida se acopla a la detección de EM/EM (LC-MS/MS)16. Por este método, los analitos en la fase móvil se ionizan y se detectan diferencialmente en función de las propiedades de masa y carga de cada molécula. El conocimiento tanto de la relación masa-carga (m/z) del metabolito como del tiempo de retención en la columna facilita así la separación de la mayoría de los intermedios metabólicos y los productos finales con alta resolución16. Esta técnica de detección también se puede acoplar a la cromatografía nanolíquida, que ofrece caudales y volúmenes de inyección de muestras mucho más bajos, lo que permite una detección más sensible de moléculas pequeñas en el complejo fondo de lisado17. LC-MS/MS también se puede aplicar con el etiquetado de isótopos, ya que las etiquetas incorporadas imparten cambios en los valores m/z de los analitos18. Las mediciones de punto de tiempo extraídas de una reacción CFME suplementada con un sustrato de 13C6-glucosa pueden determinar así los productos finales o subproductos derivados específicamente de la glucosa suplementada. Aunque este método de rastreo de isótopos aún no se aplica comúnmente en los estudios de CFME, es una herramienta poderosa para comprender las conversiones metabólicas en sistemas CFME basados en lisato, específicamente porque los contraiones de sal (es decir, acetato y glutamato) en estas reacciones también se catabolizan como sustratos secundarios19. Aprovechar esta técnica puede dibujar una imagen completa del metabolismo de la glucosa en lisados, que hasta el día de hoy no se entiende completamente. Aquí, el protocolo detalla un método para la cromatografía nano-líquida acoplada a la ionización nanoelectrospray (nano ESI) MS /MS que se puede utilizar para interrogar un posible modelo de metabolismo de la glucosa, específicamente en lisatos de E. coli (Figura 1). El modelo se basa en informes de vías fermentativas y la vía de la pentosa fosfato activa en lisatos de E. coli derivados de cepas cultivadas en medios enriquecidos5,6,8,14. La técnica se utiliza adicionalmente para investigar la producción de aminoácidos, ya que el conocimiento actual sobre el anabolismo de aminoácidos a partir de glucosa en lisados se limita a algunos ejemplos como la síntesis de aminoácidos aromáticos7. Dada la naturaleza principalmente polar de los productos finales e intermedios en estas vías (es decir, ácidos orgánicos, fosfatos de azúcar y aminoácidos), aquí se utilizó la cromatografía líquida en fase inversa. Esta técnica separa los compuestos polares por elución de una fase estacionaria no polar. Estos compuestos fueron ionizados por nano ESI en modo de iones negativos que permite la detección de analitos con al menos una carga elemental negativa y, por lo tanto, es útil para detectar compuestos ácidos. Esta técnica se emplea aquí para analizar los metabolitos derivados de la glucosa 13C-incorporando y demuestra la utilidad de LC-MS / MS para comprender el metabolismo de la glucosa en lisados.
Protocolo
1. Iniciar, detener y procesar el curso de tiempo de las reacciones CFME para la cuantificación de HPLC-RID.
- Descongelar los lisatos de E. coli previamente preparados y preparar el resto de los componentes de reacción sobre hielo.
NOTA: Los lisatos reportados aquí se derivaron de E. coli BL21DE3-Star cultivada en medios 2xYPTG (1,8 % de glucosa) hasta la fase logarítrica media.- Preparar un volumen apropiado de tampón S30 esterilizado por filtro (filtro de poro de 0,20 μm) (1 M Tris-OAc ajustado a pH 8.2 con ácido acético glacial, 1,4 M Mg(OAc)2y 6 M KOAc).
- Prepare una combinación energética que contenga glucosa, sales de glutamato, ATP, coenzima A, NAD +, tampón Bis-Tris y fosfato diotásico en el tampón S30. Las concentraciones finales en el volumen de reacción deseado utilizado para preparar las reacciones cfME aquí fueron 100 mM de glucosa, 18 mM de glutamato de magnesio, 15 mM de glutamato de amonio, 195 mM de glutamato de potasio, 1 mM de ATP, 0,2 mM de coenzima A, 1 mM de NAD+, 150 mM de Bis-Tris y 10 mM de fosfato de dipotasio.
- Combine los componentes en tubos de microcentrífuga de 1,5 ml para preparar reacciones finales con 4,5 mg/ml de proteína de lisato total. Aquí, las reacciones CFME se prepararon con volúmenes finales de 50 μL por triplicado por punto de tiempo. Incubar las reacciones a 37 °C durante sus respectivos períodos de tiempo.
NOTA: Trabaje rápido y agregue lisato como el componente final de la mezcla de reacción para prevenir reacciones metabólicas prematuras con sales de glucosa y glutamato. El consumo mínimo de glucosa puede ocurrir dependiendo de cuánto tiempo se incuban las mezclas de reacción en hielo. - Terminar las reacciones y procesar las muestras para el análisis HPLC-RID.
- Para terminar las reacciones triplicadas en sus puntos de tiempo apropiados, agregue inmediatamente un volumen igual de ácido tricloroacético al 5% al volumen de reacción final de cada muestra (es decir, 50 μL de ácido tricloroacético al 5% a una reacción de 50 μL). Diluir cada muestra con agua estéril a 2 veces el volumen de reacción (es decir, 100 μL).
- Para recapitular el tiempo cero, mezcle el mismo volumen de ácido tricloroacético al 5% que el volumen total de reacción final (es decir, 50 μL) con el lisato antes de agregar el resto de los componentes de la reacción. Este paso de acidificación precipita las enzimas de lisato antes de que metabolizen significativamente la glucosa.
- Vórtice las muestras y centrífuga en una microcentrífuga de sobremesa a 11.600 x g durante 5 min y transfiera los sobrenadantes que contienen los analitos orgánicos a los tubos limpios. Almacene las muestras a -20 °C si los análisis de HPLC se van a realizar en un día diferente. Asegúrese de descongelar las muestras almacenadas en hielo antes de continuar con el siguiente paso.
- Filtre cada sobrenadante con un filtro de poro de 0,22 μm. Como alternativa a las jeringas, use filtros de tubo de centrífuga y centrifuge los sobrenadantes a 16,300 x g durante 1 min.
- Transfiera cada filtrado a un vial de vidrio HPLC limpio. Cargue los viales en la bandeja del muestreador automático de HPLC.
- Preparar muestras para la generación de curvas estándar.
- Prepare una solución madre de todos los analitos objetivo disueltos en tampón S30 en cantidades equimolares por encima de la concentración inicial de glucosa en las reacciones CFME. Aquí, se preparó una solución de stock que consiste en 150 μM de glucosa, succinato, lactato, formiato, acetato y etanol. Realizar diluciones seriadas 1:1 (v/v) de la solución stock para obtener soluciones triplicadas de 50 μL con concentraciones finales que van desde 0 μM hasta la concentración de stock (es decir, 150 μM).
- Diluir cada solución con 50 μL de ácido tricloroacético al 5% y 100 μL de agua estéril. Repita los pasos 1.3.4-1.3.5.
NOTA: Ejecute soluciones para la generación de curvas estándar con cada lote de muestras para garantizar una cuantificación precisa de las concentraciones de metabolitos.
2. Preparación del sistema HPLC para la detección de metabolitos.
- Bajo una campana extractora, prepare una solución esterilizada de ácido sulfúrico de 5 mM a partir de agua desionizada y esterilizada por filtro. Agregue ~ 550 μL de una solución de ácido sulfúrico de grado HPLC al 98% a 2 L de agua para preparar ácido sulfúrico de 5 mM.
PRECAUCIÓN: El ácido sulfúrico es un químico peligroso, y trabajar bajo una campana de humos con el EPP de laboratorio adecuado evita la inhalación, el contacto con la piel y el contacto visual. El ácido sulfúrico concentrado reacciona vigorosamente con el agua y debe agregarse directamente al agua, no al revés. Almacene en un área fresca y seca, lejos de la luz solar directa y siga las medidas adecuadas de eliminación de desechos establecidas por el laboratorio. - Mantenga la botella de 2 L de ácido sulfúrico de 5 mM incubada en un baño de agua junto al instrumento HPLC. Fije el baño de agua a 35 °C. Coloque el tubo con un filtro de disolvente en la botella de disolvente y conecte el otro extremo a un módulo desgasificador en línea con el módulo de la bomba.
NOTA: Purgar el sistema con un disolvente recién preparado antes de instalar la columna es una buena práctica de manejo del instrumento. - Equipe el instrumento HPLC con la columna HPLC en línea con el módulo RID. Coloque la columna en el baño de agua a 35 °C si no hay un termostato de columna disponible.
- Preparar el módulo RID para su análisis a 35 °C en el software del Sistema de Datos de Cromatografía (CDS) instalado en el ordenador del sistema.
- En el menú Ver, seleccione método y ejecute vista control. Haga clic con el botón derecho en el método de > del módulo de bomba. Establezca el caudal en 0,55 mL·min-1 y seleccione el botón Encendido para iniciar la bomba.
NOTA: Si la columna estaba almacenada antes de ser equipada en el HPLC, aumente el caudal a 0,55 mL·min-1 después de equilibrar la columna siguiendo las instrucciones del fabricante. - Haga clic con el botón derecho en el panel correspondiente al módulo RID > Método. Ajuste la temperatura del módulo detector RI a 35 °C y seleccione Encendido para iniciar el calentamiento del módulo detector RI.
- Haga clic con el botón derecho en el panel Módulo RID > Control. Seleccione Encendido para la celda de referencia de purga durante al menos 15 minutos cuando se utiliza un disolvente fresco o 1 h si diferentes disolventes fluyeron a través del detector RI antes de esta configuración. Haga clic en el botón Activar.
NOTA: Mantenga la bomba y el detector ri encendidos para lograr una línea de base estable en la parcela en línea. Esto se ve afectado por las fluctuaciones de temperatura en el laboratorio y puede tardar hasta 4 h o más. Mantenga el sistema encendido durante la noche antes de la carga de la muestra.
- En el menú Ver, seleccione método y ejecute vista control. Haga clic con el botón derecho en el método de > del módulo de bomba. Establezca el caudal en 0,55 mL·min-1 y seleccione el botón Encendido para iniciar la bomba.
3. Creación de un método para la separación isocrática de HPLC de productos de fermentación orgánica en el CDS.
- En la barra de menús, seleccione Método > Nuevo método. Seleccione Método > Guardar método como [MethodName].M. Seleccione Método > Editar todo el método > Instrumento/Adquisición
- Dentro de la pestaña Bomba binaria, establezca el flujo en 0.55 mL·min-1. En Disolventes, seleccione la letra correspondiente a la entrada de disolvente en el módulo de la bomba y configúrala al 100% para la elución isocrática. Establezca los límites de presión en 0 y 400 bar e ingrese 30 min como el tiempo de parada.
- Dentro de la pestaña Muestreador, establezca el volumen de inyección en 50 μL. Seleccione la opción Como bomba/Sin límite en Tiempo de parada. Establezca la configuración auxiliar avanzada para velocidad de dibujo, velocidad de expulsióny posición de dibujo en 200 μL·min-1, 200 μL·min-1y -0,5 mm.
- Dentro de la pestaña RID, establezca la temperatura de la unidad óptica en 35 °C. En Señal, seleccione Adquirir para señal y >0,2 min para Ancho de pico. Seleccione la opción Como bomba/inyector para Tiempo de parada.
- En Avanzado dentro de la pestaña RID, establezca Salida analógica en 5% de desplazamiento cero y 500.000 nRIU para atenuación. Seleccione la opción Positivo para Polaridad de señal y la opción Encendido para Cero automático antes del análisis.
- Guarde el método seleccionando Método > Guardar método. Cargue el método seleccionando Método > Cargar método > [MethodName]. M.
4. Creación de una tabla de secuencia para el automuestreo e inicio del sistema HPLC-RID para la adquisición de datos.
- En la barra de menús, seleccione Secuencia > Nueva plantilla de secuencia. Seleccione Secuencia > Guardar plantilla de secuencia como [SequenceTemplateName]. S.
- Seleccione Secuencia > Tabla de secuencias. Adquiera 'n' filas correspondientes a 'n' viales, luego ingrese las posiciones de los viales y los nombres de las muestras en Vial y Nombre de muestra,respectivamente, de acuerdo con su disposición en la bandeja de automuestreador. Seleccione el método generado en el paso 3 en el menú desplegable Nombre del método e introduzca 50 μL como Inj/Vial (inyección por vial) para cada fila.
- Haga clic en Aplicar y guarde la plantilla de secuencia seleccionando Plantilla de secuencia > Guardar plantilla de secuencia. Asegúrese de que la plantilla de secuencia está cargada seleccionando Secuencia > Cargar plantilla de secuencia > [SequenceTemplateName]. S.
- Después de lograr una línea de base estable en la gráfica en línea, haga clic con el botón derecho en el panel Módulo RID > control > válvula de reciclaje desactivada para dirigir el flujo de disolvente a través del detector RID a los residuos. Para iniciar la adquisición de datos, seleccione Secuencia en la barra de menús, Secuencia > Ejecutar.
5. Extracción y análisis de datos post-run.
- Seleccione Vista de análisis de datos en el menú Ver. Busque el nombre de archivo de secuencia en la Lista de archivos en el lado izquierdo de la pantalla. En el panel central de la pantalla, vaya a selección de vista de señal > señal RID para ver los cromatogramas de muestra.
- Seleccione una fila correspondiente a una muestra estándar de alta concentración en el panel superior de la pantalla. Tome nota de los tiempos de retención para los picos de analitos objetivo en el cromatograma mostrado. Los picos correspondientes a los analitos objetivo se organizarán a lo largo del eje de tiempo de retención como glucosa, succinato, lactato, formiato, acetato y etanol(Figura suplementaria 1).
NOTA: El primer gran pico en el cromatograma corresponde al ácido tricloroacético. Sus unidades RI deben ser consistentes en todas las muestras de curvas estándar. Valide el tiempo de retención de cada analito objetivo ejecutando cada compuesto como una muestra separada. - Extraiga las áreas pico para cada analito objetivo de los cromatogramas de los estándares y las muestras de reacción.
- Discerna si los picos de interés están bien integrados por el software. Dibuje la línea roja como base de cada pico para obtener un área integrada con precisión debajo de la curva. Si la integración automática falla (es decir, la línea roja está torcida), seleccione el botón Integración manual del Conjunto de herramientas de integración y dibuje manualmente una base de pico para integrar el área de pico.
NOTA: Si se debe realizar la integración manual para un analito objetivo en una muestra, mantenga la coherencia e integre manualmente el mismo analito en todas las muestras. - Seleccione la herramienta Cursor del Conjunto de herramientas común para hacer clic en los picos correctamente integrados. El área de pico y el tiempo de retención correspondiente del pico seleccionado se resaltarán como una fila de tabla en el panel inferior de la pantalla.
- Para exportar áreas pico, seleccione Archivo > Exportar resultados de integración >.
- Discerna si los picos de interés están bien integrados por el software. Dibuje la línea roja como base de cada pico para obtener un área integrada con precisión debajo de la curva. Si la integración automática falla (es decir, la línea roja está torcida), seleccione el botón Integración manual del Conjunto de herramientas de integración y dibuje manualmente una base de pico para integrar el área de pico.
- Cuantificar las concentraciones de analitos objetivo utilizando curvas estándar.
- Trazar los valores del área pico frente a las concentraciones conocidas de muestras en una hoja de cálculo. Haga clic con el botón derecho en los datos trazados, Agregar línea de tendencia > Formato de línea de tendencia > Mostrar ecuación en el gráfico.
- En una hoja de cálculo separada, use las ecuaciones de las líneas de tendencia de curva estándar para convertir los valores de área pico en concentraciones para cada analito de cada muestra. Calcule las áreas pico promedio y los valores de error estándar entre triplicados para la visualización de datos.
6. Inicio, detención y procesamiento del seguimiento de isótopos del curso del tiempo de las reacciones CFME para la cuantificación LC-MS / MS.
- Configure reacciones triplicadas por punto de tiempo (excepto el tiempo cero) en hielo como se describe en 1.1-1.2. Sin embargo, en lugar de glucosa, utilice una concentración final de 100 mM 13C6-glucosa en las reacciones. Incubar las reacciones a 37 °C durante 1 h, 2 h y 3 h.
- Para terminar, congele las reacciones en nitrógeno líquido y guárdelas a -80 °C. Omita este paso de almacenamiento para el análisis el mismo día.
NOTA: El ácido tricloroacético no se utilizó para detener las reacciones debidas a la interferencia del ácido al detectar algunos metabolitos centrales de carbono a través de LC-MS / MS. En su lugar, se utilizó disolvente de extracción que contenía ácido fórmico (paso 6.3) para precipitar proteínas metabólicas, ya que la masa del ácido fórmico está por debajo del límite de detección del método de EM / EM informado. - Preparar 50 ml del disolvente de extracción. Combine y vórtice 20 ml de acetonitrilo, 20 ml de metanol y 10 ml de agua (todos de grado LC-MS) en un tubo centrífugo de 50 ml junto con 0,199 ml de ácido fórmico para hacer una solución de 0,1 M. Enfríe el disolvente a 4 °C durante la extracción y guárdelo a -20 °C cuando no esté en uso.
- Procesamiento de muestras para análisis LC-MS/MS
- El día del análisis, pipetear un volumen equivalente del disolvente de extracción (es decir, 50 μL) a cada muestra. Si las muestras se congelaron, agregue el disolvente de extracción antes de que las muestras se descongelen por completo para evitar la reactivación del metabolismo de la glucosa. Realice todos los pasos de procesamiento de muestras en hielo.
- Para recapitular el tiempo cero, pipetear el volumen final del disolvente de extracción (es decir, 50 μL) a un volumen apropiado de lisato para la concentración final deseada en la reacción (es decir, de 4,5 mg/ml en volumen de reacción de 50 μL). Agregue el resto de los componentes de reacción como en el paso 1.2. Este paso de acidificación precipita las enzimas de lisato antes de que metabolizen significativamente la glucosa.
- Incubar las muestras en disolvente de extracción sobre hielo durante 30 min con agitación suave, luego centrifugar las muestras a 21.000 x g durante 15 min a 4 °C para separar el sobrenadante de la proteína precipitada. Transfiera 50 μL del sobrenadante a viales de automuestreador y cargue los viales en la bandeja dentro del muestreador automático de 4 °C. Almacene el resto del sobrenadante a -20 °C para futuros análisis.
7. Configuración del sistema LC para el análisis LC-MS/MS.
- Preparar 1 L de Disolvente A disolviendo completamente 77.08 mg de acetato de amonio en 950 mL de agua y 50 mL de isopropanol. Prepare 1 L de disolvente B con 650 ml de acetonitrilo, 300 ml de agua y 50 ml de isopropanol junto con 77,08 mg de acetato de amonio. Asegúrese de que todos los disolventes sean de grado LC-MS.
- Conecte las botellas de disolvente que contienen los disolventes A y B al módulo de la bomba. Purgue el sistema a un caudal alto para eliminar/limitar cualquier contaminación del aire que pueda haber ocurrido durante el equipo de los disolventes al sistema LC.
- Equipe el sistema con una columna de fase invertida C18 (longitud de columna de 30 cm, diámetro interior de 75 μm y diámetro de partícula de 5 μm). Acondicione la columna al sistema LC-MS haciendo fluir el 100% del disolvente B y el flujo lento hacia el disolvente A hasta el 100%.
NOTA: Las puntas de las columnas se prepararon internamente utilizando un extractor de micropipetas y se empacaron con celdas de presión y helio.
8. Creación de un método en el software de adquisición e interpretación de datos LC-MS /MS para el sistema LC vinculado a los espectrómetros de masas de transformada de Fourier y trampa de iones.
- Abra el software Tune Plus para editar un archivo tune para el método MS.
- En el Archivo de la barra de menús, abra un archivo de ajuste de modo negativo preinstalado.
- Seleccione ScanMode en la barra de menús y, a continuación, seleccione Definir ventana de análisis. Establezca la configuración de tiempo de microescaneo para MSn en 1 tanto para Ion Trap como para FT.
- Vaya a la configuración de Nano-ESI Source y establezca el voltaje de pulverización en 4 kV. Modula esto hasta que se genere un electrospray aceptable; por lo general, se puede lograr un electrospray aceptable dentro del rango de 2-5 kV.
- Guarde el archivo de sintonía.
- Genere un nuevo método LC utilizando el Asistente de configuración del software de adquisición e interpretación de datos del instrumento. Abra roadmap > Sequence Setup > Wizard. Dado que estos métodos no requieren el uso de un calentador de columna, omita el paso Control de temperatura.
- En Opciones de bomba de gradiente de flujo, seleccione Multipaso. En la siguiente ventana, inserte 7 líneas y establezca el caudal de cada fila en 0,1 mL·min-1. Introduzca los siguientes parámetros para cada fila: de 0 a 3 min, entregue el 100% de disolvente A; de 3 a 9 min, introducir un gradiente de 100% disolvente A a 20% disolvente B; a partir de 9-19 min, introducir un nuevo gradiente de 20% de disolvente B a 100% de disolvente B; de 19-27 min, mantener al 100% disolvente B; de 27-28 min, ajuste el gradiente de nuevo al 100% disolvente A; de 28-44 min, enjuague y reacondicione la columna para las tiradas posteriores manteniendo al 100% disolvente A. Incluya un paso final para reducir el caudal a 0,03 mL·min-1 al finalizar la tirada para conservar el disolvente cuando el LC no esté en uso.
- Aplique la configuración predeterminada para las opciones del muestreador > presión de la bomba como la opción de adquisición y use el tiempo de adquisición predeterminado y use las opciones de presión de la bomba predeterminada.
- Cree un método MS/MS seleccionando el icono Orbitrap Velos Pro MS en la barra lateral de la ventana Configuración del instrumento.
- Haga clic en Nuevo método > MS/MS dependiente de datos. Establezca Tiempo de adquisición en la duración de la ejecución lc (es decir, 44 min), Segmento en 1 y Eventos de escaneo en 11. En Tune File, seleccione el archivo editado en el paso 8.1.
NOTA: El primer evento es un análisis precursor de MS1 que utiliza la transformada de Fourier MS (FTMS). Los 10 eventos siguientes serán escaneos MS2 que seleccionarán los 10 iones más intensos y únicos en cada escaneo precursor para la fragmentación de MS2. - Para el evento 1, en Descripción del análisis, establezca Analizador en FTMS y Polaridad en Negativo. En Configuración de MSn, utilice una resolución de 30.000 y una energía de colisión normalizada de 35 V. Establezca los rangos de escaneo en 50 m/z para la primera masa y 1800 m/z para la última masa para capturar moléculas pequeñas.
- Para los eventos 2 a 11, en Descripción del análisis, establezca Analizador en Trampa de iones. Seleccione Análisis dependiente y haga clic en Configuración > exclusión dinámica global > y seleccione Habilitar; establezca una duración de repetición de 30 s y una duración de exclusión de 120 s para eliminar los escaneos repetidos en proximidad.
- Vaya a Configuración de eventos de análisis y establezca Masa determinada desde Evento de análisis en 1 para todos los eventos de MS2 (del 2 al 11). Para buscar los 10 iones más intensos, configure cada evento de escaneo MS2 para detectar unnº Ion más intenso de1º a 10º. Por lo tanto, configure el evento 2 para detectar 1 como elnº ion más intenso, el evento 3 para detectar 2, y así sucesivamente.
- Cierre la ventana de configuración y vaya a Archivo > Guardar como [Method_Name].meth.
NOTA: Para uso general, mantenimiento y calibración del instrumento LC y el espectrómetro de masas, consulte las instrucciones de funcionamiento y los manuales suministrados por el fabricante.
- Haga clic en Nuevo método > MS/MS dependiente de datos. Establezca Tiempo de adquisición en la duración de la ejecución lc (es decir, 44 min), Segmento en 1 y Eventos de escaneo en 11. En Tune File, seleccione el archivo editado en el paso 8.1.
9. Configuración de una secuencia de ejecución e inicio de la ejecución LC-MS/MS.
- Configure una secuencia de ejecución utilizando el software de adquisición e interpretación de datos del sistema LC-MS/MS. Dentro de Roadmap > Sequence Setup, haga clic con el botón derecho en la tabla para insertar tantas filas como muestras. Para cada fila, establezca el Inj Vol en 5 μL y la Posición en la posición respectiva del vial en la bandeja de muestreador automático. Introduzca nombres de archivo como nombres de ejemplo y establezca la ruta de archivo deseada para los resultados de ejecución.
NOTA: Los viales en blanco que contienen disolvente A se pueden ejecutar al comienzo de la secuencia y entre cada conjunto de muestras triplicadas (cada conjunto de puntos de tiempo) para enjuagar la columna. - Para iniciar la ejecución, resalte todos los nombres de archivo de la secuencia. En la barra de menús, seleccione Acciones > Ejecutar secuencia > Aceptar.
10. Consolidación de archivos y búsqueda de anotaciones tentativas en MZmine 2.53.
- Abra MZmine e importe los archivos de salida '.raw' del paso 9.1. En la barra de menús, seleccione Métodos de datos sin procesar > Importación de datos sin procesar. Seleccione los archivos correspondientes a las muestras.
- Construya una lista de picos que distingan entre los escaneos MS1 y MS2. En la barra de menús, Métodos de datos sin procesar > Detección de características > MS/MS Peaklist Builder. La configuración relevante incluye m/z Window establecido en 0.01 y Time Window establecido en la duración de la ejecución. En Establecer filtros, seleccione Negativo como Polaridad y Centroide como Tipo de espectro.
- En la barra de menús, vaya a Métodos de lista de características > Detección de características > Peak Extender. Establezca la tolerancia m/z en 0,005 m/z o 10 ppm y la altura mínima en 1E3. Este paso creará picos completamente desarrollados.
- Eliminar picos duplicados. Vuelva a Métodos de lista de características > Filtrado > filtro de pico duplicado. Los ajustes relevantes incluyen la tolerancia m/z establecida en 0,005 m/z o 10 ppm y la tolerancia RT establecida en 5 min.
- Para alinear picos dentro de archivos de datos similares (es decir, los de reacciones triplicadas), vuelva a Métodos de lista de características > Normalización > calibración del tiempo de retención. Asegúrese de procesar muestras triplicadas juntas y deje los espacios en blanco. Los ajustes relevantes incluyen tolerancia m/z establecida en 0,005 m/z o 10 ppm, tolerancia RT establecida en 3 min absoluto (min) e intensidad estándar mínima establecida en 1E3.
- Alinear picos de todos los archivos por m/z y tiempo de retención de Métodos de lista de características > Alineación > Alineador RANSAC. Establezca la tolerancia m/z en 0,005 m/z o 10 ppm, la tolerancia RT y la tolerancia RT después de la corrección en 44 y 39 min, respectivamente, las iteraciones RANSAC en 0, el número mínimo de puntos en 10% y el valor umbral en 1. Marque la opción Requerir el mismo estado de carga.
- Corrija los puntos de datos que puedan haberse perdido en pasos anteriores en Métodos de lista de características > Relleno de huecos > Buscador de picos. Los ajustes relevantes incluyen tolerancia de intensidad establecida en 50%, tolerancia m/z establecida en 0,005 m/z o 10 ppm, y tolerancia RT establecida en 3 min. Habilite la corrección RT.
11. Cálculo de masas en modo negativo de 13metabolitos derivados de la glucosa etiquetados con C y búsqueda de las características m/z de estos analitos en datos filtrados.
- Calcule las masas de 13metabolitos etiquetados con C a partir del metabolismo de la glucosa para la búsqueda dirigida.
- Calcular la masa monoisotópica de cada compuesto objetivo a partir del número de átomos en la fórmula molecular del compuesto y las masas monoisotópicas de cada elemento20.
- Calcule la masa en modo negativo del compuesto [M-H]- restando la masa de 1 protón (1.007276 Da) de la masa monoisotópica. Esta es la masa detectada por la detección de MS en modo negativo después de que las moléculas son despojadas de un ion hidrógeno durante la ionización.
- A partir de la masa en modo negativo, calcule la masa del metabolito que incorpora 13C. Aquí, se calcularon las masas de isotopólogos que incorporan al máximo 13etiquetas C derivadas de la glucosa.
- Utilice masas calculadas de 13metabolitos etiquetados con C para buscar y anotar características m/z a partir de los resultados de MZmine. Para cada posible golpe, calcule el error de masa (ppm) utilizando la siguiente ecuación:
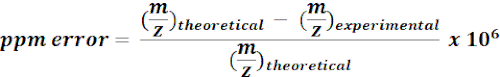
NOTA: Los valores experimentales de m/z con <15 ppm de error de masa se consideraron como anotaciones putativas en el análisis actual. - Compruebe manualmente los espectros de las anotaciones putativas en un navegador de calidad para confirmar las anotaciones.
- Abra Roadmap > Qual Browser. En la barra de herramientas, abra Archivo sin procesar para importar datos MS sin procesar de cada muestra.
- Dibuje una línea por debajo del rango deseado de tiempos de retención (es decir, correspondiente a la anotación putativa) en el cromatograma iónico total (panel superior) para ver un espectro de masas (panel inferior). Haga clic con el botón derecho en el espectro e introduzca un rango de masas que abarquen las m/z del analito objetivo. Compruebe si las anotaciones putativas tienen señales de pico distintas que están apreciablemente por encima del ruido (Figura suplementaria 2).
- Calcule las áreas de pico promedio y los errores estándar de anotaciones positivas en todas las réplicas biológicas para cada punto de tiempo. Visualice los datos (es decir, en un gráfico de barras) para observar las tendencias en el metabolismo de la glucosa.
Resultados
Para cuantificar la síntesis libre de células a base de lisato de productos de fermentación comunes a partir de glucosa, los lisatos derivados de cepas cultivadas en medios 2xYPTG fueron alimentados con 100 μM de glucosa como fuente primaria de carbono8. Las reacciones se detuvieron durante un curso de tiempo de 24 horas por acidificación de proteínas. Los sobrenadantes filtrados que contienen piruvato, succinato, lactato, formiato, acetato y etanol producidos a partir del catabolismo de glucosa se cargaron en el módulo de automuestreo de un sistema HPLC equipado con un módulo RID. Los viales con mezclas filtradas de productos finales fermentativos y glucosa a 1,17 μM, 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM y 150 μM en el tampón S30 se cargaron en el instrumento como estándares. Los analitos fueron eluidos isocráticamente desde una columna de HPLC hasta el RID. Los picos de glucosa, succinato, lactato, formiato, acetato y etanol dentro del rango de 1 a 150 μM podrían resolverse mediante RID. Las áreas pico de glucosa se derivaron mediante la integración manual de los datos rid para muestras de curso de tiempo y curva estándar. Las áreas pico extraídas para succinato, lactato, formiato, acetato y etanol se tomaron de señales integradas automáticamente. Todas las curvas estándar (área pico vs. concentración conocida) tenían valores de R2 >0,99 y eran lineales en todo el rango de concentraciones utilizadas aquí.
Las concentraciones molares para todos los analitos objetivo se calcularon a partir de sus respectivas curvas estándar. La glucosa se consumió dentro de las primeras 3 h de la reacción y se fermentó principalmente a lactato(Figura 2A,B). La acumulación de etanol también ocurrió significativamente dentro de las primeras 3 h de la reacción y se detuvo a partir de entonces(Figura 2C). La observación de una producción significativa de lactato y etanol con un consumo significativo de glucosa después de 3 h no fue sin precedentes, ya que las vías de producción de lactato y etanol permiten la regeneración de 1 mol neto de NAD+ a partir de NADH glicolítico requerido para el consumo continuo de glucosa a través de la glucólisis (Figura 1). Por lo tanto, el lactato y el etanol pueden considerarse como los principales productos finales de fermentación en el metabolismo de la glucosa libre de células a base de lisato. El acetato estuvo presente inicialmente en las reacciones como un componente del tampón S30 e inesperadamente solo se acumuló debido al metabolismo después de 6 h cuando el consumo de glucosa se había ralentizado(Figura 2D). Este resultado sugiere que la fermentación de acetato no necesariamente permite un flujo glucolítico rápido en puntos de tiempo anteriores. Mientras tanto, el formiato y el succinato se sintetizaron como productos de fermentación menores(Figura 2E,F). En conjunto, el método permitió la cuantificación absoluta del agotamiento del sustrato de azúcar y la formación de productos fermentativos en los lisatos de E. coli S30.
La detección de EM para perfilar el metabolismo de la glucosa lisada específicamente se aplicó aquí. Los lisatos derivados de cepas cultivadas en medios 2xYPTG fueron alimentados con 13C6-glucosa como fuente de carbono. Las reacciones de CFME se ejecutaron por triplicado durante 0 h, 1 h, 2 h y 3 h. Las muestras de cada punto de tiempo se cargaron en un sistema LC equipado con una columna de fase invertida y se acoplaron a la transformada de Fourier y a los espectrómetros de masas de trampa de iones. Se obtuvieron y procesaron espectros de modo iónico negativo para analizar ácidos orgánicos, fosfatos de azúcar y aminoácidos. Se buscaron masas teóricas calculadas de 13especies etiquetadas con C pertenecientes al metabolismo central del carbono para identificar específicamente compuestos derivados de la glucosa. Sobre la base de las condiciones de cultivo de la cepa de origen utilizada y los informes previos de vías activas en E. coli CFME, se supone aquí que el proteoma de lisato comprende una red metabólica que alimenta la glucosa en la fermentación glucolítica, la vía de la pentosa fosfato y, posiblemente, el anabolismo de aminoácidos5,6,7,8,14 (Figura 1). Por lo tanto, la búsqueda se redujo a los miembros de estas vías, de los cuales 16 metabolitos que incorporan etiquetas 13C derivadas de la glucosa fueron anotados inequívocamente(Tabla suplementaria 1).
13 C6-glucosa se consumió observablemente a través de la glucólisis, como lo demuestran las fluctuaciones en las abundancias intermedias glucolíticas (Figura 3A-E). De acuerdo con los datos de HPLC-RID, la glucosa se acumuló a 13C3-lactato y también se fermentó a 13C3-succinato dentro de las primeras 3 h de la reacción(Figura 4A,B). La formación de 13C3-isotopólogo de succinato apoya el modelo propuesto de metabolismo de la glucosa lisada(Figura 1),donde es probable que el succinato se genere por la carboxilación de la molécula de fosfoenolpiruvato de 3 carbonos (PEP) y no a partir de la entrada de una molécula de acetil-CoA de 2 carbonos al ciclo de TCA. La activación del ciclo de TCA se ha asumido en estudios previos de CFME, pero otros 13intermedios de TCA etiquetados con C no se detectaron aquí8,19,21. 13 Sinembargo, la síntesis de C 3-aspartato ocurrió dentro de la primera h y se consumió, reforzando la idea de que la PEP se convierte directamente en oxaloacetato(Figura 1, Figura 6C). Los datos reflejan un proteoma de lisato de cepas de origen cosechadas durante el crecimiento fermentativo en medios ricos en glucosa (2xYPTG). Esto implicaría además que el resto de las enzimas TCA que no participan en la producción de succinato forman una rama oxidativa de TCA(Figura 1). Sin embargo, no se detectó ninguno de los metabolitos en esta vía, posiblemente porque las altas concentraciones de glutamato agregadas a la reacción CFME como un contraión de sal impiden la progresión de esta rama.
Los datos de HPLC-RID se complementan adicionalmente con la falta de detección de 13C2-acetato dentro del marco de tiempo de reacción de 3 h, lo que sugiere que no hay acumulación de acetato a partir de glucosa hasta 3 h(Figura 2B). Sin embargo, el precursor directo del acetato, el acetil-fosfato (acetil-P), se acumuló, lo que sugiere que el brazo Pta de la vía Pta-AckA para la síntesis de acetato a partir de acetil-CoA está activo(Figura 4C,D). La desfosforilación catalizada por AckA de 13C2-acetil-P a 13C2-acetato probablemente no ocurra dentro de este período de tiempo debido a que el acetato es un componente importante del tampón S30 utilizado en las reacciones(Figura 1, Figura 2B).
También se observó la incorporación de 13C6-carbonos derivados de la glucosa a los fosfatos de azúcar 6-fosfogluconolactona (6PGL), 6-fosfogluconato (6PG), ribulosa-5-fosfato (Ru5P) y sedoheptulosa-7-fosfato (S7P)(Figura 5). Estos resultados confirman la participación de la vía de la pentosa fosfato en el metabolismo de la glucosa lisada y probablemente alimenta la síntesis de 13C9-tirosina,lo que ha sido sugerido antes por un estudio proteómico, al tiempo que proporciona un precursor para la producción de 13C5-histidina( Figura6A,B)7. La fenilalanina y el triptófano etiquetados no se observaron aquí, y tampoco la mayoría de los aminoácidos esenciales. Sin embargo, esto no es del todo sorprendente ya que es probable que el anabolismo de aminoácidos se enriquezca en lisatos derivados de células cultivadas en condiciones de privación de nutrientes o en la fase estacionaria7,22. Además, los datos hasta ahora sugieren que los intermediarios de la glucólisis y la fermentación se canalizan hacia reacciones finales regeneradoras de cofactores, lo que debe impedir la síntesis de muchos aminoácidos derivados de gliceraldehído-3-fosfato, piruvato y acetil-CoA (es decir, glicina, cisteína, serina, alanina, valina, leucina y lisina) (Figura 1). Como se mencionó, 13C3-aspartato se produjo dentro de la primera hora, mientras que el aspartato derivado de 13aminoácidos que incorporan C (es decir, treonina, isoleucina, metionina y asparagina) no se observaron posiblemente porque el aspartato derivado de la glucosa participa en la fermentación(Figura 1, Figura 6C). Por último, el flujo hacia el glutamato etiquetado y los aminoácidos derivados del glutamato puede haber sido impedido por altos niveles de glutamato en el entorno de reacción (Figura 1).
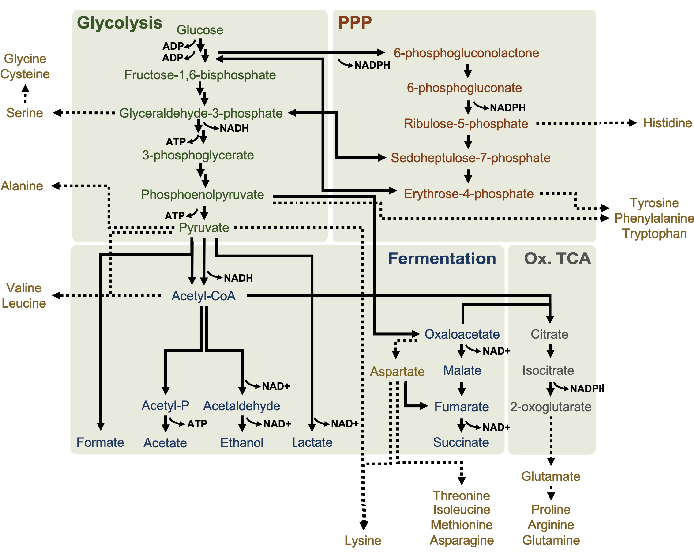
Figura 1: Un supuesto modelo metabólico de lisatos derivados de E. coli BL21DE3-Star que crece exponencialmente en altas concentraciones de glucosa. Se han notificado productos intermedios y finales de la glucólisis (verde), la vía de la pentosa fosfato (naranja oscuro) y las vías fermentativas (azul) de acetil-CoA en CFME a base de lisato. La presencia de fermentación succinata implica la activación de la rama oxidativa del TCA (gris). El anabolismo de aminoácidos (oro) en los lisados no está bien definido y se investiga aquí. Haga clic aquí para ver una versión más grande de esta figura.
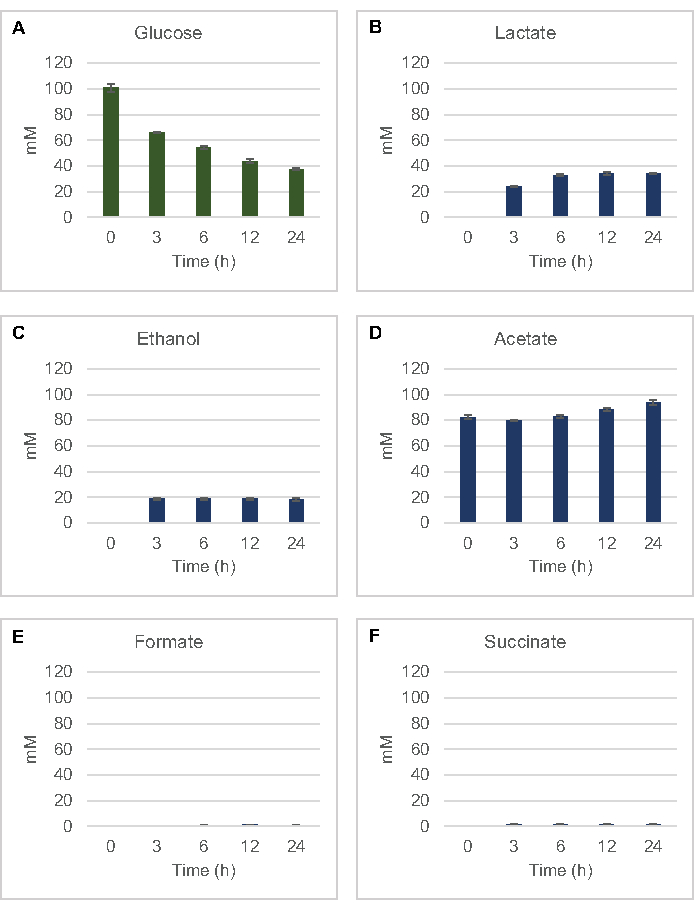
Figura 2:Datos de HPLC-RID para el consumo de glucosa y la síntesis fermentativa del producto final en reacciones CFME preparadas con extractos crudos de E. coli. (A) Consumo de glucosa y (B) lactato, (C) etanol, (D) acetato , (E) formiato y (F) succinato en reacciones CFME se monitorizaron durante 24 h. Se presentan concentraciones medias de mM y barras de error (SE) cuantificadas con curvas estándar (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
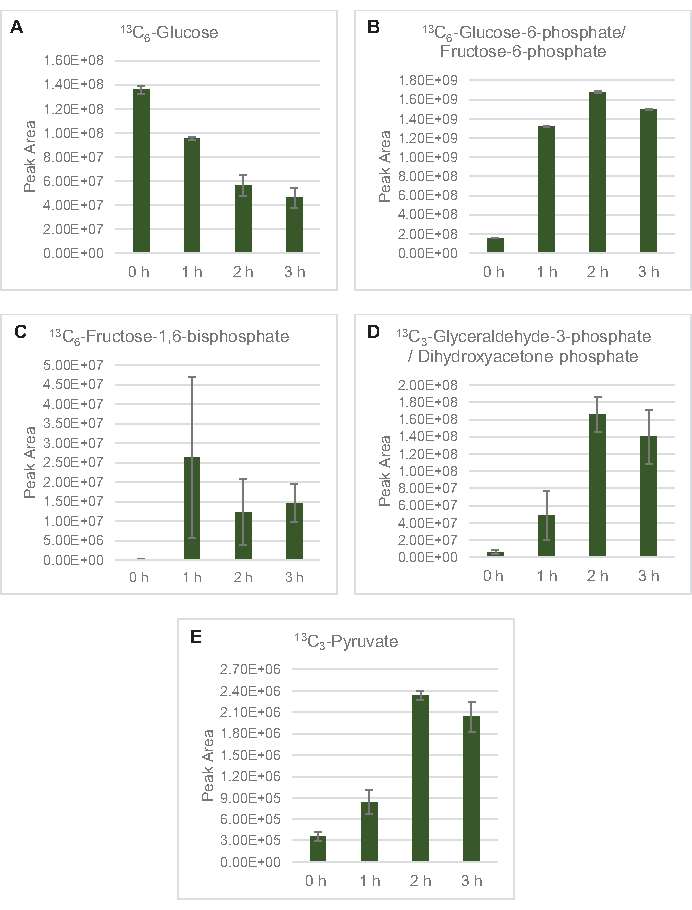
Figura 3: Tendencias del curso temporal de 13C6-glucosa y 13intermedios glicolíticos C-etiquetados en E. coli lisato CFME. Abundancias relativas de (A) 13C6-glucosa, (B) 13C6-glucosa-6-fosfato/fructosa-6-fosfato, (C) 13C6-fructosa-1,6-bisfosfato, (D) 13C3-gliceraldehído-3-fosfato/fosfato de dihidroxiacetona, y (E) 13C6 -piruvato en reacciones CFME durante 3 h. Las áreas de pico en bruto extraídas por el software mzMINE se utilizaron para calcular promedios y barras de error (SE) para anotaciones positivas (n = 3). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Tendencias del curso temporal de los productos intermedios y finales en la fermentación de 13C6-glucosa en E. coli lisato CFME. Abundancias relativas de (A) 13C3-lactato, (B) 13C3-succinato, (C) 13C2-acetil-fosfato, y (D) 13C2-acetil-CoA en reacciones CFME durante 3 h. Las áreas de pico en bruto extraídas por el software mzMINE se utilizaron para calcular promedios y barras de error (SE) para anotaciones positivas (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
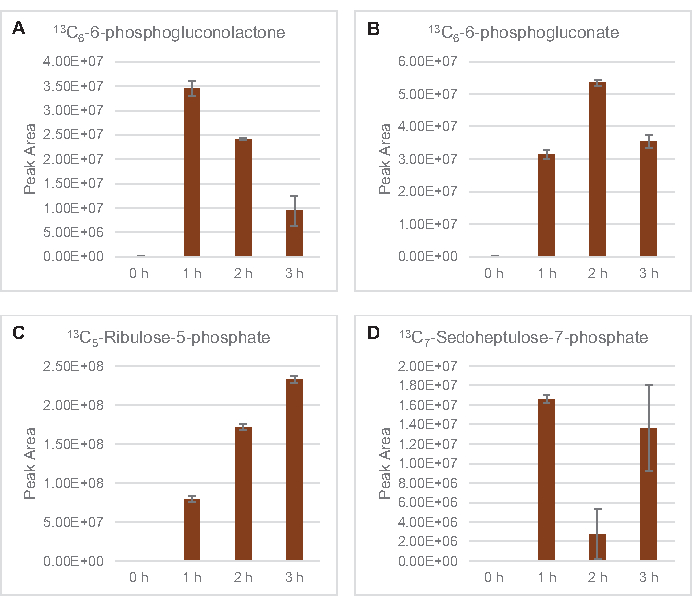
Figura 5: Tendencias del curso temporal de 13C6-intermedios de la vía de la pentosa fosfato derivada de la glucosa en E. coli lisato CFME. Abundancias relativas de (A) 13C6-6-fosfogluconolactona, (B) 13C6-6-fosfogluconato, (C) 13C5-ribulosa-5-fosfato, y (D) 13C7-sedoheptulosa-7-fosfato durante 3 h. Las áreas de pico en bruto extraídas por el software mzMINE se utilizaron para calcular promedios y barras de error (SE) para anotaciones positivas (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
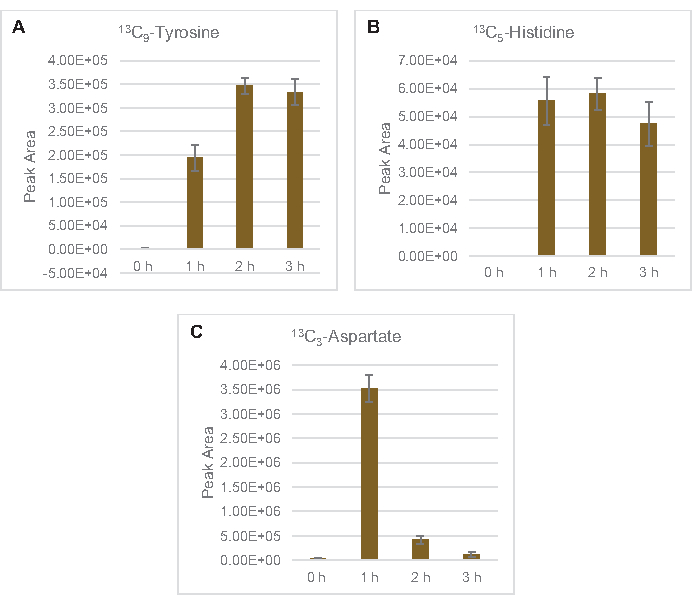
Figura 6: Tendencias del curso temporal de los aminoácidos derivados de la glucosa 13C6detectados en el lisato de E. coli CFME. Abundancias relativas de (A) 13C9-tirosina, (B) 13C5-histidina, y (C) 13C3-aspartato durante 3 h. Las áreas de pico en bruto extraídas por el software mzMINE se utilizaron para calcular promedios y barras de error (SE) para anotaciones positivas (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1:Cromatograma HPLC-RID representativo que muestra picos para los principales productos fermentativos en una reacción CFME incubada a 37 °C durante 24 h. Los picos de glucosa, succinato, lactato, formiato, acetato y etanol son suficientemente distinguibles por sus tiempos de retención en una columna de HPLC durante la elución isocrática con disolvente de ácido sulfúrico de 5 mM. Haga clic aquí para descargar este archivo.
Figura suplementaria 2:Espectros de masas representativos para metabolitos etiquetados con 13C, específicamente (A) lactato, (B) glucosa y (C) 6-fosfogluconato (6PG) en una reacción CFME incubada a 37 ° C durante 1 h. Haga clic aquí para descargar este archivo.
Tabla suplementaria 1:Lista de 13metabolitos marcados con C detectados, tiempos de retención (alineados entre muestras usando MZmine), valores teóricos de modo negativo marcado con C completamente m/ z, valores m / z de características detectadas y errores de masa calculados. Haga clic aquí para descargar esta tabla.
Discusión
El enfoque HPLC-RID descrito se puede utilizar para cuantificar con éxito el consumo de sustrato de azúcar y las conversiones posteriores a los principales productos de ácido orgánico y alcohol del metabolismo central de lisato a lo largo del tiempo. Además, este protocolo emplea un método isocrático simple que utiliza una sola fase móvil, requiere una preparación mínima de la muestra y permite un análisis simple dirigido hacia abajo. Los analitos medidos por el método HPLC-RID se distinguen únicamente por sus tiempos de retención y, por lo tanto, por sus interacciones con la resina de columna seleccionada. La columna de HPLC utilizada aquí fue particularmente diseñada para separar carbohidratos, ácidos orgánicos y alcoholes mediante la combinación de exclusión de tamaño e intercambio de ligandos (es decir, cromatografía de partición moderada por iones). El método descrito es, por lo tanto, útil para un análisis más específico de sustratos de carbohidratos y productos finales seleccionados de vías de fermentación de glucosa que se espera que faciliten y energizen principalmente las bioformaciones basadas en lisato8,15,21. Sin embargo, este protocolo no tiene en cuenta la activación de otras vías metabólicas en los extractos celulares. Las tuberías que emplean otras técnicas de separación cromatográfica (es decir, cromatografía de interacción hidrofílica), métodos de elución por gradiente, preparación de muestras más complicada (es decir, derivatización) y diferentes detectores ópticos (por ejemplo, detectores de dispersión de luz ultravioleta o luz evaporativa) podrían usarse para detectar otros metabolitos como aminoácidos y fosfatos de azúcar23,24 . Alternativamente, se puede adoptar un enfoque global para estudiar el metabolismo del lisato utilizando LC-MS / MS.
El método LC-MS/MS descrito es un flujo de trabajo único para medir e identificar una gama más amplia de metabolitos. LC-MS/MS es una herramienta analítica de última generación para el perfilado de metabolomas debido a su sensibilidad y capacidad para distinguir metabolitos por tiempo de retención y relaciones m/z con alta resolución16. Con un enfoque en las vías metabólicas del carbono central y el anabolismo de aminoácidos, se implementó el modo negativo MS / MS para detectar específicamente ácidos orgánicos polares, fosfatos de azúcar y aminoácidos. Junto con una técnica de cromatografía nanolíquida, el método proporciona una alta sensibilidad para detectar moléculas pequeñas en el fondo de lisato complejo17. Sin embargo, en términos de perfil del metabolismo CFME basado en lisato, una limitación del protocolo LC-MS / MS descrito es su límite de detección inferior de 50 m / z, que impide la medición del etanol, un producto importante en el metabolismo de la glucosa lisada, así como el formiato, que de otro modo se cuantifican fácilmente mediante el método detallado HPLC-RID. En comparación con LC-MS/MS, HPLC-RID tiene la ventaja adicional de la accesibilidad relativa en términos de costo y dificultad. Para este último punto, la solución de problemas del método LC-MS / MS descrito aquí puede requerir cierto grado de experiencia en espectrometría de masas. No obstante, la detección de EM tiene aplicaciones excepcionalmente atractivas sobre RID, ya que también puede distinguir isótopos etiquetados en metabolomas, una excelente técnica para comprender el movimiento de carbono de sustratos suplementados a través de la compleja red metabólica de lisato18. Tal enfoque se aplicó aquí complementando las reacciones con 13C6-glucosa y analizando los valores de abundancia relativa de los metabolitos que incorporan 13C aguas abajo. El análisis permitió la definición de vías activas e inactivas, apoyando suposiciones previamente informadas y proporcionando nuevos conocimientos sobre el flujo metabólico en los lisados. También se pueden realizar modificaciones dentro del método para análisis específicos. Por ejemplo, las soluciones estándar de 13compuestos objetivo etiquetados con C se pueden analizar junto con muestras para lograr mediciones cuantitativas absolutas de moléculas derivadas de la glucosa a lo largo del tiempo y sacar conclusiones sobre las distribuciones de flujo. También se puede habilitar una mejor detección de compuestos cargados positivamente dentro del flujo de trabajo actual ejecutando secuencias con archivos .meth ajustados para la detección de modo positivo.
El muestreo analítico en ambos métodos descritos está convenientemente automatizado, lo que garantiza una alta reproducibilidad. Además, se pueden esperar ejecuciones analíticas suaves siempre que se observen las prácticas adecuadas de manejo y mantenimiento del instrumento. Al utilizar estas herramientas para analizar las reacciones de CFME, se deben hacer consideraciones más críticas aguas arriba y aguas abajo del muestreo. Durante la preparación de la muestra, es importante que los controles del curso de tiempo sean representativos del tiempo cero. Aquí, las proteínas se precipitaron en lisados por acidificación para detener las reacciones metabólicas. Para muestras de tiempo cero, el disolvente ácido se combinó con lisato antes de agregar la mezcla de reacción que contenía glucosa. La acidificación con ácido tricloroacético aseguró efectivamente que la glucosa no se metaboliza en el momento cero, como se muestra en los datos de HPLC-RID(Figura 2). Si bien se realizó un procedimiento similar para calmar el metabolismo de la glucosa en el análisis LC-MS / MS informado, se detectaron 13metabolitos etiquetados con C en muestras de tiempo cero, aunque a valores de abundancia significativamente bajos en relación con las muestras extraídas en puntos de tiempo posteriores. Además, estas observaciones se limitaron a los intermedios de la glucólisis. Los datos sugieren que las reacciones retienen cierto grado de actividad glucolítica después de la acidificación con el disolvente de extracción que se detecta por este método altamente sensible. Sin embargo, debe cuantificarse el alcance de esta actividad. Un estudio previo informó que los disolventes de extracción ácida pueden no saciar suficientemente las reacciones glucolíticas intermedias, pero pueden detener el consumo significativo de glucosa10. Si bien esto aún no se ha investigado más a fondo en el sistema utilizado aquí, los cambios drásticos en los valores de abundancia relativa entre las muestras de tiempo cero y punto de tiempo posterior pueden interpretarse como tendencias en el metabolismo de la glucosa. Sin embargo, se recomienda explorar métodos alternativos de enfriamiento en aplicaciones similares, específicamente para obtener cantidades absolutas de intermedios metabólicos10. Además, también deben observarse las buenas prácticas durante los análisis de software posteriores. La consistencia es imperativa cuando se integran manualmente las áreas de pico de las señales RID para reducir el error humano. La integración manual también debe aplicarse a las zonas pico de las normas siempre que se utilicen zonas pico integradas manualmente para cuantificar las concentraciones de metabolitos en las muestras. A lo largo del análisis LC-MS/MS dirigido, las anotaciones tentativas del análisis MZmine deben validarse mediante la comprobación manual de picos utilizando un navegador de calidad MS, y las características m/z solo deben anotarse cuando los errores de masa calculados son aceptables. Aquí, estos análisis se realizaron manualmente para un conjunto limitado de objetivos, ya que aún no se ha establecido un software completo y robusto para la búsqueda de isótopos. Sin embargo, tales métodos automatizados para buscar metabolitos etiquetados con 13C están surgiendo actualmente y también agilizarían los análisis más complicados, como la elaboración de perfiles de lisados más allá del metabolismo central del carbono25.
La cromatografía líquida avanzada es un método robusto y ampliamente aplicado para separar moléculas pequeñas en mezclas metabólicas complejas11. Los métodos descritos acoalifican esta técnica de separación con el índice de refracción o la detección espectrométrica de masas para analizar con éxito las conversiones de metabolitos en reacciones CFME basadas en lisato. HPLC-RID y LC-MS/MS son herramientas individualmente poderosas para perfilar el metabolismo activo del lisato, y su complementariedad se puede aprovechar aún más para abordar las limitaciones inherentes de cada técnica. Los métodos reportados permiten la aplicación y el desarrollo de CFME, ya que se pueden utilizar para comprender el metabolismo del lisato, monitorear las mejoras en las conversiones de metabolitos dirigidos y dilucidar las alteraciones del flujo de metabolitos al manipular el metabolismo del lisato.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia conocidos u otros conflictos de intereses.
Agradecimientos
Esta investigación fue patrocinada por el Programa de Ciencia Genómica, el Departamento de Energía de los Estados Unidos, la Oficina de Ciencia, Investigación Biológica y Ambiental, como parte del Área de Enfoque Científico de Interfaces de Microbios Vegetales (http://pmi.ornl.gov). El Laboratorio Nacional de Oak Ridge es administrado por UT-Battelle, LLC, para el Departamento de Energía de los Estados Unidos bajo el contrato DE-AC05-00OR22725. Este manuscrito ha sido escrito por UT-Battelle, LLC bajo el Contrato DE-AC05- 00OR22725 con el Departamento de Energía de los Estados Unidos. El Gobierno de los Estados Unidos retiene y el editor, al aceptar el artículo para su publicación, reconoce que el Gobierno de los Estados Unidos conserva una licencia no exclusiva, pagada, irrevocable y mundial para publicar o reproducir la forma publicada de este manuscrito, o permitir que otros lo hagan, para fines del Gobierno de los Estados Unidos. El Departamento de Energía proporcionará acceso público a estos resultados de investigaciones patrocinadas por el gobierno federal de acuerdo con el Plan de Acceso Público (http://energy.gov/downloads/doe-public-access-plan) del DOE.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Referencias
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados