Method Article
Flüssigkeitschromatographie gekoppelt an Brechungsindex oder massenspektrometrische Detektion zur Metabolitenprofilierung in lysatbasierten zellfreien Systemen
In diesem Artikel
Zusammenfassung
Die Protokolle beschreiben Hochleistungs-Flüssigkeitschromatographie-Methoden, gekoppelt an Brechungsindex oder massenspektrometrische Detektion zur Untersuchung von Stoffwechselreaktionen in komplexen lysatbasierten zellfreien Systemen.
Zusammenfassung
Die Entwicklung des Zellstoffwechsels für eine gezielte Biosynthese kann umfangreiche DESIGN-Build-Test-Learn-Zyklen (DBTL) erfordern, da der Ingenieur die Überlebensanforderungen der Zelle umrennt. Alternativ kann die Durchführung von DBTL-Zyklen in zellfreien Umgebungen diesen Prozess beschleunigen und Bedenken hinsichtlich der Hostkompatibilität beseitigen. Ein vielversprechender Ansatz für zellfreies Metabolic Engineering (CFME) nutzt metabolisch aktive Rohzellextrakte als Plattformen für die Bioherstellung und für die schnelle Entdeckung und Prototypenerstellung modifizierter Proteine und Signalwege. Die Realisierung dieser Fähigkeiten und die Optimierung der CFME-Leistung erfordern Methoden zur Charakterisierung des Metaboloms von lysatbasierten zellfreien Plattformen. Das heißt, analytische Werkzeuge sind notwendig, um Verbesserungen bei gezielten Metabolitenumwandlungen und bei der Aufklärung von Veränderungen des Metabolitenflusses bei der Manipulation des Lysatstoffwechsels zu überwachen. Hier wurden Metabolitenanalysen mittels Hochleistungsflüssigkeitschromatographie (HPLC) in Verbindung mit optischer oder massenspektrometrischer Detektion angewendet, um die Metabolitenproduktion und den Fluss in E. coli S30-Lysaten zu charakterisieren. Konkret beschreibt dieser Bericht die Präparation von Proben aus CFME-Lysaten für HPLC-Analysen mittels Brechungsindexdetektion (RID), um die Erzeugung zentraler Stoffwechselzwischenprodukte und Nebenprodukte bei der Umwandlung von kostengünstigen Substraten (z.B. Glukose) in verschiedene hochwertige Produkte zu quantifizieren. Die Analyse der Metabolitenumwandlung in CFME-Reaktionen, die mit 13C-markierter Glukose durch Umkehrphasenflüssigkeitschromatographie in Verbindung mit der Tandem-Massenspektrometrie (MS/ MS) gefüttert werden, einem leistungsfähigen Werkzeug zur Charakterisierung spezifischer Metabolitenausbeuten und des Lysat-Stoffwechselflusses aus Ausgangsmaterialien, wird ebenfalls vorgestellt. Insgesamt ermöglicht die Anwendung dieser analytischen Methoden auf den CFME-Lysatstoffwechsel die Weiterentwicklung dieser Systeme als alternative Plattformen für die Ausführung schnellerer oder neuartiger Metabolic Engineering-Aufgaben.
Einleitung
Einschränkungen bei der Entwicklung von Mikroben für die chemische Produktion können durch die Rekapitulation biochemischer Reaktionen in vitro behoben werden, bei denen konkurrierende zelluläre Überlebensfunktionen fehlen1. Darüber hinaus ist die offene Reaktionsumgebung (d.h. das Fehlen einer Zellmembran) besser manipulationsfähig und im Vergleich zu lebenden Zellen leichter zu überwachen. Dieses grundlegende Konzept des zellfreien Metabolic Engineering (CFME) wurde elegant durch die Rekonstitution von Stoffwechselwegen demonstriert, um wertvolle Chemikalien wie Wasserstoff und Monoterpene mit Produktionsmetriken zu synthetisieren, die um Größenordnungen höher sind als bisher in mikrobiellen Zellfabriken1,2,3 . Methoden zur Reinigung ganzer Pfade sind jedoch derzeit zeit- und kostenbehaftet. Alternativ können zellfreie Stoffwechselsysteme aus rohen Zellextrakten durch schnelle und kostengünstige Methoden in Bezug auf die Rekonstitution des gesamten Signalwegs abgeleitet werden4. Der zentrale Stoffwechsel, der in Zellextrakten zurückgehalten wird, kann mit Energiesubstraten (z. B. Glukose und enzymatische Cofaktoren) und Salzen in gepufferten Lösungen ergänzt werden, um zentrale Stoffwechselvorstufen für über 24 h5,6zu erzeugen. Die Zugabe von exogenen Enzymen zur lysatbasierten CFME-Reaktion ermöglicht komplexere Biotransformationen von Glukose in wertvollere Chemikalien bei hohen Titern4,6,7. Obwohl die Ausbeute in diesen Systemen aufgrund ihrer zellähnlichen metabolischen Komplexität tendenziell beeinträchtigt ist, wurden und werden einzigartige Methoden zur Kuratproteome für eine höhere Ertragsumwandlung entwickelt7,8.
Die einfache Durchführung metabolischer Transformationen in lysatbasierten zellfreien Systemen macht diese hervorragenden Plattformen für die Verlagerung der chemischen Herstellung außerhalb der Zelle oder für das Prototyping neuer Wege mit hohem Durchsatz, bevor diese Designs in vivo2,9erstellt und getestet werden. Für beide Anwendungen sind Werkzeuge zur Überwachung metabolischer Umwandlungen oder zur Beobachtung von Allgemeinen Veränderungen des metabolischen Flusses in Lysaten ein wesentlicher Bestandteil der Weiterentwicklung von CFME. Die Hochleistungsflüssigkeitschromatographie (HPLC) kann zur hochauflösenden Trennung der chemischen Bestandteile von CFME-Reaktionen eingesetzt und zur Metabolitenquantifizierung an optische oder massenspektrometrische Detektoren gekoppelt werden5,10. Das zugrunde liegende Prinzip der HPLC besteht darin, dass Analyten, die in einem Lösungsmittel gelöst (d. h. mobile Phase) und durch eine Säule gepumpt werden, mit dem spezifischen Säulenpackungsmaterial (d. H. Stationäre Phase) interagieren11. Abhängig von ihren chemischen Eigenschaften weisen diese Analyten unterschiedliche Retentionszeiten auf, bevor sie schließlich aus der stationären Phase eluiert und von der mobilen Phase zu einem Detektor transportiert werden. Dieser Bericht beschreibt die Vorbereitung und Analyse von E. coli lysat-basierten CFME-Reaktionen durch HPLC-basierte Methoden, die RID- und MS/MS-Detektion nutzen.
Die HPLC gekoppelt an den Brechungsindex-Nachweis (HPLC-RID) ist eine allgemein zugängliche Methode zur schnellen Identifizierung zentraler Stoffwechselvorläufer und Endprodukte. Kurz gesagt, RID misst, wie Analyten die Ablenkung des Lichts durch die mobile Phase12verändern. RID-Signale, die Zielanalyten in Proben entsprechen, können dann durch Vergleiche mit RID-Signalen von Standardlösungen quantifiziert werden. In CFME-Anwendungen wurde diese Art der Detektion am häufigsten mit HPLC-Säulen verwendet, die Verbindungen basierend auf einer Kombination von Größenausschluss und Ligandenaustauschmechanismen oder ionenmoderter Partitionschromatographie5,6,8,13trennen. Diese spezielle Technik wird verwendet, um den Verbrauch von Zuckersubstraten wie Glukose sowie die Bildung von Fermentationsprodukten wie Succinat, Laktat, Formiat, Acetat und Ethanol in lysatbasierten CFME-Reaktionen schnell zu quantifizieren8. Die Aufzeichnung der Konzentrationsänderungen dieser Verbindungen mittels HPLC war nützlich, um sowohl das Potenzial von Rohzellextrakten zur Bündelung zentraler Stoffwechselvorläufer aufzuklären als auch zu verstehen, wie der Signalwegfluss während komplexer metabolischer Umwandlungen von Glukose in Lysaten durch fermentative Wege umgeleitet wird6,8,14. Bahnbrechende CFME-Studien in E. coli-Zellextrakten bestätigen, dass sich Fermentationsverbindungen als Endprodukte des Glukosekatabolismus anreichern und auch als unerwünschte Nebenprodukte in Lysaten vorkommen, die exogene Enzyme überexprimieren6,15. Es wird vermutet, dass der fermentative Stoffwechsel eine notwendige Rolle bei der Regeneration von Redoxäquivalenten von Cofaktoren (d. H. NAD (P) H und ATP) spielt, um glykolytische Reaktionenaufrechtzuerhalten 8. Daher ist eine HPLC-basierte optische Detektionsmethode zur Trennung von Fermentationsprodukten ein nützliches und häufig angewendetes Werkzeug bei der Ausführung verschiedener lysatbasierter CFME-Aufgaben.
CFME kann implementiert werden, um metabolische Endprodukte zu akkumulieren, die keine Kohlenhydrate, organischen Säuren oder Alkohole sind4. Die Messung von Zwischenprodukten, die so schnell verbraucht werden, wie sie synthetisiert werden, kann ebenfalls wünschenswert sein10. Während HPLC-RID in Bezug auf Kosten und Schwierigkeit zugänglich ist, ist diese Methode durch ihre Fähigkeit eingeschränkt, Metaboliten nur anhand der Retentionszeit zu unterscheiden. Ein breiteres Spektrum von Metaboliten kann analysiert werden, wenn die Flüssigkeitschromatographie mit dem MS/MS-Nachweis (LC-MS/MS) gekoppelt ist16. Mit dieser Methode werden Analyten in der mobilen Phase ionisiert und basierend auf den Massen- und Ladungseigenschaften jedes Moleküls differentiell detektiert. Die Kenntnis sowohl des Masse-zu-Ladungs-Verhältnisses (m/z) des Metaboliten als auch der Retentionszeit an der Säule erleichtert somit die Trennung der meisten Stoffwechselzwischen- und Endprodukte mit hoher Auflösung16. Diese Detektionstechnik kann auch mit der Nano-Flüssigkeitschromatographie gekoppelt werden, die viel geringere Durchflussraten und Probeninjektionsvolumina ermöglicht, was einen empfindlicheren Nachweis kleiner Moleküle im komplexen Lysathintergrund ermöglicht17. LC-MS/MS kann zusätzlich mit Isotopenmarkierung angewendet werden, da eingearbeitete Markierungen Veränderungen der m/z-Werte 18 der Analytenbewirken. Zeitpunktmessungen, die aus einer CFME-Reaktion extrahiert werden, die mit einem 13C6-Glukosesubstratergänzt wird, können somit die End- oder Nebenprodukte bestimmen, die speziell aus der ergänzten Glukose gewonnen werden. Obwohl diese Isotopenverfolgungsmethode in CFME-Studien noch nicht häufig angewendet wird, ist sie ein leistungsfähiges Werkzeug zum Verständnis metabolischer Umwandlungen in lysatbasierten CFME-Systemen, zumal Salzkonterionen (d. H. Acetat und Glutamat) in diesen Reaktionen auch als Sekundäreubstrate katabolisiert werden19. Durch den Einsatz dieser Technik kann somit ein umfassendes Bild des Glukosestoffwechsels in Lysaten zeichnen, das bis heute nicht vollständig verstanden wird. Hier beschreibt das Protokoll eine Methode zur Nanoflüssigkeitschromatographie gekoppelt an Nanoelektrospray-Ionisation (Nano-ESI) MS/MS, mit der ein mögliches Modell des Glukosestoffwechsels, insbesondere in E. coli-Lysaten, abgefragt werden kann (Abbildung 1). Das Modell basiert auf Berichten über fermentative Wege und den Pentosephosphatweg, der in E. colilysaten aktiv ist, die aus Stämmenstammen,die in Rich Media gezüchtet werden5,6,8,14. Die Technik wird zusätzlich zur Untersuchung der Aminosäureproduktion eingesetzt, da sich das derzeitige Wissen über den Aminosäureanabolismus aus Glukose in Lysaten auf wenige Beispiele wie die Synthese aromatischer Aminosäuren beschränkt7. Angesichts der meist polaren Natur von Endprodukten und Zwischenprodukten in diesen Signalwegen (d.h. organische Säuren, Zuckerphosphate und Aminosäuren) wurde hier die umkehrphasenförmige Flüssigkeitschromatographie eingesetzt. Diese Technik trennt polare Verbindungen durch Elution von einer unpolaren stationären Phase. Diese Verbindungen wurden dann durch Nano-ESI im negativen Ionenmodus ionisiert, was den Nachweis von Analyten mit mindestens einer negativen Elementarladung ermöglicht und somit für den Nachweis saurer Verbindungen nützlich ist. Diese Technik wird hier verwendet, um glukosebasierte 13C-integrierende Metaboliten zu analysieren und den Nutzen von LC-MS / MS für das Verständnis des Glukosestoffwechsels in Lysaten zu demonstrieren.
Protokoll
1. Start-, Stopp- und Verarbeitungszeitverlauf CFME-Reaktionen zur HPLC-RID-Quantifizierung.
- Zuvor hergestellte E. colilysate auftauen und den Rest der Reaktionskomponenten auf Eis vorbereiten.
HINWEIS: Die hier berichteten Lysate wurden von E. coli BL21DE3-Star abgeleitet, die in 2xYPTG(1,8 % Glukose) Medien bis zur mittleren Log-Phase gezüchtet wurden.- Bereiten Sie ein geeignetes Volumen des filtersterilisierten (0,20 μm Porenfilter) S30-Puffers (1 M Tris-OAc eingestellt auf pH 8,2 mit Eisessigsäure, 1,4 M Mg(OAc)2und 6 M KOAc) vor.
- Bereiten Sie einen Energiemix vor, der Glukose, Glutamatsalze, ATP, Coenzym A, NAD+, Bis-Tris-Puffer und Dikaliumphosphat im S30-Puffer enthält. Endkonzentrationen im gewünschten Reaktionsvolumen, das zur Vorbereitung von CFME-Reaktionen verwendet wurde, waren hier 100 mM Glucose, 18 mM Magnesiumglutamat, 15 mM Ammoniumglutamat, 195 mM Kaliumglutamat, 1 mM ATP, 0,2 mM Coenzym A, 1 mM NAD+,150 mM Bis-Tris und 10 mM Dikaliumphosphat.
- Kombinieren Sie die Komponenten in 1,5 ml Mikrozentrifugenröhrchen, um endgültige Reaktionen mit 4,5 mg / ml Gesamtlysatprotein vorzubereiten. Hier wurden CFME-Reaktionen mit Endvolumina von 50 μL in dreifacher Ausfertigung pro Zeitpunkt vorbereitet. Inkubieren Sie die Reaktionen bei 37 °C für ihren jeweiligen Zeitrahmen.
HINWEIS: Arbeiten Sie schnell und fügen Sie Lysat als letzten Bestandteil der Reaktionsmischung hinzu, um vorzeitige Stoffwechselreaktionen mit Glukose- und Glutamatsalzen zu verhindern. Ein minimaler Glukoseverbrauch kann auftreten, je nachdem, wie lange Reaktionsmischungen auf Eis inkubiert werden. - Beenden Sie die Reaktionen und verarbeiten Sie die Proben für die HPLC-RID-Analyse.
- Um die dreifachen Reaktionen zu den richtigen Zeitpunkten zu beenden, fügen Sie sofort ein gleiches Volumen von 5% Trichloressigsäure zum endgültigen Reaktionsvolumen jeder Probe hinzu (d. h. 50 μL 5% Trichloressigsäure zu einer 50 μL-Reaktion). Verdünnen Sie jede Probe mit sterilem Wasser bei dem 2-fachen des Reaktionsvolumens (d. h. 100 μL).
- Um die Zeit Null zu rekapitulieren, mischen Sie das gleiche Volumen von 5% Trichloressigsäure wie das gesamte Endreaktionsvolumen (d. H. 50 μL) mit dem Lysat, bevor Sie die restlichen Reaktionskomponenten hinzufügen. Dieser Säuerungsschritt löst Lysatenzyme aus, bevor sie Glukose signifikant verstoffwechseln.
- Wirbeln Sie die Proben und zentrifugieren Sie auf einer Tischmikrozentrifuge bei 11.600 x g für 5 min und übertragen Sie Überstände, die die organischen Analyten enthalten, in reinigte Röhrchen. Lagern Sie die Proben bei -20 °C, wenn HPLC-Analysen an einem anderen Tag durchgeführt werden sollen. Stellen Sie sicher, dass Sie die gelagerten Proben auf Eis auftauen, bevor Sie mit dem nächsten Schritt fortfahren.
- Filtern Sie jeden Überstand mit einem 0,22 μm Porenfilter. Alternativ zu Spritzen verwenden Sie Zentrifugenrohrfilter und zentrifugieren die Überstände bei 16.300 x g für 1 min.
- Jedes Filtrat wird in eine saubere HPLC-Glasdurchstechflasche überführen. Legen Sie die Durchstechflaschen in das HPLC-Autosamplerfach.
- Bereiten Sie Proben für die Standardkurvengenerierung vor.
- Bereiten Sie eine Stammlösung aller in S30-Puffer gelösten Zielanalyten in äquimolaren Mengen über der Ausgangskonzentration von Glukose in den CFME-Reaktionen vor. Hier wurde eine Stammlösung bestehend aus 150 μM Glucose, Succinat, Laktat, Formiat, Acetat und Ethanol hergestellt. Führen Sie serielle 1:1 (v/v)-Verdünnungen aus der Stammlösung durch, um dreifache 50 μL-Lösungen mit Endkonzentrationen von 0 μM bis zur Stammkonzentration (d. h. 150 μM) zu erhalten.
- Verdünnen Sie jede Lösung mit 50 μL 5% Trichloressigsäure und 100 μL sterilem Wasser. Wiederholen Sie die Schritte 1.3.4-1.3.5.
HINWEIS: Führen Sie Lösungen für die Standardkurvengenerierung mit jeder Probencharge aus, um eine genaue Quantifizierung der Metabolitenkonzentrationen zu gewährleisten.
2. Vorbereitung des HPLC-Systems für den Metabolitennachweis.
- Unter einem Abzug eine sterilisierte 5 mM Schwefelsäurelösung aus entionisiertem und filtersterilisiertem Wasser vorbereiten. Fügen Sie ~ 550 μL einer 98% HPLC-Schwefelsäurelösung zu 2 L Wasser hinzu, um 5 mM Schwefelsäure zu erhalten.
VORSICHT: Schwefelsäure ist eine gefährliche Chemikalie, und die Arbeit unter einem Abzug mit der richtigen Labor-PSA verhindert Inhalation, Hautkontakt und Augenkontakt. Konzentrierte Schwefelsäure reagiert kräftig mit Wasser und sollte direkt in Wasser zugegeben werden, nicht umgekehrt. An einem kühlen, trockenen, vor direkter Sonneneinstrahlung geschützten Bereich aufbewahren und die vom Labor festgelegten Entsorgungsmaßnahmen befolgen. - Bewahren Sie die 2 L Flasche mit 5 mM Schwefelsäure in einem Wasserbad neben dem HPLC-Gerät inkubiert auf. Stellen Sie das Wasserbad auf 35 °C ein. Legen Sie den Schlauch mit einem Lösungsmittelfilter in die Lösungsmittelflasche und befestigen Sie das andere Ende an einem Entgasermodul in Übereinstimmung mit dem Pumpenmodul.
HINWEIS: Das Spülen des Systems mit einem frisch zubereiteten Lösungsmittel vor dem Einbau der Säule ist eine gute Handhabung des Instruments. - Statten Sie das HPLC-Gerät mit der HPLC-Säule in Übereinstimmung mit dem RID-Modul aus. Stellen Sie die Säule in das 35 °C Wasserbad, wenn kein Säulenthermostat vorhanden ist.
- Bereiten Sie das RID-Modul für die Analyse bei 35 °C in der cdS-Software (Chromatography Data System) vor, die auf dem Systemcomputer installiert ist.
- Wählen Sie im Menü Ansicht die Methode aus, und führen Sie die Steuerelementansicht aus. Klicken Sie mit der rechten Maustaste auf die > Methode des Pumpenmoduls. Stellen Sie die Durchflussrate auf 0,55 mL·min-1 ein und wählen Sie die Taste Ein, um die Pumpe zu starten.
HINWEIS: Wenn die Säule vor der Ausrüstung mit der HPLC gelagert wurde, erhöhen Sie die Durchflussrate auf 0,55 ml-1, nachdem Sie die Säule gemäß den Anweisungen des Herstellers ausgeglichen haben. - Klicken Sie mit der rechten Maustaste auf das Bedienfeld, das dem RID-Modul >-Methode entspricht. Stellen Sie die Temperatur des RI-Detektormoduls auf 35 °C ein und wählen Sie Ein, um mit dem Aufwärmen des RI-Detektormoduls zu beginnen.
- Klicken Sie mit der rechten Maustaste auf das Bedienfeld RID Module > Control. Wählen Sie für die Spülreferenzzelle mindestens 15 Minuten lang ein, wenn ein frisches Lösungsmittel verwendet wird, oder 1 h, wenn vor diesem Aufbau verschiedene Lösungsmittel durch den RI-Detektor geflossen sind. Klicken Sie auf die Schaltfläche Ein.
HINWEIS: Lassen Sie die Pumpe und den RI-Detektor eingeschaltet, um eine stabile Basislinie auf dem Online-Plot zu erreichen. Dies wird durch Temperaturschwankungen im Labor beeinflusst und kann bis zu 4 h oder länger dauern. Lassen Sie das System vor dem Laden der Probe über Nacht eingeschaltet.
- Wählen Sie im Menü Ansicht die Methode aus, und führen Sie die Steuerelementansicht aus. Klicken Sie mit der rechten Maustaste auf die > Methode des Pumpenmoduls. Stellen Sie die Durchflussrate auf 0,55 mL·min-1 ein und wählen Sie die Taste Ein, um die Pumpe zu starten.
3. Erstellung einer Methode zur isokratischen HPLC-Trennung von organischen Fermentationsprodukten im CDS.
- Wählen Sie in der Menüleiste Methode > Neue Methodeaus. Wählen Sie Methode > Methode unter [Methodenname] speichern.M. Wählen Sie Methode aus > Bearbeiten Sie die gesamte Methode > Instrument/Acquisition
- Stellen Sie auf der Registerkarte Binärpumpe den Durchfluss auf 0,55 ml·min -1ein. Wählen Sie unter Lösungsmittelden Buchstaben aus, der dem Lösungsmitteleintrag am Pumpenmodul entspricht, und stellen Sie ihn für die isokratische Elution auf 100 % ein. Stellen Sie die Druckgrenzen auf 0 und 400 bar und den Eingang 30 min als Stoptime ein.
- Stellen Sie auf der Registerkarte Sampler das Injektionsvolumen auf 50 μL ein. Wählen Sie unter Stoptimedie Option Als Pumpe/No Limit aus. Legen Sie die erweiterten Hilfseinstellungen für Ziehgeschwindigkeit, Auswurfgeschwindigkeitund Ziehposition auf 200 μL·min-1, 200 μL·min-1und -0,5 mm fest.
- Stellen Sie auf der Registerkarte RID die Temperatur der optischen Einheit auf 35 °C ein. Wählen Sie unter Signaldie Option Erfassen für Signal und >0,2 min für Peakwidth. Wählen Sie die Option Als Pumpe/Injektor für Stoptime.
- Legen Sie unter Erweitert auf der Registerkarte RID den Analogausgang auf 5 % Nulloffset und 500.000 nRIU für Dämpfung fest. Wählen Sie die Option Positiv für Signalpolarität und die Option Ein für Automatische Null vor der Analyse.
- Speichern Sie die Methode, indem Sie Methode > Methode speichern auswählen. Laden Sie die Methode, indem Sie Methode > Load-Methode > [Methodenname] auswählen. M.
4. Erstellen einer Sequenztabelle für das Autosampling und Starten des HPLC-RID-Systems zur Datenerfassung.
- Wählen Sie in der Menüleiste Sequenz > Neue Sequenzvorlage. Wählen Sie Sequenz > Sequenzvorlage unter [SequenceTemplateName] speichern. S.
- Wählen Sie Sequenz > Sequenztabelle. Hängen Sie 'n'-Zeilen an, die den Durchstechflaschen 'n' entsprechen, und geben Sie dann die Positionen der Durchstechflasche und die Probennamen unter Durchstechflasche bzw. Probennameentsprechend ihrer Anordnung auf dem Autosampler-Fach ein. Wählen Sie die in Schritt 3 generierte Methode aus dem Dropdown-Menü Methodenname aus und geben Sie 50 μL als Inj/Vial (Injektion pro Durchstechflasche) für jede Zeile ein.
- Klicken Sie auf Übernehmen und speichern Sie die Sequenzvorlage, indem Sie Sequenzvorlage > Sequenzvorlage speichern auswählen. Stellen Sie sicher, dass die Sequenzvorlage geladen ist, indem Sie Sequenz > > [SequenceTemplateName] laden auswählen. S.
- Nachdem Sie eine stabile Baseline auf dem Online-Diagramm erreicht haben, klicken Sie mit der rechten Maustaste auf das Panel RID Module > Control > Off Recycling Valve, um den Lösungsmittelfluss durch den RID-Detektor zum Abfall zu leiten. Um die Datenerfassung zu starten, wählen Sie in der Menüleiste Sequenz, Sequenz > Ausführen.
5. Extrahieren und Analysieren von Daten nach dem Ausführen.
- Wählen Sie im Menü Ansicht die Option Datenanalyseansicht aus. Suchen Sie den Sequenzdateinamen aus der Dateiliste auf der linken Seite des Bildschirms. Wechseln Sie im mittleren Bereich des Bildschirms zur Signalansichtsauswahl > RID-Signal, um die Beispielchromatogramme anzuzeigen.
- Wählen Sie im oberen Bereich des Bildschirms eine Zeile aus, die einer Standardprobe mit hoher Konzentration entspricht. Notieren Sie sich die Retentionszeiten für die Zielanalytenspitzen auf dem angezeigten Chromatogramm. Peaks, die den Zielanalyten entsprechen, werden entlang der Retentionszeitachse als Glukose, Succinat, Laktat, Formiat, Acetat und Ethanol angeordnet (Ergänzende Abbildung 1).
HINWEIS: Der erste große Peak im Chromatogramm entspricht Trichloressigsäure. Seine RI-Einheiten sollten über alle Standardkurvenproben hinweg konsistent sein. Validieren Sie die Retentionszeit jedes Zielanalyten, indem Sie jede Verbindung als separate Probe ausführen. - Extrahieren Sie Peakflächen für jeden Zielanalyten aus Chromatogrammen der Standards und der Reaktionsproben.
- Erkennen Sie, ob die Peaks of Interest gut in die Software integriert sind. Zeichnen Sie die rote Linie als Basis jedes Peaks, um einen genau integrierten Bereich unter der Kurve zu erhalten. Wenn die automatische Integration fehlschlägt (d. h. die rote Linie ist schief), wählen Sie die Schaltfläche Manuelle Integration aus dem Integration Tool Set und zeichnen Sie manuell eine Peak-Basis, um den Peak-Bereich zu integrieren.
HINWEIS: Wenn die manuelle Integration für einen Zielanalyten in einer Probe durchgeführt werden muss, bleiben Sie konsistent und integrieren Sie denselben Analyten manuell in alle Proben. - Wählen Sie das Cursor-Werkzeug aus dem Common Tool Set aus, um auf richtig integrierte Peaks zu klicken. Der Peak-Bereich und die entsprechende Retentionszeit des ausgewählten Peaks werden als Tabellenzeile im unteren Bereich des Bildschirms hervorgehoben.
- Um Spitzenbereiche zu exportieren, wählen Sie Datei > exportieren > Integrationsergebnisse.
- Erkennen Sie, ob die Peaks of Interest gut in die Software integriert sind. Zeichnen Sie die rote Linie als Basis jedes Peaks, um einen genau integrierten Bereich unter der Kurve zu erhalten. Wenn die automatische Integration fehlschlägt (d. h. die rote Linie ist schief), wählen Sie die Schaltfläche Manuelle Integration aus dem Integration Tool Set und zeichnen Sie manuell eine Peak-Basis, um den Peak-Bereich zu integrieren.
- Quantifizieren Sie die Zielanalytkonzentrationen mithilfe von Standardkurven.
- Zeichnen Sie Spitzenflächenwerte im Vergleich zu bekannten Konzentrationen von Proben in einer Tabelle auf. Klicken Sie mit der rechten Maustaste auf die dargestellten Daten, Trendlinie hinzufügen > Trendlinie formatieren > Gleichung im Diagramm anzeigen.
- Verwenden Sie in einer separaten Tabelle die Gleichungen der Standardkurventrendlinien, um Spitzenflächenwerte für jeden Analyten aus jeder Probe in Konzentrationen umzuwandeln. Berechnen Sie die durchschnittlichen Spitzenbereiche und Standardfehlerwerte über Triplikate hinweg für die Datenvisualisierung.
6. Start,Stopp und Verarbeitungszeit Verlauf Isotopenverfolgung CFME-Reaktionen für LC-MS/MS-Quantifizierung.
- Richten Sie dreifache Reaktionen pro Zeitpunkt (außer Zeit Null) auf Eis ein, wie in 1.1-1.2 beschrieben. Anstelle von Glukose wird jedoch eine Endkonzentration von 100 mM 13C6-Glukosein den Reaktionen verwendet. Inkubieren Sie die Reaktionen bei 37 °C für 1 h, 2 h und 3 h.
- Um die Reaktionen zu beenden, frieren Sie die Reaktionen in flüssigem Stickstoff ein und lagern Sie sie bei -80 °C. Überspringen Sie diesen Speicherschritt für die Analyse am selben Tag.
HINWEIS: Trichloressigsäure wurde nicht verwendet, um Reaktionen aufgrund von Interferenzen durch die Säure beim Nachweis einiger zentraler Kohlenstoffmetaboliten über LC-MS / MS zu stoppen. Stattdessen wurde ein Extraktionslösungsmittel mit Ameisensäure (Schritt 6.3) verwendet, um Stoffwechselproteine auszufälschen, da die Masse der Ameisensäure unter der Nachweisgrenze der berichteten MS/MS-Methode liegt. - Bereiten Sie 50 ml des Extraktionslösungsmittels vor. Kombinieren und wirbeln Sie 20 ml Acetonitril, 20 ml Methanol und 10 ml Wasser (alle LC-MS-Qualität) in einem 50-ml-Zentrifugenröhrchen zusammen mit 0,199 ml Ameisensäure zu einer 0,1 m Lösung. Kühlen Sie das Lösungsmittel während der Extraktion auf 4 °C und lagern Sie es bei -20 °C, wenn es nicht verwendet wird.
- Verarbeitung von Proben für die LC-MS/MS-Analyse
- Am Tag der Analyse wird jeder Probe ein äquivalentes Volumen des Extraktionslösungsmittels (d. h. 50 μL) pipettet. Wenn die Proben eingefroren wurden, fügen Sie das Extraktionslösungsmittel hinzu, bevor die Proben vollständig auftauen, um die Reaktivierung des Glukosestoffwechsels zu verhindern. Führen Sie alle Probenverarbeitungsschritte auf Eis durch.
- Um die Zeit Null zu rekapitulieren, pipetten Sie das Endvolumen des Extraktionslösungsmittels (d. h. 50 μL) auf ein geeignetes Lysatvolumen für die gewünschte Endkonzentration in der Reaktion (d. h. von 4,5 mg/ml in 50 μL Reaktionsvolumen). Fügen Sie die restlichen Reaktionskomponenten wie in Schritt 1.2 hinzu. Dieser Säuerungsschritt löst Lysatenzyme aus, bevor sie Glukose signifikant verstoffwechseln.
- Die Proben in Extraktionslösungsmittel 30 min unter sanftem Schütteln auf Eis inkubieren und dann die Proben bei 21.000 x g für 15 min bei 4 °C zentrifugieren, um den Überstand vom gefällten Protein zu trennen. 50 μL des Überstands in Autosampler-Fläschchen geben und die Fläschchen auf das Fach innerhalb des 4 °C-Autosamplers laden. Lagern Sie den Rest des Überstands bei -20 °C für zukünftige Analysen.
7. Einrichtung des LC-Systems für die LC-MS/MS-Analyse.
- 1 l Lösungsmittel A vorbereiten, indem 77,08 mg Ammoniumacetat in 950 ml Wasser und 50 ml Isopropanol vollständig gelöst werden. Bereiten Sie 1 l Lösungsmittel B mit 650 ml Acetonitril, 300 ml Wasser und 50 ml Isopropanol zusammen mit 77,08 mg Ammoniumacetat vor. Stellen Sie sicher, dass alle Lösungsmittel LC-MS-Qualität haben.
- Schließen Sie die Lösungsmittelflaschen mit den Lösungsmitteln A und B an das Pumpenmodul an. Spülen Sie das System mit einer hohen Durchflussrate, um Luftverschmutzungen zu entfernen / zu begrenzen, die während der Ausrüstung der Lösungsmittel zum LC-System aufgetreten sein könnten.
- Statten Sie das System mit einer C18-Umkehrphasensäule aus (30 cm Säulenlänge, 75 μm Innendurchmesser und 5 μm Partikeldurchmesser). Konditionieren Sie die Säule für das LC-MS-System, indem Sie 100% Lösungsmittel B fließen und langsam Lösungsmittel A auf 100% hochfließen.
HINWEIS: Die Säulenspitzen wurden intern mit einem Mikropipettenzieher hergestellt und mit Druckzellen und Helium verpackt.
8. Erstellung einer Methode auf LC-MS/MS-Datenerfassungs- und Interpretationssoftware für das LC-System, die mit Fourier-Transformations- und Ionenfallen-Massenspektrometern verbunden ist.
- Öffnen Sie die Tune Plus-Software, um eine Tune-Datei für die MS-Methode zu bearbeiten.
- Öffnen Sie in der Menüleiste Datei eine vorinstallierte Tune-Datei im negativen Modus.
- Wählen Sie in der Menüleiste ScanMode und dann Scanfenster definierenaus. Stellen Sie die Microscan-Zeiteinstellung für MSn sowohl für Ionenfalle als auch für FT auf 1 ein.
- Gehen Sie zu den Einstellungen für Nano-ESI Source und stellen Sie die Sprühspannung auf 4 kV ein. Modulieren Sie dies, bis ein akzeptables Elektrospray erzeugt wird; typischerweise kann ein akzeptables Elektrospray im Bereich von 2-5 kV erreicht werden.
- Speichern Sie die Tune-Datei.
- Generieren Sie eine neue LC-Methode mit dem Setup-Assistenten der Datenerfassungs- und Interpretationssoftware des Instruments. Öffnen Sie den Assistenten für die Einrichtung > von Roadmap > Sequenz. Da für diese Methoden keine Säulenheizung erforderlich ist, überspringen Sie den Schritt Temp Control.
- Wählen Sie unter Optionen für Strömungsgradientenpumpedie Option Multistepaus. Fügen Sie im nächsten Fenster 7 Zeilen ein und stellen Sie die Durchflussrate für jede Zeile auf 0,1 mL·min-1ein. Geben Sie die folgenden Parameter für jede Zeile ein: von 0-3 min, liefern Sie 100% Lösungsmittel A; von 3-9 min einen Gradienten von 100% Lösungsmittel A bis 20% Lösungsmittel B einführen; von 9-19 min einen neuen Gradienten von 20% Lösungsmittel B bis 100% Lösungsmittel B einführen; von 19-27 min, bei 100% Lösungsmittel B halten; von 27-28 min, stellen Sie den Gradienten auf 100% Lösungsmittel A zurück; von 28-44 min, spülen und überholen Sie die Säule für nachfolgende Durchläufe, indem Sie bei 100% Lösungsmittel A halten. Schließen Sie einen letzten Schritt ein, um die Durchflussrate nach Abschluss des Laufs auf 0,03 ml-1 zu senken, um das Lösungsmittel zu konservieren, wenn der LC nicht verwendet wird.
- Wenden Sie die Standardeinstellungen für die Sampler-Optionen > Pumpendruck als Erfassungsoption an, und verwenden Sie die Standarderfassungszeit und die Optionen Standardpumpendruck.
- Erstellen Sie eine MS/MS-Methode, indem Sie das Orbitrap Velos Pro MS-Symbol in der Seitenleiste des Fensters Instrumenteneinrichtung auswählen.
- Klicken Sie auf Neue Methode > Datenabhängige MS/MS. Legen Sie die Erfassungszeit auf die Länge des LC-Laufs (d. h. 44 min), Segment auf 1 und Scanereignisse auf 11 fest. Wählen Sie für Datei optimieren die bearbeitete Datei aus Schritt 8.1 aus.
HINWEIS: Das erste Ereignis ist ein MS1-Vorläuferscan mit dem Fourier Transform MS (FTMS). Die folgenden 10 Ereignisse sind MS2-Scans, bei denen die 10 intensivsten und eindeutigsten Ionen in jedem Vorläuferscan für ms2-Fragmentierung ausgewählt werden. - Setzen Sie für Ereignis 1 unter Scanbeschreibung Analyzer auf FTMS und Polarity auf Negativ. Verwenden Sie unter MSn-Einstellungen eine Auflösung von 30.000 und eine normalisierte Kollisionsenergie von 35 V. Stellen Sie die Scanbereiche auf 50 m/z für die erste Masse und 1800 m/z für die letzte Masse ein, um kleine Moleküle einzufangen.
- Legen Sie für die Ereignisse 2 bis 11 unter Scanbeschreibung Analyzer auf Ionenfalle fest. Wählen Sie Abhängiger Scan und klicken Sie auf Einstellungen > Globale > Dynamischer Ausschluss und wählen Sie Aktivieren; Legen Sie eine Wiederholungsdauer von 30 s und eine Ausschlussdauer von 120 s fest, um wiederholte Scans in der Nähe zu vermeiden.
- Gehen Sie zu Scanereigniseinstellungen und legen Sie Mass Determined from Scan Event für alle MS2-Ereignisse (2 bis 11) auf 1 fest. Um nach den Top 10 der intensivsten Ionen zu suchen, stellen Sie jedes MS2-Scanereignis so ein, dass einn- und intensivstes Ion vom 1. bis zum 10. Ion erkannt wird. Legen Sie daher Ereignis 2 fest, um 1 als das n-ten intensivste Ion zu erkennen, Ereignis 3, um 2 zu erkennen, und so weiter.
- Schließen Sie das Setup-Fenster und gehen Sie zu Datei > Speichern unter [Method_Name].meth.
HINWEIS: Informationen zur allgemeinen Verwendung, Wartung und Kalibrierung des LC-Instruments und des Massenspektrometers finden Sie in den Bedienungsanleitungen und Handbüchern des Herstellers.
- Klicken Sie auf Neue Methode > Datenabhängige MS/MS. Legen Sie die Erfassungszeit auf die Länge des LC-Laufs (d. h. 44 min), Segment auf 1 und Scanereignisse auf 11 fest. Wählen Sie für Datei optimieren die bearbeitete Datei aus Schritt 8.1 aus.
9. Einrichten einer Laufsequenz und Starten des LC-MS/MS-Laufs.
- Richten Sie eine Run Sequence mit der Datenerfassungs- und Interpretationssoftware des LC-MS/MS-Systems ein. Klicken Sie in Roadmap > Sequence Setupmit der rechten Maustaste auf die Tabelle, um so viele Zeilen wie Samples einzufügen. Stellen Sie für jede Zeile den Inj Vol auf 5 μL und die Position auf die jeweilige Position der Durchstechflasche im Autosampler-Fach ein. Geben Sie Dateinamen als Beispielnamen ein und legen Sie den gewünschten Dateipfad für die Ausführungsergebnisse fest.
HINWEIS: Leere Fläschchen, die Lösungsmittel A enthalten, können zu Beginn der Sequenz und zwischen jedem Satz dreifacher Proben (jeder Satz von Zeitpunkten) ausgeführt werden, um die Säule zu spülen. - Um den Lauf zu starten, markieren Sie alle Dateinamen in der Sequenz. Wählen Sie in der Menüleiste Aktionen > Ablauffolge ausführen > OKaus.
10. Konsolidieren von Dateien und Suchen nach vorläufigen Anmerkungen auf MZmine 2.53.
- Öffnen Sie MZmine und importieren Sie die Ausgabedateien ".raw" aus Schritt 9.1. Wählen Sie in der Menüleiste Rohdatenmethoden > Rohdatenimportaus. Wählen Sie die Dateien aus, die den Beispielen entsprechen.
- Erstellen Sie eine Liste von Peaks, die zwischen MS1- und MS2-Scans unterscheiden. In der Menüleiste werden Rohdatenmethoden > Featureerkennung > MS/MS Peaklist Builder angezeigt. Relevante Einstellungen sind m/z Window auf 0,01 gesetzt und Time Window auf die Länge des Laufs eingestellt. Wählen Sie unter Filter festlegen die Option Negativ als Polarität und Zentriert als Spektrumtyp aus.
- Wechseln Sie in der Menüleiste zu Featurelistenmethoden > Featureerkennung > Peak Extender. Legen Sie die m/z-Toleranz auf 0,005 m/z oder 10 ppm und die Mindesthöhe auf 1E3 fest. Dieser Schritt wird vollständig ausgearbeitete Spitzen erzeugen.
- Entfernen Sie doppelte Spitzen. Wechseln Sie zurück zu Featurelistenmethoden > Filtern > Duplikatspitzenfilter. Zu den relevanten Einstellungen gehören die m/z-Toleranz auf 0,005 m/z oder 10 ppm und die RT-Toleranz auf 5 min.
- Um Peaks in ähnlichen Datendateien (d. h. denen von dreifachen Reaktionen) auszurichten, kehren Sie zu Feature List Methods > Normalization > Retention Time Calibrationzurück. Achten Sie darauf, dreifache Proben zusammen zu verarbeiten und Leerzeichen wegzulassen. Zu den relevanten Einstellungen gehören m/z Toleranz auf 0,005 m/z oder 10 ppm, RT-Toleranz auf 3 min absolut (min) und Minimale Standardintensität auf 1E3 festgelegt.
- Richten Sie Spitzen aus allen Dateien nach m/z und die Aufbewahrungszeit aus Feature List Methods > Alignment > RANSAC Aligner aus. Legen Sie die m/z-Toleranz auf 0,005 m/z oder 10 ppm, die RT-Toleranz und die RT-Toleranz nach der Korrektur auf 44 bzw. 39 min, die RANSAC-Iterationen auf 0, die Mindestanzahl der Punkte auf 10 % und den Schwellenwert auf 1 fest. Aktivieren Sie die Option Gleichen Ladezustand erforderlich.
- Korrigieren Sie alle Datenpunkte, die in früheren Schritten in Feature List Methods > Gap Filling > Peak Finderverloren gegangen sind. Zu den relevanten Einstellungen gehören intensitätstoleranz auf 50 %, m/z Toleranz auf 0,005 m/z oder 10 ppm und RT-Toleranz auf 3 min. Aktivieren Sie die RT-Korrektur.
11. Berechnung negativer Modenmassen von 13C-markierten Glucose-abgeleiteten Metaboliten und Suche nach den m/z-Merkmalen dieser Analyten in gefilterten Daten.
- Berechnen Sie die Massen von 13C-markierten Metaboliten aus dem Glukosestoffwechsel für die gezielte Suche.
- Berechnen Sie die monoisotopische Masse jeder Zielverbindung aus der Anzahl der Atome in der Summenformel der Verbindung und den monoisotopen Massen jedes Elements20.
- Berechnen Sie die negative Modenmasse [M-H] der Verbindung, indem Sie die Masse von 1 Proton (1,007276 Da) von der monoisotopen Masse subtrahieren. Dies ist die Masse, die durch die Ms-Detektion im negativen Modus nachgewiesen wird, nachdem Moleküle während der Ionisation von einem Wasserstoffion befreit wurden.
- Berechnen Sie aus der Masse des negativen Modus die Masse des 13C-integrierenden Metaboliten. Hier wurden die Massen von Isotopologen berechnet, die maximal Glukose-abgeleitete 13C-Markierungen enthalten.
- Verwenden Sie berechnete Massen von 13C-markierten Metaboliten, um m/z-Merkmale aus MZmine-Ergebnissen zu suchen und zu kommentieren. Berechnen Sie für jeden möglichen Treffer den Massenfehler (ppm) mit der folgenden Gleichung:
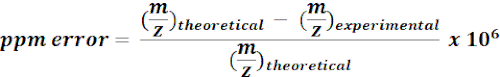
HINWEIS: Experimentelle m/z-Werte mit <15 ppm Massenfehler wurden in der aktuellen Analyse als mutmaßliche Annotationen betrachtet. - Überprüfen Sie manuell die Spektren mutmaßlicher Anmerkungen in einem Qualitätsbrowser, um Anmerkungen zu bestätigen.
- Öffnen Sie Roadmap > Qual Browser. Öffnen Sie in der Symbolleiste die Option Raw-Datei, um MS-Rohdaten jedes Beispiels zu importieren.
- Zeichnen Sie eine Linie unter dem gewünschten Bereich der Retentionszeiten (d. h. entsprechend der mutmaßlichen Anmerkung) auf dem Gesamtionenchromatogramm (oberes Panel), um ein Massenspektrum anzuzeigen (unteres Panel). Klicken Sie mit der rechten Maustaste auf das Spektrum und geben Sie einen Massenbereich ein, der die m/z des Zielanalyten umfasst. Überprüfen Sie, ob die mutmaßlichen Annotationen deutliche Spitzensignale aufweisen, die deutlich über dem Rauschen liegen (Ergänzende Abbildung 2).
- Berechnen Sie die durchschnittlichen Spitzenbereiche und die Standardfehler positiver Annotationen über biologische Replikate hinweg für jeden Zeitpunkt. Visualisieren Sie die Daten (z. B. in einem Balkendiagramm), um Trends im Glukosestoffwechsel zu beobachten.
Ergebnisse
Zur Quantifizierung der lysatbasierten zellfreien Synthese gängiger Fermentationsprodukte aus Glukose wurden Lysate aus Stämmen, die in 2xYPTG-Medien gezüchtet wurden, mit 100 μM Glukose als primäre Kohlenstoffquellegefüttert 8. Reaktionen wurden über einen 24-Stunden-Verlauf durch Proteinversauerung gestoppt. Gefilterte Überstände, die Pyruvat, Succinat, Laktat, Formiat, Acetat und Ethanol aus Glukosekatabolismus enthielten, wurden auf das Autosamplermodul eines HPLC-Systems geladen, das mit einem RID-Modul ausgestattet war. Durchstechflaschen mit gefilterten Mischungen fermentativer Endprodukte und Glukose bei 1,17 μM, 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM und 150 μM Konzentrationen im S30-Puffer wurden als Standard auf das Gerät geladen. Analyten wurden isokratisch von einer HPLC-Säule in die RID eluiert. Peaks für Glukose, Succinat, Laktat, Formiat, Acetat und Ethanol im Bereich von 1 bis 150 μM konnten durch RID aufgelöst werden. Peakflächen für Glukose wurden durch manuelle Integration aus den RID-Daten für Zeitverlaufs- und Standardkurvenproben abgeleitet. Extrahierte Spitzenbereiche für Succinat, Laktat, Formiat, Acetat und Ethanol wurden aus automatisch integrierten Signalen entnommen. Alle Standardkurven (Peakfläche vs. bekannte Konzentration) hattenR2-Werte >0,99 und waren linear über den gesamten hier verwendeten Konzentrationsbereich.
Molare Konzentrationen für alle Zielanalyten wurden aus ihren jeweiligen Standardkurven berechnet. Glukose wurde innerhalb der ersten 3 h der Reaktion verbraucht und hauptsächlich zu Laktat fermentiert (Abbildung 2A, B). Die Ethanolakkumulation trat auch signifikant innerhalb der ersten 3 Stunden der Reaktion auf und stoppte danach (Abbildung 2C). Die Beobachtung einer signifikanten Laktat- und Ethanolproduktion mit signifikantem Glukoseverbrauch nach 3 h war nicht beispiellos, da Laktat- und Ethanolproduktionswege die Regeneration von 1 Netto-mol NAD+ aus glykolytischem NADH ermöglichen, das für den fortgesetzten Glukoseverbrauch durch Glykolyse erforderlich ist (Abbildung 1). Laktat und Ethanol können daher als die wichtigsten Fermentationsendprodukte im zellfreien Glukosestoffwechsel auf Lysatbasis angesehen werden. Acetat war in den Reaktionen zunächst als Bestandteil des S30-Puffers vorhanden und akkumulierte unerwartet erst nach 6 h durch Stoffwechsel, wenn sich der Glukoseverbrauch verlangsamt hatte (Abbildung 2D). Dieses Ergebnis deutet darauf hin, dass die Acetatfermentation nicht unbedingt einen schnellen glykolytischen Fluss in früheren Zeitpunkten ermöglicht. In der Zwischenzeit wurden Formiat und Succinat als kleinere Fermentationsprodukte synthetisiert (Abbildung 2E,F). Insgesamt ermöglichte das Verfahren die absolute Quantifizierung der Zuckersubstraterschöpfung und der fermentativen Produktbildung in E. coli S30-Lysaten.
Hier wurde der MS-Nachweis zum Profil des Lysatglukosestoffwechsels speziell angewendet. Lysate, die aus Stämmen gewonnen wurden, die in 2xYPTG-Medien gezüchtet wurden, wurden mit 13C6-Glukoseals Kohlenstoffquelle gefüttert. CFME-Reaktionen wurden in dreifacher Ausfertigung für 0 h, 1 h, 2 h und 3 h durchgeführt. Proben von jedem Zeitpunkt wurden auf ein LC-System geladen, das mit einer Umkehrphasensäule ausgestattet und mit Fourier-Transformations- und Ionenfallen-Massenspektrometern gekoppelt war. Negative Ionenmodusspektren wurden erhalten und verarbeitet, um organische Säuren, Zuckerphosphate und Aminosäuren zu analysieren. Berechnete theoretische Massen von 13C-markierten Spezies, die zum zentralen Kohlenstoffstoffwechsel gehören, wurden durchsucht, um spezifisch glukosebasierte Verbindungen zu identifizieren. Basierend auf den verwendeten Quellstammkultivierungsbedingungen und früheren Berichten über aktive Signalwege in E. coli CFME wird hier angenommen, dass das Lysatproteom ein metabolisches Netzwerk umfasst, das Glukose in die glykolytische Fermentation einspeist, den Pentosephosphatweg und möglicherweise Aminosäureanabolismus5,6,7,8,14 ( Abbildung1). Daher wurde die Suche auf Mitglieder dieser Signalwege eingegrenzt, von denen 16 Metaboliten, die glucose-abgeleitete 13C-Markierungen enthielten, eindeutig annotiert waren (Ergänzende Tabelle 1).
13 C6-Glucosewurde durch Glykolyse beobachtbar verbraucht, wie die Schwankungen der glykolytischen Zwischenhäufigkeiten belegen ( Abbildung3A-E). In Übereinstimmung mit den HPLC-RID-Daten akkumulierte sich Glukose zu 13C3-Laktatund wurde innerhalb der ersten3h der Reaktion auch zu 13C3-Succinat fermentiert(Abbildung 4A,B). Die Bildung von 13C3-Succinat-Isotopologen unterstützt das vorgeschlagene Modell des Lysatglucosestoffwechsels (Abbildung 1), bei dem Succinat wahrscheinlich durch die Carboxylierung von 3-Kohlenstoffphosphosphoenolpyruvat (PEP) -Molekül und nicht durch den Eintritt eines 2-Kohlenstoff-Acetyl-CoA-Moleküls in den TCA-Zyklus erzeugt wird. Eine Aktivierung des TCA-Zyklus wurde in früheren CFME-Studien angenommen, aber andere 13C-markierte Zwischenprodukte von TCA wurden hier nicht nachgewiesen8,19,21. 13 Die C3-Aspartatsynthese fand jedoch innerhalb des ersten h statt und wurde verbraucht, was die Idee verstärkte, dass PEP direkt in Oxalacetat umgewandelt wird (Abbildung 1, Abbildung 6C). Die Daten spiegeln ein Lysatproteom aus Quellstämmen wider, die während des fermentativen Wachstums auf glukosereichen Medien (2xYPTG) geerntet wurden. Dies würde weiter bedeuten, dass der Rest der TCA-Enzyme, die nicht an der Succinatproduktion beteiligt sind, einen oxidativen TCA-Zweig bilden (Abbildung 1). Keiner der Metaboliten in diesem Signalweg wurde jedoch nachgewiesen, möglicherweise weil hohe Konzentrationen von Glutamat, die der CFME-Reaktion als Salzgegenion zugesetzt wurden, das Fortschreiten dieses Zweiges verhindern.
Die HPLC-RID-Daten werden zusätzlich durch das Fehlen eines 13C2-Acetat-Nachweises innerhalb des 3-h-Reaktionszeitrahmens ergänzt, was darauf hindeutet, dass sich bis zu 3 h kein Acetat aus Glukose ansammelt(Abbildung 2B). Der direkte Vorläufer von Acetat, Acetylphosphat (Acetyl-P), hat sich jedoch angesammelt, was darauf hindeutet, dass der Pta-Arm des Pta-AckA-Signalwegs zur Acetatsynthese aus Acetyl-CoA aktiv ist (Abbildung 4C, D). Die AckA-katalysierte Dephosphorylierung von 13C2-Acetyl-Pzu 13C2-Acetattritt wahrscheinlich nicht innerhalb dieses Zeitrahmens auf, da Acetat ein Hauptbestandteil des in den Reaktionen verwendeten S30-Puffers ist ( Abbildung1, Abbildung 2B).
Die Einarbeitung von 13C6-Glucose-abgeleiteten Kohlenstoffen zu den Zuckerphosphaten 6-Phosphogluconolacton (6PGL), 6-Phosphogluconat (6PG), Ribulose-5-phosphat (Ru5P) und Sedoheptulose-7-phosphat (S7P) wurde ebenfalls beobachtet (Abbildung 5). Diese Ergebnisse bestätigen die Beteiligung des Pentosephosphatwegs am Lysatglukosestoffwechsel und füttern wahrscheinlich die 13C9-Tyrosinsynthese, die zuvor durch eine proteomische Studie vorgeschlagen wurde, während sie auch eine Vorstufe für die 13C5-Histidinproduktionliefern (Abbildung 6A, B)7. Markiertes Phenylalanin und Tryptophan wurden hier nicht beobachtet, ebenso wenig wie die meisten essentiellen Aminosäuren. Dies ist jedoch nicht ganz überraschend, da der Aminosäureanabolismus wahrscheinlich in Lysaten angereichert wird, die aus Zellen gewonnen werden, die unter nährstoffarmen Bedingungen oder in der stationären Phase7,22gezüchtet wurden . Darüber hinaus deuten die bisherigen Daten darauf hin, dass Zwischenprodukte der Glykolyse und Fermentation in Richtung cofaktorregenerierender Endreaktionen geleitet werden, die die Synthese vieler Aminosäuren aus Glyceraldehyd-3-phosphat, Pyruvat und Acetyl-CoA (d. h. Glycin, Cystein, Serin, Alanin, Valin, Leucin und Lysin) ausschließen müssen (Abbildung 1). Wie bereits erwähnt, wurde innerhalb der ersten Stunde 13C3-Aspartatproduziert, während aus Aspartat abgeleitete 13C-integrierende Aminosäuren (d. H. Threonin, Isoleucin, Methionin und Asparagin) möglicherweise nicht beobachtet wurden, weil aus Glukose gewonnenes Aspartat an der Fermentation beteiligt ist ( Abbildung1, Abbildung 6C). Schließlich könnte der Fluss in Richtung markiertem Glutamat und aus Glutamat gewonnenen Aminosäuren durch hohe Glutamatspiegel in der Reaktionsumgebung behindert worden sein (Abbildung 1).
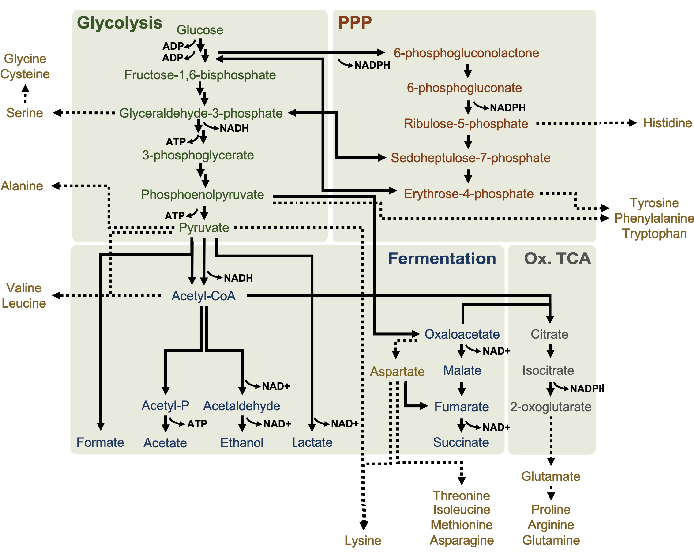
Abbildung 1: Ein mutmaßliches Stoffwechselmodell von Lysaten, abgeleitet von E. coli BL21DE3-Star, die in hohen Glukosekonzentrationen exponentiell wachsen. Zwischen- und Endprodukte der Glykolyse (grün), des Pentosephosphatweges (dunkelorange) und fermentativer Wege (blau) aus Acetyl-CoA wurden bei CFME auf Lysatbasis berichtet. Das Vorhandensein von Succinatfermentation impliziert die Aktivierung des oxidativen TCA-Zweigs (grau). Aminosäureanabolismus (Gold) in Lysaten ist nicht genau definiert und wird hier untersucht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
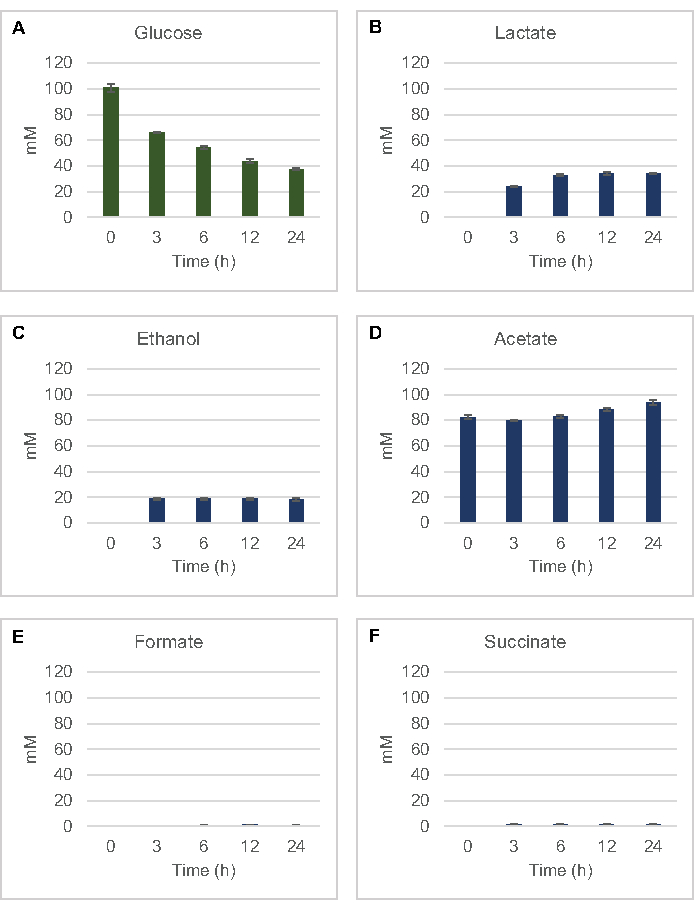
Abbildung 2: HPLC-RID-Daten für den Glukoseverbrauch und die fermentative Endproduktsynthese in CFME-Reaktionen, die mit E. coli-Rohextrakten hergestellt wurden. (A) Glukoseverbrauch und (B) Laktat, (C) Ethanol, (D) Acetat, (E) Formiat und (F) Succinatproduktion in CFME-Reaktionen wurden über 24 h überwacht. Dargestellt werden durchschnittliche mM-Konzentrationen und Fehlerbalken (SE), die mit Standardkurven quantifiziert wurden (n = 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
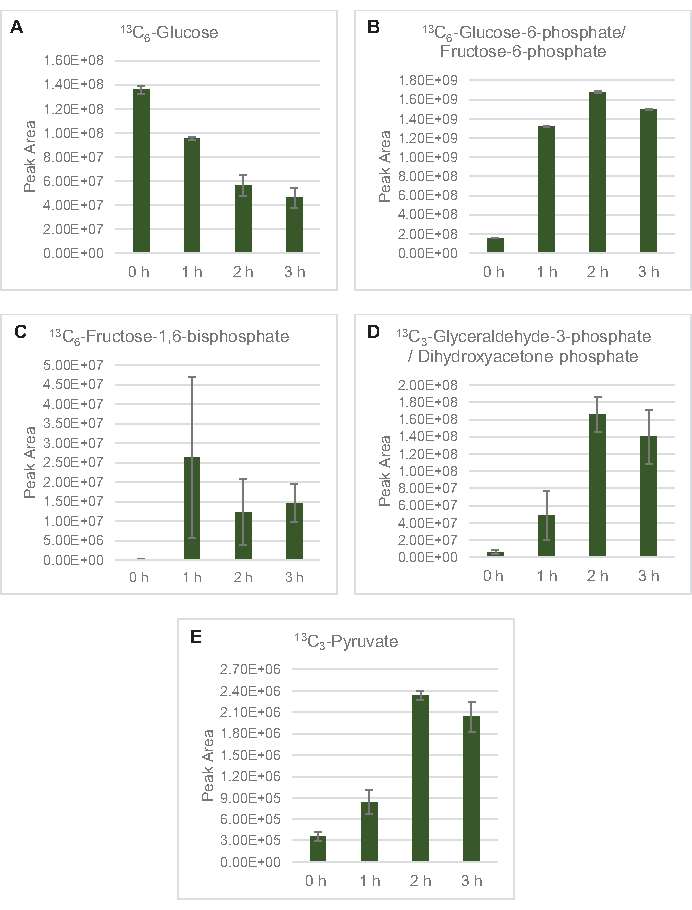
Abbildung 3: Zeitverlaufstrends von 13C6-Glucoseund 13C-markierten glykolytischen Zwischenprodukten in E. coli lysat CFME. Relative Häufigkeiten von(A) 13C6-Glucose,(B) 13C6-Glucose-6-phosphat/Fructose-6-phosphat,(C) 13C6-Fructose-1,6-bisphosphat, (D) 13C3-Glyceraldehyd-3-phosphat / Dihydroxyacetonphosphat und (E) 13C6 -Pyruvat bei CFME-Reaktionen über 3 h. Rohe Peakflächen, die von der mzMINE-Software extrahiert wurden, wurden verwendet, um Durchschnittswerte und Fehlerbalken (SE) für positive Annotationen (n = 3) zu berechnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Zeitverlaufstrends von Zwischen- und Endprodukten in 13C6-Glukosefermentation in E. colilysat CFME. Relative Häufigkeiten von (A) 13C3-Laktat,(B) 13C3-Succinat, (C) 13C2-Acetylphosphat und (D) 13C2-Acetyl-CoA in CFME-Reaktionen über 3 h. Rohe Peakflächen, die von der mzMINE-Software extrahiert wurden, wurden verwendet, um Durchschnittswerte und Fehlerbalken (SE) für positive Annotationen (n = 3) zu berechnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
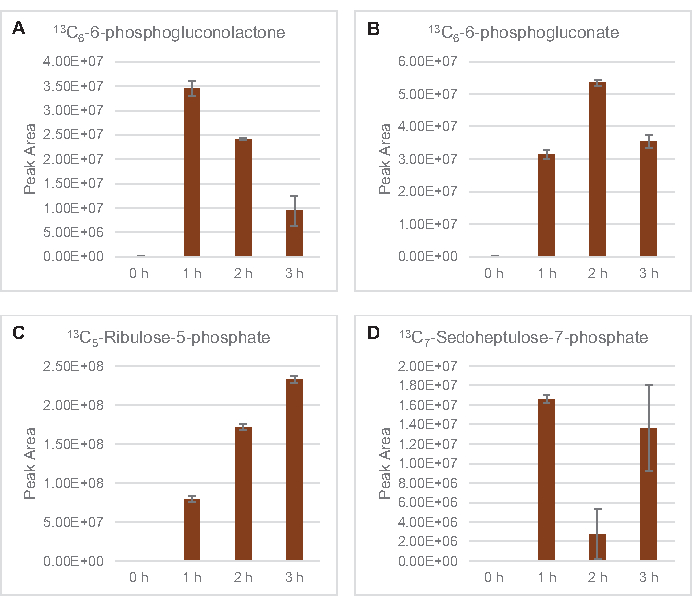
Abbildung 5: Zeitverlaufstrends von 13C6-Glucose-abgeleiteten Pentosephosphat-Signalweg-Zwischenprodukten in E. colilysat CFME. Relative Häufigkeiten von (A) 13C6-6-phosphogluconolacton, (B) 13C6-6-phosphogluconat, (C) 13C5-Ribulose-5-phosphatund (D) 13C7-sedoheptulose-7-phosphat über 3 h. Rohe Peakflächen, die von der mzMINE-Software extrahiert wurden, wurden verwendet, um Durchschnittswerte und Fehlerbalken (SE) für positive Annotationen (n = 3) zu berechnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
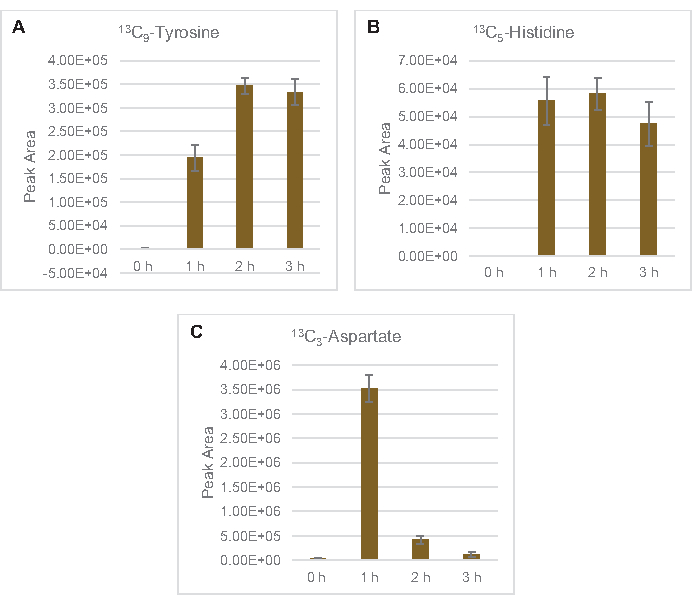
Abbildung 6: Zeitverlaufstrends der nachgewiesenen 13C6-Glucose-abgeleiteten Aminosäuren in E. colilysat CFME. Relative Häufigkeiten von (A) 13C9-Tyrosin, (B) 13C5-Histidinund (C) 13C3-Aspartat über 3 h. Rohe Peakflächen, die von der mzMINE-Software extrahiert wurden, wurden verwendet, um Durchschnittswerte und Fehlerbalken (SE) für positive Annotationen (n = 3) zu berechnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Repräsentatives HPLC-RID-Chromatogramm, das Spitzen für wichtige fermentative Produkte in einer CFME-Reaktion zeigt, die bei 37 °C für 24 h inkubiert wurde. Glukose-, Succinat-, Laktat-, Formiat-, Acetat- und Ethanolpeaks sind durch ihre Retentionszeiten auf einer HPLC-Säule während der isokratischen Elution mit 5 mM Schwefelsäurelösungsmittel ausreichend unterscheidbar. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Repräsentative Massenspektren für 13C-markierte Metaboliten, insbesondere (A) Laktat, (B) Glukose und (C) 6-Phosphogluconat (6PG) in einer CFME-Reaktion, die bei 37 °C für 1 h inkubiert wurde.
Ergänzende Tabelle 1: Liste der nachgewiesenen 13C-markierten Metaboliten, Retentionszeiten (abgestimmt auf Die Proben mit MZmine), theoretische vollständig 13C-markierte negative Mode m/z-Werte, m/z-Werte der erkannten Merkmale und berechnete Massenfehler. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Der skizzierte HPLC-RID-Ansatz kann verwendet werden, um den Zuckersubstratverbrauch und die anschließende Umwandlung in wichtige organische Säure- und Alkoholprodukte des zentralen Lysatstoffwechsels im Laufe der Zeit erfolgreich zu quantifizieren. Darüber hinaus verwendet dieses Protokoll eine einfache isokratische Methode mit einer einzigen mobilen Phase, erfordert eine minimale Probenvorbereitung und ermöglicht eine einfache gezielte nachgelagerte Analyse. Analyten, die mit der HPLC-RID-Methode gemessen werden, unterscheiden sich ausschließlich durch ihre Retentionszeiten und damit ihre Wechselwirkungen mit dem ausgewählten Säulenharz. Die hier verwendete HPLC-Säule wurde speziell entwickelt, um Kohlenhydrate, organische Säuren und Alkohole durch Kombination von Größenausschluss und Ligandenaustausch (d. H. Ionenmoderierte Partitionschromatographie) zu trennen. Die beschriebene Methode ist daher nützlich für eine gezieltere Analyse von Kohlenhydratsubstraten und ausgewählten Endprodukten von Glukosefermentationswegen, von denen erwartet wird, dass sie in erster Linie lysatbasierte Biotransformationen erleichtern und energetisieren8,15,21. Dieses Protokoll berücksichtigt jedoch nicht die Aktivierung anderer Stoffwechselwege in Zellextrakten. Pipelines, die andere chromatographische Trenntechniken (z. B. hydrophile Interaktionschromatographie), Gradientenelutionsmethoden, kompliziertere Probenvorbereitung (d. h. Derivatisierung) und verschiedene optische Detektoren (z. B. ultraviolettes Licht oder Verdunstungslichtstreudetektoren) verwenden, könnten verwendet werden, um andere Metaboliten wie Aminosäuren und Zuckerphosphate nachzuweisen23,24 . Alternativ kann ein globaler Ansatz zur Untersuchung des Lysatstoffwechsels mit LC-MS / MS verfolgt werden.
Die beschriebene LC-MS/MS-Methode ist ein einziger Workflow zur Messung und Identifizierung eines breiteren Spektrums von Metaboliten. LC-MS/MS ist ein hochmodernes Analysewerkzeug für die Metabolomprofilierung aufgrund seiner Empfindlichkeit und Fähigkeit, Metaboliten durch Retentionszeit und m/z-Verhältnisse mit hoher Auflösung zu unterscheiden16. Mit einem Fokus auf zentrale Kohlenstoffstoffwechselwege und Aminosäureanabolismus wurde der negative Modus MS / MS implementiert, um polare organische Säuren, Zuckerphosphate und Aminosäuren spezifisch nachzuweisen. In Verbindung mit einer Nano-Flüssigkeitschromatographie-Technik bietet die Methode eine hohe Empfindlichkeit für den Nachweis kleiner Moleküle im komplexen Lysathintergrund17. In Bezug auf die Profilierung des lysatbasierten CFME-Stoffwechsels ist eine Einschränkung des beschriebenen LC-MS/MS-Protokolls jedoch seine untere Nachweisgrenze von 50 m/z, die die Messung von Ethanol, einem Hauptprodukt im Lysatglukosestoffwechsel, sowie von Formiaten, die beide ansonsten leicht durch die detaillierte HPLC-RID-Methode quantifiziert werden können, ausschließt. Im Vergleich zu LC-MS/MS hat HPLC-RID den zusätzlichen Vorteil der relativen Zugänglichkeit in Bezug auf Kosten und Schwierigkeitsgrad. Bis zum letzten Punkt kann die Fehlerbehebung bei der hier beschriebenen LC-MS/MS-Methode ein gewisses Maß an Fachwissen in der Massenspektrometrie erfordern. Nichtsdestotrotz hat der MS-Nachweis einzigartig attraktive Anwendungen über RID, da er zusätzlich markierte Isotope in Metabolomen unterscheiden kann, eine ausgezeichnete Technik zum Verständnis der Kohlenstoffbewegung von ergänzten Substraten durch das komplexe Lysat-Stoffwechselnetzwerk18. Ein solcher Ansatz wurde hier angewendet, indem Reaktionen mit 13C6-Glucoseergänzt und die relativen Abundanzwerte von nachgeschalteten 13C-integrierenden Metaboliten analysiert wurden. Die Analyse ermöglichte die Definition von aktiven und inaktiven Signalwegen, unterstützte zuvor berichtete Annahmen und lieferte neue Erkenntnisse über den metabolischen Fluss in Lysaten. Modifikationen können auch innerhalb der Methode für spezifische Analysen vorgenommen werden. Beispielsweise können Standardlösungen von 13C-markierten Zielverbindungen zusammen mit Proben analysiert werden, um absolute quantitative Messungen von Glukosemolekülen im Laufe der Zeit zu erreichen und Rückschlüsse auf Flussverteilungen zu ziehen. Eine bessere Erkennung von positiv geladenen Verbindungen kann auch innerhalb des aktuellen Workflows ermöglicht werden, indem Sequenzen mit .meth-Dateien ausgeführt werden, die für die Erkennung des positiven Modus angepasst sind.
Die analytische Probenahme in beiden beschriebenen Methoden ist komfortabel automatisiert, was eine hohe Reproduzierbarkeit gewährleistet. Darüber hinaus können reibungslose Analyseläufe erwartet werden, solange die ordnungsgemäße Handhabung und Wartung der Instrumente eingehalten wird. Bei der Verwendung dieser Werkzeuge zur Analyse von CFME-Reaktionen sollten kritischere Überlegungen vor und nach der Probenahme angestellt werden. Bei der Probenvorbereitung ist es wichtig, dass Zeitverlaufskontrollen repräsentativ für Zeit-Null sind. Hier wurden Proteine in Lysaten durch Übersäuerung gefällt, um Stoffwechselreaktionen zu stoppen. Für Zeit-Null-Proben wurde das saure Lösungsmittel mit Lysat kombiniert, bevor das glukosehaltige Reaktionsgemisch hinzugefügt wurde. Die Ansäuerung mit Trichloressigsäure stellte effektiv sicher, dass Glukose nicht zum Zeitpunkt Null metabolisiert wird, wie in den HPLC-RID-Daten gezeigt (Abbildung 2). Während in der berichteten LC-MS/MS-Analyse ein ähnliches Verfahren zum Abschrecken des Glukosestoffwechsels durchgeführt wurde, wurden 13C-markierte Metaboliten in Zeit-Null-Proben nachgewiesen, wenn auch mit signifikant niedrigen Abundanzwerten im Vergleich zu Proben, die zu späteren Zeitpunkten extrahiert wurden. Darüber hinaus beschränkten sich diese Beobachtungen auf Zwischenprodukte der Glykolyse. Die Daten deuten darauf hin, dass die Reaktionen nach der Übersäuerung mit dem Extraktionslösungsmittel, das mit dieser hochempfindlichen Methode nachgewiesen wird, ein gewisses Maß an glykolytischer Aktivität beibehalten. Das Ausmaß dieser Aktivität sollte jedoch quantifiziert werden. Eine frühere Studie berichtete, dass saure Extraktionslösungsmittel möglicherweise nicht ausreichend glykolytische Zwischenreaktionen abschrecken, aber einen signifikanten Glukoseverbrauch stoppen können10. Während dies in dem hier verwendeten System noch weiter untersucht werden muss, können drastische Veränderungen der relativen Abundanzwerte zwischen Zeit-Null- und späteren Zeitpunktproben als Trends im Glukosestoffwechsel interpretiert werden. Die Erforschung alternativer Abschreckmethoden wird jedoch in ähnlichen Anwendungen empfohlen, insbesondere zur Gewinnung absoluter Mengen an metabolischen Zwischenprodukten10. Darüber hinaus sollten auch bei nachgelagerten Softwareanalysen bewährte Verfahren beachtet werden. Konsistenz ist unerlässlich, wenn Spitzenbereiche manuell aus RID-Signalen integriert werden, um menschliche Fehler zu reduzieren. Die manuelle Integration sollte auch auf Spitzenbereiche von Standards angewendet werden, wenn manuell integrierte Spitzenbereiche zur Quantifizierung der Metabolitenkonzentrationen in Proben verwendet werden. Während der gesamten gezielten LC-MS/MS-Analyse sollten vorläufige Anmerkungen aus der MZmine-Analyse durch manuelle Peak-Checking mit einem MS-Qualitätsbrowser validiert werden, und m/z-Features sollten nur dann mit Anmerkungen versehen werden, wenn berechnete Massenfehler akzeptabel sind. Hier wurden diese Analysen manuell für einen begrenzten Satz von Zielen durchgeführt, da eine umfassende und robuste Software für die Isotopensuche noch nicht etabliert ist. Solche automatisierten Methoden zur Suche nach 13C-markierten Metaboliten sind jedoch derzeit im Entstehen und würden auch kompliziertere Analysen rationalisieren, wie z.B. die Profilierung von Lysaten jenseits des zentralen Kohlenstoffstoffwechsels25.
Die fortschrittliche Flüssigkeitschromatographie ist eine robuste und weit verbreitete Methode zur Trennung kleiner Moleküle in komplexen Stoffwechselmischungen11. Die beschriebenen Methoden koppeln diese Trenntechnik mit dem Brechungsindex oder dem massenspektrometrischen Nachweis, um Metabolitenumwandlungen in lysatbasierten CFME-Reaktionen erfolgreich zu analysieren. HPLC-RID und LC-MS/ MS sind individuell leistungsfähige Werkzeuge zur Profilierung des aktiven Lysatstoffwechsels, und ihre Komplementarität kann weiter genutzt werden, um die inhärenten Einschränkungen jeder Technik anzugehen. Die berichteten Methoden ermöglichen die Anwendung und Entwicklung von CFME, da sie verwendet werden können, um den Lysatstoffwechsel zu verstehen, Verbesserungen bei gezielten Metabolitenumwandlungen zu überwachen und Veränderungen des Metabolitenflusses bei der Manipulation des Lysatstoffwechsels aufzuklären.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte bekannt sind.
Danksagungen
Diese Forschung wurde vom Genomic Science Program, U.S. Department of Energy, Office of Science, Biological and Environmental Research, als Teil der Plant Microbe Interfaces Scientific Focus Area (http://pmi.ornl.gov) gesponsert. Das Oak Ridge National Laboratory wird von UT-Battelle, LLC, für das US-Energieministerium im Auftrag DE-AC05-00OR22725 verwaltet. Dieses Manuskript wurde von UT-Battelle, LLC unter Vertrag DE-AC05- 00OR22725 mit dem US-Energieministerium verfasst. Die Regierung der Vereinigten Staaten behält und der Herausgeber erkennt durch die Annahme des Artikels zur Veröffentlichung an, dass die Regierung der Vereinigten Staaten eine nicht ausschließliche, bezahlte, unwiderrufliche, weltweite Lizenz zur Veröffentlichung oder Vervielfältigung der veröffentlichten Form dieses Manuskripts behält oder anderen gestattet, dies für Zwecke der Regierung der Vereinigten Staaten zu tun. Das Energieministerium wird der Öffentlichkeit Zugang zu diesen Ergebnissen der vom Bund geförderten Forschung in Übereinstimmung mit dem DOE Public Access Plan (http://energy.gov/downloads/doe-public-access-plan) gewähren.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Referenzen
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten