Method Article
כרומטוגרפיה נוזלית בשילוב לאינדקס שבירה או זיהוי ספקטרומטרי מסה ליצירת פרופיל מטבוליט במערכות ללא תאים מבוססות ליסאט
In This Article
Summary
הפרוטוקולים מתארים שיטות כרומטוגרפיה נוזלית בעלות ביצועים גבוהים בשילוב עם אינדקס שבירה או זיהוי ספקטרומטרי מסה לחקר תגובות מטבוליות במערכות מורכבות המבוססות על ליסאט ללא תאים.
Abstract
הנדסת חילוף החומרים התאי עבור biosynthesis ממוקד יכול לדרוש מחזורי תכנון-בניית-מבחן-ללמוד (DBTL) נרחב כמו המהנדס עובד סביב דרישות ההישרדות של התא. לחלופין, ביצוע מחזורי DBTL בסביבות נטולות תאים יכול להאיץ תהליך זה ולהקל על חששות עם תאימות מחשב מארח. גישה מבטיחה להנדסה מטבולית נטולת תאים (CFME) ממנפת תמציות תאים גולמיים פעילים מטבולית כפלטפורמות לביו-נופקשן ולגילוי מהיר של חלבונים ומסלולים מותאמים. מימוש יכולות אלה ומיטוב ביצועי CFME דורש שיטות לאפיון חילוף החומרים של פלטפורמות מבוססות ליסאט ללא תאים. כלומר, כלים אנליטיים נחוצים לניטור שיפורים בהמרות מטבוליט ממוקדות ובהבהרת שינויים בשטף חילוף החומרים בעת מניפולציה של חילוף החומרים של ליסאט. כאן, ניתוחי מטבוליט באמצעות כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) בשילוב עם זיהוי ספקטרומטרי אופטי או מסה הוחלו כדי לאפיין ייצור מטבוליט ושטף ב- E. coli S30 lysates. באופן ספציפי, דוח זה מתאר את הכנת הדגימות מ- CFME lysates עבור ניתוחי HPLC באמצעות זיהוי אינדקס שבירה (RID) כדי לכמת את הדור של מתווכים מטבוליים מרכזיים ותוצרי לוואי בהמרת מצעים בעלות נמוכה (כלומר, גלוקוז) למוצרים בעלי ערך גבוה שונים. ניתוח המרת מטבוליט בתגובות CFME המוזנות עם גלוקוז 13C-שכותרת באמצעות כרומטוגרפיה נוזלית הפוכה בשילוב ספקטרומטריית מסה דו-מושבית (MS/MS), כלי רב עוצמה לאפיון תשואות מטבוליט ספציפיות ושטף מטבולי ליסאט מחומרי התחלה, מוצג גם. בסך הכל, החלת שיטות אנליטיות אלה כדי CFME ליסאט חילוף החומרים מאפשר קידום של מערכות אלה כפלטפורמות חלופיות לביצוע משימות הנדסיות מטבוליות מהירות או חדשניות.
Introduction
מגבלות במיקרואורגניזמים הנדסיים לייצור כימי ניתן לטפל על ידי recapitulating תגובות ביוכימיות במבחנה שבו פונקציות הישרדות הסלולר המתחרים נעדרים1. יתר על כן, סביבת התגובה הפתוחה (כלומר, היעדר קרום התא) נוחה יותר למניפולציה וקלה יותר לניטור בהשוואה לתאים חיים. תפיסה בסיסית זו של הנדסה מטבולית ללא תאים (CFME) הודגמה באלגנטיות על ידי שחזור של מסלולים מטבוליים לסנתז כימיקלים יקרי ערך כמו מימן ומונוטרפנים עם מדדי ייצור בסדרי גודל גבוהים יותר מאשר שהוצגו במפעלי תאים מיקרוביאליים עד כה1,2,3 . שיטות לטיהור מסלולים שלמים, לעומת זאת, מוגבלות כיום על ידי זמן ועלות. לחלופין, מערכות מטבוליות ללא תאים ניתן לגזור תמציות תאים גולמיים באמצעות שיטות מהירות וזולות ביחס לשחזור מסלול שלם4. חילוף החומרים המרכזי שנשמר בתמציות תאים ניתן להשלים עם מצעים אנרגיה (למשל, גלוקוז ו cofactors אנזימטי) ומלחים בפתרונות חוצצים כדי ליצור מבשרי חילוף החומרים המרכזי מעל 24 שעות5,6. הוספת אנזימים אקסוגניים לתגובת CFME המבוססת על ליסאט מאפשרת טרנספורמציות ביולוגיות מורכבות יותר של גלוקוז לכימיקלים בעליערךרב יותר בטיטרים גבוהים 4,6,7. למרות התשואה נוטה להיות בסכנה במערכות אלה בשל המורכבות המטבולית דמוית התא שלהם, שיטות ייחודיות לאצור פרוטאומים lysate להמרת תשואה גבוהה יותר היו מפותחים7,8.
הקלות של ביצוע טרנספורמציות מטבוליות במערכות מבוססות ליסאט ללא תאים הופכת את הפלטפורמות המצוינות האלה להזזת ייצור כימי מחוץ לתא לחלוטין או לאב טיפוס של מסלולים חדשים עם תפוקה גבוהה לפני הבנייה והבדיקה של עיצובים אלה ב- vivo2,9. עבור כל יישום, כלים לניטור המרות מטבוליות או התבוננות בשינויים הכוללים לשטף חילוף החומרים בליזאטים הם חלק בלתי נפרד מהקידום של CFME. ניתן להשתמש בכרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) כדי להפריד בין המרכיבים הכימיים של תגובות CFME ברזולוציה גבוהה וניתן לקשר בין גלאים אופטיים או ספקטרומטריים של מסה לכימות מטבוליט5,10. העיקרון הבסיסי של HPLC הוא שניתוחים מומסים בממס (כלומר, שלב נייד) ושואבים דרך עמודה יקיימו אינטראקציה עם חומר האריזה הספציפי של העמודות (כלומר, שלב נייח)11. בהתאם למאפיינים הכימיים שלהם, ניתוחים אלה מציגים זמני שימור משתנים לפני שהם בסופו של דבר נלקחים מהשלב הנייח ונלקחים על ידי השלב הנייד לגלאי. דוח זה מפרט את ההכנה והניתוח של תגובות CFME מבוססות E. coli lysate באמצעות שיטות מבוססות HPLC הממנפות את זיהוי RID ו- MS/MS.
HPLC בשילוב עם זיהוי אינדקס שבירה (HPLC-RID) היא שיטה נגישה בדרך כלל לזיהוי מהיר של מבשרי חילוף החומרים ומוצרי הקצה המרכזיים. בקצרה, RID מודד כיצד ניתוחים משנים את הסטת האור על ידי שלב12הנייד . אותות RID המתאימים לנתחי יעד בדגימות ניתן לכמת לאחר מכן על-ידי השוואות עם אותות RID של פתרונות סטנדרטיים. ביישומי CFME, נעשה שימוש נפוץ ביותר במצב זיהוי עם עמודות HPLC המפרידות בין תרכובות בהתבסס על שילוב של אי-הכללת גודל ומנגנוני החלפת ליגנד, או כרומטוגרפיה של מחיצה מונחית יונים5,6,8,13. טכניקה מסוימת זו משמשת לכמת במהירות את הצריכה של מצעים סוכר כמו גלוקוז, כמו גם היווצרות של מוצרי תסיסה כמו תמציתי, לקטט, formate, אצטט, ואתנול מבוסס ליסאט תגובות CFME8. הקלטת שינויי הריכוז של תרכובות אלה באמצעות HPLC הייתה שימושית הן להבהרת הפוטנציאל של תמציות תאים גולמיים למאגר מבשרי חילוף החומרים המרכזיים והן בהבנת האופן שבו שטף המסלול מנותב מחדש דרך מסלולים מותססים במהלך המרות מטבוליות מורכבות מגלוקוז בליזאטים6,8,14. מחקרי CFME הזרע ב תמציות תאי E. coli לאשר כי תרכובות תסיסה לצבור כמו מוצרי קצה של קטבוליזם גלוקוז להתרחש גם כמו תוצרי לוואי לא רצויים ליסאטים כי overexpress אנזימים אקסוגניים6,15. הוא הציע כי חילוף החומרים התסיסתי ממלא תפקיד הכרחי בהתחדשות מחדש של cofactors (כלומר, NAD(P)H ו- ATP) כדי לקיים תגובות גליקוליטיות8. לפיכך, שיטת זיהוי אופטי מבוססת HPLC המיועדת להפריד בין מוצרי תסיסה היא כלי שימושי ומוחל בדרך כלל בעת ביצוע משימות CFME שונות המבוססות על ליסאט.
CFME יכול להיות מיושם כדי לצבור מוצרי קצה מטבוליים שאינם פחמימות, חומצות אורגניות, או אלכוהול4. המדידה של ביניים הנצרכים מהר ככל שהם מסונתזים עשוי גם להיות רצוי10. בעוד HPLC-RID נגיש במונחים של עלות וקושי, שיטה זו מוגבלת על ידי יכולתה להבחין רק מטבוליטים בהתבסס על זמן השמירה. ניתן לנתח מגוון רחב יותר של מטבוליטים כאשר כרומטוגרפיה נוזלית מצמידה לזיהוי MS/MS (LC-MS/MS)16. בשיטה זו, ניתוחים בשלב הנייד מיוננים ומזוהים באופן דיפרנציאלי בהתבסס על תכונות המסה והמטען של כל מולקולה. הידע הן על יחס המסה-לטעינה (m/z) של המטבוליט והן על זמן השמירה בעמודה ובכך מאפשר הפרדה בין המתווכים המטבוליים ביותר ומוצרי הקצה ברזולוציה גבוהה16. טכניקת זיהוי זו יכולה להיות מצמידה גם לכרומטוגרפיה ננו-נוזלית, המאפשרת שיעורי זרימה נמוכים בהרבה ונפחי הזרקת מדגם, ומאפשר זיהוי רגיש יותר של מולקולות קטנות ברקע המורכבlysate 17. ניתן להחיל בנוסף את LC-MS/MS עם תיוג איזוטופ מאז תוויות משולבות להקנות שינויים בערכי m/z של ניתוח18. מדידות נקודת זמן שחולצו מתגובת CFME בתוספת מצע גלוקוז 13C6יכול ובכך לקבוע את סוף או תוצרי לוואי נגזר במיוחד גלוקוז תוספת. למרות ששיטת מעקב איזוטופ זו עדיין לא מיושמת בדרך כלל במחקרי CFME, זהו כלי רב עוצמה להבנת המרות מטבוליות במערכות CFME מבוססות ליסאט, במיוחד מאז נגדי מלח (כלומר, אצטט וגלוטמט) בתגובות אלה הם גם קטבוליזם כמו מצעים משניים19. מינוף טכניקה זו יכול אפוא לצייר תמונה מקיפה של חילוף החומרים של גלוקוז בליסאטים, אשר עד היום אינו מובן לחלוטין. כאן, הפרוטוקול מפרט שיטה לכרומטוגרפיה ננו-נוזלית בשילוב ליינון ננו-אלקטרוניקטרוספריי (ננו ESI) MS/MS שניתן להשתמש בה כדי לחקור מודל אפשרי של חילוף חומרים של גלוקוז, במיוחד ב- E. coli lysates (איור 1). המודל מבוסס על דיווחים על מסלולים מותססים ועל מסלול פנטוז פוספט להיות פעיל E. coli lysates נגזר זנים גדל במדיה עשירה5,6,8,14. הטכניקה משמשת גם כדי לחקור את ייצור חומצות אמינו מאז הידע הנוכחי על אנאבוליזם חומצת אמינו מגלוקוז בליזאטים מוגבל לכמה דוגמאות כגון סינתזה של חומצות אמינו ארומטיות7. בהתחשב באופי הקוטבי בעיקר של מוצרי קצה ומתווכים במסלולים אלה (כלומר, חומצות אורגניות, פוספט סוכר וחומצות אמינו), כרומטוגרפיה נוזלית הפוכה נוצלה כאן. טכניקה זו מפרידה בין תרכובות קוטביות על ידי אלגנטיות משלב נייח לא קוטבי. תרכובות אלה היו אז מיוננים על ידי ננו ESI במצב יון שלילי המאפשר זיהוי של ניתוחים עם לפחות מטען אלמנטרי שלילי אחד ולכן הוא שימושי לאיתור תרכובות חומציות. טכניקה זו משמשת כאן כדי לנתח מטבוליטים 13C-שילוב נגזר גלוקוז ומדגים את התועלת של LC-MS/ MS להבנת חילוף החומרים גלוקוז בליסאטים.
Protocol
1. הפעלה, עצירה ועיבוד של תגובות CFME של קורס זמן לכימות HPLC-RID.
- להפשיר בעבר E. coli lysates ולהכין את שאר מרכיבי התגובה על קרח.
הערה: lysates שדווח כאן נגזר E. coli BL21DE3-כוכב גדל ב 2xYPTG (1.8 % גלוקוז) שלב באמצע יומן.- הכן נפח מתאים של מסנן מעוקר (מסנן נקבוביות 0.20 מיקרומטר) S30 חוצץ (1 M Tris-OAc מותאם ל- pH 8.2 עם חומצה אצטית קרחונית, 1.4 M Mg(OAc)2ו- 6 M KOAc).
- הכן תערובת אנרגיה המכילה גלוקוז, מלחי גלוטמט, ATP, קואנזים A, NAD+, חוצץ ביס-טריס ודיפוטסיום פוספט במאגר S30. ריכוזים סופיים בנפח התגובה הרצוי המשמש להכנת תגובות CFME כאן היו 100 mM גלוקוז, 18 mM מגנזיום גלוטמט, 15 mM אמוניום גלוטמט, 195 מ"מ אשלגן גלוטמט, 1 mM ATP, 0.2 מ"מ קואנזים A, 1 mM NAD+, 150 mM ביס-טריס, ו 10 mM דיפוטסיום פוספט.
- שלב את הרכיבים בצינורות מיקרוצנטריפוגה 1.5 מ"ל כדי להכין תגובות סופיות עם 4.5 מ"ג/מ"ל של חלבון ליסאט כולל. כאן, תגובות CFME הוכנו עם כרכים סופיים של 50 μL במשולש לכל נקודת זמן. לדגור את התגובות ב 37 °C (50 °F) עבור מסגרות הזמן המתאימות שלהם.
הערה: עבוד מהר והוסף ליסאט כמרכיב הסופי של תערובת התגובה כדי למנוע תגובות מטבוליות מוקדמות עם מלחי גלוקוז וגלוטמט. צריכת גלוקוז מינימלית יכולה להתרחש בהתאם לכמה זמן תערובות תגובה הם דגירה על קרח. - סיים את התגובות ועיבוד הדגימות עבור ניתוח HPLC-RID.
- כדי לסיים את התגובות המשולשות בנקודות הזמן המתאימות שלהם, מיד להוסיף נפח שווה של 5% חומצה טריכלורואצטית לנפח התגובה הסופי של כל מדגם (כלומר, 50 μL של 5% חומצה טריכלורואצטית לתגובה 50 μL). לדלל כל מדגם עם מים סטריליים ב 2x נפח התגובה (כלומר, 100 μL).
- כדי לשחזר את הזמן אפס, לערבב את אותו נפח של 5% חומצה trichloroacetic כמו נפח התגובה הסופי הכולל (כלומר, 50 μL) עם ליסאט לפני הוספת שאר רכיבי התגובה. שלב החמצה זה מזרז אנזימי ליסאט לפני שהם מטבוליזם משמעותי של גלוקוז.
- מערבולת את הדגימות ואת הצנטריפוגה על microcentrifuge ספסל ב 11,600 x g במשך 5 דקות ולהעביר supernatants המכיל את הניתוחים האורגניים צינורות נקיים. אחסן את הדגימות ב- -20 °C (20 °F) אם ניתוחי HPLC יבוצעו ביום אחר. ודא להפשיר את הדגימות המאוחסנות על קרח לפני שתמשיך לשלב הבא.
- סנן כל סופר-נט עם מסנן נקבוביות של 0.22 מיקרומטר. כחלופה מזרקים, להשתמש מסנני צינור צנטריפוגה צנטריפוגה צנטריפוגה צנטריפוגות ב 16,300 x g במשך 1 דקות.
- מעבירים כל סינון ל בקבוקון זכוכית HPLC נקי. טען בקבוקונים על מגש הדגימה האוטומטית של HPLC.
- הכן דוגמאות ליצירת עקומה סטנדרטית.
- הכן פתרון מלאי של כל ניתוחי היעד מומסים במאגר S30 בכמויות שווימולריות מעל הריכוז ההתחלתי של גלוקוז בתגובות CFME. כאן, תמיסת מלאי המורכבת 150 מיקרומטר גלוקוז, תמציתי, לקטט, formate, אצטט, ואתנול, הוכן. בצע דילול טורי 1:1 (v/v) מפתרון המלאי כדי לקבל פתרונות טריפליקאט 50 μL עם ריכוזים סופיים הנעים בין 0 μM לריכוז המלאי (כלומר, 150 מיקרומטר).
- לדלל כל פתרון עם 50 μL של 5% חומצה טריכלורואצטית ו 100 μL של מים סטריליים. חזור על שלבים 1.3.4-1.3.5.
הערה: הפעל פתרונות ליצירת עקומה סטנדרטית עם כל אצווה של דגימות כדי להבטיח כימות מדויק של ריכוזי מטבוליט.
2. הכנת מערכת HPLC לגילוי מטבוליט.
- מתחת למכסה המנוע של האדים, הכינו תמיסה מעוקרת של 5 מ"מ חומצה גופרתית ממים מעוקרים ומסננים. הוסף ~550 μL של 98% HPLC כיתה פתרון חומצה גופרתית 2 ליטר של מים כדי להכין 5 mM חומצה גופרתית.
אזהרה: חומצה גופרתית היא כימיקל מסוכן, ועבודה מתחת למכסה אדים עם PPE מעבדה מתאים מונעת שאיפה, מגע עם העור ומגע עין. חומצה גופרתית מרוכזת מגיבה במרץ עם מים ויש להוסיף ישירות למים, לא להיפך. יש לאחסן באזור קריר ויבש הרחק מאור שמש ישיר ולעקוב אחר אמצעי סילוק פסולת נאותים שנקבעו על ידי המעבדה. - שמור את בקבוק 2 ליטר של חומצה גופרתית 5 מ"מ דגירה באמבט מים ליד מכשיר HPLC. הגדר את אמבט המים ל 35 °C (5 °F). מניחים צינורות עם מסנן ממס בבקבוק הממס ומצמידים את הקצה השני למודול degasser בהתאם למודול המשאבה.
הערה: טיהור המערכת עם ממס מוכן טרי לפני התקנת העמודה הוא תרגול טיפול טוב מכשיר. - צייד את מכשיר HPLC בעמודת HPLC בהתאם למודול RID. מקם את העמודה באמבט המים של 35 מעלות צלזיוס אם תרמוסטט של עמוד אינו זמין.
- הכן את מודול RID לניתוח ב 35 °C בתוכנת מערכת נתונים כרומטוגרפיה (CDS) המותקנת במחשב המערכת.
- בתפריט תצוגה, בחר בשיטה והפעל את תצוגת פקד. לחץ באמצעות לחצן העכבר הימני על שיטת > מודול המשאבה. הגדר את קצב הזרימה ל- 0.55 מ"ל-1 ובחר בלחצן הפעל כדי להפעיל את המשאבה.
הערה: אם העמודה הייתה באחסון לפני שהייתה מצוידת ב- HPLC, שפר את קצב הזרימה ל- 0.55 מ"ל-1 לאחר איזון העמודה בהתאם להוראות היצרן. - לחץ באמצעות לחצן העכבר הימני על החלונית המתאימה לשיטת > מודול RID. הגדר את הטמפרטורה של מודול גלאי RI ל- 35 °C ובחר מופעל כדי להתחיל לחמם את מודול גלאי RI.
- לחץ באמצעות לחצן העכבר הימני על הלוח RID מודול > שליטה. בחר ב עבור תא הייחוס של הטיהור למשך 15 דקות לפחות בעת שימוש בממס טרי או שעה אחת אם ממיסים שונים זרמו דרך גלאי RI לפני התקנה זו. לחץ על לחצן 'הפעלה'.
הערה: שמור את המשאבה ואת גלאי RI על כדי להשיג בסיס יציב על העלילה המקוונת. זה מושפע תנודות טמפרטורה במעבדה והוא יכול לקחת עד 4 שעות או יותר. שמור את המערכת למשך הלילה לפני טעינת הדגימה.
- בתפריט תצוגה, בחר בשיטה והפעל את תצוגת פקד. לחץ באמצעות לחצן העכבר הימני על שיטת > מודול המשאבה. הגדר את קצב הזרימה ל- 0.55 מ"ל-1 ובחר בלחצן הפעל כדי להפעיל את המשאבה.
3. יצירת שיטה להפרדת HPLC איזוקרטית של מוצרי תסיסה אורגניים בתקליטורים.
- מתוך שורת התפריטים, בחר שיטה > שיטה חדשה. בחר שיטת > שיטת שמירה כ- [MethodName] .M. בחר שיטה > ערוך את הכלי/רכישה של פעולת השירות כולה >
- בכרטיסיה משאבה בינארית, הגדר את הזרימה ל- 0.55 מ"ל-1. תחת ממיסים, בחר את האות המתאימה לקלט הממס במודול המשאבה והגדר אותו ל- 100% עבור חמקה איזוקרטית. הגדר מגבלות לחץ ל- 0 ו- 400 פס והקלט 30 דקות כזמן העצירה.
- בכרטיסיה סמפלר, הגדר את אמצעי האחסון להזרקה ל- 50 μL. בחר באפשרות כמשאבה/ללא הגבלה תחת זמני עצירה. הגדר את הגדרות העזר המתקדמות עבור מהירות ציור, מהירות הוצאת ומיקום ציור ל- 200 μL·min-1, 200 μL·min-1ו - 0.5 מ"מ.
- בכרטיסיה RID, הגדר את טמפרטורת היחידה האופטית ל- 35 °C (70 °F). תחת אות, בחר רכוש עבור אות ו- >0.2 דקות עבור Peakwidth. בחרו באפשרות 'משאבה/מזרק' עבור 'זמני עצירה'.
- תחת מתקדם בכרטיסיה RID, הגדר את הפלט האנלוגי להיסט אפס של 5% ו- 500,000 nRIU עבור הפחתה. בחרו באפשרות 'חיובי' עבור קוטביות האות והאפשרות 'און' עבור 'אפס אוטומטי לפני ניתוח'.
- שמור את פעולת השירות על-ידי בחירת שיטת השירות > שיטת השמירה. טען את פעולת השירות על-ידי בחירת שיטת השירות > > [MethodName]. מ.
4. יצירת טבלת רצף לדגימה אוטומטית והפעלת מערכת HPLC-RID לרכישת נתונים.
- מתוך שורת התפריטים, בחר רצף > תבנית רצף חדשה. בחר רצף > שמור תבנית רצף כ- [SequenceTemplateName]. ס.
- בחר רצף > טבלת רצף. צרף שורות 'n' המתאימות לבקבוקונים של 'n', ולאחר מכן הזן מיקומי בקבוקונים ושמות לדוגמה תחת שם בקבוקון ושם לדוגמה, בהתאמה, בהתאם לסידור שלהם על מגש הדגימה האוטומטית. בחר את השיטה שנוצרה בשלב 3 מהתפריט הנפתח שם פעולת שירות וקלט 50 μL כ- Inj/Vial (הזרקה ל- Vial) עבור כל שורה.
- לחץ על החל ושמור את תבנית הרצף על-ידי בחירה בתבנית רצף > שמור תבנית רצף. ודא שתבנית הרצף נטענת על-ידי בחירת תבנית רצף > רצף > [SequenceTemplateName]. ס.
- לאחר השגת בסיס יציב על המגרש המקוון, לחץ באמצעות לחצן העכבר הימני על הלוח RID Module > בקרת > את שסתום המיחזור כדי לכוון את זרימת הממס דרך גלאי RID לפסולת. כדי להתחיל ברכישת נתונים, בחר רצף מתוך שורת התפריטים, רצף > הפעל.
5. חילוץ וניתוח נתונים לאחר הריצה.
- בחר בתצוגת ניתוח נתונים מתפריט תצוגה. אתר את שם קובץ הרצף מרשימת הקבצים בצד שמאל של המסך. בחלונית המרכזית על המסך, עבור אל בחירת תצוגת האות > RID אות כדי להציג את הכרומטוגרמה לדוגמה.
- בחרו שורה המתאימה לדגימה סטנדרטית בריכוז גבוה מהחלונית העליונה שעל המסך. שים לב לשעות השמירה עבור פסגות ניתוח היעד בכרומטוגרמה המוצגת. פסגות המתאימות לאתוח היעד יוסדרו לאורך ציר זמן השמירה כמו גלוקוז, תמציתי, לקטט, formate, אצטט ואתנול (איור 1 משלים).
הערה: הפסגה הגדולה הראשונה על הכרומטוגרמה תואמת לחומצה טריכלורואצטית. יחידות RI שלה צריכות להיות עקביות בכל דגימות העקומה הסטנדרטיות. אמת את זמן השמירה של כל ניתוח יעד על-ידי הפעלת כל תרכובת כדוגמה נפרדת. - לחלץ אזורי שיא עבור כל ניתוח יעד מ כרומטוגרמה של הסטנדרטים ואת דגימות התגובה.
- תבחין אם פסגות העניין משולבות היטב על ידי התוכנה. צייר את הקו האדום כבסיס של כל פסגה כדי להשיג שטח משולב במדויק מתחת לעקומה. אם האינטגרציה האוטומטית נכשלת (כלומר, הקו האדום הוא קש), בחר בלחצן שילוב ידני מערכת כלי השילוב וצייר באופן ידני בסיס שיא כדי לשלב את אזור השיא.
הערה: אם יש לבצע שילוב ידני עבור ניתוח יעד במדגם אחד, שמור על עקביות ושילוב ידני של אותו ניתוח בכל הדגימות. - בחרו בכלי הסמן מתוך ערכת הכלים המשותפת כדי ללחוץ על פסגות משולבות כראוי. אזור השיא וזמן השמירה המתאים של הפסגה שנבחרה יודגשו כשורה בטבלה בחלונית התחתונה של המסך.
- לייצוא אזורי שיא, בחר קובץ > ייצוא > תוצאות שילוב.
- תבחין אם פסגות העניין משולבות היטב על ידי התוכנה. צייר את הקו האדום כבסיס של כל פסגה כדי להשיג שטח משולב במדויק מתחת לעקומה. אם האינטגרציה האוטומטית נכשלת (כלומר, הקו האדום הוא קש), בחר בלחצן שילוב ידני מערכת כלי השילוב וצייר באופן ידני בסיס שיא כדי לשלב את אזור השיא.
- לכמת את ריכוזי ניתוח היעד באמצעות עקומות סטנדרטיות.
- התוויית ערכי אזור שיא לעומת ריכוזים ידועים של דוגמאות בגיליון אלקטרוני. לחץ באמצעות לחצן העכבר הימני על הנתונים המותווים, הוסף קו מגמה > עיצוב קו מגמה > הצג משוואת תרשים.
- בגיליון אלקטרוני נפרד, השתמש במשוואות של קווי מגמה סטנדרטיים של עקומה כדי להמיר ערכי אזור שיא לריכוזים עבור כל ניתוח מכל מדגם. חשב את אזורי השיא הממוצעים וערכי השגיאה הסטנדרטיים בין טריפליקאטים עבור פריט חזותי של נתונים.
6. איזוטופ של קורס התחלה, עצירה ועיבוד של קורס מעקב אחר תגובות CFME לכימות LC-MS/MS.
- הגדר תגובות משולשות לנקודת זמן (למעט זמן אפס) על קרח כמתואר ב- 1.1-1.2. עם זאת, במקום גלוקוז, להשתמש בריכוז הסופי של 100 mM 13C6- גלוקוז בתגובות. לדגור את התגובות ב 37 °C (55 °F) עבור 1 שעות, 2 שעות, ו 3 שעות.
- כדי לסיים, פלאש להקפיא את התגובות חנקן נוזלי ולאחסן אותם ב -80 °C (70 °F). דלג על שלב אחסון זה לניתוח באותו יום.
הערה: חומצה Trichloroacetic לא שימש כדי לעצור תגובות עקב הפרעה מן החומצה בעת זיהוי כמה מטבוליטים פחמן מרכזי באמצעות LC-MS/MS. במקום זאת, ממס מיצוי המכיל חומצה פורמית (שלב 6.3) שימש כדי לזרז חלבונים מטבוליים מאז המסה של חומצה פורמית הוא מתחת למגבלת הזיהוי של שיטת MS/MS שדווחה. - הכן 50 מ"ל של ממס החילוץ. שלב מערבולת 20 מ"ל של acetonitrile, 20 מ"ל של מתנול, ו 10 מ"ל של מים (כל LC-MS כיתה) בצינור צנטריפוגה 50 מ"ל יחד עם 0.199 מ"ל של חומצה פורמית כדי להפוך פתרון 0.1 M. מצננים את הממס ל 4 °C (75 °F) במהלך החילוץ ולאחסן את הממס ב -20 °C (70 °F) כאשר לא בשימוש.
- דגימות עיבוד עבור ניתוח LC-MS/MS
- ביום הניתוח, pipette נפח שווה ערך של ממס החילוץ (כלומר, 50 μL) לכל מדגם. אם הדגימות הוקפאו, להוסיף את ממס החילוץ לפני הדגימות להפשיר לחלוטין כדי למנוע את ההפעלה מחדש של חילוף החומרים גלוקוז. בצע את כל שלבי העיבוד לדוגמה על קרח.
- כדי לשחזר את הזמן אפס, pipette את הנפח הסופי של ממס החילוץ (כלומר, 50 μL) לנפח מתאים של ליסאט לריכוז הסופי הרצוי בתגובה (כלומר, של 4.5 מ"ג / מ"ל בנפח תגובה 50 μL). הוסף את שאר רכיבי התגובה כמו בשלב 1.2. שלב החמצה זה מזרז אנזימי ליסאט לפני שהם מטבוליזם משמעותי של גלוקוז.
- לדגור את הדגימות ממס מיצוי על קרח במשך 30 דקות עם רועד עדין, ולאחר מכן צנטריפוגות את הדגימות ב 21,000 x גרם במשך 15 דקות ב 4 °C (4 °F) כדי להפריד את supernatant מן החלבון מזרז. העבר 50 μL של supernatant לבקבוקונים autosampler לטעון את הבקבוקונים על המגש בתוך 4 °C autosampler. אחסן את שאר supernatant ב -20 °C (50 °F) עבור ניתוחים עתידיים.
7. הגדרת מערכת LC לניתוח LC-MS/MS.
- הכן 1 ליטר של ממס A על ידי המסה מוחלטת של 77.08 מ"ג של אצטט אמוניום ב 950 מ"ל של מים ו 50 מ"ל של איזופרופנול. הכן 1 ליטר של ממס B עם 650 מ"ל של אצטוניטריל, 300 מ"ל של מים, ו 50 מ"ל של איזופרופנול יחד עם 77.08 מ"ג של אמוניום אצטט. ודא שכל הממיסים הם LC-MS כיתה.
- חבר את בקבוקי הממס המכילים ממיסים A ו- B למודול המשאבה. לטהר את המערכת בקצב זרימה גבוה כדי להסיר / להגביל כל זיהום אוויר שייתכן שהתרחש במהלך הציוד של הממסים למערכת LC.
- ציידו את המערכת בעמודה C18 הפוכה (אורך עמודה של 30 ס"מ, קוטר פנימי של 75 מיקרומטר וקוטר חלקיקים של 5 מיקרומטר). התנה את העמודה למערכת LC-MS על-ידי הזרמת 100% ממס B והזרמת ממס A לאט עד 100%.
הערה: טיפים לעמודות הוכנו בתוך הבית באמצעות משיכת מיקרופיפט ועמוס בתאי לחץ והליום.
8. יצירת שיטה על LC-MS / MS נתונים לרכוש נתונים ותוכנה פרשנות עבור מערכת LC מקושרת פורייה טרנספורמציה ו יון מלכודת מסה ספקטרומטרים.
- פתח את תוכנת Tune Plus כדי לערוך קובץ כוונון עבור פעולת השירות MS.
- מתוך קובץ בשורת התפריטים, פתח קובץ כוונון מצב שלילי שהוקן מראש.
- בחר ScanMode בשורת התפריטים ולאחר מכן בחר הגדר חלון סריקה. הגדר את הגדרת זמן microscan עבור MSn ל- 1 הן עבור מלכודת יון והן עבור FT.
- עבור אל ההגדרות עבור מקור Nano-ESI והגדר את מתח הריסוס ל- 4 kV. לווסת את זה עד אלקטרוספרייה מקובל נוצר; בדרך כלל, אלקטרוספרי מקובל ניתן להשיג בטווח של 2-5 kV.
- שמור את קובץ הכוונון.
- צור שיטת LC חדשה באמצעות אשף ההתקנה של תוכנת רכישת הנתונים והפרשנות של המכשיר. פתח את אשף הגדרת רצף > > מפת דרכים. מאחר ששיטות אלה אינן דורשות שימוש בתנור עמודות, דלג על השלב שליטה זמנית.
- תחת אפשרויות משאבת מעבר צבע של זרימה, בחר ריבוי משימות. בחלון הבא, הוסף 7 שורות והגדר את קצב הזרימה עבור כל שורה ל- 0.1 מ"ל-1. הזן את הפרמטרים הבאים עבור כל שורה: מ 0-3 דקות, לספק 100% ממס A; מ 3-9 דקות, להציג שיפוע מ 100% ממס A ל 20% ממס B; מ 9-19 דקות, להציג שיפוע חדש מ 20% ממס B ל 100% ממס B; מ 19-27 דקות, להחזיק ב 100% ממס B; מ 27-28 דקות, להגדיר את מעבר הצבע בחזרה 100% ממס A; מ 28-44 דקות, לשטוף ולערוך מחדש את העמודה עבור ריצות עוקבות על ידי החזקה ב 100% ממס A. כלול צעד סופי כדי להוריד את קצב הזרימה ל 0.03 mL·min-1 עם השלמת הריצה כדי לשמר את הממס כאשר LC אינו בשימוש.
- החל הגדרות ברירת מחדל עבור אפשרויות סמפלר > לחץ משאבה כאפשרות הרכישה והשתמש זמן רכישה ברירת מחדל ולהשתמש אפשרויות ברירת מחדל משאבה לחץ.
- צור שיטת MS/MS על-ידי בחירת סמל Orbitrap Velos Pro MS מהסרגל הצידי בחלון התקנת המכשיר.
- לחץ על שיטה חדשה > נתונים תלויים MS/ MS. הגדר זמן רכישה לאורך הפעלת LC (כלומר, 44 דקות), פלח שוק ל- 1 וסרוק אירועים ל- 11. בתיבה 'כוונון קובץ', בחר את הקובץ הערוך מהשלב 8.1.
הערה: האירוע הראשון הוא סריקת מבשר MS1 באמצעות MS המרת פורייה (FTMS). 10 האירועים העוזרים יהיו סריקות MS2 שיבחרו את 10 היונים האינטנסיביים והייחודיים ביותר בכל סריקת מבשר לפיצול MS2. - עבור אירוע 1, תחת תיאור סריקה הגדר את מנתח ל- FTMS וקוטביות לשלילית. תחת הגדרות MSn, השתמש ברזולוציה של 30,000 ובאנרגיית התנגשות מנורמלת של 35 V. הגדר טווחי סריקה ל- 50 מ'/ת עבור המסה הראשונה ו- 1800 מ'/ת עבור המסה האחרונה כדי ללכוד מולקולות קטנות.
- עבור אירועים 2 עד 11, תחת תיאור סריקה הגדר מנתח למלכודת יון. בחר סריקה תלויה ולחץ על הגדרות > אי-הכלל > אי-הכלל דינאמי ובחר הפוך לזמין; הגדר משך חוזר של 30 שניות ומשך אי-הכללה של 120 שניות כדי למנוע סריקות חוזרות בסמיכות.
- עבור אל הגדרות אירוע סריקה והגדר את 'קביעת מסה' מאירוע סריקה ל- 1 עבור כל אירועי MS2 (2 עד 11). כדי לסרוק את עשרת היונים האינטנסיביים ביותר, הגדר כל אירוע סריקה MS2 כדי לזהות nth Ion האינטנסיבי ביותר מ 1st עד 10th. לכן, הגדר אירוע 2 כדי לזהות 1 כמו nהאינטנסיבי ביותר Ion, אירוע 3 כדי לזהות 2, וכן הלאה.
- סגור את חלון ההתקנה ולעבור אל קובץ > שמירה בשם [Method_Name].meth.
הערה: לשימוש כללי, תחזוקה וכיול של מכשיר LC וספקטרומטר מסה, עיין בהוראות ההפעלה ובמדריכים שסופקו על-ידי היצרן.
- לחץ על שיטה חדשה > נתונים תלויים MS/ MS. הגדר זמן רכישה לאורך הפעלת LC (כלומר, 44 דקות), פלח שוק ל- 1 וסרוק אירועים ל- 11. בתיבה 'כוונון קובץ', בחר את הקובץ הערוך מהשלב 8.1.
9. הגדרת רצף ריצה והתחלת ריצת LC-MS/MS.
- הגדר רצף ריצה באמצעות תוכנת רכישת הנתונים והפרשנות של מערכת LC-MS/MS. בתוך Roadmap > הגדרת רצף, לחץ באמצעות לחצן העכבר הימני על הטבלה כדי להוסיף שורות רבות ככל דוגמאות. עבור כל שורה, הגדר את Inj Vol ל- 5 μL ואת המיקום למיקום המתאים של הוויאל במגש הדגימה האוטומטית. הזן שמות קבצים כשמות לדוגמה והגדר את נתיב הקובץ הרצוי לקבלת תוצאות ריצה.
הערה: בקבוקונים ריקים המכילים ממס A ניתן להפעיל בתחילת הרצף ובין כל קבוצה של דוגמאות משולשות (כל קבוצה של נקודות זמן) כדי לשטוף את העמודה. - כדי להתחיל את ההפעלה, סמן את כל שמות הקבצים ברצף. מתוך שורת התפריטים, בחר פעולות > הפעל רצף > אישור.
10. איחוד קבצים וחיפוש ביאורים לא סופיים ב- MZmine 2.53.
- פתח את MZmine וייבוא קבצי הפלט '.raw' מהשלב 9.1. מתוך שורת התפריטים, בחר שיטות נתונים גולמיות > ייבוא נתונים גולמיים. בחר קבצים המתאימים לדגימות.
- בנה רשימה של פסגות המבדילות בין סריקות MS1 ו- MS2. מתוך שורת התפריטים, שיטות נתונים גולמיות > זיהוי תכונות > בונה שיא MS/MS. ההגדרות הרלוונטיות כוללות חלון m/z המוגדר כ- 0.01 וחלון זמן מוגדר לאורך ההפעלה. תחת מסננים מוגדרים, בחרו 'שלילי כקוטביות' ו'מרכזי' כסוג הספקטרום.
- מתוך שורת התפריטים, עבור אל שיטות רשימת תכונות > זיהוי תכונות > מרחיב שיא. הגדר עמידות m/z ל- 0.005 מ'/z או 10 ppm וגובה מינימלי ל- 1E3. צעד זה ייצור פסגות בשר מלא.
- הסר פסגות כפולות. חזור לשיטות רשימת תכונות > סינון > מסנן שיא כפול. ההגדרות הרלוונטיות כוללות עמידות m/z מוגדרת ל- 0.005 מ'/z או 10 ppm ואת עמידות RT מוגדרת ל 5 דקות.
- כדי ליישר פסגות בתוך קבצי נתונים דומים (כלומר, אלה של תגובות משולשות), חזור לשיטות רשימת תכונות > נורמליזציה > כיול זמן השמירה. הקפד לעבד דוגמאות משולשות יחד ולהשאיר ריקים. ההגדרות הרלוונטיות כוללות m/z עמידות מוגדרת ל- 0.005 מ'/z או 10 ppm, עמידות RT מוגדרת כ- 3 דקות מוחלטת (דקה) ועוצמה סטנדרטית מינימלית מוגדרת ל- 1E3.
- ישר פסגות מכל הקבצים לפי m/z וזמן שמירה משיטות רשימת תכונות > יישור > היישור של RANSAC. הגדר עמידות m/z ל- 0.005 מ'/z או 10 ppm, עמידות RT וסובלנות RT לאחר תיקון ל- 44 ו- 39 דקות, בהתאמה, איטרציות RANSAC ל- 0, מספר מינימלי של נקודות ל- 10%, וערך סף ל- 1. סמן את האפשרות דרוש מצב טעינה זהה.
- נכון עבור כל נקודות הנתונים שייתכן שאבדו בשלבים קודמים בשיטות רשימת תכונות > מילוי פער > Finder שיא. ההגדרות הרלוונטיות כוללות עמידות בפני עוצמה המוגדרת ל- 50%, עמידות m/z מוגדרת ל- 0.005 מ'/z או 10 ppm ו-RT Tolerance מוגדר ל- 3 דקות. הפוך תיקון RT לזמין.
11. חישוב מסות מצב שליליות של 13מטבוליטים שמקורם בגלוקוז C וחיפוש אחר תכונות m/z של ניתוחים אלה בנתונים מסוננים.
- לחשב את המסות של 13מטבוליטים C-שכותרתו מטבוליזם גלוקוז עבור החיפוש הממוקד.
- חשב את המסה המונואיזוטופית של כל תרכובת יעד ממספר האטומים בנוסחה המולקולרית של המתחם והמסות המונואיזוטופיות של כל יסוד20.
- חשב את מסת המצב השלילית של המתחם [M-H] - על-ידי חיסור המסה של פרוטון אחד (1.007276 Da) מהמסה המונואיזוטופית. זוהי המסה שזוהתה על ידי זיהוי MS במצב שלילי לאחר מולקולות מופשטות של יון מימן במהלך יינון.
- ממסת המצב השלילי, לחשב את המסה של מטבוליט 13C-שילוב. כאן, חישבו המסות של איזוטופולוגים המשלבים באופן מקסימלי 13תוויות C שמקורן בגלוקוז.
- השתמש במסות מחושבות של מטבוליטים בעלי תווית C של 13C כדי לחפש ולהביא ביאורים לתכונות m/z מתוצאות MZmine. עבור כל חבטה אפשרית, חשב את שגיאת המסה (ppm) באמצעות המשוואה הבאה:
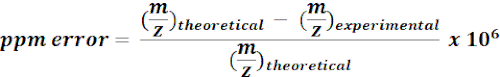
הערה: ערכי m/z ניסיוניים עם שגיאת מסה של <15 ppm נחשבו לביאורים פואטיים בניתוח הנוכחי. - בדוק באופן ידני את הספקטרום של ביאורים putative בדפדפן איכות כדי לאשר ביאורים.
- פתח מפת דרכים > דפדפן Qual. מסרגל הכלים, פתח קובץ גולמי כדי לייבא נתוני MS גולמיים של כל דגימה.
- צייר קו מתחת לטווח הרצוי של זמני שמירה (כלומר, המתאים לביאור putative) על כרומטוגרמה יון הכוללת (החלונית העליונה) כדי להציג ספקטרום מסה (החלונית התחתונה). לחץ באמצעות לחצן העכבר הימני על הספקטרום והזן מגוון של מסות המקיפה את m/z של ניתוח היעד. בדקו אם הביאורים הפוטטיביים הם בעלי אותות שיא ברורים שהם מעל הרעש(איור 2 משלים).
- חשב את אזורי השיא הממוצעים ואת השגיאות הסטנדרטיות של ביאורים חיוביים על-פני שכפולים ביולוגיים עבור כל נקודת זמן. דמיינו את הנתונים (כלומר, בגרף עמודות) כדי לבחון מגמות בחילוף החומרים של גלוקוז.
תוצאות
כדי לכמת את הסינתזה ללא תאים המבוססים על ליזאט של מוצרי תסיסה נפוצים מגלוקוז, ליזאטים שמקורם בזנים הגדלים במדיה 2xYPTG הוזנו 100 מיקרומטר גלוקוז כמקור פחמן ראשוני8. התגובות נעצרו במהלך 24 שעות על ידי החמצת חלבון. חומרים מסוננים המכילים פירובט, תמציתי, לקטט, פורמט, אצטט ואתנול המיוצרים מקטבוליזם גלוקוז נטענו על מודול הדגימה האוטומטית של מערכת HPLC המצוידת במודול RID. בקבוקונים עם תערובות מסוננות של מוצרי קצה מותססים וגלוקוז ב 1.17 μM, 2.34 μM, 4.69 מיקרומטר, 9.38 μM, 18.75 μM, 37.50 μM, 75 μM, ו 150 ריכוזי μM במאגר S30 נטענו על המכשיר כסטנדרטים. ניתוחים נבטו באופן איזוקרטי מעמודת HPLC ל- RID. פסגות עבור גלוקוז, תמציתי, לקטט, formate, אצטט, ואתנול בטווח 1 עד 150 מיקרומטר יכול להיפתר על ידי RID. אזורי שיא לגלוקוז נגזרו על ידי אינטגרציה ידנית מנתוני RID לקורס זמן ודגימות עקומות סטנדרטיות. אזורי שיא שחולצו עבור תמציתי, לקטט, formate, אצטט, ואתנול נלקחו אותות משולבים באופן אוטומטי. כל העקומות הסטנדרטיות (אזור שיא לעומת ריכוז ידוע) היו ערכי R2 >0.99 והיו ליניאריות לאורך מגוון הריכוזים המשמשים כאן.
ריכוזי הטוחנת עבור כל ניתוחי היעד חושבו מהעיקולים הסטנדרטיים שלהם. גלוקוז נצרך בתוך 3 שעות הראשונות של התגובה ובעיקר מותסס לקטט(איור 2A,B). הצטברות אתנול התרחשה גם ב-3 השעות הראשונות של התגובה ונעצרה לאחר מכן (איור 2C). התצפית על ייצור משמעותי של לקטט ואתנול עם צריכת גלוקוז משמעותית לאחר 3 שעות לא הייתה חסרת תקדים שכן מסלולי ייצור לקטט ואתנול מאפשרים התחדשות של 1 נטו מול NAD+ מ NADH גליקוליטי הנדרש להמשך צריכת גלוקוז באמצעות גליקוליזה (איור 1). לפיכך, לקטט ואתנול יכולים להיחשב כמוצרי הקצה העיקריים של תסיסה בחילוף חומרים של גלוקוז ללא תאים המבוססים על ליסאט. אצטט היה נוכח בתחילה בתגובות כמרכיב של חיץ S30 ובאופן בלתי צפוי הצטבר רק עקב חילוף החומרים לאחר 6 שעות כאשר צריכת הגלוקוז האטה (איור 2D). תוצאה זו מצביעה על כך שתסיסת אצטט אינה מאפשרת בהכרח שטף גליקוליטי מהיר בנקודות זמן מוקדמות יותר. בינתיים, formate ו תמציתי היו מסונתזים כמוצרי תסיסה מינוריים(איור 2E,F). בסך הכל, השיטה אפשרה כימות מוחלט של דלדול מצע סוכר ויצירת מוצר מותסס ב- E. coli S30 lysates.
זיהוי MS פרופיל ליסאט חילוף החומרים גלוקוז הוחל במיוחד כאן. ליסאטים שמקורם בזנים הגדלים במדיה 2xYPTG הוזנו 13C6- גלוקוז כמקור פחמן. תגובות CFME הופעלו במשולש עבור 0 שעות, 1 שעות, 2 שעות, ו 3 שעות. דגימות מכל נקודת זמן נטענו במערכת LC המצוידת בעמודה הפוכה ומצמידה לספקטרומטר מסה של מלכודת פורייה ומלכודת יונים. ספקטרום מצב יונים שלילי הושגו ועובדו כדי לנתח חומצות אורגניות, פוספטים סוכר וחומצות אמינו. מסות תיאורטיות מחושבות של 13מינים המסומנים C השייכים לחילוף החומרים של הפחמן המרכזי נבדקו כדי לזהות במיוחד תרכובות שמקורן בגלוקוז. בהתבסס על תנאי טיפוח זן המקור המנוצלים ודיווחים קודמים על מסלולים פעילים ב- E. coli CFME, ההנחה כאן כי פרוטאום ליסאט מורכב מרשת מטבולית המזינה גלוקוז לתסיסה גליקולטית, מסלול פנטוז פוספט, ואולי אנבוליזם חומצת אמינו5,6,7,8,14 ( איור1). לכן, החיפוש הצטמצם לחברים במסלולים אלה, מתוכם 16 מטבוליטים המשלבים 13תוויות C נגזר גלוקוז היו ביאורים חד משמעיים (טבלה משלימה 1).
13 C6- גלוקוז נצרך באופן נצפה באמצעות גליקוליזה, כפי שמעידות התנודות בשפע ביניים גליקוליטי (איור 3A-E). בהתאם לנתוני HPLC-RID, גלוקוז הצטבר ל-13C3-לקטט וגם הותסס ל-13 C3-תמציתי בתוך 3 השעות הראשונות של התגובה(איור 4A,B). היווצרות של איזוטופולוג 13C3-תמציתי תומכת במודל המוצע של חילוף החומרים של גלוקוז ליסאט (איור 1), שבו תמציתי צפוי להיווצר על ידי קרבוקסילציה של מולקולת פוספונולפירובאט 3 פחמן (PEP) ולא מכניסה של מולקולת אצטיל-CoA 2-פחמן למחזור TCA. הפעלת מחזור TCA כבר הניח במחקרים קודמים CFME, אבל 13מתווכים אחרים C-תוויות של TCA לא זוהו כאן8,19,21. 13 C3-aspartate סינתזה עם זאת התרחש בתוך h הראשון היה נצרך, חיזוק הרעיון כי PEP מומר ישירות אוקסלואצטט(איור 1, איור 6C). הנתונים משקפים פרוטאום ליסאט מזני מקור שנקטפו במהלך צמיחה מותססת על מדיה עשירה בגלוקוז (2xYPTG). זה מרמז עוד יותר ששאר אנזימי TCA שאינם משתתפים בייצור תמציתי יוצרים ענף TCA חמצוני(איור 1). אף אחד מהמטבוליטים במסלול זה, עם זאת, זוהו, אולי בגלל ריכוזים גבוהים של גלוטמט הוסיף לתגובת CFME כמו נגד מלח למנוע את ההתקדמות של ענף זה.
נתוני HPLC-RID משלימים בנוסף את היעדר זיהוי אצטט 13C2במסגרת זמן התגובה של 3 שעות המצביעה על כך שאין הצטברות של אצטט מגלוקוז עד 3 שעות(איור 2B). עם זאת, מבשר ישיר של אצטט, אצטיל-פוספט (אצטיל-P), הצטבר, מה שמרמז כי זרוע PTA של מסלול Pta-AckA עבור סינתזת אצטט מאצטיל-CoA פעילה (איור 4C,D). AckA מזורז dephosphorylation של 13C2 -אצטיל-Pכדי 13C2-אצטט סביר לא מתרחש בתוך מסגרת זמן זו בשל אצטט להיות מרכיב מרכזי של חיץ S30 בשימוש בתגובות (איור 1, איור 2B).
שילוב של 13C6- פחמנים שמקורם בגלוקוז לסוכר פוספטים 6-פוספוגלוקונקונקולקטון (6PGL), 6-פוספוגלוקונט (6PG), ריבולוז-5-פוספט (Ru5P) ו sedoheptulose-7-פוספט (S7P) נצפתה גם(איור 5). תוצאות אלה מאשרות את ההשתתפות של מסלול פנטוז פוספט בחילוף החומרים של גלוקוז ליסאט וסביר להניח מאכיל 13C9 -סינתזתטירוסין, אשר הוצע בעבר על ידי מחקר פרוטאומי, תוך מתן הקדמה עבור 13C5-ייצור היסטידין (איור 6A,B)7. שכותרת פנילאלנין וטריפטופן לא נצפו כאן, וגם לא רוב חומצות האמינו החיוניות. עם זאת, זה לא לגמרי מפתיע מאז אנאבוליזם חומצת אמינו עשוי להיות מועשר ליסאטים נגזר תאים הגדלים בתנאים מורעבים בחומרים מזינים או בשלב נייח7,22. יתר על כן, הנתונים עד כה מצביעים על כך שמתווכים של גליקוליזה ותסיסה מוזרמים לתגובות קצה מתחדשות של קופקטור, אשר חייבות למנוע סינתזה של חומצות אמינו רבות שמקורן בגליצרלדהיד-3-פוספט, פירובט ואצטיל-CoA (כלומר, גליצין, ציסטאין, סרין, אלנין, ואלין, לאוצין וליצין)(איור 1). כאמור, 13C3-אספרטט יוצרו בשעה הראשונה, בעוד אספרטט נגזר 13חומצות אמינו משולבות C (כלומר, threonine, איזולאוצין, מתיאונין, אספרגין) לא נצפו אולי בגלל אספרטט נגזר גלוקוז משתתף תסיסה (איור 1, איור 6C). לבסוף, השטף לכיוון גלוטמט וחומצות אמינו שנגזר מגלוטמט אולי נגוע ברמות גבוהות של גלוטמט בסביבת התגובה(איור 1).
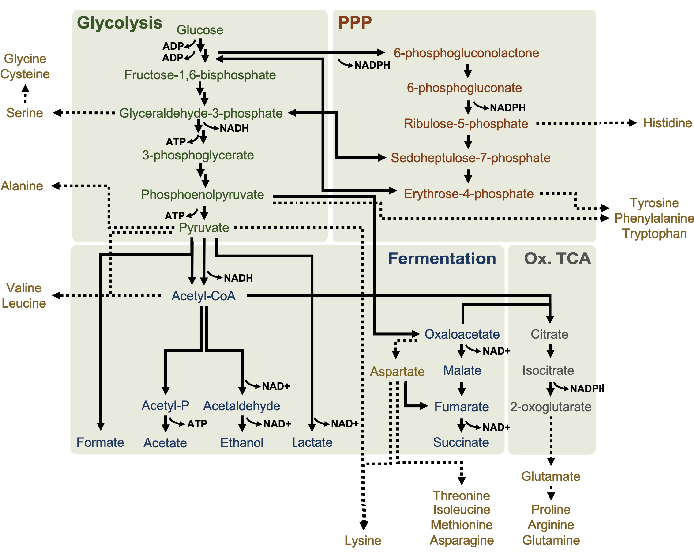
איור 1: מודל מטבולי פואטי של ליסאטים שמקורו ב-E. coli BL21DE3-Star הגדל באופן אקספוננציאלי בריכוזים גבוהים של גלוקוז. מתווכים ומוצרי קצה של גליקוליזה (ירוק), מסלול פנטוז פוספט (כתום כהה), ומסלולים מותססים (כחול) מאצטיל-CoA דווחו CFME מבוסס ליסאט. נוכחות של תסיסה תמציתית מרמזת על הפעלת ענף TCA חמצוני (אפור). אנאבוליזם חומצת אמינו (זהב) בליזאטים אינו מוגדר היטב ונחקר כאן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
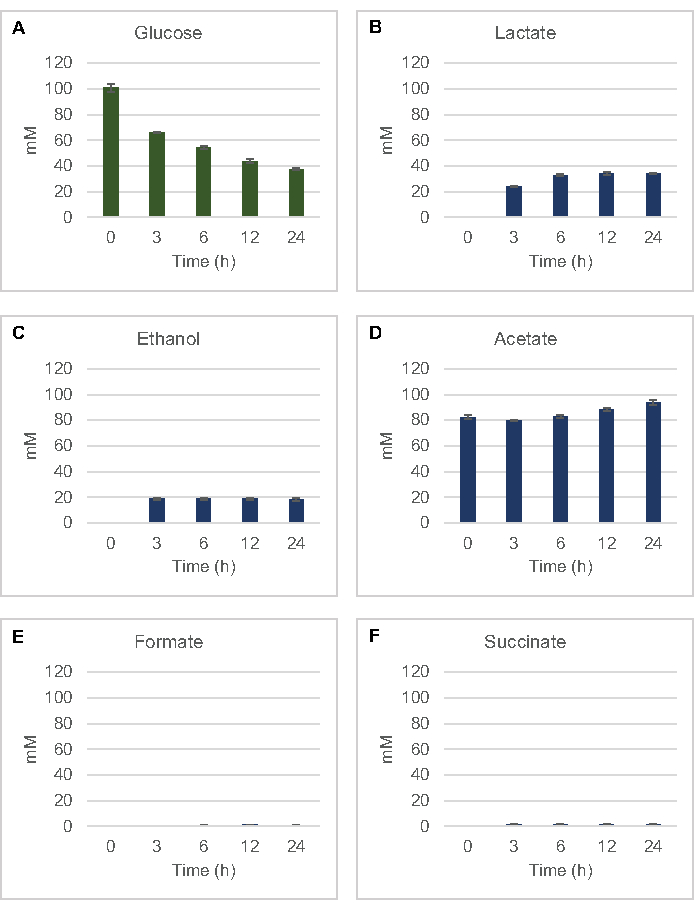
איור 2: נתוני HPLC-RID לצריכת גלוקוז וסינתזה מותססת של מוצרי קצה בתגובות CFME שהוכנו עם תמציות גולמיות E. coli. (A) צריכת גלוקוז ו -B) לקטט, (C) אתנול, (D) אצטט, (E) formate, ו -( F) ייצור תמציתי בתגובות CFME היו במעקב מעל 24 שעות. ריכוזי mM ממוצעים ופסי שגיאה (SE) המכומתים עם עקומות סטנדרטיות מוצגים (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
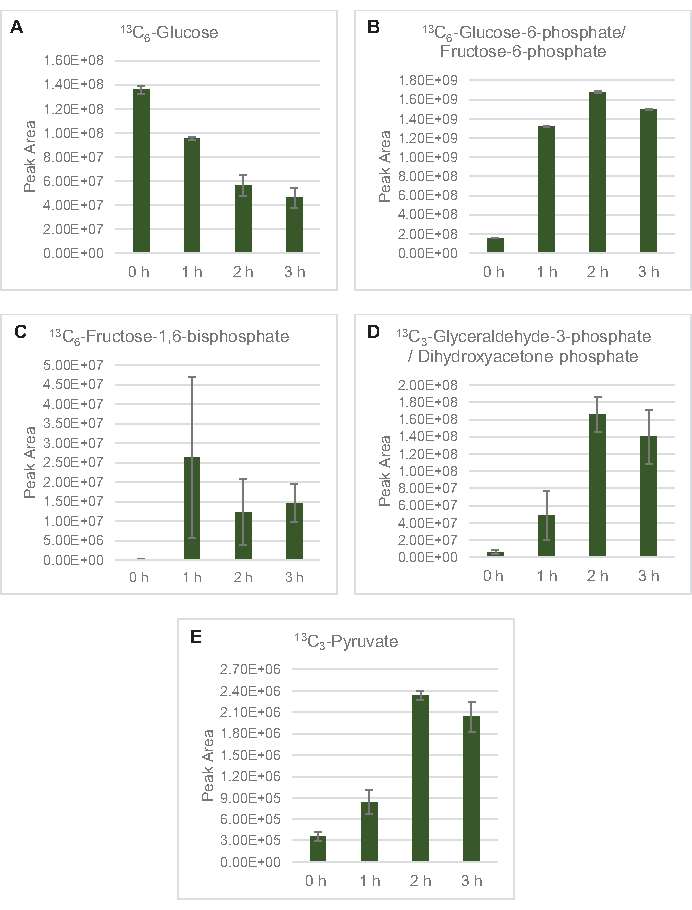
איור 3: מגמות קורס זמן של 13C6-גלוקוז ו-13 מתווכים גליקוליטיים המסומנים C ב- E. coli lysate CFME. שפע יחסי של (A) 13C6-גלוקוז, (B) 13C6-גלוקוז-6-פוספט / פרוקטוז-6-פוספט, (C ) 13C6-פרוקטוז-1,6-ביספוספט, (D) 13C3-גליצרילדהיד-3-פוספט / דיהידרוקסיאצטון פוספט, ו -( E) 13C6 -פירובט בתגובות CFME מעל 3 שעות. אזורי שיא גולמיים שחולצו על ידי תוכנת mzMINE שימשו לחישוב ממוצעים ופסי שגיאה (SE) עבור ביאורים חיוביים (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: מגמות קורס זמן של מתווכים ומוצרי קצה ב 13C6- תסיסה גלוקוז ב- E. coli lysate CFME. שפע יחסי של (A) 13C3-לקטט, (B) 13C3-תמציתי, (C) 13C2-אצטיל-פוספט, ו -( D) 13C2 -אצטיל-CoAבתגובות CFME מעל 3 שעות. אזורי שיא גולמיים שחולצו על ידי תוכנת mzMINE שימשו לחישוב ממוצעים ופסי שגיאה (SE) עבור ביאורים חיוביים (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
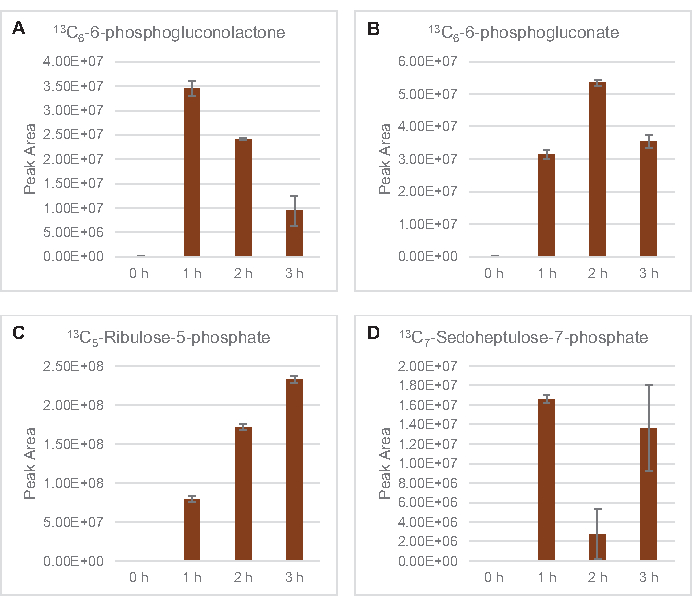
איור 5: מגמות מסלול זמן של 13C6- מסלול פנטוז פוספט נגזר גלוקוז ביניים E. coli lysate CFME. שפע יחסי של (A) 13C6-6-פוספוגלוקונקולקטון, (B) 13C6-6-פוספוגלוקונט,(C) 13C5-ribulose-5-פוספט, ו - (D) 13C7-sedoheptulose-7-פוספט מעל 3 שעות. אזורי שיא גולמיים שחולצו על ידי תוכנת mzMINE שימשו לחישוב ממוצעים ופסי שגיאה (SE) עבור ביאורים חיוביים (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
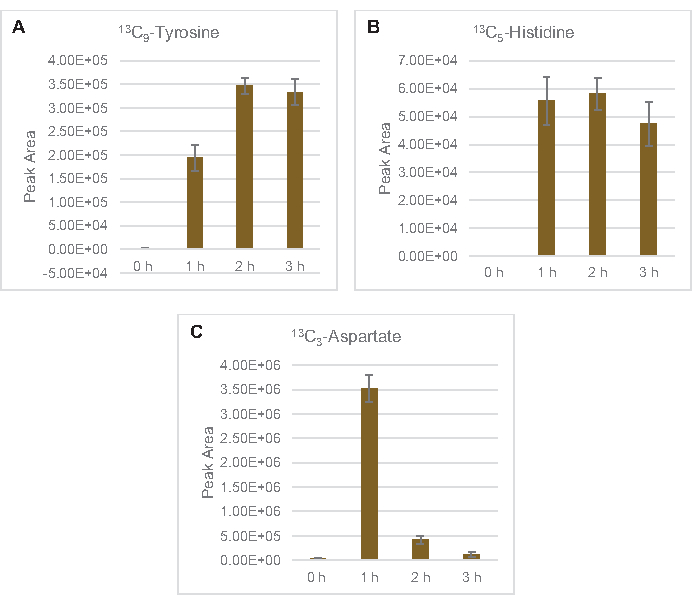
איור 6: מגמות מסלול זמן של זוהו 13C6- חומצות אמינו שמקורן גלוקוז ב- E. coli lysate CFME. שפע יחסי של (A) 13C9-טירוסין, (B) 13C5-היסטידין, ו (C) 13C3- אספרט מעל 3 שעות. אזורי שיא גולמיים שחולצו על ידי תוכנת mzMINE שימשו לחישוב ממוצעים ופסי שגיאה (SE) עבור ביאורים חיוביים (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 1 משלים:כרומטוגרמה מייצגת של HPLC-RID המציגה פסגות למוצרים מותססים עיקריים בתגובת CFME המודגרת ב-37 °C (70 °F) למשך 24 שעות. פסגות גלוקוז, תמציתי, לקטט, formate, אצטט ואתנול ניתנות להבחנה מספקת על ידי זמני השמירה שלהם בעמודת HPLC במהלך אלוטציה איזוקרטית עם ממס חומצה גופרתית 5 מ"מ. נא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: ספקטרום מסה מייצג עבור מטבוליטים עם תווית 13C, במיוחד (A) לקטט,(B) גלוקוז, ו-(C) 6-פוספוגלוקונט (6PG) בתגובת CFME דוגרה ב-37 °C למשך שעה אחת. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 1: רשימה של מטבוליטים שזוהו עםתווית C, זמני שמירה (מיושרים על-פני דוגמאות באמצעות MZmine), ערכי m/z של מצב שלילי בעלי תווית C,ערכי m/z של תכונות שזוהו ושגיאות מסה מחושבות. נא לחץ כאן כדי להוריד טבלה זו.
Discussion
ניתן להשתמש בגישת HPLC-RID המתוארת כדי לכמת בהצלחה את צריכת מצע הסוכר ואת ההמרות הבאות למוצרי חומצה ואלכוהול אורגניים עיקריים של חילוף החומרים המרכזי של ליסאט לאורך זמן. יתר על כן, פרוטוקול זה משתמש בשיטה איזוקרטית פשוטה באמצעות שלב נייד יחיד, דורש הכנה מדגם מינימלי, ומאפשר ניתוח פשוט ממוקד במורד הזרם. ניתוחים הנמדדים בשיטת HPLC-RID נבדלים אך ורק בזמני השמירה שלהם, ולכן האינטראקציות שלהם עם שרף העמודה שנבחר. עמוד HPLC המשמש כאן תוכנן במיוחד להפריד פחמימות, חומצות אורגניות ואלכוהול על ידי שילוב של אי-הכללת גודל וחילופי ליגנד (כלומר, כרומטוגרפיה של מחיצה מונחית יונים). השיטה המתוארת היא, אם כן, שימושית לניתוח ממוקד יותר של מצעים פחמימות ולבחור מוצרי קצה של מסלולי תסיסה גלוקוז אשר צפויים בעיקר להקל ולהניע ביו-טרנספורמציות מבוססות ליסאט8,15,21. עם זאת, פרוטוקול זה אינו לוקח בחשבון את ההפעלה של מסלולים מטבוליים אחרים בתמציות תאים. צינורות המשתמשים בטכניקות הפרדה כרומטוגרפיות אחרות (כלומר, כרומטוגרפיה של אינטראקציה הידרופילית), שיטות אלוטציה הדרגתיות, הכנת מדגם מורכבת יותר (כלומר, derivatization), וגלאים אופטיים שונים (למשל, אור אולטרה סגול או גלאי פיזור אור מתאדים) יכולים לשמש לזיהוי מטבוליטים אחרים כגון חומצות אמינו ופוספטים סוכר23,24 . לחלופין, גישה גלובלית לחקר חילוף החומרים ליסאט ניתן לנקוט באמצעות LC-MS/MS.
שיטת LC-MS/MS המתוארת היא זרימת עבודה יחידה למדידה ולזיהוי מגוון רחב יותר של מטבוליטים. LC-MS/MS הוא כלי אנליטי חדשני ביותר ליצירת פרופיל מטבולום בשל רגישותו ויכולתו להבחין בין מטבוליטים על-ידי זמן שמירה ויחסי m/z ברזולוציה גבוהה16. עם דגש על מסלולים מטבוליים פחמן מרכזי אנאבוליזם חומצת אמינו, מצב שלילי MS / MS יושם במיוחד לזהות חומצות אורגניות קוטביות, פוספטים סוכר, וחומצות אמינו. יחד עם טכניקת כרומטוגרפיה ננו-נוזלית, השיטה מספקת רגישות גבוהה לאיתור מולקולות קטנות ברקע ליסאט מורכב17. במונחים של יצירת פרופיל חילוף החומרים מבוסס ליסאט CFME, עם זאת, מגבלה של פרוטוקול LC-MS / MS המתואר הוא מגבלת הזיהוי הנמוכה יותר של 50 m/z, אשר מונע את מדידת אתנול, מוצר מרכזי בחילוף החומרים של גלוקוז ליזאט, כמו גם formate, אשר שניהם כימותו בקלות אחרת על ידי שיטת HPLC-RID המפורטת. בהשוואה ל- LC-MS/MS, ל-HPLC-RID יש יתרון נוסף של נגישות יחסית מבחינת עלות וקושי. לנקודה האחרונה, פתרון בעיות בשיטת LC-MS/MS המתוארת כאן עשוי לדרוש מידה מסוימת של מומחיות בספקטרומטריית מסה. עם זאת, זיהוי MS יש יישומים מושכים באופן ייחודי על RID כפי שהוא יכול גם להבחין איזוטופים מסומנים במטבולום, טכניקה מצוינת להבנת תנועת פחמן ממצעים משלימים דרך רשת חילוף החומרים המורכבת lysate18. גישה כזו יושמה כאן על ידי שכשהם תגובות עם 13C6- גלוקוז וניתוח ערכי השפע היחסי של במורד הזרם 13מטבוליטים המשלבים C. הניתוח איפשר את ההגדרה של מסלולים פעילים ולא פעילים, תמיכה בהנחות שדווחו בעבר ומתן תובנות חדשות על שטף מטבולי בליזאטים. שינויים יכולים להתבצע גם בשיטה עבור ניתוחים ספציפיים. לדוגמה, ניתן לנתח פתרונות סטנדרטיים של 13 תרכובותיעד המסומנות C יחד עם דגימות כדי להשיג מדידות כמותיות מוחלטות של מולקולות שמקורן בגלוקוז לאורך זמן ולהסיק מסקנות לגבי הפצות שטף. זיהוי טוב יותר של תרכובות טעונות חיובית יכול להיות זמין גם בתוך זרימת העבודה הנוכחית על-ידי הפעלת רצפים עם קבצי .meth המותאמים לזיהוי מצב חיובי.
דגימה אנליטית בשתי השיטות המתוארות היא אוטומטית בנוחות, ומבטיחה יכולת רבייה גבוהה. יתר על כן, ריצות אנליטיות חלקות צפויות כל עוד נצפות שיטות טיפול ותחזוקה מתאימות של מכשירים. בעת שימוש בכלים אלה כדי לנתח תגובות CFME, שיקולים קריטיים יותר צריכים להיות מורכבים במעלה הזרם ובמורד הזרם של דגימה. במהלך הכנת המדגם, חשוב כי פקדי קורס זמן מייצגים את הזמן אפס. כאן, חלבונים היו מזועזעים lysates על ידי החמצה כדי לעצור תגובות מטבוליות. עבור דגימות זמן אפס, ממס החומצה היה משולב עם ליסאט לפני הוספת תערובת התגובה המכיל גלוקוז. החמצה עם חומצה טריכלורואצטית הבטיחה ביעילות כי גלוקוז לא יטבוליזם בזמן אפס, כפי שמוצג בנתוני HPLC-RID(איור 2). בעוד הליך דומה כדי להרוות את חילוף החומרים גלוקוז בוצע בניתוח LC-MS/MS שדווח, 13מטבוליטים C-שכותרתו זוהו בדגימות זמן אפס, אם כי בערכי שפע נמוכים באופן משמעותי ביחס דגימות שחולצו בנקודות זמן מאוחרות יותר. יתר על כן, תצפיות אלה הוגבלו למתווכים של גליקוליזה. הנתונים מראים כי התגובות לשמור על מידה מסוימת של פעילות גליקוליטית לאחר החמצה עם ממס החילוץ כי מזוהה על ידי שיטה רגישה מאוד זו. עם זאת, יש לכמת את היקף הפעילות. מחקר קודם דיווח כי ממיסים מיצוי חומצי לא יכול להרוות מספיק תגובות גליקוליטי ביניים אבל יכול לעצור צריכת גלוקוזמשמעותית 10. בעוד זה נשאר להיחקר עוד יותר במערכת המשמשת כאן, שינויים דרסטיים בערכי שפע יחסי בין זמן אפס ודגימות נקודת זמן מאוחרת יותר יכול להתפרש כמגמות בחילוף החומרים של גלוקוז. עם זאת, מומלץ לבחון שיטות מרווה חלופיות ביישומים דומים, במיוחד להשגת כמויות מוחלטות של מתווכים מטבוליים10. יתר על כן, יש לראות שיטות עבודה טובות במהלך ניתוחי תוכנה במורד הזרם. עקביות היא הכרחית בעת שילוב ידני של אזורי שיא מאותות RID כדי להפחית את השגיאה האנושית. שילוב ידני צריך להיות מיושם גם על אזורי שיא של תקנים בכל פעם אזורי שיא משולבים באופן ידני משמשים כדי לכמת ריכוזי מטבוליט בדגימות. במהלך ניתוח LC-MS/MS הממוקד, יש לאמת ביאורים לא סופיים מניתוח MZmine על-ידי בדיקת שיא ידנית באמצעות דפדפן איכות MS, ויש לציין תכונות m/z רק כאשר שגיאות מסה מחושבות מקובלות. כאן, ניתוחים אלה בוצעו באופן ידני עבור קבוצה מוגבלת של מטרות מאז תוכנה מקיפה וחזקה לחיפוש איזוטופ עדיין לא הוקמה. עם זאת, שיטות אוטומטיות כאלה לחיפוש מטבוליטים עם תווית C 13מתעוררים כעת ויעלו גם ניתוחים מסובכים יותר, כמו יצירת פרופילים מעבר לחילוף החומרים המרכזישל הפחמן 25.
כרומטוגרפיה נוזלית מתקדמת היא שיטה חזקה ויישמת באופן נרחב להפרדת מולקולות קטנות בתערובות מטבוליות מורכבות11. השיטות המתוארות מצמידות טכניקת הפרדה זו עם אינדקס שבירה או זיהוי ספקטרומטרי מסה כדי לנתח בהצלחה המרות מטבוליטים בתגובות CFME מבוססות ליסאט. HPLC-RID ו-LC-MS/MS הם כלים רבי עוצמה בנפרד ליצירת פרופיל של חילוף חומרים פעיל של ליסאט, וניתן למנף את המשלים שלהם עוד יותר כדי לטפל במגבלות המובנות של כל טכניקה. השיטות המדווחות מאפשרות את היישום והפיתוח של CFME כפי שהם יכולים להיות מנוצלים כדי להבין את חילוף החומרים ליסאט, לפקח על שיפורים בהמרות מטבוליט ממוקד, ולפרור שינויים שטף מטבוליט בעת מניפולציה חילוף החומרים ליסאט.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים ידועים או ניגודי עניינים אחרים.
Acknowledgements
מחקר זה נערך בחסות תוכנית המדע הגנומי, משרד האנרגיה של ארה"ב, המשרד למדע, מחקר ביולוגי וסביבתי, כחלק מאזור המיקוד המדעי של ממשקי חיידקי הצמח (http://pmi.ornl.gov). המעבדה הלאומית אוק רידג' מנוהלת על ידי UT-Battelle, LLC, עבור משרד האנרגיה האמריקאי תחת חוזה DE-AC05-00OR2725. כתב יד זה נכתב על ידי UT-Battelle, LLC תחת חוזה DE-AC05- 00OR22725 עם משרד האנרגיה האמריקאי. ממשלת ארצות הברית שומרת והמו"ל, על ידי קבלת המאמר לפרסום, מכיר בכך שממשלת ארצות הברית שומרת על רישיון עולמי שאינו בלעדי, משולם, בלתי הפיך, לפרסם או לשחזר את הצורה שפורסמה של כתב יד זה, או לאפשר לאחרים לעשות זאת, למטרות ממשלת ארצות הברית. משרד האנרגיה יספק גישה ציבורית לתוצאות אלה של מחקר בחסות פדרלית בהתאם לתוכנית הגישה הציבורית של DOE (http://energy.gov/downloads/doe-public-access-plan).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
References
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved