Method Article
Chromatographie liquide couplée à la détection par spectrométrie de réfraction ou de masse pour le profilage de métabolites dans des systèmes sans cellules à base de lysate
Dans cet article
Résumé
Les protocoles décrivent des méthodes de chromatographie liquide à haute performance couplées à la détection de l’indice de réfraction ou de la spectrométrie de masse pour l’étude des réactions métaboliques dans des systèmes complexes sans cellules à base de lysate.
Résumé
L’ingénierie du métabolisme cellulaire pour la biosynthèse ciblée peut nécessiter des cycles étendus de conception-construction-test-apprentissage (DBTL) pendant que l’ingénieur travaille autour des exigences de survie de la cellule. Alternativement, l’exécution de cycles DBTL dans des environnements sans cellules peut accélérer ce processus et atténuer les problèmes de compatibilité de l’hôte. Une approche prometteuse de l’ingénierie métabolique sans cellules (CFME) exploite des extraits de cellules brutes métaboliquement actifs comme plates-formes pour la biofabrication et pour la découverte et le prototypage rapides de protéines et de voies modifiées. La réalisation de ces capacités et l’optimisation des performances de CFME nécessitent des méthodes pour caractériser le métabolome des plates-formes sans cellules à base de lysate. C’est-à-dire que des outils analytiques sont nécessaires pour surveiller les améliorations des conversions ciblées de métabolites et pour élucider les altérations du flux de métabolites lors de la manipulation du métabolisme des lysates. Ici, des analyses de métabolites utilisant la chromatographie liquide à haute performance (CLHP) couplée à la détection optique ou par spectrométrie de masse ont été appliquées pour caractériser la production et le flux de métabolites dans les lysates d’E. coli S30. Plus précisément, ce rapport décrit la préparation d’échantillons de lysates CFME pour des analyses HPLC à l’aide de la détection de l’indice de réfraction (RID) afin de quantifier la génération d’intermédiaires et de sous-produits métaboliques centraux dans la conversion de substrats à faible coût (c.-à-d. le glucose) en divers produits de grande valeur. L’analyse de la conversion des métabolites dans les réactions CFME alimentées avec du glucose marqué 13C par chromatographie liquide en phase inversée couplée à la spectrométrie de masse en tandem (MS / MS), un outil puissant pour caractériser les rendements en métabolites spécifiques et le flux métabolique de lysate à partir de matériaux de départ, est également présentée. Dans l’ensemble, l’application de ces méthodes analytiques au métabolisme des lysates CFME permet l’avancement de ces systèmes en tant que plates-formes alternatives pour l’exécution de tâches d’ingénierie métabolique plus rapides ou nouvelles.
Introduction
Les limites de l’ingénierie des microbes pour la production chimique peuvent être corrigées en récapitulant les réactions biochimiques in vitro où les fonctions de survie cellulaire concurrentes sont absentes1. De plus, l’environnement réactionnel ouvert (c.-à-d. l’absence de membrane cellulaire) se prête mieux à la manipulation et est plus facile à surveiller que les cellules vivantes. Ce concept fondamental d’ingénierie métabolique sans cellules (CFME) a été élégamment démontré par la reconstitution de voies métaboliques pour synthétiser des produits chimiques précieux comme l’hydrogène et les monoterpènes avec des mesures de production supérieures à celles présentées dans les usines de cellules microbiennes jusqu’à présent1,2,3 . Les méthodes de purification de voies entières, cependant, sont actuellement limitées par le temps et le coût. Alternativement, les systèmes métaboliques sans cellules peuvent être dérivés d’extraits cellulaires bruts par des méthodes rapides et peu coûteuses par rapport à la reconstitution de la voie entière4. Le métabolisme central qui est retenu dans les extraits cellulaires peut être complété par des substrats énergétiques (par exemple, le glucose et les cofacteurs enzymatiques) et des sels dans des solutions tamponnées pour générer des précurseurs métaboliques centraux pendant plus de 24 h5,6. L’ajout d’enzymes exogènes à la réaction CFME à base de lysate permet des bio-transformations plus complexes du glucose en produits chimiques plus précieux à titres élevés4,6,7. Bien que le rendement ait tendance à être compromis dans ces systèmes en raison de leur complexité métabolique semblable à celle des cellules, des méthodes uniques pour organiser des protéomes de lysate pour une conversion de rendement plus élevé ont été et sont en cours de développement7,8.
La facilité d’effectuer des transformations métaboliques dans des systèmes sans cellules à base de lysate fait de ces excellentes plates-formes soit pour déplacer la fabrication chimique en dehors de la cellule, soit pour prototyper de nouvelles voies à haut débit avant de construire et de tester ces conceptions in vivo2,9. Pour l’une ou l’autre application, les outils de surveillance des conversions métaboliques ou d’observation des altérations globales du flux métabolique dans les lysates font partie intégrante de l’avancement de l’EMFC. La chromatographie liquide à haute performance (CLHP) peut être utilisée pour séparer les constituants chimiques des réactions CFME à haute résolution et peut être couplée à des détecteurs optiques ou spectrométriques de masse pour la quantification des métabolites5,10. Le principe sous-jacent de la CLHP est que les analytes dissous dans un solvant (c.-à-d. phase mobile) et pompés à travers une colonne interagiront avec le matériau d’emballage de colonne spécifique (c.-à-d. phase stationnaire)11. Selon leurs propriétés chimiques, ces analytes présentent des temps de rétention variables avant d’être finalement élués de la phase stationnaire et transportés par la phase mobile vers un détecteur. Ce rapport détaille la préparation et l’analyse des réactions CFME à base d’E. coli lysate au moyen de méthodes basées sur la CLHP tirant parti de la détection RID et MS/MS.
La CLHP couplée à la détection de l’indice de réfraction (HPLC-RID) est une méthode généralement accessible pour identifier rapidement les précurseurs métaboliques centraux et les produits finis. En bref, RID mesure comment les analytes modifient la déviation de la lumière par la phase mobile12. Les signaux RID correspondant aux analytes cibles dans les échantillons peuvent ensuite être quantifiés par comparaison avec les signaux RID des solutions standard. Dans les applications CFME, ce mode de détection a été le plus souvent utilisé avec les colonnes HPLC qui séparent les composés en fonction d’une combinaison de mécanismes d’exclusion de taille et d’échange de ligands, ou chromatographie de partition modérée parions 5,6,8,13. Cette technique particulière est utilisée pour quantifier rapidement la consommation de substrats de sucre comme le glucose ainsi que la formation de produits de fermentation comme le succinate, le lactate, le formant, l’acétate et l’éthanol dans les réactions CFME à base de lysate8. L’enregistrement des changements de concentration de ces composés via hpLC a été utile à la fois pour élucider le potentiel des extraits de cellules brutes à mettre en commun les précurseurs métaboliques centraux et pour comprendre comment le flux de voies est redirigé par des voies fermentatives lors de conversions métaboliques complexes du glucose dans les lysates6,8,14. Les études CFME séminales dans les extraits de cellules d’E. coli confirment que les composés de fermentation s’accumulent en tant que produits finaux du catabolisme du glucose et se présentent également comme sous-produits indésirables dans les lysates qui surexpriment les enzymes exogènes6,15. Il est suggéré que le métabolisme fermentatif joue un rôle nécessaire dans la régénération des équivalents redox des cofacteurs (c.-à-d. NAD(P)H et ATP) pour soutenir les réactions glycolytiques8. Par conséquent, une méthode de détection optique basée sur la CLHP conçue pour séparer les produits de fermentation est un outil utile et couramment appliqué lors de l’exécution de diverses tâches CFME à base de lysate.
CFME peut être mis en œuvre pour accumuler des produits finaux métaboliques qui ne sont pas des glucides, des acides organiques ou des alcools4. La mesure des intermédiaires consommés aussi rapidement qu’ils sont synthétisés peut également être souhaitable10. Bien que HPLC-RID soit accessible en termes de coût et de difficulté, cette méthode est limitée par sa capacité à ne distinguer que les métabolites en fonction du temps de rétention. Une gamme plus large de métabolites peut être analysée lorsque la chromatographie liquide est couplée à la détection MS/MS (LC-MS/MS)16. Par cette méthode, les analytes en phase mobile sont ionisés et détectés différentiellement en fonction des propriétés de masse et de charge de chaque molécule. La connaissance à la fois du rapport masse/charge (m/z) du métabolite et du temps de rétention sur la colonne facilite ainsi la séparation de la plupart des intermédiaires métaboliques et des produits finis avec une haute résolution16. Cette technique de détection peut également être couplée à la chromatographie nano-liquide, qui permet des débits et des volumes d’injection d’échantillons beaucoup plus faibles, permettant une détection plus sensible de petites molécules dans le fond de lysate complexe17. LC-MS/MS peut en outre être appliqué avec le marquage isotopique puisque les étiquettes incorporées donnent des changements dans les valeurs m/z des analytes18. Les mesures ponctuelles extraites d’une réaction CFME complétée par un substrat de 13C6-glucosepeuvent ainsi déterminer les produits finaux ou sous-produits dérivés spécifiquement du glucose supplémenté. Bien que cette méthode de traçage isotopique ne soit pas encore couramment appliquée dans les études CFME, il s’agit d’un outil puissant pour comprendre les conversions métaboliques dans les systèmes CFME à base de lysate, en particulier puisque les contre-ions de sel (c’est-à-dire l’acétate et le glutamate) dans ces réactions sont également catabolisés en tant que substrats secondaires19. Tirer parti de cette technique peut ainsi dresser un tableau complet du métabolisme du glucose dans les lysates, qui à ce jour n’est pas complètement compris. Ici, le protocole détaille une méthode de chromatographie nano-liquide couplée à l’ionisation par nanoélectropulisation (nano ESI) MS/MS qui peut être utilisée pour interroger un modèle possible du métabolisme du glucose, en particulier dans les lysates d’E. coli (Figure 1). Le modèle est basé sur des rapports de voies fermentatives et de la voie du pentose phosphate étant active dans les lysates d’E. coli dérivés de souches cultivées en milieux riches5,6,8,14. La technique est également utilisée pour étudier la production d’acides aminés puisque les connaissances actuelles sur l’anabolisme des acides aminés à partir du glucose dans les lysates se limitent à quelques exemples tels que la synthèse d’acides aminés aromatiques7. Compte tenu de la nature principalement polaire des produits finaux et des intermédiaires dans ces voies (c.-à-d. les acides organiques, les phosphates de sucre et les acides aminés), la chromatographie liquide en phase inverse a été utilisée ici. Cette technique sépare les composés polaires par élution d’une phase stationnaire non polaire. Ces composés ont ensuite été ionisés par nano ESI en mode ion négatif ce qui permet la détection d’analytes avec au moins une charge élémentaire négative et est donc utile pour détecter les composés acides. Cette technique est utilisée ici pour analyser les métabolites 13C-incorporés dérivés du glucose et démontre l’utilité de LC-MS/MS pour comprendre le métabolisme du glucose dans les lysates.
Protocole
1. Démarrage, arrêt et traitement des réactions CFME pour la quantification HPLC-RID.
- Décongeler les lysates d’E. coli préalablement préparés et préparer le reste des composants de la réaction sur de la glace.
REMARQUE: Les lysates rapportés ici sont dérivés de E. coli BL21DE3-Star cultivé dans un milieu 2xYPTG (1,8 % de glucose) à mi-log.- Préparer un volume approprié de tampon S30 stérilisé par filtre (filtre à pores de 0,20 μm) (1 M de Tris-OAc ajusté à un pH de 8,2 avec de l’acide acétique glacial, 1,4 M Mg(OAc)2et 6 M de KOAc).
- Préparez un mélange énergétique contenant du glucose, des sels de glutamate, de l’ATP, de la coenzyme A, du NAD+, du tampon Bis-Tris et du phosphate dipotassique dans le tampon S30. Les concentrations finales dans le volume de réaction souhaité utilisé pour préparer les réactions CFME ici étaient de 100 mM de glucose, 18 mM de glutamate de magnésium, 15 mM de glutamate d’ammonium, 195 mM de glutamate de potassium, 1 mM d’ATP, 0,2 mM de coenzyme A, 1 mM de NAD+,150 mM de Bis-Tris et 10 mM de phosphate dipotassique.
- Combiner les composants dans des tubes de microcentrifugation de 1,5 mL pour préparer les réactions finales avec 4,5 mg/mL de protéine de lysate total. Ici, les réactions CFME ont été préparées avec des volumes finaux de 50 μL en triple exemplaire par point temporel. Incuber les réactions à 37 °C pendant leurs périodes respectives.
REMARQUE: Travaillez rapidement et ajoutez du lysate comme composant final du mélange réactionnel pour prévenir les réactions métaboliques prématurées avec les sels de glucose et de glutamate. Une consommation minimale de glucose peut se produire en fonction de la durée pendant laquelle les mélanges de réaction sont incubés sur de la glace. - Terminez les réactions et traitez les échantillons pour l’analyse HPLC-RID.
- Pour mettre fin aux réactions de triplicate à leurs moments appropriés, ajoutez immédiatement un volume égal d’acide trichloroacétique à 5 % au volume de réaction final de chaque échantillon (c.-à-d. 50 μL d’acide trichloroacétique à 5 % à une réaction de 50 μL). Diluer chaque échantillon avec de l’eau stérile à 2 fois le volume de réaction (c.-à-d. 100 μL).
- Pour récapituler le temps zéro, mélanger le même volume d’acide trichloroacétique à 5 % que le volume total de réaction finale (c.-à-d. 50 μL) avec le lysate avant d’ajouter le reste des composants de la réaction. Cette étape d’acidification précipite les enzymes lysate avant qu’elles ne métabolisent significativement le glucose.
- Vortex les échantillons et centrifuger sur une microcentrifugeuse de paillasse à 11 600 x g pendant 5 min et transférer les surnageants contenant les analytes organiques dans des tubes propres. Conservez les échantillons à -20 °C si les analyses HPLC doivent être effectuées un autre jour. Assurez-vous de décongeler les échantillons entreposés sur de la glace avant de passer à l’étape suivante.
- Filtrer chaque surnageant avec un filtre à pores de 0,22 μm. Comme alternative aux seringues, utilisez des filtres à tube centrifuge et centrifugez les surnageants à 16 300 x g pendant 1 min.
- Transférer chaque filtrat dans un flacon en verre HPLC propre. Chargez les flacons sur le plateau d’échantillonnage automatique HPLC.
- Préparez des échantillons pour la génération de courbes standard.
- Préparer une solution mère de tous les analytes cibles dissous dans le tampon S30 à des quantités équimolaires supérieures à la concentration initiale de glucose dans les réactions CFME. Ici, une solution mère composée de 150 μM de glucose, de succinate, de lactate, de formate, d’acétate et d’éthanol a été préparée. Effectuer des dilutions en série 1:1 (v/v) à partir de la solution mère pour obtenir des solutions triples de 50 μL avec des concentrations finales allant de 0 μM à la concentration sur le stock (c.-à-d. 150 μM).
- Diluer chaque solution avec 50 μL d’acide trichloroacétique à 5 % et 100 μL d’eau stérile. Répétez les étapes 1.3.4 à 1.3.5.
REMARQUE: Exécutez des solutions pour la génération de courbes standard avec chaque lot d’échantillons afin d’assurer une quantification précise des concentrations de métabolites.
2. Préparation du système CLHP pour la détection des métabolites.
- Sous une hotte, préparer une solution stérilisée d’acide sulfurique de 5 mM à partir d’eau désionisée et stérilisée par filtre. Ajouter ~550 μL d’une solution d’acide sulfurique de qualité CLHP à 98% à 2 L d’eau pour préparer 5 mM d’acide sulfurique.
ATTENTION: L’acide sulfurique est un produit chimique dangereux et travailler sous une hotte avec un EPI de laboratoire approprié empêche l’inhalation, le contact avec la peau et le contact visuel. L’acide sulfurique concentré réagit vigoureusement avec l’eau et doit être ajouté directement à l’eau, et non l’inverse. Conserver dans un endroit frais et sec, à l’écart de la lumière directe du soleil et suivre les mesures d’élimination des déchets établies par le laboratoire. - Conservez la bouteille de 2 L d’acide sulfurique de 5 mM incubée dans un bain-marie à côté de l’instrument HPLC. Réglez le bain-marie sur 35 °C. Placez le tube avec un filtre à solvant dans la bouteille de solvant et fixez l’autre extrémité à un module de dégazage aligné avec le module de pompe.
REMARQUE: Purger le système avec un solvant fraîchement préparé avant d’installer la colonne est une bonne pratique de manipulation des instruments. - Équipez l’instrument HPLC de la colonne HPLC alignée sur le module RID. Placez la colonne dans le bain-marie à 35 °C si un thermostat à colonne n’est pas disponible.
- Préparez le module RID pour analyse à 35 °C dans le logiciel Chromatography Data System (CDS) installé sur l’ordinateur du système.
- Dans le menu Affichage, sélectionnez la méthode et exécutez la vue Contrôle. Cliquez avec le bouton droit de la souris sur le module de pompe > Methodmethod . Réglez le débit sur 0,55 mL·min-1 et sélectionnez le bouton On pour lancer la pompe.
REMARQUE: Si la colonne était entreposage avant d’être équipée de la CLHP, augmenter le débit à 0,55 mL·min-1 après avoir équilibré la colonne en suivant les instructions du fabricant. - Cliquez avec le bouton droit de la souris sur le panneau correspondant à la méthode rid Module >. Réglez la température du module de détection RI sur 35 °C et sélectionnez Activé pour commencer à réchauffer le module de détection RI.
- Cliquez avec le bouton droit de la souris sur le panneau RID Module > Control. Sélectionnez Activé pour la cellule de référence de purge pendant au moins 15 minutes lors de l’utilisation d’un solvant frais ou 1 h si différents solvants ont traversé le détecteur RI avant cette configuration. Cliquez sur le bouton Activé.
REMARQUE: Gardez la pompe et le détecteur RI allumés pour obtenir une base de référence stable sur le tracé en ligne. Ceci est affecté par les fluctuations de température dans le laboratoire et peut prendre jusqu’à 4 h ou plus. Gardez le système allumé pendant la nuit avant le chargement de l’échantillon.
- Dans le menu Affichage, sélectionnez la méthode et exécutez la vue Contrôle. Cliquez avec le bouton droit de la souris sur le module de pompe > Methodmethod . Réglez le débit sur 0,55 mL·min-1 et sélectionnez le bouton On pour lancer la pompe.
3. Création d’une méthode de séparation ISOCRATIQUE PAR CLHP des produits de fermentation organique dans le CDS.
- Dans la barre de menus, sélectionnez Méthode > Nouvelle méthode. Sélectionnez Méthode > Enregistrer la méthode sous le nom [MethodName].M. Sélectionnez méthode > Modifier la méthode entière >'instrument/acquisition
- Dans l’onglet Pompe binaire, réglez le débit sur 0,55 mL·min-1. Sous Solvants, sélectionnez la lettre correspondant à l’entrée de solvant sur le module de pompe et réglez-la à 100% pour l’élution isocratique. Réglez les limites de pression à 0 et 400 bar et entrez 30 min comme stoptime.
- Dans l’onglet Sampler, réglez le volume d’injection sur 50 μL. Sélectionnez l’option As Pump/No Limit sous Stoptime. Réglez les paramètres auxiliaires avancés pour la vitesse de tirage, la vitesse d’éjectionet la position de tirage sur 200 μL·min-1, 200 μL·min-1et -0,5 mm.
- Dans l’onglet RID, réglez la température de l’unité optique sur 35 °C. Sous Signal, sélectionnez Acquérir pour Signal et >0,2 min pour Peakwidth. Sélectionnez l’option As Pump/Injector (En tant que pompe/injecteur) pour Stoptime(
- Sous Avancé dans l’onglet RID, définissez Sortie analogique sur 5 % de décalage zéro et 500 000 nRIU pour l’atténuation. Sélectionnez l’option Positif pour la polarité du signal et l’option Activé pour l’option Zéro automatique avant analyse.
- Enregistrez la méthode en sélectionnant Méthode > Enregistrer la méthode. Chargez la méthode en sélectionnant Méthode > Méthode de chargement > [MethodName]. M.
4. Création d’une table de séquence pour l’échantillonnage automatique et démarrage du système HPLC-RID pour l’acquisition de données.
- Dans la barre de menus, sélectionnez Séquence > Nouveau modèle de séquence. Sélectionnez Séquence > Enregistrer le modèle de séquence en tant que [SequenceTemplateName]. S.
- Sélectionnez Séquence > Table de séquences. Ajoutez 'n' lignes correspondant à 'n' flacons, puis entrez les positions des flacons et les noms des échantillons sous Le flacon et le Nom de l’échantillon,respectivement, en fonction de leur disposition sur le plateau d’échantillonnage automatique. Sélectionnez la méthode générée à l’étape 3 dans le menu déroulant Nom de la méthode et entrez 50 μL en tant qu’Inj/Flacon (Injection par flacon) pour chaque ligne.
- Cliquez sur Appliquer et enregistrez le modèle de séquence en sélectionnant Modèle de séquence > Enregistrer le modèle de séquence. Assurez-vous que le modèle de séquence est chargé en sélectionnant Séquence > Charger le modèle de séquence > [SequenceTemplateName]. S.
- Après avoir obtenu une ligne de base stable sur le graphique en ligne, cliquez avec le bouton droit de la souris sur le panneau module RID > Control > Off Recycling Valve pour diriger le flux de solvant à travers le détecteur RID vers les déchets. Pour démarrer l’acquisition de données, sélectionnez Séquence dans la barre de menus, Séquence > Exécuter.
5. Extraction et analyse des données après l’exécution.
- Sélectionnez Vue Analyse des données dans le menu Affichage. Recherchez le nom du fichier de séquence dans la liste des fichiers sur le côté gauche de l’écran. Sur le panneau central de l’écran, accédez à la sélection de la vue du signal > signal RID pour afficher les exemples de chromatogrammes.
- Sélectionnez une ligne correspondant à un échantillon standard à forte concentration dans le panneau supérieur de l’écran. Prenez note des temps de rétention pour les pics d’analyte cible sur le chromatogramme affiché. Les pics correspondant aux analytes cibles seront disposés le long de l’axe du temps de rétention comme le glucose, le succinate, le lactate, le formate, l’acétate etl’éthanol (figure supplémentaire 1).
REMARQUE: Le premier grand pic sur le chromatogramme correspond à l’acide trichloroacétique. Ses unités RI doivent être cohérentes dans tous les échantillons de courbes standard. Validez le temps de rétention de chaque analyte cible en exécutant chaque composé en tant qu’échantillon distinct. - Extraire les zones de crête pour chaque analyte cible à partir des chromatogrammes des étalons et des échantillons de réaction.
- Déterminez si les pics d’intérêt sont bien intégrés par le logiciel. Tracez la ligne rouge comme base de chaque pic pour obtenir une zone intégrée avec précision sous la courbe. Si l’intégration automatique échoue (c’est-à-dire que la ligne rouge est asymétrique), sélectionnez le bouton Intégration manuelle dans l’ensemble d’outils d’intégration et dessinez manuellement une base de crête pour intégrer la zone de crête.
REMARQUE : Si l’intégration manuelle doit être effectuée pour un analyte cible dans un échantillon, restez cohérent et intégrez manuellement le même analyte dans tous les échantillons. - Sélectionnez l’outil Curseur dans l’ensemble d’outils commun pour cliquer sur les pics correctement intégrés. La zone de crête et le temps de rétention correspondant du pic sélectionné seront mis en surbrillance sous la forme d’une ligne de tableau sur le panneau inférieur de l’écran.
- Pour exporter les zones de pointe, sélectionnez Fichier > Exporter les résultats de l’intégration >.
- Déterminez si les pics d’intérêt sont bien intégrés par le logiciel. Tracez la ligne rouge comme base de chaque pic pour obtenir une zone intégrée avec précision sous la courbe. Si l’intégration automatique échoue (c’est-à-dire que la ligne rouge est asymétrique), sélectionnez le bouton Intégration manuelle dans l’ensemble d’outils d’intégration et dessinez manuellement une base de crête pour intégrer la zone de crête.
- Quantifier les concentrations cibles d’analytes à l’aide de courbes standard.
- Tracer les valeurs de la zone de crête par rapport aux concentrations connues d’échantillons dans une feuille de calcul. Cliquez avec le bouton droit sur les données tracées, Ajouter une courbe de tendance > Format de ligne de tendance > Afficher l’équation sur le graphique.
- Dans une feuille de calcul distincte, utilisez les équations des courbes de tendance standard pour convertir les valeurs de la surface de crête en concentrations pour chaque analyte de chaque échantillon. Calculez les zones de crête moyennes et les valeurs d’erreur-type sur trois types pour la visualisation des données.
6. Démarrage, arrêt et traitement des réactions CFME de traçage isotopique pour la quantification LC-MS/MS.
- Mettre en place des réactions triples par point de temps (sauf le temps zéro) sur la glace comme décrit aux points 1.1-1.2. Cependant, au lieu de glucose, utilisez une concentration finale de 100 mM 13C6-glucosedans les réactions. Incuber les réactions à 37 °C pendant 1 h, 2 h et 3 h.
- Pour terminer, les flash gèlent les réactions dans de l’azote liquide et les stockent à -80 °C. Ignorez cette étape de stockage pour une analyse le jour même.
REMARQUE: L’acide trichloroacétique n’a pas été utilisé pour arrêter les réactions dues à l’interférence de l’acide lors de la détection de certains métabolites centraux du carbone via LC-MS / MS. Au lieu de cela, un solvant d’extraction contenant de l’acide formique (étape 6.3) a été utilisé pour précipiter les protéines métaboliques puisque la masse de l’acide formique est inférieure à la limite de détection de la méthode MS/MS rapportée. - Préparer 50 mL du solvant d’extraction. Combiner et vortex 20 mL d’acétonitrile, 20 mL de méthanol et 10 mL d’eau (tous de qualité LC-MS) dans un tube de centrifugeuse de 50 mL avec 0,199 mL d’acide formique pour obtenir une solution de 0,1 M. Refroidir le solvant à 4 °C pendant l’extraction et le conserver à -20 °C lorsqu’il n’est pas utilisé.
- Traitement des échantillons pour l’analyse LC-MS/MS
- Le jour de l’analyse, pipeter un volume équivalent du solvant d’extraction (c.-à-d. 50 μL) à chaque échantillon. Si les échantillons ont été congelés, ajouter le solvant d’extraction avant que les échantillons ne décongelent complètement pour éviter la réactivation du métabolisme du glucose. Effectuez toutes les étapes de traitement des échantillons sur la glace.
- Pour récapituler le temps zéro, pipeter le volume final de solvant d’extraction (c.-à-d. 50 μL) à un volume approprié de lysate pour la concentration finale souhaitée dans la réaction (c.-à-d. de 4,5 mg/mL dans un volume de réaction de 50 μL). Ajouter le reste des composants de réaction comme à l’étape 1.2. Cette étape d’acidification précipite les enzymes lysate avant qu’elles ne métabolisent significativement le glucose.
- Incuber les échantillons dans un solvant d’extraction sur de la glace pendant 30 min en agitant doucement, puis centrifuger les échantillons à 21 000 x g pendant 15 min à 4 °C pour séparer le surnageant de la protéine précipitée. Transférer 50 μL du surnageant dans les flacons d’échantillonneur automatique et charger les flacons sur le plateau à l’intérieur de l’échantillonneur automatique à 4 °C. Conservez le reste du surnageant à -20 °C pour des analyses futures.
7. Configuration du système LC pour l’analyse LC-MS/MS.
- Préparer 1 L de solvant A en dissolvant complètement 77,08 mg d’acétate d’ammonium dans 950 mL d’eau et 50 mL d’isopropanol. Préparer 1 L de solvant B avec 650 mL d’acétonitrile, 300 mL d’eau et 50 mL d’isopropanol avec 77,08 mg d’acétate d’ammonium. Assurez-vous que tous les solvants sont de qualité LC-MS.
- Connectez les bouteilles de solvant contenant les solvants A et B au module de pompe. Purger le système à un débit élevé pour éliminer/limiter toute contamination de l’air qui aurait pu se produire pendant l’équipement des solvants au système LC.
- Équipez le système d’une colonne c18 à phase inversée (longueur de colonne de 30 cm, diamètre intérieur de 75 μm et diamètre de particules de 5 μm). Conditionnez la colonne au système LC-MS en faisant couler 100 % de solvant B et en faisant remonter lentement le solvant A à 100 %.
REMARQUE: Les embouts de colonne ont été préparés à l’interne à l’aide d’un arracheur de micropipette et emballés avec des cellules de pression et de l’hélium.
8. Création d’une méthode sur le logiciel d’acquisition et d’interprétation de données LC-MS/MS pour le système LC lié aux spectromètres de masse à transformée de Fourier et à piège ionique.
- Ouvrez le logiciel Tune Plus pour modifier un fichier tune pour la méthode MS.
- Dans le fichier de la barre de menus, ouvrez un fichier de réglage en mode négatif préinstallé.
- Sélectionnez ScanMode dans la barre de menus, puis sélectionnez Définir la fenêtre d’analyse. Réglez le réglage de l’heure du microscan pour MSn sur 1 pour Ion Trap et FT.
- Accédez aux paramètres de la source Nano-ESI et réglez la tension de pulvérisation sur 4 kV. Modulez ceci jusqu’à ce qu’une électropulvérisation acceptable soit générée; en règle générale, l’électropulvérisation acceptable peut être obtenue dans la plage de 2 à 5 kV.
- Enregistrez le fichier de réglage.
- Générez une nouvelle méthode LC à l’aide de l’assistant de configuration du logiciel d’acquisition et d’interprétation des données de l’instrument. Ouvrez l’Assistant Configuration de la feuille de route > > séquence . Étant donné que ces méthodes ne nécessitent pas l’utilisation d’un chauffe-colonne, ignorez l’étape de contrôle de la température.
- Sous Options de la pompe à gradient de débit, sélectionnez Multistep. Dans la fenêtre suivante, insérez 7 lignes et réglez le débit pour chaque ligne sur 0,1 mL·min-1. Entrez les paramètres suivants pour chaque rangée: de 0 à 3 min, fournir 100% de solvant A; de 3 à 9 min, introduire un gradient de 100% solvant A à 20% solvant B; de 9 à 19 min, introduire un nouveau gradient de 20% solvant B à 100% solvant B; de 19 à 27 min, maintenir à 100% le solvant B; de 27 à 28 min, remettre le gradient à 100 % solvant A; de 28 à 44 min, rincer et reconditionner la colonne pour les essais ultérieurs en maintenant à 100 % le solvant A. Inclure une dernière étape pour abaisser le débit à 0,03 mL·min-1 à la fin du cycle afin de conserver le solvant lorsque le LC n’est pas utilisé.
- Appliquez les paramètres par défaut pour les options de l’échantillonneur > pression de la pompe comme option d’acquisition et utilisez le temps d’acquisition par défaut et utilisez les options de pression de pompe par défaut.
- Créez une méthode MS/MS en sélectionnant l’icône Orbitrap Velos Pro MS dans la barre latérale de la fenêtre Configuration de l’instrument.
- Cliquez sur Nouvelle méthode > MS/MS dépendant des données. Définissez Le temps d’acquisition sur la durée de l’exécution LC (c’est-à-dire 44 min), Segment sur 1 et Analyser les événements sur 11. Pour Tune File ( Fichier », sélectionnez le fichier modifié à l’étape 8.1.
REMARQUE : Le premier événement est une analyse précurseur MS1 à l’aide de la transformée de Fourier MS (FTMS). Les 10 événements suivants seront des analyses MS2 sélectionnant les 10 ions les plus intenses et les plus uniques dans chaque analyse précurseur pour la fragmentation MS2. - Pour l’événement 1, sous Description de l’analyse, définissez Analyseur sur FTMS et Polarité sur Négatif. Sous Paramètres MSn, utilisez une résolution de 30 000 et une énergie de collision normalisée de 35 V. Réglez les plages de balayage à 50 m/z pour la première masse et à 1800 m/z pour la dernière masse pour capturer de petites molécules.
- Pour les événements 2 à 11, sous Description de l’analyse, définissez Analyseur sur Piège à ions. Sélectionnez Analyse dépendante et cliquez sur Paramètres > Exclusion dynamique globale > et sélectionnez Activer; définissez une durée de répétition de 30 s et une durée d’exclusion de 120 s pour éliminer les analyses répétées à proximité.
- Accédez aux paramètres de l’événement d’analyse et définissez Mass Determined from Scan Event sur 1 pour tous les événements MS2 (2 à 11). Pour rechercher les 10 ions les plus intenses, définissez chaque événement d’analyse MS2 pour détecter unnième ion le plus intense du 1er au 10ème. Par conséquent, définissez l’événement 2 pour détecter 1 commen-ième ion le plus intense, l’événement 3 pour détecter 2, et ainsi de suite.
- Fermez la fenêtre d’installation et accédez à Fichier > Enregistrer sous [Method_Name].meth.
REMARQUE: Pour l’utilisation générale, l’entretien et l’étalonnage de l’instrument LC et du spectromètre de masse, reportez-vous aux instructions d’utilisation et aux manuels fournis par le fabricant.
- Cliquez sur Nouvelle méthode > MS/MS dépendant des données. Définissez Le temps d’acquisition sur la durée de l’exécution LC (c’est-à-dire 44 min), Segment sur 1 et Analyser les événements sur 11. Pour Tune File ( Fichier », sélectionnez le fichier modifié à l’étape 8.1.
9. Configuration d’une séquence d’exécution et démarrage de l’exécution LC-MS/MS.
- Configurez une séquence d’exécution à l’aide du logiciel d’acquisition et d’interprétation des données du système LC-MS/MS. Dans Roadmap > Sequence Setup, cliquez avec le bouton droit sur le tableau pour insérer autant de lignes que d’exemples. Pour chaque rangée, réglez l’Inj Vol sur 5 μL et la position sur la position respective du flacon sur le plateau d’échantillonnage automatique. Entrez les noms de fichiers sous forme d’exemples de noms et définissez le chemin d’accès souhaité pour les résultats d’exécution.
REMARQUE: Des flacons vierges contenant du solvant A peuvent être exécutés au début de la séquence et entre chaque ensemble d’échantillons triples (chaque ensemble de points temporels) pour rincer la colonne. - Pour démarrer l’exécution, mettez en surbrillance tous les noms de fichiers dans la séquence. Dans la barre de menus, sélectionnez Actions > Séquence d’exécution > OK.
10. Consolidation des fichiers et recherche d’annotations provisoires sur MZmine 2.53.
- Ouvrez MZmine et importez les fichiers de sortie '.raw' à partir de l’étape 9.1. Dans la barre de menus, sélectionnez Méthodes de données brutes > Importation de données brutes. Sélectionnez les fichiers correspondant aux exemples.
- Construisez une liste de pics distinguant les analyses MS1 et MS2. Dans la barre de menus, Méthodes de données brutes > détection de fonctionnalités > MS/MS Peaklist Builder. Les paramètres pertinents incluent m/z Window défini sur 0.01 et Time Window défini sur la durée de l’exécution. Sous Définir les filtres, sélectionnez Négatif comme Polarité et Centroided comme Type de spectre.
- Dans la barre de menus, accédez à Méthodes de liste de fonctionnalités > Détection de fonctionnalités > Peak Extender. Réglez la tolérance m/z sur 0,005 m/z ou 10 ppm et la hauteur minimale sur 1E3. Cette étape créera des pics entièrement étoffés.
- Supprimez les pics en double. Revenez à Méthodes de liste de fonctionnalités > Filtrage > Filtre de pic en double. Les paramètres pertinents incluent la tolérance m/z réglée sur 0,005 m/z ou 10 ppm et la tolérance RT réglée sur 5 min.
- Pour aligner les pics dans des fichiers de données similaires (c’est-à-dire ceux des réactions triples), revenez à Méthodes de liste de fonctionnalités > Normalisation > Étalonnage du temps de rétention. Assurez-vous de traiter des échantillons triples ensemble et de laisser de côté les blancs. Les paramètres pertinents incluent la tolérance m/z réglée sur 0,005 m/z ou 10 ppm, la tolérance RT réglée sur 3 min absolue (min) et l’intensité standard minimale réglée sur 1E3.
- Aligner les pics de tous les fichiers par m/z et le temps de rétention à partir des méthodes de liste de fonctionnalités > l’alignement >'aligneur RANSAC. Définissez la tolérance m/z sur 0,005 m/z ou 10 ppm, la tolérance RT et la tolérance RT après correction sur 44 et 39 min, respectivement, les itérations RANSAC sur 0, le nombre minimum de points sur 10 % et la valeur seuil sur 1. Cochez l’option Exiger le même état de charge.
- Correction de tous les points de données qui ont pu être perdus lors des étapes précédentes des méthodes de liste de fonctionnalités > remplissage des lacunes > Peak Finder. Les paramètres pertinents incluent la tolérance d’intensité réglée sur 50 %, la tolérance m/z réglée sur 0,005 m/z ou 10 ppm et la tolérance RT réglée sur 3 min. Activez la correction RT.
11. Calculer les masses en mode négatif de 13métabolites dérivés du glucose marqués C et rechercher les caractéristiques m/z de ces analytes dans des données filtrées.
- Calculez les masses de 13métabolites marqués C du métabolisme du glucose pour la recherche ciblée.
- Calculer la masse monoisotopique de chaque composé cible à partir du nombre d’atomes dans la formule moléculaire du composé et des masses monoisotopiques de chaque élément20.
- Calculer la masse en mode négatif [M-H] du composé en soustrayant la masse de 1 proton (1,007276 Da) de la masse monoisotopique. Il s’agit de la masse détectée par la détection MS en mode négatif après que les molécules ont été dépouillées d’un ion hydrogène pendant l’ionisation.
- À partir de la masse en mode négatif, calculez la masse du métabolite incorporant 13C. Ici, les masses d’isotopologues qui incorporent au maximum 13étiquettes C dérivées du glucose ont été calculées.
- Utilisez des masses calculées de 13métabolites marqués C pour rechercher et annoter les caractéristiques m/z à partir des résultats de MZmine. Pour chaque coup possible, calculez l’erreur de masse (ppm) à l’aide de l’équation suivante :
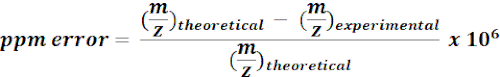
REMARQUE : Les valeurs expérimentales m/z avec une erreur de masse de <15 ppm ont été considérées comme des annotations putatives dans l’analyse actuelle. - Vérifiez manuellement les spectres des annotations putatives sur un navigateur de qualité pour confirmer les annotations.
- Ouvrez Roadmap > Qual Browser. Dans la barre d’outils, ouvrez Fichier brut pour importer les données MS brutes de chaque échantillon.
- Tracez une ligne sous la plage de temps de rétention souhaitée (c.-à-d. correspondant à l’annotation putative) sur le chromatogramme ionique total (panneau supérieur) pour afficher un spectre de masse (panneau inférieur). Faites un clic droit sur le spectre et entrez une plage de masses qui englobent le m/z de l’analyte cible. Vérifiez si les annotations putatives ont des signaux de crête distincts qui sont sensiblement supérieurs au bruit (Figure supplémentaire 2).
- Calculez les zones de crête moyennes et les erreurs-types des annotations positives sur les répliques biologiques pour chaque point temporel. Visualisez les données (c.-à-d. sur un graphique à barres) pour observer les tendances du métabolisme du glucose.
Résultats
Pour quantifier la synthèse sans cellules à base de lysate des produits de fermentation courants à partir du glucose, les lysates dérivés de souches cultivées dans des milieux 2xYPTG ont été nourris avec 100 μM de glucose comme source primaire de carbone8. Les réactions ont été arrêtées sur une période de 24 heures par acidification des protéines. Les surnageants filtrés contenant du pyruvate, du succinate, du lactate, du formate, de l’acétate et de l’éthanol produits à partir du catabolisme du glucose ont été chargés sur le module d’échantillonnage automatique d’un système HPLC équipé d’un module RID. Des flacons avec des mélanges filtrés de produits finis fermentatifs et de glucose à 1,17 μM, 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM et 150 μM dans le tampon S30 ont été chargés sur l’instrument en tant que normes. Les analytes ont été élués isocratiquement d’une colonne HPLC au RID. Les pics de glucose, de succinate, de lactate, de formate, d’acétate et d’éthanol dans la plage de 1 à 150 μM pourraient être résolus par RID. Les zones de pic pour le glucose ont été dérivées par intégration manuelle à partir des données rid pour les échantillons de trajectoire temporelle et de courbe standard. Les zones de crête extraites pour le succinate, le lactate, le formate, l’acétate et l’éthanol ont été prélevées à partir de signaux intégrés automatiquement. Toutes les courbes standard (surface de crête vs concentration connue) avaient des valeursR2 >0,99 et étaient linéaires dans toute la plage de concentrations utilisée ici.
Les concentrations molaires pour tous les analytes cibles ont été calculées à partir de leurs courbes standard respectives. Le glucose a été consommé dans les 3 premières heures de la réaction et principalement fermenté en lactate (Figure 2A, B). L’accumulation d’éthanol s’est également produite de manière significative au cours des 3 premières heures de la réaction et s’est arrêtée par la suite(figure 2C). L’observation d’une production significative de lactate et d’éthanol avec une consommation significative de glucose après 3 h n’était pas sans précédent puisque les voies de production de lactate et d’éthanol permettent la régénération de 1 mol net NAD+ à partir de NADH glycolytique nécessaire à une consommation continue de glucose par glycolyse (Figure 1). Le lactate et l’éthanol peuvent donc être considérés comme les principaux produits finaux de fermentation dans le métabolisme du glucose sans cellules à base de lysate. L’acétate était initialement présent dans les réactions en tant que composant du tampon S30 et ne s’est accumulé de manière inattendue en raison du métabolisme qu’après 6 h lorsque la consommation de glucose avait ralenti (Figure 2D). Ce résultat suggère que la fermentation de l’acétate ne permet pas nécessairement un flux glycolytique rapide dans les moments antérieurs. Pendant ce temps, le formate et le succinate ont été synthétisés en tant que produits de fermentation mineurs(Figure 2E,F). Dans l’ensemble, la méthode a permis la quantification absolue de l’épuisement du substrat de sucre et de la formation de produit fermentatif dans les lysates d’E. coli S30.
La détection de la SEP pour profiler le métabolisme du glucose lysate a été spécifiquement appliquée ici. Les lysates dérivés de souches cultivées dans des milieux 2xYPTG ont été nourris avec 13C6-glucosecomme source de carbone. Les réactions CFME ont été exécutées en triplicate pendant 0 h, 1 h, 2 h et 3 h. Les échantillons de chaque point temporel ont été chargés sur un système LC équipé d’une colonne de phase inversée et couplé à des spectromètres de masse à transformée de Fourier et à piège à ions. Des spectres de mode ionique négatif ont été obtenus et traités pour analyser les acides organiques, les phosphates de sucre et les acides aminés. Les masses théoriques calculées de 13espèces étiquetées C appartenant au métabolisme central du carbone ont été recherchées pour identifier spécifiquement les composés dérivés du glucose. Sur la base des conditions de culture de la souche source utilisée et des rapports antérieurs de voies actives dans E. coli CFME, on suppose ici que le protéome de lysate comprend un réseau métabolique qui alimente le glucose dans la fermentation glycolytique, la voie du phosphate de pentose et éventuellement l’anabolisme des acides aminés5,6,7,8,14 ( Figure1). Par conséquent, la recherche a été réduite aux membres de ces voies, dont 16 métabolites incorporant des étiquettes 13C dérivées du glucose ont été annotés sans ambiguïté (Tableau supplémentaire 1).
13 LeC6-glucosea été consommé de manière observable par glycolyse, comme en témoignent les fluctuations des abondances intermédiaires glycolytiques (Figure 3A-E). Conformément aux données HPLC-RID, le glucose s’est accumulé en 13C3-lactateet a également été fermenté en 13C3-succinatedans les 3 premières heures de la réaction(Figure 4A,B). La formation d’isotopologue du 13-succinatedeC3soutient le modèle proposé de métabolisme du glucose lysate(Figure 1),où le succinate est susceptible d’être généré par la carboxylation de la molécule de phosphoénolpyruvate de 3-carbone (PEP) et non par l’entrée d’une molécule d’acétyl-CoA à 2 carbones dans le cycle TCA. L’activation du cycle TCA a été supposée dans les études CFME précédentes, mais 13autres intermédiaires marqués C du TCA n’ont pas été détectés ici8,19,21. 13 La synthèse du C3-aspartate s’est toutefois produite au cours du premier h et a été consommée, renforçant l’idée que la PPE est directement convertie en oxaloacétate (Figure 1, Figure 6C). Les données reflètent un protéome de lysate provenant de souches sources récoltées au cours de la croissance fermentative sur des milieux riches en glucose (2xYPTG). Cela impliquerait en outre que le reste des enzymes TCA ne participant pas à la production de succinate forment une branche oxydative de TCA (Figure 1). Cependant, aucun des métabolites de cette voie n’a été détecté, peut-être parce que des concentrations élevées de glutamate ajoutées à la réaction CFME en tant que contre-ion de sel empêchent la progression de cette branche.
Les données HPLC-RID sont en outre complétées par l’absence de détection de 13C2-acétatedans le délai de réaction de 3 h, ce qui suggère qu’il n’y a pas d’accumulation d’acétate à partir du glucose jusqu’à 3 h(Figure 2B). Cependant, le précurseur direct de l’acétate, l’acétyl-phosphate (acétyl-P), s’est accumulé, suggérant que le bras Pta de la voie Pta-AckA pour la synthèse de l’acétate à partir de l’acétyl-CoA est actif(Figure 4C,D). La déphosphorylation catalysée par AckA de 13C2-acétyl-P à 13C2-acétatene se produit probablement pas dans ce délai car l’acétate est un composant majeur du tampon S30 utilisé dans les réactions (Figure 1, Figure 2B).
L’incorporation de 13carbones dérivés du glucoseen C6dans les phosphates de sucre 6-phosphogluconolactone (6PGL), 6-phosphogluconate (6PG), ribulose-5-phosphate (Ru5P) et sedoheptulose-7-phosphate (S7P) a également été observée(Figure 5). Ces résultats confirment la participation de la voie du pentose phosphate dans le métabolisme du lysate de glucose et alimentent probablement la synthèse de 13C 9-tyrosine, ce qui a été suggéré précédemment par une étude protéomique, tout en fournissant également un précurseur pour la production de 13C5-histidine( Figure6A, B)7. La phénylalanine et le tryptophane marqués n’ont pas été observés ici, pas plus que la plupart des acides aminés essentiels. Cependant, cela n’est pas tout à fait surprenant puisque l’anabolisme des acides aminés est susceptible d’être enrichi en lysates dérivés de cellules cultivées dans des conditions pauvres en nutriments ou à la phase stationnaire7,22. De plus, les données jusqu’à présent suggèrent que les intermédiaires de la glycolyse et de la fermentation sont canalisés vers des réactions finales de régénération des cofacteurs, ce qui doit empêcher la synthèse de nombreux acides aminés dérivés du glycéraldéhyde-3-phosphate, du pyruvate et de l’acétyl-CoA (c’est-à-dire la glycine, la cystéine, la sérine, l’alanine, la valine, la leucine et la lysine)(figure 1). Comme mentionné, 13-aspartatedeC3a été produit dans la première heure, tandis que l’aspartate dérivé de 13acides aminés incorporant du C (c.-à-d. thréonine, isoleucine, méthionine et asparagine) n’ont pas été observés, peut-être parce que l’aspartate dérivé du glucose participe à la fermentation (Figure 1, Figure 6C). Enfin, le flux vers le glutamate marqué et les acides aminés dérivés du glutamate peut avoir été entravé par des niveaux élevés de glutamate dans l’environnement réactionnel (Figure 1).
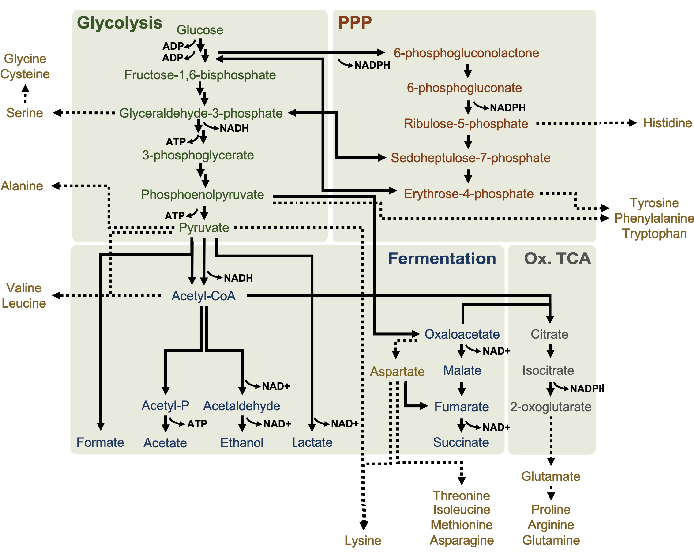
Figure 1: Un modèle métabolique putatif de lysates dérivés de E. coli BL21DE3-Star en croissance exponentielle à des concentrations élevées de glucose. Des intermédiaires et des produits finaux de la glycolyse (vert), de la voie du pentose phosphate (orange foncé) et des voies fermentatives (bleu) de l’acétyl-CoA ont été rapportés dans le CFME à base de lysate. La présence de fermentation du succinate implique l’activation de la branche oxydative du TCA (gris). L’anabolisme des acides aminés (or) dans les lysates n’est pas bien défini et est étudié ici. Veuillez cliquer ici pour voir une version agrandie de cette figure.
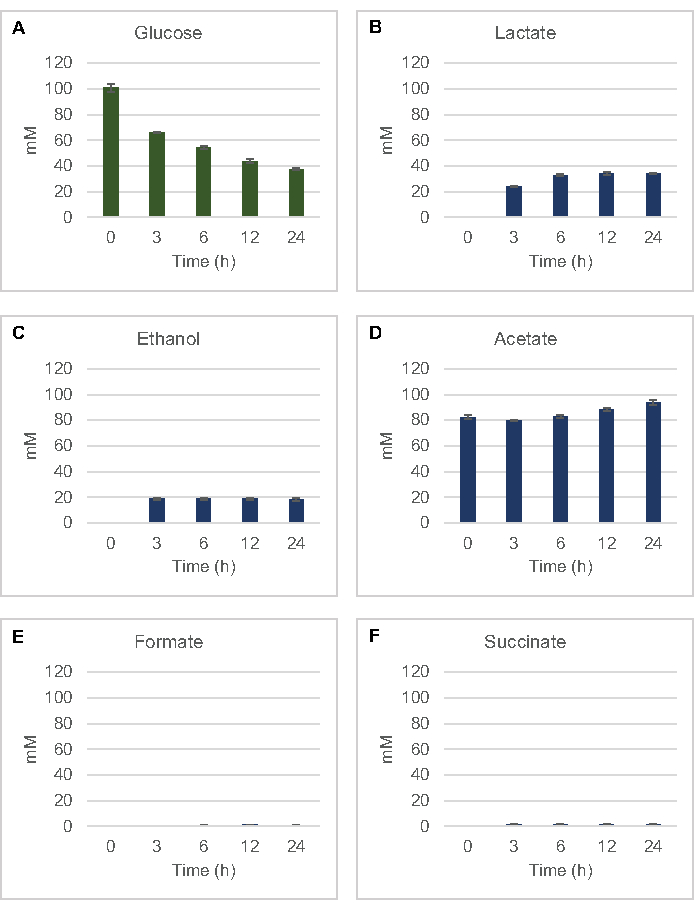
Figure 2: Les données HPLC-RID pour la consommation de glucose et la synthèse fermentative du produit final dans les réactions CFME préparées avec des extraits bruts d’E. coli. (A) La consommation de glucose et (B) le lactate, (C) l’éthanol, (D) l’acétate , (E) le formage et (F) la production de succinate dans les réactions CFME ont été surveillées pendant 24 h. Les concentrations moyennes de mM et les barres d’erreur (SE) quantifiées à l’avec des courbes standard sont présentées (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
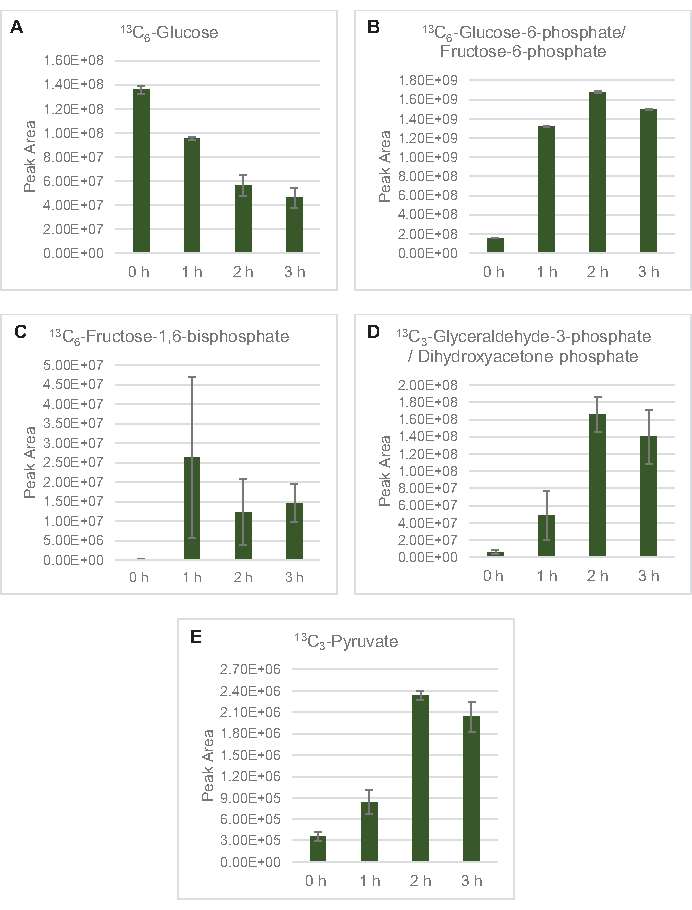
Figure 3: Tendances temporelles du 13C6-glucoseet de 13intermédiaires glycolytiques marqués C dans E. coli lysate CFME. Abondances relatives de (A) 13C6-glucose, (B) 13C6-glucose-6-phosphate/fructose-6-phosphate, (C ) 13C6-fructose-1,6-bisphosphate, (D) 13C3-glycéraldéhyde-3-phosphate / phosphate de dihydroxyacétone, et (E) 13C6 -pyruvate dans les réactions CFME sur 3 h. Les zones de crête brutes extraites par le logiciel mzMINE ont été utilisées pour calculer les moyennes et les barres d’erreur (SE) pour les annotations positives (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4: Évolution temporelle des produits intermédiaires et des produits finis dans la fermentation du glucose 13C6dans le lysate d’E. coli CFME. Abondances relatives de (A) 13C3-lactate,(B) 13C3-succinate, (C) 13C2-acétyl-phosphate, et (D) 13C2-acétyl-CoA dans les réactions CFME sur 3 h. Les zones de crête brutes extraites par le logiciel mzMINE ont été utilisées pour calculer les moyennes et les barres d’erreur (SE) pour les annotations positives (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
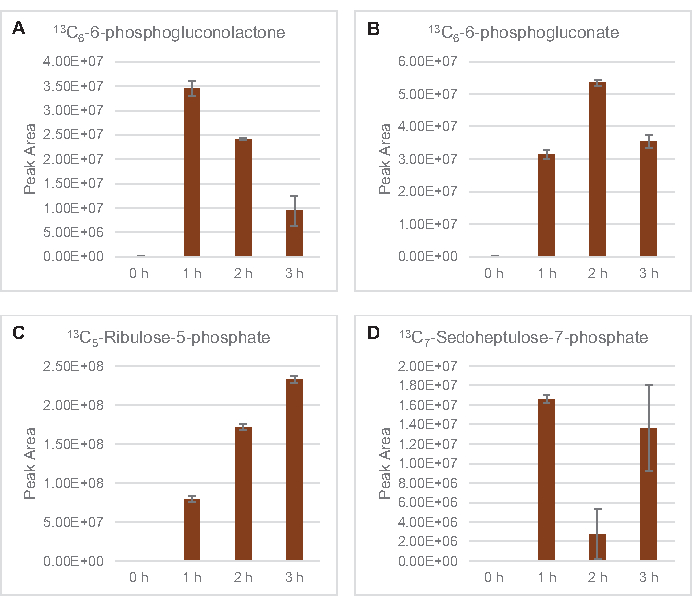
Figure 5: Tendances temporelles de la voie du pentose phosphate dérivé du 13C6-glucosedans le lysate d’E. coli CFME. Abondances relatives de (A) 13C6-6-phosphogluconolactone, (B) 13C6-6-phosphogluconate,(C) 13C5-ribulose-5-phosphate, et (D) 13C7-sédoheptulose-7-phosphate sur 3 h. Les zones de crête brutes extraites par le logiciel mzMINE ont été utilisées pour calculer les moyennes et les barres d’erreur (SE) pour les annotations positives (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
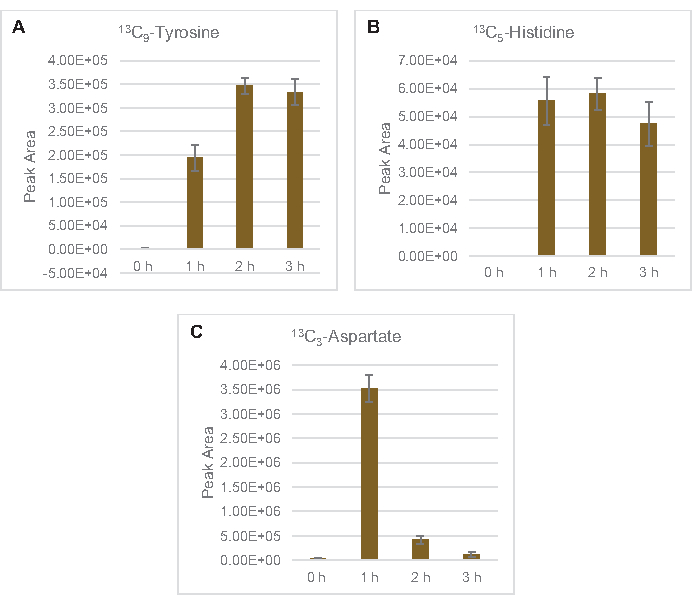
Figure 6: Tendances temporelles des acides aminés dérivés du 13C6-glucosedétectés dans le lysate d’E. coli CFME. Abondances relatives de (A) 13C9-tyrosine, (B) 13C5-histidine, et (C) 13C3-aspartate sur 3 h. Les zones de crête brutes extraites par le logiciel mzMINE ont été utilisées pour calculer les moyennes et les barres d’erreur (SE) pour les annotations positives (n = 3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1: Chromatogramme HPLC-RID représentatif montrant les pics pour les principaux produits fermentatifs dans une réaction CFME incubée à 37 °C pendant 24 h. Les pics de glucose, de succinate, de lactate, de formate, d’acétate et d’éthanol se distinguent suffisamment par leurs temps de rétention sur une colonne HPLC lors de l’élution isocratique avec un solvant d’acide sulfurique de 5 mM. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2: Spectres de masse représentatifs pour les métabolites marqués au 13C, en particulier le lactate (A), le glucose (B) et le 6-phosphogluconate (6PG) dans une réaction CFME incubée à 37 °C pendant 1 h. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1: Liste des 13métabolites marqués C détectés, temps de rétention (alignés sur les échantillons à l’aide de MZmine), valeurs théoriques m/zen mode négatif marqué c, valeurs m/z des caractéristiques détectées et erreurs de masse calculées. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
L’approche HPLC-RID décrite peut être utilisée pour quantifier avec succès la consommation de substrat de sucre et les conversions ultérieures en principaux produits d’acide organique et d’alcool du métabolisme central du lysate au fil du temps. De plus, ce protocole utilise une méthode isocratique simple utilisant une seule phase mobile, nécessite une préparation minimale des échantillons et permet une analyse ciblée simple en aval. Les analytes mesurés par la méthode HPLC-RID se distinguent uniquement par leurs temps de rétention, et donc leurs interactions avec la résine de colonne sélectionnée. La colonne CLHP utilisée ici a été particulièrement conçue pour séparer les glucides, les acides organiques et les alcools en combinant l’exclusion de taille et l’échange de ligands (c.-à-d. chromatographie de partition modérée par ions). La méthode décrite est donc utile pour une analyse plus ciblée des substrats glucidiques et de certains produits finaux des voies de fermentation du glucose qui devraient principalement faciliter et dynamiser les bio-transformations à base de lysate8,15,21. Cependant, ce protocole ne tient pas compte de l’activation d’autres voies métaboliques dans les extraits cellulaires. Des pipelines utilisant d’autres techniques de séparation chromatographique (c.-à-d. chromatographie par interaction hydrophile), des méthodes d’élution par gradient, une préparation d’échantillon plus compliquée (c.-à-d. la dérivatisation) et différents détecteurs optiques (p. ex., détecteurs de diffusion de lumière ultraviolette ou de lumière par évaporation) pourraient être utilisés pour détecter d’autres métabolites tels que les acides aminés et les phosphates de sucre23,24 . Alternativement, une approche globale pour étudier le métabolisme du lysate peut être prise en utilisant LC-MS / MS.
La méthode LC-MS/MS décrite est un flux de travail unique permettant de mesurer et d’identifier un plus large éventail de métabolites. LC-MS/MS est un outil analytique de pointe pour le profilage du métabolome en raison de sa sensibilité et de sa capacité à distinguer les métabolites par temps de rétention et rapports m/z avec une haute résolution16. En mettant l’accent sur les voies métaboliques centrales du carbone et l’anabolisme des acides aminés, le mode négatif MS / MS a été mis en œuvre pour détecter spécifiquement les acides organiques polaires, les phosphates de sucre et les acides aminés. Couplée à une technique de chromatographie nano-liquide, la méthode offre une sensibilité élevée pour la détection de petites molécules dans le fond de lysate complexe17. En ce qui concerne le profilage du métabolisme CFME à base de lysate, cependant, une limitation du protocole LC-MS/MS décrit est sa limite de détection inférieure de 50 m/z, ce qui empêche la mesure de l’éthanol, un produit majeur dans le métabolisme du glucose lysate, ainsi que du formate, qui sont tous deux autrement facilement quantifiés par la méthode détaillée HPLC-RID. Par rapport au LC-MS/MS, HPLC-RID présente l’avantage supplémentaire d’une accessibilité relative en termes de coût et de difficulté. À ce dernier point, le dépannage de la méthode LC-MS/MS décrite ici peut nécessiter un certain degré d’expertise en spectrométrie de masse. Néanmoins, la détection de la SEP a des applications particulièrement attrayantes par rapport au RID car elle peut également distinguer les isotopes marqués dans les métabolomes, une excellente technique pour comprendre le mouvement du carbone à partir de substrats supplémentés à travers le réseau métabolique complexe de lysate18. Une telle approche a été appliquée ici en complétant les réactions avec du 13C6-glucoseet en analysant les valeurs d’abondance relative des métabolites incorporant 13C en aval. L’analyse a permis de définir les voies actives et inactives, soutenant les hypothèses précédemment rapportées et fournissant de nouvelles informations sur le flux métabolique dans les lysates. Des modifications peuvent également être apportées à la méthode pour des analyses spécifiques. Par exemple, des solutions étalons de 13composés cibles marqués C peuvent être analysées avec des échantillons pour obtenir des mesures quantitatives absolues de molécules dérivées du glucose au fil du temps et tirer des conclusions sur les distributions de flux. Une meilleure détection des composés chargés positivement peut également être activée dans le flux de travail actuel en exécutant des séquences avec des fichiers .meth ajustés pour la détection en mode positif.
L’échantillonnage analytique dans les deux méthodes décrites est facilement automatisé, ce qui garantit une reproductibilité élevée. De plus, on peut s’attendre à des analyses fluides tant que les bonnes pratiques de manipulation et de maintenance des instruments sont observées. Lors de l’utilisation de ces outils pour analyser les réactions CFME, des considérations plus critiques devraient être prises en amont et en aval de l’échantillonnage. Lors de la préparation de l’échantillon, il est important que les contrôles de parcours temporel soient représentatifs du temps zéro. Ici, les protéines ont été précipitées dans les lysates par acidification pour arrêter les réactions métaboliques. Pour les échantillons à temps zéro, le solvant acide a été combiné avec du lysate avant d’ajouter le mélange réactionnel contenant du glucose. L’acidification avec de l’acide trichloroacétique a permis de s’assurer efficacement que le glucose n’est pas métabolisé à zéro temps, comme le montrent les données HPLC-RID (Figure 2). Bien qu’une procédure similaire pour éteindre le métabolisme du glucose ait été effectuée dans l’analyse LC-MS/MS rapportée, 13métabolites marqués C ont été détectés dans des échantillons à temps zéro, bien qu’à des valeurs d’abondance significativement faibles par rapport aux échantillons extraits à des moments ultérieurs. De plus, ces observations étaient limitées aux intermédiaires de la glycolyse. Les données suggèrent que les réactions conservent un certain degré d’activité glycolytique après acidification avec le solvant d’extraction détecté par cette méthode très sensible. L’ampleur de cette activité doit toutefois être quantifiée. Une étude précédente a rapporté que les solvants d’extraction acides peuvent ne pas étancher suffisamment les réactions glycolytiques intermédiaires, mais peuvent arrêter une consommation significative de glucose10. Bien que cela reste à étudier plus avant dans le système utilisé ici, des changements drastiques dans les valeurs d’abondance relative entre les échantillons de temps zéro et de point de temps ultérieur peuvent être interprétés comme des tendances dans le métabolisme du glucose. L’exploration de méthodes de trempe alternatives, cependant, est recommandée dans des applications similaires, en particulier pour obtenir des quantités absolues d’intermédiaires métaboliques10. En outre, les bonnes pratiques lors des analyses logicielles en aval doivent également être observées. La cohérence est impérative lors de l’intégration manuelle des zones de crête à partir des signaux RID afin de réduire les erreurs humaines. L’intégration manuelle devrait également être appliquée aux zones de pointe des normes chaque fois que des zones de crête intégrées manuellement sont utilisées pour quantifier les concentrations de métabolites dans les échantillons. Tout au long de l’analyse LC-MS/MS ciblée, les annotations provisoires de l’analyse MZmine doivent être validées par une vérification manuelle des pics à l’aide d’un navigateur de qualité MS, et les fonctionnalités m/z ne doivent être annotées que lorsque les erreurs de masse calculées sont acceptables. Ici, ces analyses ont été effectuées manuellement pour un ensemble limité de cibles puisque le logiciel complet et robuste pour la recherche d’isotopes n’est pas encore établi. Cependant, de telles méthodes automatisées pour la recherche de métabolites marqués au 13C sont actuellement en train d’émerger et rationaliseraient également des analyses plus compliquées, comme le profilage des lysates au-delà du métabolisme central du carbone25.
La chromatographie liquide avancée est une méthode robuste et largement appliquée pour séparer de petites molécules dans des mélanges métaboliques complexes11. Les méthodes décrites associent cette technique de séparation à l’indice de réfraction ou à la détection par spectrométrie de masse pour analyser avec succès les conversions de métabolites dans les réactions CFME à base de lysate. HPLC-RID et LC-MS/MS sont des outils individuellement puissants pour profiler le métabolisme actif des lysates, et leur complémentarité peut être exploitée pour répondre aux limites inhérentes à chaque technique. Les méthodes rapportées permettent l’application et le développement de CFME car elles peuvent être utilisées pour comprendre le métabolisme des lysates, surveiller les améliorations dans les conversions ciblées de métabolites et élucider les altérations du flux de métabolites lors de la manipulation du métabolisme des lysates.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou d’autres conflits d’intérêts.
Remerciements
Cette recherche a été parrainée par le Genomic Science Program, U.S. Department of Energy, Office of Science, Biological and Environmental Research, dans le cadre du Domaine d’intérêt scientifique sur les interfaces microbienne végétales (http://pmi.ornl.gov). Oak Ridge National Laboratory est géré par UT-Battelle, LLC, pour le département de l’Énergie des États-Unis en vertu du contrat DE-AC05-00OR22725. Ce manuscrit a été rédigé par UT-Battelle, LLC en vertu du contrat DE-AC05- 00OR22725 avec le département de l’Énergie des États-Unis. Le Gouvernement des États-Unis conserve et l’éditeur, en acceptant l’article pour publication, reconnaît que le Gouvernement des États-Unis conserve une licence mondiale non exclusive, payante, irrévocable et mondiale pour publier ou reproduire la forme publiée de ce manuscrit, ou permettre à d’autres de le faire, aux fins du Gouvernement des États-Unis. Le ministère de l’Énergie donnera au public accès à ces résultats de recherche parrainée par le gouvernement fédéral conformément au Plan d’accès public (http://energy.gov/downloads/doe-public-access-plan).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Références
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon