Method Article
Cromatografia líquida acoplada ao índice refrativo ou detecção espectrométrica em massa para perfil metabólito em sistemas livres de células baseadas em lysato
Neste Artigo
Resumo
Os protocolos descrevem métodos de cromatografia líquida de alto desempenho acoplados ao índice refrativo ou detecção espectrométrica em massa para estudar reações metabólicas em sistemas complexos de isenta de células baseadas em lysato.
Resumo
O metabolismo celular de engenharia para biossíntese direcionada pode exigir extensos ciclos de aprendizado de projeto-construção-teste (DBTL) à medida que o engenheiro trabalha em torno dos requisitos de sobrevivência da célula. Alternativamente, a realização de ciclos DBTL em ambientes livres de células pode acelerar esse processo e aliviar as preocupações com a compatibilidade do host. Uma abordagem promissora para a engenharia metabólica livre de células (CFME) aproveita extratos de células brutas metabolicamente ativos como plataformas para a biocoformação e para a rápida descoberta e prototipagem de proteínas e caminhos modificados. Realizar esses recursos e otimizar o desempenho do CFME requer métodos para caracterizar o metabolome de plataformas sem células baseadas em lysato. Ou seja, ferramentas analíticas são necessárias para monitorar melhorias nas conversões metabólicas e em elucidar alterações ao fluxo metabólito ao manipular o metabolismo do lysate. Aqui, foram aplicadas análises metabólicas utilizando cromatografia líquida de alto desempenho (HPLC) juntamente com detecção espectrométrica óptica ou de massa para caracterizar a produção metabólica e o fluxo em lysatos E. coli S30. Especificamente, este relatório descreve a preparação de amostras de lises CFME para análises de HPLC utilizando detecção de índices refrativos (RID) para quantificar a geração de intermediários metabólicos centrais e subprodutos na conversão de substratos de baixo custo (ou seja, glicose) para vários produtos de alto valor. A análise da conversão metabólica em reações de CFME alimentadas com glicose rotulada em 13C através de cromatografia líquida de fase inversa acoplada à espectrometria de massa tandem (MS/MS), uma poderosa ferramenta para caracterizar rendimentos específicos de metabólitos e fluxo metabólico de liseto a partir de materiais iniciais, também é apresentada. Ao todo, a aplicação desses métodos analíticos ao metabolismo de lisesato CFME permite o avanço desses sistemas como plataformas alternativas para a execução de tarefas de engenharia metabólica mais rápidas ou novas.
Introdução
Limitações nos micróbios de engenharia para produção química podem ser abordadas recapitulando reações bioquímicas in vitro onde as funções de sobrevivência celular concorrentes estão ausentes1. Além disso, o ambiente de reação aberta (ou seja, ausência de membrana celular) é mais resistente à manipulação e é mais fácil de monitorar em comparação com células vivas. Este conceito fundamental de engenharia metabólica livre de células (CFME) tem sido elegantemente demonstrado pela reconstituição de vias metabólicas para sintetizar produtos químicos valiosos como hidrogênio e monoterpenos com métricas de produção que são ordens de magnitude superiores às apresentadas em fábricas de células microbianas até agora1,2,3 . Os métodos para purificar caminhos inteiros, no entanto, são atualmente limitados pelo tempo e custo. Alternativamente, sistemas metabólicos livres de células podem ser derivados de extratos de células brutas através de métodos rápidos e baratos em relação à reconstituição de toda a via4. O metabolismo central retido nos extratos celulares pode ser suplementado com substratos de energia (por exemplo, glicose e cofatores enzimáticos) e sais em soluções tamponadas para gerar precursores metabólicos centrais por mais de 24horas, 5,6. A adição de enzimas exógenas à reação cfme baseada em lisato permite bio-transformações mais complexas de glicose em produtos químicos mais valiosos em títulos elevados4,6,7. Embora o rendimento tende a ser comprometido nesses sistemas devido à sua complexidade metabólica semelhante à célula, métodos únicos para curadoria de proteomes de liseto para maior conversão de rendimento foram e estão sendo desenvolvidos7,8.
A facilidade de realizar transformações metabólicas em sistemas livres de células baseadas em liseto faz com que essas excelentes plataformas para mover a fabricação química fora da célula completamente ou para prototipar novas vias com alta produtividade antes de construir e testar esses projetos in vivo2,9. Para qualquer aplicação, ferramentas para monitorar conversões metabólicas ou observar alterações globais no fluxo metabólico em lysates são fundamentais para o avanço do CFME. A cromatografia líquida de alto desempenho (HPLC) pode ser usada para separar os constituintes químicos das reações cfme com alta resolução e pode ser acoplado a detectores ópticos ou espectrométricos em massa para quantificação metabólica5,10. O princípio subjacente do HPLC é que os analitos dissolvidos em uma fase solvente (ou seja, fase móvel) e bombeados através de uma coluna interagirão com o material específico de embalagem de coluna (ou seja, fase estacionária)11. Dependendo de suas propriedades químicas, esses analitos apresentam tempos de retenção variados antes de serem eventualmente elucidos da fase estacionária e transportados pela fase móvel para um detector. Este relatório detalha a preparação e análise das reações de CFME baseadas em E. coli através de métodos baseados em HPLC que aproveitam a detecção rid e MS/MS.
O HPLC acoplado à detecção de índices refrativos (HPLC-RID) é um método geralmente acessível para identificar rapidamente precursores metabólicos centrais e produtos finais. Brevemente, rid mede como os analitos alteram a deflexão da luz pela fasemóvel 12. Os sinais RID correspondentes aos analitos de destino em amostras podem então ser quantificados por comparações com sinais RID de soluções padrão. Em aplicações CFME, este modo de detecção tem sido mais comumente utilizado com colunas HPLC que separam compostos baseados em uma combinação de mecanismos de exclusão de tamanho e troca de ligantes, ou cromatografia de partição moderadapor íons 5,6,8,13. Esta técnica em particular é usada para quantificar rapidamente o consumo de substratos de açúcar como glicose, bem como a formação de produtos de fermentação como succinato, lactato, formato, acetato e etanol nas reações CFME à base de lysato8. Registrar as mudanças de concentração desses compostos via HPLC tem sido útil tanto para elucidar o potencial de extratos de células brutas para agrupar precursores metabólicos centrais quanto entender como o fluxo de vias é redirecionado através de vias fermentativas durante conversões metabólicas complexas de glicose noslysates 6,8,14. Estudos seminal de CFME em extratos de células E. coli confirmam que os compostos de fermentação se acumulam como produtos finais de catabolismo de glicose e também ocorrem como subprodutos indesejados em lises que expressam enzimas exógenasexcessivas 6,15. Sugere-se que o metabolismo fermentativo desempenha um papel necessário na regeneração de equivalentes de redox de cofatores (ou seja, NAD(P)H e ATP) para sustentar reações glicolíticos8. Assim, um método de detecção óptica baseado em HPLC projetado para separar produtos de fermentação é uma ferramenta útil e comumente aplicada ao executar várias tarefas cfme baseadas em lysate.
O CFME pode ser implementado para acumular produtos finais metabólicos que não sejam carboidratos, ácidos orgânicos ou álcoois4. A medição de intermediários que são consumidos tão rapidamente quanto sintetizados também pode ser desejável10. Embora o HPLC-RID seja acessível em termos de custo e dificuldade, este método é limitado por sua capacidade de distinguir apenas metabólitos com base no tempo de retenção. Uma gama mais ampla de metabólitos pode ser analisada quando a cromatografia líquida é acoplado à detecção de MS/MS (LC-MS/MS)16. Por este método, os analitos na fase móvel são ionizados e detectados diferencialmente com base na massa de cada molécula e propriedades de carga. O conhecimento tanto da relação massa-carga (m/z) do metabólito quanto do tempo de retenção na coluna facilita assim a separação da maioria dos intermediários metabólicos e produtos finais com alta resolução16. Esta técnica de detecção também pode ser acoplada à cromatografia nano-líquida, que proporciona taxas de fluxo muito mais baixas e volumes de injeção de amostra, permitindo uma detecção mais sensível de pequenas moléculas no fundo de lysato complexo17. O LC-MS/MS pode ser aplicado adicionalmente com rotulagem de isótopos, uma vez que as etiquetas incorporadas transmitem alterações nos valores m/z deanalitos 18. As medidas de ponto de tempo extraídas de uma reação de CFME suplementada com um substrato de 13C6-glicose podem, assim, determinar o final ou subprodutos derivados especificamente da glicose suplementada. Embora este método de rastreamento de isótopos ainda não seja comumente aplicado em estudos de CFME, é uma ferramenta poderosa para entender conversões metabólicas em sistemas CFME baseados em lisato, especificamente uma vez que as contra-contrações de sal (ou seja, acetato e glutamato) nessas reações também são catabolizadas como substratos secundários19. Aproveitar essa técnica pode, assim, desenhar uma imagem abrangente do metabolismo da glicose em lysates, que até hoje não é completamente compreendido. Aqui, o protocolo detalha um método de cromatografia nano-líquida acoplado à ionização nanoeletrática (nano ESI) MS que pode ser usado para interrogar um possível modelo de metabolismo de glicose, especificamente em E. coli lysates(Figura 1). O modelo baseia-se em relatos de vias fermentativas e a via fosfato pentose ativa em E. coli lysates derivados de cepas cultivadas em mídia rica5,6,8,14. A técnica também é usada para investigar a produção de aminoácidos, uma vez que o conhecimento atual sobre o anabolismo aminoácido a partir da glicose em lisatos limita-se a alguns exemplos, como a síntese de aminoácidos aromáticos7. Dada a natureza majoritariamente polar dos produtos finais e intermediários nessas vias (ou seja, ácidos orgânicos, fosfatos de açúcar e aminoácidos), utilizou-se cromatografia líquida em faseversa. Esta técnica separa compostos polares por eluição de uma fase estacionária não polar. Esses compostos foram então ionizados por nano ESI no modo íon negativo que permite a detecção de analitos com pelo menos uma carga elementar negativa e, portanto, é útil para detectar compostos ácidos. Esta técnica é utilizada aqui para analisar metabólitos derivados da glicose de 13C e demonstra a utilidade da LC-MS/MS para a compreensão do metabolismo da glicose em lysates.
Protocolo
1. Reações CFME do curso de partida, parada e processamento do curso de tempo para quantificação HPLC-RID.
- Degelo previamente preparado E. coli lysates e preparar o resto dos componentes de reação no gelo.
NOTA: Os lises relatados aqui foram derivados de E. coli BL21DE3-Star cultivado em mídia 2xYPTG (1,8 % glicose) até a fase de registro médio.- Prepare um volume apropriado de filtro esterilizado (filtro de poros de 0,20 μm) tampão S30 (1 M Tris-OAc ajustado ao pH 8.2 com ácido acético glacial, 1,4 M Mg(OAc)2e 6 M KOAc).
- Prepare uma mistura de energia contendo glicose, sais de glutamato, ATP, Coenzyme A, NAD+, tampão Bis-Tris e fosfato de dipotassium no buffer S30. As concentrações finais no volume de reação desejado utilizado para preparar reações de CFME aqui foram de 100 mM de glicose, Glutamato de magnésio de 18 mM, 15 mM de glutamato de amônio, glúteo de potássio de 195 mM, 1 mM ATP, 0,2 mM Coenzyme A, 1 mM NAD+, 150 mM Bis-Tris e 10 mM dipotassium fosfato.
- Combine os componentes em tubos de microcentrifuuge de 1,5 mL para preparar reações finais com 4,5 mg/mL de proteína total de liseto. Aqui, as reações do CFME foram preparadas com volumes finais de 50 μL em triplicado por ponto de tempo. Incubar as reações a 37 °C para seus respectivos prazos.
NOTA: Trabalhe rápido e adicione lisato como o componente final da mistura de reação para evitar reações metabólicas prematuras com sais de glicose e glutamato. O consumo mínimo de glicose pode ocorrer dependendo de quanto tempo as misturas de reação são incubadas no gelo. - Termine as reações e processe as amostras para análise HPLC-RID.
- Para terminar as reações triplicadas em seus pontos de tempo apropriados, adicione imediatamente um volume igual de ácido tricloroacético de 5% ao volume final de reação de cada amostra (ou seja, 50 μL de ácido tricloroacético de 5% a uma reação de 50 μL). Diluir cada amostra com água estéril a 2x o volume de reação (ou seja, 100 μL).
- Para recapitular o tempo zero, misture o mesmo volume de ácido tricloroacético de 5% com o volume total de reação final (ou seja, 50 μL) com o lisato antes de adicionar o resto dos componentes de reação. Esta etapa de acidificação precipita enzimas lisato antes de metabolizar significativamente a glicose.
- Vórtice as amostras e centrífugas em um microcentrifuuge benchtop a 11.600 x g por 5 min e transfira sobrenantes contendo os analitos orgânicos para tubos limpos. Armazene as amostras a -20 °C se as análises do HPLC forem realizadas em um dia diferente. Certifique-se de descongelar as amostras armazenadas no gelo antes de prosseguir para o próximo passo.
- Filtre cada supernante com um filtro de poros de 0,22 μm. Como alternativa às seringas, use filtros de tubo de centrífugas e centrífugue os supernantes a 16.300 x g por 1 min.
- Transfira cada filtrado para um frasco de vidro HPLC limpo. Carregue frascos na bandeja do amplificador automático HPLC.
- Prepare amostras para geração de curva padrão.
- Prepare uma solução de estoque de todos os analitos de destino dissolvidos no buffer S30 em quantidades equimolar acima da concentração inicial de glicose nas reações do CFME. Aqui, foi preparada uma solução de estoque composta por glicose de 150 μM, succinato, lactato, formate, acetato e etanol. Realizar diluições seriais 1:1 (v/v) da solução de estoque para obter soluções triplicadas de 50 μL com concentrações finais que variam de 0 μM à concentração de estoque (ou seja, 150 μM).
- Diluir cada solução com 50 μL de ácido tricloroacético e 100 μL de água estéril. Repetição de passos 1.3.4-1.3.5.
NOTA: Execute soluções para geração de curvas padrão com cada lote de amostras para garantir a quantificação precisa das concentrações metabólitos.
2. Preparando o sistema HPLC para detecção de metabólitos.
- Sob uma capa de fumaça, prepare uma solução esterilizada de ácido sulfúrico de 5 mM a partir de água desionizada e esterilizada por filtro. Adicione ~550 μL de uma solução de ácido sulfúrico de 98% hplc de grau HPLC a 2 L de água para preparar ácido sulfúrico de 5 mM.
ATENÇÃO: O ácido sulfúrico é um produto químico perigoso, e trabalhar sob um capô de fumaça com EPI de laboratório adequado evita inalação, contato com a pele e contato visual. O ácido sulfúrico concentrado reage vigorosamente com água e deve ser adicionado diretamente à água, não o contrário. Guarde em uma área fria e seca longe da luz solar direta e siga as medidas adequadas de descarte de resíduos definidas pelo laboratório. - Mantenha a garrafa de 2 L de ácido sulfúrico de 5 mM incubada em um banho de água ao lado do instrumento HPLC. Coloque o banho de água para 35 °C. Coloque a tubulação com um filtro de solvente na garrafa de solvente e conecte a outra extremidade a um módulo de degasser em linha com o módulo da bomba.
NOTA: Limpar o sistema com um solvente recém-preparado antes da instalação da coluna é uma boa prática de manuseio de instrumentos. - Equipar o instrumento HPLC com a coluna HPLC em linha com o módulo RID. Coloque a coluna no banho de água de 35 °C se um termostato de coluna não estiver disponível.
- Prepare o módulo RID para análise a 35 °C no software CDS (Chromatography Data System, sistema de dados de cromatografia) instalado no computador do sistema.
- No menu Exibir, selecione o Método e execute a exibição de controle. Clique com o botão direito do mouse no método > do módulo de bomba. Defina a taxa de fluxo para 0,55 mL·min-1 e selecione o botão Continuar para iniciar a bomba.
NOTA: Se a coluna estiver armazenada antes de ser equipada no HPLC, aumente a vazão para 0,55 mL·min-1 após equilibrar a coluna seguindo as instruções do fabricante. - Clique com o botão direito do mouse no painel correspondente ao método > do módulo RID. Defina a temperatura do módulo detector de RI para 35 °C e selecione On para iniciar o aquecimento do módulo detector de RI.
- Clique com o botão direito do mouse no painel RID Module > Control. Selecione On para a célula de referência de purga por pelo menos 15 minutos ao usar um solvente fresco ou 1h se diferentes solventes fluírem através do detector de RI antes desta configuração. Clique no botão Continuar.
NOTA: Mantenha a bomba e o detector de RI ligados para obter uma linha de base estável na trama on-line. Isso é afetado por flutuações de temperatura em laboratório e pode levar até 4h ou mais. Mantenha o sistema ligado durante a noite antes do carregamento da amostra.
- No menu Exibir, selecione o Método e execute a exibição de controle. Clique com o botão direito do mouse no método > do módulo de bomba. Defina a taxa de fluxo para 0,55 mL·min-1 e selecione o botão Continuar para iniciar a bomba.
3. Criar um método para a separação iscrática do HPLC dos produtos de fermentação orgânica no CDS.
- Na barra de menu, selecione Método > Novo Método. Selecione Método > Salvar método como [MethodName].M. Selecione o método > editar método completo > instrumento/aquisição
- Dentro da guia Bomba Binária, defina o fluxo para 0,55 mL·min-1. Em Solventes,selecione a letra correspondente à entrada do solvente no módulo da bomba e coloque-a 100% para eluição isocrática. Defina limites de pressão para 0 e 400 barras e entrada de 30 minutos como o Stoptime.
- Dentro da guia Sampler, defina o volume de injeção para 50 μL. Selecione a opção Como bomba/limite em stoptime. Defina as Configurações Auxillary Avançadas para Velocidade de Saque, Velocidade de Ejetare Posição de Desenho para 200 μL·min-1, 200 μL·min-1e -0,5 mm.
- Dentro da guia RID, defina temperatura da unidade óptica para 35 °C. Em Signal, selecione Adquirir para Sinal e >0,2 min para Peakwidth. Selecione a opção Como bomba/injetor para stoptime.
- Em Avançado dentro da guia RID, defina saída analógica para deslocamento zero de 5% e 500.000 nRIU para atenuação. Selecione a opção Positivo para Polaridade de Sinal e a opção On para Zero Automático Antes da Análise.
- Salve o método selecionando Método > Método Salvar. Carregue o método selecionando método > método de carga > [MethodName]. M.
4. Criar uma tabela de sequência para autosamplagem e iniciar o sistema HPLC-RID para aquisição de dados.
- Na barra de menu, selecione Sequência > novo modelo de sequência. Selecione Sequência > Modelo de sequência de salvar como [SequenceTemplateName]. S.
- Selecione Sequência > Tabela de Sequência. Anexar 'n' linhas correspondentes a frascos 'n' e, em seguida, insira posições de frasco e nomes de amostra sob frasco e nome da amostra,respectivamente, de acordo com seu arranjo na bandeja do autosampler. Selecione o método gerado na etapa 3 do menu suspenso do nome do método e insira 50 μL como Inj/Vial (Injeção por Frasco) para cada linha.
- Clique em Aplicar e salvar o modelo de sequência selecionando modelo de sequência > Modelo de Sequência de salvar. Certifique-se de que o modelo de sequência seja carregado selecionando sequência > modelo de sequência de carga > [SequenceTemplateName]. S.
- Depois de alcançar uma linha de base estável na trama on-line, clique com o botão direito do mouse no painel RID Module > Control > Off Recycling Valve para direcionar o fluxo de solventes através do detector RID para o lixo. Para iniciar a aquisição de dados, selecione Sequência na barra de menu, Sequência > Executar.
5. Extrair e analisar dados pós-escoamento.
- Selecione a exibição de análise de dados no menu Exibir. Localize o nome do arquivo sequencial da lista de arquivos no lado esquerdo da tela. No painel central na tela, vá para o Sinal De Seleção > SINAL RID para visualizar os cromatogramas de amostra.
- Selecione uma linha correspondente a uma amostra de alto padrão de concentração do painel superior na tela. Observe os tempos de retenção para os picos de analito do alvo no cromatógrafo exibido. Os picos correspondentes aos analitos alvo serão organizados ao longo do eixo do tempo de retenção como glicose, succinito, lactato, formate, acetato e etanol(Figura Suplementar 1).
NOTA: O primeiro grande pico no cromatograma corresponde ao ácido tricloroacético. Suas unidades de RI devem ser consistentes em todas as amostras de curva padrão. Valide o tempo de retenção de cada alvo, executando cada composto como uma amostra separada. - Extrair áreas de pico para cada alvo analito a partir de cromatógrafos dos padrões e amostras de reação.
- Discerna se os picos de interesse estão bem integrados pelo software. Desenhe a linha vermelha como a base de cada pico para obter uma área precisamente integrada sob a curva. Se a integração automática falhar (ou seja, a linha vermelha será askew), selecione o botão Integração Manual do Conjunto de Ferramentas de Integração e desenhe manualmente uma base de pico para integrar a área de pico.
NOTA: Se a integração manual for realizada para um analito de destino em uma amostra, mantenha-se consistente e integre manualmente o mesmo analito em todas as amostras. - Selecione a ferramenta Cursor no Conjunto de Ferramentas Comuns para clicar em picos devidamente integrados. A área de pico e o tempo de retenção correspondente do pico selecionado serão destacados como uma linha de tabela no painel inferior da tela.
- Para exportar áreas de pico, selecione Arquivo > Resultados de Integração > de Exportação.
- Discerna se os picos de interesse estão bem integrados pelo software. Desenhe a linha vermelha como a base de cada pico para obter uma área precisamente integrada sob a curva. Se a integração automática falhar (ou seja, a linha vermelha será askew), selecione o botão Integração Manual do Conjunto de Ferramentas de Integração e desenhe manualmente uma base de pico para integrar a área de pico.
- Quantifique as concentrações de analitos de destino usando curvas padrão.
- Valores de área de pico de gráfico versus concentrações conhecidas de amostras em uma planilha. Clique com o botão direito do mouse nos dados plotados, Adicione Trendline > Formação Trendline > Equação de Exibição no Gráfico.
- Em uma planilha separada, use as equações das linhas de tendência de curva padrão para converter valores de área de pico em concentrações para cada analito de cada amostra. Calcule as áreas de pico média e os valores de erro padrão entre os triplicados para visualização de dados.
6. Isótopos do curso de início, parada e processamento do curso de tempo de processamento traçando reações do CFME para quantificação de LC-MS/MS.
- Configure reações triplicadas por ponto de tempo (exceto tempo zero) no gelo, conforme descrito em 1.1-1.2. No entanto, em vez de glicose, use uma concentração final de 100 mM 13C6-glicose nas reações. Incubar as reações a 37 °C para 1 h, 2 h e 3h.
- Para terminar, congele as reações em nitrogênio líquido e armazene-as a -80 °C. Pule esta etapa de armazenamento para análise no mesmo dia.
NOTA: O ácido tricloroacético não foi usado para parar as reações devido à interferência do ácido ao detectar alguns metabólitos centrais de carbono via LC-MS/MS. Em vez disso, o solvente de extração contendo ácido fórmico (etapa 6.3) foi usado para precipitar proteínas metabólicas, uma vez que a massa do ácido fórmico está abaixo do limite de detecção do método MS/MS relatado. - Prepare 50 mL do solvente de extração. Combine e vórtice 20 mL de acetonitrila, 20 mL de metanol e 10 mL de água (todos de grau LC-MS) em um tubo de centrífuga de 50 mL juntamente com 0,199 mL de ácido fórmico para fazer uma solução de 0,1 M. Esfrie o solvente a 4 °C durante a extração e armazene o solvente a -20 °C quando não estiver em uso.
- Amostras de processamento para análise LC-MS/MS
- No dia da análise, pipeta um volume equivalente do solvente de extração (ou seja, 50 μL) para cada amostra. Se as amostras foram congeladas, adicione o solvente de extração antes que as amostras descongelem completamente para evitar a reativação do metabolismo da glicose. Realize todas as etapas de processamento de amostras no gelo.
- Para recapitular o tempo zero, pipeta o volume final de solvente de extração (ou seja, 50 μL) a um volume apropriado de lise para a concentração final desejada na reação (ou seja, de 4,5 mg/mL em volume de reação de 50 μL). Adicione o resto dos componentes de reação como na etapa 1.2. Esta etapa de acidificação precipita enzimas lisato antes de metabolizar significativamente a glicose.
- Incubar as amostras em solvente de extração no gelo por 30 minutos com agitação suave, depois centrifugar as amostras a 21.000 x g por 15 min a 4 °C para separar o sobrenante da proteína precipitada. Transfira 50 μL do supernatante para frascos de autosampler e carregue os frascos na bandeja dentro do autosampler de 4 °C. Armazene o resto do supernatante a -20 °C para futuras análises.
7. Configuração do sistema LC para análise LC-MS/MS.
- Prepare 1 L de Solvente A dissolvendo completamente 77,08 mg de acetato de amônio em 950 mL de água e 50 mL de isopropanol. Prepare 1 L de Solvente B com 650 mL de acetonitrilo, 300 mL de água e 50 mL de isopropanol junto com 77,08 mg de acetato de amônio. Certifique-se de que todos os solventes são de grau LC-MS.
- Conecte as garrafas de solvente contendo solventes A e B ao módulo da bomba. Purgue o sistema a uma alta vazão para remover/limitar qualquer contaminação de ar que possa ter ocorrido durante o equipamento dos solventes para o sistema LC.
- Equipar o sistema com uma coluna de fases invertidas C18 (comprimento da coluna de 30 cm, diâmetro interno de 75 μm e diâmetro de partícula de 5 μm). Condicionar a coluna ao sistema LC-MS fluindo 100% solvente B e fluindo lentamente até solvente A para 100%.
NOTA: As pontas da coluna foram preparadas internamente usando um puxador de micropipette e embaladas com células de pressão e hélio.
8. Criar um método sobre o software de aquisição e interpretação de dados LC-MS/MS para o sistema LC vinculado aos Espectrômetros de Massa Fourier Transform e Ion Trap.
- Abra o software Tune Plus para editar um arquivo de sintonia para o método MS.
- A partir do arquivo na barra de menu, abra um arquivo de sintonia de modo negativo pré-instalado.
- Selecione ScanMode na barra de menu e selecione Definir janela de varredura. Ajuste a configuração do tempo microscan para MSn a 1 tanto para Ion Trap quanto FT.
- Vá para as configurações para Nano-ESI Source e ajuste a Tensão de Pulverização para 4 kV. Modular isso até que um eletrospray aceitável seja gerado; tipicamente, eletrospray aceitável pode ser alcançado dentro da faixa de 2-5 kV.
- Salve o arquivo de sintonia.
- Gere um novo método LC usando o Assistente de Configuração do software de aquisição e interpretação de dados do instrumento. Configuração de sequência de >de > de estrada aberta > Assistente . Como esses métodos não requerem o uso de um aquecedor de coluna, pule a etapa de Controle de Temperatura.
- Em Opções de bomba de gradiente de fluxo,selecione Multistep. Na janela seguinte, insira 7 linhas e defina a taxa de fluxo para cada linha para 0,1 mL·min-1. Insira os seguintes parâmetros para cada linha: de 0 a 3 min, entregue 100% solvente A; de 3 a 9 min, introduza um gradiente de 100% solvente A a 20% solvente B; de 9 a 19 min, introduza um novo gradiente de 20% de solvente B a 100% solvente B; de 19 a 27 min, mantenha-se 100% solvente B; de 27 a 28 min, defina o gradiente de volta para 100% solvente A; de 28-44 min, enxágue e recondicionamento da coluna para execuções subsequentes mantendo-se em 100% solvente A. Inclua um passo final para baixar a taxa de fluxo para 0,03 mL·min-1 após a conclusão da corrida para conservar o solvente quando a LC não estiver em uso.
- Aplique configurações padrão para opções de sampler > pressão da bomba como opção de aquisição e use o tempo de aquisição padrão e use opções de pressão padrão da bomba.
- Crie um método MS/MS selecionando o ícone Orbitrap Velos Pro MS na barra lateral na janela Configuração de instrumentos.
- Clique em Novo Método > Data Dependent MS/MS. Definir Tempo de Aquisição para o comprimento da corrida LC (ou seja, 44 min), Segmentar para 1 e Scan Events para 11. Para tune file, selecione o arquivo editado a partir da etapa 8.1.
NOTA: O primeiro evento é uma varredura precursora do MS1 usando o Fourier Transform MS (FTMS). Os 10 eventos seguintes serão os exames MS2 selecionando os 10 íons mais intensos e únicos em cada varredura precursora para fragmentação de MS2. - Para o evento 1, em Análise descrição do conjunto Analisador para FTMS e Polaridade negativa. De acordo com as configurações do MSn, use uma Resolução de 30.000 e uma Energia de Colisão Normalizada de 35 V. Definir intervalos de varredura a 50 m/z para a primeira massa e 1800 m/z para a última massa para capturar pequenas moléculas.
- Para eventos de 2 a 11, em Scan Description set Analyzer to Ion Trap. Selecione Digitalizar dependente e clique em Configurações > exclusão dinâmica > global e selecione Ativar; definir uma duração de repetição de 30 s e 120 s de exclusão para eliminar as repetições nas proximidades.
- Vá para as configurações do Evento de Varredura e defina Massa Determinada do Evento de Varredura para 1 para todos os eventos DE MS2 (2 a 11). Para escanear os 10 íons mais intensos, defina cada evento de varredura MS2 para detectar um nth Most Intense Ion de1º a 10º . Portanto, defina o Evento 2 para detectar 1 como o nth Most Intense Ion, evento 3 para detectar 2, e assim por diante.
- Feche a janela de configuração e vá para Arquivo > Salvar Como [Method_Name].meth.
NOTA: Para uso geral, manutenção e calibração do instrumento LC e do espectrômetro de massa, consulte as instruções de operação e manuais fornecidos pelo fabricante.
- Clique em Novo Método > Data Dependent MS/MS. Definir Tempo de Aquisição para o comprimento da corrida LC (ou seja, 44 min), Segmentar para 1 e Scan Events para 11. Para tune file, selecione o arquivo editado a partir da etapa 8.1.
9. Configuração de uma sequência de execução e início da execução LC-MS/MS.
- Configure uma sequência de execução usando o software de aquisição e interpretação de dados do sistema LC-MS/MS. Dentro de Roadmap > Configuração de sequência, clique com o botão direito do mouse na tabela para inserir tantas linhas quanto amostras. Para cada linha, defina o Inj Vol para 5 μL e a Posição para a respectiva posição do frasco na bandeja do autosampler. Insira nomes de arquivos como nomes de exemplo e defina o caminho de arquivo desejado para obter resultados de execução.
NOTA: Frascos em branco contendo solvente A podem ser executados no início da sequência e entre cada conjunto de amostras triplicadas (cada conjunto de pontos de tempo) para enxaguar a coluna. - Para iniciar a execução, destaque todos os nomes de arquivos na sequência. Na barra de menu, selecione Ações > Executar sequência > OK.
10. Consolidando arquivos e procurando anotações provisórias no MZmine 2.53.
- Abra mzmine e importe os arquivos de saída '.raw' da etapa 9.1. Na barra de menu, selecione Métodos de Dados Brutos > Importação de Dados Brutos. Selecione arquivos correspondentes às amostras.
- Construa uma lista de picos distinguindo entre as varreduras MS1 e MS2. Na barra de menu, os métodos de dados brutos > detecção de recursos > construtor de peaklist MS/MS. As configurações relevantes incluem m/z Janela definida para 0,01 e Janela de tempo definida para o comprimento da execução. Em filtros definidos, selecione Negativo como Polaridade e Centralided como o Tipo de Espectro.
- Na barra de menu, vá para Os métodos de lista de recursos > detecção de recursos > extensor de pico. Ajuste m/z Tolerância a 0,005 m/z ou 10 ppm e Altura Mínima a 1E3. Esta etapa criará picos totalmente carnudos.
- Remova os picos duplicados. Volte para os métodos de lista de recursos > filtragem > filtro de pico duplicado. As configurações relevantes incluem m/z Tolerância definida para 0,005 m/z ou 10 ppm e o RT Tolerance definido para 5 min.
- Para alinhar picos dentro de arquivos de dados semelhantes (ou seja, aqueles de reações triplicadas), volte aos Métodos de Lista de Recursos > Normalização > Calibração do Tempode Retenção . Certifique-se de processar amostras triplicadas juntos e deixar em branco. As configurações relevantes incluem m/z Tolerância definida para 0,005 m/z ou 10 ppm, TOLERÂNCIA RT definida para 3 min absoluto (min) e Intensidade Padrão Mínima definida para 1E3.
- Alinhe os picos de todos os arquivos por m/z e o tempo de retenção dos métodos de lista de recursos > alinhamento > do ransac aligner. Definir m/z Tolerância a 0,005 m/z ou 10 ppm, Tolerância RT e Tolerância RT Após a correção para 44 e 39 min, respectivamente, Iterações RANSAC para 0, Número Mínimo de Pontos a 10% e Valor Limiar para 1. Marque a opção Exigir o mesmo estado de carga.
- Corrija para quaisquer pontos de dados que possam ter sido perdidos em etapas anteriores em Métodos de lista de recursos > preenchimento de lacunas > Localizador de Pico. As configurações relevantes incluem a Tolerância de Intensidade definida para 50%, m/z Tolerância definida para 0,005 m/z ou 10 ppm, e RT Tolerance definido para 3 min. Habilite a correção de RT.
11. Calcular massas de modo negativas de metabólitos derivados de glicose de 13C e procurar as características m/z desses analitos em dados filtrados.
- Calcule as massas de metabólitos rotulados em 13C do metabolismo da glicose para a busca direcionada.
- Calcule a massa monoisotópica de cada composto alvo a partir do número de átomos na fórmula molecular do composto e das massas monoisotópicas de cada elemento20.
- Calcule a massa de modo negativo do composto [M-H]- subtraindo a massa de 1 próton (1,007276 Da) da massa monoisotópica. Esta é a massa detectada pela detecção de MS no modo negativo depois que moléculas são retiradas de um íon de hidrogênio durante a ionização.
- A partir da massa do modo negativo, calcule a massa do metabólito de 13C.incorporação. Aqui, foram calculadas as massas de isotopologues que incorporam ao máximo 13rótulos C derivados da glicose.
- Use massas calculadas de metabólitos com 13C para pesquisar e anotar recursos m/z dos resultados do MZmine. Para cada acerto possível, calcule o erro de massa (ppm) usando a seguinte equação:
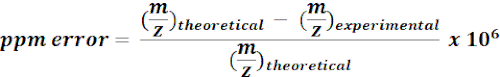
NOTA: Os valores experimentais de m/z com erro de massa de < 15 ppm foram considerados como anotações putativas na análise atual. - Verifique manualmente espectros de anotações putativas em um navegador de qualidade para confirmar anotações.
- Open Roadmap > Qual Browser. Da Barra de Ferramentas, Abra o Arquivo Bruto para importar dados de MS brutos de cada amostra.
- Desenhe uma linha sob a faixa desejada de tempos de retenção (ou seja, correspondente à anotação putativa) no cromatógrama de íon total (painel superior) para visualizar um espectro de massa (painel inferior). Clique com o botão direito do mouse no espectro e insira uma gama de massas que englobam o m/z do analito alvo. Verifique se as anotações putativas têm sinais de pico distintos que estão consideravelmente acima do ruído(Figura Suplementar 2).
- Calcule as áreas de pico médias e os erros padrão de anotações positivas em réplicas biológicas para cada ponto de tempo. Visualize os dados (ou seja, em um gráfico de barras) para observar tendências no metabolismo da glicose.
Resultados
Para quantificar a síntese sem células à base de lysato de produtos de fermentação comum a partir da glicose, os lysates derivados de cepas cultivadas em mídia 2xYPTG foram alimentados com 100 μM de glicose como fonte primária de carbono8. As reações foram interrompidas durante um curso de tempo de 24 horas por acidificação de proteínas. Supernantes filtrados contendo piruvato, succinato, lactato, formate, acetato e etanol produzidos a partir do catabolismo de glicose foram carregados no módulo autosampler de um sistema HPLC equipado com um módulo RID. Frascos com misturas filtradas de produtos finais fermentativos e glicose a 1,17 μM, 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM e 150 μM de concentrações no buffer S30 foram carregadas no instrumento como padrões. Os analitos foram eluted isocraticamente de uma coluna HPLC para o RID. Os picos de glicose, succinato, lactato, formate, acetato e etanol dentro da faixa de 1 a 150 μM poderiam ser resolvidos pela RID. As áreas de pico para glicose foram derivadas pela integração manual dos dados RID para o curso de tempo e amostras de curva padrão. As áreas de pico extraídas para succinato, lactato, formate, acetato e etanol foram retiradas de sinais automaticamente integrados. Todas as curvas padrão (área de pico versus concentração conhecida) tinham valores R2 >0,99 e eram lineares em toda a gama de concentrações utilizadas aqui.
As concentrações molares para todos os analitos-alvo foram calculadas a partir de suas respectivas curvas padrão. A glicose foi consumida nas primeiras 3h da reação e fermentada principalmente para lactato (Figura 2A,B). O acúmulo de etanol também ocorreu significativamente nas primeiras 3h da reação e parou depois(Figura 2C). A observação da significativa produção de lactato e etanol com consumo significativo de glicose após 3h não foi inédita, uma vez que as vias de produção de lactato e etanol permitem a regeneração de 1 nadh de nadh de nadh glilítico necessário para o consumo contínuo de glicose por meio da glicolise(Figura 1). O lactato e o etanol podem, portanto, ser considerados como os principais produtos finais de fermentação no metabolismo de glicose sem células à base de lysato. O acetato estava inicialmente presente nas reações como um componente do tampão S30 e inesperadamente só se acumulou devido ao metabolismo após 6h quando o consumo de glicose havia desacelerado(Figura 2D). Este resultado sugere que a fermentação de acetatos não necessariamente permite fluxo glicolítico rápido em pontos de tempo anteriores. Enquanto isso, formato e succininato foram sintetizados como produtos de fermentação menor (Figura 2E,F). Ao todo, o método possibilitou a quantificação absoluta do esgotamento do substrato de açúcar e a formação de produtos fermentativos em e. coli S30.
A detecção de ESM para traçar o metabolismo de glicose de lysate foi aplicada especificamente aqui. Os lysatos derivados de cepas cultivadas em mídia 2xYPTG foram alimentados com 13C6-glicose como fonte de carbono. As reações do CFME foram realizadas em triplicado por 0h, 1 h, 2 h e 3h. Amostras de cada ponto de tempo foram carregadas em um sistema LC equipado com uma coluna de fase invertida e acoplado a espectrômetros de massa de fourier e de captura de íons. Espectros do modo íon negativo foram obtidos e processados para analisar ácidos orgânicos, fosfatos de açúcar e aminoácidos. Foram pesquisadas massas teóricas calculadas de 13espécies rotuladas por C pertencentes ao metabolismo central de carbono para identificar especificamente compostos derivados da glicose. Com base nas condições de cultivo da cepa de origem utilizada e relatórios prévios de vias ativas em E. coli CFME, presume-se aqui que o proteome lisato compreende uma rede metabólica que alimenta a glicose na fermentação glicóltica, na via fosfato pentose e possivelmente no anabolismo de aminoácidos5,6,7,8,14 (Figura 1). Portanto, a busca foi reduzida aos membros dessas vias, dos quais 16 metabólitos que incorporam rótulos de 13C derivados da glicose foram inequivocamente anotados(Tabela Suplementar 1).
13 C6-glicose foi consumida observamente através da glicólise, como evidenciado pelas flutuações em abundâncias intermediárias glicolíticas(Figura 3A-E). Consistente com os dados HPLC-RID, a glicose acumulou até 13C3-lactato e também foi fermentada para 13C3-succinato nas primeiras 3h da reação (Figura 4A,B). A formação de isotopologue de 13C3-succinato suporta o modelo proposto de metabolismo de glicose de lysato(Figura 1),onde o succinato provavelmente será gerado pela carboxilação da molécula de fosfoenolpyruvate de 3 carbonos (PEP) e não desde a entrada de uma molécula de acetil-CoA de 2 carbonos até o ciclo TCA. A ativação do ciclo TCA foi assumida em estudos anteriores do CFME, mas outros 13intermediários rotulados por C de TCA não foram detectados aqui8,19,21. 13 C3-aspartate síntese no entanto ocorreu dentro do primeiro h e foi consumida, reforçando a ideia de que pep é diretamente convertido em oxaloacetato (Figura 1, Figura 6C). Os dados refletem um proteome de liseto de cepas de origem colhidas durante o crescimento fermentativo em mídia rica em glicose (2xYPTG). Isso implicaria ainda que o resto das enzimas TCA que não participam da produção de succinato formam um ramo oxidativo de TCA(Figura 1). Nenhum dos metabólitos nesta via, no entanto, foi detectado, possivelmente porque altas concentrações de glutamato adicionadas à reação do CFME como contração do sal impedem a progressão deste ramo.
Os dados HPLC-RID são adicionalmente complementados pela falta de detecção de acetato de 13C2dentro do prazo de reação de 3 horas, sugerindo que não há acúmulo de acetato de glicose até 3 h(Figura 2B). No entanto, o precursor direto do acetato, acetil-fosfato (acetil-P), acumulou, sugerindo que o braço Pta da via Pta-AckA para síntese de acetato de acetil-CoA está ativo(Figura 4C,D). A desfosforilação catalisada de 13C2-acetil-P a 13C2-acetato provavelmente não ocorre dentro deste prazo devido ao acetato ser um componente principal do tampão S30 usado nas reações (Figura 1, Figura 2B).
Também foi observada a incorporação de 13C6-carbonos derivados da glicose aos fosfatos de açúcar 6-fosfogluconolactona (6PGL), 6-fosfogluconato (6PG), ribulose-5-fosfato (Ru5P) e sedoheptulose-7-fosfato (S7P) (Figura 5). Esses resultados confirmam a participação da via fosfato pentose no metabolismo da glicose de lysato e provavelmente alimentam 13C 9-tyrosine síntese, que já foi sugerida antes por um estudo proteômico, ao mesmo tempo em que fornece um precursor para a produção de 13C5-histidina(Figura 6A, B)7. Fenilalanina e triptofano não foram observados aqui, e nem a maioria dos aminoácidos essenciais. No entanto, isso não é totalmente surpreendente, uma vez que o anabolismo aminoácido provavelmente será enriquecido em lisatos derivados de células cultivadas em condições famintas de nutrientes ou na fase estacionária7,22. Além disso, os dados até agora sugerem que os intermediários da glicólise e da fermentação são funneled para cofator regenerando reações finais, que devem impedir a síntese de muitos aminoácidos derivados do gliceraldeído-3-fosfato, piruvato e acetil-CoA (ou seja, glicina, cisteína, serina, alanina, valina, leucina e lisina)(Figura 1). Como mencionado, 13C3-aspartato foi produzido na primeira hora, enquanto os aminoácidos derivados de aspartato derivados de aspartato de 13C (ou seja, threonina, isoleucina, metona e asparagine) não foram observados possivelmente porque o aspartato derivado da glicose participa da fermentação(Figura 1, Figura 6C). Por fim, o fluxo para glutamato rotulado e aminoácidos derivados do glutamato pode ter sido impedido por altos níveis de glutamato no ambiente de reação(Figura 1).
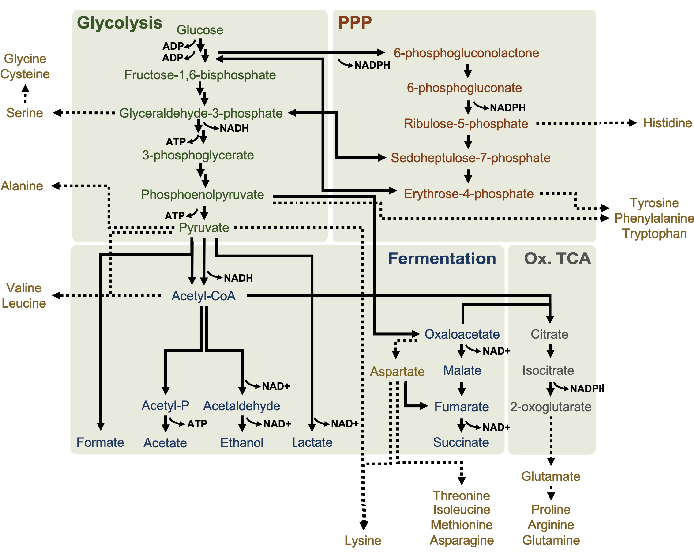
Figura 1: Um modelo metabólico putativo de lises derivados de E. coli BL21DE3-Star crescendo exponencialmente em altas concentrações de glicose. Intermediários e produtos finais de glicólise (verde), a via fosfato pentose (laranja escura) e vias fermentativas (azul) de acetil-CoA foram relatados em CFME à base de lysato. A presença de fermentação de succinita implica a ativação do ramo oxidativo TCA (cinza). O anabbolismo aminoácido (ouro) em lisatos não é bem definido e é investigado aqui. Clique aqui para ver uma versão maior desta figura.
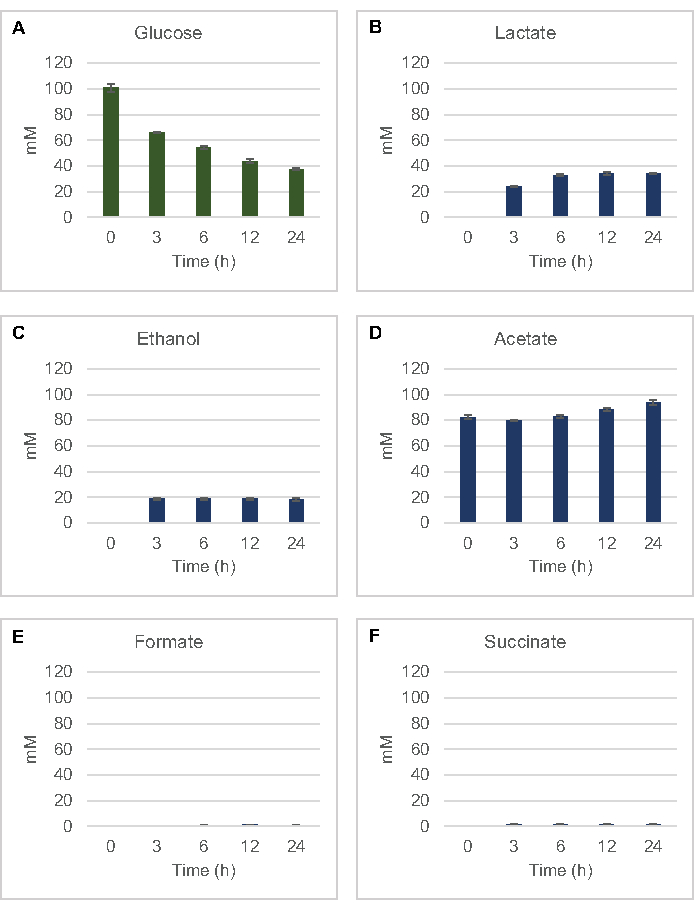
Figura 2: Dados HPLC-RID para consumo de glicose e síntese de produtos finais fermentativos em reações CFME preparadas com extratos brutos de E. coli. (A) Consumo de glicose e(B) lactato,(C) etanol, (D) acetato, (E) formato e (F) produção de succinato em reações CFME foram monitorados ao longo de 24 h. Concentrações médias de MM e barras de erro (SE) quantificadas com curvas padrão são apresentadas (n = 3). Clique aqui para ver uma versão maior desta figura.
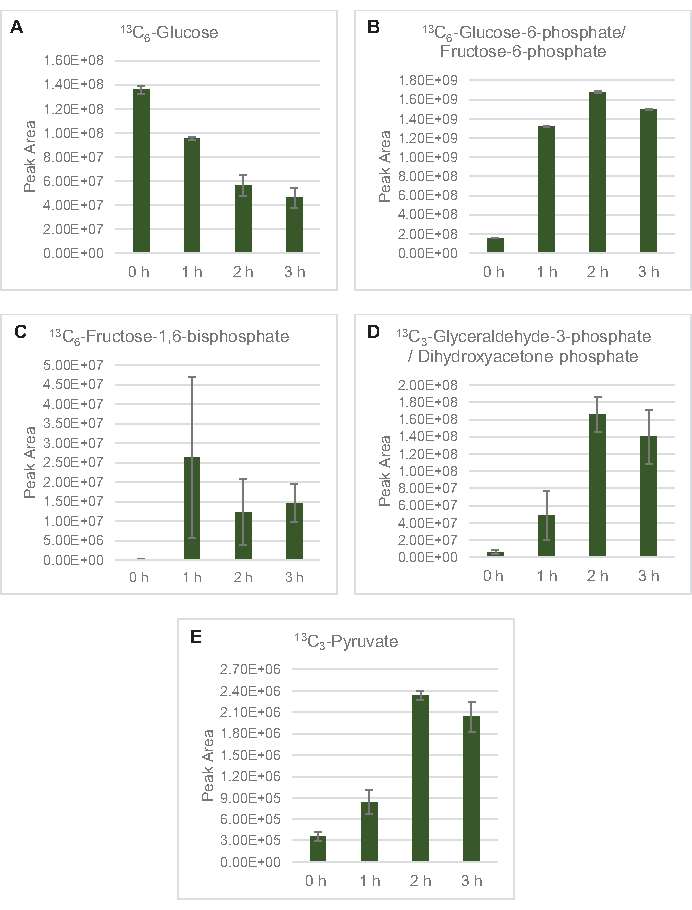
Figura 3: Tendências do curso de tempo de 13C6-glicose e intermediários glicolíticos com 13C no E. coli lysate CFME. Abundância relativa de (A) 13C6-glicose, (B) 13C6-glicose-6-fosfato/frutose-6-fosfato, (C) 13C6-frutose-1,6-bisfosfato, (D) 13C3-glicealdeído-3-fosfato/dihidroxyaceona fosfato, e (E) 13C6 -piruvato em reações CFME acima de 3 h. Áreas de pico brutas extraídas pelo software mzMINE foram utilizadas para calcular médias e barras de erro (SE) para anotações positivas (n = 3). Clique aqui para ver uma versão maior desta figura.

Figura 4: Tendências do curso de tempo de intermediários e produtos finais em 13C6-fermentação de glicose em E. coli lysate CFME. Abundâncias relativas de (A) 13C3-lactato, (B) 13C3-succinato, (C) 13C2-acetil-fosfato, e (D) 13C2-acetil-CoA em reações CFME acima de 3 h. Áreas de pico brutas extraídas pelo software mzMINE foram utilizadas para calcular médias e barras de erro (SE) para anotações positivas (n = 3). Clique aqui para ver uma versão maior desta figura.
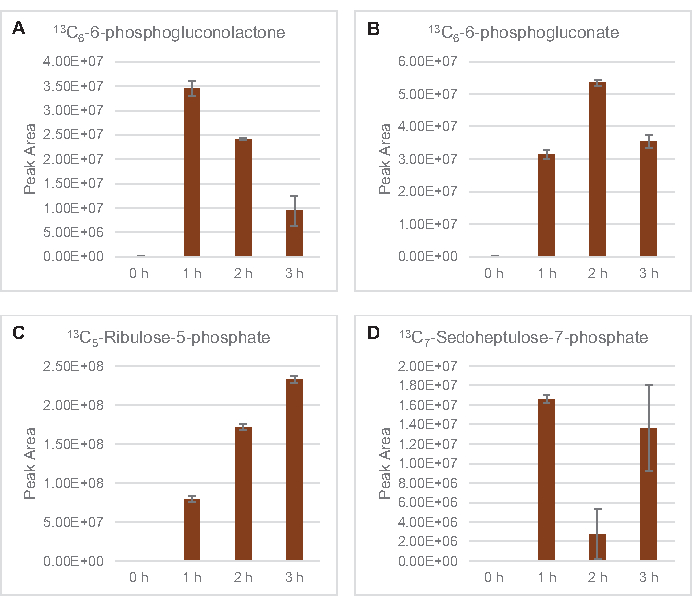
Figura 5: Tendências do curso de tempo de 13C6-glicose derivadas da via fosfato de fosfato em E. coli lysate CFME. Abundâncias relativas de (A) 13C6-6-fosfogluconolactona, (B) 13C6-6-fosfogluconato, (C) 13C5-ribulose-5-fosfato, e (D) 13C7-sedoheptulose-7-fosfato sobre 3 h. Áreas de pico brutas extraídas pelo software mzMINE foram utilizadas para calcular médias e barras de erro (SE) para anotações positivas (n = 3). Clique aqui para ver uma versão maior desta figura.
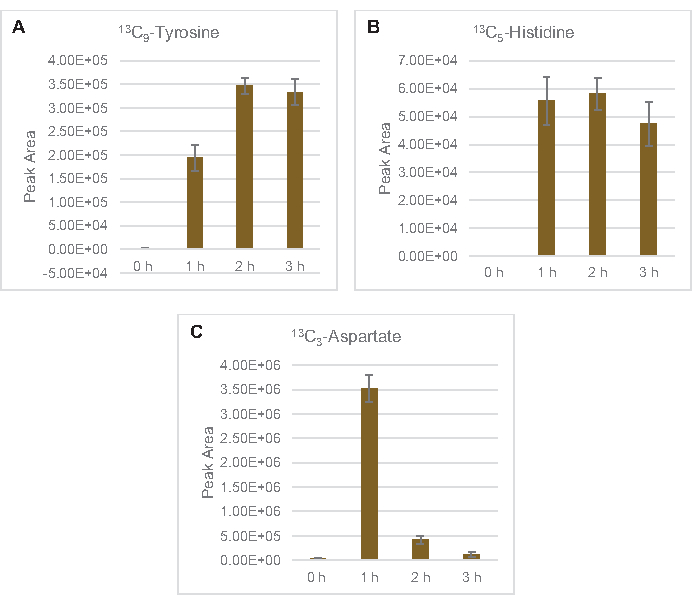
Figura 6: Tendências do curso de tempo detectadas 13C6-aminoácidos derivados de glicose em E. coli lysate CFME. Abundâncias relativas de (A) 13C9-tyrosine, (B) 13C5-histidina, e (C) 13C3-aspartate acima de 3 h. Áreas de pico brutas extraídas pelo software mzMINE foram utilizadas para calcular médias e barras de erro (SE) para anotações positivas (n = 3). Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Cromograma HPLC-RID representativo mostrando picos para produtos fermentativos principais em uma reação CFME incubada a 37 °C por 24 h. Picos de glicose, succinito, lactato, formato, acetato e etanol são suficientemente distinguíveis por seus tempos de retenção em uma coluna HPLC durante a eluição isocrática com solvente de ácido sulfúrico de 5 mM. Clique aqui para baixar este Arquivo.
Figura suplementar 2: Espectros de massa representativos para metabólitos rotulados em 13C, especificamente (A) lactato,(B) glicose e (C) 6-fosfogluconato (6PG) em uma reação CFME incubada a 37 °C por 1 h. Por favor clique aqui para baixar este Arquivo.
Tabela suplementar 1: Lista de metabólitos detectados com 13C, tempos de retenção (alinhados entre amostras usando MZmine), teóricos de modo negativo de 13C, valores m/z, valores m/z de recursos detectados e erros de massa calculados. Clique aqui para baixar esta Tabela.
Discussão
A abordagem desmeque HPLC-RID pode ser usada para quantificar com sucesso o consumo de substrato de açúcar e conversões subsequentes para grandes produtos orgânicos de ácido orgânico e álcool do metabolismo central de lisato ao longo do tempo. Além disso, este protocolo emprega um método isocrático simples usando uma única fase móvel, requer uma preparação mínima da amostra e permite uma simples análise a jusante direcionada. Os analitos medidos pelo método HPLC-RID são distinguidos unicamente por seus tempos de retenção e, portanto, suas interações com a resina de coluna selecionada. A coluna HPLC utilizada aqui foi particularmente projetada para separar carboidratos, ácidos orgânicos e álcoois, combinando exclusão de tamanho e troca de ligantes (ou seja, cromatografia de partição moderada por íons). O método descrito é, portanto, útil para uma análise mais direcionada de substratos de carboidratos e selecionar produtos finais de vias de fermentação de glicose que devem facilitar e energizar principalmente as biotransividamentos à base de lysato8,15,21. No entanto, este protocolo não contabiliza a ativação de outras vias metabólicas em extratos celulares. Os gasodutos que empregam outras técnicas de separação cromatográfica (ou seja, cromatografia de interação hidrofílica), métodos de elução gradiente, preparação de amostras mais complicadas (ou seja, derivatização) e diferentes detectores ópticos (por exemplo, detectores de dispersão de luz ultravioleta ou evaporativo) poderiam ser usados para detectar outros metabólitos, como aminoácidos e fosfatos de açúcar23,24 . Alternativamente, uma abordagem global para estudar o metabolismo do lysato pode ser tomada usando LC-MS/MS.
O método LC-MS/MS descrito é um único fluxo de trabalho para medir e identificar uma gama mais ampla de metabólitos. O LC-MS/MS é uma ferramenta analítica de última geração para o perfil metabolome devido à sua sensibilidade e capacidade de distinguir metabólitos por tempo de retenção e razões m/z com alta resolução16. Com foco nas vias metabólicas de carbono central e anabolismo aminoácido, o modo negativo MS/MS foi implementado para detectar especificamente ácidos orgânicos polares, fosfatos de açúcar e aminoácidos. Aliado a uma técnica de cromatografia nano-líquida, o método proporciona alta sensibilidade para detectar pequenas moléculas no fundo de lise complexa17. Em termos de perfil do metabolismo CFME baseado em lysate, no entanto, uma limitação do protocolo LC-MS/MS descrito é o seu limite de detecção mais baixo de 50 m/z, o que impede a medição do etanol, um produto importante no metabolismo de glicose lysate, bem como formato, ambos são facilmente quantificados pelo método detalhado HPLC-RID. Em comparação com o LC-MS/MS, o HPLC-RID tem a vantagem adicional de acessibilidade relativa em termos de custo e dificuldade. Até o último ponto, a solução de problemas do método LC-MS/MS descrito aqui pode exigir algum grau de experiência em espectrometria de massa. No entanto, a detecção de MS tem aplicações exclusivamente atraentes sobre rid, pois pode também distinguir isótopos rotulados em metabolomas, uma excelente técnica para entender o movimento de carbono a partir de substratos suplementados através da complexa rede metabólica18. Tal abordagem foi aplicada aqui suplementando reações com 13C6-glicose e analisando os valores relativos de abundância de metabólitos de 13C a jusante. A análise permitiu a definição de vias ativas e inativas, apoiando suposições relatadas anteriormente e fornecendo novos insights sobre o fluxo metabólico em lysates. Modificações também podem ser feitas dentro do método para análises específicas. Por exemplo, soluções padrão de compostos-alvo com 13C podem ser analisadas juntamente com amostras para alcançar medições quantitativas absolutas de moléculas derivadas de glicose ao longo do tempo e tirar conclusões sobre distribuições de fluxo. Uma melhor detecção de compostos carregados positivamente também pode ser habilitada dentro do fluxo de trabalho atual executando sequências com arquivos .meth ajustados para detecção positiva do modo.
A amostragem analítica em ambos os métodos descritos é convenientemente automatizada, garantindo alta reprodutibilidade. Além disso, podem ser esperadas corridas analíticas suaves, desde que sejam observadas práticas adequadas de manuseio de instrumentos e manutenção. Ao usar essas ferramentas para analisar as reações do CFME, considerações mais críticas devem ser feitas rio acima e a jusante da amostragem. Durante a preparação da amostra, é importante que os controles do curso de tempo sejam representativos do tempo zero. Aqui, as proteínas foram precipitadas em lisatos por acidificação para parar as reações metabólicas. Para amostras de tempo zero, o solvente ácido foi combinado com lisato antes de adicionar a mistura de reação contendo glicose. A acidificação com ácido tricloroacético efetivamente garantiu que a glicose não seja metabolizada no tempo zero, como mostrado nos dados HPLC-RID(Figura 2). Enquanto um procedimento semelhante para saciar o metabolismo da glicose foi realizado na análise relatada de LC-MS/MS, 13metabólitos rotulados por C foram detectados em amostras de tempo zero, embora em valores de abundância significativamente baixos em relação às amostras extraídas em momentos posteriores. Além disso, essas observações limitavam-se a intermediários da glicólise. Os dados sugerem que as reações retêm algum grau de atividade glicóltica após a acidificação com o solvente de extração detectado por este método altamente sensível. A extensão dessa atividade, no entanto, deve ser quantificada. Um estudo anterior relatou que solventes de extração ácida podem não saciar suficientemente reações glicolíticas intermediárias, mas podem parar o consumo significativo de glicose10. Embora isso continue sendo investigado no sistema utilizado aqui, mudanças drásticas nos valores relativos de abundância entre o tempo zero e as amostras de ponto de tempo posterior podem ser interpretadas como tendências no metabolismo da glicose. A exploração de métodos alternativos de extinção, no entanto, é recomendada em aplicações semelhantes, especificamente para a obtenção de quantidades absolutas de intermediários metabólicos10. Além disso, também devem ser observadas boas práticas durante análises de software a jusante. A consistência é imperativa ao integrar manualmente áreas de pico de sinais RID para reduzir o erro humano. A integração manual também deve ser aplicada às áreas de pico de padrões sempre que áreas de pico integradas manualmente estiverem sendo usadas para quantificar concentrações metabólicas em amostras. Ao longo da análise LC-MS/MS direcionada, as anotações provisórias da análise do MZmine devem ser validadas por verificação manual de pico usando um navegador de qualidade MS, e os recursos m/z só devem ser anotados quando erros de massa calculados forem aceitáveis. Aqui, essas análises foram realizadas manualmente para um conjunto limitado de metas, uma vez que ainda não está estabelecido um software abrangente e robusto para a busca de isótopos. No entanto, tais métodos automatizados para a busca de metabólitos rotulados em 13C estão atualmente emergindo e simplificariam análises mais complicadas também, como o perfil de lysates além do metabolismo central de carbono25.
A cromatografia líquida avançada é um método robusto e amplamente aplicado para separar pequenas moléculas em misturas metabólicas complexas11. Os métodos descritos acoplam essa técnica de separação com o índice refrativo ou detecção espectrométrica de massa para analisar com sucesso conversões metabólicas em reações CFME baseadas em lysato. O HPLC-RID e o LC-MS/MS são ferramentas individualmente poderosas para traçar o perfil do metabolismo de lises, e sua complementaridade pode ser ainda mais aproveitada para atender às limitações inerentes de cada técnica. Os métodos relatados permitem a aplicação e o desenvolvimento do CFME, pois podem ser utilizados para entender o metabolismo de lisestê, monitorar melhorias nas conversões de metabólicas e elucidar alterações no fluxo metabólito ao manipular o metabolismo de lise.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou outros conflitos de interesse.
Agradecimentos
Esta pesquisa foi patrocinada pelo Programa de Ciência Genômica, Departamento de Energia dos EUA, Escritório de Ciência, Pesquisa Biológica e Ambiental, como parte da Área de Foco Científico de Interfaces de Micróbios Vegetais (http://pmi.ornl.gov). Oak Ridge National Laboratory é gerenciado pela UT-Battelle, LLC, para o Departamento de Energia dos EUA sob contrato DE-AC05-00OR22725. Este manuscrito foi de autoria da UT-Battelle, LLC sob o contrato DE-AC05-00OR22725 com o Departamento de Energia dos EUA. O Governo dos Estados Unidos mantém e o editor, ao aceitar o artigo para publicação, reconhece que o Governo dos Estados Unidos mantém uma licença mundial não exclusiva, paga, irrevogável para publicar ou reproduzir a forma publicada deste manuscrito, ou permitir que outros o façam, para fins do Governo dos Estados Unidos. O Departamento de Energia fornecerá acesso público a esses resultados de pesquisas patrocinadas pelo governo federal de acordo com o Plano de Acesso Público do DOE (http://energy.gov/downloads/doe-public-access-plan).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Referências
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados