Method Article
Cromatografia liquida accoppiata all'indice di rifrazione o al rilevamento spettrometrico di massa per la profilazione dei metaboliti in sistemi privi di cellule a base di lisato
In questo articolo
Riepilogo
I protocolli descrivono metodi di cromatografia liquida ad alte prestazioni accoppiati all'indice di rifrazione o al rilevamento spettrometrico di massa per lo studio delle reazioni metaboliche in complessi sistemi privi di cellule a base di lisato.
Abstract
L'ingegneria del metabolismo cellulare per la biosintesi mirata può richiedere ampi cicli di progettazione-costruzione-test-apprendimento (DBTL) mentre l'ingegnere lavora intorno ai requisiti di sopravvivenza della cellula. In alternativa, l'esecuzione di cicli DBTL in ambienti privi di celle può accelerare questo processo e alleviare i problemi di compatibilità dell'host. Un approccio promettente all'ingegneria metabolica senza cellule (CFME) sfrutta gli estratti di cellule grezze metabolicamente attivi come piattaforme per la bio produzione e per scoprire e prototipare rapidamente proteine e percorsi modificati. Realizzare queste capacità e ottimizzare le prestazioni CFME richiede metodi per caratterizzare il metaboloma delle piattaforme cell-free basate su lisato. Cioè, gli strumenti analitici sono necessari per monitorare i miglioramenti nelle conversioni mirate dei metaboliti e per chiarire le alterazioni del flusso dei metaboliti quando si manipola il metabolismo del lisato. Qui, le analisi dei metaboliti utilizzando la cromatografia liquida ad alte prestazioni (HPLC) accoppiata con il rilevamento ottico o spettrometrico di massa sono state applicate per caratterizzare la produzione e il flusso di metaboliti nei lasati di E. coli S30. In particolare, questo rapporto descrive la preparazione di campioni di lisati CFME per analisi HPLC utilizzando il rilevamento dell'indice di rifrazione (RID) per quantificare la generazione di intermedi metabolici centrali e sottoprodotti nella conversione di substrati a basso costo (cioè glucosio) in vari prodotti di alto valore. Viene inoltre presentata l'analisi della conversione dei metaboliti in reazioni CFME alimentate con 13glucosio C-labeled attraverso cromatografia liquida in fase inversa accoppiata alla spettrometria di massa tandem (MS/MS), un potente strumento per caratterizzare le rese di metaboliti specifici e il flusso metabolico di lisato dalle materie prime. Complessivamente, l'applicazione di questi metodi analitici al metabolismo del lisato CFME consente l'avanzamento di questi sistemi come piattaforme alternative per l'esecuzione di compiti di ingegneria metabolica più veloci o nuovi.
Introduzione
Le limitazioni nell'ingegneria dei microbi per la produzione chimica possono essere affrontate ricapitolando le reazioni biochimiche in vitro in cui le funzioni di sopravvivenza cellulare concorrenti sono assenti1. Inoltre, l'ambiente di reazione aperto (cioè l'assenza di una membrana cellulare) è più suscettibile di manipolazione ed è più facile da monitorare rispetto alle cellule vive. Questo concetto fondamentale di ingegneria metabolica senza cellule (CFME) è stato elegantemente dimostrato dalla ricostituzione delle vie metaboliche per sintetizzare sostanze chimiche preziose come idrogeno e monoterpeni con metriche di produzione che sono ordini di grandezza superiori a quelli presentati nelle fabbriche di cellule microbiche finora1,2,3 . I metodi per purificare interi percorsi, tuttavia, sono attualmente limitati da tempi e costi. In alternativa, i sistemi metabolici privi di cellule possono essere derivati da estratti di cellule grezze attraverso metodi rapidi ed economici relativi alla ricostituzione dell'intero percorso4. Il metabolismo centrale che viene trattenuto negli estratti cellulari può essere integrato con substrati energetici (ad esempio, glucosio e cofattori enzimatici) e sali in soluzioni tamponate per generare precursori metabolici centrali per oltre 24 ore5,6. L'aggiunta di enzimi esogeni alla reazione CFME a base di losato consente bio-trasformazioni più complesse del glucosio in sostanze chimiche più preziose a titoli elevati4,6,7. Sebbene la resa tenda ad essere compromessa in questi sistemi a causa della loro complessità metabolica simile a quella cellulare, metodi unici per curare i proteomi del lisato per una conversione a resa più elevata sono stati e sono in fase di sviluppo7,8.
La facilità di effettuare trasformazioni metaboliche in sistemi privi di cellule a base di lisato rende queste eccellenti piattaforme per spostare del tutto la produzione chimica al di fuori della cellula o per prototipare nuovi percorsi con un alto rendimento prima di costruire e testare questi progetti in vivo2,9. Per entrambe le applicazioni, gli strumenti per il monitoraggio delle conversioni metaboliche o l'osservazione delle alterazioni complessive del flusso metabolico nei lisati sono parte integrante del progresso della CFME. La cromatografia liquida ad alte prestazioni (HPLC) può essere utilizzata per separare i costituenti chimici delle reazioni CFME ad alta risoluzione e può essere accoppiata a rivelatori ottici o spettrometrici di massa per la quantificazione dei metaboliti5,10. Il principio alla base dell'HPLC è che gli analiti disciolti in un solvente (cioè in fase mobile) e pompati attraverso una colonna interagiranno con il materiale specifico di imballaggio della colonna (cioè fase stazionaria)11. A seconda delle loro proprietà chimiche, questi analiti mostrano tempi di ritenzione variabili prima di essere eventualmente eluiti dalla fase stazionaria e trasportati dalla fase mobile a un rivelatore. Questo rapporto descrive in dettaglio la preparazione e l'analisi delle reazioni CFME a base di E. coli lysate attraverso metodi basati su HPLC che sfruttano il rilevamento RID e MS / MS.
L'HPLC accoppiato al rilevamento dell'indice di rifrazione (HPLC-RID) è un metodo generalmente accessibile per identificare rapidamente i precursori metabolici centrali e i prodotti finali. In breve, RID misura come gli analeti cambiano la deflessione della luce dalla fase mobile12. I segnali RID corrispondenti agli analiti bersaglio nei campioni possono quindi essere quantificati mediante confronti con i segnali RID di soluzioni standard. Nelle applicazioni CFME, questa modalità di rilevamento è stata più comunemente utilizzata con colonne HPLC che separano i composti in base a una combinazione di esclusione dimensionale e meccanismi di scambio del ligando, o cromatografia di partizione moderata da ioni5,6,8,13. Questa particolare tecnica viene utilizzata per quantificare rapidamente il consumo di substrati di zucchero come il glucosio e la formazione di prodotti di fermentazione come succinato, lattato, formate, acetato ed etanolo nelle reazioni CFME a base di llitasi8. Registrare i cambiamenti di concentrazione di questi composti tramite HPLC è stato utile sia per chiarire il potenziale degli estratti di cellule grezze per mettere in comune i precursori metabolici centrali sia per capire come il flusso della via viene reindirizzato attraverso le vie fermentative durante complesse conversioni metaboliche dal glucosio nei lisati6,8,14. Studi CFME seminali in estratti di cellule di E. coli confermano che i composti di fermentazione si accumulano come prodotti finali del catabolismo del glucosio e si verificano anche come sottoprodotti indesiderati nei lizzati che sovraesprimono gli enzimi esogeni6,15. Si suggerisce che il metabolismo fermentativo svolga un ruolo necessario nella rigenerazione degli equivalenti redox dei cofattori (cioè NAD(P)H e ATP) per sostenere le reazioni glicolitiche8. Quindi, un metodo di rilevamento ottico basato su HPLC progettato per separare i prodotti di fermentazione è uno strumento utile e comunemente applicato quando si eseguono varie attività CFME basate su il lsato.
CFME può essere implementato per accumulare prodotti finali metabolici che non sono carboidrati, acidi organici o alcoli4. La misurazione degli intermedi che vengono consumati con la stessa rapidità con cui vengono sintetizzati può anche essere desiderabile10. Mentre HPLC-RID è accessibile in termini di costi e difficoltà, questo metodo è limitato dalla sua capacità di distinguere i metaboliti solo in base al tempo di ritenzione. Una gamma più ampia di metaboliti può essere analizzata quando la cromatografia liquida è accoppiata al rilevamento MS/MS (LC-MS/MS)16. Con questo metodo, gli analiti nella fase mobile vengono ionizzati e rilevati in modo differenziale in base alle proprietà di massa e carica di ciascuna molecola. La conoscenza sia del rapporto massa-carica (m/z) del metabolita che del tempo di ritenzione sulla colonna facilita così la separazione della maggior parte degli intermedi metabolici e dei prodotti finali ad alta risoluzione16. Questa tecnica di rilevamento può anche essere accoppiata alla cromatografia nano-liquida, che offre portate e volumi di iniezione del campione molto più bassi, consentendo il rilevamento più sensibile di piccole molecole nel complesso fondo di lisato17. LC-MS/MS può anche essere applicato con l'etichettatura isotopica poiché le etichette incorporate impartiscono modifiche nei valori m/z degli analti18. Le misurazioni del punto temporale estratte da una reazione CFME integrata con un substrato di glucosio a 13C6possono quindi determinare i prodotti finali o i sottoprodotti derivati specificamente dal glucosio integrato. Sebbene questo metodo di tracciamento degli isotopi non sia ancora comunemente applicato negli studi CFME, è un potente strumento per comprendere le conversioni metaboliche nei sistemi CFME a base di lisato, in particolare poiché i controioni di sale (cioè acetato e glutammato) in queste reazioni sono anche catabolizzati come substrati secondari19. Sfruttando questa tecnica si può quindi tracciare un quadro completo del metabolismo del glucosio nei lizzati, che ancora oggi non è completamente compreso. Qui, il protocollo descrive in dettaglio un metodo per la cromatografia nano-liquida accoppiata alla ionizzazione nanoelettrospray (nano ESI) MS / MS che può essere utilizzato per interrogare un possibile modello di metabolismo del glucosio, in particolare nei lisati di E. coli (Figura 1). Il modello si basa su segnalazioni di vie fermentative e della via del pentoso fosfato attive nei lasati di E. coli derivati da ceppi coltivati in rich media5,6,8,14. La tecnica viene inoltre utilizzata per studiare la produzione di aminoacidi poiché le attuali conoscenze sull'anabolismo degli aminoacidi dal glucosio nei lizzati sono limitate a pochi esempi come la sintesi di amminoacidi aromatici7. Data la natura prevalentemente polare dei prodotti finali e degli intermedi in queste vie (cioè acidi organici, fosfati di zucchero e amminoacidi), qui è stata utilizzata la cromatografia liquida a fase inversa. Questa tecnica separa i composti polari per eluizione da una fase stazionaria non polare. Questi composti sono stati poi ionizzati da nano ESI in modalità ionica negativa che consente la rilevazione di analiti con almeno una carica elementare negativa ed è quindi utile per rilevare composti acidi. Questa tecnica è impiegata qui per analizzare i metaboliti 13C-incorporanti derivati dal glucosio e dimostra l'utilità di LC-MS / MS per comprendere il metabolismo del glucosio nei lizzati.
Protocollo
1. Avvio, arresto e tempo di elaborazione delle reazioni CFME per la quantificazione HPLC-RID.
- Scongelare i lasati di E. coli precedentemente preparati e preparare il resto dei componenti di reazione sul ghiaccio.
NOTA: I lasati qui riportati sono stati derivati da E. coli BL21DE3-Star coltivato in mezzi 2xYPTG (1,8 % di glucosio) fino alla fase mid-log.- Preparare un volume appropriato di tampone S30 sterilizzato con filtro (0,20 μm per pori) (1 M Tris-OAc regolato a pH 8,2 con acido acetico glaciale, 1,4 M Mg (OAc)2e 6 M KOAc).
- Preparare un mix energetico contenente glucosio, sali di glutammato, ATP, coenzima A, NAD +, tampone Bis-Tris e fosfato dipotassico nel tampone S30. Le concentrazioni finali nel volume di reazione desiderato utilizzato per preparare le reazioni CFME qui erano 100 mM di glucosio, 18 mM di glutammato di magnesio, 15 mM di glutammato di ammonio, 195 mM di glutammato di potassio, 1 mM DI ATP, 0,2 mM di coenzima A, 1 mM NAD+,150 mM di Bis-Tris e 10 mM di fosfato dipotassico.
- Combinare i componenti in tubi microcentrifuga da 1,5 mL per preparare le reazioni finali con 4,5 mg/mL di proteina di lizzata totale. Qui, le reazioni CFME sono state preparate con volumi finali di 50 μL in triplice per timepoint. Incubare le reazioni a 37 °C per i rispettivi intervalli di tempo.
NOTA: Lavorare velocemente e aggiungere il liscerato come componente finale della miscela di reazione per prevenire reazioni metaboliche premature con sali di glucosio e glutammato. Il consumo minimo di glucosio può verificarsi a seconda di quanto tempo le miscele di reazione vengono incubate sul ghiaccio. - Terminare le reazioni ed elaborare i campioni per l'analisi HPLC-RID.
- Per terminare le reazioni triplicate nei punti temporali appropriati, aggiungere immediatamente un volume uguale di acido tricloroacetico al 5% al volume di reazione finale di ciascun campione (cioè 50 μL di acido tricloroacetico al 5% a una reazione di 50 μL). Diluire ogni campione con acqua sterile a 2 volte il volume di reazione (cioè 100 μL).
- Per ricapitolare il tempo zero, mescolare lo stesso volume di acido tricloroacetico al 5% del volume totale della reazione finale (cioè 50 μL) con il lisato prima di aggiungere il resto dei componenti della reazione. Questa fase di acidificazione precipita gli enzimi del lsato prima che metabolizzano significativamente il glucosio.
- Vortice i campioni e centrifuga su una microcentrifuga da banco a 11.600 x g per 5 minuti e trasferire i supernatanti contenenti gli analiti organici in tubi puliti. Conservare i campioni a -20 °C se le analisi HPLC devono essere condotte in un giorno diverso. Assicurarsi di scongelare i campioni conservati sul ghiaccio prima di procedere al passaggio successivo.
- Filtrare ogni surnatante con un filtro dei pori da 0,22 μm. In alternativa alle siringhe, utilizzare filtri a tubo centrifugo e centrifugare i supernatanti a 16.300 x g per 1 minuto.
- Trasferire ogni filtrato in un flaconcino di vetro HPLC pulito. Caricare i flaconcini sul vassoio dell'autocampionatore HPLC.
- Preparare i campioni per la generazione di curve standard.
- Preparare una soluzione madre di tutti gli anati bersaglio disciolti nel tampone S30 a quantità equimolari superiori alla concentrazione iniziale di glucosio nelle reazioni CFME. Qui è stata preparata una soluzione stock composta da 150 μM di glucosio, succinato, lattato, formate, acetato ed etanolo. Eseguire diluizioni seriali 1:1 (v/v) dalla soluzione stock per ottenere soluzioni triplicate da 50 μL con concentrazioni finali comprese tra 0 μM e la concentrazione di stock (cioè 150 μM).
- Diluire ogni soluzione con 50 μL di acido tricloroacetico al 5% e 100 μL di acqua sterile. Ripetere i passaggi 1.3.4-1.3.5.
NOTA: eseguire soluzioni per la generazione di curve standard con ogni lotto di campioni per garantire una quantificazione accurata delle concentrazioni di metaboliti.
2. Preparazione del sistema HPLC per il rilevamento dei metaboliti.
- Sotto una cappa aspirante, preparare una soluzione di acido solforico sterilizzata da 5 mM da acqua deionizzata e sterilizzata con filtro. Aggiungere ~ 550 μL di una soluzione di acido solforico di grado HPLC al 98% a 2 L di acqua per preparare 5 mM di acido solforico.
ATTENZIONE: l'acido solforico è una sostanza chimica pericolosa e lavorare sotto una cappa aspirante con DPI da laboratorio adeguati impedisce l'inalazione, il contatto con la pelle e il contatto visivo. L'acido solforico concentrato reagisce vigorosamente con l'acqua e deve essere aggiunto direttamente all'acqua, non il contrario. Conservare in un'area fresca e asciutta, lontano dalla luce solare diretta e seguire le adeguate misure di smaltimento dei rifiuti stabilite dal laboratorio. - Tenere il flacone da 2 L di acido solforico da 5 mM incubato a bagnomaria accanto allo strumento HPLC. Impostare il bagno d'acqua a 35 °C. Posizionare il tubo con un filtro solvente nella bottiglia del solvente e collegare l'altra estremità a un modulo di degasatore in linea con il modulo pompa.
NOTA: lo spurgo del sistema con un solvente appena preparato prima di installare la colonna è una buona pratica di gestione dello strumento. - Equipaggiare lo strumento HPLC con la colonna HPLC in linea con il modulo RID. Posizionare la colonna nel bagno d'acqua a 35 °C se non è disponibile un termostato a colonna.
- Preparare il modulo RID per l'analisi a 35 °C nel software Chromatography Data System (CDS) installato sul computer di sistema.
- Nel menu Visualizza, selezionare Metodo ed eseguire Control View. Fare clic con il pulsante destro del mouse sul modulo pompa > Metodo. Impostare la portata su 0,55 ml·min-1 e selezionare il pulsante On per avviare la pompa.
NOTA: se la colonna era in deposito prima di essere equipaggiata con l'HPLC, aumentare la portata a 0,55 ml·min-1 dopo aver bilanciato la colonna seguendo le istruzioni del produttore. - Fare clic con il pulsante destro del mouse sul pannello corrispondente al metodo > del modulo RID. Impostare la temperatura del modulo rilevatore RI su 35 °C e selezionare On per avviare il riscaldamento del modulo rilevatore RI.
- Fare clic con il pulsante destro del mouse sul pannello RID Module > Control. Selezionare On per la cella di riferimento di spurgo per almeno 15 minuti quando si utilizza un solvente fresco o 1 ora se diversi solventi sono fluiti attraverso il rilevatore RI prima di questa configurazione. Fare clic sul pulsante On.
NOTA: tenere accesi la pompa e il rilevatore RI per ottenere una linea di base stabile sul grafico online. Ciò è influenzato dalle fluttuazioni di temperatura in laboratorio e può richiedere fino a 4 ore o più. Mantenere il sistema acceso durante la notte prima del caricamento del campione.
- Nel menu Visualizza, selezionare Metodo ed eseguire Control View. Fare clic con il pulsante destro del mouse sul modulo pompa > Metodo. Impostare la portata su 0,55 ml·min-1 e selezionare il pulsante On per avviare la pompa.
3. Creazione di un metodo per la separazione HPLC isocratica dei prodotti di fermentazione biologica nel CDS.
- Dalla barra dei menu, selezionare Metodo > Nuovo metodo. Selezionare Metodo > Salva metodo come [Nomesodo].M. Selezionare Metodo > Modifica intero metodo > strumento/acquisizione
- Nella scheda Pompa binaria, impostare il flusso su 0,55 ml·min-1. In Solventi, selezionare la lettera corrispondente all'ingresso del solvente sul modulo pompa e impostarla su 100% per l'eluizione isocratica. Impostare i limiti di pressione su 0 e 400 bar e l'ingresso 30 minuti come Stoptime.
- Nella scheda Campionatore, impostare volume di iniezione su 50 μL. Selezionare l'opzione Come pompa/Nessun limite in Tempo di arresto. Impostare le impostazioni ausiliarie avanzate per Velocità di disegno, Velocitàdi espulsione e Posizione di disegno su 200 μL·min-1, 200 μL·min-1e -0,5 mm.
- All'interno della scheda RID, impostare Temperatura unità ottica su 35 °C. In Segnale, selezionare Acquisisci per Segnale e >0,2 min per Larghezza di picco. Selezionate l'opzione Come pompa/iniettore per Tempo di arresto.
- In Avanzate nella scheda RID, impostare Uscita analogica su 5% Di offset zero e 500.000 nRIU per Attenuazione. Selezionate l'opzione Positiva per Polarità segnale (Signal Polarity) e l'opzione On (Automatic Zero Before Analysis) per Zero automatico (Automatic Zero Before Analysis).
- Salvare il metodo selezionando Metodo > Salva metodo. Caricare il metodo selezionando Metodo > Metodo di caricamento > [Nome Metodo]. M.
4. Creazione di una tabella di sequenza per l'autocampionamento e avvio del sistema HPLC-RID per l'acquisizione dei dati.
- Dalla barra dei menu, selezionate Sequenza > Nuovo modello di sequenza. Selezionare Sequenza > Salva modello sequenza come [SequenceTemplateName]. S.
- Selezionate Sequenza > Tabella sequenza (Sequence Table). Aggiungere 'n' righe corrispondenti a 'n' flaconcini, quindi inserire le posizioni dei flaconcini e i nomi dei campioni rispettivamente in Vial e Sample Name,in base alla loro disposizione sul vassoio dell'autocampionatore. Selezionare il metodo generato nel passaggio 3 dal menu a discesa Nome metodo e immettere 50 μL come Inj/Flaconcino (Iniezione per flaconcino) per ogni riga.
- Fate clic su Applica (Apply) e salvate il modello di sequenza selezionando Modello di sequenza (Sequence Template) > Salva modello di sequenza (Save Sequence Template). Assicurarsi che il modello di sequenza sia caricato selezionando Sequenza > Carica modello di sequenza > [SequenceTemplateName]. S.
- Dopo aver raggiunto una linea di base stabile sul grafico online, fare clic con il pulsante destro del mouse sul pannello Modulo RID > Controllo > valvola di riciclaggio Off per dirigere il flusso di solvente attraverso il rilevatore RID verso i rifiuti. Per avviare l'acquisizione dei dati, selezionare Sequenza dalla barra dei menu, Sequenza > Esegui.
5. Estrazione e analisi dei dati post-esecuzione.
- Selezionare la vista Analisi dati dal menu Visualizza. Individuate il nome del file di sequenza dall'elenco dei file sul lato sinistro dello schermo. Nel pannello centrale sullo schermo, vai al Signal View Selection > RID Signal per visualizzare i cromatogrammi campione.
- Selezionare una riga corrispondente a un campione standard ad alta concentrazione dal pannello superiore sullo schermo. Prendere nota dei tempi di ritenzione per i picchi di analita target sul cromatogramma visualizzato. I picchi corrispondenti agli analiti bersaglio saranno disposti lungo l'asse del tempo di ritenzione come glucosio, succinato, lattato, formate, acetato ed etanolo (Figura supplementare 1).
NOTA: Il primo grande picco sul cromatogramma corrisponde all'acido tricloroacetico. Le sue unità RI devono essere coerenti in tutti i campioni di curve standard. Convalidare il tempo di ritenzione di ciascun analita target eseguendo ogni composto come campione separato. - Estrarre le aree di picco per ciascun analita bersaglio dai cromatogrammi degli standard e dei campioni di reazione.
- Discernere se i picchi di interesse sono ben integrati dal software. Disegna la linea rossa come base di ogni picco per ottenere un'area accuratamente integrata sotto la curva. Se l'integrazione automatica non riesce (ad es. la linea rossa è incerta), selezionare il pulsante Integrazione manuale dal set di strumenti di integrazione e disegnare manualmente una base di picco per integrare l'area di picco.
NOTA: se è necessario eseguire l'integrazione manuale per un analita di destinazione in un campione, mantenere la coerenza e integrare manualmente lo stesso analita in tutti i campioni. - Selezionate lo strumento Cursore dal set di strumenti comune per fare clic sui picchi correttamente integrati. L'area di picco e il tempo di ritenzione corrispondente del picco selezionato verranno evidenziati come riga di tabella nel pannello inferiore dello schermo.
- Per esportare le aree di picco, selezionare File > Esporta > risultati dell'integrazione.
- Discernere se i picchi di interesse sono ben integrati dal software. Disegna la linea rossa come base di ogni picco per ottenere un'area accuratamente integrata sotto la curva. Se l'integrazione automatica non riesce (ad es. la linea rossa è incerta), selezionare il pulsante Integrazione manuale dal set di strumenti di integrazione e disegnare manualmente una base di picco per integrare l'area di picco.
- Quantificare le concentrazioni di analita target utilizzando curve standard.
- Traccia i valori dell'area di picco rispetto alle concentrazioni note di campioni in un foglio di calcolo. Fare clic con il pulsante destro del mouse sui dati tracciati, Aggiungi linea di tendenza > Formato linea di tendenza > Visualizza equazione sul grafico.
- In un foglio di calcolo separato, utilizzare le equazioni delle linee di tendenza della curva standard per convertire i valori dell'area di picco in concentrazioni per ogni analita di ciascun campione. Calcola le aree di picco medie e i valori di errore standard su triplicati per la visualizzazione dei dati.
6. Avvio, arresto e tempo di elaborazione del corso isotopico traccia delle reazioni CFME per la quantificazione LC-MS / MS.
- Impostare le reazioni triplicate per punto temporale (ad eccezione del tempo zero) sul ghiaccio come descritto al punto 1.1-1.2. Tuttavia, invece di glucosio, utilizzare una concentrazione finale di 100 mM 13C6-glucosio nelle reazioni. Incubare le reazioni a 37 °C per 1 ora, 2 ore e 3 ore.
- Per terminare, congelare le reazioni in azoto liquido e conservarle a -80 °C. Salta questo passaggio di archiviazione per l'analisi in giornata.
NOTA: L'acido tricloroacetico non è stato utilizzato per arrestare le reazioni dovute all'interferenza dell'acido nel rilevare alcuni metaboliti centrali del carbonio tramite LC-MS/MS. Invece, il solvente da estrazione contenente acido formico (fase 6.3) è stato utilizzato per precipitare le proteine metaboliche poiché la massa dell'acido formico è inferiore al limite di rilevazione del metodo MS/MS riportato. - Preparare 50 ml del solvente di estrazione. Combinare e vortice 20 mL di acetonitrile, 20 mL di metanolo e 10 ml di acqua (tutti di grado LC-MS) in un tubo centrifugo da 50 mL insieme a 0,199 mL di acido formico per produrre una soluzione da 0,1 M. Raffreddare il solvente a 4 °C durante l'estrazione e conservare il solvente a -20 °C quando non è in uso.
- Elaborazione di campioni per l'analisi LC-MS/MS
- Il giorno dell'analisi, pipettare un volume equivalente del solvente di estrazione (cioè 50 μL) a ciascun campione. Se i campioni sono stati congelati, aggiungere il solvente di estrazione prima che i campioni si scongelino completamente per impedire la riattivazione del metabolismo del glucosio. Eseguire tutte le fasi di elaborazione del campione sul ghiaccio.
- Per ricapitolare il tempo zero, pipettare il volume finale del solvente di estrazione (cioè 50 μL) a un volume appropriato di lisato per la concentrazione finale desiderata nella reazione (cioè di 4,5 mg/mL in 50 μL di volume di reazione). Aggiungere il resto dei componenti di reazione come nel passaggio 1.2. Questa fase di acidificazione precipita gli enzimi del lsato prima che metabolizzano significativamente il glucosio.
- Incubare i campioni in solvente di estrazione su ghiaccio per 30 minuti con un delicato scuotimento, quindi centrifugare i campioni a 21.000 x g per 15 minuti a 4 °C per separare il surnatante dalla proteina precipitata. Trasferire 50 μL del surnatante ai flaconcini dell'autocampionatore e caricare i flaconcini sul vassoio all'interno dell'autocampionatore a 4 °C. Conservare il resto del surnatante a -20 °C per analisi future.
7. Impostazione del sistema LC per l'analisi LC-MS/MS.
- Preparare 1 L di Solvente A sciogliendo completamente 77,08 mg di acetato di ammonio in 950 ml di acqua e 50 ml di isopropanolo. Preparare 1 L di solvente B con 650 mL di acetonitrile, 300 ml di acqua e 50 ml di isopropanolo insieme a 77,08 mg di acetato di ammonio. Assicurarsi che tutti i solventi siano di grado LC-MS.
- Collegare le bottiglie di solvente contenenti solventi A e B al modulo pompa. Spurgare il sistema ad una portata elevata per rimuovere/limitare qualsiasi contaminazione dell'aria che possa essersi verificata durante l'apparecchiatura dei solventi al sistema LC.
- Dotare il sistema di una colonna a fasi inverse C18 (lunghezza della colonna di 30 cm, diametro interno di 75 μm e diametro delle particelle di 5 μm). Condizionare la colonna al sistema LC-MS facendo scorrere il solvente B al 100% e facendo scorrere lentamente il solvente A al 100%.
NOTA: le punte delle colonne sono state preparate internamente utilizzando un estrattore di micropipette e imballate con celle a pressione ed elio.
8. Creazione di un metodo su software di acquisizione e interpretazione dati LC-MS/MS per il sistema LC collegato agli spettrometri di massa a trasformata di Fourier e trappola ioio.
- Aprire il software Tune Plus per modificare un file di sintonizzazione per il metodo MS.
- Dal file sulla barra dei menu, aprire un file di sintonizzazione in modalità negativa preinstallato.
- Selezionare ScanMode sulla barra dei menu, quindi selezionare Definisci finestra di scansione. Impostare l'impostazione del tempo di microscansione per MSn su 1 sia per Ion Trap che per FT.
- Vai alle impostazioni per la sorgente Nano-ESI e imposta la tensione di spruzzatura su 4 kV. Modulare questo fino a quando non viene generato un elettrospray accettabile; in genere, l'elettrospray accettabile può essere raggiunto nell'intervallo di 2-5 kV.
- Salvare il file di sintonizzazione.
- Generare un nuovo metodo LC utilizzando l'Installazione guidata del software di acquisizione e interpretazione dei dati dello strumento. Apri Roadmap > Installazione guidata sequenza > guidata. Poiché questi metodi non richiedono l'utilizzo di un riscaldatore a colonna, ignorare il passaggio Controllo temp.
- In Opzioni pompa gradiente di flusso, selezionate Multistep. Nella finestra successiva, inserire 7 linee e impostare la portata per ogni riga su 0,1 ml·min-1. Immettere i seguenti parametri per ogni riga: da 0-3 min, erogare il 100% di solvente A; da 3-9 min, introdurre un gradiente dal 100% solvente A al 20% solvente B; da 9-19 min, introdurre un nuovo gradiente dal 20% solvente B al 100% solvente B; da 19-27 min, tenere al 100% solvente B; da 27-28 min, riportare il gradiente al 100% solvente A; da 28-44 min, risciacquo e ricondizionamento della colonna per le tirature successive mantenendo al 100% solvente A. Includere una fase finale per abbassare la portata a 0,03 ml·min-1 al termine della corsa per conservare il solvente quando la LC non è in uso.
- Applicare le impostazioni predefinite per le opzioni del campionatore > la pressione della pompa come opzione di acquisizione e utilizzare il tempo di acquisizione predefinito e utilizzare le opzioni di pressione della pompa predefinita.
- Creare un metodo MS/MS selezionando l'icona Orbitrap Velos Pro MS dalla barra laterale nella finestra Configurazione strumento.
- Fare clic su Nuovo metodo > MS/MS dipendente dai dati. Impostare Il tempo di acquisizione sulla durata dell'esecuzione LC (ad es. 44 min), Segment su 1 e Scan Events su 11. Per Ottimizza file, selezionare il file modificato dal passaggio 8.1.
NOTA: il primo evento è una scansione precursore MS1 utilizzando la trasformata di Fourier MS (FTMS). I successivi 10 eventi saranno scansioni MS2 che selezionano i 10 ioni più intensi e unici in ogni scansione precursore per la frammentazione MS2. - Per l'evento 1, in Descrizione scansione impostare Analizzatore su FTMS e Polarità su Negativo. In Impostazioni MSn, utilizzare una risoluzione di 30.000 e un'energia di collisione normalizzata di 35 V. Impostare intervalli di scansione su 50 m/z per la prima massa e 1800 m/z per l'ultima massa per catturare piccole molecole.
- Per gli eventi da 2 a 11, in Descrizione scansione impostare Analyzer su Ion Trap. Selezionare Scansione dipendente e fare clic su Impostazioni > Esclusione dinamica > globale e selezionare Abilita; impostare una durata di ripetizione di 30 s e una durata di esclusione di 120 s per eliminare le scansioni ripetute in prossimità.
- Vai a Impostazioni evento scansione e imposta Massa determinata dall'evento di scansione su 1 per tutti gli eventi MS2 (da 2 a 11). Per cercare i primi 10 ioni più intensi, impostare ogni evento di scansione MS2 per rilevare un nesimo ione più intenso da 1° a 10°. Pertanto, impostare l'evento 2 per rilevare 1 come nesimo ione più intenso, l'evento 3 per rilevare 2 e così via.
- Chiudere la finestra di configurazione e passare a File > Salva con nome [Method_Name].meth.
NOTA: per l'uso generale, la manutenzione e la calibrazione dello strumento LC e dello spettrometro di massa, fare riferimento alle istruzioni per l'uso e ai manuali forniti dal produttore.
- Fare clic su Nuovo metodo > MS/MS dipendente dai dati. Impostare Il tempo di acquisizione sulla durata dell'esecuzione LC (ad es. 44 min), Segment su 1 e Scan Events su 11. Per Ottimizza file, selezionare il file modificato dal passaggio 8.1.
9. Impostazione di una sequenza di esecuzione e avvio dell'esecuzione LC-MS/MS.
- Impostare una sequenza di esecuzione utilizzando il software di acquisizione e interpretazione dei dati del sistema LC-MS/MS. All'interno di Roadmap > Sequence Setup, fare clic con il pulsante destro del mouse sulla tabella per inserire tante righe quanti esempi. Per ogni riga, impostare l'Inj Vol su 5 μL e la posizione sulla rispettiva posizione del flaconcino sul vassoio dell'autocampionatore. Immettere i nomi dei file come nomi di esempio e impostare il percorso di file desiderato per i risultati di esecuzione.
NOTA: i flaconcini vuoti contenenti solvente A possono essere eseguiti all'inizio della sequenza e tra ogni serie di campioni di triplicato (ogni serie di punti temporali) per risciacquare la colonna. - Per avviare l'esecuzione, evidenziare tutti i nomi di file nella sequenza. Dalla barra dei menu, selezionare Azioni > Esegui sequenza > OK.
10. Consolidamento dei file e ricerca di annotazioni provvisorie su MZmine 2.53.
- Apri MZmine e importa i file di output ".raw" dal passaggio 9.1. Dalla barra dei menu, selezionare Metodi dati non elaborati > Importazione dati non elaborati. Selezionare i file corrispondenti agli esempi.
- Costruisci un elenco di picchi distinguendo tra scansioni MS1 e MS2. Dalla barra dei menu, Raw Data Methods > Feature Detection > MS/MS Peaklist Builder. Le impostazioni rilevanti includono m/z Window impostato su 0.01 e Time Window impostato sulla lunghezza dell'esecuzione. In Imposta filtri selezionare Negativo come Polarità e Centroided come Tipo di spettro.
- Dalla barra dei menu, vai a Metodi dell'elenco delle funzionalità > rilevamento delle funzionalità > Peak Extender. Impostare la tolleranza m/z su 0,005 m/z o 10 ppm e l'altezza minima su 1E3. Questo passaggio creerà picchi completamente arricchiti.
- Rimuovi i picchi duplicati. Tornare a Metodi dell'elenco delle funzionalità > filtraggio > Filtro di picco duplicato. Le impostazioni rilevanti includono la tolleranza m/z impostata su 0,005 m/z o 10 ppm e la tolleranza RT impostata su 5 min.
- Per allineare i picchi all'interno di file di dati simili (ad es. quelli delle reazioni triplicate), tornare a Metodi di > normalizzazione > calibrazione del tempo di ritenzione dell'elenco delle funzionalità. Assicurarsi di elaborare insieme i campioni triplicati e di lasciare fuori gli spazi vuoti. Le impostazioni rilevanti includono tolleranza m/z impostata su 0,005 m/z o 10 ppm, tolleranza RT impostata su 3 min assoluti (min) e intensità standard minima impostata su 1E3.
- Allineare i picchi da tutti i file di m/z e tempo di conservazione da Feature List Methods > Alignment > RANSAC Aligner. Impostare tolleranza m/z su 0,005 m/z o 10 ppm, tolleranza RT e tolleranza RT dopo la correzione rispettivamente su 44 e 39 minuti, iterazioni RANSAC su 0, numero minimo di punti al 10% e valore soglia su 1. Spuntare l'opzione Richiedi lo stesso stato di carica.
- Correggere eventuali punti dati che potrebbero essere stati persi nei passaggi precedenti in Metodi elenco funzionalità > Riempimento lacune > Peak Finder. Le impostazioni rilevanti includono Tolleranza di intensità impostata su 50%, Tolleranza m/z impostata su 0,005 m/z o 10 ppm e Tolleranza RT impostata su 3 min. Abilitare la correzione RT.
11. Calcolo delle masse in modalità negativa di 13metaboliti derivati dal glucosio con etichetta C e ricerca delle caratteristiche m/z di questi analiti nei dati filtrati.
- Calcola le masse di 13metaboliti C-labeled dal metabolismo del glucosio per la ricerca mirata.
- Calcola la massa monoisotopica di ciascun composto bersaglio dal numero di atomi nella formula molecolare del composto e dalle masse monoisotopiche di ciascun elemento20.
- Calcolare la massa in modalità negativa del composto [M-H]- sottraendo la massa di 1 protone (1,007276 Da) dalla massa monoisotopica. Questa è la massa rilevata dal rilevamento ms in modalità negativa dopo che le molecole sono state private di uno ione idrogeno durante la ionizzazione.
- Dalla massa del modo negativo, calcolare la massa del metabolita che incorpora 13C. Qui sono state calcolate le masse di isotopologhi che incorporano al massimo 13etichette C derivate dal glucosio.
- Utilizzare masse calcolate di 13metaboliti C-labeled per cercare e annotare le caratteristiche m / z dai risultati di MZmine. Per ogni possibile hit, calcola l'errore di massa (ppm) usando la seguente equazione:
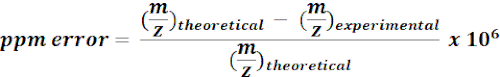
NOTA: i valori m/z sperimentali con errore di massa <15 ppm sono stati considerati come annotazioni putative nell'analisi corrente. - Controllare manualmente gli spettri delle annotazioni putative su un browser di qualità per confermare le annotazioni.
- Apri Roadmap > Qual Browser. Dalla barra degli strumenti, Apri file raw per importare i dati MS grezzi di ciascun campione.
- Disegna una linea sotto l'intervallo desiderato di tempi di ritenzione (cioè corrispondente all'annotazione putativa) sul cromatogramma iogeno totale (pannello superiore) per visualizzare uno spettro di massa (pannello inferiore). Fare clic con il pulsante destro del mouse sullo spettro e immettere un intervallo di masse che comprendono m/z dell'analita target. Verificare se le annotazioni putative hanno segnali di picco distinti che sono sensibilmente al di sopra del rumore (Figura supplementare 2).
- Calcola le aree di picco medie e gli errori standard delle annotazioni positive tra le repliche biologiche per ogni punto temporale. Visualizza i dati (cioè su un grafico a barre) per osservare le tendenze nel metabolismo del glucosio.
Risultati
Per quantificare la sintesi senza cellule a base di lisato di prodotti di fermentazione comuni dal glucosio, i lisati derivati da ceppi coltivati in mezzi 2xYPTG sono stati alimentati con glucosio da 100 μM come fonte primaria di carbonio8. Le reazioni sono state interrotte in un arco di tempo di 24 ore mediante acidificazione delle proteine. I supernatanti filtrati contenenti piruvato, succinato, lattato, formate, acetato ed etanolo prodotti dal catabolismo del glucosio sono stati caricati sul modulo autocampionatore di un sistema HPLC dotato di un modulo RID. Fiale con miscele filtrate di prodotti finali fermentativi e glucosio a 1,17 μM, 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM e concentrazioni di 150 μM nel tampone S30 sono state caricate sullo strumento come standard. Gli analizzati sono stati eluiti isocraticamente da una colonna HPLC al RID. I picchi per glucosio, succinato, lattato, tesa, acetato ed etanolo entro l'intervallo da 1 a 150 μM potrebbero essere risolti dal RID. Le aree di picco per il glucosio sono state derivate dall'integrazione manuale dai dati RID per i campioni di corso temporale e curva standard. Le aree di picco estratte per succinato, lattato, formate, acetato ed etanolo sono state prelevate da segnali integrati automaticamente. Tutte le curve standard (area di picco vs concentrazione nota) avevano valori R2 >0,99 ed erano lineari in tutto l'intervallo di concentrazioni qui utilizzate.
Le concentrazioni molari per tutti gli analeti bersaglio sono state calcolate dalle rispettive curve standard. Il glucosio è stato consumato entro le prime 3 ore della reazione e fermentato principalmente in lattato (Figura 2A,B). Anche l'accumulo di etanolo si è verificato in modo significativo entro le prime 3 ore della reazione e si è fermato successivamente (Figura 2C). L'osservazione di una significativa produzione di lattato ed etanolo con un consumo significativo di glucosio dopo 3 ore non è stata senza precedenti poiché le vie di produzione di lattato ed etanolo consentono la rigenerazione di 1 mol netta NAD+ dal NADH glicolitico necessario per il consumo continuato di glucosio attraverso la glicolisi (Figura 1). Il lattato e l'etanolo possono quindi essere considerati i principali prodotti finali di fermentazione nel metabolismo del glucosio privo di cellule a base di lizzati. L'acetato era inizialmente presente nelle reazioni come componente del tampone S30 e inaspettatamente si accumulava solo a causa del metabolismo dopo 6 ore quando il consumo di glucosio era rallentato (Figura 2D). Questo risultato suggerisce che la fermentazione dell'acetato non consente necessariamente un rapido flusso glicolitico nei punti temporali precedenti. Nel frattempo, il formate e il succinato sono stati sintetizzati come prodotti di fermentazione minori (Figura 2E, F). Complessivamente, il metodo ha permesso la quantificazione assoluta dell'esaurimento del substrato zuccherino e della formazione di prodotti fermentativi nei lasati di E. coli S30.
Il rilevamento della SM per profilare il metabolismo del glucosio del lsato in particolare è stato applicato qui. I lisati derivati da ceppi coltivati in mezzi 2xYPTG sono stati alimentati con 13C6-glucosio come fonte di carbonio. Le reazioni CFME sono state eseguite in triplice copia per 0 h, 1 h, 2 h e 3 h. I campioni di ciascun punto temporale sono stati caricati su un sistema LC dotato di una colonna a fase inversa e accoppiati a spettrometri di massa a trasformata di Fourier e trappola ioiana. Gli spettri in modalità ionico negativa sono stati ottenuti ed elaborati per analizzare acidi organici, fosfati di zucchero e amminoacidi. Sono state ricercate masse teoriche calcolate di 13specie etichettate con C appartenenti al metabolismo centrale del carbonio per identificare composti specificamente derivati dal glucosio. Sulla base delle condizioni di coltivazione del ceppo di origine utilizzate e delle precedenti segnalazioni di percorsi attivi in E. coli CFME, si presume qui che il proteoma di lisi comprende una rete metabolica che alimenta il glucosio nella fermentazione glicolitica, la via del pentoso fosfato e possibilmente l'anabolismo degli amminoacidi5,6,7,8,14 ( Figura1). Pertanto, la ricerca è stata ristretta ai membri di queste vie, di cui 16 metaboliti che incorporano etichette 13C derivate dal glucosio sono state annotate in modo inequivocabile (Tabella supplementare 1).
13 anni C6-glucosioè stato consumato in modo osservabile attraverso la glicolisi, come evidenziato dalle fluttuazioni delle abbondanze intermedie glicolitiche (Figura 3A-E). Coerentemente con i dati HPLC-RID, il glucosio si è accumulato a 13C3-lattatoed è stato anche fermentato a 13C3-succinatoentro le prime 3 ore dellareazione (Figura 4A,B). La formazione dell'isotopologo 13C3-succinatosupporta il modello proposto del metabolismo del glucosio del lsato ( Figura1), in cui è probabile che il succinato sia generato dalla carbossilazione della molecola di fosfoenolpiruvato a 3 atomi di carbonio (PEP) e non dall'ingresso di una molecola di acetil-CoA a 2 atomi di carbonio al ciclo TCA. L'attivazione del ciclo TCA è stata ipotizzata in precedenti studi CFME, ma altri 13intermedi C-labeled di TCA non sono stati rilevati qui8,19,21. 13 anni La sintesi di C 3-aspartato tuttavia si è verificata entro la prima h ed è stata consumata, rafforzando l'idea che il PEP sia direttamente convertito in ossalacetato (Figura 1, Figura 6C). I dati riflettono un proteoma di lisato da ceppi di origine raccolti durante la crescita fermentativa su mezzi ricchi di glucosio (2xYPTG). Ciò implicherebbe inoltre che il resto degli enzimi TCA che non partecipano alla produzione di succinato formano un ramo ossidativo del TCA (Figura 1). Nessuno dei metaboliti in questa via, tuttavia, è stato rilevato, probabilmente perché alte concentrazioni di glutammato aggiunte alla reazione CFME come contraione salino impediscono la progressione di questo ramo.
I dati HPLC-RID sono inoltre integrati dalla mancanza di rilevamento di 13C2-acetatoentro il periodo di 3 ore di reazione che suggerisce che non c'è accumulo di acetato da glucosio fino a 3 ore (Figura 2B). Tuttavia, il precursore diretto dell'acetato, l'acetil-fosfato (acetil-P), si è accumulato, suggerendo che il braccio Pta della via Pta-AckA per la sintesi dell'acetato da acetil-CoA è attivo (Figura 4C,D). La defosforilazione catalizzato da AckA di 13C 2-acetil-P a 13C2-acetatoprobabilmente non si verifica entro questo lasso di tempo a causa del fatto che l'acetato è un componente importante del tampone S30 utilizzato nelle reazioni (Figura 1, Figura 2B).
È stata osservata anche l'incorporazione di 13carboni derivati dal glucosio C6ai fosfati di zucchero 6-fosfogluconolattone (6PGL), 6-fosfogluconato (6PG), ribulosio-5-fosfato (Ru5P) e sedoeptosio-7-fosfato (S7P) (Figura 5). Questi risultati confermano la partecipazione della via del pentoso fosfato nel metabolismo del glucosio del lisato e probabilmente alimentano la sintesi di 13C 9-tirosina, che è stata suggerita in precedenza da uno studio proteomico, fornendo anche un precursore per la produzione di 13C5-istidina (Figura 6A, B)7. Fenilalanina e triptofano etichettati non sono stati osservati qui, e nemmeno la maggior parte degli aminoacidi essenziali. Tuttavia, questo non è del tutto sorprendente poiché l'anabolismo degli aminoacidi è probabilmente arricchito in lasati derivati da cellule cresciute in condizioni di fame di nutrienti o nella fase stazionaria7,22. Inoltre, i dati finora suggeriscono che gli intermedi della glicolisi e della fermentazione sono incanalati verso reazioni finali rigeneranti cofattoriali, che devono precludere la sintesi di molti amminoacidi derivati da gliceraldeide-3-fosfato, piruvato e acetil-CoA (cioè glicina, cisteina, serina, alanina, valina, leucina e lisina) (Figura 1). Come accennato, 13C 3-aspartato è stato prodotto entro la prima ora, mentre l'aspartato derivato da 13aminoacidi che incorporano C (cioè treonina, isoleucina, metionina e asparagina) non sono stati osservati probabilmente perché l'aspartato derivato dal glucosio partecipa alla fermentazione (Figura 1, Figura 6C). Infine, il flusso verso il glutammato etichettato e gli amminoacidi derivati dal glutammato potrebbe essere stato ostacolato da alti livelli di glutammato nell'ambiente di reazione (Figura 1).
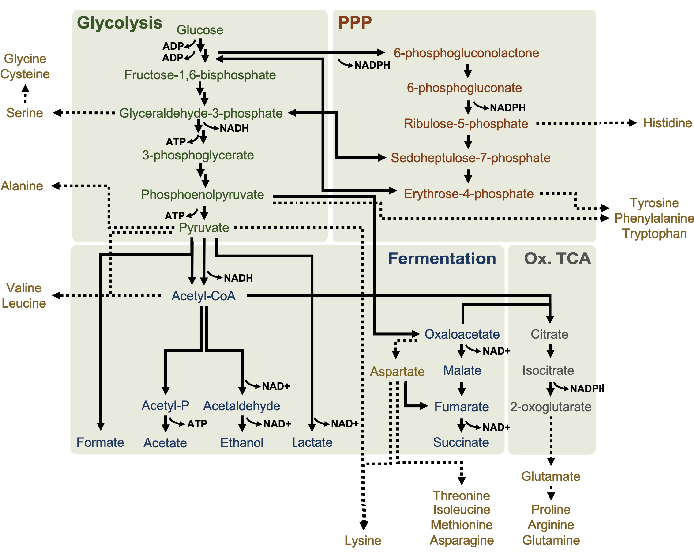
Figura 1: Un presunto modello metabolico di lasati derivato da E. coli BL21DE3-Star che cresce esponenzialmente in alte concentrazioni di glucosio. Intermedi e prodotti finali della glicolisi (verde), la via del pentoso fosfato (arancione scuro) e le vie fermentative (blu) da acetil-CoA sono stati riportati nel CFME a base di lisi. La presenza della fermentazione succinata implica l'attivazione del ramo ossidativo TCA (grigio). L'anabolismo degli aminoacidi (oro) nei lizzati non è ben definito ed è studiato qui. Fare clic qui per visualizzare una versione più grande di questa figura.
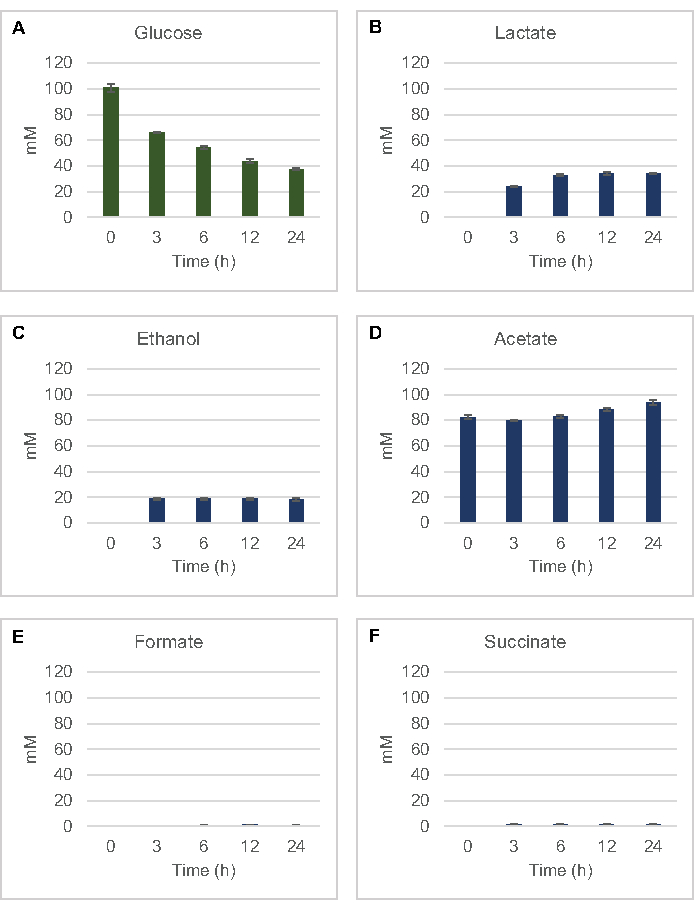
Figura 2: Dati HPLC-RID per il consumo di glucosio e la sintesi fermentativa del prodotto finale nelle reazioni CFME preparate con estratti grezzi di E. coli. (A) Consumo di glucosio e (B) lattato, (C) etanolo , (D) acetato , (E) e (F) produzione di succinato nelle reazioni CFME sono stati monitorati per 24 ore. Vengono presentate le concentrazioni medie di mM e le barre di errore (SE) quantificate con curve standard (n = 3). Fare clic qui per visualizzare una versione più grande di questa figura.
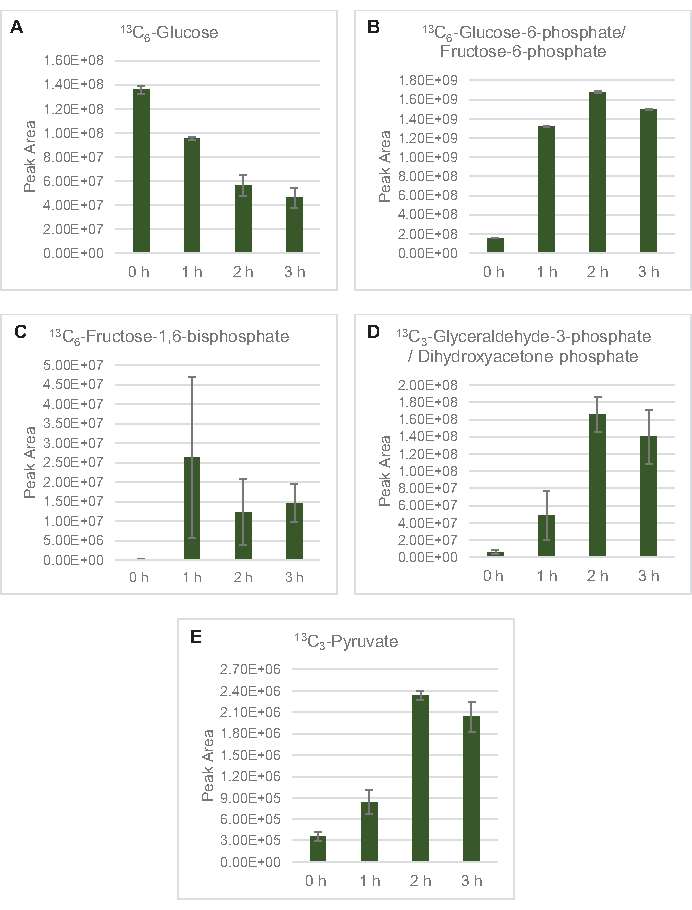
Figura 3: Andamento del corso temporale di 13C6-glucosio e 13intermedi glicolitici C-label in E. coli lysate CFME. Abbondanze relative di (A) 13C6-glucosio, (B) 13C6-glucosio-6-fosfato/fruttosio-6-fosfato, (C) 13C6-fruttosio-1,6-bisfosfato, (D) 13C3-gliceraldeide-3-fosfato/diidrossiacetone fosfato, e (E) 13C6 -piruvato in reazioni CFME superiori a 3 ore. Le aree di picco grezze estratte dal software mzMINE sono state utilizzate per calcolare le medie e le barre di errore (SE) per le annotazioni positive (n = 3). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Andamento del corso temporale degli intermedi e dei prodotti finali nella fermentazione del glucosio 13C6nel CFME del lico di E. coli. Abbondanze relative di (A) 13C3-lattato, (B) 13C3-succinato, (C) 13C2-acetil-fosfato e (D) 13C2-acetil-CoA in reazioni CFME superiori a 3 ore. Le aree di picco grezze estratte dal software mzMINE sono state utilizzate per calcolare le medie e le barre di errore (SE) per le annotazioni positive (n = 3). Fare clic qui per visualizzare una versione più grande di questa figura.
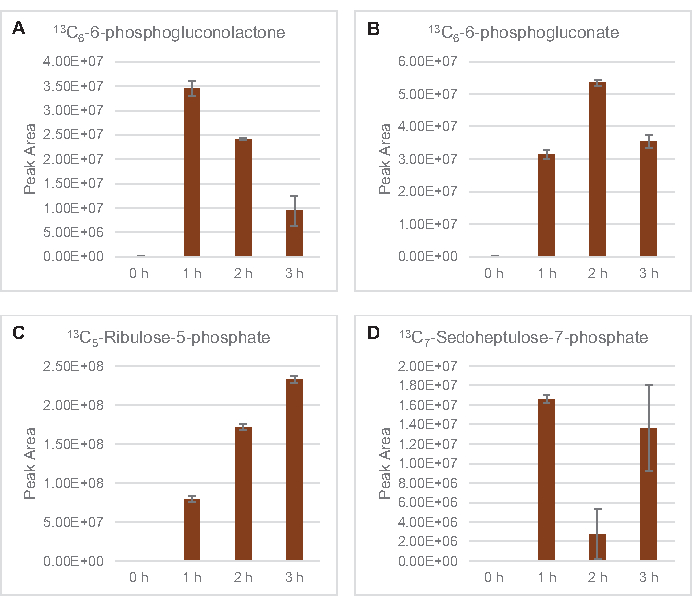
Figura 5: Andamento del decorso temporale degli intermedi della via del pentoso fosfato derivato dal glucosio 13C6in E. coli lysate CFME. Abbondanze relative di (A) 13C6-6-fosfogluconolattone, (B) 13C6-6-fosfogluconato, (C) 13C5-ribulosio-5-fosfato e (D) 13C7-sedoeptosio-7-fosfato oltre 3 ore. Le aree di picco grezze estratte dal software mzMINE sono state utilizzate per calcolare le medie e le barre di errore (SE) per le annotazioni positive (n = 3). Fare clic qui per visualizzare una versione più grande di questa figura.
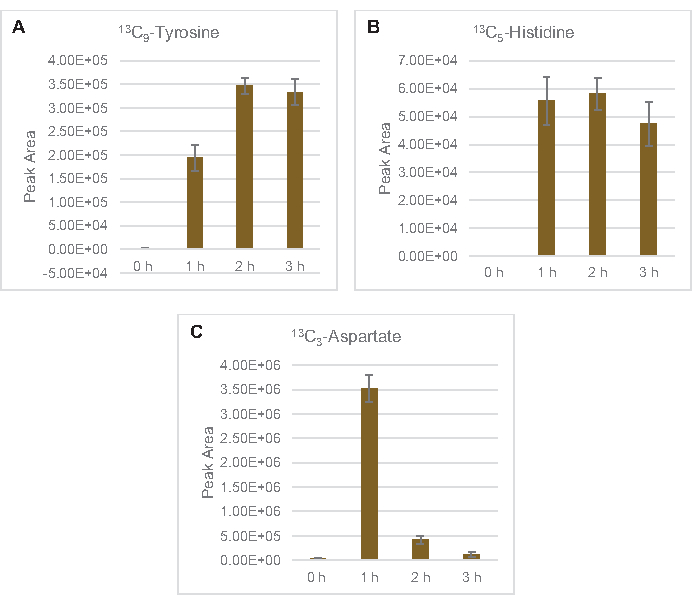
Figura 6: Tendenze del decorso temporale degli amminoacidi derivati dal glucosio 13C6rilevati in E. coli lysate CFME. Abbondanza relativa di (A) 13C9-tirosina, (B) 13C5-istidina, e (C) 13C3-aspartato su 3 h. Le aree di picco grezze estratte dal software mzMINE sono state utilizzate per calcolare le medie e le barre di errore (SE) per le annotazioni positive (n = 3). Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Cromatogramma HPLC-RID rappresentativo che mostra i picchi per i principali prodotti fermentativi in una reazione CFME incubata a 37 °C per 24 ore. I picchi di glucosio, succinato, lattato, formiato, acetato ed etanolo sono sufficientemente distinguibili per i loro tempi di ritenzione su una colonna HPLC durante l'eluizione isocratica con solvente di acido solforico 5 mM. Fare clic qui per scaricare questo file.
Figura supplementare 2: Spettri di massa rappresentativi per metaboliti etichettati con 13C, in particolare (A) lattato, glucosio (B) e (C) 6-fosfogluconato (6PG) in una reazione CFME incubata a 37 °C per 1 ora. Fare clic qui per scaricare questo file.
Tabella supplementare 1:Elenco dei 13metaboliti marcati C rilevati, tempi di ritenzione (allineati tra i campioni utilizzando MZmine), valori teorici di modalitànegativa m/z completamente marcati con C, valori m/z delle caratteristiche rilevate ed errori di massa calcolati. Fare clic qui per scaricare questa tabella.
Discussione
L'approccio HPLC-RID delineato può essere utilizzato per quantificare con successo il consumo di substrato di zucchero e le successive conversioni in importanti prodotti organici acidi e alcolici del metabolismo centrale del lsato nel tempo. Inoltre, questo protocollo impiega un semplice metodo isocratico che utilizza una singola fase mobile, richiede una preparazione minima del campione e consente una semplice analisi mirata a valle. Gli analeti misurati con il metodo HPLC-RID si distinguono esclusivamente per i loro tempi di ritenzione e quindi per le loro interazioni con la resina della colonna selezionata. La colonna HPLC utilizzata qui è stata particolarmente progettata per separare carboidrati, acidi organici e alcoli combinando l'esclusione delle dimensioni e lo scambio di ligandi (cioè la cromatografia della partizione moderata da ioni). Il metodo descritto è, quindi, utile per un'analisi più mirata dei substrati di carboidrati e per selezionare i prodotti finali delle vie di fermentazione del glucosio che dovrebbero principalmente facilitare ed energizzare le bio-trasformazioni a base di lisato8,15,21. Tuttavia, questo protocollo non tiene conto dell'attivazione di altre vie metaboliche negli estratti cellulari. Per rilevare altri metaboliti come amminoacidi efosfatativi, è possibile utilizzare tubazioni che impiegano altre tecniche di separazione cromatografica (ad esempio, cromatografia di interazione idrofila), metodi di eluizione a gradiente, preparazione del campione più complicata (ad esempio, derivatizzazione) e diversi rivelatori ottici (ad esempio, rilevatori di luce ultravioletta o di diffusione della luce evaporativa) . In alternativa, un approccio globale allo studio del metabolismo del lsato può essere adottato utilizzando LC-MS / MS.
Il metodo LC-MS/MS descritto è un unico flusso di lavoro per misurare e identificare una gamma più ampia di metaboliti. LC-MS/MS è uno strumento analitico all'avanguardia per la profilazione del metaboloma grazie alla sua sensibilità e capacità di distinguere i metaboliti per tempo di ritenzione e rapporti m/z ad alta risoluzione16. Con particolare attenzione alle vie metaboliche centrali del carbonio e all'anabolismo degli aminoacidi, la modalità negativa MS / MS è stata implementata per rilevare specificamente acidi organici polari, fosfati di zucchero e amminoacidi. Accoppiato con una tecnica di cromatografia nano-liquida, il metodo fornisce un'elevata sensibilità per rilevare piccole molecole nel complesso fondo di lisato17. In termini di profilazione del metabolismo CFME basato sul lsato, tuttavia, una limitazione del protocollo LC-MS / MS descritto è il suo limite di rilevamento inferiore di 50 m / z, che preclude la misurazione dell'etanolo, un prodotto importante nel metabolismo del glucosio del lsato, così come il formato, che sono entrambi altrimenti facilmente quantificati dal metodo DETTAGLIATO HPLC-RID. Rispetto a LC-MS/MS, HPLC-RID ha l'ulteriore vantaggio di una relativa accessibilità in termini di costi e difficoltà. A quest'ultimo punto, la risoluzione dei problemi del metodo LC-MS/MS qui descritto potrebbe richiedere un certo grado di esperienza nella spettrometria di massa. Tuttavia, il rilevamento della SM ha applicazioni straordinariamente interessanti rispetto al RID in quanto può inoltre distinguere gli isotopi etichettati nei metabolomi, una tecnica eccellente per comprendere il movimento del carbonio da substrati integrati attraverso la complessa rete metabolica del lsato18. Tale approccio è stato applicato qui integrando le reazioni con 13C6-glucosio e analizzando i valori di abbondanza relativa dei metaboliti a valle 13C-incorporanti. L'analisi ha permesso la definizione di vie attive e inattive, supportando ipotesi precedentemente riportate e fornendo nuove intuizioni sul flusso metabolico nei lisati. Le modifiche possono anche essere apportate all'interno del metodo per analisi specifiche. Ad esempio, le soluzioni standard di 13composti bersaglio marcati con C possono essere analizzate insieme a campioni per ottenere misurazioni quantitative assolute delle molecole derivate dal glucosio nel tempo e trarre conclusioni sulle distribuzioni del flusso. Una migliore rilevazione di composti caricati positivamente può anche essere abilitata all'interno del flusso di lavoro corrente eseguendo sequenze con file .meth regolati per il rilevamento in modalità positiva.
Il campionamento analitico in entrambi i metodi descritti è opportunamente automatizzato, garantendo un'elevata riproducibilità. Inoltre, ci si può aspettare un regolare funzionamento analitico purché si osservino adeguate pratiche di gestione e manutenzione degli strumenti. Quando si utilizzano questi strumenti per analizzare le reazioni CFME, è necessario fare considerazioni più critiche a monte e a valle del campionamento. Durante la preparazione del campione, è importante che i controlli del percorso temporale siano rappresentativi del tempo zero. Qui, le proteine sono state precipitate nei lizzati mediante acidificazione per fermare le reazioni metaboliche. Per i campioni a tempo zero, il solvente acido è stato combinato con il lisato prima di aggiungere la miscela di reazione contenente glucosio. L'acidificazione con acido tricloroacetico ha efficacemente assicurato che il glucosio non venga metabolizzato al tempo zero, come mostrato nei dati HPLC-RID (Figura 2). Mentre una procedura simile per estinguere il metabolismo del glucosio è stata eseguita nell'analisi LC-MS / MS riportata, 13metaboliti C-labeled sono stati rilevati in campioni time-zero, anche se a valori di abbondanza significativamente bassi rispetto ai campioni estratti in momenti successivi. Inoltre, queste osservazioni erano limitate agli intermedi della glicolisi. I dati suggeriscono che le reazioni mantengono un certo grado di attività glicolitica dopo l'acidificazione con il solvente di estrazione che viene rilevato con questo metodo altamente sensibile. La portata di questa attività, tuttavia, dovrebbe essere quantificata. Uno studio precedente ha riportato che i solventi da estrazione acidi potrebbero non spegnere sufficientemente le reazioni glicolitiche intermedie, ma possono fermare il consumo significativo di glucosio10. Mentre questo rimane da indagare ulteriormente nel sistema utilizzato qui, drastici cambiamenti nei valori di abbondanza relativa tra campioni time-zero e timepoint successivi possono essere interpretati come tendenze nel metabolismo del glucosio. L'esplorazione di metodi di tempra alternativi, tuttavia, è raccomandata in applicazioni simili, in particolare per ottenere quantità assolute di intermedi metabolici10. Inoltre, dovrebbero essere osservate anche le buone pratiche durante le analisi a valle del software. La coerenza è fondamentale quando si integrano manualmente le aree di picco dai segnali RID per ridurre l'errore umano. L'integrazione manuale dovrebbe essere applicata anche alle aree di picco degli standard ogni volta che vengono utilizzate aree di picco integrate manualmente per quantificare le concentrazioni di metaboliti nei campioni. Durante l'analisi LC-MS/MS mirata, le annotazioni provvisorie dell'analisi MZmine devono essere convalidate mediante il controllo manuale dei picchi utilizzando un browser di qualità MS e le funzionalità m/z devono essere annotate solo quando gli errori di massa calcolati sono accettabili. Qui, queste analisi sono state eseguite manualmente per un insieme limitato di obiettivi poiché il software completo e robusto per la ricerca di isotopi non è ancora stato stabilito. Tuttavia, tali metodi automatizzati per la ricerca di metaboliti etichettati con 13C stanno attualmente emergendo e semplificherebbero anche analisi più complicate, come la profilazione dei lasati oltre il metabolismo centrale del carbonio25.
La cromatografia liquida avanzata è un metodo robusto e ampiamente applicato per separare piccole molecole in miscele metaboliche complesse11. I metodi descritti accoppiano questa tecnica di separazione con l'indice di rifrazione o il rilevamento spettrometrico di massa per analizzare con successo le conversioni di metaboliti nelle reazioni CFME a base di llysate. HPLC-RID e LC-MS/MS sono strumenti individualmente potenti per profilare il metabolismo attivo del lizzato e la loro complementarità può essere ulteriormente sfruttata per affrontare i limiti intrinseci di ciascuna tecnica. I metodi riportati consentono l'applicazione e lo sviluppo di CFME in quanto possono essere utilizzati per comprendere il metabolismo del lisato, monitorare i miglioramenti nelle conversioni mirate dei metaboliti e chiarire le alterazioni del flusso di metaboliti quando si manipola il metabolismo del lisato.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o altri conflitti di interesse.
Riconoscimenti
Questa ricerca è stata sponsorizzata dal Genomic Science Program, U.S. Department of Energy, Office of Science, Biological and Environmental Research, come parte della Plant Microbe Interfaces Scientific Focus Area (http://pmi.ornl.gov). Oak Ridge National Laboratory è gestito da UT-Battelle, LLC, per il Dipartimento dell'Energia degli Stati Uniti sotto contratto DE-AC05-00OR22725. Questo manoscritto è stato scritto da UT-Battelle, LLC sotto contratto DE-AC05- 00OR22725 con il Dipartimento dell'Energia degli Stati Uniti. Il governo degli Stati Uniti conserva e l'editore, accettando l'articolo per la pubblicazione, riconosce che il governo degli Stati Uniti conserva una licenza non esclusiva, pagata, irrevocabile e mondiale per pubblicare o riprodurre la forma pubblicata di questo manoscritto, o consentire ad altri di farlo, per scopi del governo degli Stati Uniti. Il Dipartimento dell'Energia fornirà l'accesso pubblico a questi risultati della ricerca sponsorizzata a livello federale in conformità con il Piano di accesso pubblico del DOE (http://energy.gov/downloads/doe-public-access-plan).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Riferimenti
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon