Method Article
立体定向病毒注射和梯度指数晶状体植入术用于深部脑 体内 钙成像
Erratum Notice
摘要
Miniscope 体内 钙成像是一种强大的技术,用于研究自由行为小鼠的神经元动力学和微循环。该协议描述了使用微型镜进行脑部手术以实现良好的 体内 钙成像。
摘要
微型荧光显微镜(miniscope)是自由行为动物 体内 钙成像的有效工具。与传统的多光子钙成像系统相比,它具有几个优点:(1)紧凑;(2)重量轻;(3)价格实惠;(4)允许从自由行为的动物中记录下来。该协议描述了使用定制开发的微型镜记录系统进行脑深部 体内 钙成像的脑外科手术。制备过程包括三个步骤,包括(1)立体定位在小鼠大脑的所需大脑区域注射病毒,以用遗传编码的钙传感器标记特定的神经元亚组;(2)植入梯度指数(GRIN)晶状体,可以将钙图像从大脑深处区域传递到微型镜系统;(3)将微型镜架固定在小鼠头骨上,以便以后可以安装微型内窥镜。为了进行 体内 钙成像,将微型镜固定在支架上,并收集神经元钙图像以及同时进行的行为记录。目前的手术方案与任何商业或定制的单光子和双光子成像系统兼容,用于深脑 体内 钙成像。
引言
细胞内Ca2+ 信号传导是细胞生长、增殖、分化、迁移、基因转录、分泌和凋亡的重要调节因子1。在神经元中,Ca2 + 信号传导被精确控制,因为它的时空模式与膜兴奋性,神经递质释放和突触可塑性2等关键功能有关。
体内钙成像是一种强大的技术,可用于解码正常动物行为的神经回路表示元素,识别脑部疾病动物模型中的异常神经元活动,并解开可能使这些改变的回路正常化的潜在治疗靶点。两种常见的体内钙成像系统是双光子激光扫描荧光显微镜3,4,5,6和头戴式微型微内窥镜(miniscope)7,8,9,10,11,12,13.传统的双光子显微镜具有制高无上的优势,例如更好的分辨率,更低的噪声和更低的光漂白;然而,实验动物需要头部固定,限制了可以进行的行为研究3,4,5,6。相比之下,头戴式微型镜系统体积小且便于携带,因此可以使用自由行为的动物7,8,9,10,11,12,13来研究各种行为测试。
有两个主要的Ca2 + 指标,化学指标5,14 和遗传编码钙指标(GECI)15,16。通过使用与病毒载体一起递送的高灵敏度GECI来促进Ca2 + 成像,这些载体允许靶向回路中神经元的特定标记。不断努力提高灵敏度,寿命和标记亚细胞区室的能力,使GECI成为各种 体内 钙成像研究的理想选择17,18,19。
成像过程中光在脑组织中的散射限制了光学的深度穿透,即使使用双光子显微镜也是如此。然而,梯度指数(GRIN)镜头克服了这个问题,因为GRIN镜头可以直接嵌入生物组织,并将图像从大脑深处区域传递到显微镜物镜。与由光学均匀材料制成的传统透镜不同,它需要复杂的形状表面来聚焦和创建图像,GRIN透镜的性能是基于透镜材料内逐渐折射率的变化,从而实现与平面20的聚焦。GRIN透镜可以制造直径小至0.2毫米。因此,微型化的GRIN晶状体可以植入大脑深处而不会造成太大的损伤。
在本文中,介绍了用于深部脑体内钙成像的完整手术方案。出于演示目的,我们描述了专门针对小鼠大脑内侧前额叶皮层(mPFC)的脑外科手术,并通过国家药物滥用研究所(NIDA / IRP)的Lin博士小组开发的定制微型镜系统进行体内钙成像记录7,12。实验程序涉及两次主要的脑部手术。第一种手术是在mPFC中立体定向注射表达GCaMP6f(GECI)的病毒载体。第二种手术是将GRIN晶状体植入同一大脑区域。从这些脑部手术中恢复后,随后的程序是使用牙科水泥将微型镜支架(底座)固定在小鼠头骨上。体内Ca2+成像可以在将微型内窥镜安装到其底座上后随时进行。用于病毒注射和GRIN晶状体植入的手术方案与任何用于深脑体内钙成像的商业或定制单光子和双光子成像系统兼容。
研究方案
实验方案遵循怀俄明大学的动物护理指南。本研究中使用的小鼠是6个月大的雄性C57BL / 6J。该程序可用于靶向任何大脑深处区域进行 体内 钙成像。在这里,为了演示,目标脑区域是小鼠mPFC(前部和后部(A / P):1.94毫米,内侧和外侧(M / L):0.5毫米,背侧和腹侧(D / V):1.8毫米)。该协议基于先前发布的协议21进行修改。
1. 在mPFC中立体定向注射病毒(图1)
- 手术准备
- 使用高压灭菌器对所有手术器械进行灭菌,并将其放置在无菌表面上。
- 通过用盐水启动并用5μL盐水预填充它来制备10μL注射器。将注射器连接到微泵上(参见 材料表)。
- 打开加热垫,将温度保持在35°C。
- 将小鼠置于诱导室(5"x 10"x 4",长x宽x高)中,具有5%异氟醚和1 L / min的氧气流速。仔细观察和计算小鼠的呼吸频率。一旦小鼠的呼吸频率降低到1次呼吸/秒,取出小鼠。
注意:通过观察每次吸入期间背部肌肉向下和向上的运动,可以很容易地监测小鼠的呼吸速率。 - 让鼠标停留在与手术区域分开的台式区域。用剃须刀将毛发从鼠头剃掉,直到第一个颈椎。
- 将鼠标固定在立体定位载物台上(参见 材料表),并用耳杆和鼻夹固定其位置。将异氟醚流向立体定位阶段保持在1.5%异氟醚和0.5 L /min氧气流速。
- 用干净的棉签将润滑眼科眼膏涂抹在双眼上,以防止手术过程中眼睛干燥。评估鼠标上的踏板反射,以确认鼠标在开始手术前已完全麻醉。
- 用7.5%聚维酮碘溶液(见 材料表)和70%乙醇消毒无毛区域,每次使用无菌棉签三次。
- 在无毛区域的皮肤下注射少量(50μL)的2%利多卡因。
- 使用手术刀沿着中线穿过皮肤做一个2厘米的切口,以暴露颅骨的λ和胸骨。
- 借助干燥的棉签和尖镊子,从颅骨上取下筋膜。
- 在可见前牙和λ后,使用牙钻毛刺的尖端(直径0.5毫米)测量前牙和λ的Z坐标(见 材料表)。调整鼻托的高度,直到鼻子和λ位于相同的Z位置。
- 将 0.5 mm 牙钻毛刺定位到 A/P:1.94 mm 的位置,M/L:距牙颧 0.5 mm 的位置。钻穿头骨。
注意:在这里,为了演示,目标大脑区域是小鼠mPFC。该协议可用于靶向任何其他深部大脑区域。例如,如果目标大脑区域是伏隔核(NAc),则相应的位置应为A / P:0.9 mm,M / L:1.2 mm。 - 使用30 G针尖去除硬脑膜,并使用45°角锋利的镊子清洁所有碎骨碎片。
注意:出血很常见,因为小血管在清洁步骤中可能会破裂。使用无菌棉签止血,并用盐水清洗该区域。将生理盐水涂抹在暴露的颅骨区域,以保持其湿润。 - 使用微泵的控制面板将病毒加载到微升注射器中。以50 nL / s的流速抽出500 nL气泡,然后取出800 nL病毒。
注意:出于演示目的,此处将表达GCaMP6f(一种GECI)的腺相关病毒血清型1(AAV1)AAV1-CamKII-GCamp6f注射到mPFC中(见 材料表)。病毒的滴度为2.8 x 1013 GC / mL。注射前在盐水中稀释1:2。 - 将针尖放在前凸角的顶部,刚好碰到前角,然后记下前凸凸的Z坐标。将针头移到钻孔上方,注入100 nL病毒,以确保针头不堵塞。
- 将针头缓慢向下移动到脑组织中,到达目标Z坐标D / V:1.75 mm,然后稍微向上移动到D / V的Z坐标:1.65 mm。
注意:这是为了创建一个小口袋,用于输注病毒溶液。如果目标脑区是NAc,则D/V对应的目标Z坐标应为4.2mm,然后略微向上移动至4.1mm。 - 使用控制面板将微泵设置为以50 nL / min的流速注入500 nL病毒。点击控制面板上的 "运行 "按钮以注入病毒。
注意:注射大约需要10分钟。注射结束后,再等待5-10分钟,然后再将针头从大脑中取出。在注射期间经常使用盐水以保持暴露的颅骨区域湿润。 - 将针头向上移出大脑。以50 nL / s的流速两次注入500 nL体积。
注意:此步骤确认已将适当体积的病毒输送到大脑中。在最初的500 nL注射期间,病毒被释放,随后是气泡。在第二次500nL注射期间,首先出现气泡,然后是盐水。注射器现在已准备好为下一只小鼠加载病毒。手术完成后,用丙酮彻底清洁微升注射器和针头,然后用盐水清洁。 - 将皮肤边缘对齐,并用缝合线(尺寸4.0)小心地关闭切口。在缝合区域涂抹抗生素软膏以防止感染。
- 将鼠标从立体定位舞台上取出,然后将其放回原来的笼子。将家庭笼子放在33°C培养箱中,直到小鼠处于行走状态。
注意:小鼠通常需要10-15分钟才能从异氟醚麻醉中醒来,然后才能开始四处移动。 - 在小鼠开始四处移动后,给予非甾体抗炎药3个术后日(见 材料表)。让小鼠从手术中恢复14天,然后再进行GRIN晶状体植入术。
2. 在 mPFC 中植入 GRIN 晶状体(图 1)
- 手术准备
- 制备含有124 mM的NaCl,2.5 mM的KCl,1.25 mM的NaH2PO4,1.2 mM的MgCl2,25 mM葡萄糖,26 mM的NaHCO3 和2.4 mM的CaCl2的人造脑脊液(ACSF)。
- 使用高压灭菌器对所有手术器械进行灭菌,并将其放置在无菌表面上。
- 打开加热垫,将温度保持在35°C。
- 融化1%琼脂糖并将其保存在42°C的水浴中直至使用。
注意:融化的琼脂糖可以在水浴中保存几个小时。 - 将GRIN镜片(直径1毫米,长度4.38毫米, 图2A)在70%乙醇中消毒15分钟,将其转移到充满盐水的管中以在植入前正确冲洗。
注意:GRIN镜片(见 材料表) 是通过 特殊玻璃中的银和锂离子交换生产的,使其无毒且神经元友好6,7。然而,许多市售的GRIN镜片可能会浸出有毒残留物,导致神经变性,使其不适合植入活脑进行长期 的体内 成像研究。这些GRIN镜片可能需要涂覆生物相容性物质,如parylene-C,以防止对邻近神经元的毒副作用22。
- 称量小鼠并通过腹腔注射氯胺酮/ 赛拉嗪混合物麻醉(见 材料表)(氯胺酮:100mg / kg;赛拉嗪:15毫克/千克)。
注意:体重30g的小鼠在手术过程中需要300μL氯胺酮/赛拉嗪混合物(氯胺酮100mg / mL和赛拉嗪1.5mg / mL)和150μL氯胺酮(10mg / mL)作为额外剂量。为了在整个手术过程中保持小鼠保持麻醉状态,每小时至少需要额外剂量的氯胺酮(50mg / kg)施用一次。需要通过评估踏板反射来经常监测小鼠的麻醉阶段。 - 用剃须刀剃掉手术区域的头发,并用湿纸巾清洁头发。
- 将鼠标置于立体定位阶段,并通过收紧鼻夹和耳杆固定其位置。用无菌棉签在双眼上涂抹润滑眼药膏。通过评估踏板反射来确认鼠标已完全麻醉。
- 用7.5%聚维酮碘溶液和70%乙醇消毒无毛区域,每次使用无菌棉签三次。在大腿肌内注射2mg / kg地塞米松,以降低手术相关肿胀和炎症的风险。
- 在手术区域的皮肤下注射50μL2%利多卡因。
- 使用细剪刀切除1.5厘米(高)x 1.0厘米(基部)的三角形皮肤区域,从眼睛之间的前侧到λ后面的后侧。
- 使用细镊子,微刀片和棉签从颅骨上取出骨膜组织。
注意:在进行下一步之前,应彻底清洁并干燥头骨。 - 将氰基丙烯酸酯(见 材料表)涂抹在皮肤的边缘,并将皮肤附着在颅骨上。等待5分钟,直到氰基丙烯酸酯变干。
- 借助 0.5 mm 钻头毛刺尖端,通过调整鼻夹的高度,将前凸和 λ 在同一水平面上对齐。
- 将牙钻毛刺(直径 1.2 毫米)定位到 A/P 位置:1.94 毫米,M/L:距牙颧 0.8 毫米。钻穿头骨。使用30 G针尖去除硬脑膜,并使用45°角锋利的镊子清洁所有碎骨碎片。
注意:如果不完全清除,这种骨碎片可能会阻碍随后的抽吸步骤。 - 将一根27 G手动抛光的钝端针(图2B)连接到针座上,该针座与倾斜角度为10°的机械臂相连(图2C)。将针座的另一端连接到室内真空系统。
注:机械臂(见 材料表)由Lin博士在NIDA/IRP的小组开发,由定制开发的开放式访问软件AutoStereota(https://github.com/liang-bo/AutoStereota)控制23 - 找到针尖,只是触摸眉毛。将 bregma 的 Z 坐标设置为 0,方法是单击 AutoStereota 上的 Bregma 按钮。
- 将 输入 X 值设置为 0.8, 将输入 Y 值设置为 1.94, 将输入 Z 值设置为 1.0,然后单击" 查找 "按钮将指针移动到颅骨上钻孔的顶部。
- 通过AutoStereota将针的位置调整到暴露的脑组织区域的中心。
注:要在横向或内侧方向上移动针头,请输入"步长"值,然后单击"自动胸针"上的" 横向 "或" 内侧 "按钮。同样,要在前部或后部以及背侧或腹侧方向移动针头,请分别单击 喙 或 尾部 和 背侧 或 腹侧 按钮。 - 打开真空吸尘器,开始用ACSF冲洗暴露的大脑区域,通过重力控制的管道系统(参见材料表)连接到带有弯曲尖端的30 G针头上。ACSF用95%O 2和5%CO 2的气体混合物连续鼓泡,并通过0.2μm过滤器过滤。
注意:ACSF流速约为1.5毫升/分钟。气体混合物的输出压力保持在~3 psi。 - 借助 AutoStereota 软件 (图 3).
注意:脑组织的抽吸分4轮完成,以便产生柱状口袋(深度1.8毫米,直径1毫米)。- 在"zStep"会话中,单击并检查第一行和第二行。将第一行的值设置为 0.2 和 1。将第二行的值设置为 0.15 和 4(图 3A)。
- 在"模式"会话中,将 针尺寸 设置为 27 号量规,将 1.2 设置为 Dims 0.9。所有其他值都使用默认值(图 3A)。
- 依次单击" 设置"、" 保持零 "和" 开始 "按钮以开始吸气。
注意:这是第 1轮抽吸。输入值表示在第一步中吸入深度为0.2 mm(从Z坐标0开始),具有1层;在第二步中,抽吸深度为0.15毫米,连续重复4层。抽吸分辨率为1.2,直径为0.9 mm。在抽吸过程中,可以通过轨迹图面板监控针尖的即时位置。完成此抽吸回合后,将生成一个深度为0.8 mm,直径为1 mm的柱形口袋。针尖将返回到 Z 坐标为 0 的中心。 - 在"zStep"会话中,单击并检查第一行和第二行。将第一行的值设置为 1 和 1。将第二行的值设置为 0.15 和 4(图 3B)。
- 在"模式"会话中,保持所有值与上一轮相同(图3B)。
- 依次单击" 设置"、" 保持零 "和" 开始 "按钮以开始吸气。
注意:这是第 2轮抽吸。输入值表示在具有1层的第一步中,吸入深度为1 mm(从Z坐标0开始);在第二步中,抽吸深度为0.15毫米,连续重复4层。完成此抽吸回合后,将生成深度为1.6 mm,直径为1 mm的柱形口袋。 - 在"zStep"会话中,单击并仅检查第一行。将第一行的值设置为 1.8 和 1(图 3C)。
- 在"模式"会话中,将 针尺寸 设置为 27 号和 2.2。所有其他值与上一轮的值相同(图3C)。
- 依次单击" 设置"、" 保持零 "和" 开始 "按钮以开始吸气。
注意:这是第3 轮抽吸。输入值表示抽吸深度为 1.8 mm(从 Z 坐标 0 开始),共 1 层。期望分辨率为2.2。完成此抽吸回合后,将生成深度为1.8 mm,直径为1 mm的柱形口袋。 - 在"zStep"会话中,单击并仅检查第一行。将第一行的值设置为 1.6 和 1(图 3D)。
- 在"模式"会话中,设置 针尺寸 27号和2.2,设置 Dims 0.6(图3D)。
- 依次单击" 设置"、" 保持零 "和" 开始" 按钮,以开始吸气。
注意:这是第 4轮抽吸。这一步的目的是清理口袋里积聚的血液。出血是常见的,因为小血管在抽吸过程中破裂。要彻底清除血液,请停止ACSF冲洗5分钟,然后再次打开灌溉。多次重复第 4轮抽吸,直到口袋无血。该协议可用于靶向任何其他深部大脑区域。例如,如果目标大脑区域是NAc,则D / V的最终对应Z坐标应为4.4 mm。
- 停止ACSF的真空和灌溉。将针头置于 +2 mm Z 坐标和前 0.5mm 的中央。将无菌 1 毫米 GRIN 镜头放入口袋中。
- 保持针尖与暴露的 GRIN 镜片接触,以确保 GRIN 镜片以 10° 角固定。用无菌软纸轻轻按压GRIN晶状体的上表面,以确保GRIN晶状体的下表面与脑组织接触。
- 在刮刀的帮助下,将融化的琼脂糖涂抹在GRIN晶状体和脑组织之间的间隙中。琼脂糖形成凝胶后,使用微刀片除去多余的琼脂糖。
- 用盐水和棉签彻底清洁头骨。在随后的牙科水泥(见 材料表)应用之前,让颅骨干燥。
- 从-20°C冰箱中取出混合孔。将牙科水泥粉与催化剂液混合,并在颅骨上涂上一层自固化的粘性树脂水泥;首先,包围GRIN镜头,然后覆盖整个暴露的头骨。
- 等待5分钟,让它完全硬化。小心取下抽吸针头。
- 在干净的塑料井中,将牙科水泥粉,黑炭与液体混合,并在第一层牙科水泥的顶部涂上薄薄的一层混合物。等待5分钟让它变硬。
- 用PCR管制成的定制盖盖住暴露的GRIN镜片,保护其(图2D)。应用氰基丙烯酸酯将盖子连接到牙科水泥上。
- 皮下注射1mL预热盐水至小鼠,然后0.1mg / kg丁丙诺啡。将鼠标放回其家笼子中。将家庭笼子放在33°C培养箱中并监测小鼠,直到其处于可移动状态。老鼠通常需要20-40分钟才能从麻醉中醒来,然后才能开始四处走动。
- 给予非甾体抗炎药并监测小鼠至少3个术后天。让小鼠从手术中恢复30天。
3.将微型镜支架(底座)固定在小鼠头骨上(图1)
- 用5%异氟醚和1 L / min氧气流速在诱导室中麻醉小鼠,直到其呼吸频率降至1呼吸/ s。
- 将鼠标放在立体定位阶段,并用耳杆和鼻夹固定其位置。保持异氟醚(1.5%)和氧气(0.5升/分钟)的连续流动。
- 在眼睛上涂抹眼药膏,以保持眼睛湿润。打开加热垫,将温度保持在35°C。 通过评估踏板反射来确认鼠标已完全麻醉。
- 使用尖镊子轻轻取下覆盖GRIN镜头的盖子。使用微钻完全从牙科水泥中钻出干燥的氰基丙烯酸酯残留物(参见 材料表)。
- 用小剪刀剪掉牙齿水泥区域周围的头发。借助压缩空气除尘器清理碎屑。使用丙酮浸渍棉签清洁GRIN镜片的上表面。
- 准备带有支架(底座)的迷你内窥镜。
- 将#00-90六角螺母(参见 材料表)放入底座中的插槽中,然后应用氰基丙烯酸酯将其固定在那里(图2E)。
- 将聚四氟乙烯(PTFE)胶带紧紧地贴在微型镜的螺纹周围,并修剪掉多余的胶带(图2F)。
- 将微型内窥镜固定到底座上,然后使用锁定螺钉将微型内窥镜固定到底座上(图2G)。
- 将微型内窥镜连接到其电缆,然后打开定制开发的,目前开放的访问软件NeuView(参见 材料表)。
注:NeuView软件是为Lin博士在NIDA / IRP7,12的小组为微型镜体内钙成像定制的。它是开放获取的(https://github.com/giovannibarbera/miniscope_v1.0)。 - 在 NeuView 中,单击 硬件,选中 LED1, 然后单击流按钮 以查看实时图像(图 4A)。要停止直播,请单击" 停止 "按钮。
- 将微型内窥镜固定在定制的微型内窥镜握持臂(图2H)中,其XYZ位置可以使用电动控制器进行操作(图2I)。
- 将微型瞄准镜定位在暴露的 GRIN 镜头正上方,并使其平行于镜头表面。慢慢地将微型瞄准镜朝向GRIN镜头,并调整其Z位置,直到找到最佳焦距平面。
注意:最佳焦平面是通过比较几个可能的Z位置并选择焦平面来确定的,该焦平面具有大多数细胞体的清晰可视化。 - 在微型镜底座周围小心地涂上第一层牙科水泥,而不改变微型镜的位置。水泥硬化后,轻轻取下固定臂,使微型镜可以独立站在鼠标头上。
注意:牙齿水泥在硬化后往往会收缩,并且它会将微型镜拖离原始焦点平面。通常,在应用牙科水泥以补偿潜在的变化之前,微型镜Z位置略微提升到原始焦平面上方。 - 在底座周围涂上第二层牙科水泥以填充所有间隙,并确保间隙中没有LED光泄漏。让牙齿水泥变硬。
- 从立体定位舞台中取出鼠标。拧松锁定螺钉,然后将微型内窥镜从底座上拆下。将3D打印的保护帽放入底座以保护暴露的GRIN镜头,并拧紧底座中的锁定螺钉(图2J)。
- 将鼠标放回其家笼子中。
注意:小鼠通常需要10-15分钟才能从异氟醚麻醉中醒来,然后才能开始四处移动。
4. 微型镜安装和 体内 Ca2+ 成像(图1)
- 将微型内窥镜安装到底座上
- 在诱导室中短暂麻醉小鼠(5%异氟醚和1 L / min氧气流速)。将鼠标放在干净的工作台表面上。
- 用小螺丝刀拧松锁定螺钉,取下保护盖,并用丙酮浸泡的棉签清洁GRIN镜头的表面。
- 将PTFE胶带紧紧缠绕在微型内窥镜螺纹上,并将微型内窥镜固定在鼠标头上的底座上。
- 将微型示波器连接到电缆(图2K),打开NeuView软件。
- 在 NeuView 中,单击 硬件,选中 LED1, 然后单击流按钮 以查看实时图像(图 4A)。
- 通过调整微型镜相对于底座的位置来确定最佳焦平面,在钝镊子的帮助下稍微收紧或松开。
注意:最佳焦平面是通过比较几个可能的位置并选择具有大多数细胞体清晰可视化的位置来确定的。 - 拧紧锁定螺钉,然后将鼠标放回其主固定架中。
- 在 NeuView 中,将 LED 灯功率调整到最佳水平。单击" 捕获 ",然后单击" 触发 "按钮开始录制,并在150帧后单击" 停止 "。
注:尽可能低的功率决定了 LED 功率的最佳水平,以获得足够明亮的图像。录制短视频的目的是便于将来识别相同的焦平面以进行重复成像。 - 从微型内窥镜上拔下电缆。让小鼠在开始实验之前至少恢复30分钟。
注意:为了保护微型内窥镜,通常,在这短时间内会移除水瓶和食品丝喂料器。如果小鼠需要在家庭笼子中停留更长时间,建议在家庭笼子中提供市售的减肥凝胶(参见 材料表)。
- 用于 体内 钙成像的数据采集
注意: 体内 钙成像可以与研究人员所需的任何行为测试同时进行。出于演示目的,此处的示例是在开场测试期间 进行体内 Ca2 + 成像。若要实现此目标,需要两台计算机。一台计算机配备了商业软件(参见 材料表)来控制相机自动记录鼠标行为。另一台计算机配备了NeuView来控制微型望远镜并记录Ca2 + 图像。- 打开行为相机软件(参见 材质表),通过实时流功能查看鼠标行为竞技场。手动调整顶部相机的对焦(图2L)。
- 选择 触发/选通 ,然后选中"启用/禁用触发"(图4B)。单击" 录制 "按钮,使用 "浏览 "选择保存行为记录的位置,选择所需的图像格式。
注意:启用"触发控制"功能以允许行为记录由 NeuView 软件触发,以便行为帧和相应的钙成像帧在时间上耦合在一起。行为记录可以以任何所需的格式保存。行为记录通常以 JPEG 格式保存在指定的文件夹中。 - 将鼠标靠近竞技场,并将微型内窥镜连接到与数据采集系统连接的电缆(图2L)(参见 材料表)。然后将鼠标放置在竞技场的中心。
- 借助NeuView软件的直播功能,调整LED功率以优化钙图像的亮度。
注意:对于钙成像,默认情况下,记录帧速率为 10 帧/秒。 - 在NeuView中,取消选中 LED1,单击" 捕获 ",然后单击 "触发 "按钮开始录制,然后在100帧后点击" 停止 "。
注意:这是为了在关闭LED灯的情况下录制大约100帧的背景图像。 - 在行为相机软件中,单击 开始录制 (图4C)。在 NeuView 中,选中 LED1,单击" 捕获",然后单击" 触发 "按钮开始录制。点击 停止 后 3000 帧.
注意:这是为了同时记录钙成像和行为。露天测试时间为15分钟,通常分为三个记录会话,每个会话5分钟。这是为了防止微型内窥镜因连续使用而过热。 - 将钙成像和行为记录保存在指定的文件夹中。重复录制两个会话,同时在每个会话之前录制背景,并将所有录制保存在指定的文件夹中。
- 从底座上拆下迷你镜。
- 录制完成后,断开电缆与微型示波器的连接。
- 在诱导室中短暂麻醉小鼠(5%异氟醚和1L / min氧气流速)。将鼠标放在干净、温暖的表面上。
- 拧下底座中的锁定螺钉,然后将微型内窥镜从底座上拆下。将保护盖放回底座上,然后拧紧锁定螺钉。将鼠标放回其家笼子中。
结果
图1显示了实验过程的示意图,包括病毒注射,GRIN镜片植入,将微型镜基部固定在小鼠头骨上,以及通过微型镜进行体内钙成像。整个过程需要约2个月。图2显示了用于体内钙成像的微型镜方案中描述的主要成分。图3显示了GRIN镜片植入过程中AutoStereota软件的接口。图4显示了NeuView和体内钙成像过程中行为记录软件的界面。
体内钙成像的结果取决于病毒注射和GRIN晶状体植入手术的成功。图5显示了体内钙成像记录的一系列结局(即,不成功,次优和良好)。在不成功的情况下,钙图像可能看起来很暗或很亮,但通常没有或很少显示活跃的神经元。如果活性神经元少于五个,我们通常不会进行体内钙记录实验。良好的体内钙成像通常显示数百个活跃的神经元。如果一个记录包含少于一百个活动神经元,我们认为它是次优记录。
在次优和良好的 体内记录中 ,进行了钙成像实验,并进行了随后的数据分析。 图1 显示了来自小鼠mPFC的具有代表性的 体内 钙成像记录。行为视频和钙成像数据通常单独处理。鼠标行为视频可以手动评分。钙成像文件使用CaImAn钙图像处理工具箱24进行处理。 图6 显示了来自良好 体内 钙成像记录的代表性细胞图谱和几种钙痕量。
完成 体内 钙成像后,最后一步是确认病毒注射和GRIN晶状体植入是否发生在所需的大脑区域。为此,小鼠灌注磷酸盐缓冲盐水(PBS),然后灌注4%多聚甲醛(PFA)。收获小鼠大脑,在4%PFA中后固定12小时,并在4°C下储存在PBS中。 然后将小鼠大脑用振动切片机切成50μm厚的切片。用DAPI染色脑切片并在显微镜下观察(方案中未描述)12。 图7 是来自实验小鼠前方约1.94毫米的小鼠脑切片,显示了植入GRIN晶状体的轨迹。GRIN晶状体轨道下方和周围的绿色荧光区域表示GCaMP6f在mPFC区域中的表达。
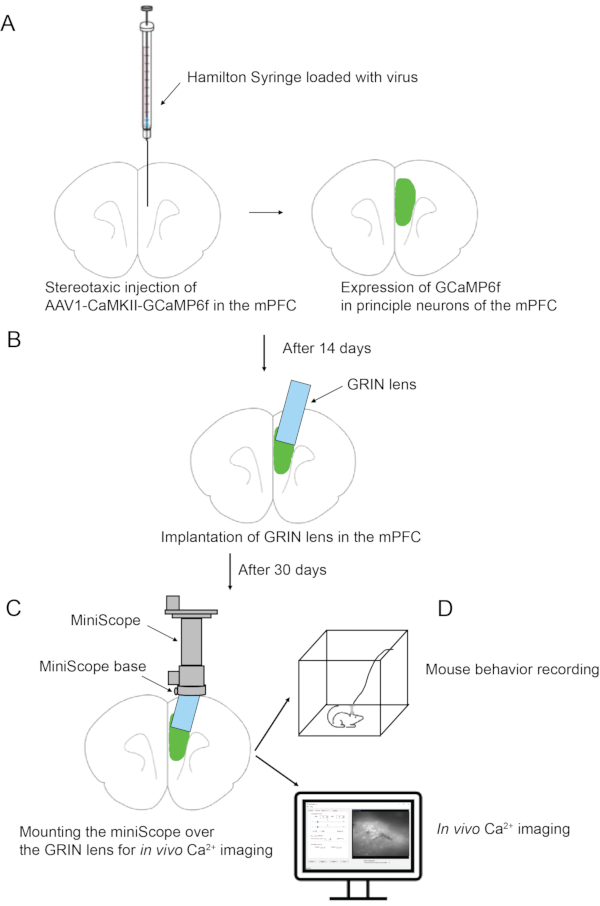
图1:实验过程的示意图概述。 (A)在mPFC中对病毒进行立体定位注射。(B) 在 mPFC 中植入 GRIN 晶状体。(C)将微型镜底座固定在小鼠头骨上。(D)微型镜安装和 体内 钙成像。 请点击此处查看此图的大图。

图2: 体内 钙成像所需的主要成分。 (A) 直径为 1 毫米、长度为 4.38 毫米的 GRIN 镜头。(B) 一根27克手动抛光的钝端针头,用于脑组织抽吸。(C)机械臂与针座耦合。(D)来自PCR管的定制盖子,用于保护暴露的GRIN镜头,直到将微型镜底座固定在小鼠头骨上。(E) 带六角螺母的微型内窥镜支架(底座)。(F) 微型内窥镜,其螺纹部分用PTFE胶带包裹。(G) 微型内窥镜用锁紧螺钉固定在其底座上。(H) 微型内窥镜握持臂。(I)定制的3D电动控制器,用于方便微型镜在XYZ位置的移动。(J)固定在底座上的保护帽,以保护暴露的GRIN镜头,而鼠标不进行 体内 钙成像。(K) 微型示波器连接到电缆。(L) 用于 体内 Ca2+成像的 数据采集系统。 请点击此处查看此图的大图。
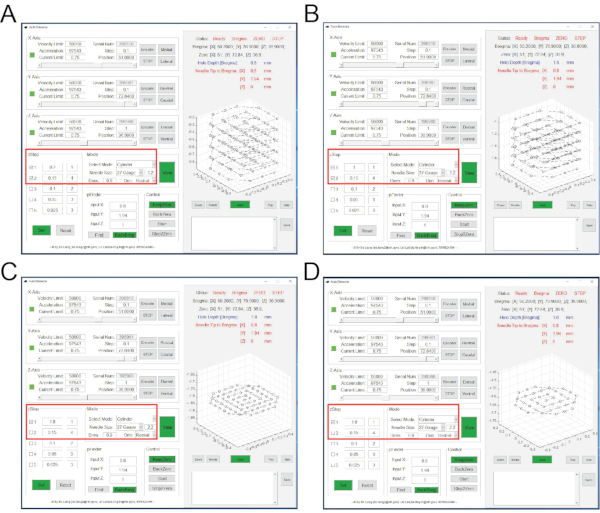
图 3:逐层脑组织抽吸过程中 AutoStereota 软件的接口。 (A) 对应于步骤 2.17.1 至 2.17.3 的接口。(B)步骤2.17.4至2.17.6对应的接口。(C)步骤2.17.7至2.17.9对应的接口。(四)接口对应步骤2.17.10~2.17.12。红色框突出显示输入值。 请点击此处查看此图的大图。
图4:NeuView软件和体内钙成像过程中的行为记录软件 的 接口。 (A) NeuView 的接口。(乙、丙)行为记录软件的接口。红色框突出显示需要单击的按钮。 请点击此处查看此图的大图。
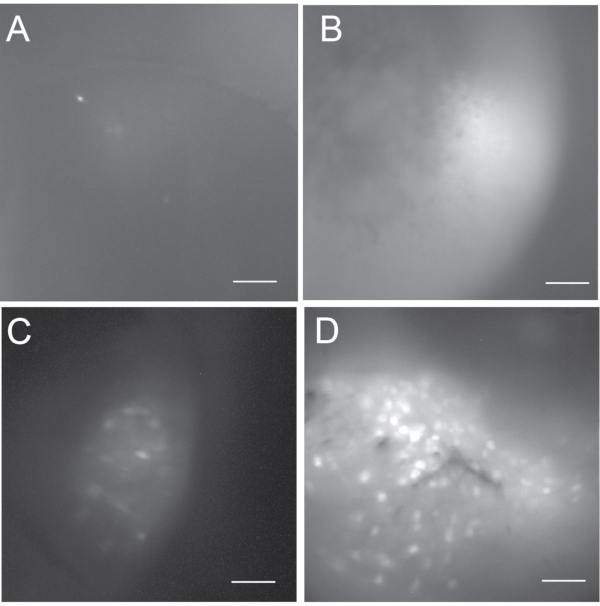
图5:最大投影荧光细胞图,以显示可能的结果范围。 (A,B) 不成功的体内 钙成像,不可接受用于后续的数据分析。(A)是黑暗的,含有少于5个活跃的神经元。(B)明亮但没有活跃的神经元。(C)来自包含一些活性神经元的次优 体内 钙成像的细胞图谱。(D)来自良好的 体内 钙成像的细胞图谱,其中包括数百个活性神经元。比例尺:100 μm。 请点击此处查看此图的大图。
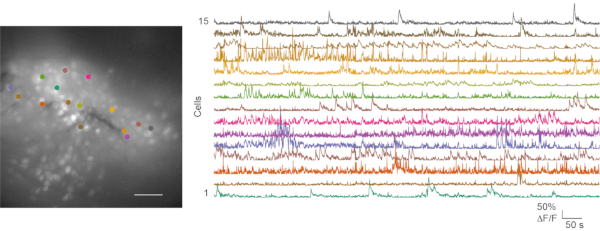
图6:来自成功的体内 钙成像的代表性细胞图和钙瞬变。 左图是开场测试期间 mPFC中体内 钙成像记录的最大投影荧光细胞图。录音持续5分钟。右侧面板显示了来自 15 个感兴趣区域(颜色匹配)的钙瞬变。比例尺:100 μm。 请点击此处查看此图的大图。
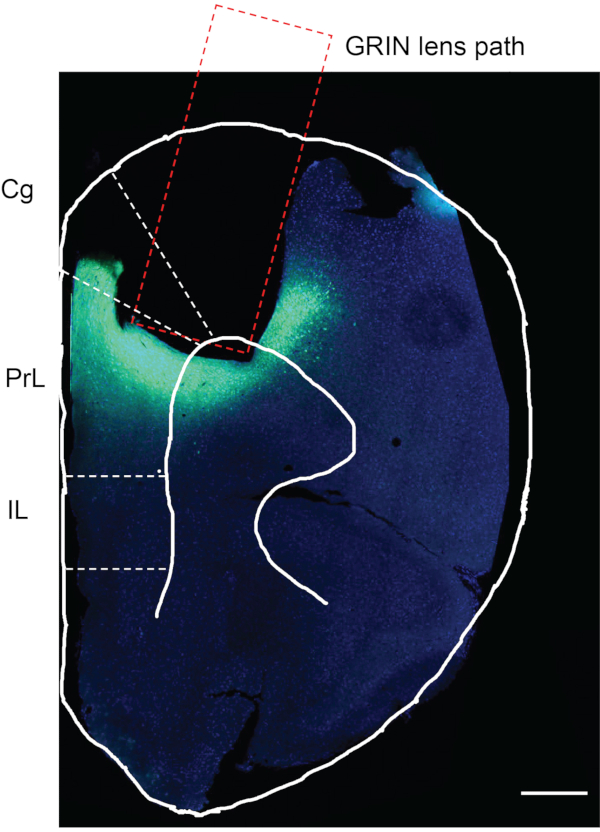
图7:实验小鼠的尸检评估。 GCaMP6f表达和GRIN晶状体植入实验小鼠mPFC的死后评估。矩形区域表示GRIN晶状体植入的路径。GRIN晶状体植入区域下方的绿色区域证实了GCaMP6f的表达,并且GRIN晶状体被精确地植入了所需的大脑区域。Cg,扣带皮层;PrL,前期皮层;IL,下皮层。比例尺:400 μm。 请点击此处查看此图的大图。
表1:NIDA的定制微型内窥镜系统与其他微型内窥镜系统的比较 7,8,9,10,11,13,25,26。 请按此下载此表格。
影片1:在 开场测试期间从小鼠mPFC进行体内钙成像记录。出于演示目的,此视频仅显示 1 分钟的录制。原始录制帧速率为 10 帧/秒。视频比原始录制快6倍。请点击这里下载这部电影。
讨论
神经科学的一个核心问题是了解神经动力学和电路如何编码和存储信息,以及它们在脑部疾病中是如何改变的。使用体内微型镜Ca2 +成像系统,可以同时监测来自局部微循环内数百个神经元的个体神经活动。在这里,描述了用于病毒注射和GRIN晶状体植入的详细手术方案,以通过定制开发的微型内窥镜记录系统为啮齿动物准备深部脑体内Ca2 +成像。表1显示了我们的微型内窥镜系统与其他市售和定制的微型内窥镜系统的比较7,8,9,10,11,13,25,26。值得注意的是,使用本手术方案的GRIN晶状体植入与任何商业或定制单光子和双光子成像系统兼容,用于深部脑体内钙成像。
从病毒注射到微型镜 体内 钙成像的数据采集,整个实验过程至少需要2个月才能完成。这是一个复杂且劳动密集型的过程。实验的最终成功取决于多种因素,包括正确选择GECI,在目标大脑区域准确注射病毒,在所需的神经群体中有足够的病毒表达,在所需位置精确植入GRIN晶状体,从手术中充分恢复,以及手术后是否发生严重炎症,以及动物的行为是否受到手术的严重影响, 等等。
两个关键步骤包括立体定向注射病毒和GRIN晶状体植入。出于演示目的,在小鼠mPFC中进行立体定位显微注射,在CaMKII启动子的控制下编码GCaMP6f的腺相关病毒(AAV1),该启动子选择性地标记mPFC中的锥体神经元。选择GCaMP6f,因为它是最快和最敏感的钙指示剂之一,半衰减时间为71 ms15。此外,GCaMP6f的AAV病毒表达是持久的(即,几个月),使其成为长期进行重复 的体内 Ca2 + 成像的理想选择,用于神经退行性疾病小鼠模型的纵向研究27。目前的手术方案可以适应于靶向任何其他大脑区域的不同细胞群。各种可用的病毒工具允许在所需年龄对所需大脑区域的特定神经群体进行选择性标记。此外,研究人员可以利用Cre-LoxP重组系统和各种可用的转基因小鼠模型进行遗传修饰并研究行为和神经回路结果28,29。
所提出的方案的一个独特特征是,在GRIN晶状体(直径1毫米)植入之前进行自动逐层脑组织抽吸。这是通过连接到真空系统的27 G针,由定制的机械臂和软件23控制的。根据我们的经验,该方法产生均匀的表面供GRIN晶状体接触,并且比手动组织抽吸对邻近组织造成的损害更小23。因此,该程序为直径相对较宽(例如1 mm)的GRIN镜片带来了明显的优势。然而,植入直径较小(0.5 mm 或 0.25 mm)的 GRIN 晶状体可能不需要组织抽吸术。相反,它可以直接沿着用30 G针21制成的前导轨道种植。
除了上面讨论的两个关键步骤外,还必须仔细考虑许多其他因素才能成功运营。(1)所有接触大脑的器械都应进行消毒,以防止感染。(2)所有手术步骤都需要进行,以尽量减少对大脑的损害,以防止进一步的炎症和过度的疤痕组织形成。(3)需要仔细考虑最初给予并在手术期间维持的麻醉剂量,特别是腹膜内给药的麻醉剂量。麻醉剂量可以根据不同的小鼠菌株进行修改,因为有些可能更容易受到伤害。(4)手术过程中需要不断监测小鼠的状况。最后,(5)手术后需要定期监测小鼠,因为手术后可能发生许多并发症。
虽然在GRIN晶状体植入步骤中单侧切除了大量的脑组织,但我们没有观察到任何明显的行为缺陷7,12。迷你内窥镜的重量约为2克,电缆是定制设计的,使其轻巧并确保鼠标可以轻松携带它。微型内窥镜和电缆仅在体内成像之前连接到动物上,并在成像后分离。整个成像过程通常不超过30分钟。因此,这些仪器不会阻止鼠标自由行为。微型镜安装和拆卸步骤需要用异氟醚进行短暂的麻醉(少于2分钟),以限制动物。我们通常让小鼠在进行体内成像之前从异氟醚的短暂暴露中恢复30分钟。我们每周进行一次体内钙成像,持续数周,没有注意到对小鼠健康和小鼠社会行为的任何影响12。
当前微型镜记录系统的一个主要限制是需要将显微镜连接到电缆上进行数据采集。电缆的存在有时会限制鼠标任务的性能,并限制一次记录一只动物。最近,无线微型内窥镜已经开发出25,26。这将扩大任务性能,并允许同时从组中的多个动物进行 体内 成像。此外,开发具有光谱可分离波长的更灵敏的GECI与双色微型显微镜相结合将为神经科学研究提供更多令人兴奋的可能性。
披露声明
作者报告没有竞争性经济利益。
致谢
这项工作得到了美国国立卫生研究院(NIH)5P20GM121310,R61NS115161和UG3NS115608的资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
参考文献
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987 (2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173 (2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174 (2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。