Method Article
Derin Beyin In Vivo Kalsiyum Görüntüleme için Stereotaksik Viral Enjeksiyon ve Degrade İndeks Lens İmplantasyonu
Bu Makalede
Erratum Notice
Özet
Miniskop in vivo kalsiyum görüntüleme, serbestçe davranan farelerde nöronal dinamikleri ve mikro devreleri incelemek için güçlü bir tekniktir. Bu protokol, bir miniskop kullanarak iyi in vivo kalsiyum görüntüleme elde etmek için beyin ameliyatları yapmayı açıklar.
Özet
Minyatür floresan mikroskop (miniskop), serbestçe davranan hayvanlardan in vivo kalsiyum görüntüleme için güçlü bir araçtır. Geleneksel çoklu foton kalsiyum görüntüleme sistemlerine göre çeşitli avantajlar sunar: (1) kompakt; (2) hafif; (3) uygun fiyatlı; ve (4) serbestçe davranan hayvanlardan kayıt yapılmasına izin verir. Bu protokol, özel olarak geliştirilmiş bir miniskop kayıt sistemi kullanarak derin beyin in vivo kalsiyum görüntüleme için beyin ameliyatlarını tanımlar. Hazırlık prosedürü, (1) genetik olarak kodlanmış kalsiyum sensörü ile belirli bir nöron alt grubunu etiketlemek için virüsü bir fare beyninin istenen beyin bölgesine stereotaksik olarak enjekte etmek; (2) kalsiyum görüntüsünü derin beyin bölgesinden miniskop sistemine aktarabilen gradyan indeksli (GRIN) lensin implantasyonu; ve (3) miniskop tutucusunu, miniskobun daha sonra takılabileceği fare kafatasının üzerine yapıştırmak. İn vivo kalsiyum görüntülemeyi gerçekleştirmek için, miniskop tutucuya bağlanır ve eşzamanlı davranış kayıtlarıyla birlikte nöronal kalsiyum görüntüleri toplanır. Mevcut cerrahi protokol, derin beyin in vivo kalsiyum görüntüleme için herhangi bir ticari veya özel yapım tek foton ve iki fotonlu görüntüleme sistemleriyle uyumludur.
Giriş
Hücre içi Ca2+ sinyalizasyonu, hücre büyümesi, proliferasyon, farklılaşma, migrasyon, gen transkripsiyonu, sekresyon ve apoptozun önemli bir düzenleyicisidir1. Nöronlarda, Ca 2+ sinyallemesi tam olarak kontrol edilir, çünkü uzay-zamansal paterni, membran uyarılabilirliği, nörotransmitter salınımı ve sinaptik plastisite2 gibi önemli işlevlerle ilgilidir.
İn vivo kalsiyum görüntüleme, normal hayvan davranışlarına temel nöral devre temsilini çözmek, beyin bozukluklarının hayvan modellerinde anormal nöronal aktiviteleri tanımlamak ve bu değiştirilmiş devreleri normalleştirebilecek potansiyel terapötik hedefleri çözmek için kullanılabilecek güçlü bir tekniktir. İki yaygın in vivo kalsiyum görüntüleme sistemi iki fotonlu lazer taramalı floresan mikroskopi 3,4,5,6 ve başa monte minyatür mikroskopi (miniskop)7,8,9,10,11,12,13 . Geleneksel iki foton mikroskobu, daha iyi çözünürlük, daha düşük gürültü ve daha düşük fotobeyazlatma gibi komuta avantajları sunar; ancak deney hayvanlarının kafalarının sabit olması ve yapılabilecek davranış çalışmalarınısınırlayan 3,4,5,6 olması gerekmektedir. Buna karşılık, başa monte miniskop sistemi küçük ve taşınabilirdir, bu da serbestçe davranan hayvanlarıkullanarak çok çeşitli davranış testlerini incelemeyi mümkün kılar 7,8,9,10,11,12,13.
İki önde gelen Ca2+ göstergesi, kimyasal göstergeler5,14 ve genetik olarak kodlanmış kalsiyum göstergeleri (GECI'ler) 15,16 vardır. Ca2+ görüntüleme, hedeflenen devredeki nöronların spesifik olarak etiketlenmesine izin veren viral vektörlerle birlikte verilen oldukça hassas GECI'ler kullanılarak kolaylaştırılmıştır. Hassasiyeti, uzun ömürlülüğü ve hücre altı bölmeleri bile etiketleme yeteneğini arttırmaya yönelik sürekli çaba, GECI'leri çeşitli in vivo kalsiyum görüntüleme çalışmaları için ideal kılmaktadır17,18,19.
Görüntüleme sırasında ışığın beyin dokusuna saçılması, iki fotonlu mikroskopi ile bile optik penetrasyonu derinlemesine sınırlar. Bununla birlikte, Gradient Index (GRIN) lens, GRIN lensi doğrudan biyolojik dokulara gömülebildiği ve derin beyin bölgesinden gelen görüntüleri mikroskop hedefine aktarabildiği için bu sorunun üstesinden gelir. Optik olarak homojen malzemeden yapılmış geleneksel lenslerin aksine ve odaklamak ve görüntü oluşturmak için karmaşık şekilli bir yüzey gerektiren GRIN lens performansı, lens malzemesi içinde düzlem yüzeyi20 ile odaklanmayı sağlayan kademeli bir kırılma indisi değişikliğine dayanır. GRIN lens çapı 0,2 mm'ye kadar üretilebilir. Bu nedenle, minyatür bir GRIN lens, çok fazla hasara neden olmadan derin beyne implante edilebilir.
Bu makalede, derin beyin in vivo kalsiyum görüntülemesi için tam bir cerrahi protokol sunulmuştur. Gösterim amacıyla, özellikle fare beyninin medial prefrontal korteksi (mPFC) ve in vivo kalsiyum görüntüleme kaydını hedefleyen beyin ameliyatlarını, Ulusal Uyuşturucu Bağımlılığı Enstitüsü'ndeki (NIDA / IRP) Dr. Lin'in grubu tarafından geliştirilen özel yapım bir miniskop sistemi aracılığıyla tanımladık7,12. Deneysel prosedür iki büyük beyin ameliyatını içerir. İlk ameliyat, mPFC'de GCaMP6f'yi (bir GECI) eksprese eden bir viral vektörün stereotaksik olarak enjekte edilmesidir. İkinci ameliyat, GRIN lensini aynı beyin bölgesine implante etmektir. Bu beyin ameliyatlarından kurtulduktan sonra, sonraki prosedür, diş çimentosu kullanarak fare kafatasına miniskop tutucusunu (taban) yapıştırmaktır. İn vivo Ca2+ görüntüleme, miniskobu tabanına monte ettikten sonra herhangi bir zamanda gerçekleştirilebilir. Viral enjeksiyon ve GRIN lens implantasyonu için cerrahi protokol, derin beyin in vivo kalsiyum görüntüleme için herhangi bir ticari veya özel yapım tek foton ve iki foton görüntüleme sistemleriyle uyumludur.
Protokol
Deneysel protokol, Wyoming Üniversitesi'nin hayvan bakım kılavuzlarını takip ediyor. Bu çalışmada kullanılan fare 6 aylık erkek C57BL/6J'dir. Prosedür, in vivo kalsiyum görüntüleme için herhangi bir derin beyin bölgesini hedeflemek için kullanılabilir. Burada, gösterim için, hedeflenen beyin bölgesi fare mPFC'sidir (ön ve arka (A / P): 1.94 mm, medial ve lateral (M / L): 0.5 mm, dorsal ve ventral (D / V): 1.8 mm). Bu protokol, daha önce yayımlanmış protokol21'e göre değiştirilir.
1. mPFC'ye stereotaksik virüs enjeksiyonu (Şekil 1)
- Ameliyata hazırlık
- Tüm cerrahi aletleri bir otoklav kullanarak sterilize edin ve steril bir yüzeye yerleştirin.
- 10 μL'lik bir şırıngayı tuzlu suyla astarlayarak ve 5 μL salin ile önceden doldurarak hazırlayın. Şırıngayı bir mikro pompaya takın (bkz.
- Isıtma yastığını açın ve sıcaklığı 35 ° C'de tutun.
- Fareyi %5 izofluran ve 1 L/dak oksijen akış hızı ile indüksiyon odasına (5" x 10" x 4", uzunluk x genişlik x yükseklik) yerleştirin. Farenin solunum hızını dikkatlice izleyin ve sayın. Solunum hızı 1 nefese düştüğünde fareyi çıkarın.
NOT: Farenin solunum hızı, her inhalasyon sırasında sırt kası hareketinin aşağı ve yukarı doğru izlenmesiyle kolayca izlenebilir. - Farenin ameliyat alanından ayrılmış bir tezgah üstü alana yerleşmesine izin verin. Bir tıraş makası ile, saçları fare kafasından ilk servikal omurlara kadar tıraş edin.
- Fareyi stereotaksik sahneye yerleştirin (bkz. Malzeme Tablosu) ve kulak çubukları ve burun klipsi ile konumunu sabitleyin. İzofluran akışını stereotaksik aşamaya% 1.5 izofluran ve 0.5 L / dak oksijen akış hızında tutun.
- Ameliyat sırasında gözlerin kurumasını önlemek için yağlayıcı oftalmik göz merhemini her iki göze de temiz bir pamuklu çubukla uygulayın. Ameliyata başlamadan önce farenin tamamen uyuşturulduğunu doğrulamak için fare üzerindeki pedal reflekslerini değerlendirin.
- Steril pamuklu çubuklar kullanarak tüysüz bölgeyi% 7.5 povidon-iyot çözeltisi ( Malzeme Tablosuna bakınız) ve% 70 etanol ile her biri üç kez dezenfekte edin.
- Tüysüz bölgenin derisinin altına küçük bir hacim (50 μL)% 2 lidokain enjekte edin.
- Kafatasının lambda ve bregmasını ortaya çıkarmak için bir neşter kullanarak orta hat boyunca deriden 2 cm'lik bir kesi yapın.
- Fasyayı kafatasından kuru pamuklu çubuklar ve sivri forseps yardımıyla çıkarın.
- Bregma ve lambda görünür olduktan sonra, bregma ve lambda'nın Z koordinatlarını ölçmek için bir dental matkap çapağının ucunu (0,5 mm çapında) kullanın (bkz. Bregma ve lambda aynı Z pozisyonunda kalana kadar burun tutucunun yüksekliğini ayarlayın.
- 0,5 mm'lik dental matkap çapağını bregmadan A/P: 1,94 mm, M/L: 0,5 mm konumuna getirin. Kafatasını delin.
NOT: Burada, gösterim için, hedeflenen beyin bölgesi fare mPFC'sidir. Bu protokol, diğer derin beyin bölgelerini hedeflemek için kullanılabilir. Örneğin, hedeflenen beyin bölgesi Nucleus Accumbens (NAc) ise, karşılık gelen pozisyon A / P: 0.9 mm, M / L: 1.2 mm olmalıdır. - Durayı 30 G'lık bir iğne ucu kullanarak çıkarın ve 45 ° açılı keskin forseps kullanarak tüm kemik kalıntılarını temizleyin.
NOT: Temizleme adımı sırasında küçük kan damarları yırtılabileceğinden kanama yaygındır. Kanamayı durdurmak için steril pamuklu çubuklar kullanın ve bölgeyi yıkamak için salin uygulayın. Nemli tutmak için açıkta kalan kafatası bölgesine salin uygulayın. - Mikropompanın kontrol panelini kullanarak virüsü mikrolitre şırıngaya yükleyin. 500 nL hava kabarcığını ve ardından 800 nL virüsü 50 nL / s akış hızında çekin.
NOT: Gösterim amacıyla, burada, GCaMP6f'yi (GECI) ifade eden adeno ilişkili bir virüs serotip 1 (AAV1), AAV1-CamKII-GCamp6f, mPFC'ye enjekte edilir (bkz. Virüsün titresi 2.8 x 1013 GC / mL'dir. Enjeksiyondan önce tuzlu su içinde seyreltilmiş 1: 2'dir. - İğnenin ucunu bregma'nın üstüne yerleştirin ve sadece bregma'ya dokunun ve bregma'nın Z-koordinatını not edin. İğneyi delinmiş deliğin üzerine taşıyın ve iğnenin tıkanmadığından emin olmak için 100 nL virüs enjekte edin.
- İğneyi yavaşça beyin dokusuna doğru D / V: 1.75 mm'nin hedeflenen Z-koordinatına doğru hareket ettirin ve ardından hafifçe D / V: 1.65 mm'nin Z-koordinatına doğru hareket ettirin.
NOT: Bu, viral çözeltinin demlenmesi için küçük bir cep oluşturmaktır. Hedeflenen beyin bölgesi NAc ise, D / V'nin karşılık gelen hedeflenen Z-koordinatı 4.2 mm olmalı ve daha sonra hafifçe 4.1 mm'ye kadar hareket etmelidir. - Mikro pompayı 50 nL/dak akış hızında 500 nL virüs enjekte edecek şekilde ayarlamak için kontrol panelini kullanın. Virüsü enjekte etmek için kontrol panelindeki RUN düğmesine basın.
NOT: Enjeksiyon yaklaşık 10 dakika sürecektir. Enjeksiyon bittikten sonra, iğneyi beyinden çıkarmadan önce 5-10 dakika daha bekleyin. Enjeksiyon döneminde maruz kalan kafatası bölgesini nemli tutmak için sıklıkla salin uygulayın. - İğneyi beyinden yukarı ve dışarı doğru hareket ettirin. 50 nL/s akış hızında iki kez 500 nL hacim enjekte edin.
NOT: Bu adım, virüsün uygun bir hacminin beyne uygulandığını doğrular. İlk 500 nL enjeksiyon sırasında, virüs serbest bırakılır, ardından hava kabarcıkları gelir. İkinci 500 nL enjeksiyon sırasında, önce hava kabarcıkları ortaya çıkar, ardından salin gelir. Şırınga artık bir sonraki fare için virüsü yüklemeye hazır. Ameliyat yapıldıktan sonra, mikrolitre şırınga ve iğne aseton ve ardından salin ile iyice temizlenir. - Cilt kenarlarını hizalayın ve insizyonu bir dikişle (boyut 4.0) dikkatlice kapatın. Enfeksiyonu önlemek için dikişli bölgeye antibiyotik merhem uygulayın.
- Fareyi stereotaksik aşamadan çıkarın ve ev kafesine geri getirin. Ev kafesini fare ayaktay olana kadar 33 °C'lik bir inkübatöre yerleştirin.
NOT: Bir farenin hareket etmeye başlamadan önce izofluran anestezisinden uyanması genellikle 10-15 dakika sürer. - Fare hareket etmeye başladıktan sonra, ameliyat sonrası 3 gün boyunca steroid olmayan antienflamatuar ilaçlar uygulayın (bakınız Malzeme Tablosu). GRIN lens implantasyonuna başlamadan önce farenin 14 gün boyunca ameliyattan kurtulmasına izin verin.
2. mPFC'de GRIN lens implantasyonu (Şekil 1)
- Ameliyata hazırlık
- 124 mM NaCl, 2.5 mM KCl, 1.25 mM NaH 2 PO 4, 1.2 mM MgCl 2,25mM glikoz,26 mM NaHCO3 ve2.4 mM CaCl2 içeren yapay beyin omurilik sıvısını (ACSF) hazırlayın.
- Tüm cerrahi aletleri bir otoklav kullanarak sterilize edin ve steril bir yüzeye yerleştirin.
- Isıtma yastığını açın ve sıcaklığı 35 ° C'de tutun.
- % 1 Agarose'u eritin ve kullanana kadar 42 ° C'de bir su banyosunda saklayın.
NOT: Eritilmiş agaroz su banyosunda birkaç saat bekletilebilir. - GRIN lensi (1 mm çapında, 4,38 mm uzunluğunda, Şekil 2A) %70 etanol içinde 15 dakika boyunca dezenfekte edin, implante etmeden önce düzgün bir şekilde durulamak için tuzlu suyla dolu bir tüpe aktarın.
NOT: GRIN camlar (bakınız Malzeme Tablosu) özel gözlüklerde gümüş ve lityum-iyon değişimi yoluyla üretilir, bu da onları toksik olmayan ve nöron dostu hale getirir 6,7. Bununla birlikte, ticari olarak temin edilebilen birçok GRIN lens, toksik kalıntıları süzerek nörodejenerasyona neden olabilir ve bu da onları uzun süreli in vivo görüntüleme çalışmaları için canlı beyinde implantasyon için uygun hale getirmez. Bu GRIN lensler, komşu nöronlar üzerindeki toksik yan etkileri önlemek için parilen-C gibi biyouyumlu ajanlarla kaplanmayı gerektirebilir22.
- Fareyi tartın ve intraperitoneal Ketamin/Ksilazin karışımı enjeksiyonu ile anestezi altına alın (bkz. Malzeme Tablosu) (Ketamin:100 mg/kg; Ksilazin: 15 mg / kg).
NOT: 30 g ağırlığındaki bir fare, başlangıç dozu için 300 μL Ketamin/Ksilazin karışımı (Ketamin 100 mg/mL ve Ksilazin 1.5 mg/mL) ve ameliyat sırasında ek dozlar için 150 μL Ketamin (10 mg/mL) gerektirir. Tüm cerrahi işlem boyunca farenin anestezi altında kalmasını sağlamak için, saatte en az bir kez ek Ketamin dozlarının (50 mg / kg) uygulanması gerekir. Farenin anestezi aşamasının pedal refleksleri değerlendirilerek sıklıkla izlenmesi gerekir. - Saçları cerrahi bölgeden tıraş makinesi ile tıraş edin ve ıslak bir kağıt havlu kullanarak saçları temizleyin.
- Fareyi stereotaksik aşamaya yerleştirin ve burun klipsi ve kulak çubuklarını sıkarak konumunu sabitleyin. Her iki göze de steril bir pamuklu çubukla yağlama oftalmik göz merhemi uygulayın. Pedal reflekslerini değerlendirerek farenin tamamen uyuşturulduğunu onaylayın.
- Steril pamuklu çubuklar kullanarak tüysüz bölgeyi% 7.5 povidon-iyot çözeltisi ve% 70 etanol ile her biri üç kez dezenfekte edin. Ameliyatla ilişkili şişlik ve iltihaplanma riskini azaltmak için uylukta kas içinden 2 mg / kg Deksametazon uygulayın.
- Ameliyat bölgesinin derisinin altına 50 μL% 2 Lidokain enjekte edin.
- 1,5 cm (yükseklik) x 1,0 cm (taban) üçgen cilt alanını, gözler arasındaki ön taraftan lambdanın arkasındaki arka tarafa kadar çıkarmak için ince bir makas kullanın.
- Periosteum dokusunu kafatasından ince forseps, mikro bıçak ve pamuklu çubuklarla çıkarın.
NOT: Bir sonraki adıma geçmeden önce kafatası iyice temizlenmeli ve kurutulmalıdır. - Siyanoakrilat (bakınız Malzeme Tablosu) cildin kenarlarına uygulayın ve cildi kafatasına takın. Siyanoakrilat kuruyana kadar 5 dakika bekleyin.
- 0,5 mm'lik matkap çapak ucu yardımıyla, burun klipsinin yüksekliğini ayarlayarak bregma ve lambda'yı aynı yatay düzlemde hizalayın.
- Bir dental matkap çapağını (1,2 mm çapında) bregmadan A/P: 1,94 mm, M/L: 0,8 mm konumuna getirin. Kafatasını delin. Durayı 30 G'lık bir iğne ucu kullanarak çıkarın ve 45 ° açılı keskin forseps kullanarak tüm kemik kalıntılarını temizleyin.
NOT: Bu kemik kalıntıları, tamamen çıkarılmazsa sonraki aspirasyon adımını engelleyebilir. - 27 G'lik manuel olarak cilalanmış künt uçlu bir iğneyi (Şekil 2B), 10°'lik bir açıyla eğilmiş bir robotik kola bağlı iğne tutucuya takın (Şekil 2C). İğne tutucunun diğer ucunu ev vakum sistemine bağlayın.
NOT: Robotik kol (bakınız Malzeme Tablosu) Dr. Lin'in NIDA/IRP'deki grubu tarafından geliştirilmiştir ve özel olarak geliştirilmiş, şu anda açık erişimli bir yazılım olan AutoStereota (https://github.com/liang-bo/AutoStereota)23 tarafından kontrol edilmektedir. - Sadece bregmaya dokunmak için iğnenin ucunu bulun. AutoStereota'daki Bregma düğmesine tıklayarak bregma'nın Z-koordinatını 0 olarak ayarlayın.
- Giriş X değerini 0,8, Giriş Y değerini 1,94, Giriş Z değerini 1,0 olarak ayarlayın, ardından iğneyi kafatasındaki delinmiş deliğin üstüne taşımak için Bul düğmesine tıklayın.
- İğnenin pozisyonunu AutoStereota ile maruz kalan beyin dokusu alanının merkezine ayarlayın.
NOT: İğneyi lateral veya medial yönlerde hareket ettirmek için Adım değerini girin ve AutoStereota'daki Lateral veya Medial düğmelerine tıklayın. Benzer şekilde, iğneyi anterior veya posterior ve dorsal veya ventral yönlerde hareket ettirmek için, sırasıyla Rostral veya Caudal ve Dorsal veya Ventral düğmelere tıklayın. - Vakumu açın ve açıkta kalan beyin bölgesini, bükülmüş uçlu 30 G'lik bir iğneye bağlı yerçekimi kontrollü bir boru sistemi (Malzeme Tablosuna bakınız) aracılığıyla ACSF ile durulamaya başlayın. ACSF, %95 O2 ve %5 CO 2'lik bir gaz karışımı ile sürekli kabarcıklanırve 0,2 μm'lik bir filtreden süzülür.
NOT: ACSF akış hızı ~ 1,5 mL/dak'dır. Gaz karışımının çıkış basıncı ~ 3 psi'de tutulur. - AutoStereota yazılımı yardımıyla beyin dokusunu katman katman aspire edin (Şekil 3).
NOT: Beyin dokusunun aspirasyonu 4 turda tamamlanır, böylece bir sütun cebi (1.8 mm derinlikte ve 1 mm çapında) üretilir.- "zStep" oturumunda, birinci ve ikinci satırları tıklayın ve kontrol edin. İlk satırın değerlerini 0,2 ve 1 olarak ayarlayın. İkinci satırın değerlerini 0,15 ve 4 olarak ayarlayın (Şekil 3A).
- "Mod" oturumunda, İğne boyutu 27 Ölçer ve 1.2, Dims 0.9 olarak ayarlayın. Diğer tüm değerler varsayılan değerleri kullanır (Şekil 3A).
- Aspirasyonu başlatmak için Set, Keep Zero ve Start düğmelerine sırayla tıklayın.
NOT: Bu, aspirasyonun 1. turudur. Giriş değerleri, 1 katmanlı ilk adımda aspirasyon derinliğinin 0,2 mm (0'ın Z-koordinatından) olduğunu gösterir; İkinci adım sırasında, aspirasyon derinliği 0,15 mm'dir ve 4 kat boyunca sürekli tekrarlanır. Aspirasyon çözünürlüğü 1.2 ve çapı 0.9 mm'dir. Aspirasyon sırasında, iğne ucunun anlık konumu, iz grafiği panelinden izlenebilir. Bu aspirasyon turunu tamamladıktan sonra, 0,8 mm derinliğinde ve 1 mm çapında bir kolon cebi oluşturulur. İğne ucu 0 Z-koordinatı ile merkeze geri dönecektir. - "zStep" oturumunda, birinci ve ikinci satırları tıklayın ve kontrol edin. İlk satırın değerlerini 1 ve 1 olarak ayarlayın. İkinci satırın değerlerini 0,15 ve 4 olarak ayarlayın (Şekil 3B).
- "Mod" oturumunda, tüm değerleri önceki turla aynı tutun (Şekil 3B).
- Aspirasyonu başlatmak için Set, Keep Zero ve Start düğmelerine sırayla tıklayın.
NOT: Bu, aspirasyonun 2. turudur. Giriş değerleri, 1 katmanlı ilk adımda aspirasyon derinliğinin 1 mm (0'ın Z-koordinatından) olduğunu gösterir; İkinci adım sırasında, aspirasyon derinliği 0,15 mm'dir ve 4 kat boyunca sürekli tekrarlanır. Bu aspirasyon turunu tamamladıktan sonra, 1.6 mm derinliğinde ve 1 mm çapında kolon cebi oluşturulur. - "zStep" oturumunda, yalnızca ilk satırı tıklayın ve kontrol edin. İlk satırın değerlerini 1,8 ve 1 olarak ayarlayın (Şekil 3C).
- "Mod" oturumunda, İğne boyutu 27 Ölçer ve 2.2'yi ayarlayın. Diğer tüm değerler önceki turunkiyle aynı kalır (Şekil 3C).
- Aspirasyonu başlatmak için Set, Keep Zero ve Start düğmelerine sırayla tıklayın.
NOT: Bu, aspirasyonun 3. turudur. Giriş değerleri, aspirasyon derinliğinin 1 katmanlı 1,8 mm (0'ın Z-koordinatından) olduğunu gösterir. Aspirasyon kararı 2.2'dir. Bu aspirasyon turunu tamamladıktan sonra 1,8 mm derinliğinde ve 1 mm çapında kolon cebi oluşturulur. - "zStep" oturumunda, yalnızca ilk satırı tıklayın ve kontrol edin. İlk satırın değerlerini 1,6 ve 1 olarak ayarlayın (Şekil 3B).
- "Mod" oturumunda, İğne boyutu 27 Ölçer ve 2.2'yi ayarlayın, Dims 0.6'yı ayarlayın (Şekil 3D).
- Aspirasyonu başlatmak için Set, Keep Zero ve Start düğmelerine sırayla tıklayın.
NOT: Bu, aspirasyonun 4. turudur. Bu adımın amacı cepte biriken kanı temizlemektir. Aspirasyon işlemi sırasında küçük kan damarları yırtıldığı için kanama yaygındır. Kanı iyice temizlemek için, ACSF'nin sulanmasını 5 dakika durdurun ve ardından sulamayı tekrar açın. Cep kansız olana kadar 4. aspirasyon turunu birkaç kez tekrarlayın. Bu protokol, diğer derin beyin bölgelerini hedeflemek için kullanılabilir. Örneğin, hedeflenen beyin bölgesi NAc ise, D / V'nin son karşılık gelen Z-koordinatı 4.4 mm olmalıdır.
- ACSF'nin vakum ve sulanmasını durdurun. İğneyi +2 mm Z-koordinatına ve merkeze 0,5 mm ön tarafa getirin. Steril 1mm GRIN lensi cebe yerleştirin.
- GRIN lensin 10° açıyla yerleştirilmesini sağlamak için iğnenin ucunu açıkta kalan GRIN lensle temas halinde tutun. GRIN lensin alt yüzeyinin beyin dokusuyla temas halinde olduğundan emin olmak için GRIN lensin üst yüzeyine steril yumuşak mendil kağıdı ile hafifçe bastırın.
- Erimiş Agarose'u GRIN lens ve beyin dokusu arasındaki boşluğa bir spatula yardımıyla uygulayın. Agarose bir jel oluşturduktan sonra, bir mikro bıçak kullanarak fazla Agarose'u çıkarın.
- Kafatasını tuzlu ve pamuklu çubuklarla iyice temizleyin. Sonraki diş çimentosu uygulamasından önce kafatasının kurumasına izin verin (bakınız Malzeme Tablosu).
- Karıştırma kuyusunu -20 °C dondurucudan çıkarın. Diş çimento tozu ve katalizör sıvısını karıştırın ve kafatasına kendi kendine sertleşen yapışkan reçine çimento tabakası uygulayın; İlk olarak, GRIN lensi çevreleyin ve ardından açıkta kalan tüm kafatasını örtün.
- 5 dakika bekleyin ve tamamen sertleşmesine izin verin. Aspirasyon iğnesini dikkatlice çıkarın.
- Temiz bir plastik kutuda, diş çimento tozu, siyah kömürü sıvı ile karıştırın ve karışımın ince bir tabakasını 1. diş çimentosu tabakasının üzerine uygulayın. Sertleşmesi için 5 dakika bekleyin.
- Açıkta kalan GRIN lensi PCR tüpünden yapılmış özelleştirilmiş bir kapakla kaplayarak koruyun (Şekil 2D). Kapağı diş çimentosuna takmak için siyanoakrilat uygulayın.
- Fareye deri altından 1 mL önceden ısıtılmış salin enjekte edin ve ardından 0.1 mg / kg Buprenorfin enjekte edin. Fareyi tekrar ev kafesine yerleştirin. Ev kafesini 33 ° C'lik bir inkübatöre yerleştirin ve fareyi ayaklanana kadar izleyin. Bir farenin hareket etmeye başlamadan önce anesteziden uyanması genellikle 20-40 dakika sürer.
- Nonsteroidal antienflamatuar ilaçlar uygulayın ve fareyi ameliyat sonrası en az 3 gün boyunca izleyin. Farenin 30 gün boyunca ameliyattan kurtulmasına izin verin.
3. Miniskop tutucusunun (taban) fare kafatasına yapıştırılması (Şekil 1)
- Fareyi% 5 izofluran ve 1 L / dak oksijen akış hızı ile bir indüksiyon odasında, solunum hızı 1 nefes / s'ye düşene kadar anestezi altına alın.
- Fareyi stereotaksik aşamaya yerleştirin ve kulak çubukları ve burun klipsleri ile konumunu sabitleyin. Sürekli bir izofluran (% 1.5) ve oksijen (0.5 L / dak) akışını koruyun.
- Nemli tutmak için gözlerine oftalmik merhem uygulayın. Isıtma yastığını açın ve sıcaklığı 35 ° C'de tutun. Pedal reflekslerini değerlendirerek farenin tamamen uyuşturulduğunu onaylayın.
- GRIN lensi kaplayan kapağı sivri forseps kullanarak nazikçe çıkarın. Kurutulmuş siyanoakrilat kalıntılarını diş çimentosundan tamamen bir mikromatkap kullanarak delin (bkz.
- Diş çimento alanının etrafındaki saçları küçük makasla kesin. Sıkıştırılmış hava duster yardımıyla kalıntıları temizleyin. GRIN lensin üst yüzeyini temizlemek için asetonla daldırılmış pamuklu çubuk kullanın.
- Miniskobu tutucusuyla (taban) hazırlayın.
- Tabanda bulunan yuvaya #00-90 altıgen somun yerleştirin (bkz. Malzeme Tablosu) ve oraya sabitlemek için siyanoakrilat uygulayın (Şekil 2E).
- Miniskopun dişinin etrafına sıkıca bir politetrafloroetilen (PTFE) bant uygulayın ve ekstra bandı kesin (Şekil 2F).
- Miniskobu tabana sabitleyin ve miniskobu tabana sabitlemek için kilitleme vidasını kullanın (Şekil 2G).
- Miniskobu kablosuna bağlayın ve özel olarak geliştirilmiş, şu anda açık erişimli yazılım NeuView'u açın (bkz.
NOT: NeuView yazılımı, NIDA/IRP 7,12'de Dr. Lin'in grubundan miniskop in vivo kalsiyum görüntüleme için özel olarak geliştirilmiştir. Açık erişimdir (https://github.com/giovannibarbera/miniscope_v1.0). - NeuView'da Donanım'a tıklayın, LED1'i kontrol edin ve canlı görüntüleri görüntülemek için Akış düğmesine tıklayın (Şekil 4A). Canlı yayını durdurmak için, Durdur düğmesine tıklayın.
- Miniskopu, XYZ konumu motorlu kontrolörler kullanılarak manipüle edilebilen özel yapım bir miniskop tutma koluna (Şekil 2H) yerleştirin (Şekil 2I).
- Miniskobu açıkta kalan GRIN lensin hemen üstüne yerleştirin ve lensin yüzeyine paralel hale getirin. Miniskobu GRIN lense doğru yavaşça indirin ve en iyi netleme düzlemi bulunana kadar Z konumunu ayarlayın.
NOT: En iyi odak düzlemi, birkaç olası Z konumunun karşılaştırılması ve çoğu hücre gövdesinin net bir şekilde görselleştirilmesiyle odak düzleminin seçilmesiyle belirlenir. - Miniskobun konumunu değiştirmeden miniskop tabanının etrafına ilk diş çimentosu tabakasını dikkatlice uygulayın. Çimento sertleştikten sonra, tutma kolunu yavaşça çıkarın, böylece miniskop fare kafasında kendi başına durabilir.
NOT: Diş çimentosu sertleştikten sonra küçülme eğilimindedir ve miniskobu orijinal odak düzleminden uzağa sürükler. Tipik olarak, miniskop Z pozisyonu, potansiyel değişikliği telafi etmek için diş çimentosu uygulanmadan önce orijinal odak düzleminin biraz üzerine kaldırılır. - Tüm boşlukları doldurmak ve boşluklardan LED ışık sızıntısı olmadığından emin olmak için tabanın etrafına ikinci bir diş çimentosu tabakası uygulayın. Diş çimentosunun sertleşmesine izin verin.
- Fareyi stereotaksik aşamadan çıkarın. Kilitleme vidasını gevşetin ve miniskobu tabandan ayırın. Açıkta kalan GRIN lensi korumak için tabana 3D baskılı bir koruyucu kapak yerleştirin ve tabandaki kilitleme vidasını sıkın (Şekil 2J).
- Fareyi tekrar ev kafesine yerleştirin.
NOT: Bir farenin hareket etmeye başlamadan önce izofluran anestezisinden uyanması genellikle 10-15 dakika sürer.
4. Miniskop montajı ve in vivo Ca2+ görüntüleme (Şekil 1)
- Miniskobu tabanına monte edin
- Fareyi indüksiyon odasında kısaca anestezi altına alın (%5 izofluran ve 1 L/dak oksijen akış hızı). Fareyi temiz bir tezgah yüzeyine yerleştirin.
- Kilitleme vidasını küçük bir tornavidayla gevşetin, koruyucu kapağı çıkarın ve GRIN lensin yüzeyini asetonla ıslatılmış pamuklu çubukla temizleyin.
- Bir PTFE bandını miniskop dişinin etrafına sıkıca sarın ve miniskobu fare kafasındaki tabanına sabitleyin.
- Miniskobu kabloya bağlayın (Şekil 2K), NeuView Yazılımını açın.
- NeuView'da Donanım'a tıklayın, LED1'i kontrol edin ve canlı görüntüleri görüntülemek için Akış düğmesine tıklayın (Şekil 4A).
- Miniskopun tabana göre konumunu ayarlayarak, künt forseps yardımıyla hafifçe sıkarak veya gevşeterek en iyi odak düzlemini tanımlayın.
NOT: En iyi odak düzlemi, birkaç olası konumu karşılaştırarak ve çoğu hücre gövdesinin net bir şekilde görselleştirilmesine sahip olanı seçerek belirlenir. - Kilitleme vidasını sıkın ve fareyi tekrar ev kafesine yerleştirin.
- NeuView'da LED ışık gücünü optimum seviyeye ayarlayın. Kayda başlamak için Yakala ve ardından Tetik düğmelerine tıklayın ve 150 kare sonra Durdur'a basın.
NOT: Mümkün olan en düşük güç, yeterince parlak bir görüntü elde etmek için LED gücünün optimum seviyesini belirler. Kısa bir video kaydetmenin amacı, gelecekte tekrarlayan görüntüleme için aynı odak düzlemini tanımlamayı kolaylaştırmaktır. - Kabloyu miniskoptan çıkarın. Denemeye başlamadan önce farenin en az 30 dakika boyunca iyileşmesine izin verin.
NOT: Miniskobu korumak için, tipik olarak, su şişesi ve tel gıda besleyici bu kısa süre zarfında çıkarılır. Farenin ev kafesinde daha uzun süre kalması gerekiyorsa, ev kafesinde ticari olarak temin edilebilen diyet jeli (bkz.
- İn vivo kalsiyum görüntüleme için veri toplama
NOT: İn vivo kalsiyum görüntüleme, araştırmacının istediği herhangi bir davranış testi ile aynı anda gerçekleştirilebilir. Gösterim amacıyla, buradaki örnek açık alan testi sırasında in vivo Ca2+ görüntülemedir. Bu hedefe ulaşmak için iki bilgisayar gereklidir. Bir bilgisayar, fare davranışını otomatik olarak kaydetmek üzere bir kamerayı kontrol etmek için ticari yazılımlarla donatılmıştır (bkz. Diğer bilgisayar, miniskobu kontrol etmek ve Ca2+ görüntülerini kaydetmek için NeuView ile donatılmıştır.- Fare davranış alanını bir Canlı Yayın işlevi aracılığıyla görüntülemek için davranış kamerası yazılımını açın (bkz. Üst kameranın odağını manuel olarak ayarlayın (Şekil 2L).
- Tetikleyici/Flaş'ı seçin ve "Tetikleyiciyi etkinleştir/devre dışı bırak" seçeneğini işaretleyin (Şekil 4B). Kaydet düğmesine tıklayın, davranış kayıtlarının kaydedileceği konumu seçmek için Gözat'ı kullanın, istediğiniz görüntü formatını seçin.
NOT: "Tetik Kontrolü" işlevi, davranış çerçevesinin ve ilgili kalsiyum görüntüleme çerçevelerinin geçici olarak birbirine bağlanması için davranış kaydının NeuView yazılımı tarafından tetiklenmesine izin vermek üzere etkinleştirilmiştir. Davranış kaydı istenen herhangi bir formatta kaydedilebilir. Davranış kaydı genellikle belirlenen klasöre JPEG biçiminde kaydedilir. - Fareyi arenaya yaklaştırın ve miniskobu Veri Toplama Sistemine bağlı kabloya bağlayın (Şekil 2L) (bkz. Fare daha sonra arenanın ortasına yerleştirilir.
- NeuView yazılımının Livestream işleviyle, kalsiyum görüntüsünün parlaklığını optimize etmek için LED gücünü ayarlayın.
NOT: Kalsiyum görüntüleme için, kayıt kare hızı varsayılan olarak 10 kare/sn'dir. - NeuView'da LED1'in işaretini kaldırın, kayda başlamak için Yakala ve ardından Tetik düğmelerine tıklayın ve 100 kare sonra Durdur'a basın.
NOT: Bu, LED ışığı kapalıyken yaklaşık 100 kare boyunca arka plan görüntüleri kaydetmek içindir. - Behavior camera yazılımında, Kaydı Başlat'ı tıklatın (Şekil 4C). NeuView'da LED1'i kontrol edin, kayda başlamak için Yakala'ya ve ardından Tetikleyici düğmelere tıklayın. 3000 kare sonra Durdur'a basın.
NOT: Bu, kalsiyum görüntülemeyi ve davranışını aynı anda kaydetmek içindir. Açık alan testi 15 dakika uzunluğundadır ve tipik olarak her biri 5 dakikalık üç kayıt oturumuna bölünmüştür. Bu, miniskopun sürekli kullanım nedeniyle aşırı ısınmasını önlemek içindir. - Hem kalsiyum görüntüleme hem de davranış kayıtlarını belirlenen klasörlere kaydedin. Her oturumdan önce arka planı kaydederken kaydı iki oturum daha tekrarlayın ve tüm kayıtları belirtilen klasöre kaydedin.
- Miniskobu tabanından ayırın.
- Kayıt tamamlandıktan sonra, kabloyu miniskoptan çıkarın.
- Fareyi indüksiyon odasında kısaca anestezi altına alın (%5 izofluran ve 1L/dk oksijen akış hızı). Fareyi temiz ve sıcak bir yüzeye yerleştirin.
- Tabandaki kilitleme vidasını sökün ve miniskobu tabandan ayırın. Koruyucu kapağı tabanın üzerine geri takın ve kilitleme vidasını sıkın. Fareyi tekrar ev kafesine koyun.
Sonuçlar
Şekil 1, viral enjeksiyon, GRIN lens implantasyonu, miniskop tabanının fare kafatasına yapıştırılması ve bir miniskop aracılığıyla in vivo kalsiyum görüntüleme dahil olmak üzere şematik deneysel prosedürü göstermektedir. Tüm prosedür ~ 2 ay sürer. Şekil 2, miniskop in vivo kalsiyum görüntüleme protokolünde açıklanan ana bileşenleri göstermektedir. Şekil 3, GRIN lens implantasyonu sırasında AutoStereota yazılımının arayüzlerini göstermektedir. Şekil 4, in vivo kalsiyum görüntüleme sırasında NeuView ve davranış kayıt yazılımının arayüzlerini göstermektedir.
İn vivo kalsiyum görüntülemenin sonucu hem viral enjeksiyon hem de GRIN lens implantasyon ameliyatlarının başarısına bağlıdır. Şekil 5 , in vivo kalsiyum görüntüleme kayıtlarından bir dizi sonucu (yani başarısız, optimal olmayan ve iyi) göstermektedir. Başarısız vakalarda, kalsiyum görüntüsü karanlık veya parlak görünebilir, ancak genellikle hiç veya çok az aktif nöron ortaya çıkarır. Beşten az aktif nöron varsa, tipik olarak in vivo kalsiyum kayıt deneylerini takip etmiyoruz. İyi bir in vivo kalsiyum görüntüleme tipik olarak yüzlerce aktif nöronu ortaya çıkarır. Bir kayıt yüzden az aktif nöron içeriyorsa, bunu yetersiz bir kayıt olarak kabul ederiz.
Hem suboptimal hem de iyi kayıtlarda in vivo kalsiyum görüntüleme deneyleri takip edildi ve ardından veri analizi yapıldı. Film 1 , fare mPFC'sinden temsili bir in vivo kalsiyum görüntüleme kaydını gösterir. Davranış videoları ve kalsiyum görüntüleme verileri genellikle ayrı ayrı işlenir. Fare davranışı videoları manuel olarak puanlanabilir. Kalsiyum görüntüleme dosyaları, CaImAn kalsiyum görüntü işleme araç kutusu24 kullanılarak işlenir. Şekil 6 , temsili bir hücre haritasını ve iyi bir in vivo kalsiyum görüntüleme kaydından elde edilen birkaç kalsiyum izini göstermektedir.
İn vivo kalsiyum görüntülemeyi tamamladıktan sonra, son adım, viral enjeksiyon ve GRIN lens implantasyonunun istenen beyin bölgesinde gerçekleşip gerçekleşmediğini doğrulamaktır. Bu amaçla, fare fosfat tamponlu salin (PBS) ve ardından% 4 paraformaldehit (PFA) ile perfüze edildi. Fare beyni hasat edildi, 12 saat boyunca% 4 PFA'ya sabitlendi ve 4 ° C'de PBS'de saklandı. Fare beyni daha sonra bir vibratom ile 50 μm kalınlığında dilimler halinde bölümlendi. Beyin dilimleri DAPI ile boyandı ve mikroskop altında gözlemlendi (protokolde tanımlanmadı)12. Şekil 7, GRIN lensinin implante edildiği izi gösteren, deneysel bir fareden bregma'ya ~ 1.94 mm ön tarafta bir fare beyin dilimidir. GRIN lens izinin altındaki ve etrafındaki yeşil floresan bölgesi, mPFC bölgesindeki GCaMP6f ekspresyonunu gösterir.
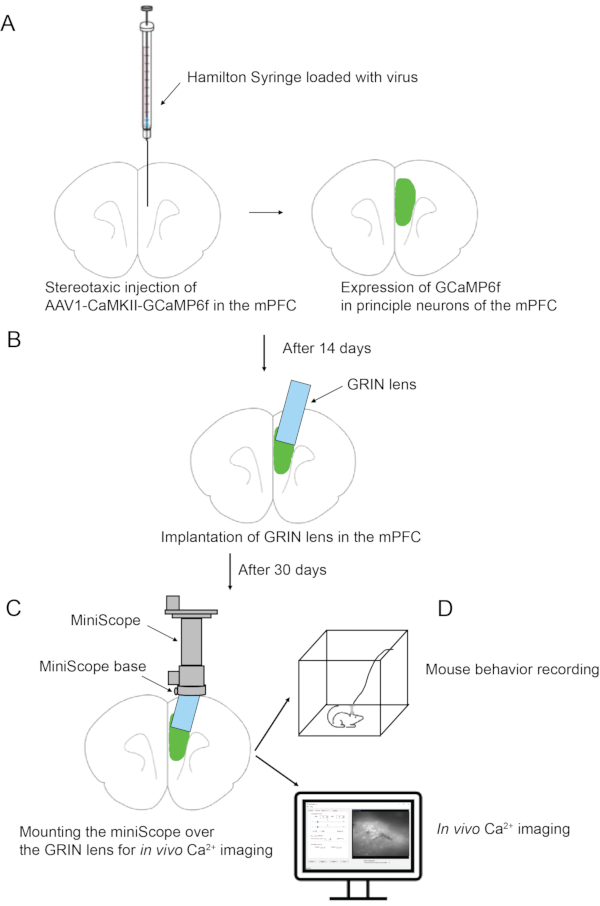
Şekil 1: Deneysel prosedüre şematik genel bakış . (A) mPFC'de virüsün stereotaksik enjeksiyonu. (B) mPFC'de GRIN lens implantasyonu. (C) Miniskop tabanının fare kafatasına yapıştırılması. (D) Miniskop montajı ve in vivo kalsiyum görüntüleme. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: İn vivo kalsiyum görüntüleme için gerekli ana bileşenler. (A) 1 mm çapında ve 4,38 mm uzunluğunda GRIN lens. (B) Beyin dokusu aspirasyonu için kullanılan 27 G manuel olarak cilalanmış künt uçlu iğne. (C) Robotik kol iğne tutucuya bağlandı. (D) Açıkta kalan GRIN lensi fare kafatasına miniskop tabanının yapıştırılmasına kadar korumak için bir PCR tüpünden özel yapım bir kapak. (E) Altıgen somunlu miniskop tutucu (taban). (F) İplik kısmı PTFE bant ile sarılmış bir miniskop. (G) Tabanına bir kilitleme vidası ile tutturulmuş bir miniskop. (H) Miniskop tutma kolu. (I) Miniskobun XYZ konumlarında hareketini kolaylaştırmak için kullanılan özel yapım bir 3D motorlu kontrolör. (J) Fare in vivo kalsiyum görüntüleme yapmazken açıkta kalan GRIN lensi korumak için tabana tutturulmuş koruyucu bir kapak. (K) Kabloya bağlı miniskop. (L) İn vivo Ca2+ görüntüleme için Veri Toplama Sistemi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
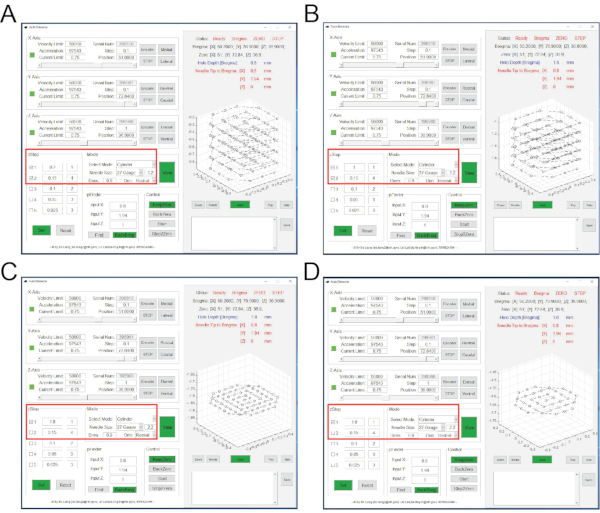
Şekil 3: Katman katman beyin dokusu aspirasyonu sırasında AutoStereota yazılımının arayüzleri. (A) Adım 2.17.1 ila 2.17.3'e karşılık gelen arayüz. (B) Adım 2.17.4 ila 2.17.6'ya karşılık gelen arayüz. (C) 2.17.7 ila 2.17.9 arasındaki adımlara karşılık gelen arayüz. (D) 2.17.10 ila 2.17.12 arasındaki adımlara karşılık gelen arayüz. Kırmızı kutular giriş değerlerini vurgular. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
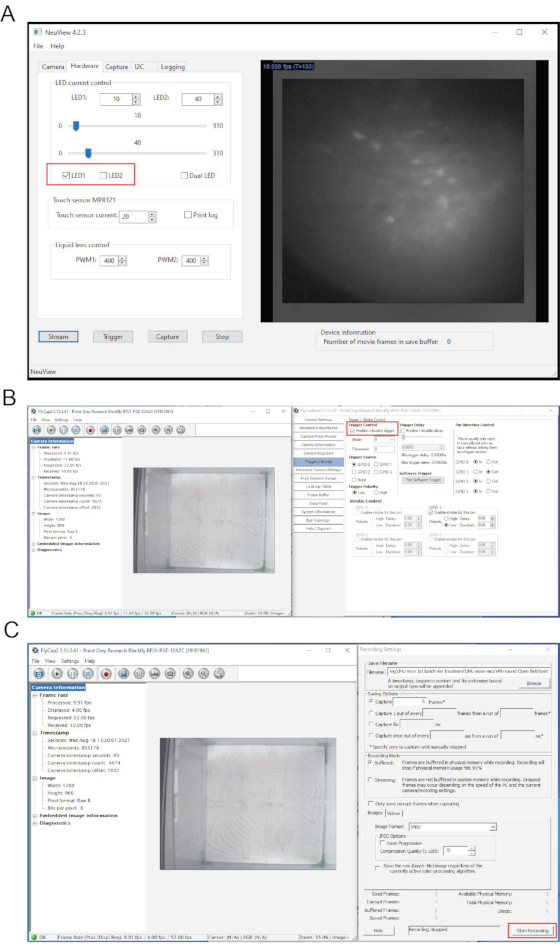
Şekil 4: NeuView yazılımının arayüzleri ve in vivo kalsiyum görüntüleme sırasında davranış kayıt yazılımı. (A) NeuView arayüzü. (B,C) Davranış kayıt yazılımının arayüzleri. Kırmızı kutular, tıklatılması gereken düğmeleri vurgular. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
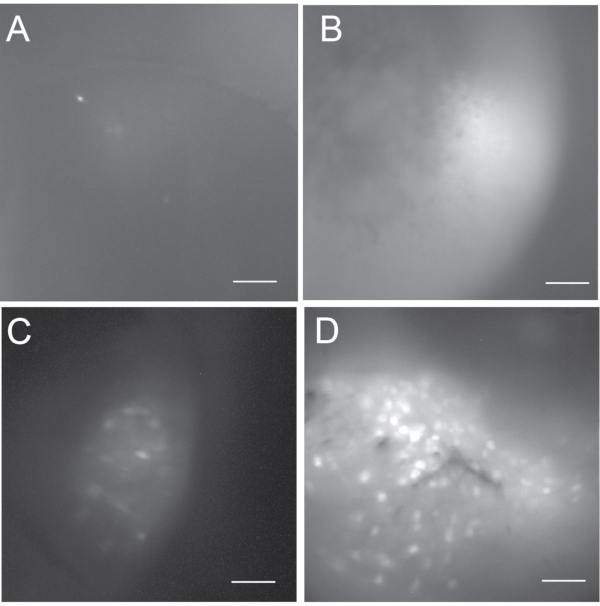
Şekil 5: Olası sonuçların aralığını göstermek için maksimum projeksiyon floresan hücre haritaları . (A,B) Sonraki veri analizi için kabul edilemez başarısız in vivo kalsiyum görüntüleme. (A) karanlıktır ve 5'ten az aktif nöron içerir. (B) parlaktır ancak aktif nöronları yoktur. (C) Bazı aktif nöronları içeren suboptimal bir in vivo kalsiyum görüntülemeden elde edilen hücre haritası. (D) Birkaç yüz aktif nöron içeren iyi bir in vivo kalsiyum görüntülemeden elde edilen hücre haritası. Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
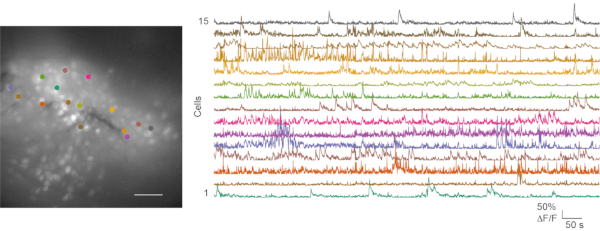
Şekil 6: Başarılı bir in vivo kalsiyum görüntülemeden elde edilen temsili hücre haritası ve kalsiyum geçicileri. Sol panel, açık alan testi sırasında mPFC'deki in vivo kalsiyum görüntüleme kaydından maksimum projeksiyon floresan hücre haritasıdır. Kayıt 5 dakika sürer. Sağ panel, ilgi çekici 15 bölgeden (renk eşli) kalsiyum geçicilerini gösterir. Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
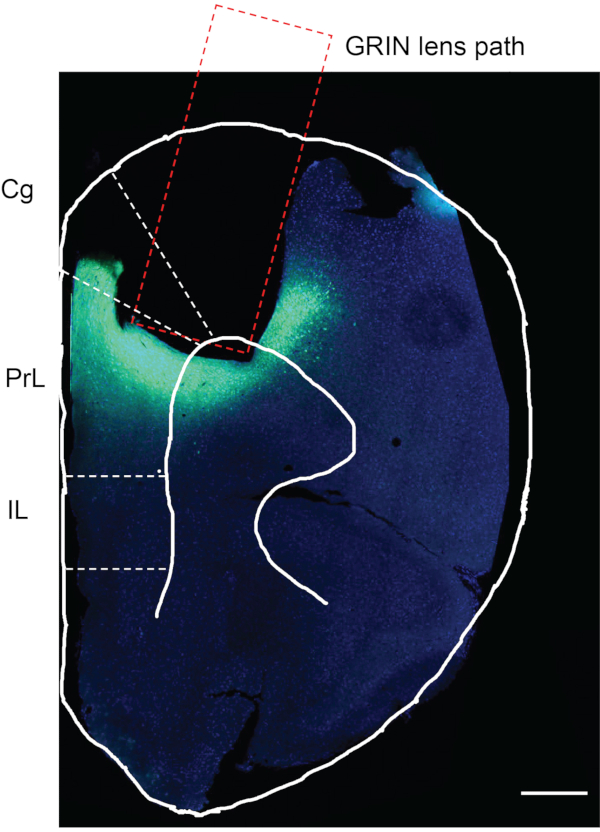
Şekil 7: Deneysel bir farenin ölüm sonrası değerlendirmesi. Deneysel bir farenin mPFC'sinde GCaMP6f ekspresyonu ve GRIN lens implantasyonu için postmortem değerlendirme. Dikdörtgen alan, GRIN lens implantasyonunun yolunu gösterir. GRIN lens implante edilen bölgenin altındaki yeşil alan, GCaMP6f'nin ifade edildiğini ve GRIN lensin tam olarak istenen beyin bölgesine implante edildiğini doğrulamaktadır. Cg, singulat korteks; PrL, prelimbik korteks; IL, infralimbik korteks. Ölçek çubuğu: 400 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: NIDA'daki özel yapım miniskop sisteminin diğer miniskop sistemleriyle karşılaştırılması 7,8,9,10,11,13,25,26. Bu tabloyu indirmek için lütfen tıklayınız.
Film 1: Açık alan testi sırasında fare mPFC'sinden in vivo kalsiyum görüntüleme kaydı. Tanıtım amacıyla, bu video sadece 1 dakikalık kayıt gösterir. Orijinal kayıt kare hızı 10 kare/sn'dir. Video, orijinal kayıttan 6 kat daha hızlıdır. Bu Filmi indirmek için lütfen tıklayınız.
Tartışmalar
Sinirbilimdeki merkezi bir soru, sinirsel dinamiklerin ve devrelerin bilgiyi nasıl kodladığını ve depoladığını ve beyin hastalıklarında nasıl değiştirildiğini anlamaktır. Bir miniskop in vivo Ca2+ görüntüleme sistemi kullanılarak, yerel bir mikro devre içindeki yüzlerce nörondan bireysel nöral aktivite, serbestçe davranan bir hayvandan aynı anda izlenebilir. Burada, kemirgenleri özel olarak geliştirilmiş bir miniskop kayıt sistemi aracılığıyla in vivo Ca2+ görüntülemeye derin bir beyin için hazırlamak için viral enjeksiyon ve GRIN lens implantasyonu için ayrıntılı bir cerrahi protokol açıklanmaktadır. Tablo 1, miniskop sistemimizin ticari olarak temin edilebilen ve özel olarak üretilen diğer miniskop sistemleri 7,8,9,10,11,13,25,26 ile karşılaştırmalarını göstermektedir. Mevcut cerrahi protokolü kullanan GRIN lens implantasyonunun, derin bir beyin in vivo kalsiyum görüntüleme için herhangi bir ticari veya özel yapım tek foton ve iki foton görüntüleme sistemleriyle uyumlu olduğunu belirtmek gerekir.
Viral enjeksiyondan miniskobun in vivo kalsiyum görüntülemesinin veri toplanmasına kadar, tüm deneysel prosedürün tamamlanması en az 2 ay sürer. Karmaşık ve emek yoğun bir süreçtir. Deneyin nihai başarısı, GECI'lerin doğru seçimi, hedeflenen beyin bölgesine doğru virüs enjeksiyonu, istenen nöral popülasyonda yeterli viral ekspresyon, GRIN lensin tam olarak istenen yere implantasyonu, ameliyatlardan yeterli iyileşme, ayrıca ameliyat sonrası şiddetli inflamasyonun meydana gelip gelmediği ve hayvanın davranışının ameliyatlardan ciddi şekilde etkilenip etkilenmediği gibi birçok faktöre bağlıdır. ve benzeri.
İki kritik adım stereotaksik virüs enjeksiyonu ve GRIN lens implantasyonunu içerir. Gösterim amacıyla, stereotaksik mikroenjeksiyon, fare mPFC'sinde, mPFC'deki piramidal nöronları seçici olarak etiketleyen CaMKII promotörünün kontrolü altında GCaMP6f'yi kodlayan adeno ilişkili virüs (AAV1) ile gerçekleştirildi. GCaMP6f, 71 ms15'lik yarı bozunma süresine sahip en hızlı ve en hassas kalsiyum göstergelerinden biri olduğu için seçildi. Ek olarak, GCaMP6f'ın AAV viral ekspresyonu uzun ömürlüdür (yani, birkaç ay), nörodejeneratif hastalıkların fare modellerinde uzunlamasına çalışmalar için uzun bir süre boyunca tekrarlayan in vivo Ca2 + görüntüleme yapmak için idealdir27. Mevcut cerrahi protokol, başka herhangi bir beyin bölgesindeki farklı hücre popülasyonlarını hedeflemek için uyarlanabilir. Çeşitli mevcut viral araçlar, istenen yaşta istenen beyin bölgesindeki spesifik nöral popülasyonların seçici olarak etiketlenmesine izin verir. Ek olarak, araştırmacılar genetik modifikasyonlar yapmak ve davranışsal ve nöral devre sonuçlarını incelemek için Cre-LoxP rekombinasyon sisteminden ve çeşitli transgenik fare modellerinden yararlanabilirler28,29.
Sunulan protokolün benzersiz bir özelliği, otomatik katman katman beyin dokusu aspirasyonunun GRIN lens (1 mm çapında) implantasyonundan önce gerçekleştirilmiş olmasıdır. Bu, özel yapım bir robotik kol ve yazılım 23 tarafından kontrol edilen bir vakum sistemine bağlı27 G'lik bir iğne ile elde edilir. Deneyimlerimize dayanarak, bu yöntem GRIN lensin temas etmesi için düzgün bir yüzey oluşturur ve komşu dokuya manuel doku aspirasyonundan daha az zarar verir23. Bu nedenle, bu prosedür nispeten daha geniş çaplı (örneğin, 1 mm) GRIN lensler için belirgin bir avantaj sağlar. Bununla birlikte, daha küçük çaplı (0,5 mm veya 0,25 mm) bir GRIN lensin implante edilmesi için doku aspirasyonu gerekli olmayabilir. Bunun yerine, 30 G iğne21 ile yapılan öncü iz boyunca doğrudan ekilebilir.
Yukarıda tartışılan iki kritik adımın yanı sıra, başarılı bir operasyon için diğer birçok faktör de dikkatlice düşünülmelidir. (1) Beyne temas eden tüm aletler enfeksiyonu önlemek için sterilize edilmelidir. (2) Daha fazla inflamasyonu ve aşırı skar dokusu oluşumunu önlemek için beyne verilen hasarı en aza indirmek için tüm cerrahi adımların uygulanması gerekir. (3) Başlangıçta verilen ve ameliyat sırasında sürdürülen anestezi dozları, özellikle intraperitoneal olarak uygulananlar dikkatle düşünülmelidir. Anestezi dozları, bazıları daha duyarlı olabileceğinden, farklı fare suşlarına göre değiştirilebilir. (4) Ameliyat sırasında farenin durumu sürekli izlenmelidir. Son olarak, (5) farelerin ameliyat sonrası düzenli olarak izlenmesi gerekir, çünkü ameliyattan sonra birçok komplikasyon ortaya çıkabilir.
GRIN lens implantasyon adımı sırasında beyin dokusunun bir kısmı tek taraflı olarak çıkarılmasına rağmen, belirgin bir davranış eksikliği gözlemlemedik 7,12. Miniskopun ağırlığı yaklaşık 2 gramdır ve kablo, hafif hale getirmek ve farenin kolayca taşıyabilmesini sağlamak için özel olarak tasarlanmıştır. Miniskop ve kablo sadece in vivo görüntülemeden önce hayvana bağlanır ve görüntülemeden sonra ayrılır. Tüm görüntüleme işlemi genellikle 30 dakikadan fazla sürmez. Bu nedenle, bu araçlar farenin serbestçe davranmasını engellemez. Miniskop kurulum ve demontaj adımları, hayvan kısıtlaması amacıyla izofluran ile kısa bir anesteziye (2 dakikadan az) ihtiyaç duyar. Genellikle farenin in vivo görüntüleme yapmadan önce 30 dakika boyunca izoflurana kısa süre maruz kalmaktan kurtulmasına izin veriyoruz. Fare sağlığı ve fare sosyal davranışı üzerinde herhangi bir etki fark etmeden birkaç hafta boyunca haftada bir kez miniskop in vivo kalsiyum görüntüleme yaptık12.
Mevcut miniskop kayıt sisteminin en büyük sınırlamalarından biri, mikroskobu veri toplama için bir kabloya bağlama ihtiyacıdır. Kablonun varlığı bazen fare görev performansını kısıtlar ve aynı anda bir hayvanın kaydını sınırlar. Son zamanlarda, kablosuz bir miniskop geliştirildi25,26. Bu, görev performansını genişletecek ve bir gruptaki birden fazla hayvandan eşzamanlı in vivo görüntülemeye izin verecektir. Dahası, çift renkli bir miniskop ile birleştirilmiş spektral olarak ayrılabilir dalga boylarına sahip daha hassas GECI'ler geliştirmek, sinirbilim araştırmaları için daha heyecan verici olanaklar sunacaktır.
Açıklamalar
Yazarlar rakip finansal çıkarlar olmadığını bildirmektedir.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüsü (NIH) 5P20GM121310, R61NS115161 ve UG3NS115608'den gelen hibelerle desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
Referanslar
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987 (2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173 (2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174 (2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır