Method Article
Stereotaktische virale Injektion und Gradientenindex-Linsenimplantation für Deep Brain In Vivo Calcium Imaging
In diesem Artikel
Erratum Notice
Zusammenfassung
Miniscope in vivo Calcium-Bildgebung ist eine leistungsstarke Technik zur Untersuchung neuronaler Dynamik und Mikroschaltkreise in sich frei verhaltenden Mäusen. Dieses Protokoll beschreibt die Durchführung von Gehirnoperationen, um eine gute In-vivo-Kalziumbildgebung mit einem Miniskop zu erreichen.
Zusammenfassung
Ein Miniatur-Fluoreszenzmikroskop (Miniskop) ist ein wirksames Werkzeug für die In-vivo-Kalziumbildgebung von sich frei verhaltenden Tieren. Es bietet mehrere Vorteile gegenüber herkömmlichen Multi-Photonen-Calcium-Bildgebungssystemen: (1) kompakt; (2) leichtgewichtig; (3) erschwinglich; und (4) ermöglicht die Aufzeichnung von sich frei verhaltenden Tieren. Dieses Protokoll beschreibt Gehirnoperationen für die Deep-Brain-in-vivo-Kalziumbildgebung unter Verwendung eines speziell entwickelten Miniscope-Aufzeichnungssystems. Das Präparationsverfahren besteht aus drei Schritten, einschließlich (1) der stereotaktischen Injektion des Virus in die gewünschte Hirnregion eines Mausgehirns, um eine bestimmte Untergruppe von Neuronen mit einem genetisch kodierten Calciumsensor zu kennzeichnen; (2) Implantation einer GRIN-Linse (Gradient-Index), die Kalziumbild von der tiefen Hirnregion an das Miniscope-System weiterleiten kann; und (3) den Miniscope-Halter über dem Mausschädel anbringen, an dem das Miniscope später befestigt werden kann. Um eine In-vivo-Kalziumbildgebung durchzuführen, wird das Miniscope am Halter befestigt und neuronale Kalziumbilder werden zusammen mit gleichzeitigen Verhaltensaufzeichnungen gesammelt. Das vorliegende Operationsprotokoll ist mit allen kommerziellen oder kundenspezifischen Einzelphotonen- und Zwei-Photonen-Bildgebungssystemen für die In-vivo-Kalziumbildgebung des tiefen Gehirns kompatibel.
Einleitung
Die intrazelluläre Ca2 + -Signalgebung ist ein wesentlicher Regulator für Zellwachstum, Proliferation, Differenzierung, Migration, Gentranskription, Sekretion und Apoptose1. In Neuronen wird die Ca2+ -Signalgebung präzise gesteuert, da ihr räumlich-zeitliches Muster mit entscheidenden Funktionen wie der Erregbarkeit der Membran, der Freisetzung von Neurotransmittern und der synaptischen Plastizität2 zusammenhängt.
In vivo Calcium-Bildgebung ist eine leistungsstarke Technik, die verwendet werden kann, um die Repräsentation neuronaler Schaltkreise elementar zu normalem Tierverhalten zu entschlüsseln, abweichende neuronale Aktivitäten in Tiermodellen von Hirnerkrankungen zu identifizieren und potenzielle therapeutische Ziele zu entschlüsseln, die diese veränderten Schaltkreise normalisieren können. Die beiden gängigen In-vivo-Calcium-Bildgebungssysteme sind Zwei-Photonen-Laser-Scanning-Fluoreszenzmikroskopie 3,4,5,6 und Head-Mounted-Miniatur-Mikroendoskopie (Miniskop) 7,8,9,10,11,12,13 . Die konventionelle Zwei-Photonen-Mikroskopie bietet entscheidende Vorteile wie bessere Auflösung, geringeres Rauschen und geringeres Photobleichen; Die Versuchstiere müssen jedoch kopffest fixiert werden, was die Verhaltensstudien, die durchgeführt werden können,auf 3,4,5,6 begrenzt. Im Gegensatz dazu ist das am Kopf montierte Miniscope-System klein und tragbar, so dass es möglich ist, eine Vielzahl von Verhaltenstests mit sich frei verhaltenden Tieren 7,8,9,10,11,12,13 zu untersuchen.
Es gibt zwei Ca2+-Frühindikatoren, chemische Indikatoren5,14 und genetisch kodierte Kalziumindikatoren (GECIs) 15,16. Die Ca2+-Bildgebung wurde durch die Verwendung hochempfindlicher GECIs erleichtert, die mit viralen Vektoren geliefert werden, die eine spezifische Markierung von Neuronen im Zielschaltkreis ermöglichen. Die kontinuierlichen Bemühungen, die Empfindlichkeit, Langlebigkeit und Fähigkeit, sogar die subzellulären Kompartimente zu kennzeichnen, zu verbessern, machen GECIs ideal für verschiedene In-vivo-Kalziumbildgebungsstudien 17,18,19.
Die Streuung von Licht im Hirngewebe während der Bildgebung begrenzt die optische Durchdringung in der Tiefe, selbst bei der Zwei-Photonen-Mikroskopie. Die Gradientenindex-Linse (GRIN) überwindet dieses Problem jedoch, da die GRIN-Linse direkt in das biologische Gewebe eingebettet werden kann und Bilder von der tiefen Hirnregion an das Mikroskopobjektiv weiterleitet. Im Gegensatz zu herkömmlichen Linsen aus optisch homogenem Material und einer kompliziert geformten Oberfläche, um zu fokussieren und Bilder zu erzeugen, basiert die GRIN-Linsenleistung auf einer allmählichen Brechungsindexänderung innerhalb des Linsenmaterials, die den Fokus mit einer ebenen Oberfläche20 erreicht. GRIN-Linsen können bis zu einem Durchmesser von 0,2 mm hergestellt werden. Daher kann eine miniaturisierte GRIN-Linse in das tiefe Gehirn implantiert werden, ohne zu viel Schaden anzurichten.
In diesem Artikel wird ein vollständiges Operationsprotokoll für die Deep-Brain-In-vivo-Kalziumbildgebung vorgestellt. Zu diesem Demonstrationszweck beschreiben wir Gehirnoperationen, die speziell auf den medialen präfrontalen Kortex (mPFC) des Mausgehirns abzielen, und die In-vivo-Kalziumbildgebung über ein speziell entwickeltes Miniscope-System, das von Dr. Lins Gruppe am National Institute on Drug Abuse (NIDA / IRP) entwickelt wurde) 7,12. Das experimentelle Verfahren umfasst zwei große Gehirnoperationen. Die erste Operation ist die stereotaktische Injektion eines viralen Vektors, der GCaMP6f (ein GECI) im mPFC exprimiert. Die zweite Operation besteht darin, die GRIN-Linse in die gleiche Gehirnregion zu implantieren. Nach der Genesung von diesen Gehirnoperationen besteht das anschließende Verfahren darin, den Miniscope-Halter (Basis) mit Zahnzement am Mausschädel anzubringen. Im lebenden Organismus Ca2+ Bildgebung kann jederzeit nach der Montage des Miniscopes auf seiner Basis durchgeführt werden. Das Operationsprotokoll für die virale Injektion und die Implantation der GRIN-Linse ist mit allen kommerziellen oder kundenspezifischen Einzelphotonen- und Zwei-Photonen-Bildgebungssystemen für die Calcium-Bildgebung des tiefen Gehirns kompatibel.
Protokoll
Das experimentelle Protokoll folgt den Tierpflegerichtlinien der University of Wyoming. Die in dieser Studie verwendete Maus ist 6 Monate alt männlich C57BL/6J. Das Verfahren kann verwendet werden, um beliebige Tiefenhirnregionen für die In-vivo-Kalziumbildgebung anzusprechen. Zur Demonstration ist der Zielhirnbereich der mPFC der Maus (anterior und posterior (A/P): 1,94 mm, medial und lateral (M/L): 0,5 mm, dorsal und ventral (D/V): 1,8 mm). Dieses Protokoll wird auf der Grundlage des zuvor veröffentlichten Protokolls21 modifiziert.
1. Stereotaktische Injektion des Virus in den mPFC (Abbildung 1)
- Vorbereitung auf die Operation
- Sterilisieren Sie alle chirurgischen Instrumente mit einem Autoklaven und legen Sie sie über eine sterile Oberfläche.
- Bereiten Sie eine 10-μL-Spritze vor, indem Sie sie mit Kochsalzlösung grundieren und mit 5 μL Kochsalzlösung vorfüllen. Befestigen Sie die Spritze an einer Mikropumpe (siehe Materialtabelle).
- Schalten Sie das Heizkissen ein und halten Sie die Temperatur bei 35 °C.
- Legen Sie die Maus in die Induktionskammer (5 "x 10" x 4", Länge x Breite x Höhe) mit 5% Isofluran und 1 L/min Sauerstoffdurchflussrate. Beobachten und zählen Sie sorgfältig die Atemfrequenz der Maus. Nehmen Sie die Maus heraus, sobald ihre Atemfrequenz auf 1 Atemzug/s sinkt.
HINWEIS: Die Atemfrequenz der Maus kann leicht überwacht werden, indem die Bewegung der Rückenmuskulatur nach unten und oben während jeder Inhalation beobachtet wird. - Lassen Sie die Maus sich auf einem vom Operationsbereich getrennten Tischbereich niederlassen. Rasieren Sie mit einem Rasierklipper die Haare vom Mauskopf bis zu den ersten Halswirbeln.
- Setzen Sie die Maus auf den stereotaktischen Tisch (siehe Materialtabelle) und sichern Sie ihre Position mit Ohrstangen und Nasenclip. Halten Sie den Isofluranfluss zur stereotaktischen Stufe bei 1,5% Isofluran und 0,5 l / min Sauerstoffdurchflussrate.
- Tragen Sie die schmierende Augensalbe mit einem sauberen Wattestäbchen auf beide Augen auf, um eine Trockenheit der Augen während der Operation zu verhindern. Beurteilen Sie die Pedalreflexe an der Maus, um zu bestätigen, dass die Maus vor Beginn der Operation vollständig betäubt ist.
- Desinfizieren Sie den haarlosen Bereich mit 7,5% Povidon-Jod-Lösung (siehe Materialtabelle) und 70% Ethanol jeweils dreimal mit sterilen Wattestäbchen.
- Injizieren Sie ein kleines Volumen (50 μL) von 2% Lidocain unter die Haut des haarlosen Bereichs.
- Machen Sie einen 2 cm langen Schnitt durch die Haut entlang der Mittellinie mit einem Skalpell, um das Lambda und Bregma des Schädels freizulegen.
- Entfernen Sie die Faszie vom Schädel mit Hilfe von trockenen Wattestäbchen und spitzen Pinzetten.
- Nachdem die Bregma und das Lambda sichtbar sind, verwenden Sie die Spitze eines Zahnbohrgrats (0,5 mm Durchmesser), um die Z-Koordinaten von Bregma und Lambda zu messen (siehe Materialtabelle). Passen Sie die Höhe des Nasenhalters an, bis Bregma und Lambda in der gleichen Z-Position liegen.
- Suchen Sie den 0,5 mm Bohrergrat an einer Position von A/P: 1,94 mm, M/L: 0,5 mm vom Bregma entfernt. Bohren Sie sich durch den Schädel.
HINWEIS: Zur Demonstration ist die Zielhirnregion die mPFC der Maus. Dieses Protokoll kann verwendet werden, um auf jede andere Tiefenhirnregion abzuzielen. Wenn der Zielhirnbereich beispielsweise der Nucleus Accumbens (NAc) ist, sollte die entsprechende Position A / P: 0,9 mm, M / L: 1, 2 mm sein. - Entfernen Sie die Dura mit einer 30 G Nadelspitze und reinigen Sie alle Knochenreste mit einer um 45° abgewinkelten scharfen Pinzette.
HINWEIS: Blutungen sind häufig, da kleine Blutgefäße während des Reinigungsschritts reißen können. Verwenden Sie sterile Wattestäbchen, um Blutungen zu stoppen, und tragen Sie Kochsalzlösung auf, um den Bereich zu waschen. Tragen Sie Kochsalzlösung auf den freiliegenden Schädelbereich auf, um ihn feucht zu halten. - Laden Sie das Virus über das Bedienfeld der Mikropumpe in die Mikroliterspritze. Entnehmen Sie 500 nL Luftblase, gefolgt von 800 nL des Virus bei einer Durchflussrate von 50 nL/s.
HINWEIS: Zu Demonstrationszwecken wird hier ein Adeno-assoziierter Virus-Serotyp 1 (AAV1), der GCaMP6f (ein GECI), AAV1-CamKII-GCamp6f, exprimiert, in den mPFC injiziert (siehe Materialtabelle). Der Titer des Virus beträgt 2,8 x10 13 GC/ml. Es wird vor der Injektion 1:2 in Kochsalzlösung verdünnt. - Legen Sie die Spitze der Nadel auf die Oberseite des Bregmas, um nur die Bregma zu berühren, und notieren Sie sich die Z-Koordinate der Bregma. Bewegen Sie die Nadel über das gebohrte Loch und injizieren Sie 100 nL des Virus, um sicherzustellen, dass die Nadel nicht verstopft ist.
- Bewegen Sie sich langsam die Nadel hinunter in das Hirngewebe zur angestrebten Z-Koordinate von D / V: 1,75 mm und dann leicht nach oben zur Z-Koordinate von D / V: 1,65 mm.
HINWEIS: Dies dient dazu, eine kleine Tasche für die zu infundierende virale Lösung zu schaffen. Wenn die Zielhirnregion die NAc ist, sollte die entsprechende gezielte Z-Koordinate von D / V 4,2 mm betragen und sich dann leicht auf 4,1 mm bewegen. - Verwenden Sie das Bedienfeld, um die Mikropumpe so einzustellen, dass 500 nL des Virus mit einer Durchflussrate von 50 nL / min injiziert werden. Klicken Sie auf die Schaltfläche AUSFÜHREN in der Systemsteuerung, um den Virus zu injizieren.
HINWEIS: Die Injektion dauert ca. 10 min. Nachdem die Injektion beendet ist, warten Sie weitere 5-10 Minuten, bevor Sie die Nadel aus dem Gehirn nehmen. Tragen Sie häufig Kochsalzlösung auf, um den exponierten Schädelbereich während der Injektionszeit feucht zu halten. - Bewegen Sie die Nadel nach oben und aus dem Gehirn. Injizieren Sie zweimal 500 nL Volumen bei einer Durchflussrate von 50 nL/s.
HINWEIS: Dieser Schritt bestätigt, dass ein angemessenes Volumen des Virus in das Gehirn verabreicht wurde. Während der ersten 500-nL-Injektionen wird das Virus freigesetzt, gefolgt von Luftblasen. Während der zweiten 500-nL-Injektion erscheinen zuerst Luftblasen, gefolgt von Kochsalzlösung. Die Spritze ist nun bereit, den Virus für die nächste Maus zu laden. Sobald die Operation abgeschlossen ist, werden die Mikroliterspritze und die Nadel gründlich mit Aceton gereinigt, gefolgt von Kochsalzlösung. - Richten Sie die Hautränder aus und schließen Sie den Schnitt vorsichtig mit einer Naht (Größe 4.0). Tragen Sie eine antibiotische Salbe auf die genähte Stelle auf, um eine Infektion zu verhindern.
- Entfernen Sie die Maus von der stereotaktischen Bühne und bringen Sie sie in ihren Heimatkäfig zurück. Legen Sie den Hauskäfig in einen 33 °C-Inkubator, bis die Maus gehfähig ist.
HINWEIS: Es dauert normalerweise 10-15 Minuten, bis eine Maus aus der Isofluran-Anästhesie aufwacht, bevor sie sich bewegt. - Nachdem sich die Maus bewegt hat, verabreichen Sie nichtsteroidale entzündungshemmende Medikamente für 3 postoperative Tage (siehe Materialtabelle). Lassen Sie die Maus sich 14 Tage lang von der Operation erholen, bevor Sie eine GRIN-Linsenimplantation durchführen.
2. Implantation der GRIN-Linse in den mPFC (Abbildung 1)
- Vorbereitung auf die Operation
- Es wird die künstliche Zerebrospinalflüssigkeit (ACSF) hergestellt, die 124 mM NaCl, 2,5 mM KCl, 1,25 mM NaH 2 PO 4, 1,2 mM MgCl 2, 25 mM Glucose, 26 mMNaHCO 3 und2,4 mM CaCl2 enthält.
- Sterilisieren Sie alle chirurgischen Instrumente mit einem Autoklaven und legen Sie sie über eine sterile Oberfläche.
- Schalten Sie das Heizkissen ein und halten Sie die Temperatur bei 35 °C.
- 1% Agarose schmelzen und bis zur Verwendung in einem Wasserbad bei 42 °C aufbewahren.
HINWEIS: Die geschmolzene Agarose kann einige Stunden im Wasserbad aufbewahrt werden. - Desinfizieren Sie eine GRIN-Linse (1 mm Durchmesser, 4,38 mm Länge, Abbildung 2A) in 70% Ethanol für 15 min, geben Sie sie in ein mit Kochsalzlösung gefülltes Röhrchen, um es vor dem Implantieren richtig zu spülen.
HINWEIS: GRIN-Linsen (siehe Materialtabelle) werden über Silber- und Lithium-Ionen-Austausch in Spezialgläsern hergestellt, wodurch sie ungiftig und neuronenfreundlichsind 6,7. Viele kommerziell erhältliche GRIN-Linsen können jedoch toxische Reste auslaugen und Neurodegeneration verursachen, was sie für die Implantation in das lebende Gehirn für langfristige In-vivo-Bildgebungsstudien ungeeignet macht. Diese GRIN-Linsen können eine Beschichtung mit biokompatiblen Wirkstoffen wie Parylene-C erfordern, um toxische Nebenwirkungen auf benachbarte Neuronenzu verhindern 22.
- Wiegen Sie die Maus und betäuben Sie sie durch eine intraperitoneale Injektion von Ketamin/Xylazin-Gemisch (siehe Materialtabelle) (Ketamin:100 mg/kg; Xylat: 15 mg/kg).
HINWEIS: Eine Maus mit einem Gewicht von 30 g benötigt 300 μL Ketamin/Xylazin-Gemisch (Ketamin 100 mg/ml und Xylazin 1,5 mg/ml) für die Anfangsdosis und 150 μL Ketamin (10 mg/ml) für zusätzliche Dosen während der Operation. Um die Maus während des gesamten chirurgischen Prozesses unter Narkose zu halten, müssen mindestens einmal pro Stunde zusätzliche Dosen von Ketamin (50 mg / kg) verabreicht werden. Das Anästhesiestadium der Maus muss häufig durch die Beurteilung der Pedalreflexe überwacht werden. - Rasieren Sie das Haar mit einem Rasierer vom Operationsbereich und reinigen Sie das Haar mit einem nassen Papiertuch.
- Platzieren Sie die Maus in der stereotaktischen Stufe und sichern Sie ihre Position, indem Sie den Nasenclip und die Ohrbügel festziehen. Tragen Sie die schmierende Augensalbe mit einem sterilen Wattestäbchen auf beide Augen auf. Vergewissern Sie sich, dass die Maus vollständig betäubt ist, indem Sie die Pedalreflexe beurteilen.
- Desinfizieren Sie den haarlosen Bereich mit 7,5% Povidon-Jod-Lösung und 70% Ethanol jeweils dreimal mit sterilen Wattestäbchen. Verabreichen Sie 2 mg/kg Dexamethason intramuskulär in den Oberschenkel, um das Risiko von chirurgischen Schwellungen und Entzündungen zu senken.
- Injizieren Sie 50 μL 2% Lidocain unter die Haut des Operationsbereichs.
- Verwenden Sie eine feine Schere, um einen dreieckigen Hautbereich von 1,5 cm (Höhe) x 1,0 cm (Basis) von der Vorderseite zwischen den Augen bis zur hinteren Seite hinter dem Lambda zu entfernen.
- Entfernen Sie das Periostgewebe aus dem Schädel mit einer feinen Pinzette, einer Mikroklinge und Wattestäbchen.
HINWEIS: Der Schädel sollte gründlich gereinigt und getrocknet werden, bevor der nächste Schritt fortgesetzt wird. - Tragen Sie Cyanacrylat (siehe Materialtabelle) auf die Hautränder auf und befestigen Sie die Haut am Schädel. Warten Sie 5 Minuten, bis das Cyanacrylat trocknet.
- Mit Hilfe einer 0,5 mm Bohrgratspitze richten Sie Bregma und Lambda in derselben horizontalen Ebene aus, indem Sie die Höhe des Nasenclips einstellen.
- Suchen Sie einen Zahnbohrgrat (1,2 mm Durchmesser) an einer Position von A / P: 1,94 mm, M / L: 0,8 mm vom Bregma entfernt. Bohren Sie sich durch den Schädel. Entfernen Sie die Dura mit einer 30 G Nadelspitze und reinigen Sie alle Knochenreste mit einer um 45° abgewinkelten scharfen Pinzette.
HINWEIS: Dieser Knochenschutt kann den nachfolgenden Aspirationsschritt blockieren, wenn er nicht vollständig entfernt wird. - Befestigen Sie eine manuell polierte stumpfe Nadel mit 27 g (Abbildung 2B) an dem Nadelhalter, der mit einem um 10° geneigten Roboterarm gekoppelt ist (Abbildung 2C). Schließen Sie das andere Ende des Nadelhalters an das Hausvakuumsystem an.
HINWEIS: Der Roboterarm (siehe Table of Materials) wird von der Gruppe von Dr. Lin am NIDA/IRP entwickelt und von einer speziell entwickelten, derzeit frei zugänglichen Software, AutoStereota (https://github.com/liang-bo/AutoStereota)23 gesteuert. - Lokalisieren Sie die Spitze der Nadel, um nur die Bregma zu berühren. Setzen Sie die Z-Koordinate von bregma auf 0, indem Sie auf die Schaltfläche Bregma in AutoStereota klicken.
- Setzen Sie den Wert für Eingang X auf 0,8, den Wert für Eingang Y auf 1,94, den Wert für Eingang Z auf 1,0 und klicken Sie dann auf die Schaltfläche Suchen, um die Nadel auf die Oberseite des gebohrten Lochs am Schädel zu bewegen.
- Passen Sie die Nadelposition über AutoStereota an die Mitte des exponierten Hirngewebebereichs an.
HINWEIS: Um die Nadel in laterale oder mediale Richtung zu bewegen, geben Sie den Schrittwert ein und klicken Sie auf AutoStereota auf die Schaltflächen Seitlich oder Medial. Um die Nadel in vorderer oder hinterer und dorsaler oder ventraler Richtung zu bewegen, klicken Sie auf die Tasten Rostral oder Caudal bzw. Dorsal bzw. Ventral. - Schalten Sie das Vakuum ein und beginnen Sie, den exponierten Hirnbereich mit ACSF durch ein schwerkraftgesteuertes Schlauchsystem (siehe Materialtabelle) zu spülen, das mit einer 30-G-Nadel mit einer gebogenen Spitze verbunden ist. ACSF wird kontinuierlich mit einem Gasgemisch aus 95% O2 und 5%CO2 gesprudelt und durch einen 0,2 μm Filter gefiltert.
HINWEIS: Die ACSF-Durchflussrate beträgt ~ 1,5 ml / min. Der Ausgangsdruck des Gasgemisches wird bei ~3 psi gehalten. - Aspirieren Sie Hirngewebe Schicht für Schicht mit Hilfe der AutoStereota-Software (Abbildung 3).
HINWEIS: Die Aspiration des Hirngewebes wird in 4 Runden abgeschlossen, so dass eine Säulentasche (1,8 mm in der Tiefe und 1 mm im Durchmesser) erzeugt wird.- Klicken Sie in der Sitzung "zStep" auf die erste und zweite Zeile und überprüfen Sie sie. Legen Sie die Werte für die erste Zeile auf 0,2 und 1 fest. Legen Sie die Werte für die zweite Zeile auf 0,15 und 4 fest (Abbildung 3A).
- Stellen Sie in der Sitzung "Modus" die Nadelgröße 27 und 1,2 die Dims 0,9 ein. Alle anderen Werte verwenden Standardwerte (Abbildung 3A).
- Klicken Sie nacheinander auf die Schaltflächen Set, Keep Zero und Start , um die Aspiration zu starten.
HINWEIS: Dies ist die1. Runde der Aspiration. Eingabewerte geben an, dass die Aspirationstiefe während des ersten Schritts mit 1 Schicht 0,2 mm (von der Z-Koordinate von 0) beträgt; Während des zweiten Schritts beträgt die Aspirationstiefe 0,15 mm, die für 4 Schichten kontinuierlich wiederholt wird. Die Aspirationsauflösung beträgt 1,2 und der Durchmesser 0,9 mm. Während der Aspiration kann die sofortige Position der Nadelspitze über das Gleisdiagrammfeld überwacht werden. Nach Abschluss dieser Absaugrunde wird eine Säulentasche mit 0,8 mm Tiefe und 1 mm Durchmesser erzeugt. Die Nadelspitze befindet sich wieder in der Mitte mit der Z-Koordinate 0. - Klicken Sie in der Sitzung "zStep" auf die erste und zweite Zeile und überprüfen Sie sie. Legen Sie die Werte für die erste Zeile auf 1 und 1 fest. Legen Sie die Werte für die zweite Zeile auf 0,15 und 4 fest (Abbildung 3B).
- Behalten Sie in der Sitzung "Modus" alle Werte wie in der vorherigen Runde bei (Abbildung 3B).
- Klicken Sie nacheinander auf die Schaltflächen Set, Keep Zero und Start , um die Aspiration zu starten.
HINWEIS: Dies ist die 2. Runde der Aspiration. Eingabewerte geben an, dass die Aspirationstiefe 1 mm (von der Z-Koordinate von 0) während des ersten Schritts mit 1 Schicht beträgt; Während des zweiten Schritts beträgt die Aspirationstiefe 0,15 mm, die für 4 Schichten kontinuierlich wiederholt wird. Nach Abschluss dieser Absaugrunde wird die Säulentasche mit 1,6 mm Tiefe und 1 mm Durchmesser erzeugt. - Klicken Sie in der Sitzung "zStep" auf und aktivieren Sie nur die erste Zeile. Legen Sie die Werte für die erste Zeile auf 1,8 und 1 fest (Abbildung 3C).
- Stellen Sie in der Sitzung "Modus" die Nadelgröße 27 Gauge und 2.2 ein. Alle anderen Werte bleiben mit denen der vorherigen Runde identisch (Abbildung 3C).
- Klicken Sie nacheinander auf die Schaltflächen Set, Keep Zero und Start , um die Aspiration zu starten.
HINWEIS: Dies ist die 3. Runde der Aspiration. Die Eingabewerte geben an, dass die Aspirationstiefe 1,8 mm (von der Z-Koordinate 0) mit 1 Schicht beträgt. Die Aspirationsauflösung beträgt 2,2. Nach Abschluss dieser Absaugrunde wird die Säulentasche mit 1,8 mm Tiefe und 1 mm Durchmesser erzeugt. - Klicken Sie in der Sitzung "zStep" auf und aktivieren Sie nur die erste Zeile. Legen Sie die Werte für die erste Zeile auf 1,6 und 1 fest (Abbildung 3D).
- Stellen Sie in der Sitzung "Modus" die Nadelgröße 27 und 2.2 die Dims 0.6 ein (Abbildung 3D).
- Klicken Sie nacheinander auf die Schaltflächen Set, Keep Zero und Start , um die Aspiration zu starten.
HINWEIS: Dies ist die4. Runde der Aspiration. Der Zweck dieses Schrittes ist es, das in der Tasche angesammelte Blut zu reinigen. Blutungen sind häufig, da kleine Blutgefäße während des Aspirationsprozesses reißen. Um das Blut gründlich zu reinigen, stoppen Sie die Bewässerung von ACSF für 5 Minuten und schalten Sie dann die Bewässerung wieder ein. Wiederholen Sie die 4. Aspirationsrunde mehrmals, bis die Tasche blutfreiist. Dieses Protokoll kann verwendet werden, um auf andere Tiefenhirnregionen abzuzielen. Wenn beispielsweise der Zielhirnbereich der NAc ist, sollte die endgültige entsprechende Z-Koordinate von D / V 4,4 mm betragen.
- Stoppen Sie das Vakuum und die Bewässerung von ACSF. Bringen Sie die Nadel auf +2 mm Z-Koordinate und 0,5 mm vorne in die Mitte. Legen Sie die sterile 1mm GRIN-Linse in die Tasche.
- Halten Sie die Nadelspitze in Kontakt mit der freiliegenden GRIN-Linse, um sicherzustellen, dass die GRIN-Linse im 10 ° -Winkel abgesetzt wird. Drücken Sie die Oberseite der GRIN-Linse vorsichtig mit sterilem Weichpapier an, um sicherzustellen, dass die untere Oberfläche der GRIN-Linse mit dem Hirngewebe in Kontakt kommt.
- Tragen Sie die geschmolzene Agarose in der Lücke zwischen der GRIN-Linse und dem Hirngewebe mit Hilfe eines Spatels auf. Nachdem Agarose ein Gel gebildet hat, entfernen Sie überschüssige Agarose mit einer Mikroklinge.
- Reinigen Sie den Schädel gründlich mit Kochsalzlösung und Wattestäbchen. Lassen Sie den Schädel trocknen, bevor Sie den Zahnzement (siehe Materialtabelle) auftragen.
- Nehmen Sie das Mischen gut aus -20 °C Gefrierschrank. Mischen Sie das Zahnzementpulver und die Katalysatorflüssigkeit und tragen Sie eine Schicht selbsthärtenden Haftharzements auf den Schädel auf. Umgeben Sie zuerst die GRIN-Linse und bedecken Sie dann den gesamten freiliegenden Schädel.
- Warten Sie 5 Minuten und lassen Sie es vollständig aushärten. Entfernen Sie die Aspirationsnadel vorsichtig.
- Mischen Sie in einem sauberen Kunststoffbrunnen Zahnzementpulver, schwarze Holzkohle mit Flüssigkeit und tragen Sie eine dünne Schicht der Mischung auf die 1. Schicht Zahnzement auf. Warten Sie 5 Minuten, um es aushärten zu lassen.
- Schützen Sie die freiliegende GRIN-Linse, indem Sie sie mit einer kundenspezifischen Kappe aus einem PCR-Röhrchen abdecken (Abbildung 2D). Tragen Sie Cyanacrylat auf, um die Kappe auf dem Zahnzement zu befestigen.
- Injizieren Sie 1 ml vorgewärmte Kochsalzlösung subkutan in die Maus, gefolgt von 0,1 mg/kg Buprenorphin. Legen Sie die Maus zurück in den Hauskäfig. Legen Sie den Hauskäfig in einen 33 °C-Inkubator und überwachen Sie die Maus, bis sie gehfähig ist. Es dauert normalerweise 20-40 Minuten, bis eine Maus aus der Anästhesie aufwacht, bevor sie sich bewegt.
- Verabreichen Sie nichtsteroidale entzündungshemmende Medikamente und überwachen Sie die Maus für mindestens 3 postoperative Tage. Lassen Sie die Maus sich 30 Tage lang von der Operation erholen.
3. Anbringen der Miniscope-Halterung (Basis) am Mausschädel (Abbildung 1)
- Betäuben Sie die Maus in einer Induktionskammer mit 5% Isofluran und 1 l / min Sauerstoffdurchfluss, bis ihre Atemfrequenz auf 1 Atemzug / s abnimmt.
- Platzieren Sie die Maus in der stereotaktischen Stufe und sichern Sie ihre Position mit Ohrstangen und Nasenclips. Aufrechterhaltung eines kontinuierlichen Flusses von Isofluran (1,5%) und Sauerstoff (0,5 l/min).
- Tragen Sie Augensalbe auf die Augen auf, um sie feucht zu halten. Schalten Sie das Heizkissen ein und halten Sie die Temperatur bei 35 °C. Vergewissern Sie sich, dass die Maus vollständig betäubt ist, indem Sie die Pedalreflexe beurteilen.
- Entfernen Sie die Kappe, die die GRIN-Linse bedeckt, vorsichtig mit einer spitzen Pinzette. Bohren Sie die getrockneten Cyanacrylatrückstände vollständig mit einem Mikrobohrer aus dem Zahnzement ab (siehe Materialtabelle).
- Schneiden Sie die Haare um den Zahnzementbereich mit einer kleinen Schere. Reinigen Sie die Ablagerungen mit Hilfe eines Druckluftstaubtuchs. Verwenden Sie ein in Aceton getauchtes Wattestäbchen, um die Oberseite der GRIN-Linse zu reinigen.
- Bereiten Sie das Miniscope mit seiner Halterung (Basis) vor.
- Setzen Sie eine Sechskantmutter #00-90 (siehe Materialtabelle) in den Schlitz in der Basis ein und tragen Sie Cyanacrylat auf, um sie dort zu befestigen (Abbildung 2E).
- Tragen Sie ein Klebeband aus Polytetrafluorethylen (PTFE) fest um das Gewinde des Miniscopes an und schneiden Sie das zusätzliche Band ab (Abbildung 2F).
- Befestigen Sie das Miniscope an der Basis, und befestigen Sie das Miniscope mit der Verriegelungsschraube an der Basis (Abbildung 2G).
- Schließen Sie das Miniscope an sein Kabel an und schalten Sie die eigens entwickelte, derzeit frei zugängliche Software NeuView ein (siehe Materialverzeichnis).
HINWEIS: Die NeuView-Software wurde speziell für die Miniscope-In-vivo-Kalziumbildgebung von Dr. Lins Gruppe am NIDA/IRP 7,12 entwickelt. Es ist Open Access (https://github.com/giovannibarbera/miniscope_v1.0). - Klicken Sie in NeuView auf Hardware, aktivieren Sie LED1 und klicken Sie auf die Schaltfläche Stream , um die Livebilder anzuzeigen (Abbildung 4A). Um das Live-Streaming zu stoppen, klicken Sie auf die Schaltfläche Stopp .
- Setzen Sie das Miniscope in einen speziell angefertigten Miniscope-Haltearm (Abbildung 2H) ein, dessen XYZ-Position mit motorisierten Steuerungen manipuliert werden kann (Abbildung 2I).
- Platzieren Sie das Miniscope direkt über dem freiliegenden GRIN-Objektiv und machen Sie es parallel zur Oberfläche des Objektivs. Bringen Sie das Miniscope langsam in Richtung des GRIN-Objektivs und passen Sie seine Z-Position an, bis die beste Fokusebene gefunden ist.
HINWEIS: Die beste Fokusebene wird ermittelt, indem mehrere mögliche Z-Positionen verglichen und die Fokusebene mit einer klaren Visualisierung der meisten Zellkörper ausgewählt wird. - Tragen Sie die erste Schicht Zahnzement vorsichtig um die Miniscope-Basis auf, ohne die Position des Miniscopes zu verändern. Nachdem der Zement ausgehärtet ist, entfernen Sie vorsichtig den Haltearm, so dass das Miniscope alleine auf dem Mauskopf stehen kann.
HINWEIS: Der Zahnzement neigt dazu, nach dem Aushärten zu schrumpfen, und er zieht das Miniscope von der ursprünglichen Fokusebene nach unten. Typischerweise wird die Position des Miniscope Z leicht über die ursprüngliche Brennebene angehoben, bevor Zahnzement aufgetragen wird, um die mögliche Änderung auszugleichen. - Tragen Sie eine zweite Schicht Zahnzement um die Basis auf, um alle Lücken zu füllen und sicherzustellen, dass kein LED-Licht aus den Lücken austritt. Lassen Sie den Zahnzement aushärten.
- Entfernen Sie die Maus von der stereotaktischen Bühne. Lösen Sie die Verriegelungsschraube und lösen Sie das Miniscope von der Basis. Setzen Sie eine 3D-gedruckte Schutzkappe in die Basis ein, um die freiliegende GRIN-Linse zu schützen, und ziehen Sie die Verriegelungsschraube in der Basis fest (Abbildung 2J).
- Legen Sie die Maus zurück in den Hauskäfig.
HINWEIS: Es dauert normalerweise 10-15 Minuten, bis eine Maus aus der Isofluran-Anästhesie aufwacht, bevor sie sich bewegt.
4. Miniscope-Montage und In-vivo-Ca 2+- Bildgebung (Abbildung 1)
- Montieren Sie das Miniscope an der Basis
- Betäuben Sie die Maus kurz in der Induktionskammer (5% Isofluran und 1 L/min Sauerstoffdurchfluss). Legen Sie die Maus auf eine saubere Bankfläche.
- Lösen Sie die Verriegelungsschraube mit einem kleinen Schraubendreher, entfernen Sie die Schutzkappe und reinigen Sie die Oberfläche der GRIN-Linse mit einem acetongetränkten Wattestäbchen.
- Wickeln Sie ein PTFE-Band fest um das Miniscope-Gewinde und befestigen Sie das Miniscope an seiner Basis am Mauskopf.
- Schließen Sie das Miniscope an das Kabel an (Abbildung 2K), schalten Sie die NeuView Software ein.
- Klicken Sie in NeuView auf Hardware, aktivieren Sie LED1 und klicken Sie auf die Schaltfläche Stream , um die Livebilder anzuzeigen (Abbildung 4A).
- Identifizieren Sie die beste Fokusebene, indem Sie die Position des Miniscopes relativ zur Basis anpassen, entweder leicht anziehen oder mit Hilfe einer stumpfen Pinzette lockern.
HINWEIS: Die beste Fokusebene wird ermittelt, indem mehrere mögliche Orte verglichen und die mit einer klaren Visualisierung der meisten Zellkörper ausgewählt wird. - Ziehen Sie die Verriegelungsschraube fest und legen Sie die Maus wieder in den Hauskäfig.
- Stellen Sie in NeuView die LED-Lichtleistung auf das optimale Niveau ein. Klicken Sie auf die Schaltflächen Capture und dann auf Trigger, um die Aufnahme zu starten und nach 150 Frames auf Stop zu klicken.
HINWEIS: Die niedrigstmögliche Leistung bestimmt das optimale Niveau der LED-Leistung, um ein ausreichend helles Bild zu erzielen. Der Zweck der Aufnahme eines kurzen Videos besteht darin, die Identifizierung derselben Fokusebene in der Zukunft für die sich wiederholende Bildgebung zu erleichtern. - Trennen Sie das Kabel vom Miniscope. Lassen Sie die Maus sich mindestens 30 Minuten erholen, bevor Sie mit dem Experiment beginnen.
HINWEIS: Um das Miniscope zu schützen, werden in der Regel die Wasserflasche und der Drahtfutterspender während dieser kurzen Zeit entfernt. Wenn die Maus länger in ihrem Hauskäfig bleiben muss, wird empfohlen, handelsübliches Diätgel (siehe Materialtabelle) im Hauskäfig zuzuführen.
- Datenerfassung für die in vivo Kalziumbildgebung
HINWEIS: In vivo Calcium Imaging kann gleichzeitig zusammen mit allen Verhaltenstests durchgeführt werden, die der Forscher wünscht. Zum Demonstrationszweck ist das Beispiel hier in vivo Ca2+ Bildgebung während eines Freifeldtests. Um dieses Ziel zu erreichen, sind zwei Computer erforderlich. Ein Computer ist mit kommerzieller Software (siehe Materialverzeichnis) ausgestattet, um eine Kamera zu steuern, um das Mausverhalten automatisch aufzuzeichnen. Der andere Computer ist mit NeuView ausgestattet, um das Miniscope zu steuern und die Ca2+ Bilder aufzunehmen.- Aktivieren Sie die Verhaltenskamera-Software (siehe Materialtabelle), um die Mausverhaltensarena über eine Livestream-Funktion anzuzeigen. Stellen Sie den Fokus der oberen Kamera manuell ein (Abbildung 2L).
- Wählen Sie Trigger/Strobe und aktivieren Sie "Trigger aktivieren/deaktivieren" (Abbildung 4B). Klicken Sie auf die Schaltfläche Aufnahme , wählen Sie mit Durchsuchen den Speicherort aus, an dem Verhaltensaufzeichnungen gespeichert werden, und wählen Sie das gewünschte Bildformat aus.
HINWEIS: Die Funktion "Trigger Control" ist aktiviert, damit die Verhaltensaufzeichnung von der NeuView-Software ausgelöst werden kann, so dass die Verhaltens-Frames und die entsprechenden Calcium-Imaging-Frames zeitlich miteinander gekoppelt werden. Die Verhaltensaufzeichnung kann in jedem gewünschten Format gespeichert werden. Die Verhaltensaufzeichnung wird in der Regel im JPEG-Format im angegebenen Ordner gespeichert. - Bringen Sie die Maus in die Nähe der Arena und verbinden Sie das Miniscope mit dem Kabel, das mit dem Datenerfassungssystem verbunden ist (Abbildung 2L) (siehe Materialtabelle). Die Maus wird dann in der Mitte der Arena platziert.
- Mit der Livestream-Funktion der NeuView-Software können Sie die LED-Leistung anpassen, um die Helligkeit des Kalziumbildes zu optimieren.
HINWEIS: Für die Kalziumbildgebung beträgt die Aufnahmebildrate standardmäßig 10 Bilder/s. - Deaktivieren Sie in NeuView LED1, klicken Sie auf die Schaltflächen Capture und dann auf Trigger , um die Aufnahme zu starten, und drücken Sie nach 100 Frames Stopp .
HINWEIS: Dies dient dazu, Hintergrundbilder für etwa 100 Bilder mit ausgeschaltetem LED-Licht aufzunehmen. - Klicken Sie in der Verhaltenskamera-Software auf Aufzeichnung starten (Abbildung 4C). Aktivieren Sie in NeuView LED1, klicken Sie auf Capture und dann auf Trigger-Schaltflächen, um die Aufnahme zu starten. Drücken Sie nach 3000 Frames Stopp.
HINWEIS: Dies dient dazu, Kalziumbildgebung und -verhalten gleichzeitig aufzuzeichnen. Der Open-Field-Test dauert 15 Minuten und ist in der Regel in drei Aufnahmesitzungen von jeweils 5 Minuten unterteilt. Damit soll verhindert werden, dass das Miniscope durch Dauereinsatz überhitzt. - Speichern Sie sowohl die Kalziumbildgebung als auch die Verhaltensaufzeichnungen in den vorgesehenen Ordnern. Wiederholen Sie die Aufnahme für zwei weitere Sitzungen, während Sie den Hintergrund vor jeder Sitzung aufzeichnen, und speichern Sie alle Aufzeichnungen im angegebenen Ordner.
- Trennen Sie das Miniscope von seiner Basis.
- Trennen Sie nach Abschluss der Aufnahme das Kabel vom Miniscope.
- Betäuben Sie die Maus kurz in der Induktionskammer (5% Isofluran und 1L/min Sauerstoffdurchfluss). Legen Sie die Maus auf eine saubere, warme Oberfläche.
- Schrauben Sie die Verriegelungsschraube in der Basis ab und lösen Sie das Miniscope von der Basis. Setzen Sie die Schutzkappe wieder über die Basis und ziehen Sie die Verriegelungsschraube fest. Setzen Sie die Maus wieder in ihren Heimkäfig.
Ergebnisse
Abbildung 1 zeigt das schematische experimentelle Verfahren, einschließlich viraler Injektion, GRIN-Linsenimplantation, Anheftung der Miniscope-Base am Mausschädel und In-vivo-Calcium-Bildgebung über ein Miniskop. Der gesamte Eingriff dauert ~2 Monate. Abbildung 2 zeigt die Hauptkomponenten, die im Protokoll für die Miniscope-In-vivo-Calciumbildgebung beschrieben sind. Abbildung 3 zeigt die Schnittstellen der AutoStereota-Software während der Implantation der GRIN-Linse. Abbildung 4 zeigt die Schnittstellen von NeuView und Verhaltensaufzeichnungssoftware während der In-vivo-Kalziumbildgebung.
Das Ergebnis der In-vivo-Kalziumbildgebung hängt vom Erfolg sowohl der viralen Injektion als auch der GRIN-Linsenimplantationsoperationen ab. Abbildung 5 zeigt eine Reihe von Ergebnissen (d. h. erfolglos, suboptimal und gut) aus In-vivo-Calcium-Bildgebungsaufzeichnungen . In erfolglosen Fällen kann das Kalziumbild entweder dunkel oder hell erscheinen, zeigt aber normalerweise keine oder nur sehr wenige aktive Neuronen. Wir verfolgen normalerweise keine In-vivo-Kalzium-Aufzeichnungsexperimente , wenn es weniger als fünf aktive Neuronen gibt. Eine gute In-vivo-Kalziumbildgebung zeigt typischerweise mehrere hundert aktive Neuronen. Wenn eine Aufnahme weniger als hundert aktive Neuronen enthält, betrachten wir sie als suboptimale Aufzeichnung.
Sowohl in suboptimalen als auch in guten Aufzeichnungen in vivo wurden Calcium-Bildgebungsexperimente durchgeführt und die anschließende Datenanalyse durchgeführt. Film 1 zeigt eine repräsentative In-vivo-Calcium-Bildgebungsaufzeichnung von der Maus mPFC. Verhaltensvideos und Kalziumbildgebungsdaten werden in der Regel separat verarbeitet. Videos zum Verhalten der Maus können manuell bewertet werden. Calcium-Bildgebungsdateien werden mit der CaImAn Calcium-Bildverarbeitungs-Toolbox24 verarbeitet. Abbildung 6 zeigt eine repräsentative Zellkarte und mehrere Kalziumspuren aus einer guten In-vivo-Calciumbildaufnahme.
Nach Abschluss der In-vivo-Calcium-Bildgebung besteht der letzte Schritt darin, zu bestätigen, ob die virale Injektion und GRIN-Linsenimplantation in der gewünschten Hirnregion stattgefunden hat. Zu diesem Zweck wurde die Maus mit phosphatgepufferter Kochsalzlösung (PBS) durchblutet, gefolgt von 4% Paraformaldehyd (PFA). Das Gehirn der Maus wurde geerntet, in 4% PFA für 12 h postfixiert und in PBS bei 4 °C gelagert. Das Mäusegehirn wurde dann in 50 μm dicke Scheiben mit einem Vibratom geschnitten. Die Hirnschnitte wurden mit DAPI gefärbt und unter dem Mikroskop beobachtet (nicht im Protokoll beschrieben)12. Abbildung 7 zeigt eine Maus-Gehirnscheibe ~ 1,94 mm vor Bregma von einer experimentellen Maus, die die Spur zeigt, wo die GRIN-Linse implantiert wurde. Der grüne Fluoreszenzbereich unter und um die GRIN-Linsenspur zeigt die Expression von GCaMP6f im mPFC-Bereich an.
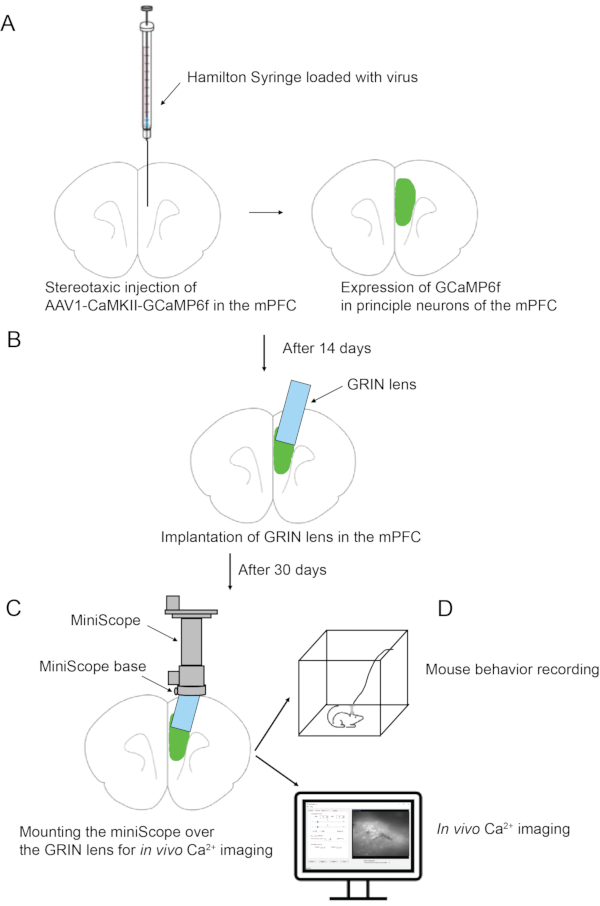
Abbildung 1: Schematischer Überblick über das experimentelle Vorgehen . (A) Stereotaktische Injektion des Virus in den mPFC. (B) Implantation von GRIN-Linsen in den mPFC. (C) Anbringen der Miniscope-Basis am Mausschädel. (D) Miniscope-Montage und In-vivo-Calcium-Bildgebung . Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Hauptkomponenten, die für die In-vivo-Kalziumbildgebung benötigt werden. (A) Eine GRIN-Linse mit 1 mm Durchmesser und 4,38 mm Länge. (B) Eine manuell polierte stumpfe Nadel mit 27 G, die für die Aspiration des Hirngewebes verwendet wird. (C) Der Roboterarm, der mit dem Nadelhalter gekoppelt ist. (D) Eine maßgeschneiderte Kappe aus einem PCR-Tubus zum Schutz der exponierten GRIN-Linse bis zur Anbringung der Miniscope-Basis am Mausschädel. (E) Der Miniscope-Halter (Sockel) mit einer Sechskantmutter. (F) Ein Miniscope, dessen Gewindeteil mit dem PTFE-Band umwickelt ist. (G) Ein Miniskop, das mit einer Verriegelungsschraube an seiner Basis befestigt ist. (H) Der Miniscope-Haltearm. (I) Ein speziell angefertigter motorisierter 3D-Controller, der die Bewegung des Miniskops in XYZ-Positionen erleichtert. (J) Eine Schutzkappe, die an der Basis befestigt ist, um die exponierte GRIN-Linse zu schützen, während die Maus keine In-vivo-Kalziumbildgebung durchführt. (K) Das Miniscope, das mit dem Kabel verbunden ist. (L) Das Datenerfassungssystem für die In-vivo-Ca 2+- Bildgebung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
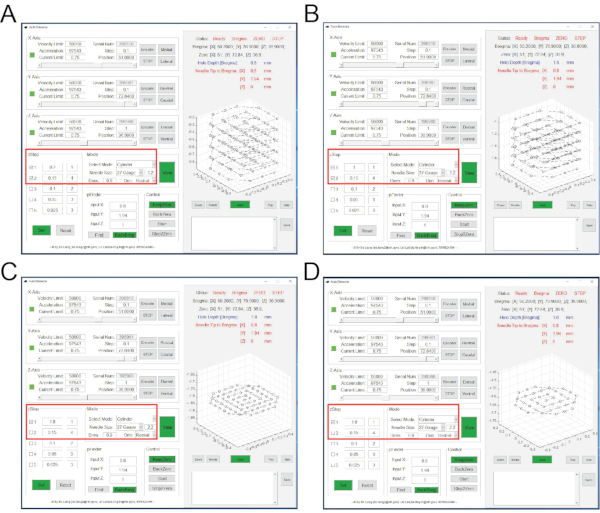
Abbildung 3: Schnittstellen der AutoStereota-Software während der Schicht-für-Schicht-Hirngewebeaspiration. (A) Die Grenzfläche, die den Schritten 2.17.1 bis 2.17.3 entspricht. (B) Die Schnittstelle, die den Schritten 2.17.4 bis 2.17.6 entspricht. c) Die Schnittstelle gemäß den Schritten 2.17.7 bis 2.17.9. (D) Die Schnittstelle, die den Schritten 2.17.10 bis 2.17.12 entspricht. Rote Kästchen heben die Eingabewerte hervor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 4: Schnittstellen der NeuView-Software und der Verhaltensaufzeichnungssoftware während der In-vivo-Kalziumbildgebung . (A) Die Schnittstelle von NeuView. (B,C) Die Schnittstellen der Verhaltensaufzeichnungssoftware. Rote Kästchen markieren Schaltflächen, auf die geklickt werden muss. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
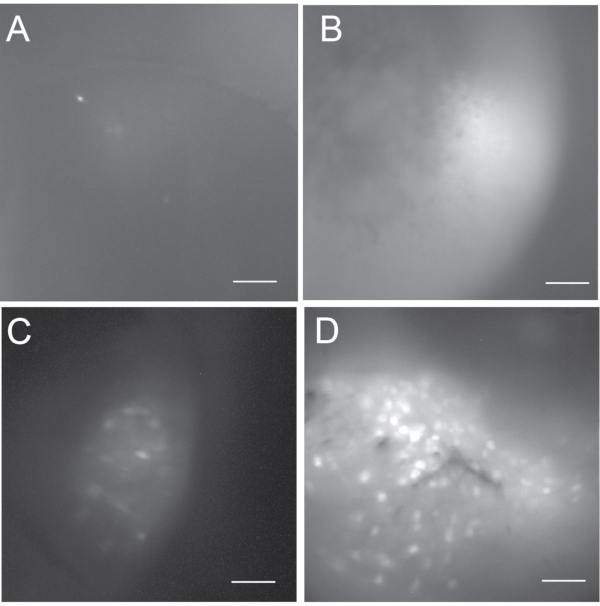
Abbildung 5: Maximale Projektion Fluoreszenzzellkarten, um die Bandbreite der möglichen Ergebnisse zu zeigen. (A,B) Erfolglose In-vivo-Calcium-Bildgebung, die für die nachfolgende Datenanalyse nicht akzeptabel ist. (A) ist dunkel und enthält weniger als 5 aktive Neuronen. (B) ist hell, hat aber keine aktiven Neuronen. (C) Die Zellkarte aus einer suboptimalen In-vivo-Kalziumbildgebung, die einige aktive Neuronen enthält. (D) Die Zellkarte aus einer guten In-vivo-Kalziumbildgebung, die mehrere hundert aktive Neuronen umfasst. Maßstabsstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
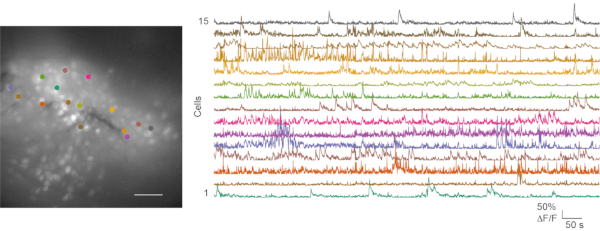
Abbildung 6: Repräsentative Zellkarte und Calciumtransienten aus einer erfolgreichen in vivo Calciumbildgebung. Das linke Feld zeigt die maximale Projektionsfluoreszenzzellkarte aus einer in vivo Calcium-Bildgebungsaufzeichnung im mPFC während eines Freifeldtests. Die Aufnahme dauert 5 min. Das rechte Feld zeigt Calciumtransienten aus 15 Regionen von Interesse (farblich abgestimmt). Maßstabsstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
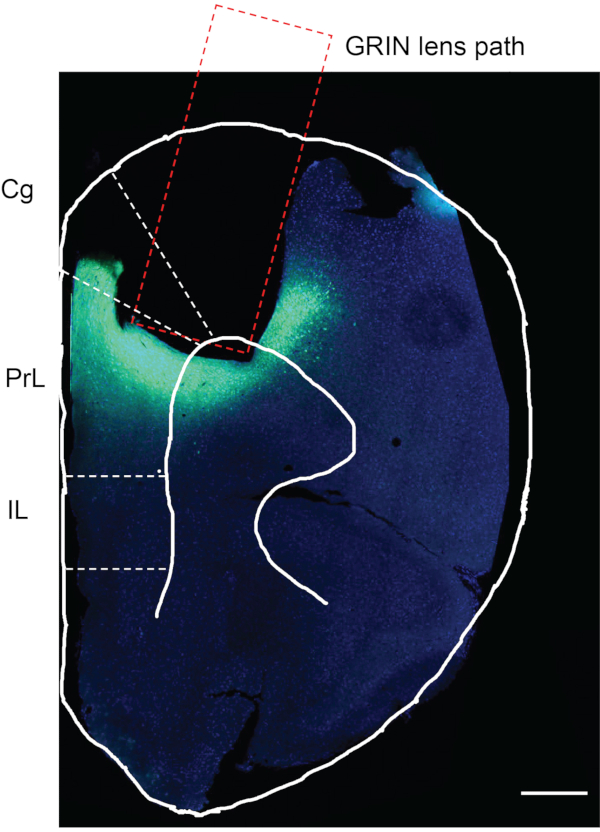
Abbildung 7: Postmortale Beurteilung einer Versuchsmaus. Die postmortale Beurteilung für GCaMP6f-Expression und GRIN-Linsenimplantation in den mPFC einer experimentellen Maus. Der rechteckige Bereich gibt den Weg für die Implantation der GRIN-Linse an. Der grüne Bereich unter der implantierten GRIN-Linsenregion bestätigt, dass GCaMP6f exprimiert wurde und die GRIN-Linse genau in die gewünschte Hirnregion implantiert wurde. Cg, cingulärer Kortex; PrL, prälimbischer Kortex; IL, infralimbischer Kortex. Maßstabsstab: 400 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Vergleiche des speziell angefertigten Miniscope-Systems am NIDA mit anderen Miniscope-Systemen 7,8,9,10,11,13,25,26. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Film 1: Eine In-vivo-Calcium-Bildgebungsaufzeichnung von der Maus mPFC während eines Freifeldtests. Zu Demonstrationszwecken zeigt dieses Video nur 1 Minute Aufnahme. Die ursprüngliche Aufnahmebildrate beträgt 10 Bilder/s. Das Video ist 6-mal schneller als die Originalaufnahme. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Diskussion
Eine zentrale Frage in den Neurowissenschaften ist das Verständnis, wie neuronale Dynamik und Schaltkreise Informationen kodieren und speichern und wie sie bei Gehirnerkrankungen verändert werden. Mit einem Miniscope in vivo Ca2+ Bildgebungssystem kann die individuelle neuronale Aktivität von mehreren hundert Neuronen innerhalb eines lokalen Mikroschaltkreises gleichzeitig von einem sich frei verhaltenden Tier überwacht werden. Hier wird ein detailliertes Operationsprotokoll für die virale Injektion und GRIN-Linsenimplantation beschrieben, um Nagetiere über ein speziell entwickeltes Miniscope-Aufzeichnungssystem auf eine tiefe Gehirn-in-vivo-Ca 2+-Bildgebung vorzubereiten. Tabelle 1 zeigt die Vergleiche unseres Miniscope-Systems mit anderen handelsüblichen und kundenspezifischen Miniscope-Systemen 7,8,9,10,11,13,25,26. Es ist erwähnenswert, dass die GRIN-Linsenimplantation unter Verwendung des vorliegenden chirurgischen Protokolls mit allen kommerziellen oder kundenspezifischen Einzelphotonen- und Zwei-Photonen-Bildgebungssystemen für eine Deep-Brain-In-vivo-Kalziumbildgebung kompatibel ist.
Von der viralen Injektion bis zur Datenerfassung der Miniscope in vivo Calcium-Bildgebung dauert das gesamte experimentelle Verfahren mindestens 2 Monate. Es ist ein komplizierter und arbeitsintensiver Prozess. Der letztendliche Erfolg des Experiments hängt von mehreren Faktoren ab, einschließlich der richtigen Auswahl der GECIs, der genauen Injektion des Virus in den Zielhirnbereich, der ausreichenden Virusexpression in der gewünschten neuronalen Population, der Implantation der GRIN-Linse genau an der gewünschten Stelle, der ausreichenden Erholung von Operationen sowie der Frage, ob nach der Operation eine schwere Entzündung auftritt und ob das Verhalten des Tieres durch Operationen stark beeinträchtigt wird. Und so weiter.
Zwei kritische Schritte umfassen die stereotaktische Injektion von Viren und die Implantation von GRIN-Linsen. Zu diesem Demonstrationszweck wurde die stereotaktische Mikroinjektion in der mPFC der Maus durchgeführt, wobei das Adeno-assoziierte Virus (AAV1) GCaMP6f unter der Kontrolle eines CaMKII-Promotors kodiert, der pyramidale Neuronen im mPFC selektiv markiert. GCaMP6f wurde ausgewählt, da es mit einer halben Zerfallszeit von 71 ms15 einer der schnellsten und empfindlichsten Kalziumindikatoren ist. Darüber hinaus ist die virale AAV-Expression von GCaMP6f lang anhaltend (d. h. mehrere Monate), was sie ideal für die Durchführung repetitiver In-vivo-Ca 2 + -Bildgebung über einen langen Zeitraum für Längsschnittstudien in Mausmodellen neurodegenerativer Erkrankungenist 27. Das aktuelle Operationsprotokoll kann angepasst werden, um verschiedene Zellpopulationen in jeder anderen Gehirnregion anzusprechen. Verschiedene verfügbare virale Werkzeuge ermöglichen die selektive Markierung spezifischer neuronaler Populationen in der gewünschten Hirnregion im gewünschten Alter. Darüber hinaus können Forscher das Cre-LoxP-Rekombinationssystem und verschiedene verfügbare transgene Mausmodelle nutzen, um genetische Modifikationen durchzuführen und das Ergebnis von Verhaltens- und neuronalen Schaltkreisen zu untersuchen28,29.
Ein einzigartiges Merkmal des vorgestellten Protokolls ist, dass die automatisierte Schicht-für-Schicht-Hirngewebeaspiration vor der Implantation der GRIN-Linse (1 mm Durchmesser) durchgeführt wurde. Dies wird durch eine 27-G-Nadel erreicht, die mit einem Vakuumsystem verbunden ist, das von einem speziell angefertigten Roboterarm und der Software23 gesteuert wird. Basierend auf unserer Erfahrung erzeugt diese Methode eine gleichmäßige Oberfläche für den Kontakt mit der GRIN-Linse und verursacht weniger Schäden am benachbarten Gewebe als die manuelle Gewebeaspiration23. Aus diesem Grund bringt dieses Verfahren einen offensichtlichen Vorteil für GRIN-Linsen mit einem relativ breiteren Durchmesser (z. B. 1 mm). Für die Implantation einer GRIN-Linse mit einem kleineren Durchmesser (0,5 mm oder 0,25 mm) ist jedoch möglicherweise keine Gewebeaspiration erforderlich. Stattdessen kann es direkt entlang der führenden Spur mit einer 30 G Nadel21 gepflanzt werden.
Neben den beiden oben besprochenen kritischen Schritten müssen viele weitere Faktoren für eine erfolgreiche Operation sorgfältig abgewogen werden. (1) Alle Instrumente, die das Gehirn berühren, sollten sterilisiert werden, um eine Infektion zu verhindern. (2) Alle chirurgischen Schritte müssen durchgeführt werden, um die Schädigung des Gehirns zu minimieren und weitere Entzündungen und übermäßige Narbengewebebildung zu verhindern. (3) Die Anästhesiedosen, die anfangs verabreicht und während der Operation aufrechterhalten werden, insbesondere diejenigen, die intraperitoneal verabreicht werden, müssen sorgfältig abgewogen werden. Die Anästhesiedosen können je nach Mausstämmen modifiziert werden, da einige anfälliger sein können. (4) Der Zustand der Maus muss während der Operation ständig überwacht werden. Schließlich (5) müssen die Mäuse nach der Operation regelmäßig überwacht werden, da nach der Operation viele Komplikationen auftreten können.
Obwohl während des Implantationsschritts der GRIN-Linse einseitig ein Stück Hirngewebe entfernt wird, haben wir keine offensichtlichen Verhaltensdefizite beobachtet 7,12. Das Gewicht des Miniscopes beträgt etwa 2 Gramm und das Kabel wurde speziell entwickelt, um es leicht zu machen und sicherzustellen, dass die Maus es leicht tragen kann. Das Miniskop und das Kabel werden erst vor der In-vivo-Bildgebung am Tier befestigt und nach der Bildgebung abgelöst. Der gesamte Bildgebungsprozess dauert in der Regel nicht länger als 30 Minuten. Daher hindern diese Instrumentierungen die Maus nicht daran, sich frei zu verhalten. Die Installations- und Deinstallationsschritte des Miniscopes erfordern eine kurze Anästhesie (weniger als 2 Minuten) mit Isofluran zum Zwecke der Tierhaltung. Normalerweise lassen wir die Maus 30 Minuten lang von der kurzen Exposition von Isofluran erholen, bevor wir eine In-vivo-Bildgebung durchführen. Wir haben einige Wochen lang einmal pro Woche eine Miniscope-In-vivo-Kalziumbildgebung durchgeführt, ohne Auswirkungen auf die Gesundheit der Maus und das Sozialverhalten der Maus zu bemerken12.
Eine wesentliche Einschränkung des derzeitigen Miniscope-Aufzeichnungssystems ist die Notwendigkeit, das Mikroskop zur Datenerfassung an ein Kabel anzuschließen. Das Vorhandensein des Kabels schränkt manchmal die Ausführung der Mausaufgabe ein und schränkt die Aufnahme eines Tieres nach dem anderen ein. Vor kurzem wurde ein drahtloses Miniscope entwickelt25,26. Dies erweitert die Aufgabenleistung und ermöglicht die gleichzeitige In-vivo-Bildgebung von mehreren Tieren in einer Gruppe. Darüber hinaus wird die Entwicklung empfindlicherer GECIs mit spektral trennbaren Wellenlängen in Kombination mit einem zweifarbigen Miniscope weitere aufregende Möglichkeiten für die neurowissenschaftliche Forschung bieten.
Offenlegungen
Die Autoren berichten von keinen konkurrierenden finanziellen Interessen.
Danksagungen
Diese Arbeit wird durch Zuschüsse des National Institute of Health (NIH) 5P20GM121310, R61NS115161 und UG3NS115608 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
Referenzen
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987(2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173(2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174(2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten