Method Article
הזרקה נגיפית סטריאוטקסית והשתלת עדשה בעלת אינדקס שיפוע להדמיית סידן עמוקה במוח In Vivo
In This Article
Erratum Notice
Summary
הדמיית סידן in vivo של Miniscope in vivo היא טכניקה רבת עוצמה לחקר דינמיקה עצבית ומיקרו-מעגלים בעכברים המתנהגים בחופשיות. פרוטוקול זה מתאר ביצוע ניתוחי מוח להשגת הדמיית סידן in vivo טובה באמצעות מיניסקופ.
Abstract
מיקרוסקופ פלואורסצנטי מיניאטורי (מיניסקופ) הוא כלי רב עוצמה להדמיית סידן in vivo מחיות המתנהגות בחופשיות. הוא מציע מספר יתרונות על פני מערכות הדמיה קונבנציונליות של סידן מרובה פוטונים: (1) קומפקטי; (2) קל משקל; (3) בר השגה; ו-(4) מאפשר הקלטה מבעלי חיים שמתנהגים בחופשיות. פרוטוקול זה מתאר ניתוחי מוח להדמיית סידן in vivo במוח עמוק באמצעות מערכת הקלטה של מיניסקופ שפותחה בהתאמה אישית. הליך ההכנה מורכב משלושה שלבים, כולל (1) הזרקה סטריאוטקסית של הנגיף באזור המוח הרצוי במוח של מוח עכבר כדי לתייג תת-קבוצה מסוימת של נוירונים עם חיישן סידן מקודד גנטית; (2) השתלת עדשת אינדקס גרדיאנט (GRIN) שיכולה להעביר תמונת סידן מאזור מוח עמוק למערכת המיניסקופ; ו-(3) הצמדת מחזיק המיניסקופ מעל גולגולת העכבר, שם ניתן לחבר מיניסקופ מאוחר יותר. כדי לבצע הדמיית סידן in vivo , המיניסקופ מהודק על המחזיק, ותמונות סידן עצבי נאספות יחד עם הקלטות התנהגות סימולטניות. פרוטוקול הניתוח הנוכחי תואם לכל מערכת הדמיה מסחרית או מותאמת אישית של פוטון יחיד ושני פוטונים להדמיית סידן in vivo עמוקה במוח.
Introduction
איתות Ca2+ תוך-תאי הוא מווסת חיוני של גדילת תאים, התפשטות, התמיינות, הגירה, שעתוק גנים, הפרשה ואפופטוזיס1. בתאי עצב, איתות Ca2+ נשלט במדויק מכיוון שהתבנית המרחבית-טמפורלית שלו קשורה לתפקודים חיוניים כגון רגישות ממברנה, שחרור נוירוטרנסמיטורים ופלסטיות סינפטית2.
הדמיית סידן In vivo היא טכניקה רבת עוצמה שניתן להשתמש בה כדי לפענח ייצוג מעגלים עצביים יסודיים להתנהגויות נורמליות של בעלי חיים, לזהות פעילויות עצביות חריגות במודלים של בעלי חיים של הפרעות מוחיות, ולחשוף מטרות טיפוליות פוטנציאליות שעשויות לנרמל את המעגלים המשתנים האלה. שתי מערכות ההדמיה הנפוצות של סידן in vivo הן מיקרוסקופיה פלואורסצנטית לסריקת לייזר דו-פוטונית 3,4,5,6 ומיקרואנדוסקופיה ממוזערת (מיניסקופ) המותקנת על הראש 7,8,9,10,11,12,13 . המיקרוסקופיה הקונבנציונלית של שני פוטונים מציעה יתרונות שולטים כגון רזולוציה טובה יותר, רעש נמוך יותר והלבנת תמונות נמוכה יותר; עם זאת, חיות הניסוי נדרשות להיות קבועות ראש, מה שמגביל את מחקרי ההתנהגות שניתן לבצע 3,4,5,6. לעומת זאת, מערכת המיניסקופ המותקנת על הראש היא קטנה וניידת, מה שמאפשר לחקור מגוון רחב של מבחני התנהגות באמצעות בעלי חיים המתנהגים בחופשיות 7,8,9,10,11,12,13.
ישנם שני אינדיקטורים מובילים של Ca2+, אינדיקטורים כימיים 5,14 ואינדיקטורים לסידן מקודדים גנטית (GECIs)15,16. הדמיית Ca2+ התאפשרה על ידי שימוש ב-GECIs רגישים ביותר המועברים עם וקטורים נגיפיים המאפשרים תיוג ספציפי של נוירונים במעגל הממוקד. המאמץ המתמשך לשפר את הרגישות, אריכות הימים והיכולת לתייג אפילו את התאים התת-תאיים, הופך את ה-GECIs לאידיאליים למחקרי הדמיית סידן in vivo שונים 17,18,19.
פיזור האור ברקמת המוח במהלך ההדמיה מגביל את החדירה האופטית לעומק, אפילו עם המיקרוסקופיה הדו-פוטונית. עם זאת, עדשת ה-Gradient Index (GRIN) מתגברת על בעיה זו מכיוון שעדשת ה-GRIN יכולה להיות מוטמעת ישירות ברקמות הביולוגיות ולהעביר תמונות מאזור המוח העמוק אל מטרת המיקרוסקופ. בניגוד לעדשה קונבנציונלית העשויה מחומר הומוגני אופטי ודורשת משטח בעל צורה מסובכת כדי להתמקד וליצור תמונות, ביצועי עדשת GRIN מבוססים על שינוי הדרגתי במקדם השבירה בתוך חומר העדשה שמשיג מיקוד עם משטח מישור20. ניתן לייצר עדשת GRIN עד לקוטר של 0.2 מ"מ. לכן, עדשת GRIN ממוזערת יכולה להיות מושתלת במוח העמוק מבלי לגרום נזק רב מדי.
במאמר זה, פרוטוקול ניתוח מלא מוצג עבור המוח העמוק in vivo סידן הדמיה. לצורך ההדגמה, אנו מתארים ניתוחי מוח המכוונים באופן ספציפי לקליפת המוח הקדם-מצחית המדיאלית (mPFC) של מוח העכבר והקלטת הדמיית סידן in vivo באמצעות מערכת מיניסקופים שנבנתה בהתאמה אישית שפותחה על ידי קבוצתו של ד"ר לין במכון הלאומי לשימוש בסמים (NIDA/IRP)7,12. ההליך הניסיוני כולל שני ניתוחי מוח גדולים. הניתוח הראשון הוא הזרקה סטריאוטקסית של וקטור ויראלי המבטא GCaMP6f (GECI) ב-mPFC. הניתוח השני הוא להשתיל את עדשת ה-GRIN באותו אזור במוח. לאחר ההחלמה מניתוחי מוח אלה, ההליך הבא הוא להצמיד את מחזיק המיניסקופ (בסיס) על גולגולת העכבר באמצעות מלט דנטלי. In vivo ניתן לבצע הדמיה Ca2+ בכל עת לאחר הרכבת המיניסקופ על בסיסו. פרוטוקול הניתוח להזרקה ויראלית והשתלת עדשות GRIN תואם לכל מערכת הדמיה מסחרית או מותאמת אישית של פוטון יחיד ושני פוטונים עבור הדמיית הסידן in vivo במוח העמוק.
Protocol
הפרוטוקול הניסויי תואם את הנחיות הטיפול בבעלי חיים של אוניברסיטת ויומינג. העכבר שבו נעשה שימוש במחקר זה הוא זכר בן 6 חודשים C57BL/6J. ניתן להשתמש בהליך כדי להתמקד בכל אזורי המוח העמוקים להדמיית סידן in vivo . כאן, להדגמה, אזור המוח הממוקד הוא mPFC העכבר (קדמי ואחורי (A/P): 1.94 מ"מ, מדיאלי ורוחבי (M/L): 0.5 מ"מ, גב וגחון (D/V): 1.8 מ"מ). פרוטוקול זה משתנה בהתבסס על פרוטוקול21 שפורסם בעבר.
1. הזרקה סטריאוטקסית של נגיף ב-mPFC (איור 1)
- הכנה לניתוח
- לעקר את כל כלי הניתוח באמצעות אוטוקלאב ולהניח אותם על משטח סטרילי.
- הכינו מזרק של 10 μL על ידי החדרתו עם מלח ומילוי מראש ב-5 μL של מלח. הצמידו את המזרק למיקרו-פומפה (ראו טבלת חומרים).
- הפעילו את משטח החימום ושמרו על הטמפרטורה ב-35 מעלות צלזיוס.
- מקם את העכבר בתא האינדוקציה (5 אינץ' x 10 אינץ' x 4 אינץ', אורך x רוחב x גובה) עם 5% איזופלורן וקצב זרימת חמצן של 1 ליטר לדקה. שימו לב היטב וספרו את קצב הנשימה של העכבר. מוציאים את העכבר ברגע שקצב הנשימה שלו יורד ל-1 נשימה/שנייה.
הערה: ניתן לנטר בקלות את קצב הנשימה של העכבר על ידי צפייה בתנועת שרירי הגב כלפי מטה וכלפי מעלה במהלך כל שאיפה. - אפשרו לעכבר להתיישב על אזור ספסל המופרד מהאזור הכירורגי. עם קוצץ גילוח, לגלח את השיער מראש העכבר עד החוליות הצוואריות הראשונות.
- הניחו את העכבר על הבמה הסטריאוטקסית (ראו טבלת חומרים) והבטיחו את מיקומו באמצעות מוטות אוזניים ותופס אף. שמור על זרימת האיזופלורן לשלב הסטריאוטקסי בקצב זרימת החמצן של 1.5% ו-0.5 ליטר לדקה של זרימת חמצן.
- יש למרוח את משחת העיניים האופטלמית המשמן על שתי העיניים עם צמר גפן נקייה כדי למנוע יובש בעיניים במהלך הניתוח. הערך רפלקסים של דוושות בעכבר כדי לאשר שהעכבר מורדם לחלוטין לפני תחילת הניתוח.
- יש לחטא את האזור חסר השיער בתמיסת פובידון-יוד של 7.5% (ראו טבלת חומרים) ו-70% אתנול שלוש פעמים כל אחת באמצעות צמר גפן סטרילי.
- הזריקו נפח קטן (50 μL) של 2% לידוקאין מתחת לעור של האזור חסר השיער.
- בצע חתך של 2 ס"מ דרך העור לאורך קו האמצע באמצעות אזמל כדי לחשוף את למבדה ואת bregma של הגולגולת.
- הסר את החיתולית מהגולגולת בעזרת צמר גפן יבשה ומלקחיים מחודדים.
- לאחר שהברגמא והמבדה גלויים לעין, השתמשו בקצה של בור מקדחה דנטלי (בקוטר 0.5 מ"מ) כדי למדוד את קואורדינטות Z של bregma ו-lambda (ראו טבלת חומרים). התאם את גובה מחזיק האף עד שהברגמה והמבדה ישכבו באותה תנוחת Z.
- אתר את בור המקדחה הדנטלית בקוטר 0.5 מ"מ למצב של A/P: 1.94 מ"מ, M/L: 0.5 מ"מ מהברגמה. קודחים דרך הגולגולת.
הערה: כאן, להדגמה, אזור המוח הממוקד הוא mPFC העכבר. פרוטוקול זה יכול לשמש כדי להתמקד בכל אזור מוח עמוק אחר. לדוגמה, אם אזור המוח הממוקד הוא גרעין אקומבנס (NAc), המיקום המתאים צריך להיות A/P: 0.9 מ"מ, M/L: 1.2 מ"מ. - הסירו את הדורה בעזרת קצה מחט של 30 גרם ונקו את כל פיסות פסולת העצם באמצעות מלקחיים חדים בעלי זווית של 45°.
הערה: דימום נפוץ מכיוון שכלי דם קטנים עלולים להיקרע במהלך שלב הניקוי. השתמשו במטושים מכותנה סטרילית כדי לעצור את הדימום והחלו מלוחים כדי לשטוף את האזור. יש למרוח מלח על אזור הגולגולת החשוף כדי לשמור עליו לח. - טען את הנגיף לתוך מזרק המיקרוליטר באמצעות לוח הבקרה של המיקרו-פומפה. למשוך 500 nL של בועת אוויר ואחריו 800 nL של הנגיף בקצב זרימה של 50 nL/s.
הערה: לצורך ההדגמה, כאן, וירוס הקשור לאדנו סרוטיפ 1 (AAV1) המבטא GCaMP6f (GECI), AAV1-CamKII-GCamp6f, מוזרק ל- mPFC (ראה טבלת חומרים). הטיטר של הנגיף הוא 2.8 x 1013 GC/mL. השעה 1:2 מדוללת במי מלח לפני ההזרקה. - הניחו את קצה המחט בחלק העליון של הברגמא רק כדי לגעת בברגמה וציינו את קואורדינטת Z של ברגמא. הזז את המחט מעל החור שנקדח והזריק 100 nL של הנגיף כדי להבטיח שהמחט לא תהיה סתומה.
- הזיזו באיטיות את המחט לתוך רקמת המוח אל קואורדינטת Z ממוקדת של D/V: 1.75 מ"מ ואז הזיזו אותה מעט עד לקואורדינטת Z של D/V: 1.65 מ"מ.
הערה: זה כדי ליצור כיס קטן עבור הפתרון הוויראלי להיות חדור. אם אזור המוח הממוקד הוא ה-NAc, קואורדינטת ה-Z הממוקדת המתאימה של D/V צריכה להיות 4.2 מ"מ, ולאחר מכן לנוע מעט עד 4.1 מ"מ. - השתמש בלוח הבקרה כדי להגדיר את המיקרו-פומפה להזרקת 500 nL של הנגיף בקצב זרימה של 50 nL/min. לחץ על כפתור RUN בלוח הבקרה כדי להזריק את הנגיף.
הערה: ההזרקה תימשך כ-10 דקות. לאחר סיום ההזרקה, יש להמתין 5-10 דקות נוספות לפני שתוציאו את המחט מהמוח. יש למרוח לעתים קרובות מלח כדי לשמור על אזור הגולגולת החשוף לח במהלך תקופת ההזרקה. - הזיזו את המחט למעלה והחוצה מהמוח. הזריקו נפח של 500 nL פעמיים בקצב זרימה של 50 nL/s.
הערה: שלב זה מאשר כי נפח תקין של הנגיף ניתן לתוך המוח. במהלך 500 זריקות nL הראשונות, הנגיף משתחרר, ואחריו בועות אוויר. במהלך ההזרקה השנייה של 500 nL, בועות אוויר מופיעות לראשונה, ואחריהן מי מלח. המזרק מוכן כעת לטעון את הווירוס עבור העכבר הבא. לאחר סיום הניתוח, מזרק המיקרוליטר והמחט מנוקים ביסודיות עם אצטון ואחריו מלח. - מסדרים את קצוות העור וסוגרים בזהירות את החתך עם תפר (מידה 4.0). יש למרוח משחה אנטיביוטית על האזור התפור כדי למנוע זיהום.
- הסר את העכבר מהבמה הסטריאוטקסית והחזיר אותו לכלוב הביתי שלו. מניחים את הכלוב הביתי באינקובטור של 33 מעלות צלזיוס עד שהעכבר אמבולטורי.
הערה: בדרך כלל לוקח לעכבר 10-15 דקות להתעורר מהרדמה איזופלורנית לפני שהוא מתחיל לנוע. - לאחר שהעכבר מתחיל לנוע, תנו תרופות נוגדות דלקת לא סטרואידליות במשך 3 ימים לאחר הניתוח (ראו טבלת חומרים). תנו לעכבר להתאושש מהניתוח במשך 14 יום לפני שתמשיך בהשתלת עדשת GRIN.
2. השתלת עדשת GRIN ב-mPFC (איור 1)
- הכנה לניתוח
- הכן את הנוזל השדרתי המלאכותי (ACSF) המכיל 124 mM של NaCl, 2.5 mM של KCl, 1.25 mM של NaH2PO4, 1.2 mM של MgCl2, 25 mM של גלוקוז, 26 mM של NaHCO3 ו 2.4 mM של CaCl2.
- לעקר את כל כלי הניתוח באמצעות אוטוקלאב ולהניח אותם על משטח סטרילי.
- הפעילו את משטח החימום ושמרו על הטמפרטורה ב-35 מעלות צלזיוס.
- ממיסים 1% אגרוז ושומרים אותו באמבט מים בטמפרטורה של 42 מעלות צלזיוס עד לשימוש.
הערה: ניתן לשמור את האגרוז המומס באמבט המים במשך כמה שעות. - יש לחטא עדשת GRIN (בקוטר של 1 מ"מ, באורך של 4.38 מ"מ, איור 2A) ב-70% אתנול למשך 15 דקות, ולהעביר אותה לצינור מלא במי מלח כדי לשטוף אותה כראוי לפני ההשתלה.
הערה: עדשות GRIN (ראו טבלת חומרים) מיוצרות באמצעות חילופי כסף וליתיום-יון במשקפיים מיוחדים, מה שהופך אותן ללא רעילות וידידותיות לנוירונים 6,7. עם זאת, עדשות GRIN רבות הזמינות באופן מסחרי עלולות לזלוג לשאריות רעילות, ולגרום לניוון עצבי, מה שהופך אותן לבלתי מתאימות להשתלה במוח החי למחקרי הדמיה in vivo ארוכי טווח. עדשות GRIN אלה עשויות לדרוש ציפוי עם חומרים תואמים ביולוגית כמו פארילן-C כדי למנוע תופעות לוואי רעילות על נוירונים שכנים22.
- שוקלים את העכבר ומרדימים אותו על ידי הזרקה תוך-צפקית של תערובת קטמין/קסילאזין (ראו טבלת חומרים) (קטמין:100 מ"ג/ק"ג; קסילאזין: 15 מ"ג/ק"ג).
הערה: עכבר במשקל 30 גרם דורש 300 μL של תערובת קטמין/קסילאזין (קטמין 100 מ"ג/מ"ל וקסילאזין 1.5 מ"ג/מ"ל) עבור המינון הראשוני ו-150 μL של קטמין (10 מ"ג/מ"ל) למינונים נוספים במהלך הניתוח. כדי לשמור על העכבר נשאר מורדם במהלך כל התהליך הכירורגי, יש לתת מינונים נוספים של קטמין (50 מ"ג/ק"ג) לפחות פעם בשעה. שלב ההרדמה של העכבר צריך להיות מנוטר לעתים קרובות על ידי הערכת רפלקסים של דוושות. - לגלח את השיער מהאזור הכירורגי באמצעות מכונת גילוח ולנקות את השיער באמצעות מגבת נייר רטובה.
- הניחו את העכבר בשלב הסטריאוטקסי והבטיחו את מיקומו על ידי הידוק קליפס האף ומוטות האוזניים. יש למרוח משחת עיניים משומן על שתי העיניים עם מטוש כותנה סטרילי. ודא שהעכבר מורדם באופן מלא על ידי הערכת רפלקסים של דוושות.
- יש לחטא את האזור חסר השיער בתמיסה של 7.5% פובידון-יוד ו-70% אתנול שלוש פעמים כל אחת באמצעות צמר גפן סטרילי. נהלו 2 מ"ג/ק"ג של דקסמתזון תוך שרירי בירך כדי להפחית את הסיכון לנפיחות ודלקת הקשורות לניתוח.
- הזריקו 50 μL של 2% לידוקאין מתחת לעור של אזור הניתוח.
- השתמשו במספריים עדינים כדי לבלום אזור עור משולש בגודל 1.5 ס"מ (גובה) x 1.0 ס"מ (בסיס), מהצד הקדמי בין העיניים לצד האחורי שמאחורי הלמבדה.
- הסר את רקמת הפריוסטאום מהגולגולת באמצעות מלקחיים עדינים, מיקרו-להב ומטושים מכותנה.
הערה: יש לנקות ולייבש את הגולגולת ביסודיות לפני ביצוע הצעד הבא. - יש למרוח ציאנואקרילט (ראו טבלת חומרים) על שולי העור ולהצמיד את העור לגולגולת. יש להמתין 5 דקות עד שהציאנואקרילט יתייבש.
- בעזרת קצה בור מקדחה בקוטר 0.5 מ"מ, יישרו את הברגמה והמבדה באותו מישור אופקי על ידי התאמת גובה קליפס האף.
- אתרו בור מקדחה דנטלי (בקוטר 1.2 מ"מ) למיקום של A/P: 1.94 מ"מ, M/L: 0.8 מ"מ מהברגמה. קודחים דרך הגולגולת. הסירו את הדורה בעזרת קצה מחט של 30 גרם ונקו את כל פיסות פסולת העצם באמצעות מלקחיים חדים בעלי זווית של 45°.
הערה: פסולת עצם זו יכולה לחסום את שלב השאיפה הבא אם לא תוסר לחלוטין. - חברו מחט בעלת קצה קהה מלוטש ידנית של 27 גרם (איור 2B) למחזיק המחט, המחוברת לזרוע רובוטית מוטה בזווית של 10° (איור 2C). חברו את הקצה השני של מחזיק המחט למערכת הוואקום הביתית.
הערה: הזרוע הרובוטית (ראו טבלת חומרים) פותחה על ידי קבוצתו של ד"ר לין ב-NIDA/IRP ונשלטת על ידי תוכנה שפותחה בהתאמה אישית, כיום בגישה פתוחה, AutoStereota (https://github.com/liang-bo/AutoStereota)23 - אתרו את קצה המחט רק כדי לגעת בברגמא. הגדר את קואורדינטת Z של bregma ל- 0 על ידי לחיצה על לחצן Bregma ב- AutoStereota.
- הגדר את ערך הקלט X ל- 0.8, ערך הקלט Y ל- 1.94, ערך הקלט Z ל- 1.0 ולאחר מכן לחץ על לחצן חיפוש כדי להעביר את המחט לחלק העליון של החור שנקדח בגולגולת.
- התאם את מיקום המחט למרכז אזור רקמת המוח החשופה באמצעות AutoStereota.
הערה: כדי להזיז את המחט לכיוונים רוחביים או מדיאליים, הזן את הערך שלב ולחץ על הלחצנים Lateral או Medial ב- AutoStereota. באופן דומה, כדי להזיז את המחט בכיוונים קדמיים או אחוריים וגבריים או גחוניים, לחץ על כפתורי Rostral או Caudal ו- Dorsal או Ventral, בהתאמה. - הפעילו את הוואקום והתחילו לשטוף את אזור המוח החשוף באמצעות ACSF דרך מערכת צינורות מבוקרת כבידה (ראו טבלת חומרים) המחוברת למחט של 30 גרם עם קצה כפוף. ACSF מבעבע באופן רציף עם תערובת גזים של 95% O2 ו-5% CO2 ומסונן דרך מסנן של 0.2 מיקרומטר.
הערה: קצב זרימת ACSF הוא ~ 1.5 מ"ל לדקה. לחץ הפלט של תערובת הגז נשמר על ~ 3 psi. - לשאוף רקמת המוח שכבה אחר שכבה בעזרת תוכנת AutoStereota (תרשים 3).
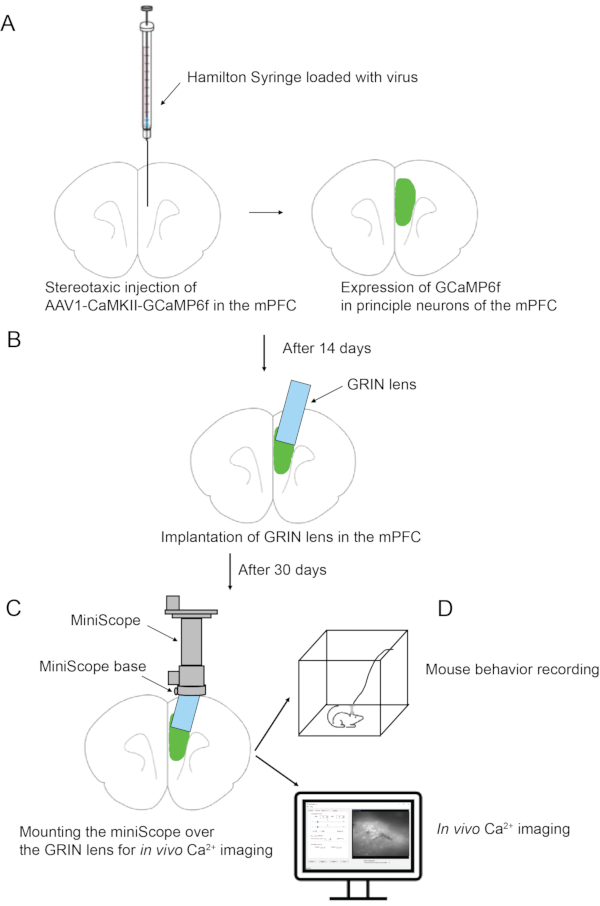
הערה: שאיפת רקמת המוח הושלמה ב -4 סיבובים כך שנוצר כיס עמודה (1.8 מ"מ עומק וקוטר 1 מ"מ).- בהפעלה "zStep", לחץ ובדוק את השורה הראשונה והשנייה. הגדר את הערכים עבור השורה הראשונה ל- 0.2 ו- 1. הגדר את הערכים עבור השורה השנייה ל- 0.15 ו- 4 (איור 3A).
- בהפעלה "מצב", הגדר את גודל המחט 27 מד ו- 1.2, הגדר את Dims 0.9. כל הערכים האחרים משתמשים בערכי ברירת מחדל (איור 3A).
- לחץ ברצף על הלחצנים 'הגדר', 'שמור אפס' ו'התחל' כדי להתחיל את השאיפה.
הערה: זהו סיבוב 1st של שאיפה. ערכי קלט מצביעים על כך שעומק השאיפה הוא 0.2 מ"מ (מקואורדינטת Z של 0) במהלך הצעד הראשון עם שכבה אחת; במהלך השלב השני, עומק השאיפה הוא 0.15 מ"מ, חוזר על עצמו ללא הרף במשך 4 שכבות. רזולוציית השאיפה היא 1.2, והקוטר הוא 0.9 מ"מ. במהלך השאיפה, ניתן לעקוב אחר המיקום המיידי של קצה המחט באמצעות לוח גרף המסלול. לאחר השלמת סיבוב שאיפה זה, נוצר כיס עמוד עם עומק 0.8 מ"מ וקוטר 1 מ"מ. קצה המחט יחזור למרכז עם קואורדינטת Z של 0. - בהפעלה "zStep", לחץ ובדוק את השורה הראשונה והשנייה. הגדר את הערכים עבור השורה הראשונה ל- 1 ו- 1. הגדר את הערכים עבור השורה השנייה ל- 0.15 ו- 4 (איור 3B).
- בהפעלה "מצב", שמרו על כל הערכים זהים לסיבוב הקודם (איור 3B).
- לחץ ברצף על הלחצנים 'הגדר', 'שמור אפס' ו'התחל' כדי להתחיל את השאיפה.
הערה: זהו הסיבובהשני של השאיפה. ערכי קלט מצביעים על כך שעומק השאיפה הוא 1 מ"מ (מקואורדינטת Z של 0) במהלך הצעד הראשון עם שכבה אחת; במהלך השלב השני, עומק השאיפה הוא 0.15 מ"מ, חוזר על עצמו ללא הרף במשך 4 שכבות. לאחר השלמת סיבוב שאיפה זה, נוצר כיס העמוד עם עומק 1.6 מ"מ וקוטר 1 מ"מ. - בהפעלה "zStep", לחץ ובדוק את השורה הראשונה בלבד. הגדר את הערכים עבור השורה הראשונה ל- 1.8 ו- 1 (איור 3C).
- בהפעלה "מצב", הגדר גודל מחט 27 מד ו- 2.2. כל שאר הערכים נשארים זהים לאלה של הסיבוב הקודם (איור 3C).
- לחץ ברצף על הלחצנים 'הגדר', 'שמור אפס' ו'התחל' כדי להתחיל את השאיפה.
הערה: זהו הסיבובהשלישי של השאיפה. ערכי קלט מצביעים על כך שעומק השאיפה הוא 1.8 מ"מ (מקואורדינטת Z של 0) עם שכבה אחת. החלטת השאיפה היא 2.2. לאחר השלמת סיבוב שאיפה זה, נוצר כיס העמוד עם עומק 1.8 מ"מ וקוטר 1 מ"מ. - בהפעלה "zStep", לחץ ובדוק את השורה הראשונה בלבד. הגדר את הערכים עבור השורה הראשונה ל- 1.6 ו- 1 (איור 3D).
- בהפעלה "מצב", הגדר את גודל המחט 27 מד ו- 2.2, הגדר את Dims 0.6 (איור 3D).
- לחץ ברצף על הלחצנים 'הגדר', 'שמור אפס ' ו'התחל ', כדי להתחיל את השאיפה.
הערה: זהו הסיבובהרביעי של השאיפה. מטרת שלב זה היא לנקות את הדם שנצבר בכיס. דימום נפוץ כאשר כלי דם קטנים נקרעים במהלך תהליך השאיפה. כדי לנקות ביסודיות את הדם, להפסיק את ההשקיה של ACSF במשך 5 דקות ולאחר מכן להפעיל שוב את ההשקיה. חזור על הסיבובהרביעי של השאיפה מספר פעמים עד שהכיס נקי מדם. ניתן להשתמש בפרוטוקול זה כדי להתמקד באזורים אחרים במוח העמוק. לדוגמה, אם אזור המוח הממוקד הוא ה-NAc, קואורדינטת ה-Z המתאימה הסופית של D/V צריכה להיות 4.4 מ"מ.
- עצור את הוואקום וההשקיה של ACSF. הביאו את המחט ל+2 מ"מ קואורדינטות Z ו-0.5 מ"מ קדמיות למרכז. מכניסים את עדשת ה-GRIN הסטרילית בקוטר 1 מ"מ לכיס.
- שמרו על קצה המחט במגע עם עדשת ה-GRIN החשופה כדי להבטיח שעדשת ה-GRIN תתמקם בזווית של 10°. לחץ בעדינות על המשטח העליון של עדשת GRIN עם נייר טישו רך סטרילי כדי להבטיח שהמשטח התחתון של עדשת GRIN נמצא במגע עם רקמת המוח.
- יש למרוח את האגרוז המומס במרווח שבין עדשת ה-GRIN לרקמת המוח בעזרת מרית. לאחר שאגרוז יוצר ג'ל, הסר עודף אגרוז באמצעות מיקרו-להב.
- נקו את הגולגולת ביסודיות עם מלחים ומטושים מכותנה. אפשרו לגולגולת להתייבש לפני היישום הבא של המלט הדנטלי (ראו טבלת חומרים).
- הוציאו את הערבוב היטב ממקפיא של -20 מעלות צלזיוס. מערבבים את אבקת המלט הדנטלית ואת נוזל הזרז ומניחים שכבה של מלט שרף דבק מרפא את עצמו על הגולגולת; ראשית, הקף את עדשת GRIN ולאחר מכן כיסה את כל הגולגולת החשופה.
- המתן 5 דקות ותן לו להתקשות לחלוטין. הסר את מחט השאיפה בזהירות.
- בבאר פלסטיק נקייה, מערבבים אבקת מלט דנטלית, פחם שחור עם נוזל, ומורחים שכבה דקה של התערובת על גבי השכבה הראשונה של המלט הדנטלי. חכו 5 דקות כדי לתת לו להתקשות.
- הגן על עדשת ה-GRIN החשופה על-ידי כיסויה בפקק מותאם אישית העשוי מצינור PCR (איור 2D). יש למרוח ציאנואקרילט כדי לחבר את המכסה למלט הדנטלי.
- הזריקו 1 מ"ל של מלח תת-עורי מוכן מראש לעכבר ואחריו 0.1 מ"ג/ק"ג של בופרנורפין. הניחו את העכבר בחזרה בכלוב הביתי שלו. מניחים את הכלוב הביתי באינקובטור של 33 מעלות צלזיוס ומנטרים את העכבר עד שהוא אמבולטורי. בדרך כלל לוקח לעכבר 20-40 דקות להתעורר מהרדמה לפני שהוא מתחיל לנוע.
- מתן תרופות נוגדות דלקת לא סטרואידליות ועקוב אחר העכבר במשך 3 ימים לפחות לאחר הניתוח. תן לעכבר להתאושש מהניתוח במשך 30 יום.
3. הצמדת מחזיק מיניסקופ (בסיס) לגולגולת העכבר (איור 1)
- מרדימים את העכבר בתא אינדוקציה עם 5% איזופלורן וקצב זרימת חמצן של 1 ליטר/דקה עד שקצב הנשימה שלו יורד לנשימה אחת לשנייה.
- הניחו את העכבר בשלב הסטריאוטקסי והבטיחו את מיקומו באמצעות מוטות אוזניים ותפסני אף. שמרו על זרימה רציפה של איזופלורן (1.5%) וחמצן (0.5 ליטר לדקה).
- יש למרוח משחה אופטלמית על עיניה כדי לשמור על לחותן. הפעילו את משטח החימום ושמרו על הטמפרטורה ב-35 מעלות צלזיוס. ודא שהעכבר מורדם באופן מלא על ידי הערכת רפלקסים של דוושות.
- הסר את המכסה המכסה את עדשת GRIN בעדינות באמצעות מלקחיים מחודדים. קדחו את שאריות הציאנואקרילט המיובשות מהמלט הדנטלי באמצעות מיקרודריל (ראו טבלת חומרים).
- חותכים את השיער סביב אזור הבטון הדנטלי עם מספריים קטנים. נקו את הפסולת בעזרת אבק אוויר דחוס. השתמשו במטוש כותנה טבול באצטון כדי לנקות את המשטח העליון של עדשת GRIN.
- הכן את המיניסקופ עם המחזיק שלו (בסיס).
- הניחו אום מס' 00-90 הקסדצימלי (ראו טבלת חומרים) בחריץ הקיים בבסיס והחלו ציאנואקרילט כדי לאבטח אותו שם (איור 2E).
- מרחו סרט פוליאתילטרפלואורואתילן (PTFE) בחוזקה סביב חוט המיניסקופ וגזרו את הקלטת הנוספת (איור 2F).
- הדקו את המיניסקופ לבסיס והשתמשו בבורג הנעילה כדי להדק את המיניסקופ לבסיס (איור 2G).
- חבר את המיניסקופ לכבל שלו והפעל את התוכנה שפותחה בהתאמה אישית, הנמצאת כעת בגישה פתוחה, NeuView (ראה טבלת חומרים).
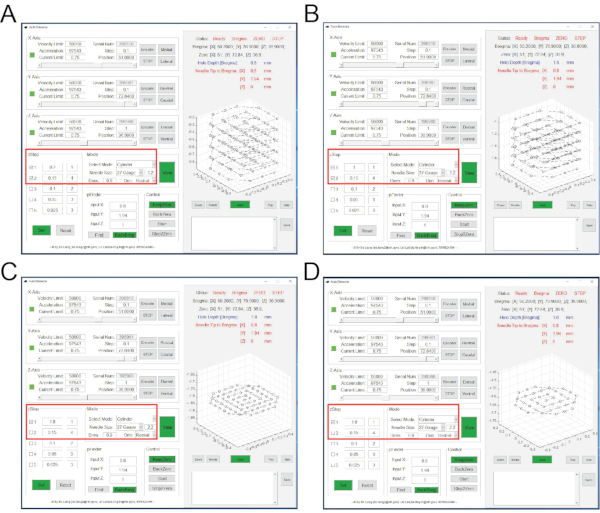
הערה: תוכנת NeuView פותחה בהתאמה אישית להדמיית סידן in vivo של מיניסקופ מקבוצתו של ד"ר לין ב-NIDA/IRP 7,12. זוהי גישה פתוחה (https://github.com/giovannibarbera/miniscope_v1.0). - ב-NeuView, לחץ על חומרה, בדוק את LED1 ולחץ על לחצן הזרם כדי להציג את התמונות החיות (איור 4A). כדי להפסיק את ההזרמה בשידור חי, לחץ על עצור כפתור.
- הניחו את המיניסקופ בזרוע אוחזת במיניסקופ שנבנה בהתאמה אישית (איור 2H) שאת מיקום ה-XYZ שלה ניתן לתמרן באמצעות בקרים ממונעים (איור 2I).
- אתרו את המיניסקופ ממש מעל עדשת ה-GRIN החשופה והפכו אותו למקביל לפני השטח של העדשה. הורידו באיטיות את המיניסקופ לכיוון עדשת ה-GRIN והתאימו את מיקום ה-Z שלו עד שיימצא מישור המיקוד הטוב ביותר.
הערה: מישור המוקד הטוב ביותר נקבע על ידי השוואת מספר מיקומי Z אפשריים ובחירת מישור המוקד עם הדמיה ברורה של רוב גופי התא. - יש למרוח בזהירות את השכבה הראשונה של מלט דנטלי סביב בסיס המיניסקופ מבלי לשנות את מיקום המיניסקופ. לאחר הקשחת המלט, הסר בעדינות את הזרוע המחזיקה כך שהמיניסקופ יוכל לעמוד בפני עצמו על ראש העכבר.
הערה: המלט הדנטלי נוטה להתכווץ לאחר ההתקשות, והוא יגרור את המיניסקופ מטה הרחק ממישור המיקוד המקורי. בדרך כלל מיקום המיניסקופ Z מורם מעט מעל מישור המוקד המקורי לפני מריחת מלט דנטלי כדי לפצות על השינוי הפוטנציאלי. - יש למרוח שכבה שנייה של מלט דנטלי סביב הבסיס כדי למלא את כל הפערים ולוודא שאין דליפת נורת LED מהמרווחים. תנו למלט הדנטלי להתקשות.
- הסר את העכבר מהשלב הסטריאוטקסי. שחררו את בורג הנעילה ונתקו את המיניסקופ מהבסיס. הכניסו לבסיס מכסה מגן מודפס בתלת-ממד כדי להגן על עדשת ה-GRIN החשופה והידקו את בורג הנעילה בבסיס (איור 2J).
- הניחו את העכבר בחזרה בכלוב הביתי שלו.
הערה: בדרך כלל לוקח לעכבר 10-15 דקות להתעורר מהרדמה איזופלורנית לפני שהוא מתחיל לנוע.
4. הרכבה של מיניסקופ והדמיית in vivo Ca2+ (איור 1)
- הרכיבו את המיניסקופ לבסיסו
- מרדימים את העכבר לזמן קצר בתא האינדוקציה (5% איזופלורן וקצב זרימת חמצן של 1 ליטר/דקה). הניחו את העכבר על משטח ספסל נקי.
- שחררו את בורג הנעילה באמצעות מברג קטן, הסירו את מכסה המגן ונקו את פני השטח של עדשת ה-GRIN בעזרת צמר גפן ספוגת אצטון.
- עוטפים סרט PTFE בחוזקה סביב חוט המיניסקופ ומהדקים את המיניסקופ לבסיסו על ראש העכבר.
- חברו את המיניסקופ לכבל (איור 2K), הפעילו את תוכנת NeuView.
- ב-NeuView, לחץ על חומרה, בדוק את LED1 ולחץ על לחצן הזרם כדי להציג את התמונות החיות (איור 4A).
- זהה את מישור המוקד הטוב ביותר על ידי התאמת מיקום המיניסקופ ביחס לבסיס, או הידוק קל או התרופפות בעזרת מלקחיים קהים.
הערה: מישור המוקד הטוב ביותר נקבע על ידי השוואת מספר מיקומים אפשריים ובחירת אחד עם הדמיה ברורה של רוב גופי התא. - הידקו את בורג הנעילה והחזירו את העכבר לכלוב הביתי שלו.
- ב-NeuView, התאימו את עוצמת תאורת ה-LED לרמה האופטימלית. לחץ על לכידה ולאחר מכן הפעל לחצנים כדי להתחיל להקליט ולחץ על עצור לאחר 150 פריימים.
הערה: ההספק הנמוך ביותר האפשרי קובע את הרמה האופטימלית של עוצמת ה-LED להשגת תמונה בהירה מספיק. מטרת הקלטת סרטון קצר היא להקל על זיהוי אותו מישור מוקד בעתיד להדמיה חוזרת ונשנית. - נתק את הכבל מהמיניסקופ. תן לעכבר להתאושש לפחות 30 דקות לפני תחילת הניסוי.
הערה: כדי להגן על המיניסקופ, בדרך כלל, בקבוק המים ומזין המזון חוט מוסרים במהלך פרק זמן קצר זה. אם העכבר צריך להישאר בכלוב הביתי שלו זמן רב יותר, מומלץ לספק ג'ל תזונה זמין מסחרית (ראו טבלת חומרים) בכלוב הביתי.
- איסוף נתונים להדמיית סידן in vivo
הערה: הדמיית סידן In vivo יכולה להתבצע בו זמנית יחד עם כל בדיקות ההתנהגות שהחוקר חפץ בהן. לצורך ההדגמה, הדוגמה כאן היא הדמיית in vivo Ca2+ במהלך בדיקת שדה פתוח. כדי להשיג מטרה זו, נדרשים שני מחשבים. מחשב אחד מצויד בתוכנה מסחרית (ראה טבלת חומרים) כדי לשלוט במצלמה כדי לתעד התנהגות עכבר באופן אוטומטי. המחשב השני מצויד ב- NeuView כדי לשלוט במיניסקופ ולהקליט את תמונות Ca2+ .- הפעל את תוכנת מצלמת ההתנהגות (ראה טבלת חומרים) כדי להציג את זירת התנהגות העכבר באמצעות פונקציית שידור חי. כוונו באופן ידני את המיקוד של המצלמה העליונה (איור 2L).
- בחר טריגר/סטרוב ובדוק "הפעל/השבת את ההדק" (איור 4B). לחץ על הקלט כפתור, השתמש בעיון כדי לבחור את המיקום שבו יישמרו הקלטות התנהגות, בחר את תבנית התמונה הרצויה.
הערה: הפונקציה "בקרת טריגר" מופעלת כדי לאפשר הפעלת הקלטת ההתנהגות על-ידי תוכנת NeuView, כך שמסגרות ההתנהגות ומסגרות הדמיית הסידן המתאימות יצורמדו זו לזו באופן זמני. ניתן לשמור את הקלטת אופן הפעולה בכל פורמט רצוי. הקלטת אופן הפעולה נשמרת בדרך כלל בתבנית JPEG בתיקיה המיועדת. - קירבו את העכבר לזירה וחברו את המיניסקופ לכבל המקושר למערכת איסוף הנתונים (איור 2L) (ראו טבלת חומרים). העכבר ממוקם לאחר מכן במרכז הזירה.
- עם פונקציית ההזרמה החיה של תוכנת NeuView, התאם את עוצמת ה-LED כדי למטב את הבהירות של תמונת הסידן.
הערה: עבור הדמיית סידן, קצב הפריימים של ההקלטה הוא 10 פריימים לשנייה כברירת מחדל. - ב- NeuView, בטל את הסימון של LED1, לחץ על לכידה ולאחר מכן הפעל את הלחצנים כדי להתחיל להקליט, ולחץ על עצור לאחר 100 פריימים.
הערה: זה כדי להקליט תמונות רקע במשך כ-100 פריימים עם תאורת LED כבויה. - בתוכנת מצלמת ההתנהגות, לחץ על התחל הקלטה (איור 4C). ב- NeuView, בדוק את LED1, לחץ על לכידה ולאחר מכן הפעל את הלחצנים כדי להתחיל להקליט. לחץ על עצור אחרי 3000 פריימים.
הערה: זה כדי לתעד הדמיה והתנהגות של סידן בו זמנית. המבחן בשטח פתוח הוא באורך של 15 דקות, ובדרך כלל מחולק לשלושה מפגשי הקלטה כל אחד של 5 דקות. זאת כדי למנוע מהמיניסקופ להתחמם יתר על המידה עקב שימוש מתמשך. - שמור גם את הדמיית הסידן וגם את הקלטות ההתנהגות בתיקיות המיועדות. חזור על ההקלטה לשני סשנים נוספים תוך כדי הקלטת הרקע לפני כל הפעלה ושמור את כל ההקלטות בתיקיה המיועדת.
- נתקו את המיניסקופ מבסיסו.
- לאחר השלמת ההקלטה, נתקו את הכבל מהמיניסקופ.
- מרדימים את העכבר לזמן קצר בתא האינדוקציה (5% איזופלורן ו-1 ליטר/דקה של קצב זרימת חמצן). הניחו את העכבר על משטח נקי וחם.
- פתחו את בורג הנעילה בבסיס ונתקו את המיניסקופ מהבסיס. החזירו את מכסה המגן מעל הבסיס והידקו את בורג הנעילה. החזירו את העכבר לכלוב הביתי שלו.
תוצאות
איור 1 מראה את ההליך הניסויי הסכמטי, הכולל הזרקה נגיפית, השתלת עדשת GRIN, הצמדת בסיס המיניסקופ לגולגולת העכבר והדמיית סידן in vivo באמצעות מיניסקופ. ההליך כולו אורך כחודשיים. איור 2 מראה את המרכיבים העיקריים המתוארים בפרוטוקול להדמיית סידן in vivo של מיניסקופ. איור 3 מציג את הממשקים של תוכנת AutoStereota במהלך השתלת עדשת GRIN. איור 4 מציג את הממשקים של NeuView ואת תוכנת הקלטת ההתנהגות במהלך הדמיית סידן in vivo.
התוצאה של הדמיית סידן in vivo תלויה בהצלחתם של ניתוחי הזרקה נגיפית והשתלת עדשות GRIN. איור 5 מראה מגוון של תוצאות (כלומר, לא מוצלחות, לא אופטימליות וטובות) מרישומי הדמיית סידן in vivo . במקרים לא מוצלחים, תמונת הסידן יכולה להיראות כהה או בהירה, אך בדרך כלל חושפת לא או מעט מאוד נוירונים פעילים. בדרך כלל איננו ממשיכים בניסויים ברישום סידן in vivo אם יש פחות מחמישה תאי עצב פעילים. הדמיית סידן in vivo טובה חושפת בדרך כלל כמה מאות נוירונים פעילים. אם הקלטה מכילה פחות ממאה תאי עצב פעילים, אנו רואים בה הקלטה לא אופטימלית.
הן בהקלטות לא אופטימליות והן בהקלטות טובות בוצעו ניסויי הדמיית סידן in vivo , וניתוח הנתונים שלאחר מכן בוצע. סרט 1 מציג הקלטה מייצגת של הדמיית סידן in vivo מ-mPFC של העכבר. סרטוני התנהגות ונתוני הדמיית סידן מעובדים בדרך כלל בנפרד. ניתן להבקיע באופן ידני סרטוני התנהגות עכבר. קבצי הדמיית סידן מעובדים באמצעות ארגז הכלים לעיבוד תמונה של סידן CaImAn24. איור 6 מראה מפת תאים מייצגת וכמה עקבות סידן מרישום טוב של הדמיית סידן in vivo .
לאחר השלמת הדמיית הסידן in vivo , השלב האחרון הוא לאשר אם ההזרקה הנגיפית והשתלת עדשת GRIN התרחשו באזור המוח הרצוי. לשם כך, העכבר הוחדר עם מלח בעל מאגר פוספט (PBS) ואחריו 4% פרפורמלדהיד (PFA). מוח העכבר נקטף, הוצב ב-4% PFA במשך 12 שעות, ואוחסן ב-PBS בטמפרטורה של 4 מעלות צלזיוס. מוח העכבר נחתך אז לפרוסות בעובי 50 מיקרומטר עם ויברטום. פרוסות המוח הוכתמו ב-DAPI ונצפו תחת המיקרוסקופ (לא מתואר בפרוטוקול)12. איור 7 הוא פרוסת מוח של עכבר בגודל של כ-1.94 מ"מ קדמית לברגמא מעכבר ניסיוני, ומראה את המסלול שבו הושתלה עדשת ה-GRIN. אזור הפלואורסצנציה הירוק מתחת למסלול עדשות GRIN ובסביבתו מציין את הביטוי של GCaMP6f באזור mPFC.
איור 1: סקירה סכמטית של ההליך הניסיוני. (B) השתלת עדשת GRIN ב-mPFC. (C) הצמדת בסיס מיניסקופ לגולגולת העכבר. (D) הרכבה של מיניסקופ והדמיית סידן in vivo. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: רכיבים עיקריים הדרושים להדמיית סידן in vivo . (A) עדשת GRIN בקוטר 1 מ"מ ובאורך 4.38 מ"מ. (B) מחט קהה בעלת קצה קהה מלוטשת באורך 27 גרם המשמשת לשאיפת רקמת המוח. (C) הזרוע הרובוטית המוצמדת למחזיק המחט. (D) מכסה מותאם אישית מצינור PCR להגנה על עדשת ה-GRIN החשופה עד להצמדת בסיס מיניסקופ על גולגולת העכבר. (E) מחזיק המיניסקופ (בסיס) עם אום הקסדצימלי. (F) מיניסקופ שחלק החוט שלו עטוף בקלטת PTFE. (G) מיניסקופ מהודק לבסיסו באמצעות בורג נעילה. (ח) המיניסקופ האוחז בזרועו. (I) בקר ממונע תלת-ממדי שנבנה בהתאמה אישית ומשמש להקלה על תנועת המיניסקופ במיקומי XYZ. (J) מכסה מגן מהודק על הבסיס כדי להגן על עדשת ה-GRIN החשופה בזמן שהעכבר אינו מבצע הדמיית סידן in vivo . (K) המיניסקופ המחובר לכבל. (L) מערכת רכישת הנתונים להדמיה in vivo Ca2+ . אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 3: ממשקים של תוכנת AutoStereota במהלך שאיפת רקמת מוח שכבה אחר שכבה. (B) הממשק המתאים לשלבים 2.17.4 עד 2.17.6. (C) הממשק המתאים לשלבים 2.17.7 עד 2.17.9. (ד) הממשק המתאים לשלבים 2.17.10 עד 2.17.12. תיבות אדומות מדגישות את ערכי הקלט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 4: הממשקים של תוכנת NeuView ותוכנת הקלטת ההתנהגות במהלך הדמיית סידן in vivo . (A) הממשק של NeuView. (ב,ג) הממשקים של תוכנת הקלטת ההתנהגות. תיבות אדומות מדגישות לחצנים שיש ללחוץ עליהם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
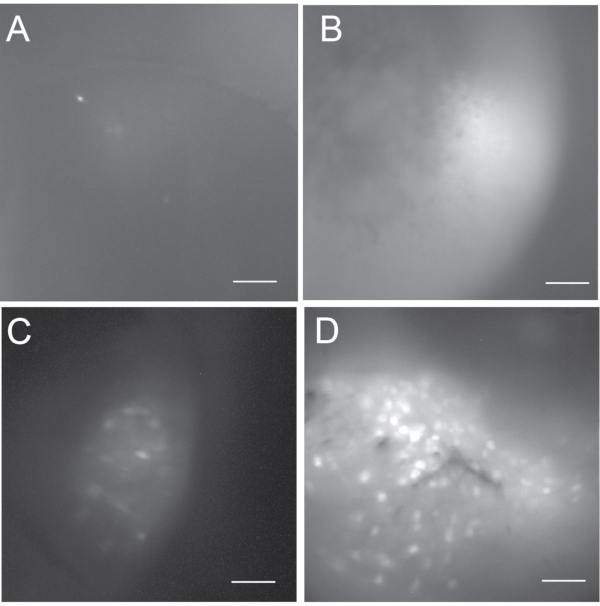
איור 5: הקרנה מקסימלית של תאים פלואורסצנטיים ממפים כדי להראות את טווח התוצאות האפשריות. (A) הוא כהה ומכיל פחות מ-5 תאי עצב פעילים. (B) הוא בהיר אך אין לו נוירונים פעילים. (C) מפת התאים מהדמיית סידן in vivo תת-אופטימלית המכילה כמה תאי עצב פעילים. (D) מפת התאים מהדמיית סידן in vivo טובה הכוללת כמה מאות נוירונים פעילים. סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
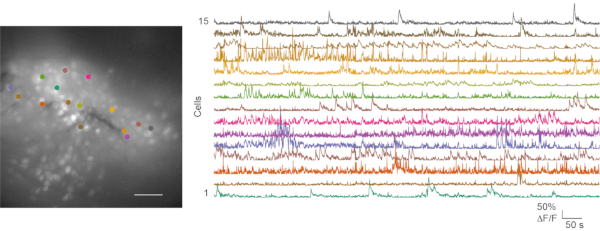
איור 6: מפת תאים מייצגת וחולף סידן מהדמיית סידן in vivo מוצלחת. הפאנל השמאלי הוא מפת התאים הפלואורסצנטיים של ההקרנה המקסימלית מהקלטת הדמיית סידן in vivo ב-mPFC במהלך בדיקת שדה פתוח. ההקלטה נמשכת 5 דקות. הפאנל הימני מציג ארעי סידן מ-15 אזורי עניין (תואמי צבע). סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
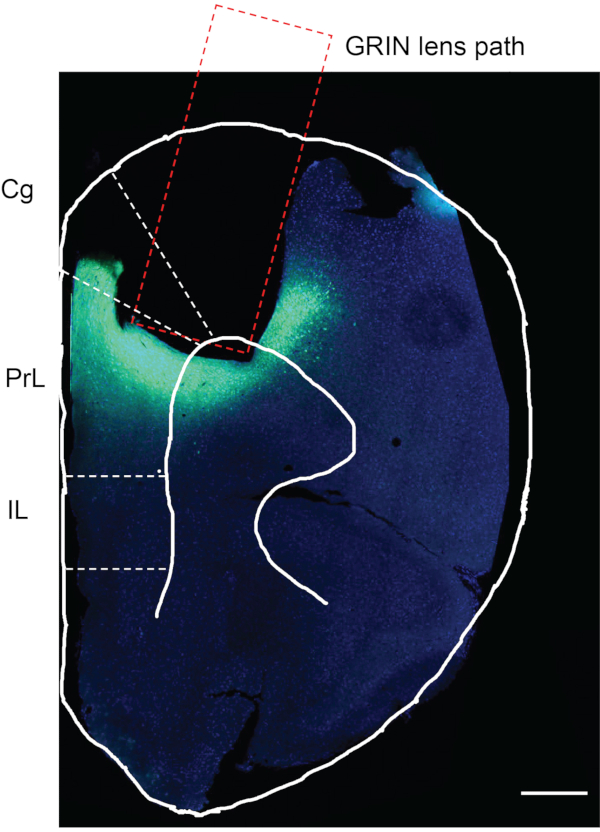
איור 7: הערכה לאחר המוות של עכבר ניסיוני. ההערכה שלאחר המוות עבור ביטוי GCaMP6f והשתלת עדשת GRIN ב- mPFC של עכבר ניסיוני. האזור המלבני מציין את הנתיב להשתלת עדשת GRIN. האזור הירוק שמתחת לאזור המושתל בעדשת GRIN מאשר כי GCaMP6f הובטא, ועדשת GRIN הושתלה בדיוק באזור המוח הרצוי. Cg, קליפת המוח הסינגולטית; PrL, קליפת המוח הפרה-לימבית; IL, קליפת המוח האינפרא-לימבית. סרגל קנה מידה: 400 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה 1: השוואות של מערכת המיניסקופים שנבנתה בהתאמה אישית ב-NIDA עם מערכות מיניסקופ אחרות 7,8,9,10,11,13,25,26. אנא לחץ כאן כדי להוריד טבלה זו.
סרט 1: הקלטת הדמיית סידן in vivo מ-mPFC של העכבר במהלך בדיקת שדה פתוח. למטרות הדגמה, סרטון זה מציג רק הקלטה של דקה אחת. קצב הפריימים המקורי של ההקלטה הוא 10 פריימים לשנייה. הסרטון מהיר פי 6 מההקלטה המקורית. אנא לחץ כאן כדי להוריד את הסרט הזה.
Discussion
שאלה מרכזית במדעי המוח היא הבנת האופן שבו דינמיקה ומעגלים עצביים מקודדים ומאחסנים מידע, וכיצד הם משתנים במחלות מוח. באמצעות מיניסקופ in vivo Ca2+ הדמיה, ניתן לנטר בו זמנית פעילות עצבית בודדת מכמה מאות נוירונים בתוך מיקרו-מעגל מקומי מבעל חיים שמתנהג באופן חופשי. כאן, פרוטוקול ניתוח מפורט להזרקה ויראלית והשתלת עדשת GRIN מתואר כדי להכין מכרסמים להדמיית מוח עמוק in vivo Ca2+ באמצעות מערכת הקלטה של מיניסקופ שפותחה בהתאמה אישית. טבלה 1 מציגה את ההשוואות של מערכת המיניסקופ שלנו עם מערכות מיניסקופ אחרות הזמינות מסחרית ובהתאמה אישית 7,8,9,10,11,13,25,26. ראוי לציין כי השתלת עדשת GRIN באמצעות הפרוטוקול הכירורגי הנוכחי תואמת לכל מערכת הדמיה מסחרית או מותאמת אישית של פוטון יחיד ושני פוטונים עבור הדמיית סידן in vivo במוח עמוק.
מהזרקה ויראלית ועד רכישת נתונים של הדמיית סידן in vivo של מיניסקופ, כל הליך הניסוי לוקח לפחות חודשיים להשלים. זהו תהליך מסובך ועתיר עבודה. ההצלחה הסופית של הניסוי תלויה במספר גורמים, כולל בחירה נכונה של GECIs, הזרקת וירוס במדויק באזור המוח הממוקד, ביטוי ויראלי מספיק באוכלוסייה העצבית הרצויה, השתלת עדשת GRIN בדיוק במיקום הרצוי, התאוששות נאותה מניתוחים, כמו גם, האם דלקת חמורה מתרחשת לאחר הניתוח, והאם התנהגות בעלי החיים מושפעת קשות מניתוחים, וכן הלאה.
שני שלבים קריטיים כוללים הזרקה סטריאוטקסית של וירוס והשתלת עדשת GRIN. לצורך ההדגמה, המיקרו-איניג'קציה הסטריאוטקסית בוצעה ב-mPFC של העכבר, כאשר נגיף הקשור לאדנו (AAV1) מקודד את GCaMP6f בשליטת מקדם CaMKII שמתייג באופן סלקטיבי נוירונים פירמידליים ב-mPFC. GCaMP6f נבחר מכיוון שהוא אחד ממדדי הסידן המהירים והרגישים ביותר עם זמן של חצי ריקבון של 71 אלפיות השנייה15. בנוסף, הביטוי הנגיפי AAV של GCaMP6f הוא ארוך טווח (כלומר, מספר חודשים), מה שהופך אותו לאידיאלי לביצוע הדמיה חוזרת ונשנית in vivo Ca2+ לאורך תקופה ארוכה עבור מחקרי אורך במודלים של עכברים של מחלות נוירודגנרטיביות27. פרוטוקול הניתוח הנוכחי יכול להיות מותאם למיקוד אוכלוסיות תאים שונות בכל אזור מוח אחר. כלים ויראליים שונים זמינים מאפשרים תיוג סלקטיבי של אוכלוסיות עצביות ספציפיות באזור המוח הרצוי בגיל הרצוי. בנוסף, חוקרים יכולים לנצל את מערכת הרקומבינציה Cre-LoxP ואת מודלי העכברים המהונדסים הזמינים השונים כדי לבצע שינויים גנטיים ולחקור את תוצאות המעגלים ההתנהגותיים והעצביים28,29.
מאפיין ייחודי אחד של הפרוטוקול המוצג הוא שהשאיפה האוטומטית של רקמת המוח שכבה אחר שכבה בוצעה לפני השתלת עדשת GRIN (בקוטר 1 מ"מ). זה מושג באמצעות מחט 27 גרם המחוברת למערכת ואקום, הנשלטת על ידי זרוע רובוטית שנבנתה בהתאמה אישית ותוכנה23. בהתבסס על הניסיון שלנו, שיטה זו יוצרת משטח אחיד לעדשת GRIN למגע וגורמת פחות נזק לרקמה השכנה מאשר שאיפת רקמות ידנית23. מסיבה זו, הליך זה מביא יתרון ברור לעדשות GRIN בקוטר רחב יחסית (למשל, 1 מ"מ). עם זאת, ייתכן ששאיפת רקמות אינה נחוצה להשתלת עדשת GRIN בקוטר קטן יותר (0.5 מ"מ או 0.25 מ"מ). במקום זאת, ניתן לשתול אותו ישירות לאורך המסלול המוביל המיוצר עם מחט 30 G21.
מלבד שני השלבים הקריטיים שנדונו לעיל, יש לשקול בזהירות גורמים רבים אחרים לצורך ניתוח מוצלח. (1) יש לעקר את כל המכשירים שבאים במגע עם המוח כדי למנוע זיהום. (2) כל שלבי הניתוח צריכים להתבצע כדי למזער את הנזק למוח כדי למנוע דלקת נוספת ויצירת רקמת צלקת מוגזמת. (3) יש לשקול בקפידה את מינוני ההרדמה שניתנו בתחילה ונשמרו במהלך הניתוח, במיוחד אלה שניתנו באופן תוך-צפקי. מינוני ההרדמה עשויים להשתנות בהתאם לזני עכברים שונים, שכן חלקם עשויים להיות רגישים יותר. (4) מצבו של העכבר צריך להיות מנוטר כל הזמן במהלך הניתוח. לבסוף, (5) העכברים צריכים להיות במעקב קבוע לאחר הניתוח, שכן סיבוכים רבים עלולים להתרחש לאחר הניתוח.
למרות שנתח של רקמת מוח מוסר באופן חד צדדי במהלך שלב השתלת עדשת GRIN, לא ראינו ליקויי התנהגות ברורים 7,12. משקלו של המיניסקופ הוא כ-2 גרם והכבל מתוכנן בהתאמה אישית כדי להפוך אותו לקליל ולהבטיח שהעכבר יוכל לשאת אותו בקלות. המיניסקופ והכבל מחוברים לחיה רק לפני הדמיית in vivo ומנותקים לאחר ההדמיה. תהליך ההדמיה כולו אורך בדרך כלל לא יותר מ-30 דקות. לכן, מכשור זה אינו מונע מהעכבר להתנהג בחופשיות. התקנת המיניסקופ ושלבי הדה-אינסטלציה זקוקים להרדמה קצרה (פחות מ-2 דקות) עם איזופלורן לצורך ריסון בעלי חיים. בדרך כלל אנו מאפשרים לעכבר להתאושש מהחשיפה הקצרה של איזופלורן למשך 30 דקות לפני ביצוע הדמיית in vivo. ביצענו הדמיית סידן in vivo של מיניסקופ פעם בשבוע במשך כמה שבועות מבלי לשים לב להשפעה כלשהי על בריאות העכברים ועל ההתנהגות החברתית של העכבר12.
מגבלה מרכזית אחת של מערכת ההקלטה הנוכחית של המיניסקופ היא הצורך לחבר את המיקרוסקופ לכבל לצורך רכישת נתונים. נוכחות הכבל מגבילה לעתים את ביצועי משימת העכבר ומגבילה את ההקלטה של חיה אחת בכל פעם. לאחרונה פותח מיניסקופ אלחוטי25,26. זה ירחיב את ביצועי המשימה ויאפשר הדמיית in vivo בו זמנית ממספר בעלי חיים בקבוצה. יתר על כן, פיתוח GECIs רגישים יותר עם אורכי גל הניתנים להפרדה ספקטרלית בשילוב עם מיניסקופ דו-צבעי יציעו אפשרויות מרגשות יותר למחקר במדעי המוח.
Disclosures
המחברים אינם מדווחים על אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכת על ידי מענקים מהמכון הלאומי לבריאות (NIH) 5P20GM121310, R61NS115161 ו- UG3NS115608.
Materials
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
References
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987 (2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173 (2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174 (2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved