Method Article
입체 택시 바이러스 주입 및 생체 내 심부 뇌를위한 그라디언트 인덱스 렌즈 이식
Erratum Notice
요약
Miniscope in vivo 칼슘 이미징은 자유롭게 행동하는 마우스에서 신경 역학과 미세 회로를 연구하는 강력한 기술입니다. 이 프로토콜은 미니 스코프를 사용하여 좋은 생체 내 칼슘 이미징을 달성하기 위해 뇌 수술을 수행하는 것을 설명합니다.
초록
소형 형광 현미경 (miniscope)은 자유롭게 행동하는 동물의 생체 내 칼슘 이미징을위한 강력한 도구입니다. 그것은 기존의 다중 광자 칼슘 이미징 시스템에 비해 몇 가지 장점을 제공합니다 : (1) 컴팩트; (2) 경량; (3) 저렴한; (4) 자유롭게 행동하는 동물로부터 녹음 할 수 있습니다. 이 프로토콜은 맞춤형 미니스코프 기록 시스템을 사용하여 심부 뇌 생체 내 칼슘 이미징을위한 뇌 수술을 설명합니다. 상기 준비 절차는 (1) 뉴런의 특정 하위군을 유전적으로 암호화된 칼슘 센서로 표지하기 위해 마우스 뇌의 원하는 뇌 영역에 바이러스를 입체화학적으로 주입하는 단계를 포함하는 세 단계로 구성된다; (2) 심부 뇌 영역에서 미니스코프 시스템으로 칼슘 이미지를 중계 할 수있는 그라디언트 인덱스 (GRIN) 렌즈의 이식; (3) 미니 스코프를 마우스 두개골 위에 부착하여 나중에 미니 스코프를 부착 할 수 있습니다. 생체 내 칼슘 이미징을 수행하기 위해 미니스코프를 홀더에 고정하고 신경 칼슘 이미지를 동시 행동 기록과 함께 수집합니다. 본 수술 프로토콜은 심뇌 생체 내 칼슘 이미징을 위한 임의의 상업적 또는 맞춤형 단일 광자 및 이광자 이미징 시스템과 호환된다.
서문
세포내Ca2+ 신호전달은 세포 성장, 증식, 분화, 이동, 유전자 전사, 분비 및 아폽토시스1의 필수 조절자이다. 뉴런에서Ca2+ 신호전달은 시공간적 패턴이 막 흥분성, 신경전달물질 방출, 시냅스 가소성2와 같은 중요한 기능과 관련이 있기 때문에 정밀하게 제어된다.
생체 내 칼슘 이미징은 정상적인 동물 행동에 대한 원소의 신경 회로 표현을 해독하고, 뇌 장애의 동물 모델에서 비정상적인 신경 활동을 식별하고, 이러한 변경된 회로를 정상화 할 수있는 잠재적 인 치료 목표를 밝히는 데 활용할 수있는 강력한 기술입니다. 두 가지 일반적인 생체 내 칼슘 이미징 시스템은 이광자 레이저 스캐닝 형광 현미경 3,4,5,6 및 헤드 장착형 소형 현미경 내시경 (miniscope) 7,8,9,10,11,12,13 입니다. . 기존의 이광자 현미경은 더 나은 해상도, 낮은 노이즈 및 낮은 광표백과 같은 명령 이점을 제공합니다. 그러나, 실험 동물은 3,4,5,6 수행 될 수있는 행동 연구를 제한하여 머리를 고정시켜야합니다. 대조적으로, 헤드 마운트 미니 스코프 시스템은 작고 휴대가 가능하여 자유롭게 행동하는 동물 7,8,9,10,11,12,13을 사용하여 다양한 행동 테스트를 연구 할 수 있습니다.
두 가지 주요 Ca2+ 지표, 화학 지표5,14 및 유전자 인코딩 칼슘 지표 (GECIs)15,16이 있습니다. Ca2+ 이미징은 표적 회로에서 뉴런의 특정 표지를 허용하는 바이러스 벡터와 함께 전달되는 매우 민감한 GECI를 사용하여 촉진되었습니다. 감도, 수명 및 세포 하부 구획을 라벨링하는 능력을 향상시키기위한 지속적인 노력으로 GECI는 다양한 생체 내 칼슘 이미징 연구 17,18,19에 이상적입니다.
이미징 중 뇌 조직에서 빛의 산란은 이광자 현미경을 사용하더라도 광학 침투를 심층적으로 제한합니다. 그러나 그라디언트 인덱스 (GRIN) 렌즈는 GRIN 렌즈가 생물학적 조직에 직접 매립되어 심부 뇌 영역의 이미지를 현미경 목표로 전달할 수 있기 때문에 이러한 문제를 극복합니다. 광학적으로 균질한 재료로 만들어진 종래의 렌즈와는 달리, 초점을 맞추고 이미지를 생성하기 위해 복잡한 형상의 표면을 필요로 하며, GRIN 렌즈 성능은 평면 표면(20)으로 초점을 달성하는 렌즈 재료 내의 점진적인 굴절률 변화에 기초한다. GRIN 렌즈는 직경 0.2mm까지 제작할 수 있습니다. 따라서 소형화된 GRIN 렌즈는 너무 많은 손상을 일으키지 않고 심뇌에 이식할 수 있습니다.
이 기사에서는 심뇌 in vivo 칼슘 이미징에 대한 완전한 수술 프로토콜이 제시됩니다. 시연을 위해, 우리는 마우스 뇌의 내측 전두엽 피질 (mPFC)을 목표로하는 뇌 수술과 국립 약물 남용 연구소 (NIDA / IRP)7,12의 린 박사 그룹이 개발 한 맞춤형 미니 스코프 시스템을 통한 생체 내 칼슘 이미징 기록에 대해 설명합니다. 실험 절차에는 두 가지 주요 뇌 수술이 포함됩니다. 첫 번째 수술은 GCaMP6f (GECI)를 발현하는 바이러스 벡터를 mPFC에 입체 적으로 주입하는 것입니다. 두 번째 수술은 GRIN 렌즈를 동일한 뇌 영역에 이식하는 것입니다. 이러한 뇌 수술에서 회복 된 후, 후속 절차는 치과 시멘트를 사용하여 마우스 두개골에 미니 스코프 홀더 (베이스)를 부착하는 것입니다. 생체 내 Ca2+ 이미징은 미니스코프를 베이스에 장착한 후 언제든지 수행할 수 있습니다. 바이러스 주입 및 GRIN 렌즈 이식을 위한 수술 프로토콜은 심뇌 생체 내 칼슘 이미징을 위한 상업적 또는 맞춤형 단일 광자 및 이광자 이미징 시스템과 호환됩니다.
프로토콜
실험 프로토콜은 와이오밍 대학의 동물 관리 지침을 따릅니다. 이 연구에 사용된 마우스는 6개월 된 수컷 C57BL/6J이다. 이 절차는 생체 내 칼슘 이미징을 위해 모든 심부 뇌 영역을 타겟팅하는 데 사용할 수 있습니다. 여기서, 시연을 위해, 표적 뇌 영역은 마우스 mPFC (전방 및 후부 (A / P) : 1.94 mm, 내측 및 측면 (M / L) : 0.5 mm, 등쪽 및 복부 (D / V) : 1.8 mm)입니다. 이 프로토콜은 이전에 공개된 프로토콜(21)에 기초하여 수정된다.
1. mPFC에 바이러스의 입체적 주입(그림 1)
- 수술 준비
- 오토클레이브를 사용하여 모든 수술기구를 멸균하고 멸균 표면 위에 놓습니다.
- 10 μL 주사기를 식염수로 프라이밍하고 5 μL의 식염수로 미리 충전하여 제조하였다. 주사기를 마이크로 펌프에 부착 하십시오 (재료 표 참조).
- 가열 패드를 켜고 온도를 35°C로 유지하십시오.
- 마우스를 5% 이소플루란과 1L/min의 산소 유량으로 유도 챔버(5" x 10" x 4", 길이 x 너비 x 높이)에 놓습니다. 조심스럽게 마우스의 호흡률을 관찰하고 계산하십시오. 호흡률이 1 호흡 / s로 감소하면 마우스를 꺼내십시오.
참고: 마우스의 호흡 속도는 각 흡입 동안 허리 근육의 아래쪽과 위쪽 움직임을 관찰하여 쉽게 모니터링 할 수 있습니다. - 마우스가 수술 부위와 분리 된 벤치 탑 영역에 정착하도록하십시오. 면도 클리퍼를 사용하여 마우스 머리에서 첫 번째 자궁 경부 척추까지 머리카락을 면도하십시오.
- 마우스를 입체 택시 스테이지( 재료 표 참조)에 고정시키고 이어 바와 코 클립으로 마우스의 위치를 고정합니다. 입체택시 단계로의 이소플루란 흐름을 1.5% 이소플루란 및 0.5L/min의 산소 유량으로 유지하십시오.
- 수술 중 눈의 건조를 방지하기 위해 깨끗한 면봉으로 양쪽 눈에 윤활 안과 눈 연고를 바르십시오. 마우스의 페달 반사 신경을 평가하여 수술을 시작하기 전에 마우스가 완전히 마취되었는지 확인합니다.
- 무모 부위를 7.5% 포비돈-요오드 용액( 물자 표 참조)과 70% 에탄올로 각각 멸균 면봉을 사용하여 세 번 소독합니다.
- 무모 부위의 피부 아래에 2 % 리도카인의 작은 부피 (50 μL)를 주사하십시오.
- 메스를 사용하여 중간 선을 따라 피부를 통해 2cm 절개하여 두개골의 람다와 브레그마를 노출시킵니다.
- 마른 면봉과 뾰족한 집게의 도움으로 두개골에서 근막을 제거하십시오.
- 브레그마와 람다가 보이면 치과용 드릴 버 (직경 0.5mm)의 팁을 사용하여 브레그마와 람다의 Z 좌표를 측정 합니다 (재료 표 참조). 브레그마와 람다가 동일한 Z 위치에 놓일 때까지 코 홀더의 높이를 조정하십시오.
- 0.5mm 치과용 드릴 버를 A/P: 1.94mm, M/L: 0.5mm의 위치에 배치합니다. 두개골을 뚫습니다.
참고: 여기서, 시연을 위해, 표적 뇌 영역은 마우스 mPFC이다. 이 프로토콜은 다른 심부 뇌 영역을 타겟팅하는 데 사용할 수 있습니다. 예를 들어, 표적 뇌 영역이 핵 축적 (NAc)인 경우 해당 위치는 A / P : 0.9mm, M / L : 1.2mm이어야합니다. - 30G 바늘 팁을 사용하여 경막을 제거하고 45° 각진 날카로운 포셉을 사용하여 뼈 파편의 모든 조각을 청소합니다.
참고: 출혈은 청소 단계에서 작은 혈관이 파열될 수 있기 때문에 흔합니다. 멸균 된 면봉을 사용하여 출혈을 멈추고 식염수를 바르면 그 부위를 씻으십시오. 노출 된 두개골 부위에 식염수를 바르면 촉촉하게 유지됩니다. - 마이크로펌프의 제어판을 사용하여 마이크로리터 주사기에 바이러스를 로드합니다. 500 nL의 기포를 회수한 후 50 nL/s의 유속으로 800 nL의 바이러스를 빼내십시오.
참고: 시범 목적을 위해, 여기에서, GCaMP6f (GECI), AAV1-CamKII-GCamp6f를 발현하는 아데노-관련 바이러스 혈청형 1 (AAV1)을 mPFC 내로 주입한다 ( 물질의 표 참조). 바이러스의 역가는 2.8 x 1013 GC/mL이다. 주사 전에 식염수에 희석 된 1:2입니다. - 바늘 끝을 브레그마 상단에 올려 놓고 브레그마를 만지고 브레그마의 Z 좌표를 적어 둡니다. 바늘을 뚫은 구멍 위로 옮기고 바늘이 막히지 않도록 바이러스 100nL를 주입하십시오.
- 바늘을 뇌 조직으로 천천히 내려가 D/V의 목표 Z 좌표(1.75mm)로 이동한 다음 D/V의 Z 좌표(1.65mm)까지 약간 움직입니다.
참고 : 이것은 바이러스 성 용액을 주입 할 수있는 작은 주머니를 만드는 것입니다. 표적 뇌 영역이 NAc 인 경우, D / V의 해당 표적 Z 좌표는 4.2mm이어야하며 4.1mm까지 약간 움직여야합니다. - 제어판을 사용하여 마이크로 펌프가 50nL/min의 유속으로 500nL의 바이러스를 주입하도록 설정합니다. 제어판의 RUN 버튼을 눌러 바이러스를 주입하십시오.
참고 : 주사는 약 10 분이 소요됩니다. 주사가 끝나면 뇌에서 바늘을 꺼내기 전에 5-10 분 정도 기다리십시오. 주사 기간 동안 노출 된 두개골 부위를 촉촉하게 유지하기 위해 식염수를 자주 바르십시오. - 바늘을 위아래로 움직여 뇌에서 꺼내십시오. 500nL 부피를 50nL/s의 유속으로 두 번 주입합니다.
참고 :이 단계는 바이러스의 적절한 볼륨이 뇌에 투여되었음을 확인합니다. 처음 500 nL 주사 중에 바이러스가 방출되고 기포가 뒤 따른다. 두 번째 500 nL 주입 중에 기포가 먼저 나타나고 식염수가 뒤 따른다. 주사기는 이제 다음 마우스를 위해 바이러스를로드 할 준비가되었습니다. 수술이 완료되면 마이크로 리터 주사기와 바늘을 아세톤으로 철저히 청소하고 식염수로 청소합니다. - 피부 가장자리를 일렬로 세우고 봉합사 (크기 4.0)로 절개를 조심스럽게 닫습니다. 감염을 예방하기 위해 꿰매어 진 부위에 항생제 연고를 바르십시오.
- 입체 택시 단계에서 마우스를 제거하고 홈 케이지로 되돌립니다. 홈 케이지를 마우스가 외래가 될 때까지 33°C 인큐베이터에 놓는다.
참고 : 마우스가 움직이기 시작하기 전에 이소플루란 마취에서 깨어나는 데 보통 10-15 분이 걸립니다. - 마우스가 움직이기 시작한 후, 수술 후 3 일 동안 비 스테로이드 성 항염증제를 투여 하십시오 (자료 표 참조). GRIN 렌즈 이식을 추구하기 전에 마우스가 수술에서 14 일 동안 회복되도록하십시오.
2. mPFC에 GRIN 렌즈 이식(그림 1)
- 수술 준비
- 124 mM의 NaCl, 2.5 mM의 KCl, 1.25 mM의 NaH2PO4, 1.2 mM의 MgCl2,25mM의 글루코스,26 mM의 NaHCO3 및 2.4 mM의 CaCl2를 함유하는 인공 뇌척수액 (ACSF)을제조하였다.
- 오토클레이브를 사용하여 모든 수술기구를 멸균하고 멸균 표면 위에 놓습니다.
- 가열 패드를 켜고 온도를 35°C로 유지하십시오.
- 1% 아가로스를 녹이고 사용할 때까지 42°C의 수조에 보관한다.
참고 : 녹은 아가로스는 몇 시간 동안 수조에 보관할 수 있습니다. - GRIN 렌즈(직경 1mm, 길이 4.38mm, 그림 2A)를 70% 에탄올에 15분 동안 소독한 후 식염수로 채워진 튜브에 옮겨 이식 전에 제대로 헹구십시오.
참고 : GRIN 렌즈 (재료 표 참조)는 특수 안경에서은 및 리튬 이온 교환을 통해 생산되므로 독성이 없으며 신경 친화적 인 6,7을 제공합니다. 그러나 상업적으로 이용 가능한 많은 GRIN 렌즈는 독성 잔여물을 침출하여 신경 변성을 일으켜 장기간 생체 내 영상 연구를 위해 살아있는 뇌에 이식하기에 부적합 할 수 있습니다. 이러한 GRIN 렌즈는 이웃 뉴런(22)에 대한 독성 부작용을 방지하기 위해 파릴렌-C와 같은 생체적합성 제제를 사용한 코팅이 필요할 수 있다.
- 마우스의 무게를 측정하고 케타민 / 자일라진 혼합물의 복강 내 주사로 마취하십시오 ( 물질 표 참조) (케타민 : 100 mg / kg; 자일라진 : 15 mg / kg).
참고: 체중이 30g인 마우스는 초기 용량의 경우 케타민/자일라진 혼합물 300μL(케타민 100mg/mL 및 자일라진 1.5mg/mL)가 필요하고 수술 중 추가 용량의 경우 케타민(10mg/mL) 150μL가 필요합니다. 전체 수술 과정에서 마우스를 마취 상태로 유지하려면 케타민 (50 mg / kg)의 추가 용량을 적어도 한 시간에 한 번 투여해야합니다. 마우스의 마취 단계는 페달 반사를 평가하여 자주 모니터링해야합니다. - 면도기로 수술 부위의 머리카락을 면도하고 젖은 종이 타월을 사용하여 머리카락을 닦으십시오.
- 마우스를 입체 택시 단계에 놓고 코 클립과 이어 바를 조여서 위치를 고정하십시오. 멸균 된 면봉으로 양쪽 눈에 윤활 안과 눈 연고를 바르십시오. 페달 반사 신경을 평가하여 마우스가 완전히 마취되었는지 확인하십시오.
- 멸균 면봉을 사용하여 7.5 % 포비돈 요오드 용액과 70 % 에탄올로 무모 부위를 세 번 소독하십시오. Dexamethasone을 허벅지에 근육 내 2 mg / kg으로 투여하여 수술 관련 붓기 및 염증의 위험을 낮 춥니 다.
- 수술 부위의 피부 아래에 50 μL의 2 % 리도카인을 주사하십시오.
- 미세한 가위를 사용하여 눈 사이의 앞쪽에서 람다 뒤의 뒤쪽까지 1.5cm (높이) x 1.0cm (기본) 삼각형 피부 영역을 절제하십시오.
- 미세 포셉, 마이크로 블레이드 및 면봉을 사용하여 두개골에서 골막 조직을 제거하십시오.
참고 : 두개골은 다음 단계를 수행하기 전에 철저히 청소하고 말려야합니다. - 시아 노 아크릴레이트 ( 재료 표 참조)를 피부 가장자리에 바르고 피부를 두개골에 부착하십시오. 시아노아크릴레이트가 건조될 때까지 5분 동안 기다리십시오.
- 0.5mm 드릴 버 팁을 사용하여 노즈 클립의 높이를 조정하여 브레그마와 람다를 동일한 수평면에 정렬합니다.
- 치과용 드릴 버(직경 1.2mm)를 A/P: 1.94mm, M/L: 0.8mm의 위치에 배치합니다. 두개골을 뚫습니다. 30G 바늘 팁을 사용하여 경막을 제거하고 45° 각진 날카로운 포셉을 사용하여 뼈 파편의 모든 조각을 청소합니다.
참고: 이 뼈 파편은 완전히 제거되지 않으면 후속 흡인 단계를 차단할 수 있습니다. - 수동으로 연마한 27G의 무딘 엔드 바늘(그림 2B)을 10° 각도로 기울어진 로봇 팔에 연결된 바늘 홀더에 부착합니다(그림 2C). 바늘 홀더의 다른 쪽 끝을 집 진공 시스템에 연결하십시오.
참고: 로봇 암(자료표 참조)은 NIDA/IRP의 린 박사 그룹에 의해 개발되었으며 현재 맞춤형 오픈 액세스 소프트웨어인 AutoStereota(https://github.com/liang-bo/AutoStereota)23에 의해 제어됩니다. - 바늘 끝을 찾아 브레그마를 만지기만 하면 됩니다. AutoStereota에서 Bregma 버튼을 클릭하여 bregma의 Z 좌표를 0으로 설정하십시오.
- 입력 X 값을 0.8로, 입력 Y 값을 1.94로, 입력 Z 값을 1.0으로 설정한 다음 찾기 버튼을 클릭하여 바늘을 두개골의 뚫린 구멍 상단으로 이동합니다.
- AutoStereota를 통해 바늘의 위치를 노출 된 뇌 조직 영역의 중심으로 조정하십시오.
참고: 바늘을 횡방향 또는 중간 방향으로 이동하려면 단계 값을 입력하고 AutoStereota의 횡방향 또는 내측 버튼을 클릭합니다. 마찬가지로, 바늘을 전방 또는 후방, 등쪽 또는 복부 방향으로 이동하려면 Rostral 또는 Caudal 및 Dorsal 또는 Ventral 버튼을 각각 클릭하십시오. - 진공을 켜고 구부러진 팁이있는 30G 바늘에 연결된 중력 제어 튜브 시스템 ( 재료 표 참조)을 통해 ACSF로 노출 된 뇌 영역을 헹구기 시작하십시오. ACSF는 95% O2 및 5%CO2 의 가스 혼합물로 연속적으로 버블링되고0.2 μm 필터를 통해 여과된다.
참고: ACSF 유량은 ~ 1.5 mL/분입니다. 가스 혼합물의 출력 압력은 ∼3 psi로 유지된다. - AutoStereota 소프트웨어의 도움으로 뇌 조직을 층별로 흡인하십시오 (그림 3).
참고 : 뇌 조직의 흡인은 4 라운드로 완료되어 기둥 포켓 (깊이 1.8mm, 직경 1mm)이 생성됩니다.- "zStep" 세션에서 첫 번째 행과 두 번째 행을 클릭하고 확인합니다. 첫 번째 행의 값을 0.2와 1로 설정합니다. 두 번째 행의 값을 0.15와 4로 설정합니다(그림 3A).
- "모드"세션에서 바늘 크기 27 게이지와 1.2 를 설정하고 딤 값을 0.9로 설정합니다. 다른 모든 값은 기본값을 사용합니다(그림 3A).
- 설정, 제로 유지 및 시작 버튼을 순차적으로 클릭하여 포부를 시작하십시오.
참고 : 이것은 포부의 1라운드입니다 . 입력 값은 흡기 깊이가 0.2 mm (0의 Z 좌표로부터)임을 나타내며 1 층이있는 첫 번째 단계 동안; 두 번째 단계에서 흡인 깊이는 0.15mm이며 4 층 동안 지속적으로 반복됩니다. 흡인 분해능은 1.2이고 직경은 0.9mm입니다. 흡인 동안, 바늘 팁의 즉각적인 위치는 트랙 그래프 패널을 통해 모니터링 될 수있다. 이 흡인 라운드를 완료 한 후, 깊이 0.8mm와 직경 1mm의 기둥 포켓이 생성됩니다. 바늘 팁은 Z 좌표가 0인 가운데로 돌아갑니다. - "zStep" 세션에서 첫 번째 행과 두 번째 행을 클릭하고 확인합니다. 첫 번째 행의 값을 1과 1로 설정합니다. 두 번째 행의 값을 0.15와 4로 설정합니다(그림 3B).
- "모드" 세션에서 모든 값을 이전 라운드와 동일하게 유지합니다(그림 3B).
- 설정, 제로 유지 및 시작 버튼을 순차적으로 클릭하여 포부를 시작하십시오.
참고 : 이것은 포부의 2번째 라운드입니다. 입력 값은 흡기 깊이가 1 층이있는 첫 번째 단계 동안 (0의 Z 좌표로부터) 1mm임을 나타냅니다. 두 번째 단계에서 흡인 깊이는 0.15mm이며 4 층 동안 지속적으로 반복됩니다. 이 흡인 라운드를 완료 한 후, 깊이 1.6mm, 직경 1mm의 컬럼 포켓이 생성됩니다. - "zStep" 세션에서 첫 번째 행만 클릭하고 확인합니다. 첫 번째 행의 값을 1.8과 1로 설정합니다(그림 3C).
- "모드" 세션에서 바늘 크기 27게이지와 2.2를 설정합니다. 다른 모든 값은 이전 라운드의 값과 동일하게 유지됩니다(그림 3C).
- 설정, 제로 유지 및 시작 버튼을 순차적으로 클릭하여 포부를 시작하십시오.
참고 : 이것은 포부의 3번째 라운드입니다. 입력 값은 흡기 깊이가 1.8mm(Z 좌표 0에서)이고 레이어가 1임을 나타냅니다. 포부 결의안은 2.2입니다. 이 흡인 라운드를 완료 한 후, 깊이 1.8mm, 직경 1mm의 컬럼 포켓이 생성됩니다. - "zStep" 세션에서 첫 번째 행만 클릭하고 확인합니다. 첫 번째 행의 값을 1.6과 1로 설정합니다(그림 3D).
- "모드" 세션에서 바늘 크기 27게이지와 2.2를 설정하고 딤 값을 0.6 으로 설정합니다(그림 3D).
- 설정, 제로 유지 및 시작 버튼을 순차적으로 클릭하여 포부를 시작하십시오.
참고 : 이것은 포부의 4번째 라운드입니다. 이 단계의 목적은 주머니에 축적 된 혈액을 청소하는 것입니다. 출혈은 흡인 과정에서 작은 혈관이 파열되기 때문에 흔합니다. 혈액을 철저히 청소하려면 ACSF의 관개를 5 분 동안 중단 한 다음 관개를 다시 켭니다. 주머니에 피가 없을 때까지 포부의 4번째 라운드를 여러 번 반복하십시오. 이 프로토콜은 다른 심부 뇌 영역을 타겟팅하는 데 사용할 수 있습니다. 예를 들어, 표적 뇌 영역이 NAc인 경우, D/V의 최종 대응 Z 좌표는 4.4mm여야 한다.
- ACSF의 진공 및 관개를 중단하십시오. 바늘을 +2mm Z 좌표로, 중앙에 0.5mm 앞쪽으로 가져갑니다. 멸균된 1mm GRIN 렌즈를 주머니에 넣습니다.
- 바늘 끝을 노출된 GRIN 렌즈와 접촉시켜 GRIN 렌즈가 10° 각도로 고정되도록 합니다. GRIN 렌즈의 윗면을 멸균 연조직 종이로 부드럽게 눌러 GRIN 렌즈의 아래쪽 표면이 뇌 조직과 접촉하도록 합니다.
- 녹은 아가로스를 주걱으로 GRIN 렌즈와 뇌 조직 사이의 틈새에 바르십시오. 아가로스가 겔을 형성한 후, 마이크로 블레이드를 이용하여 과량의 아가로스를 제거한다.
- 식염수와 면봉으로 두개골을 철저히 닦으십시오. 후속 치과 시멘트 ( 재료 표 참조) 적용 전에 두개골을 말리십시오.
- 혼합을 잘 -20°C 냉동고에서 꺼내십시오. 치과용 시멘트 분말과 촉매액을 혼합하고 두개골에 자기경화형 접착수지 시멘트층을 도포하는 단계; 먼저 GRIN 렌즈를 둘러 싼 다음 노출 된 두개골 전체를 덮으십시오.
- 5 분 동안 기다렸다가 완전히 굳어지도록하십시오. 흡인 바늘을 조심스럽게 제거하십시오.
- 깨끗한 플라스틱 우물에서 치과 시멘트 분말, 검은 숯을 액체와 혼합하고 치과 시멘트 1 층 위에 혼합물의 얇은 층을 바르십시오. 경화되도록 5 분 동안 기다리십시오.
- 노출된 GRIN 렌즈를 PCR 튜브로 만든 맞춤형 캡으로 덮어 보호합니다(그림 2D). 시아 노 아크릴레이트를 적용하여 치과 시멘트에 뚜껑을 부착하십시오.
- 미리 예열된 식염수 1 mL를 마우스에 피하 주사한 후 0.1mg/kg의 부프레노르핀을 주입합니다. 마우스를 홈 케이지에 다시 넣으십시오. 홈 케이지를 33°C 인큐베이터에 놓고 외래가 될 때까지 마우스를 모니터링한다. 마우스가 움직이기 시작하기 전에 마취에서 깨어나는 데 보통 20-40 분이 걸립니다.
- 비 스테로이드 성 항염증제를 투여하고 적어도 3 일 동안 마우스를 수술 후 모니터링하십시오. 마우스가 30 일 동안 수술에서 회복되도록하십시오.
3. 마우스 두개골에 미니스코프 홀더(베이스) 부착(그림 1)
- 호흡률이 1회 호흡/초로 감소할 때까지 5% 이소플루란과 1L/min 산소 유량으로 유도 챔버에서 마우스를 마취시킵니다.
- 마우스를 입체 관념 단계에 놓고 이어 바 및 코 클립으로 위치를 고정하십시오. 이소플루란(1.5%)과 산소(0.5L/min)의 지속적인 흐름을 유지합니다.
- 눈에 안과 연고를 바르면 촉촉하게 유지하십시오. 가열 패드를 켜고 온도를 35°C로 유지하십시오. 페달 반사 신경을 평가하여 마우스가 완전히 마취되었는지 확인하십시오.
- GRIN 렌즈를 덮고 있는 캡을 뾰족한 포셉을 사용하여 부드럽게 분리합니다. 건조된 시아노아크릴레이트 잔여물을 마이크로드릴을 사용하여 치과용 시멘트로부터 완전히 뚫어낸다( 재료 표 참조).
- 작은 가위로 치과 시멘트 부위 주변의 머리카락을 자릅니다. 압축 공기 먼지 제거기를 사용하여 파편을 청소하십시오. 아세톤에 담근 면봉을 사용하여 GRIN 렌즈의 윗면을 청소하십시오.
- 홀더(받침대)로 미니스코프를 준비합니다.
- #00-90 육각 너트( 재료 표 참조)를 베이스에 있는 슬롯에 넣고 시아노아크릴레이트를 적용하여 고정시킵니다(그림 2E).
- 폴리테트라플루오로에틸렌(PTFE) 테이프를 미니스코프의 스레드 주위에 단단히 바르고 여분의 테이프를 다듬습니다(그림 2F).
- 미니스코프를 베이스에 고정하고 잠금 나사를 사용하여 미니스코프를 베이스에 고정합니다(그림 2G).
- 미니 스코프를 케이블에 연결하고 맞춤 개발, 현재 오픈 액세스 소프트웨어 인 NeuView ( 자료표 참조)를 켭니다.
참고: NeuView 소프트웨어는 NIDA/IRP 7,12의 Dr. Lin's 그룹의 생체 내 칼슘 이미징을 위해 맞춤 개발되었습니다. 그것은 오픈 액세스 (https://github.com/giovannibarbera/miniscope_v1.0)입니다. - NeuView에서 하드웨어를 클릭하고 LED1을 확인한 다음 스트림 단추를 클릭하여 라이브 이미지를 봅니다(그림 4A). 라이브 스트리밍을 중지하려면 중지 버튼을 클릭하십시오.
- 미니스코프를 전동 컨트롤러를 사용하여 XYZ 위치를 조작할 수 있는 맞춤형 미니스코프 홀딩 암(그림 2H)에 고정합니다(그림 2I).
- 노출된 GRIN 렌즈 바로 위에 있는 미니스코프를 찾아 렌즈 표면과 평행하게 만듭니다. 미니스코프를 GRIN 렌즈쪽으로 천천히 내리고 최적의 초점 평면이 발견될 때까지 Z 위치를 조정합니다.
참고: 최상의 초점면은 여러 가능한 Z 위치를 비교하고 대부분의 세포체를 명확하게 시각화하여 초점면을 선택하여 결정됩니다. - 치과 시멘트의 첫 번째 층을 미니 스코프베이스의 위치를 변경하지 않고 조심스럽게 미니 스코프 베이스 주위에 적용하십시오. 시멘트가 경화 된 후 미니 스코프가 마우스 머리에 스스로 설 수 있도록 홀딩 암을 부드럽게 제거하십시오.
참고 : 치과 시멘트는 경화 후 수축하는 경향이 있으며 미니 스코프를 원래 초점면에서 멀리 끌어 당깁니다. 일반적으로 미니스코프 Z 위치는 잠재적 인 변화를 보상하기 위해 치과 시멘트를 적용하기 전에 원래 초점면보다 약간 들어 올려집니다. - 바닥 주위에 치과 시멘트의 두 번째 층을 적용하여 모든 틈새를 채우고 틈새에서 LED 조명이 누출되지 않도록하십시오. 치과 시멘트가 굳어지게하십시오.
- 스테레오택시 단계에서 마우스를 제거합니다. 잠금 나사를 풀고 베이스에서 미니스코프를 분리합니다. 3D 프린팅된 보호 캡을 베이스에 넣어 노출된 GRIN 렌즈를 보호하고 베이스의 잠금 나사를 조이십시오(그림 2J).
- 마우스를 홈 케이지에 다시 넣으십시오.
참고 : 마우스가 움직이기 시작하기 전에 이소플루란 마취에서 깨어나는 데 보통 10-15 분이 걸립니다.
4. 미니스코프 장착 및 생체 내 Ca2+ 이미징 (그림 1)
- 미니 스코프를 기지에 장착하십시오.
- 마우스를 유도 챔버에서 잠깐 마취하십시오 (5 % 이소 플루란 및 1 L / min 산소 유량). 마우스를 깨끗한 벤치 표면에 놓습니다.
- 작은 스크루 드라이버로 잠금 나사를 풀고 보호 캡을 제거한 다음 아세톤에 젖은 면봉으로 GRIN 렌즈 표면을 청소하십시오.
- PTFE 테이프를 미니스코프 스레드 주위에 단단히 감싸고 마우스의 밑면에 미니스코프를 고정합니다.
- 미니스코프를 케이블에 연결하고(그림 2K), NeuView 소프트웨어를 켭니다.
- NeuView에서 하드웨어를 클릭하고 LED1을 확인한 다음 스트림 단추를 클릭하여 라이브 이미지를 봅니다(그림 4A).
- 무딘 집게를 사용하여 약간 조이거나 느슨하게하거나베이스를 기준으로 미니 스코프의 위치를 조정하여 최상의 초점 평면을 식별하십시오.
참고: 최상의 초점 평면은 여러 가능한 위치를 비교하고 대부분의 세포체를 명확하게 시각화한 위치를 선택하여 결정됩니다. - 잠금 나사를 조이고 마우스를 홈 케이지에 다시 놓습니다.
- NeuView에서 LED 조명 전력을 최적의 수준으로 조정합니다. 캡처 를 클릭 한 다음 트리거 버튼을 클릭하여 녹음을 시작하고 150 프레임 후에 중지 를 누르십시오.
참고: 가능한 가장 낮은 전력은 충분히 밝은 이미지를 얻기 위한 LED 전력의 최적 레벨을 결정합니다. 짧은 비디오를 녹화하는 목적은 반복적 인 이미징을 위해 미래에 동일한 초점 평면을 쉽게 식별하는 것입니다. - 미니 스코프에서 케이블을 뽑습니다. 실험을 시작하기 전에 마우스를 적어도 30 분 동안 회복시키십시오.
참고: 미니스코프를 보호하기 위해, 일반적으로 물병과 와이어 푸드 피더는 이 짧은 시간 동안 제거됩니다. 마우스가 홈 케이지에 더 오래 머물러야하는 경우 가정용 케이지에 시판되는 다이어트 젤 ( 재료 표 참조)을 공급하는 것이 좋습니다.
- 생체 내 칼슘 이미징을 위한 데이터 수집
참고 : 생체 내 칼슘 이미징은 연구자가 원하는 행동 테스트와 함께 동시에 수행 할 수 있습니다. 실증을 위해, 여기서 예는 개방 필드 테스트 동안 생체내 Ca2+ 이미징이다. 이 목표를 달성하려면 두 대의 컴퓨터가 필요합니다. 한 컴퓨터에는 마우스 동작을 자동으로 기록하도록 카메라를 제어하는 상용 소프트웨어( 자료 표 참조)가 장착되어 있습니다. 다른 컴퓨터에는 미니 스코프를 제어하고 Ca2 + 이미지를 기록하기 위해 NeuView가 장착되어 있습니다.- 비헤이비어티 카메라 소프트웨어( 자료 표 참조)를 켜서 Livestream 기능을 통해 마우스 동작 경기장을 확인합니다. 상단 카메라의 초점을 수동으로 조정합니다(그림 2L).
- 트리거/스트로브를 선택하고 "트리거 사용/사용 안 함"을 선택합니다(그림 4B). 녹음 버튼을 클릭하고 찾아보기를 사용하여 행동 녹음이 저장 될 위치를 선택하고 원하는 이미지 형식을 선택하십시오.
참고: "트리거 제어" 기능을 사용하면 NeuView 소프트웨어에 의해 동작 기록이 트리거되어 동작 프레임과 해당 칼슘 이미징 프레임이 일시적으로 함께 결합됩니다. 동작 기록은 원하는 형식으로 저장할 수 있습니다. 동작 기록은 일반적으로 지정된 폴더에 JPEG 형식으로 저장됩니다. - 마우스를 경기장 가까이로 가져와 미니스코프를 데이터 수집 시스템에 연결된 케이블에 연결합니다(그림 2L). 그런 다음 마우스를 경기장 중앙에 배치합니다.
- NeuView 소프트웨어의 Livestream 기능을 사용하여 LED 전원을 조정하여 칼슘 이미지의 밝기를 최적화하십시오.
참고: 칼슘 이미징의 경우 녹화 프레임 속도는 기본적으로 10프레임/초입니다. - NeuView에서 LED1의 선택을 취소하고 캡처 를 클릭한 다음 트리거 버튼을 클릭하여 녹화를 시작한 다음 100프레임 후에 중지 를 누르십시오.
참고: 이것은 LED 표시등이 꺼진 상태에서 약 100 프레임의 배경 이미지를 기록하는 것입니다. - 비헤이비어 카메라 소프트웨어에서 녹화 시작 을 클릭합니다(그림 4C). NeuView에서 LED1을 확인하고 캡처를 클릭한 다음 트리거 버튼을 클릭하여 녹화를 시작합니다. 히트 중지 3000 프레임 후.
참고 : 이것은 칼슘 이미징과 행동을 동시에 기록하는 것입니다. 오픈 필드 테스트는 길이가 15분이며, 일반적으로 5분마다 세 번의 레코딩 세션으로 나뉩니다. 이것은 지속적인 사용으로 인해 미니 스코프가 과열되는 것을 방지하기위한 것입니다. - 칼슘 이미징과 행동 기록을 지정된 폴더에 저장합니다. 각 세션 전에 배경을 기록하는 동안 두 번 더 녹음을 반복하고 모든 녹음을 지정된 폴더에 저장하십시오.
- 미니스코프를 베이스에서 분리합니다.
- 녹화가 완료되면 미니 스코프에서 케이블을 뽑습니다.
- 마우스를 유도 챔버에서 잠깐 마취하십시오 (5 % 이소 플루란 및 1L / min의 산소 유량). 마우스를 깨끗하고 따뜻한 표면에 놓습니다.
- 베이스의 잠금 나사를 풀고 베이스에서 미니스코프를 분리합니다. 보호 캡을 베이스 위에 다시 놓고 잠금 나사를 조이십시오. 마우스를 홈 케이지에 다시 넣으십시오.
결과
도 1은 바이러스 주입, GRIN 렌즈 이식, 마우스 두개골에 대한 미니스코프 베이스의 부착, 및 미니스코프를 통한 생체내 칼슘 이미징을 포함하는 개략적인 실험 절차를 보여준다. 전체 절차는 ~ 2 개월이 걸립니다. 도 2는 생체내 칼슘 이미징을 위한 미니스코프 프로토콜에 설명된 주요 구성요소들을 도시한다. 그림 3은 GRIN 렌즈 이식 중 AutoStereota 소프트웨어의 인터페이스를 표시합니다. 그림 4는 생체 내 칼슘 이미징 동안 NeuView 및 행동 기록 소프트웨어의 인터페이스를 표시합니다.
생체 내 칼슘 이미징의 결과는 바이러스 주입과 GRIN 렌즈 이식 수술의 성공에 달려 있습니다. 도 5는 생체내 칼슘 이미징 기록으로부터의 다양한 결과(즉, 성공적이지 못함, 최적이 아닌 및 양호함)를 보여준다. 실패한 경우, 칼슘 이미지는 어둡거나 밝게 보일 수 있지만 일반적으로 활성 뉴런이 없거나 거의 나타나지 않습니다. 우리는 일반적으로 다섯 개 미만의 활성 뉴런이있는 경우 생체 내 칼슘 기록 실험을 추구하지 않습니다. 좋은 생체 내 칼슘 이미징은 일반적으로 수백 개의 활성 뉴런을 나타냅니다. 기록에 백 개 미만의 활성 뉴런이 포함되어 있다면, 우리는 그것을 차선책으로 간주합니다.
차선책과 양호한 기록 에서 생체 내 칼슘 이미징 실험이 추구되었고, 후속 데이터 분석이 수행되었다. 무비 1은 마우스 mPFC로부터의 대표적인 생체내 칼슘 이미징 기록을 나타낸다. 행동 비디오 및 칼슘 이미징 데이터는 일반적으로 별도로 처리됩니다. 마우스 동작 비디오는 수동으로 점수를 매길 수 있습니다. 칼슘 이미징 파일은 CaIman 칼슘 이미지 프로세싱 툴박스(24)를 사용하여 처리된다. 도 6은 양호한 생체내 칼슘 영상 기록으로부터의 대표적인 세포 맵 및 몇몇 칼슘 트레이스를 도시한다.
생체 내 칼슘 이미징을 완료 한 후, 마지막 단계는 바이러스 주입 및 GRIN 렌즈 이식이 원하는 뇌 영역에서 발생했는지 여부를 확인하는 것입니다. 이러한 목적을 위해, 마우스를 포스페이트 완충 식염수 (PBS)로 관류시키고, 이어서 4% 파라포름알데히드 (PFA)로 관류시켰다. 마우스 뇌를 수확하고, 12시간 동안 4% PFA에 후고정시키고, 4°C에서 PBS에 저장하였다. 이어서, 마우스 뇌를 비브라톰으로 50 μm 두께의 슬라이스로 절편화하였다. 뇌 절편을 DAPI로 염색하고 현미경 (프로토콜에 기술되지 않음)12 하에서 관찰하였다. 도 7은 실험 마우스로부터의 브레그마 전방 ∼1.94 mm 마우스 뇌 슬라이스로서, GRIN 렌즈가 이식된 위치를 추적하여 나타낸 것이다. GRIN 렌즈 트랙 아래 및 주위의 녹색 형광 영역은 mPFC 영역에서 GCaMP6f의 발현을 나타낸다.
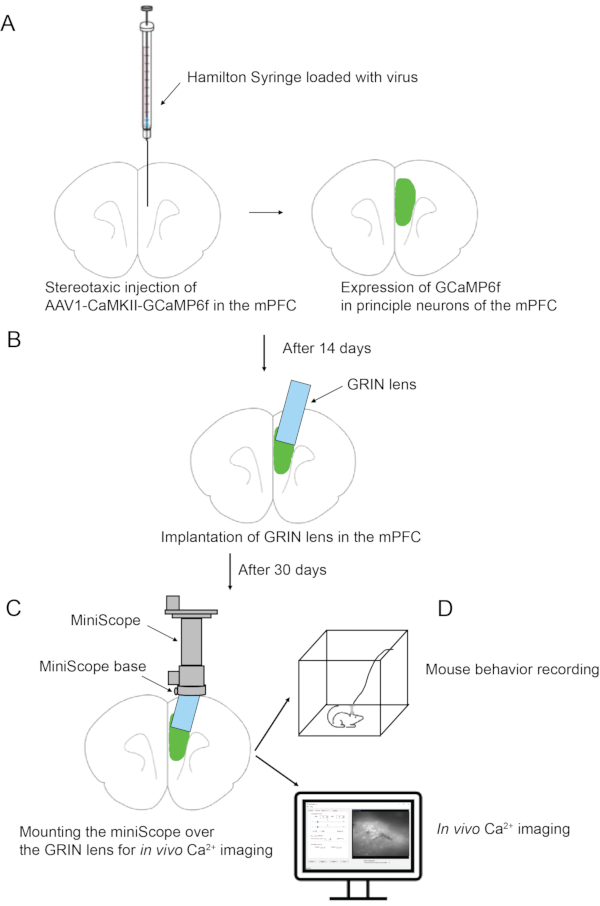
도 1: 실험 절차의 개략적인 개요 . (A) mPFC에 바이러스의 입체형 주사. (b) mPFC에 GRIN 렌즈 이식. (C) 마우스 두개골에 미니스코프 베이스를 부착. (D) 미니스코프 장착 및 생체 내 칼슘 이미징. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 생체 내 칼슘 영상 화에 필요한 주요 구성 요소. (A) 직경 1mm, 길이 4.38mm의 GRIN 렌즈. (B) 뇌 조직 흡인에 사용되는 27G의 수동으로 연마된 무딘 엔드 바늘. (c) 바늘 홀더에 결합된 로봇 암. (D) 마우스 두개골에 미니스코프 베이스가 부착될 때까지 노출된 GRIN 렌즈를 보호하기 위해 PCR 튜브로부터 맞춤형 캡. (E) 육각 너트가 있는 미니스코프 홀더(베이스). (F) 스레드 부분이 PTFE 테이프로 감싸인 미니 스코프. (G) 잠금 나사로 베이스에 고정된 미니스코프. (H) 미니 스코프 지주 암. (I) XYZ 위치에서 미니 스코프의 움직임을 용이하게하는 데 사용되는 맞춤형 3D 전동 컨트롤러. (J) 마우스가 생체내 칼슘 이미징을 수행하지 않는 동안 노출된 GRIN 렌즈를 보호하기 위해 베이스에 고정된 보호 캡. (K) 케이블에 연결된 미니스코프. (L) 생체내 Ca2+ 이미징을 위한 데이터 수집 시스템. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
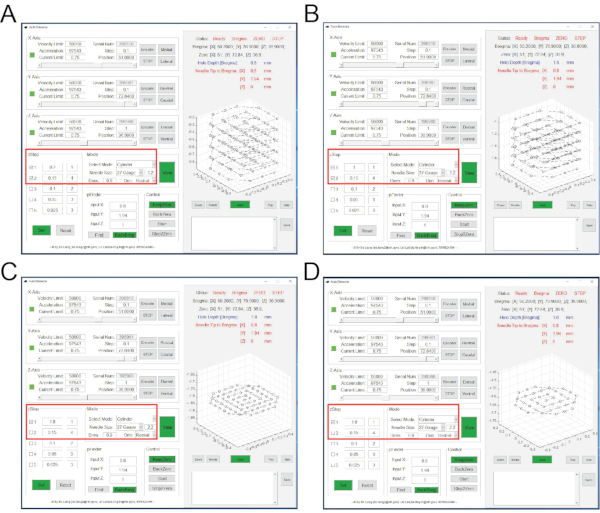
그림 3: 층별 뇌 조직 흡인 중 AutoStereota 소프트웨어의 인터페이스. (A) 2.17.1~2.17.3단계에 해당하는 인터페이스. (b) 단계 2.17.4 내지 2.17.6에 대응하는 인터페이스. (c) 단계 2.17.7 내지 2.17.9에 대응하는 인터페이스. (d) 단계 2.17.10 내지 2.17.12에 대응하는 인터페이스. 빨간색 상자는 입력 값을 강조 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
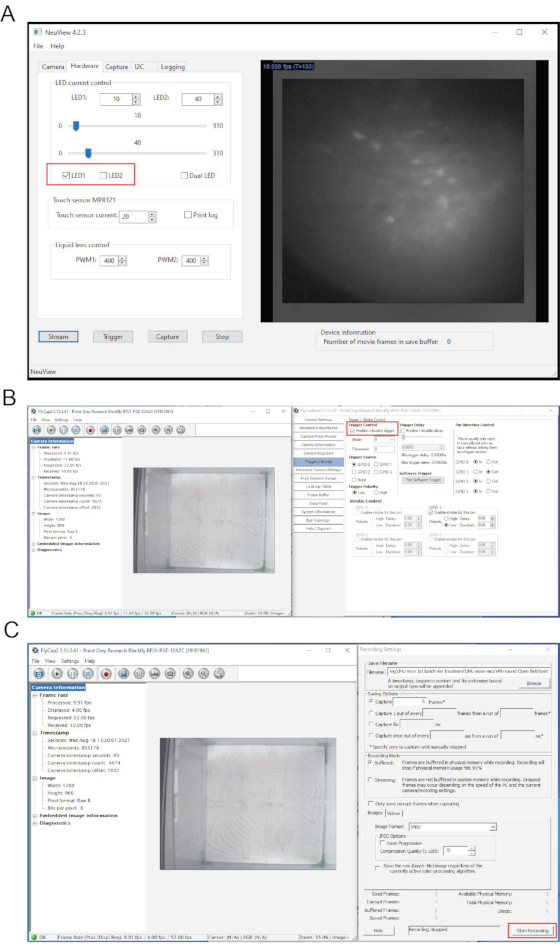
그림 4: 생체 내 칼슘 이미징 중 NeuView 소프트웨어 및 행동 기록 소프트웨어의 인터페이스. (A) NeuView의 인터페이스. (B,C) 행동 기록 소프트웨어의 인터페이스. 빨간색 상자는 클릭해야 하는 단추를 강조 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
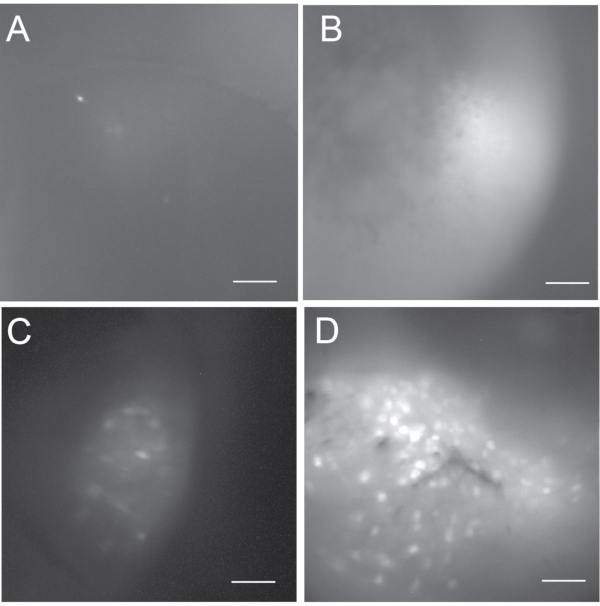
그림 5: 최대 프로젝션 형광 세포는 가능한 결과의 범위를 보여주기 위해 매핑됩니다 . (A,B) 후속 데이터 분석에 허용되지 않는 생체 내 칼슘 이미징에 실패함. (A) 어둡고 5 개 미만의 활성 뉴런을 포함합니다. (B)는 밝지만 활동적인 뉴런이 없다. (c) 일부 활성 뉴런을 포함하는 차선의 생체내 칼슘 영상으로부터의 세포 맵. (d) 수백 개의 활성 뉴런을 포함하는 양호한 생체내 칼슘 영상으로부터의 세포 지도. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
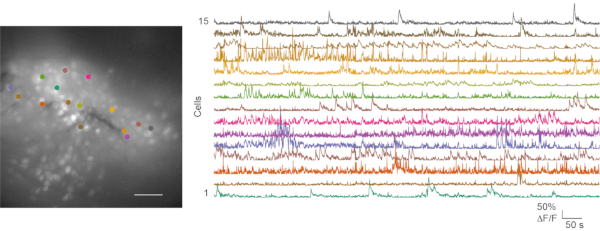
도 6: 성공적인 생체내 칼슘 영상화로부터의 대표적인 세포 맵 및 칼슘 과도기. 왼쪽 패널은 개방 필드 시험 동안 mPFC에 기록된 생체내 칼슘 이미징으로부터의 최대 프로젝션 형광 세포 맵이다. 녹음은 5 분 동안 지속됩니다. 오른쪽 패널은 15 관심 영역 (색상 일치)의 칼슘 과도 상태를 보여줍니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
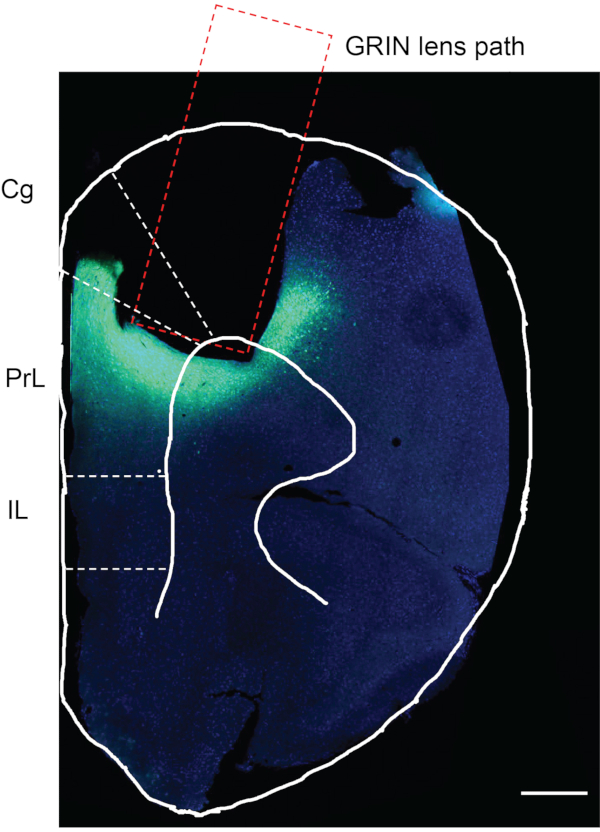
도 7: 실험 마우스의 사후 평가. 실험 마우스의 mPFC에서의 GCaMP6f 발현 및 GRIN 렌즈 이식에 대한 사후 평가. 직사각형 영역은 GRIN 렌즈 이식을 위한 경로를 나타낸다. GRIN 렌즈 이식 영역 아래의 녹색 영역은 GCaMP6f가 발현되었음을 확인하고 GRIN 렌즈가 원하는 뇌 영역에 정확하게 이식되었음을 확인합니다. Cg, 신구레이트 피질; PrL, 전변연계 피질; IL, 적외선 피질. 스케일 바: 400 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: NIDA에서 맞춤 제작한 미니스코프 시스템과 다른 미니스코프 시스템의 비교 7,8,9,10,11,13,25,26. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
무비 1: 오픈 필드 테스트 동안 마우스 mPFC로부터의 생체내 칼슘 이미징 기록. 데모를 위해 이 동영상은 1분 녹화만 표시합니다. 원래 녹화 프레임 속도는 10 프레임 / 초입니다. 비디오는 원래 녹화보다 6 배 빠릅니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
토론
신경 과학의 핵심 질문은 신경 역학과 회로가 정보를 인코딩하고 저장하는 방법과 뇌 질환에서 어떻게 변경되는지 이해하는 것입니다. 생체 내 현미경Ca2+ 이미징 시스템을 사용하여 국소 미세회로 내의 수백 개의 뉴런으로부터의 개별 신경 활동을 자유롭게 행동하는 동물로부터 동시에 모니터링할 수 있습니다. 여기에서, 바이러스 주입 및 GRIN 렌즈 이식을 위한 상세한 수술 프로토콜이 맞춤형 미니스코프 기록 시스템을 통해 생체 내 심부 뇌Ca2+ 이미징을 위한 설치류를 제조하기 위해 기술된다. 표 1은 당사의 미니스코프 시스템을 상업적으로 이용 가능하고 맞춤 제작된 다른 미니 스코프 시스템(7,8,9,10,11,13,25,26)과 비교한 결과를 보여줍니다. 본 수술 프로토콜을 사용하는 GRIN 렌즈 이식은 심부 뇌 생체 내 칼슘 이미징을위한 상업적 또는 맞춤형 단일 광자 및 이광자 이미징 시스템과 호환된다는 점은 주목할 가치가 있습니다.
바이러스 주입에서 생체 내 칼슘 이미징의 축소경 데이터 수집에 이르기까지 전체 실험 절차를 완료하는 데 최소 2 개월이 걸립니다. 복잡하고 노동 집약적 인 과정입니다. 실험의 궁극적 인 성공은 GECI의 적절한 선택, 표적 뇌 영역에 바이러스의 정확한 주입, 원하는 신경 집단에서의 충분한 바이러스 발현, 원하는 위치에 정확하게 GRIN 렌즈 이식, 수술로부터의 적절한 회복, 수술 후 심각한 염증이 발생하는지 여부 및 동물의 행동이 수술에 의해 심각하게 영향을 받는지 여부 등 여러 요인에 달려 있습니다. 등등.
두 가지 중요한 단계는 바이러스의 입체 택시 주입과 GRIN 렌즈 이식을 포함합니다. 실증적 목적을 위해, mPFC 내의 피라미드성 뉴런을 선택적으로 표지하는 CaMKII 프로모터의 제어 하에 GCaMP6f를 코딩하는 아데노-연관 바이러스 (AAV1)와 함께 마우스 mPFC에서 입체택시 미세주입을 수행하였다. GCaMP6f는 71ms15의 절반 붕괴 시간을 가진 가장 빠르고 민감한 칼슘 지표 중 하나이기 때문에 선택되었습니다. 또한, GCaMP6f의 AAV 바이러스 발현은 오래 지속되며(즉, 수개월), 신경퇴행성 질환27의 마우스 모델에서 종단 연구를 위해 장기간에 걸쳐 반복적인 생체내 Ca2+ 이미징을 수행하는 데 이상적이다. 현재의 수술 프로토콜은 임의의 다른 뇌 영역에서 상이한 세포 집단을 표적화하기 위해 적응될 수 있다. 다양한 사용 가능한 바이러스 도구를 사용하면 원하는 나이에 원하는 뇌 영역에서 특정 신경 집단을 선택적으로 표지 할 수 있습니다. 또한, 연구자들은 Cre-LoxP 재조합 시스템과 다양한 이용 가능한 트랜스제닉 마우스 모델을 활용하여 유전자 변형을 수행하고 행동 및 신경 회로 결과28,29를 연구 할 수 있습니다.
제시된 프로토콜의 한 가지 독특한 특징은 GRIN 렌즈 (직경 1mm) 이식 전에 자동화된 층별 뇌 조직 흡인이 수행되었다는 것입니다. 이것은 진공 시스템에 연결된 27G 바늘을 통해 달성되며, 맞춤형 로봇 암 및 소프트웨어(23)에 의해 제어된다. 우리의 경험에 기초하여, 이 방법은 GRIN 렌즈가 접촉하기 위한 균일한 표면을 생성하고, 수동 조직 흡인(23)보다 이웃 조직에 더 적은 손상을 야기한다. 이러한 이유로, 이 절차는 비교적 넓은 직경(예를 들어, 1mm)을 갖는 GRIN 렌즈에 명백한 이점을 제공한다. 그러나 조직 흡인은 더 작은 직경 (0.5mm 또는 0.25mm)의 GRIN 렌즈를 이식하는 데 필요하지 않을 수 있습니다. 대신에, 30 G 바늘(21)로 만들어진 선행 트랙을 따라 직접 심어질 수 있다.
위에서 설명한 두 가지 중요한 단계 외에도 성공적인 작동을 위해 많은 다른 요소를주의 깊게 고려해야합니다. (1) 뇌에 접촉하는 모든 기구는 감염을 예방하기 위해 멸균되어야 한다. (2) 모든 수술 단계는 추가 염증 및 과도한 흉터 조직 형성을 방지하기 위해 뇌 손상을 최소화하기 위해 수행되어야합니다. (3) 수술 초기에 주어지고 수술 중에 유지되는 마취 용량, 특히 복강내 투여된 마취 용량은 신중하게 고려될 필요가 있다. 마취 용량은 다른 마우스 균주에 따라 변형될 수 있으며, 일부는 더 민감할 수 있다. (4) 수술 중 마우스의 상태를 지속적으로 모니터링해야합니다. 마지막으로, (5) 마우스는 수술 후 많은 합병증이 발생할 수 있으므로 수술 후 정기적으로 모니터링해야합니다.
GRIN 렌즈 이식 단계 동안 뇌 조직의 덩어리가 일방적으로 제거되었지만, 우리는 명백한 행동 결핍 7,12을 관찰하지 못했습니다. 미니 스코프의 무게는 약 2 그램이며 케이블은 가볍게 만들고 마우스가 쉽게 운반 할 수 있도록 맞춤 설계되었습니다. 미니스코프와 케이블은 생체 내 이미징 전에 동물에게만 부착되고 이미징 후 분리됩니다. 전체 이미징 프로세스는 일반적으로 30 분을 넘지 않습니다. 따라서 이러한 계측기는 마우스가 자유롭게 작동하는 것을 방지하지 못합니다. 미니 스코프 설치 및 제거 단계는 동물 억제를 목적으로 이소플루란으로 간단한 마취 (2 분 미만)가 필요합니다. 우리는 전형적으로 마우스가 생체내 영상화를 수행하기 전에 30분 동안 이소플루란의 짧은 노출로부터 회복되게 한다. 우리는 마우스 건강과 마우스 사회적 행동에 어떤 영향도 느끼지 않고 몇 주 동안 일주일에 한 번 미니 스코프 생체 내 칼슘 이미징을 수행했습니다12.
현재 미니스코프 기록 시스템의 주요 한계 중 하나는 데이터 수집을 위해 현미경을 케이블에 연결해야한다는 것입니다. 케이블이 있으면 마우스 작업 성능이 제한되고 한 번에 한 마리의 동물이 기록되는 것이 제한됩니다. 최근에는 무선 미니스코프가 개발되었습니다25,26. 이것은 작업 성능을 넓히고 그룹의 여러 동물로부터 동시에 생체 내 이미징을 가능하게합니다. 또한, 이중 컬러 미니스코프와 결합된 분광적으로 분리가능한 파장을 가진 더 민감한 GECI를 개발하면 신경 과학 연구에 더 흥미로운 가능성을 제공할 것입니다.
공개
저자는 경쟁하는 재정적 이익을보고하지 않습니다.
감사의 말
이 작업은 NIH (National Institute of Health) 5P20GM121310, R61NS115161 및 UG3NS115608의 보조금으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
참고문헌
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987(2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173(2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174(2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유