需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
原发性患者特异性主动脉平滑肌细胞的分离和体外半定量实时收缩测量
摘要
本文介绍了一种基于外植体培养的方法,用于分离和培养原代患者特异性人主动脉平滑肌细胞和真皮成纤维细胞。此外,还提出了一种用于测量细胞收缩和后续分析的新方法,可用于研究这些细胞中患者特异性差异。
摘要
平滑肌细胞(SMC)是主动脉介质中的主要细胞类型。它们的收缩机制对于主动脉中力的传递很重要,并调节血管收缩和血管舒张。编码SMC收缩器官蛋白的基因突变与主动脉疾病有关,例如胸主动脉瘤。 在体外 测量SMC收缩具有挑战性,特别是以高通量方式,这对于筛查患者材料至关重要。当前可用的方法不适合此目的。本文提出了一种基于电电池基板阻抗传感(ECIS)的新方法。首先,描述了一种外植体方案,用于从主动脉活检和患者特异性人原发性真皮成纤维细胞中分离出患者特异性人原发性SMC,以研究主动脉瘤。接下来,详细描述了一种新的收缩方法来测量这些细胞的收缩反应,包括随后的分析和比较不同组的建议。该方法可用于在转化(心血管)研究以及患者和药物筛选研究的背景下研究贴壁细胞的收缩。
引言
平滑肌细胞(SMC)是主动脉内侧层中的主要细胞类型,是主动脉最厚的一层。在壁内,它们是径向的,除其他功能外,还参与血管收缩和血管舒张1。SMC收缩机制通过与细胞外基质2的功能连接参与主动脉中力的传递。编码SMC收缩器官蛋白质的基因突变,如平滑肌肌球蛋白重链(MYH11)和平滑肌肌动蛋白(ACTA2),与家族性胸主动脉瘤病例有关,强调了SMC收缩在维持主动脉结构和功能完整性方面的相关性1,2.此外,TGFβ信号通路中的突变也与主动脉瘤有关,它们在主动脉瘤病理生理学中的作用也可以在皮肤成纤维细胞中研究3。
体外SMC收缩的高通量测量具有挑战性。由于SMC收缩力不能在人体体内测量,因此在人体细胞上进行体外测定是一种可行的替代方案。此外,动物模型中的腹主动脉瘤(AAA)发展要么是由弹性蛋白酶灌注等化学诱导的,要么是由特定突变引起的。因此,动物数据不能与人类的AAA发展相提并论,后者大多具有多因素原因,例如吸烟,年龄和/或动脉粥样硬化。体外迄今为止,SMC收缩力主要通过牵引力显微镜4,5,荧光细胞内钙通量6的定量和胶原皱纹测定7来测定。虽然牵引力显微镜提供了对单个细胞产生的力的宝贵数字洞察力,但由于复杂的数学数据处理和一次分析一个细胞,它不适合高通量筛选,这意味着测量每个供体的代表性细胞数量非常耗时。Fura-2染料和胶原起皱测定允许表面上确定收缩,并且不能给出精确的数值输出,使它们不太适合区分患者特异性差异。通过优化一种测量体外SMC收缩的新方法,首次证明了腹主动脉瘤患者主动脉瘤患者主动脉瘤细胞中SMC收缩受损8。这是通过重新利用电电池基板阻抗传感(ECIS)方法完成的。ECIS是一种实时的中等通量测定法,用于定量贴壁细胞行为和收缩9,10,11,例如SMC生长和伤口愈合和迁移测定中的行为12,13,14。确切的方法在协议部分进行了描述。以这种优化的方式,ECIS也可用于研究成纤维细胞收缩,因为它们的大小和形态相似。
本文的目的是逐步描述使用ECIS8测量体外SMC收缩的方法,并比较对照组和患者SMC之间的收缩。首先,解释了原代SMC从对照和患者主动脉活检中的分离和培养,可用于收缩测量。其次,描述了收缩测量和分析,以及SMC标志物表达的验证。此外,本文描述了分离患者特异性真皮成纤维细胞的方法,其收缩可以使用相同的方法测量。这些细胞可用于专注于主动脉瘤或其他心血管病理学的患者特异性研究15,或使用转分化方案的预后研究,其允许在动脉瘤手术前进行收缩测量16。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:在阿姆斯特丹大学医学中心,阿姆斯特丹VU大学医学中心,Zaans Medisch Centrum,Zaandam和荷兰霍恩的Dijklander医院的开放动脉瘤修复期间获得了主动脉瘤活检。控制主动脉组织是从附着在肾动脉上的主动脉碎片获得的,用于肾移植。仅纳入18岁以上的患者,所有患者都表示知情同意参加该研究。所有材料均按照赫尔辛基WMA宣言的规定和VU医疗中心医学伦理委员会的机构指南收集。所有实验和实验方案均按照机构指南进行,并得到VU医疗中心医学伦理委员会的批准。有关所用对照和患者细胞系的完整信息,请参阅 8。
1. 从主动脉活检中分离出原发性人类SMC
注意:在无菌组织培养层流罩下执行以下步骤。在处理人体血液和人体组织样本时,戴上手套并使用标准无菌技术。SMC在231人血管平滑肌细胞基础培养基中培养,补充有100 U / mL青霉素,100μg/ mL链霉素和平滑肌生长补充剂称为 SMC培养基。
- 将两对手术镊子和手术刀浸入70%乙醇中,然后将其擦干,对它们进行灭菌。
- 在培养皿中移液2 mL SMC培养基,其中将进行组织解剖。
- 将2.5 mL SMC培养基移液到两个T25烧瓶中。旋转烧瓶,使少量的培养基覆盖整个表面。
- 将收获的人类主动脉壁活检从手术室运送到实验室,在无菌塑料管中用冷的无菌组织转移溶液(见 材料表)或0.9%NaCl。
- 打开带有组织培养罩内组织的管子。使用灭菌的镊子将活检从管中取出,并将其置于培养皿中(图1A)。
- 目视检查活检以识别三个主动脉层,即内膜内膜(内层)、内膜(中间)和外层(外层)。寻找内膜侧的动脉粥样硬化斑块和外膜侧的粘稠结缔组织(图1B)以区分层。
- 要将 SMC 与介质隔离,请卸下其他两层。首先将内膜斑块面朝上放置组织(图1B)。通过用镊子将其从组织中拉出,同时用另一对镊子将组织向下推,以去除固体斑块。去除随后的斑块层,直到粉红色,均匀的内侧层可见。
- 翻转组织(图1C)。重复与步骤 1.7 相同的过程,方法是拉出外延层(图 1D)。请务必根据需要多次尝试移除所有可见部件,因为此层不会轻易从介质上分离。
注意:必须正确去除内膜层和外膜层,以获得尽可能干净的SMC群体。 - 一旦内侧层被分离,将组织切成大约1 mm x 1 mm x 1 mm的立方体。用镊子向下按压培养基,然后用手术刀沿一个方向切割组织。不要来回切割;进行清洁的单向切割,以尽量减少损坏。根据活检的大小,尝试制作尽可能多的立方体(图1E)。
- 使用镊子将组织片放在T25烧瓶的上四分之一。如果材料量允许,每个烧瓶放置10-20个立方体(图1F)。
注意:使用光滑的镊子来最大限度地减少组织与镊子肋骨的粘附,并轻松将组织分离到烧瓶中。 - 在培养箱中将组织立方体在T25烧瓶中以5%CO2 在37°C下孵育约10天。
注意:预计第一个细胞会在那个时间左右生长。最初迁移的细胞可能看起来比普通的SMC小。 - 一旦观察到细胞生长,向烧瓶中加入2.5 mL培养基,确保不要将其移液到组织片上以防止它们分离。
- 大约再过5天后,当在组织片段周围观察到细胞簇时,改变培养基。如果组织片脱落,请将其取出,因为它们不会重新附着。
- 一旦细胞汇合80-90%,将它们转移到T75烧瓶中并继续以这种格式培养。
注意:建议使用 1:2 或 1:3 的分割比。在早期传代时冻结细胞的备份。细胞通常保持其性质直到传代10;后面的段落不应用于实验。
2. 从皮肤活检中分离原发性真皮成纤维细胞
注意:在无菌组织培养层流罩下执行以下步骤。在处理人体血液和人体组织样本时,戴上手套并使用标准无菌技术。成纤维细胞在补充有10%胎牛血清,100 U / mL青霉素和100μg/ mL链霉素的基础培养基中培养,称为 成纤维细胞培养基。
- 将两对手术镊子和手术刀浸入70%乙醇中,然后将其擦干,对它们进行灭菌。
- 在培养皿中移液2 mL成纤维细胞培养基,其中将进行组织解剖。
- 将2.5 mL成纤维细胞培养基移入两个T25烧瓶中。旋转烧瓶,使少量的培养基覆盖整个表面。
- 将收获的皮肤活检从手术室运送到冰上实验室,在冷的无菌组织转移溶液(见 材料表)或0.9%NaCl的无菌塑料管中。
- 打开带有组织培养罩内组织的管子。使用灭菌的镊子将活检从管中取出,并将其置于培养皿中(图2A)。
- 目视检查活检以识别三个皮肤层,表皮,真皮和皮下脂肪。寻找可识别的皮肤表面,有时有可见的头发,以识别表皮。在另一侧,寻找皮下脂肪,通常是黄色和粘稠的。确定表皮和皮下脂肪之间的层作为真皮 - 活成纤维细胞的来源(图2B)。
- 要从真皮中分离成纤维细胞,请去除其他两层并将组织放在其侧面,以便所有三层都可见。
注意:与主动脉组织不同,皮肤层不能彼此分开;因此,必须切割它们。组织也更橡胶,使其更难切割。使用锋利的手术刀。 - 用镊子按住组织。与表皮和真皮之间的边界平行切割。切除整个表皮。尝试切入一条干净的线,不要来回移动,以避免组织损伤。
- 翻转纸巾。重复与步骤2.8相同的过程;这一次,在真皮内切除与皮下脂肪平行的边界。
- 分离真皮后,将组织切成约1 x 1 x 1 mm3的立方体。用镊子向下按压组织,并使用手术刀沿一个方向切割组织。不要来回切割;进行清洁的单向切割,以尽量减少损坏。考虑到活检的大小,尝试制作尽可能多的立方体(图2C)。
- 使用镊子将组织片放在T25烧瓶的上四分之一。如果材料量允许,每个烧瓶放置10-20个立方体(图2D)。
注意:使用光滑的镊子来最大限度地减少组织与镊子肋骨的粘附,并轻松将组织分离到烧瓶中。 - 在培养箱中将组织立方体在T25烧瓶中以5%CO2 在37°C下孵育约10天。
注意:预计第一个细胞会在那附近生长。最初迁移的细胞可能看起来比正常的成纤维细胞小。 - 一旦观察到细胞生长,向烧瓶中加入2.5 mL培养基,确保不要将其移液到组织片上以防止它们分离。
- 大约5天后,当可以在组织片段周围观察到细胞簇时,改变培养基。如果组织片脱落,请将其取出,因为它们不会重新附着。
- 一旦细胞汇合80-90%,将它们转移到T75烧瓶中并继续以这种格式培养。
注意:建议使用 1:2 或 1:3 的分割比。在早期传代时冻结细胞的备份。细胞通常保持其性质直到传代10;后面的段落不应用于实验。
3. 测量收缩(例如SMC)
- 准备96w10e ECIS阵列(参见 图3A ,了解具有放大电极和电极接种细胞的阵列的代表性图像)。
注意:在无菌组织培养层流罩下执行以下步骤。- 在室温下,每孔用200μL 10mM L-半胱氨酸涂覆无菌96w10e阵列30分钟。
- 用无菌水清洗盘子两次。让板在组织培养罩中干燥过夜,盖子略微打开。
注意:仅在首次使用平板时才需要用L-半胱氨酸涂覆板。 - 第二天,紫外线杀菌板和盖子30分钟。向上转动盖子,使内部灭菌。板材灭菌后,请勿打开流罩外的板。
- 在 ECIS 阵列上接种细胞
- 在水浴中预热1%无菌明胶溶液30分钟。
注意:溶液储存在冰箱中,可能会凝固,使其难以移液。 - 随后,用每孔100μL1%明胶溶液涂覆孔,并将板在37°C下孵育至少1小时。
- 从孔中吸出明胶。
- 使用自动细胞计数器计数细胞,并在200μL SMC培养基中以30,000个细胞/孔的接种密度一式三份接种SMC。
- 将板与SMC一起放入细胞培养箱中的ECIS 96孔架中。双击 ECIS 应用生物物理学软件 以打开程序,然后按 "设置" 按钮。
- 检查所有电极是否都与左侧下部标记为 "孔配置"的支架(绿色;如果没有连接,则为红色)接触。如果电极连接不正确,请在开始测量之前调整支架中的板。
- 通过单击阵列类型在同一面板中选择板类型(96 孔 阵列)。
- 在右上方面板" 数据收集设置"中,单击 单频率 并将阻抗值更改为 4000 Hz ,将间隔更改为 8 s。
- 单击" 开始 "按钮开始测量。等待新面板打开,其中可以保存 ECIS 文件。
- 让细胞附着并建立单层48小时。
注意:电极上的细胞附着和扩散产生基线电阻值(图3B)。
- 在水浴中预热1%无菌明胶溶液30分钟。
- 刺激细胞诱导收缩
- 通过用10μg/ mL钙离子载体,离子霉素刺激细胞来诱导SMC收缩。
注意:离子霉素将诱导细胞外Ca2 +的流入,激活收缩级联反应;参见 图4A ,了解未受刺激和受刺激的收缩细胞的代表性图像。 - 将1mg离子霉素粉末稀释在100μL二甲基亚砜中以制成10mg / mL的储备溶液,并在-20°C下储存10μL等分试样。 使用前,将离子霉素溶液在SMC培养基中以1:10稀释,以制备要添加到细胞中的工作溶液。
- 当阵列仍在细胞培养箱内的阵列支架中并且电极连接到系统时进行细胞刺激。
- 为了刺激细胞,取下盖子并将其放在培养箱内的无菌表面上。准备两个移液器,设定为2μL和150μL。
- 在开始刺激之前,按软件中的 标记 并发表评论。
注意:这将使在分析数据时更容易找到刺激的确切时间。 - 将2μL离子霉素工作溶液移液尽快移入每个孔中。一旦所有细胞都受到刺激,使用第二个移液管在孔中混合培养基。
注意:由于快速效果,没有必要在不同的细胞系和条件之间更换吸头。在刺激和混合的同时快速工作,因为离子霉素具有急性作用。当刺激满板时,一次最多刺激3列。每次刺激后,等待至少30分钟,直到下一次刺激,让细胞从由打开培养箱门引起的温度和CO2 变化中恢复。 - 刺激完成后,立即再次按 标记 以添加刺激已完成的注释。
- 完成刺激实验
- 记录离子霉素刺激后约5分钟的阻抗值。按 "完成"完成录制。
- 重复使用ECIS阵列最多三次:用无菌水洗涤孔两次,并用胰蛋白酶或类似试剂将板在37°C下孵育2-3小时。重复步骤 3.1.2 和 3.1.3。
- 通过用10μg/ mL钙离子载体,离子霉素刺激细胞来诱导SMC收缩。
- 导出数据
- 要导出数据,请单击 "文件|导出数据|到 Excel(已选定)。选择要保存文件的文件夹。
- 当程序要求合并或分离工作表时,单击" 分离 "。
- 分析收缩输出
- 为了计算收缩反应,请使用以下等式(1),其中C表示收缩(以与基线相比的变化百分比表示),预刺激(PrS)表示在离子霉素刺激前的阻力值(以Ω表示),刺激后(PoS)表示完成刺激后2分钟的阻力(以Ω表示)。
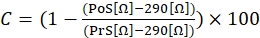 (1)
(1)
注意:如公式(1)所示,在最终计算中,从所有结果中减去填充没有任何附着细胞的培养基的孔的阻抗值(值为290 Ω)。建议在每个实验中一式三份测量收缩反应,并使用相同的细胞系进行三次独立实验,以解释任何实验间和实验内的变化。 - 执行三个独立实验后,通过计算三个测量值的平均值(包括标准偏差(SD))将数据分组在一起。
- 为了计算收缩反应,请使用以下等式(1),其中C表示收缩(以与基线相比的变化百分比表示),预刺激(PrS)表示在离子霉素刺激前的阻力值(以Ω表示),刺激后(PoS)表示完成刺激后2分钟的阻力(以Ω表示)。
- 比较不同的组
- 为了定义正常收缩的范围并调查随后的特定研究问题,使用对照组定义"正常收缩",并将其与患者或治疗组的收缩反应进行比较。
- 计算整个对照组的平均值和SD,即所有细胞系的结束值,如步骤3.5.2中所述。
- 使用平均± 2SD 的范围来识别另一组中超出此范围的细胞,表明它们具有改变的收缩反应。
注意:收缩反应改变背后的机制取决于特定的研究问题,并且是细胞和条件依赖性的,不会在本方案中讨论。
4. 检测 SMC 特定标记物的存在
- 核糖核酸分离
- 在6孔板中接种用于收缩测量的相同患者特异性细胞系,每个细胞系一个孔。使用自动细胞计数器计数细胞,并在SMC培养基中以200,000个细胞/孔的接种密度接种细胞,并允许它们附着过夜。
- 用无菌PBS洗涤细胞一次。
- 裂解细胞并根据制造商的说明分离细胞。
- 中密度脂腺苷酸合成
- 在20μL逆转录反应混合物中进行cDNA合成。根据制造商提供的说明稀释总分离RNA的浓度。
- qPCR
- 测量SMC标记基因的基因表达,例如 ACTA2,CNN1,SMTN 和 TAGLN ,以确认分离的细胞确实是SMC并检测SMC标记物。检查结果与收缩输出的相关性。
- 使用至少两个管家基因来规范化数据,例如 YWHAZ 和 TBP。
注意:qPCR运行和分析可以使用不同的PCR机器和兼容软件进行,具体取决于实验室中可用和优化的内容。关于引物序列 ,见补充表S1 。
Access restricted. Please log in or start a trial to view this content.
结果
为了测试该方法的可重复性,该方法首先仅使用对照SMC进行验证。为了确定实验间测量的再现性,将所有纳入的对照和患者细胞系的两个独立测量绘制为Bland-Altman图(图3B)。该图表明,除了一个异常值细胞系外,该方法在置信区间之外没有显示出变异性。此外,这些结果表明,在同一实验中播种并同时刺激的两个孔显示出几乎相同的收缩反应曲线(图4C
Access restricted. Please log in or start a trial to view this content.
讨论
本文提出了一种基于阻抗和表面占用变化 的体外测量SMC收缩的方法。首先,描述了患者特异性原代人类SMC和皮肤成纤维细胞的分离,培养和扩增,然后描述了如何使用它们进行收缩测量。
该研究的局限性与通过外植体方案获得细胞有关。从活检中增殖的细胞可能具有与 体内原始组织不同的性质。此外,这里介绍的外植体方案并不具有创新性,但包括用于提供?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突需要声明。
致谢
我们要感谢Tara van Merrienboer,Albert van Wijk,Jolanda van der Velden,Jan D. Blankensteijn,Lan Tran,Peter L. Hordijk,PAREL-AAA团队以及阿姆斯特丹UMC,Zaans Medisch Centrum和Dijklander医院的所有血管外科医生为这项研究提供了材料和支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 96-well Array | Applied Biophysics | 96W10idf PET | Array used to measure contraction in the ECIS setup |
| Custodiol | Dr. Franz Höhler Chemie GmbH | RVG 12801 | Solution used to transfer tissue in from surgery room to laboratorium |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | Solution used to dilute ionomycin |
| Fetal Bovine Serum | Gibco | 26140079 | Addition to cell culture medium |
| Ham's F-10 Nutrient Mix | Gibco | 11550043 | Medium used to culture skin fibroblasts |
| Human Vascular Smooth Muscle Cell Basal Medium (formerly ''Medium 231'') | Gibco | M231500 | Medium used to culture smooth muscle cells |
| Invitrogen countess II | Thermo Fisher Scientific | AMQAX1000 | Automated cell counter |
| Ionomycin calcium salt from Streptomyces conglobatus | Sigma-Aldrich | I0634-1MG | Compound used for contraction stimulation |
| NaCl 0.9% | Fresenius Kabi | B230561 | Solution used to transfer tissue in from surgery room to laboratorium |
| Penicillin-Streptomycin | Gibco | 15140122 | Antibiotics used for cell culture medium |
| Phospathe buffered saline | Gibco | 10010023 | Used to wash cells |
| Quick-RNA Miniprep Kit | Zymo Research | R1055 | Kit used for RNA isolation |
| Smooth Muscle Growth Supplement (SMGS) | Gibco | S00725 | Supplement which is added to smooth muscle cell culture medium |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | Kit used for cDNA synthesis |
| SYBR Green PCR Master Mix | Thermo Fisher Scientific | 4309155 | Reagent for qPCR |
| Trypsin-EDTA | Gibco | 15400-054 | Used to trypsinize cells |
| ZTheta | Applied Biophysics | ZTheta | ECIS instrument used for contraction measurements |
参考文献
- Milewicz, D. M., et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction. Annual Review of Genomics and Human Genetics. 9, 283-302 (2008).
- Milewicz, D. M., et al. Altered smooth muscle cell force generation as a driver of thoracic aortic aneurysms and dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (1), 26-34 (2017).
- Groeneveld, M. E., et al. Betaglycan (TGFBR3) up-regulation correlates with increased TGF-β signaling in Marfan patient fibroblasts in vitro. Cardiovascular Pathology. 32, 44-49 (2018).
- Chen, J., Li, H., SundarRaj, N., Wang, J. H. C. Alpha-smooth muscle actin expression enhances cell traction force. Cell Motility and the Cytoskeleton. 64 (4), 248-257 (2007).
- Peyton, S. R., Putnam, A. J. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. Journal of Cellular Physiology. 204 (1), 198-209 (2005).
- Williams, D. A., Fogarty, K. E., Tsien, R. Y., Fay, F. S. Calcium gradients in single smooth muscle cells revealed by the digital imaging microscope using Fura-2. Nature. 318 (6046), 558-561 (1985).
- Wu, D., et al. NLRP3 (nucleotide oligomerization domain-like receptor family, pyrin domain containing 3)-caspase-1 inflammasome degrades contractile proteins: implications for aortic biomechanical dysfunction and aneurysm and dissection formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (4), 694-706 (2017).
- Bogunovic, N., et al. Impaired smooth muscle cell contractility as a novel concept of abdominal aortic aneurysm pathophysiology. Scientific Reports. 9 (1), 1-14 (2019).
- Hurst, V., Goldberg, P. L., Minnear, F. L., Heimark, R. L., Vincent, P. A. Rearrangement of adherens junctions by transforming growth factor-β1: role of contraction. American Journal of Physiology-Lung Cellular and Molecular Physiology. 276 (4), 582-595 (1999).
- Hu, N., et al. Comparison between ECIS and LAPS for establishing a cardiomyocyte-based biosensor. Sensors and Actuators B: Chemical. 185, 238-244 (2013).
- Peters, M. F., Lamore, S. D., Guo, L., Scott, C. W., Kolaja, K. L. Human stem cell-derived cardiomyocytes in cellular impedance assays: bringing cardiotoxicity screening to the front line. Cardiovascular Toxicology. 15 (2), 127-139 (2015).
- Zhang, S., Yang, Y., Kone, B. C., Allen, J. C., Kahn, A. M. Insulin-stimulated cyclic guanosine monophosphate inhibits vascular smooth muscle cell migration by inhibiting Ca/calmodulin-dependent protein kinase II. Circulation. 107 (11), 1539-1544 (2003).
- Halterman, J. A., Kwon, H. M., Zargham, R., Bortz, P. D. S., Wamhoff, B. R. Nuclear factor of activated T cells 5 regulates vascular smooth muscle cell phenotypic modulation. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (10), 2287-2296 (2011).
- Bass, H. M., Beard, R. S., Cha, B. J., Yuan, S. Y., Nelson, P. R. Thrombomodulin induces a quiescent phenotype and inhibits migration in vascular smooth muscle cells in vitro. Annals of Vascular Surgery. 30, 149-156 (2016).
- Burger, J., et al. Molecular phenotyping and functional assessment of smooth muscle like-cells with pathogenic variants in aneurysm genes ACTA2, MYH11, SMAD3 and FBN1. Human Molecular Genetics. , (2021).
- Yeung, K. K., et al. Transdifferentiation of human dermal fibroblasts to smooth muscle-like cells to study the effect of MYH11 and ACTA2 mutations in aortic aneurysms. Human Mutation. 38 (4), 439-450 (2017).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。