JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
일차 환자 특이적 대동맥 평활근 세포 및 체외에서 반정량적 실시간 수축 측정의 분리
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 원발성, 환자 특이적 인간 대동맥 평활근 세포 및 진피 섬유아세포의 분리 및 배양을 위한 explant 배양 기반 방법을 기술한다. 또한, 세포 수축 및 후속 분석을 측정하기위한 새로운 방법이 제시되며, 이는 이들 세포의 환자 별 차이를 연구하는 데 사용될 수 있습니다.
초록
평활근 세포 (SMCs)는 대동맥 매질에서 우세한 세포 유형이다. 그들의 수축 기계는 대동맥에서 힘의 전달에 중요하며 혈관 수축과 혈관 확장을 조절합니다. SMC 수축 장치 단백질을 코딩하는 유전자의 돌연변이는 대동맥류, 예컨대 흉부 대동맥류와 관련이 있다. 시험관 내에서 SMC 수축을 측정하는 것은 특히 환자 물질 스크리닝에 필수적인 높은 처리량 방식으로 도전적입니다. 현재 사용 가능한 방법은 이러한 목적에 적합하지 않습니다. 이 논문은 전기 셀 기판 임피던스 감지 (ECIS)에 기반한 새로운 방법을 제시합니다. 먼저, 대동맥류의 연구를 위해 대동맥류 연구를 위해 환자 특이적 인간 원발성 SMCs를 대동맥류 생검 및 환자 특이적 인간 원발성 진피 섬유아세포로부터 분리하기 위한 explant 프로토콜이 기술된다. 다음으로, 이들 세포의 수축 반응을 측정하기 위한 새로운 수축 방법에 대한 상세한 설명이 주어지며, 상이한 집단을 비교하기 위한 후속 분석 및 제안을 포함한다. 이 방법은 번역 (심혈관) 연구 및 환자 및 약물 스크리닝 연구의 맥락에서 부착성 세포의 수축을 연구하는데 사용될 수 있다.
서문
평활근 세포 (SMCs)는 대동맥의 가장 두꺼운 층인 대동맥 내측 층에서 우세한 세포 유형이다. 벽 내에서, 그들은 방사상 지향적이며 다른 기능들 중에서도 혈관 수축 및 혈관 확장에 관여합니다1. SMC 수축 기계는 세포외 매트릭스(2)와의 기능적 링크를 통해 대동맥에서의 힘의 전달에 관여한다. 평활근 미오신 중쇄 (MYH11) 및 평활근 액틴 (ACTA2)과 같은 SMC 수축 장치의 단백질을 암호화하는 유전자의 돌연변이는 가족 흉부 대동맥류의 경우와 관련이 있으며, 대동맥의 구조적 및 기능적 완전성을 유지하는 데 SMC 수축의 관련성을 강조합니다 1,2 . 또한, TGFβ 신호전달 경로의 돌연변이는 대동맥류와도 관련이 있으며, 대동맥류에서의 병태생리학에서의 그 효과는 피부 섬유아세포3에서도 연구될 수 있다.
시험관 내에서 SMC 수축의 높은 처리량 측정은 도전적입니다. SMC 수축성은 인간에서 생체 내에서 측정 될 수 없기 때문에 인간 세포에 대한 시험관 내 분석은 실현 가능한 대안을 제시합니다. 더욱이, 동물 모델에서의 복부 대동맥류(AAA) 발달은 예를 들어, 엘라스타제 관류에 의해 화학적으로 유도되거나, 또는 특정 돌연변이에 의해 유발된다. 따라서 동물 데이터는 흡연, 연령 및 / 또는 죽상 동맥 경화증과 같은 다각적 인 원인을 가진 인간의 AAA 발달과 비교할 수 없습니다. 시험관내 SMC 수축성은 지금까지 주로 견인력 현미경4,5, Fura-2 형광 세포내 칼슘 플럭스6의 정량화 및 콜라겐 주름 분석7에 의해 측정되었다. 견인력 현미경 검사는 단일 세포에 의해 생성 된 힘에 대한 귀중한 숫자 통찰력을 제공하지만 복잡한 수학적 데이터 처리 및 한 번에 하나의 세포 분석으로 인해 높은 처리량 스크리닝에는 적합하지 않으므로 기증자 당 대표적인 세포 수를 측정하는 데 매우 많은 시간이 소요됩니다. Fura-2 염료 및 콜라겐 주름 분석은 수축의 피상적 인 결정을 허용하고 정확한 수치 출력을 제공하지 않으므로 환자 별 차이를 구별하는 데 적합하지 않습니다. 복부 대동맥류 환자의 대동맥류로부터 유래된 세포에서 손상된 SMC 수축은 시험관내8에서 SMC 수축을 측정하기 위한 새로운 방법을 최적화함으로써 처음으로 입증되었다. 이는 전기 셀-기판 임피던스 감지(ECIS) 방법을 용도 변경함으로써 수행되었다. ECIS는 상처 치유 및 이동 분석(12,13,14)에서 SMC 성장 및 거동과 같은 부착성 세포 거동 및 수축 9,10,11의 정량화를 위한 실시간 중간 처리량 분석법이다. 정확한 방법은 프로토콜 섹션에 설명되어 있습니다. 이러한 최적화된 방식으로, ECIS는 또한 유사한 크기 및 형태학으로 인해 섬유아세포 수축을 연구하는데 사용될 수 있다.
이 논문의 목적은 ECIS8을 사용하여 시험관 내에서 SMC 수축을 측정하고 대조군과 환자 SMC 간의 수축을 비교하는 방법에 대한 단계적 설명을 제공하는 것입니다. 첫째, 대조군 및 환자 대동맥 생검으로부터 일차 SMCs의 분리 및 배양이 설명되며, 이는 수축 측정에 사용될 수 있다. 둘째, 수축 측정 및 분석, SMC 마커 발현의 검증이 설명된다. 또한,이 논문은 동일한 방법론을 사용하여 수축을 측정 할 수있는 환자 특정 진피 섬유 아세포의 분리 방법을 설명합니다. 이들 세포는 대동맥류 또는 다른 심혈관 병리(15)에 초점을 맞춘 환자 특이적 연구 또는 동맥류 수술 전에 수축 측정을 허용하는 전분화 프로토콜을 이용한 예후 연구(16)에 사용될 수 있다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고 : 대동맥 생검은 암스테르담 대학 의료 센터, VU 대학 의료 센터, 암스테르담, Zaans Medisch Centrum, Zaandam 및 Dijklander 병원, Hoorn, 네덜란드에서 열린 동맥류 수리 중에 얻어졌습니다. 대조군 대동맥 조직은 신장 이식을 위해 수확된 신장 동맥에 부착된 대동맥의 조각으로부터 수득되었다. 18 세 이상의 환자 만 포함되었으며 모든 환자는 연구에 참여하기 위해 정보에 입각 한 동의를했습니다. 모든 자료는 헬싱키 WMA 선언의 규정과 VU 의료 센터의 의료 윤리위원회의 제도적 지침에 따라 수집되었습니다. 모든 실험 및 실험 프로토콜은 제도적 지침에 따라 수행되었으며 VU 의료 센터의 의료 윤리위원회의 승인을 받았습니다. 사용된 대조군 및 환자 세포주에 대한 완전한 정보는 8을 참조한다.
1. 대동맥 생검에서 일차 인간 SMC를 분리하는 것
참고: 멸균 조직 배양 층류 후드 아래에서 다음 단계를 수행하십시오. 인간의 혈액과 인간 조직 샘플을 취급 할 때 장갑을 착용하고 표준 무균 기술을 사용하십시오. SMC는 100 U/mL 페니실린, 100 μg/mL 스트렙토마이신 및 SMC 배지로 불리는 평활근 성장 보충제가 보충된 231 인간 혈관 평활근 세포 기초 배지에서 배양됩니다.
- 두 쌍의 외과 용 포셉과 메스를 70 % 에탄올에 담근 다음 닦아서 멸균하십시오.
- 조직 해부가 수행될 페트리 접시에 SMC 배지 2 mL를 피펫한다.
- SMC 배지 2.5 mL를 두 개의 T25 플라스크에 피펫한다. 작은 양의 매체가 전체 표면을 덮을 수 있도록 플라스크를 소용돌이 치십시오.
- 수확 된 인간 대동맥벽 생검을 수술실에서 얼음 위의 실험실로 차가운 멸균 조직 전달 용액 ( 재료 표 참조) 또는 0.9 % NaCl로 멸균 플라스틱 튜브로 운반하십시오.
- 조직 배양 후드 내부의 조직이있는 튜브를 엽니 다. 멸균된 포셉을 사용하여 튜브 밖으로 생검을 꺼내 페트리 접시에 넣습니다(그림 1A).
- 생검을 육안으로 검사하여 세 개의 대동맥 층, tunica intima (내부), 미디어 (중간) 및 출현 (외부 층)을 확인합니다. 층을 구별하기 위해 내막 쪽에는 죽상 경화성 플라크가 있고 모험 쪽에는 칙칙한 결합 조직이 있는지 확인합니다 (그림 1B).
- 미디어에서 SMC를 분리하려면 다른 두 레이어를 제거합니다. 내막 플라크 쪽이 있는 조직을 먼저 위로 놓습니다(그림 1B). 고체 플라크를 포셉으로 조직에서 떼어내어 제거하고 다른 한 쌍의 포셉으로 조직을 밀어 내립니다. 분홍색의 균일 한 내측 층이 보일 때까지 플라크의 후속 층을 제거하십시오.
- 조직을 대칭 이동합니다(그림 1C). 모험 레이어를 당겨 1.7단계와 동일한 절차를 반복합니다(그림 1D). 이 레이어가 미디어에서 쉽게 분리되지 않으므로 필요한 만큼 많은 시도에서 보이는 모든 부분을 제거해야 합니다.
참고 : 가능한 한 깨끗한 SMC 인구를 얻기 위해 내막 및 모험 층을 적절하게 제거하는 것이 중요합니다. - 내측 층이 분리되면 조직을 약 1mm x 1mm x 1mm의 큐브로 자릅니다. 포셉으로 미디어를 아래로 누르고 메스를 사용하여 조직을 한 방향으로 자릅니다. 앞뒤로 자르지 마십시오. 손상을 최소화하기 위해 깨끗하고 단방향 절단을하십시오. 생검의 크기를 감안할 때 가능한 한 많은 큐브를 만들어보십시오(그림 1E).
- 조직 조각을 포셉을 사용하여 T25 플라스크의 상부 분기에 놓습니다. 재료의 양이 허용하는 경우 플라스크 당 10-20 큐브를 놓습니다 (그림 1F).
참고 : 부드러운 포셉을 사용하여 포셉의 갈비뼈에 대한 조직의 접착을 최소화하고 조직을 플라스크에 쉽게 분리하십시오. - 조직 큐브를 인큐베이터에서 37°C의 5% CO2에서 대략 10일 동안T25 플라스크에서 인큐베이션한다.
참고 : 첫 번째 세포 유출은 그 무렵에 예상됩니다. 처음에 마이그레이션하는 셀은 일반 SMC보다 작게 보일 수 있습니다. - 세포 성장이 관찰되면 플라스크에 배지 2.5mL를 넣고 조직 조각에 피펫을 넣어 분리되지 않도록하십시오.
- 대략 5일 후에 조직 조각 주위에 세포의 군집이 관찰되면 배양 배지를 변경한다. 조직 조각이 분리되면 다시 부착되지 않으므로 제거하십시오.
- 세포가 80-90 % 합류하면 T75 플라스크로 옮기고이 형식으로 배양을 계속하십시오.
참고: 1:2 또는 1:3 분할 비율을 사용하는 것이 좋습니다. 초기 통과시 세포의 백업을 동결하십시오. 세포는 일반적으로 10 계대까지 그들의 특성을 유지한다; 나중에 구절은 실험에 사용되어서는 안됩니다.
2. 피부 생검에서 원발성 진피 섬유아세포를 분리하는 것
참고: 멸균 조직 배양 층류 후드 아래에서 다음 단계를 수행하십시오. 인간의 혈액과 인간 조직 샘플을 취급 할 때 장갑을 착용하고 표준 무균 기술을 사용하십시오. 섬유아세포는 섬유아세포 배지로 지칭되는 10% 태아 소 혈청, 100 U/mL 페니실린 및 100 μg/mL 스트렙토마이신이 보충된 Basal 배지에서 배양 됩니다.
- 두 쌍의 외과 용 포셉과 메스를 70 % 에탄올에 담근 다음 닦아서 멸균하십시오.
- 조직 해부가 수행될 페트리 접시에 섬유아세포 배지 2 mL를 피펫한다.
- 섬유아세포 배지 2.5 mL를 피펫 두 개의 T25 플라스크에 넣었다. 작은 양의 매체가 전체 표면을 덮을 수 있도록 플라스크를 소용돌이 치십시오.
- 수확 된 피부 생검을 수술실에서 차가운 멸균 조직 전달 용액 ( 재료 표 참조) 또는 멸균 플라스틱 튜브의 0.9 % NaCl의 얼음 위에서 실험실로 운반하십시오.
- 조직 배양 후드 내부의 조직이있는 튜브를 엽니 다. 멸균된 포셉을 사용하여 튜브 밖으로 생검을 꺼내 페트리 접시에 넣습니다(그림 2A).
- 생검을 육안으로 검사하여 세 가지 피부 층, 표피, 진피 및 피하 지방을 확인합니다. 표피를 식별하기 위해 때로는 머리카락이있는 인식 가능한 피부 표면을 찾으십시오. 반대편에서 종종 노랗고 칙칙한 피하 지방을 찾으십시오. 표피와 피하 지방 사이의 층을 진피-생존 가능한 섬유아세포의 공급원으로서 확인한다(도 2B).
- 진피에서 섬유아세포를 분리하려면 다른 두 층을 제거하고 세 층 모두가 보이도록 조직을 옆으로 놓습니다.
참고 : 대동맥 조직과 달리 피부 층은 서로 분리 될 수 없습니다. 따라서 그들은 잘려야합니다. 조직은 또한 고무질이있어 절단하기가 더 어렵습니다. 날카로운 메스를 사용하십시오. - 포셉으로 조직을 잡으십시오. 표피와 진피 사이의 경계에 평행하게 자릅니다. 표피 전체를 잘라냅니다. 하나의 깨끗한 라인으로 자르고 조직 손상을 피하기 위해 앞뒤로 움직이지 마십시오.
- 조직을 뒤집습니다. 2.8단계와 동일한 절차를 반복합니다. 이번에는 피하 지방과의 경계에 평행한 진피 내에서 절단하십시오.
- 진피가 분리되면 조직을 약 1 x 1 x 1 mm3의 큐브로 자릅니다. 포셉으로 조직을 누르고 메스를 사용하여 조직을 한 방향으로 자릅니다. 앞뒤로 자르지 마십시오. 손상을 최소화하기 위해 깨끗하고 단방향 절단을하십시오. 생검의 크기를 감안할 때 가능한 한 많은 큐브를 만들어보십시오 (그림 2C).
- 조직 조각을 포셉을 사용하여 T25 플라스크의 상부 분기에 놓습니다. 재료의 양이 허용하는 경우 플라스크 당 10-20 큐브를 놓습니다 (그림 2D).
참고 : 부드러운 포셉을 사용하여 포셉의 갈비뼈에 대한 조직의 접착을 최소화하고 조직을 플라스크에 쉽게 분리하십시오. - 조직 큐브를 인큐베이터에서 37°C의 5% CO2에서 대략 10일 동안T25 플라스크에서 인큐베이션한다.
참고 : 첫 번째 세포 유출은 그 무렵에 예상됩니다. 처음에 이동하는 세포는 정상적인 섬유 아세포보다 작게 보일 수 있습니다. - 세포 성장이 관찰되면 플라스크에 배지 2.5mL를 넣고 조직 조각에 피펫을 넣어 분리되지 않도록하십시오.
- 대략 5일 후에 조직 조각 주위에 세포의 군집이 관찰될 수 있을 때, 배양 배지를 변경한다. 조직 조각이 분리되면 다시 부착되지 않으므로 제거하십시오.
- 세포가 80-90 % 합류하면 T75 플라스크로 옮기고이 형식으로 배양을 계속하십시오.
참고: 1:2 또는 1:3 분할 비율을 사용하는 것이 좋습니다. 초기 통과시 세포의 백업을 동결하십시오. 세포는 일반적으로 10 계대까지 그들의 특성을 유지한다; 나중에 구절은 실험에 사용되어서는 안됩니다.
3. 수축 측정(예: SMC)
- 96w10e ECIS 어레이를 준비한다(확대된 전극 및 전극 상에 시딩된 셀이 있는 어레이의 대표적인 이미지는 도 3A 참조).
참고: 멸균 조직 배양 층류 후드 아래에서 다음 단계를 수행하십시오.- 멸균된 96w10e 어레이를 웰 당 200 μL의 10 mM L-시스테인으로 실온에서 30분 동안 코팅한다.
- 멸균수로 접시를 두 번 씻으십시오. 뚜껑을 약간 열어 조직 배양 후드에서 플레이트를 밤새 말리십시오.
참고: 플레이트를 L-시스테인으로 코팅하는 것은 플레이트를 처음 사용할 때만 필요합니다. - 다음날, 30 분 동안 플레이트와 뚜껑을 UV로 살균하십시오. 뚜껑을 위쪽으로 돌려 내부가 살균되도록 합니다. 플레이트가 멸균되면 플로우 후드 외부에서 플레이트를 열지 마십시오.
- ECIS 어레이의 셀 시드
- 1 % 멸균 젤라틴 용액을 수조에서 30 분 동안 미리 따뜻하게하십시오.
참고 : 용액은 냉장고에 보관되어 응고 될 수 있으므로 피펫이 어려워집니다. - 이어서, 웰을 웰 당 1% 젤라틴 용액 100 μL로 코팅하고, 플레이트를 적어도 1시간 동안 37°C에서 인큐베이션한다.
- 우물에서 젤라틴을 흡인하십시오.
- 자동화 된 세포 계수기를 사용하여 세포를 계수하고 SMC 배지의 200 μL에 30,000 세포 / 웰의 시딩 밀도로 삼중으로 SMC를 시드하십시오.
- SMCs가 있는 플레이트를 ECIS 96-웰 홀더에 넣고 세포 배양 인큐베이터에 넣는다. ECIS 응용 생물물리학 소프트웨어를 두 번 클릭하여 프로그램을 열고 설정 단추를 누릅니다.
- 모든 전극이 오른쪽 구성이라고 표시된 왼쪽 하단 패널의 홀더(녹색, 연결되지 않은 경우 빨간색)와 접촉하는지 확인합니다. 전극이 제대로 연결되지 않은 경우 측정을 시작하기 전에 홀더의 플레이트를 조정하십시오.
- 배열 유형을 클릭하여 동일한 패널에서 플레이트 유형(96웰 배열)을 선택합니다.
- 오른쪽 상단 패널 데이터 수집 설정에서 단일 주파수 를 클릭하고 임피던스 값을 4000Hz 로, 간격을 8초로 변경합니다.
- 시작 단추를 클릭하여 측정을 시작합니다. ECIS 파일을 저장할 수 있는 새 패널이 열릴 때까지 기다립니다.
- 세포가 부착되도록 허용하고 48 시간 동안 단층을 확립하십시오.
참고: 전극에 셀을 부착하고 확산하면 기준 저항 값이 생성됩니다(그림 3B).
- 1 % 멸균 젤라틴 용액을 수조에서 30 분 동안 미리 따뜻하게하십시오.
- 수축을 유도하는 세포의 자극
- 10 μg/mL의 칼슘 이오노포어, 이오노마이신으로 세포를 자극하여 SMC 수축을 유도한다.
참고: 이오노마이신은 세포외Ca2+의 유입을 유도하여 수축성 캐스케이드를 활성화시킵니다. 자극되지 않고 자극된 수축된 세포의 대표적인 이미지에 대해서는 도 4A 를 참조한다. - 이오노마이신 분말 1mg을 디메틸설폭사이드 100μL에 희석하여 10mg/mL의 원액을 만들고 -20°C에서 10μL 분취량을 저장한다. 사용 전에, 이오노마이신 용액을 SMC 배지에 1:10으로 희석하여 세포에 첨가될 작업 용액을 제조하였다.
- 어레이가 세포 배양 인큐베이터 내부의 어레이 홀더에 여전히 있고 전극이 시스템에 부착되어 있는 동안 세포 자극을 수행하십시오.
- 세포를 자극하려면 뚜껑을 제거하고 인큐베이터 내부의 멸균 표면에 놓습니다. 2 μL 및 150 μL로 설정된 두 개의 피펫을 준비하십시오.
- 자극을 시작하기 전에 소프트웨어에서 Mark 를 누르고 주석을 달으십시오.
참고: 이렇게 하면 데이터를 분석할 때 자극의 정확한 타이밍을 쉽게 찾을 수 있습니다. - 2 μL의 이오노마이신 작업 용액을 가능한 한 빨리 각 웰에 피펫한다. 일단 모든 세포가 자극되면, 두 번째 피펫을 사용하여 웰에 배지를 혼합한다.
참고 : 빠른 효과로 인해 다른 세포주와 조건 사이의 팁을 변경할 필요가 없습니다. 이오노마이신이 급성 효과를 갖기 때문에 자극하고 혼합하면서 빠르게 작업하십시오. 전체 플레이트를 자극 할 때 한 번에 최대 3 개의 열을 자극하십시오. 모든 자극 후에, 다음 자극이 세포가 인큐베이터 도어의 개방에 의해 야기된 온도 및CO2 변화로부터 회복되게 할 때까지 적어도 30분 동안 기다린다. - 자극이 완료된 직후, Mark 를 다시 눌러 자극이 완료되었다는 주석을 추가합니다.
- 자극 실험 완료
- 이오노마이신 자극 후 약 5분 동안 임피던스 값을 기록한다. 마침을 눌러 녹음을 마칩니다.
- ECIS 어레이를 최대 3회 재사용: 웰을 멸균수로 두 번 세척하고, 플레이트를 트립신 또는 유사한 시약으로 2-3시간 동안 37°C에서 인큐베이션한다. 3.1.2단계와 3.1.3단계를 반복합니다.
- 10 μg/mL의 칼슘 이오노포어, 이오노마이신으로 세포를 자극하여 SMC 수축을 유도한다.
- 데이터 내보내기
- 데이터를 내보내려면 파일 | | 데이터 내보내기 엑셀로(선택됨). 파일을 저장할 폴더를 선택합니다.
- 프로그램에서 시트를 결합하거나 분리 하도록 요청하면 분리를 클릭합니다.
- 수축 출력 분석
- 수축 반응을 계산하기 위해, 다음 수학식 1을 사용하여, 여기서 C는 수축(기준선과 비교하여 변화의 %로 나타냄)을 나타내고, 프리자극(PrS)은 이오노마이신 자극 직전의 저항값(Ω으로 표현됨)을 나타내고, 자극 후 2분 후에 저항(Ω으로 표시됨)을 나타낸다.
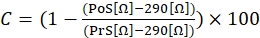 (1)
(1)
참고: 수학식 1과 같이, 부착된 세포가 없는 배지로 채워진 웰의 임피던스 값(290 Ω의 값)은 최종 계산의 모든 결과에서 뺍니다. 각 실험에서 삼중으로 수축 반응을 측정하고 실험 간 및 실험 내 변이를 설명하기 위해 동일한 세포주로 세 가지 독립적 인 실험을 수행하는 것이 좋습니다. - 세 가지 독립적인 실험이 수행되면, 표준 편차(SD)를 포함하는 세 가지 측정치의 평균을 계산하여 데이터를 함께 그룹화합니다.
- 수축 반응을 계산하기 위해, 다음 수학식 1을 사용하여, 여기서 C는 수축(기준선과 비교하여 변화의 %로 나타냄)을 나타내고, 프리자극(PrS)은 이오노마이신 자극 직전의 저항값(Ω으로 표현됨)을 나타내고, 자극 후 2분 후에 저항(Ω으로 표시됨)을 나타낸다.
- 서로 다른 그룹 비교
- 정상 수축의 범위를 정의하고 후속 특정 연구 질문을 조사하려면 대조군을 사용하여 "정상 수축"을 정의하고 환자 또는 치료 그룹의 수축 반응과 비교하십시오.
- 단계 3.5.2에 기재된 바와 같이, 전체 대조군, 즉 모든 세포주에 대한 최종 값의 평균 및 SD를 계산한다.
- 평균 ± 2SD의 범위를 사용하여 이 범위를 벗어나는 다른 그룹의 세포를 식별하여 변경된 수축 반응이 있음을 나타냅니다.
참고 : 변경된 수축 반응의 메커니즘은 특정 연구 질문의 대상이되며 세포 및 상태에 따라 다르며이 프로토콜에서는 논의되지 않습니다.
4. SMC 특정 마커의 존재 감지
- RNA 분리
- 수축 측정에 사용된 동일한 환자 특이적 세포주를 6-웰 플레이트에 시딩하고, 세포주 당 하나의 웰에 시딩한다. 자동화 된 세포 카운터를 사용하여 세포를 계산하고 SMC 배지에서 200,000 세포 / 웰의 시딩 밀도로 세포를 시드하고 밤새 부착 할 수 있도록하십시오.
- 세포를 멸균 PBS로 한 번 세척한다.
- 세포를 용해시키고 제조업체의 지시에 따라 세포를 분리하십시오.
- cDNA 합성
- 역전사 반응 혼합물의 20 μL에서 cDNA 합성을 수행한다. 제조업체가 제공 한 지침에 따라 분리 된 총 RNA의 농도를 희석하십시오.
- qPCR
- SMC 마커 유전자, 예를 들어, ACTA2, CNN1, SMTN 및 TAGLN 의 유전자 발현을 측정하여 단리된 세포가 실제로 SMCs임을 확인하고 SMC 마커를 검출한다. 결과와 수축 출력의 상관 관계를 확인하십시오.
- 데이터를 정상화하기 위해 적어도 두 개의 하우스 키핑 유전자를 사용하십시오 (예 : YWHAZ 및 TBP).
참고: qPCR 실행 및 분석은 실험실에서 사용 가능하고 최적화된 제품에 따라 다른 PCR 기계 및 호환 소프트웨어를 사용하여 수행할 수 있습니다. 프라이머 서열에 대해서는 보충표 S1 을 참조한다.
Access restricted. Please log in or start a trial to view this content.
결과
이 방법의 재현성을 테스트하기 위해 이 방법은 먼저 제어 SMC만 사용하여 검증되었습니다. 실험간 측정 재현성을 결정하기 위해, 포함된 모든 대조군 및 환자 세포주에 대한 두 개의 독립적인 측정값을 Bland-Altman 플롯으로 플롯팅하였다(도 3B). 플롯은 이 방법이 하나의 이상치 세포주를 제외하고는 신뢰 구간 밖의 가변성을 나타내지 않는다는 것을 입증하였다. 또한, 이러한 ...
Access restricted. Please log in or start a trial to view this content.
토론
이 논문은 임피던스 및 표면 점유의 변화를 기반으로 시험관 내에서 SMC 수축을 측정하는 방법을 제시합니다. 먼저, 환자 특이적 일차 인간 SMC 및 피부 섬유아세포의 단리, 배양 및 확장이 설명되고, 이어서 수축 측정에 이를 사용하는 방법이 설명된다.
연구의 한계는 explant 프로토콜을 통해 세포를 얻는 것과 관련이 있습니다. 생검에서 증식하는 세포는 생체 내에서<...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
우리는 Tara van Merrienboer, Albert van Wijk, Jolanda van der Velden, Jan D. Blankensteijn, Lan Tran, Peter L. Hordijk, PAREL-AAA 팀 및 암스테르담 UMC, Zaans Medisch Centrum 및 Dijklander 병원의 모든 혈관 외과 의사가이 연구에 대한 자료와 지원을 제공 한 것에 대해 감사하게 생각합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 96-well Array | Applied Biophysics | 96W10idf PET | Array used to measure contraction in the ECIS setup |
| Custodiol | Dr. Franz Höhler Chemie GmbH | RVG 12801 | Solution used to transfer tissue in from surgery room to laboratorium |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | Solution used to dilute ionomycin |
| Fetal Bovine Serum | Gibco | 26140079 | Addition to cell culture medium |
| Ham's F-10 Nutrient Mix | Gibco | 11550043 | Medium used to culture skin fibroblasts |
| Human Vascular Smooth Muscle Cell Basal Medium (formerly ''Medium 231'') | Gibco | M231500 | Medium used to culture smooth muscle cells |
| Invitrogen countess II | Thermo Fisher Scientific | AMQAX1000 | Automated cell counter |
| Ionomycin calcium salt from Streptomyces conglobatus | Sigma-Aldrich | I0634-1MG | Compound used for contraction stimulation |
| NaCl 0.9% | Fresenius Kabi | B230561 | Solution used to transfer tissue in from surgery room to laboratorium |
| Penicillin-Streptomycin | Gibco | 15140122 | Antibiotics used for cell culture medium |
| Phospathe buffered saline | Gibco | 10010023 | Used to wash cells |
| Quick-RNA Miniprep Kit | Zymo Research | R1055 | Kit used for RNA isolation |
| Smooth Muscle Growth Supplement (SMGS) | Gibco | S00725 | Supplement which is added to smooth muscle cell culture medium |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | Kit used for cDNA synthesis |
| SYBR Green PCR Master Mix | Thermo Fisher Scientific | 4309155 | Reagent for qPCR |
| Trypsin-EDTA | Gibco | 15400-054 | Used to trypsinize cells |
| ZTheta | Applied Biophysics | ZTheta | ECIS instrument used for contraction measurements |
참고문헌
- Milewicz, D. M., et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction. Annual Review of Genomics and Human Genetics. 9, 283-302 (2008).
- Milewicz, D. M., et al. Altered smooth muscle cell force generation as a driver of thoracic aortic aneurysms and dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (1), 26-34 (2017).
- Groeneveld, M. E., et al. Betaglycan (TGFBR3) up-regulation correlates with increased TGF-β signaling in Marfan patient fibroblasts in vitro. Cardiovascular Pathology. 32, 44-49 (2018).
- Chen, J., Li, H., SundarRaj, N., Wang, J. H. C. Alpha-smooth muscle actin expression enhances cell traction force. Cell Motility and the Cytoskeleton. 64 (4), 248-257 (2007).
- Peyton, S. R., Putnam, A. J. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. Journal of Cellular Physiology. 204 (1), 198-209 (2005).
- Williams, D. A., Fogarty, K. E., Tsien, R. Y., Fay, F. S. Calcium gradients in single smooth muscle cells revealed by the digital imaging microscope using Fura-2. Nature. 318 (6046), 558-561 (1985).
- Wu, D., et al. NLRP3 (nucleotide oligomerization domain-like receptor family, pyrin domain containing 3)-caspase-1 inflammasome degrades contractile proteins: implications for aortic biomechanical dysfunction and aneurysm and dissection formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (4), 694-706 (2017).
- Bogunovic, N., et al. Impaired smooth muscle cell contractility as a novel concept of abdominal aortic aneurysm pathophysiology. Scientific Reports. 9 (1), 1-14 (2019).
- Hurst, V., Goldberg, P. L., Minnear, F. L., Heimark, R. L., Vincent, P. A. Rearrangement of adherens junctions by transforming growth factor-β1: role of contraction. American Journal of Physiology-Lung Cellular and Molecular Physiology. 276 (4), 582-595 (1999).
- Hu, N., et al. Comparison between ECIS and LAPS for establishing a cardiomyocyte-based biosensor. Sensors and Actuators B: Chemical. 185, 238-244 (2013).
- Peters, M. F., Lamore, S. D., Guo, L., Scott, C. W., Kolaja, K. L. Human stem cell-derived cardiomyocytes in cellular impedance assays: bringing cardiotoxicity screening to the front line. Cardiovascular Toxicology. 15 (2), 127-139 (2015).
- Zhang, S., Yang, Y., Kone, B. C., Allen, J. C., Kahn, A. M. Insulin-stimulated cyclic guanosine monophosphate inhibits vascular smooth muscle cell migration by inhibiting Ca/calmodulin-dependent protein kinase II. Circulation. 107 (11), 1539-1544 (2003).
- Halterman, J. A., Kwon, H. M., Zargham, R., Bortz, P. D. S., Wamhoff, B. R. Nuclear factor of activated T cells 5 regulates vascular smooth muscle cell phenotypic modulation. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (10), 2287-2296 (2011).
- Bass, H. M., Beard, R. S., Cha, B. J., Yuan, S. Y., Nelson, P. R. Thrombomodulin induces a quiescent phenotype and inhibits migration in vascular smooth muscle cells in vitro. Annals of Vascular Surgery. 30, 149-156 (2016).
- Burger, J., et al. Molecular phenotyping and functional assessment of smooth muscle like-cells with pathogenic variants in aneurysm genes ACTA2, MYH11, SMAD3 and FBN1. Human Molecular Genetics. , (2021).
- Yeung, K. K., et al. Transdifferentiation of human dermal fibroblasts to smooth muscle-like cells to study the effect of MYH11 and ACTA2 mutations in aortic aneurysms. Human Mutation. 38 (4), 439-450 (2017).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유