Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung primärer patientenspezifischer glatter Aortenmuskelzellen und semiquantitative Echtzeit-Kontraktionsmessungen in vitro
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Beitrag beschreibt eine explantationskulturbasierte Methode zur Isolierung und Kultivierung primärer, patientenspezifischer humaner Aortenglattmuskelzellen und dermaler Fibroblasten. Weiterhin wird eine neuartige Methode zur Messung der Zellkontraktion und anschließenden Analyse vorgestellt, mit der patientenspezifische Unterschiede in diesen Zellen untersucht werden können.
Zusammenfassung
Glatte Muskelzellen (SMCs) sind der vorherrschende Zelltyp in den Aortenmedien. Ihre kontraktile Maschinerie ist wichtig für die Kraftübertragung in der Aorta und reguliert die Vasokonstriktion und Vasodilatation. Mutationen in Genen, die für die SMC-kontraktilen Apparatusproteine kodieren, sind mit Aortenerkrankungen wie thorakalen Aortenaneurysmen assoziiert. Die Messung der SMC-Kontraktion in vitro ist eine Herausforderung, insbesondere im Hochdurchsatz, was für das Screening von Patientenmaterial unerlässlich ist. Derzeit verfügbare Methoden sind für diesen Zweck nicht geeignet. Dieser Beitrag stellt eine neuartige Methode vor, die auf der Impedanzmessung von elektrischen Zellen und Substraten (ECIS) basiert. Zunächst wird ein Explantationsprotokoll beschrieben, um patientenspezifische humane primäre SMCs aus Aortenbiopsien und patientenspezifischen humanen primären dermalen Fibroblasten zur Untersuchung von Aortenaneurysmen zu isolieren. Als nächstes wird eine detaillierte Beschreibung einer neuen Kontraktionsmethode gegeben, um die kontraktile Reaktion dieser Zellen zu messen, einschließlich der anschließenden Analyse und des Vorschlags zum Vergleich verschiedener Gruppen. Mit dieser Methode kann die Kontraktion adhärenter Zellen im Rahmen von translationalen (kardiovaskulären) Studien sowie Patienten- und Medikamenten-Screening-Studien untersucht werden.
Einleitung
Glatte Muskelzellen (SMCs) sind der vorherrschende Zelltyp in der Aortenmedialschicht, der dicksten Schicht der Aorta. Innerhalb der Wand sind sie radial orientiert und unter anderem an Vasokonstriktion und Vasodilatation beteiligt1. Die kontraktile SMC-Maschinerie ist an der Kraftübertragung in der Aorta durch die funktionelle Verbindung mit der extrazellulären Matrix2 beteiligt. Mutationen in Genen, die für die Proteine des SMC-kontraktilen Apparates kodieren, wie die schwere Kette der glatten Muskulatur Myosin (MYH11) und das glatte Muskelaktin (ACTA2), wurden mit Fällen von familiären thorakalen Aortenaneurysmen in Verbindung gebracht, was die Relevanz der SMC-Kontraktion für die Aufrechterhaltung der strukturellen und funktionellen Integrität der Aortaunterstreicht 1,2 . Darüber hinaus sind Mutationen im TGFβ-Signalweg auch mit Aortenaneurysmen assoziiert, und ihre Auswirkungen in der Pathophysiologie des Aortenaneurysmas können auch in Hautfibroblasten3 untersucht werden.
Die Hochdurchsatzmessung der SMC-Kontraktion in vitro ist eine Herausforderung. Da die SMC-Kontraktilität beim Menschen nicht in vivo gemessen werden kann, stellen In-vitro-Assays an menschlichen Zellen eine praktikable Alternative dar. Darüber hinaus wird die Entwicklung eines abdominalen Aortenaneurysmas (AAA) in Tiermodellen entweder chemisch induziert, beispielsweise durch Elastaseperfusion, oder durch eine spezifische Mutation verursacht. Daher sind Tierdaten nicht mit der AAA-Entwicklung beim Menschen vergleichbar, die meist eine multifaktorielle Ursache hat, wie Rauchen, Alter und/oder Atherosklerose. In vitro Die SMC-Kontraktilität wurde bisher hauptsächlich durch Zugkraftmikroskopie 4,5, Quantifizierung der intrazellulären Fura-2-Calciumflüsse6 und Kollagenfalten-Assays7 gemessen. Während die Zugkraftmikroskopie einen unschätzbaren numerischen Einblick in die von einer einzelnen Zelle erzeugten Kräfte bietet, ist sie aufgrund der komplexen mathematischen Datenverarbeitung und der Analyse einer Zelle nach der anderen nicht für ein Hochdurchsatz-Screening geeignet, was bedeutet, dass es sehr zeitaufwendig ist, eine repräsentative Anzahl von Zellen pro Spender zu messen. Fura-2-Farbstoff- und Kollagenfalten-Assays ermöglichen die oberflächliche Bestimmung der Kontraktion und liefern keine präzise numerische Ausgabe, wodurch sie weniger geeignet sind, patientenspezifische Unterschiede zu unterscheiden. Eine gestörte SMC-Kontraktion in Zellen, die aus der Aorta von Patienten mit Bauchaortenaneurysmen stammen, wurde erstmals durch die Optimierung einer neuartigen Methode zur Messung der SMC-Kontraktion in vitro8 nachgewiesen. Dies geschah durch die Wiederverwendung der ECIS-Methode (Electric Cell-Substrat Impedance Sensing). ECIS ist ein Echtzeit-Assay mit mittlerem Durchsatz zur Quantifizierung des adhärenten Zellverhaltens und der Kontraktion 9,10,11 wie SMC-Wachstum und -Verhalten in Wundheilungs- und Migrationsassays12,13,14. Die genaue Methode ist im Protokollabschnitt beschrieben. Auf diese optimierte Weise kann das ECIS aufgrund ihrer ähnlichen Größe und Morphologie auch zur Untersuchung der Fibroblastenkontraktion verwendet werden.
Ziel dieses Papiers ist es, eine schrittweise Beschreibung der Methode zur Messung der SMC-Kontraktion in vitro unter Verwendung von ECIS8 und zum Vergleich der Kontraktion zwischen Kontroll- und Patienten-SMCs zu liefern. Zunächst wird die Isolierung und Kultivierung von primären SMCs aus Kontroll- und Patientenaortenbiopsien erläutert, die zur Kontraktionsmessung genutzt werden können. Zweitens werden Kontraktionsmessungen und -analysen sowie die Überprüfung der SMC-Markerexpression beschrieben. Darüber hinaus beschreibt dieser Beitrag die Methode zur Isolierung patientenspezifischer dermaler Fibroblasten, deren Kontraktion mit der gleichen Methodik gemessen werden kann. Diese Zellen können für patientenspezifische Studien verwendet werden, die sich auf Aortenaneurysmen oder andere kardiovaskuläre Pathologien15 konzentrieren, oder für prognostische Studien unter Verwendung eines Transdifferenzierungsprotokolls, das eine Kontraktionsmessung vor einer Aneurysmaoperationermöglicht 16.
Access restricted. Please log in or start a trial to view this content.
Protokoll
HINWEIS: Aortenbiopsien wurden während der offenen Aneurysmareparatur in Amsterdam University Medical Centers, VU University Medical Center, Amsterdam, Zaans Medisch Centrum, Zaandam und Dijklander Hospital, Hoorn, Niederlande, gewonnen. Kontrollaortengewebe wurde aus dem Stück der Aorta gewonnen, das an der Nierenarterie befestigt ist, die für Nierentransplantationen entnommen wurde. Nur Patienten über 18 Jahre wurden eingeschlossen, und alle Patienten gaben ihre informierte Zustimmung zur Teilnahme an der Studie. Das gesamte Material wurde in Übereinstimmung mit den Vorschriften der WMA-Deklaration von Helsinki und den institutionellen Richtlinien des Medical Ethical Committee des VU Medical Center gesammelt. Alle Experimente und experimentellen Protokolle wurden in Übereinstimmung mit den institutionellen Richtlinien durchgeführt und vom Medical Ethical Committee des VU Medical Center genehmigt. Vollständige Informationen über die Kontroll- und Patientenzelllinien, die verwendet werden, finden Sie unter 8.
1. Isolierung primärer menschlicher SMCs aus Aortenbiopsien
HINWEIS: Führen Sie die folgenden Schritte unter einer sterilen Gewebekultur-Laminar-Flow-Haube durch. Tragen Sie Handschuhe und verwenden Sie aseptische Standardtechniken beim Umgang mit menschlichem Blut und menschlichen Gewebeproben. SMCs werden in 231 Human Vascular Smooth Muscle Cell Basal Medium kultiviert, ergänzt mit 100 U / ml Penicillin, 100 μg / ml Streptomycin und Smooth Muscle Growth Supplement, das als SMC-Medium bezeichnet wird.
- Sterilisieren Sie zwei Paar chirurgische Pinzetten und ein Skalpell, indem Sie sie in 70% Ethanol tauchen und anschließend trocken wischen.
- Pipette 2 ml SMC-Medium in einer Petrischale, in der die Gewebedissektion durchgeführt wird.
- Pipette 2,5 ml SMC-Medium in zwei T25-Kolben. Wirbeln Sie die Kolben herum, so dass das kleine Volumen des Mediums die gesamte Oberfläche bedeckt.
- Transportieren Sie die entnommene humane Aortenwandbiopsie in einem sterilen Kunststoffröhrchen mit kalter, steriler Gewebetransferlösung (siehe Materialtabelle) oder 0,9% NaCl aus dem Operationssaal ins Labor.
- Öffnen Sie das Röhrchen mit dem Gewebe in der Gewebekulturhaube. Nehmen Sie die Biopsie mit der sterilisierten Pinzette aus dem Röhrchen und legen Sie sie in die Petrischale (Abbildung 1A).
- Untersuchen Sie die Biopsie visuell, um die drei Aortenschichten Tunica intima (innere), Medien (Mitte) und Adventitia (äußere Schicht) zu identifizieren. Achten Sie auf das Vorhandensein von atherosklerotischen Plaques auf der intimen Seite und schleimigem Bindegewebe auf der Adventivseite (Abbildung 1B), um die Schichten zu unterscheiden.
- Um SMCs vom Medium zu isolieren, entfernen Sie die beiden anderen Schichten. Legen Sie das Gewebe mit der Intima-Plaque zuerst mit der Seite nach oben (Abbildung 1B). Entfernen Sie die feste Plaque, indem Sie sie mit einer Pinzette vom Gewebe wegziehen, während Sie das Gewebe mit der anderen Pinzette nach unten drücken. Entfernen Sie nachfolgende Plaqueschichten, bis die rosafarbene, gleichmäßige mediale Schicht sichtbar ist.
- Drehen Sie das Gewebe um (Abbildung 1C). Wiederholen Sie den gleichen Vorgang wie in Schritt 1.7, indem Sie die Adventialschicht abziehen (Abbildung 1D). Achten Sie darauf, alle sichtbaren Teile in so vielen Versuchen wie nötig zu entfernen, da sich diese Schicht nicht leicht vom Medium löst.
HINWEIS: Es ist wichtig, dass die intimen und zufälligen Schichten ordnungsgemäß entfernt werden, um eine möglichst saubere SMC-Population zu erhalten. - Sobald die mediale Schicht isoliert ist, schneiden Sie das Gewebe in Würfel von etwa 1 mm x 1 mm x 1 mm. Drücken Sie das Medium mit einer Pinzette nach unten und schneiden Sie das Gewebe mit dem Skalpell in eine Richtung. Schneiden Sie nicht hin und her; Machen Sie saubere, unidirektionale Schnitte, um Schäden zu minimieren. Versuchen Sie, angesichts der Größe der Biopsie so viele Würfel wie möglich herzustellen (Abbildung 1E).
- Legen Sie die Gewebestücke mit der Pinzette in das obere Viertel des T25-Kolbens. Platzieren Sie 10-20 Würfel pro Kolben, wenn die Materialmenge dies zulässt (Abbildung 1F).
HINWEIS: Verwenden Sie eine glatte Pinzette, um die Haftung des Gewebes an den Rippen der Pinzette zu minimieren und das Gewebe leicht in den Kolben zu lösen. - Inkubieren Sie die Gewebewürfel in den T25-Kolben für ca. 10 Tage bei 5% CO2 bei 37 °C in einem Inkubator.
HINWEIS: Das erste Zellwachstum wird um diese Zeit erwartet. Die Zellen, die anfänglich migrieren, sehen möglicherweise kleiner aus als normale SMCs. - Sobald das Zellwachstum beobachtet wurde, fügen Sie 2,5 ml Medium in den Kolben hinzu und achten Sie darauf, es nicht auf die Gewebestücke zu pipettieren, um zu verhindern, dass sie sich lösen.
- Nach etwa 5 weiteren Tagen, wenn Zellcluster um die Gewebestücke herum beobachtet werden, wechseln Sie das Kulturmedium. Wenn sich Gewebestücke lösen, entfernen Sie sie, da sie sich nicht wieder anheften.
- Sobald die Zellen zu 80-90% konfluent sind, übertragen Sie sie in einen T75-Kolben und kultivieren Sie weiter in diesem Format.
HINWEIS: Ein Split-Verhältnis von 1:2 oder 1:3 wird empfohlen. Frieren Sie eine Sicherung der Zellen in einer frühen Passage ein. Die Zellen behalten ihre Eigenschaften im Allgemeinen bis zur Passage 10 bei; Spätere Passagen sollten nicht für Experimente verwendet werden.
2. Isolierung primärer dermaler Fibroblasten aus Hautbiopsien
HINWEIS: Führen Sie die folgenden Schritte unter einer sterilen Gewebekultur-Laminar-Flow-Haube durch. Tragen Sie Handschuhe und verwenden Sie aseptische Standardtechniken beim Umgang mit menschlichem Blut und menschlichen Gewebeproben. Fibroblasten werden in Basalmedium kultiviert, ergänzt mit 10% fetalem Rinderserum, 100 U / ml Penicillin und 100 μg / ml Streptomycin, das als Fibroblastenmedium bezeichnet wird.
- Sterilisieren Sie zwei Paar chirurgische Pinzetten und ein Skalpell, indem Sie sie in 70 % Ethanol tauchen und anschließend trocken wischen.
- Pipette 2 ml Fibroblastenmedium in einer Petrischale, in der die Gewebedissektion durchgeführt wird.
- Pipettieren Sie 2,5 ml Fibroblastenmedium in zwei T25-Kolben. Wirbeln Sie die Kolben herum, so dass das kleine Volumen des Mediums die gesamte Oberfläche bedeckt.
- Transportieren Sie die entnommene Hautbiopsie aus dem Operationssaal ins Labor auf Eis in kalter, steriler Gewebetransferlösung (siehe Materialtabelle) oder 0,9% NaCl in einem sterilen Kunststoffröhrchen.
- Öffnen Sie das Röhrchen mit dem Gewebe in der Gewebekulturhaube. Nehmen Sie die Biopsie mit der sterilisierten Pinzette aus dem Röhrchen und legen Sie sie in die Petrischale (Abbildung 2A).
- Untersuchen Sie die Biopsie visuell, um die drei Hautschichten, die Epidermis, die Dermis und das subkutane Fett zu identifizieren. Suchen Sie nach einer erkennbaren Hautoberfläche, manchmal mit sichtbaren Haaren, um die Epidermis zu identifizieren. Suchen Sie auf der gegenüberliegenden Seite nach dem subkutanen Fett, das oft gelb und schleimig ist. Identifizieren Sie die Schicht zwischen der Epidermis und dem subkutanen Fett als Dermis - die Quelle lebensfähiger Fibroblasten (Abbildung 2B).
- Um Fibroblasten von der Dermis zu isolieren, entfernen Sie die anderen beiden Schichten und legen Sie das Gewebe auf die Seite, so dass alle drei Schichten sichtbar sind.
HINWEIS: Im Gegensatz zum Aortengewebe können Hautschichten nicht voneinander getrennt werden; Daher müssen sie geschnitten werden. Das Gewebe ist auch gummiartiger, was das Schneiden erschwert. Verwenden Sie ein scharfes Skalpell. - Halten Sie das Gewebe mit einer Pinzette fest. Parallel zur Grenze zwischen Epidermis und Dermis geschnitten. Schneiden Sie die gesamte Epidermis weg. Versuchen Sie, eine saubere Linie einzuschneiden und bewegen Sie sich nicht hin und her, um Gewebeschäden zu vermeiden.
- Drehen Sie das Gewebe um. Wiederholen Sie den gleichen Vorgang wie in Schritt 2.8. Diesmal innerhalb der Dermis parallel zur Grenze mit dem subkutanen Fett schneiden.
- Sobald die Dermis isoliert ist, schneiden Sie das Gewebe in Würfel von etwa 1 x 1 x 1 mm3. Drücken Sie das Gewebe mit einer Pinzette nach unten und schneiden Sie das Gewebe mit dem Skalpell in eine Richtung. Schneiden Sie nicht hin und her; Machen Sie saubere, unidirektionale Schnitte, um Schäden zu minimieren. Versuchen Sie, angesichts der Größe der Biopsie so viele Würfel wie möglich herzustellen (Abbildung 2C).
- Legen Sie die Gewebestücke mit der Pinzette in das obere Viertel des T25-Kolbens. Platzieren Sie 10-20 Würfel pro Kolben, wenn die Materialmenge dies zulässt (Abbildung 2D).
HINWEIS: Verwenden Sie eine glatte Pinzette, um die Haftung des Gewebes an den Rippen der Pinzette zu minimieren und das Gewebe leicht in den Kolben zu lösen. - Inkubieren Sie die Gewebewürfel in den T25-Kolben für ca. 10 Tage bei 5% CO2 bei 37 °C in einem Inkubator.
HINWEIS: Das erste Zellwachstum wird um diese Zeit herum erwartet. Die Zellen, die anfangs wandern, sehen möglicherweise kleiner aus als normale Fibroblasten. - Sobald das Zellwachstum beobachtet wurde, fügen Sie 2,5 ml Medium in den Kolben hinzu und achten Sie darauf, es nicht auf die Gewebestücke zu pipettieren, um zu verhindern, dass sie sich lösen.
- Nach etwa 5 weiteren Tagen, wenn Zellcluster um die Gewebestücke herum beobachtet werden können, wechseln Sie das Kulturmedium. Wenn sich Gewebestücke lösen, entfernen Sie sie, da sie sich nicht wieder anheften.
- Sobald die Zellen zu 80-90% konfluent sind, übertragen Sie sie in einen T75-Kolben und kultivieren Sie weiter in diesem Format.
HINWEIS: Ein Split-Verhältnis von 1:2 oder 1:3 wird empfohlen. Frieren Sie eine Sicherung der Zellen in einer frühen Passage ein. Die Zellen behalten ihre Eigenschaften im Allgemeinen bis zur Passage 10 bei; Spätere Passagen sollten nicht für Experimente verwendet werden.
3. Messung der Kontraktion (Beispiel SMCs)
- Bereiten Sie ein 96w10e ECIS-Array vor (siehe Abbildung 3A für ein repräsentatives Bild des Arrays mit vergrößerten Elektroden und Zellen, die auf den Elektroden gesät sind).
HINWEIS: Führen Sie die folgenden Schritte unter einer sterilen Gewebekultur-Laminar-Flow-Haube durch.- Beschichten Sie ein steriles 96w10e-Array mit 200 μL 10 mM L-Cystein pro Well für 30 min bei Raumtemperatur.
- Waschen Sie den Teller zweimal mit sterilem Wasser. Lassen Sie die Platte über Nacht in der Gewebekulturhaube bei leicht geöffnetem Deckel trocknen.
HINWEIS: Die Beschichtung der Platte mit L-Cystein ist nur erforderlich, wenn die Platte zum ersten Mal verwendet wird. - Am nächsten Tag Platte und Deckel für 30 min UV-sterilisieren. Drehen Sie den Deckel nach oben, so dass die Innenseite sterilisiert ist. Sobald die Platte sterilisiert ist, öffnen Sie die Platte nicht außerhalb der Durchflusshaube.
- Seeding-Zellen auf dem ECIS-Array
- 1% sterile Gelatinelösung im Wasserbad für 30 min vorwärmen.
HINWEIS: Die Lösung wird im Kühlschrank aufbewahrt und kann sich verfestigen, was das Pipetten erschwert. - Beschichten Sie anschließend die Vertiefungen mit 100 μL der 1 %igen Gelatinelösung pro Vertiefung und inkubieren Sie die Platte bei 37 °C für mindestens 1 h.
- Saugen Sie die Gelatine aus den Vertiefungen ab.
- Zählen Sie die Zellen mit einem automatisierten Zellzähler und säen Sie die SMCs in dreifacher Ausfertigung bei einer Aussaatdichte von 30.000 Zellen / Well in 200 μL SMC-Medium.
- Legen Sie die Platte mit den SMCs in den ECIS 96-Well-Halter im Zellkultur-Inkubator. Doppelklicken Sie auf die ECIS Applied Biophysics Software , um das Programm zu öffnen, und drücken Sie die Setup-Taste .
- Überprüfen Sie, ob alle Elektroden Kontakt mit dem Halter (grün; rot, wenn keine Verbindung) im linken unteren Bereich mit der Aufschrift Well Configuration haben. Wenn die Elektroden nicht richtig angeschlossen sind, stellen Sie die Platte in der Halterung ein, bevor Sie mit der Messung beginnen.
- Wählen Sie den Plattentyp (96-Well-Array) im selben Bedienfeld aus, indem Sie auf " Array-Typ" klicken.
- Klicken Sie im rechten oberen Bereich auf Datensammlungseinrichtung und ändern Sie den Impedanzwert auf 4000 Hz und das Intervall auf 8 s.
- Klicken Sie auf die Schaltfläche Start , um die Messungen zu starten. Warten Sie, bis ein neuer Bereich geöffnet wird, in dem die ECIS-Datei gespeichert werden kann.
- Lassen Sie die Zellen befestigen und eine Monoschicht für 48 h aufbauen.
HINWEIS: Das Anbringen und Verteilen von Zellen auf den Elektroden erzeugt einen Basiswiderstandswert (Abbildung 3B).
- 1% sterile Gelatinelösung im Wasserbad für 30 min vorwärmen.
- Stimulation von Zellen zur Induktion der Kontraktion
- Induzieren Sie die SMC-Kontraktion, indem Sie die Zellen mit 10 μg / ml des Calciumionophors, Ionomycin, stimulieren.
HINWEIS: Ionomycin induziert den Zustrom von extrazellulärem Ca2+ und aktiviert die kontraktile Kaskade; Siehe Abbildung 4A für repräsentative Bilder von nicht stimulierten und stimulierten kontrahierten Zellen. - Verdünnen Sie 1 mg Ionomycinpulver in 100 μL Dimethylsulfoxid, um eine Stammlösung von 10 mg / ml herzustellen, und lagern Sie 10 μL Aliquots bei -20 ° C. Vor Gebrauch verdünnen Sie die Ionomycinlösung 1:10 in SMC-Medium, um die Arbeitslösung vorzubereiten, die den Zellen zugesetzt werden soll.
- Führen Sie die Zellstimulation durch, während sich das Array noch im Array-Halter im Zellkultur-Inkubator befindet und die Elektroden am System befestigt sind.
- Um die Zellen zu stimulieren, entfernen Sie den Deckel und legen Sie ihn auf eine sterile Oberfläche im Inkubator. Bereiten Sie zwei Pipetten vor, die auf 2 μL und 150 μL eingestellt sind.
- Bevor Sie mit der Stimulation beginnen, drücken Sie in der Software auf Markieren und geben Sie einen Kommentar ab.
HINWEIS: Dies macht es einfacher, den genauen Zeitpunkt der Stimulation bei der Analyse der Daten zu finden. - Pipette 2 μL der Ionomycin-Arbeitslösung so schnell wie möglich in jedes Well. Sobald alle Zellen stimuliert wurden, mischen Sie das Medium in den Vertiefungen mit der zweiten Pipette.
HINWEIS: Aufgrund der schnellen Effekte ist es nicht notwendig, die Spitzen zwischen verschiedenen Zelllinien und Bedingungen zu wechseln. Arbeiten Sie schnell beim Stimulieren und Mischen, da das Ionomycin eine akute Wirkung hat. Wenn Sie eine volle Platte stimulieren, stimulieren Sie maximal 3 Säulen auf einmal. Warten Sie nach jeder Stimulation mindestens 30 Minuten bis zur nächsten Stimulation, damit sich die Zellen von der Temperatur und der CO2-Veränderung, die durch das Öffnen der Inkubatortür verursacht wird, erholen können. - Drücken Sie direkt nach der Stimulation erneut auf Markierung , um einen Kommentar hinzuzufügen, dass die Stimulation durchgeführt wurde.
- Beenden des Stimulationsexperiments
- Notieren Sie die Impedanzwerte für ca. 5 min nach der Ionomycin-Stimulation. Beenden Sie die Aufnahme, indem Sie auf Fertig stellen klicken.
- Verwenden Sie die ECIS-Arrays bis zu dreimal wieder: Waschen Sie die Brunnen zweimal mit sterilem Wasser und inkubieren Sie die Platte bei 37 ° C für 2-3 h mit Trypsin oder einem ähnlichen Reagenz. Wiederholen Sie die Schritte 3.1.2 und 3.1.3.
- Induzieren Sie die SMC-Kontraktion, indem Sie die Zellen mit 10 μg / ml des Calciumionophors, Ionomycin, stimulieren.
- Exportieren der Daten
- Um die Daten zu exportieren, klicken Sie auf Datei | Daten exportieren | In Excel (ausgewählt). Wählen Sie einen Ordner aus, in dem die Datei gespeichert werden soll.
- Klicken Sie auf Trennen , wenn das Programm Sie auffordert, Blätter zu kombinieren oder zu trennen.
- Analysieren der kontraktilen Ausgabe
- Um die kontraktile Reaktion zu berechnen, verwenden Sie die folgende Gleichung (1), wobei C die Kontraktion angibt (ausgedrückt in % der Veränderung im Vergleich zum Ausgangswert), die Vorstimulation (PrS) den Widerstandswert (ausgedrückt in Ω) kurz vor der Ionomycinstimulation und die Nachstimulation (PoS) den Widerstand (ausgedrückt in Ω) 2 Minuten nach Beendigung der Stimulation angibt.
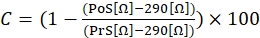 (1)
(1)
HINWEIS: Wie in Gleichung (1) gezeigt, wird der Impedanzwert eines mit Kulturmedium gefüllten Brunnens ohne angehängte Zellen (Wert von 290 Ω) von allen Ergebnissen der endgültigen Berechnung subtrahiert. Es wird empfohlen, kontraktile Reaktionen in jedem Experiment dreifach zu messen und drei unabhängige Experimente mit derselben Zelllinie durchzuführen, um jede inter- und intraexperimentelle Variation zu berücksichtigen. - Sobald die drei unabhängigen Experimente durchgeführt wurden, gruppieren Sie die Daten zusammen, indem Sie den Durchschnitt der drei Messungen berechnen, einschließlich der Standardabweichung (SD).
- Um die kontraktile Reaktion zu berechnen, verwenden Sie die folgende Gleichung (1), wobei C die Kontraktion angibt (ausgedrückt in % der Veränderung im Vergleich zum Ausgangswert), die Vorstimulation (PrS) den Widerstandswert (ausgedrückt in Ω) kurz vor der Ionomycinstimulation und die Nachstimulation (PoS) den Widerstand (ausgedrückt in Ω) 2 Minuten nach Beendigung der Stimulation angibt.
- Vergleich verschiedener Gruppen
- Um den Bereich der normalen Kontraktion zu definieren und nachfolgende spezifische Forschungsfragen zu untersuchen, verwenden Sie die Kontrollgruppe, um die "normale Kontraktion" zu definieren und sie mit der kontraktilen Reaktion von Patienten oder Behandlungsgruppen zu vergleichen.
- Berechnen Sie den Mittelwert und SD der gesamten Kontrollgruppe, d. h. der Endwerte für alle Zelllinien, wie in Schritt 3.5.2 beschrieben.
- Verwenden Sie den Bereich des Mittelwerts ± 2SD, um Zellen in der anderen Gruppe zu identifizieren, die außerhalb dieses Bereichs liegen, was darauf hinweist, dass sie eine veränderte kontraktile Reaktion haben.
HINWEIS: Der Mechanismus hinter der veränderten kontraktilen Reaktion unterliegt spezifischen Forschungsfragen und ist zell- und zustandsabhängig und wird in diesem Protokoll nicht diskutiert.
4. Erkennen des Vorhandenseins von SMC-spezifischen Markern
- RNA-Isolierung
- Samen Sie die gleichen patientenspezifischen Zelllinien, die für die Kontraktionsmessungen verwendet wurden, in 6-Well-Platten, eine Vertiefung pro Zelllinie. Zählen Sie die Zellen mit einem automatisierten Zellzähler und säen Sie die Zellen mit einer Aussaatdichte von 200.000 Zellen / gut in SMC-Medium und lassen Sie sie über Nacht anheften.
- Waschen Sie die Zellen einmal mit sterilem PBS.
- Lysieren Sie die Zellen und isolieren Sie die Zellen gemäß den Anweisungen des Herstellers.
- cDNA-Synthese
- Führen Sie eine cDNA-Synthese in 20 μL eines umgekehrten Transkriptionsreaktionsgemisches durch. Verdünnen Sie die Konzentrationen der gesamten isolierten RNA gemäß den Anweisungen des Herstellers.
- qPCR
- Messen Sie die Genexpression von SMC-Markergenen, z. B. ACTA2, CNN1, SMTN und TAGLN , um zu bestätigen, dass die isolierten Zellen tatsächlich SMCs sind, und erkennen Sie SMC-Marker. Überprüfen Sie, ob die Ergebnisse mit der kontraktilen Ausgabe korreliert sind.
- Verwenden Sie mindestens zwei Housekeeping-Gene, um die Daten zu normalisieren, z. B. YWHAZ und TBP.
HINWEIS: Der qPCR-Lauf und die Analyse können mit verschiedenen PCR-Maschinen und kompatibler Software durchgeführt werden, je nachdem, was im Labor verfügbar und optimiert ist. Siehe Zusatztabelle S1 für Primersequenzen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Um die Reproduzierbarkeit dieser Methode zu testen, wurde die Methode zunächst nur mit Kontroll-SMCs validiert. Um die Reproduzierbarkeit interexperimenteller Messungen zu bestimmen, wurden zwei unabhängige Messungen aller eingeschlossenen Kontroll- und Patientenzelllinien als Bland-Altman-Diagramm dargestellt (Abbildung 3B). Das Diagramm zeigte, dass diese Methode keine Variabilität außerhalb des Konfidenzintervalls zeigt, mit Ausnahme einer Ausreißerzelllinie. Darüber hinaus zeigten ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Papier stellt eine Methode zur Messung der SMC-Kontraktion in vitro vor, basierend auf den Änderungen der Impedanz und der Oberflächenbesetzung. Zunächst wird die Isolierung, Kultivierung und Expansion von patientenspezifischen primären menschlichen SMCs und Hautfibroblasten beschrieben, gefolgt von deren Verwendung für Kontraktionsmessungen.
Eine Einschränkung der Studie hängt mit der Gewinnung der Zellen durch ein Explantationsprotokoll zusammen. Die Zellen, die sich ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Wir danken Tara van Merrienboer, Albert van Wijk, Jolanda van der Velden, Jan D. Blankensteijn, Lan Tran, Peter L. Hordijk, dem PAREL-AAA-Team und allen Gefäßchirurgen der Amsterdamer UMC, des Zaans Medisch Centrums und des Dijklander-Krankenhauses für die Bereitstellung von Materialien und Unterstützung für diese Studie.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well Array | Applied Biophysics | 96W10idf PET | Array used to measure contraction in the ECIS setup |
| Custodiol | Dr. Franz Höhler Chemie GmbH | RVG 12801 | Solution used to transfer tissue in from surgery room to laboratorium |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | Solution used to dilute ionomycin |
| Fetal Bovine Serum | Gibco | 26140079 | Addition to cell culture medium |
| Ham's F-10 Nutrient Mix | Gibco | 11550043 | Medium used to culture skin fibroblasts |
| Human Vascular Smooth Muscle Cell Basal Medium (formerly ''Medium 231'') | Gibco | M231500 | Medium used to culture smooth muscle cells |
| Invitrogen countess II | Thermo Fisher Scientific | AMQAX1000 | Automated cell counter |
| Ionomycin calcium salt from Streptomyces conglobatus | Sigma-Aldrich | I0634-1MG | Compound used for contraction stimulation |
| NaCl 0.9% | Fresenius Kabi | B230561 | Solution used to transfer tissue in from surgery room to laboratorium |
| Penicillin-Streptomycin | Gibco | 15140122 | Antibiotics used for cell culture medium |
| Phospathe buffered saline | Gibco | 10010023 | Used to wash cells |
| Quick-RNA Miniprep Kit | Zymo Research | R1055 | Kit used for RNA isolation |
| Smooth Muscle Growth Supplement (SMGS) | Gibco | S00725 | Supplement which is added to smooth muscle cell culture medium |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | Kit used for cDNA synthesis |
| SYBR Green PCR Master Mix | Thermo Fisher Scientific | 4309155 | Reagent for qPCR |
| Trypsin-EDTA | Gibco | 15400-054 | Used to trypsinize cells |
| ZTheta | Applied Biophysics | ZTheta | ECIS instrument used for contraction measurements |
Referenzen
- Milewicz, D. M., et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction. Annual Review of Genomics and Human Genetics. 9, 283-302 (2008).
- Milewicz, D. M., et al. Altered smooth muscle cell force generation as a driver of thoracic aortic aneurysms and dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (1), 26-34 (2017).
- Groeneveld, M. E., et al. Betaglycan (TGFBR3) up-regulation correlates with increased TGF-β signaling in Marfan patient fibroblasts in vitro. Cardiovascular Pathology. 32, 44-49 (2018).
- Chen, J., Li, H., SundarRaj, N., Wang, J. H. C. Alpha-smooth muscle actin expression enhances cell traction force. Cell Motility and the Cytoskeleton. 64 (4), 248-257 (2007).
- Peyton, S. R., Putnam, A. J. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. Journal of Cellular Physiology. 204 (1), 198-209 (2005).
- Williams, D. A., Fogarty, K. E., Tsien, R. Y., Fay, F. S. Calcium gradients in single smooth muscle cells revealed by the digital imaging microscope using Fura-2. Nature. 318 (6046), 558-561 (1985).
- Wu, D., et al. NLRP3 (nucleotide oligomerization domain-like receptor family, pyrin domain containing 3)-caspase-1 inflammasome degrades contractile proteins: implications for aortic biomechanical dysfunction and aneurysm and dissection formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (4), 694-706 (2017).
- Bogunovic, N., et al. Impaired smooth muscle cell contractility as a novel concept of abdominal aortic aneurysm pathophysiology. Scientific Reports. 9 (1), 1-14 (2019).
- Hurst, V., Goldberg, P. L., Minnear, F. L., Heimark, R. L., Vincent, P. A. Rearrangement of adherens junctions by transforming growth factor-β1: role of contraction. American Journal of Physiology-Lung Cellular and Molecular Physiology. 276 (4), 582-595 (1999).
- Hu, N., et al. Comparison between ECIS and LAPS for establishing a cardiomyocyte-based biosensor. Sensors and Actuators B: Chemical. 185, 238-244 (2013).
- Peters, M. F., Lamore, S. D., Guo, L., Scott, C. W., Kolaja, K. L. Human stem cell-derived cardiomyocytes in cellular impedance assays: bringing cardiotoxicity screening to the front line. Cardiovascular Toxicology. 15 (2), 127-139 (2015).
- Zhang, S., Yang, Y., Kone, B. C., Allen, J. C., Kahn, A. M. Insulin-stimulated cyclic guanosine monophosphate inhibits vascular smooth muscle cell migration by inhibiting Ca/calmodulin-dependent protein kinase II. Circulation. 107 (11), 1539-1544 (2003).
- Halterman, J. A., Kwon, H. M., Zargham, R., Bortz, P. D. S., Wamhoff, B. R. Nuclear factor of activated T cells 5 regulates vascular smooth muscle cell phenotypic modulation. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (10), 2287-2296 (2011).
- Bass, H. M., Beard, R. S., Cha, B. J., Yuan, S. Y., Nelson, P. R. Thrombomodulin induces a quiescent phenotype and inhibits migration in vascular smooth muscle cells in vitro. Annals of Vascular Surgery. 30, 149-156 (2016).
- Burger, J., et al. Molecular phenotyping and functional assessment of smooth muscle like-cells with pathogenic variants in aneurysm genes ACTA2, MYH11, SMAD3 and FBN1. Human Molecular Genetics. , (2021).
- Yeung, K. K., et al. Transdifferentiation of human dermal fibroblasts to smooth muscle-like cells to study the effect of MYH11 and ACTA2 mutations in aortic aneurysms. Human Mutation. 38 (4), 439-450 (2017).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten