需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
沙 门氏菌 斑疹伤寒诱导的小鼠脓毒性腹膜炎的特征
摘要
该协议描述了小鼠模型系统中革兰氏阴性单细菌性脓毒症的诱导。该模型有助于研究脓毒症期间的炎症和致死宿主反应。
摘要
脓毒症是对微生物侵袭或组织损伤的宿主免疫反应失调,导致器官损伤在远离感染或损伤的部位。目前,广泛使用的脓毒症小鼠模型包括脂多糖(LPS)诱导的内毒素血症,盲肠结扎和穿刺(CLP)以及单细菌感染模型系统。该协议描述了一种研究鼠伤寒 沙门氏菌 感染诱导的小鼠脓毒性腹膜炎期间宿主反应的方法。 S. 鼠伤寒是一种革兰氏阴性细胞内病原体,在小鼠中引起伤寒样疾病。
该方案详细说明了培养制备,通过腹腔注射诱导小鼠脓毒性腹膜炎,以及研究全身宿主反应的方法。此外,还介绍了不同器官中细菌负荷的评估以及腹膜灌洗中中性粒细胞数量增加的流式细胞术分析。 沙门氏菌 鼠伤寒诱导的小鼠败血症导致促炎细胞因子增加和腹膜腔中嗜中性粒细胞的快速浸润,导致存活率降低。
该方案中的每个步骤都经过优化,导致脓毒性腹膜炎发病机制的高再现性。该模型可用于研究细菌脓毒症期间的免疫反应,不同基因在疾病进展中的作用以及药物对减轻脓毒症的作用。
引言
脓毒症被定义为对微生物侵袭或组织损伤的全身炎症和免疫反应失调,导致远离感染或损伤部位的器官损伤。脓毒性休克是脓毒症的一个亚群,其特征为容量复苏期间持续低血压,死亡风险显著增加1。在COVID-19大流行期间,公众对这种疾病的认识越来越高。尽管相关死亡率很高,但由于脓毒症诊断的复杂性,缺乏关于脓毒症全球负担的全面流行病学数据。2017年,全世界有4890万例脓毒症发病率和1100万例死亡,占全球所有死亡人数的19.7%2。此外,一项关于重症监护病房患者感染和相关脓毒症患病率延长的研究发现,62% 的患者阳性分离株是革兰氏阴性菌3。
最初,脓毒症的研究集中在描述微生物发病机制上。然而,理解"危险假说",即宿主如何区分自我和非自我,导致脓毒症研究的平衡向理解宿主对入侵病原体的反应倾斜。广泛使用的脓毒症小鼠模型包括脂多糖(LPS)诱导的内毒素血症模型,多种微生物脓毒症模型,盲肠结扎和穿刺(CLP)和结肠上行支架腹膜炎(CASP),以及单细菌感染模型4。
我们已经通过使用鼠伤寒 沙门氏菌 诱导腹膜败血症来标准化小鼠模型系统。该模型优于其他模型,因为鼠伤寒 沙门氏菌 是一种细胞内病原体,模仿革兰氏阴性脓毒症的临床相关病症。在该模型中,腹膜炎脓毒症的结果是全身性的,感染后96小时内死亡率为100%。因此,该模型有助于研究炎症和致命的宿主反应。在该模型中,脓毒症是通过腹腔注射50万个菌落形成单位(CFU)的鼠伤寒 沙门氏菌 到8-10周龄的C57BL / 6小鼠中诱导的。全身感染可以通过在感染后约16小时评估器官细菌负荷来确认。本文展示了鼠伤寒 沙门氏菌 诱导的小鼠腹膜炎败血症,表征了腹膜细胞组成的改变,并量化了不同器官中的细菌负担。
研究方案
所有使用鼠伤寒 沙门氏菌 的实验都在生物安全2级(BSL-2)设施中进行。必须注意使用适当的个人防护装备(PPE),确保安全,并遵循标准的BSL-2生物危害处置方法。所有小鼠实验均按照机构动物伦理委员会IISc的指南进行。小鼠在IISc中央动物设施(注册号:48/1999/CPCSEA,日期为1/3/1999)进行繁殖和维护,该设施由印度政府环境和森林部批准。实验方案由动物实验目的与控制和监督委员会批准,批准的许可证号为CAF/Ethics/797/2020。
BSL2 定义:BSL2 等级表示生物危害剂对环境和实验室工作人员构成中等威胁5.
1. 鼠伤寒 沙门氏菌的培养制备
- 将100μL鼠伤寒 沙门氏菌 NCTC 12023甘油储备液加入3mLLuria Bertani(LB)肉汤中。将培养物在37°C下以160rpm孵育过夜。
- 将50μL过夜培养物在LB肉汤中连通到志贺氏菌(SS)琼脂平板上,并在37°C下孵育〜12小时。在 体内 感染实验之前,将带有细菌菌落的SS琼脂板在4°C下储存数天。
- 使用微尖从条纹SS琼脂平板中挑选单个菌落。将微尖放入3mL LB肉汤中,并在37°C下以160rpm培养过夜。
- 将0.1mL细菌培养物加入50mL LB肉汤中,并在37°C下以160rpm的振荡器培养箱中孵育3-4小时以达到对数生化阶段。使用LB肉汤将培养物稀释2倍。
注意:在对数阶段,细菌细胞处于最佳健康状态,并且正在积极分裂。 - 在分光光度计或酶标仪中以600nm波长的光测量培养物的光密度(OD)。一旦OD达到1.0,在1.5 mL微量离心管中制作两个等分试样的1mL培养物。
- 将管以7,750× g 离心15分钟。弃去上清液,用1mL 1x PBS 2x洗涤沉淀。将管以7,750× g 离心15分钟。
- 将沉淀重悬于两个不同的1.5 mL微量离心管中0.5 mL的1x PBS中。将两个管中的悬浮液组合成一个1.5 mL管,现在含有约2个×10个8 菌落形成单元(CFU)/ mL。
- 通过稀释该储备溶液制备1×106 CFU / mL的细菌细胞悬浮液。
注意:在特定的实验室条件下优化与OD相对应的CFU,以便在开始实验之前确定OD 1.0的CFU。
2. 小鼠和感染
- 将8-10周龄的雄性C57BL / 6小鼠放在动物设施的洁净空气室中,体重约20克,以进行几天的适应。
- 在感染当天,用一只手握住小鼠,用70%乙醇擦拭腹部皮肤,并展开后腿,以便更好地接近腹壁。
- 在1 mL注射器的帮助下,腹膜内注射0.5mL 1 ×106 CFU / mL细菌悬浮液。因此,每只鼠标接收5个×10个5 CFU。对照组,未感染的小鼠单独接受0.5毫升PBS。感染后,平板培养物以检查实际注射的CFU,其可能从0.2-0.8百万CFU / 0.5mL不等。
- 按照分配将小鼠放回笼子里。
- 感染后约12-18 小时使用CO 2窒息法处死小鼠以获得最佳反应。通常,所有受感染的小鼠在96小时内死亡。在一些实验干预下,一些小鼠可能会存活下来。在96小时后对这些小鼠实施安乐死。此外,安乐死任何体温低于33.2°C并在96小时时急性痛苦的小鼠作为人道终点。
注意:在此模型中,一些小鼠可能在注射 沙门氏菌 12小时后开始死亡。因此,正确规划涉及多个时间点的实验。
3. CFU对器官的评估
- 通过CO2 窒息牺牲感染的小鼠,并用一块浸有70%乙醇的棉花擦拭腹部。切开腹部皮肤。请参阅Ray和Dittel的文章,以获取有关如何收集腹膜灌洗液的视频协议6。切开腹膜腔,并将感兴趣的器官收集在微量离心管中。此外,由于患有脓毒症的小鼠的血液凝固速度快且数量低,因此在牺牲后迅速收集血液。
注意:本视频演示了肝脏器官CFU的枚举,因为肝脏在这种脓毒症模型中经历了广泛的组织病理学损伤。 - 切一小块肝脏并将其放入微量离心管中。
注意:在进行下一步之前,这可以在冰上储存最多2-3小时。 - 称重并将碎片转移到微量离心管中。优选,切割重量为〜10-15mg的碎片以进行适当的均质化。在较小的器官(如肠系膜淋巴结(MLN)或胸腺)的情况下使用整个器官。
- 向试管中加入0.5 mL 1x PBS,并使用手动均质机使器官均质化。确保器官完全同质化。通过加入 0.5 mL 的 1x PBS,将体积增至 1 mL。
- 将管在4°C下以200× g 离心5分钟。
- 将上清液收集到新鲜的微量离心管中,并在96孔板中制备1×10-1 和10-2 的稀释液。
- 将50μL稀释剂铺展到新鲜的SS琼脂平板上,并将板在37°C下孵育12小时。
- 计算每种病症中出现的菌落数量,并使用等式(1)使用器官重量对数据进行归一化:
CFU/毫克 =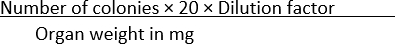 (1)
(1)
注意:公式中使用数字20将每板的菌落转换为CFU / mL。通过将1 mL除以接种的给定体积的培养物的量(在这种情况下为50μL)得出该数字。
例如,如果在SS琼脂平板中发现100个菌落,其中50μL的1×10-1 稀释的重10mg的均质器官扩散,则
CFU/毫克 =
4. 腹膜渗出物中各种免疫细胞群的流式细胞术分析
- 收集Ray和Dittel6之前描述的腹膜细胞。
- 将细胞沉淀从腹膜灌洗液中重悬于1mLRPMI中,补充10%胎牛血清(FBS)。使用血细胞计数器枚举腹膜灌洗液中的总细胞数。调整细胞数量,使每个试管接收0.2-0.5百万个细胞。
注意:脓毒症小鼠的腹膜灌洗可能含有红细胞,这可能是由于出血而出现的。在计数腹膜细胞时,要小心排除红细胞。在明场显微镜下,红细胞看起来比免疫细胞小得多。这些看起来像扁平的圆盘或甜甜圈,圆形,中心有凹痕,但不是空心的。裂解红细胞的步骤可以加入7. - 将细胞在4°C下以200× g 旋转10分钟,弃去上清液,并用1x冷PBS洗涤细胞1x。将细胞在4°C下以200× g 离心10分钟。
- 使用FcR阻断剂(1:400稀释)阻断PEC上的Fc受体,在PBS中由5%FBS和0.02%叠氮化钠组成的封闭缓冲液中制备。在冰上孵育15分钟。
- 将细胞在4°C下以200× g 离心10分钟。弃去上清液。在封闭缓冲液中稀释感兴趣的荧光染料偶联抗体。使用1:500稀释的抗小鼠LY6G染色嗜中性粒细胞。
注意:也可以使用例如,针对B细胞的抗小鼠B220,针对T细胞的抗小鼠CD3和针对巨噬细胞的抗小鼠F4/80来检测其他免疫细胞群。 - 在单独的试管中的200μL稀释抗体溶液中孵育约0.2百万个细胞。作为阴性对照,在每种荧光染料类型中留出一根管子,用于未染色的对照,用200μL不含抗体的封闭缓冲液孵育细胞。
- 将样品在冰上孵育45分钟,每15分钟间歇敲击一次。
- 在4°C下以200× g 离心细胞10分钟。 弃去上清液。如果需要储存几天,则在室温下用4%多聚甲醛固定细胞约15分钟。但是,最好从流式细胞仪中新染色的样品中获取数据。
- 将细胞重悬于200μLFACS染色缓冲液(PBS中2%FBS)中。在流式细胞仪中获取数据。
结果
使用这种特定模型的宿主免疫反应的详细表征显示在以前的出版物8,9中。本节描述了所描述的协议的一些代表性结果。该模型旨在诱导 S的全身感染。鼠伤寒通过腹腔注射细菌培养诱导脓毒症。为了确认感染,将脓毒性小鼠的肝脏和脾脏裂解物扩散到SS琼脂平板上,并计数菌落的数量。在 图1中,SS琼脂平板的图像表明脓毒?...
讨论
本文介绍了一种通过腹腔注射鼠伤寒 沙门氏菌 诱导严重细菌性脓毒症的方法。该模型优于其他模型,因为鼠伤寒 沙门氏菌 是一种细胞内病原体,因此具有高致病性,模仿革兰氏阴性脓毒症的临床相关病症。在该模型中,腹膜炎脓毒症的结果是全身性的,感染后96小时内死亡率为100%。因此,该模型有助于研究炎症和致死宿主反应8 以及治疗干预在减轻脓毒症方面的?...
披露声明
作者没有利益冲突需要披露。
致谢
我们感谢中央动物设施IISc为我们提供用于研究的小鼠。这项研究由印度政府生物技术和科学与工程研究委员会向DpN提供的赠款资助。DBT-IISc计划和DST-FIST赠款的基础设施支持得到了极大的认可。我们感谢DpN实验室所有前任和现任成员的支持。
材料
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
参考文献
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。