このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおける サルモネラ ・チフス菌誘発性敗血症性腹膜炎の特性評価
要約
このプロトコールは、マウスモデル系におけるグラム陰性単細菌敗血症の誘導を記載する。このモデルは、敗血症中の炎症性および致死性の宿主応答を調査するのに有用である。
要約
敗血症は、微生物の侵入または組織損傷に対する調節不全の宿主免疫応答であり、感染または損傷のそれから離れた部位で器官損傷をもたらす。現在、敗血症の広く使用されているマウスモデルには、リポ多糖(LPS)誘発性内毒素血症、盲腸結紮および穿刺(CLP)、および単細菌感染モデル系が含まれる。このプロトコールは、マウスにおける サルモネラ・ チフス菌感染誘発敗血症性腹膜炎の間の宿主応答を研究する方法を記載する。 S. グラム陰性細胞内病原体である腸チフスは、マウスに腸チフス様疾患を引き起こす。
このプロトコールは、培養調製、腹腔内注射によるマウスにおける敗血症性腹膜炎の誘導、および全身宿主応答を研究する方法を詳述する。さらに、異なる器官における細菌負荷の評価および腹膜洗浄における好中球数の増加のフローサイトメトリー分析が提示される。 サルモネラ マウスにおけるチフス誘発敗血症は、炎症誘発性サイトカインの増加および腹腔内の好中球の急速な浸潤をもたらし、生存率を低下させる。
このプロトコルのすべてのステップが最適化されており、敗血症性腹膜炎の病因の再現性が高い。このモデルは、細菌敗血症中の免疫学的応答、疾患進行における異なる遺伝子の役割、および敗血症を減弱させる薬物の効果を研究するのに有用である。
概要
敗血症は、微生物の侵入または組織損傷に対する調節不全の全身性炎症および免疫応答として定義され、感染または損傷の部位から離れた器官損傷をもたらす。敗血症性ショックは、体積蘇生中に持続する低血圧を特徴とする敗血症のサブセットであり、死亡リスクが実質的に増加する1。一般の人々は、COVID-19パンデミックの間にこの障害をより認識するようになりました。その高い関連死亡率にもかかわらず、敗血症の世界的な負担に関する包括的な疫学的データは、その診断の複雑さのために欠けている。2017年には、世界中で4,890万人の敗血症発生率と1,100万人が死亡し、全世界の死亡の19.7%を占めています2。さらに、集中治療室の患者における感染および関連する敗血症の長期有病率に関する研究は、患者からの陽性分離株の62%がグラム陰性生物であることを発見しました3。
当初、敗血症の調査は微生物の病因を描写することに焦点を当てていました。しかし、宿主が自己と非自己をどのように区別するかを決定する「危険仮説」を理解することは、敗血症研究のバランスを、侵入する病原体に対する宿主の反応を理解する方向に傾けることにつながった。敗血症の広く用いられているマウスモデルには、リポ多糖(LPS)誘発内毒素血症モデル、多微生物敗血症モデル、盲腸結紮および穿刺(CLP)および結腸上突起ステント腹膜炎(CASP)、および単細菌感染モデル4が含まれる。
我々は、 サルモネラ・ チフス菌を用いて腹膜敗血症を誘導することにより、マウスモデル系を標準化した。 サルモネラ・ チフス菌はグラム陰性敗血症の臨床的に関連する状態を模倣する細胞内病原体であるため、このモデルは他のモデルよりも有利である。このモデルにおける腹膜炎敗血症の結果は全身性であり、感染後96時間以内に100%の死亡率を有する。したがって、このモデルは、炎症性および致死性の宿主応答を研究する上で有用である。このモデルでは、敗血症は、8〜10週齢のC57BL/6マウスに50万個のコロニー形成単位(CFU)の サルモネラ ・チフス菌を腹腔内注射することによって誘発される。全身感染は、感染後〜16時間の臓器細菌負荷を評価することによって確認することができる。この記事では、マウスにおける サルモネラ ・チフス菌誘発性腹膜炎敗血症を実証し、腹膜細胞組成の結果生じる変化を特徴付け、異なる器官における細菌負荷を定量化する。
プロトコル
サルモネラ・チフス菌を用いたすべての実験は、バイオ安全レベル2(BSL-2)施設で実施された。適切な個人用保護具(PPE)を使用し、安全性を確保し、標準的なBSL-2バイオハザード処理方法に従うように注意する必要があります。全てのマウス実験は、IIScの動物倫理委員会によって述べられたガイドラインに従って実施した。マウスは、インド政府環境森林省によって承認されたIIScの中央動物施設(登録番号:48/1999/CPCSEA、1999年1月3日付)で飼育および維持された。実験プロトコルは、動物実験の目的および管理および監督委員会によって承認され、承認された許可番号CAF/Ethics/797/2020で承認されました。
BSL2の定義:BSL2評価は、バイオハザード剤が環境および実験室スタッフに中程度の脅威をもたらすことを表す5。
1. サルモネラ・チフス菌の培養調製
- サル モネラ ・チフス菌NCTC 12023グリセロールストック100 μLをルリア・ベルタニ(LB)ブロス3 mLに加える。培養物を37°Cで160rpmで一晩インキュベートする。
- LBブロス中で一晩増殖させた培養物のストリーク50 μLをサルモネラ赤痢菌(SS)寒天プレート上に、37°Cで約12時間インキュベートした。細菌コロニーを有するSS寒天プレートを in vivo 感染実験の前に数日間4°Cで保存する。
- マイクロチップを用いて縞模様のSS寒天プレートから単一のコロニーを選ぶ。マイクロチップを3mLのLBブロスに吐出し、37°Cで160rpmで一晩培養した。
- 0.1 mLの細菌培養物を50 mLのLBブロスに加え、160 rpmのシェーカーインキュベーター内で37°Cで3〜4時間インキュベートして、増殖の対数段階に達する。LBブロスを用いて培養物を2倍に希釈する。
注:対数期の間、細菌細胞は最高の健康状態にあり、積極的に分裂しています。 - 分光光度計またはマイクロプレートリーダーで600nmの波長の光における培養物の光学密度(OD)を測定する。ODが1.0に達したら、1.5mLマイクロフュージチューブに1mLの培養液の2つのアリコートを作る。
- チューブを 7,750 × g で 15 分間遠心分離します。上清を捨て、ペレットを1mLの1x PBS 2xで洗浄する。チューブを 7,750 × g で 15 分間遠心分離します。
- ペレットを2つの異なる1.5mLマイクロフュージチューブ内の0.5mLの1x PBSに再懸濁する。両方のチューブからの懸濁液を、約2 ×108 コロニー形成単位(CFU)/mLを含む1つの1.5 mLチューブに結合します。
- この原液を希釈して1×106CFU /mLの菌体懸濁液を調製する。
注意: 実験を開始する前に、OD に対応する CFU を特定の実験室条件下で最適化して、OD 1.0 の CFU を決定してください。
2.マウスと感染症
- 8〜10週齢の雄C57BL / 6マウスを飼育し、動物施設のクリーンエアルームで数日間、体重〜20gを収容します。
- 感染の日には、片手でマウスを持ち、腹部の皮膚を70%エタノールで拭き取り、腹壁のアクセシビリティを向上させるために後肢を広げます。
- 1 mLシリンジの助けを借りて、0.5 mLの1×106 CFU/mL細菌懸濁液を腹腔内に注入する。したがって、各マウスは 5 ×105 CFU を受け取ります。対照、非感染マウスは、0.5mLのPBSのみを受け取る。感染後、注入された実際のCFUをチェックするために培養物をプレートし、これは0.2〜0.8百万CFU/0.5mLの間で変化し得る。
- マウスを割り当てられたとおりにケージに戻します。
- 最良の応答を得るために、感染後〜12〜18時間のCO2 窒息を用いてマウスを屠殺する。通常、感染したすべてのマウスは96時間以内に死亡する。いくつかの実験的介入の下では、いくつかのマウスは生き残るかもしれない。96時間後にこれらのマウスを安楽死させる。また、体温が33.2°C未満で96時間で急性苦痛を感じたマウスを人道的エンドポイントとして安楽死させる。
注:このモデルでは、一部のマウスは サルモネラ菌 注射の12時間後に死に始めることがあります。したがって、複数の時点を含む実験を適切に計画してください。
3. 臓器のCFU評価
- 感染したマウスをCO2 窒息により屠殺し、70%エタノールに浸した綿片で腹部を拭いた。腹部の皮膚を切り開きます。腹膜洗浄液6の収集方法に関するビデオプロトコルについては、RayとDirtelの記事を参照してください。腹腔を切り開き、目的の器官をマイクロフュージチューブに集める。さらに、敗血症のマウスの血液は急速に凝固し、量が少ないので、犠牲にした後はすぐに集めてください。
注:このビデオは、敗血症のこのモデルで肝臓が広範な組織病理学的損傷を受けるにつれて、肝臓からの臓器CFUの列挙を示しています。 - 肝臓の小片を切ってマイクロフュージチューブに入れます。
注:これは、次のステップに進む前に、最大2〜3時間氷上に保管することができます。 - 少量の計量を行い、微量遠心チューブに移します。好ましくは、適切な均質化のために〜10〜15mgの重量を量る小片を切断する。腸間膜リンパ節(MLN)や胸腺などの小さな臓器の場合は、臓器全体を使用してください。
- 0.5mLの1x PBSをチューブに加え、ハンドホモジナイザーを使用して臓器を均質化する。臓器が完全に均質化されていることを確認してください。0.5 mL の 1x PBS を加えて、体積を 1 mL にします。
- チューブを200 × g で4°Cで5分間遠心分離する。
- 上清を新鮮なマイクロフュージチューブに集め、96ウェルプレートに1×10-1 および10-2 の希釈液を調製する。
- 希釈液50 μLを新鮮なSS寒天プレートに広げ、プレートを37°Cで12時間インキュベートします。
- 各条件に出現するコロニーの数をカウントし、式(1)を使用して臓器重量でデータを正規化します。
CFU/mg =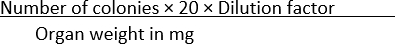 (1)
(1)
注: 式では、プレートあたりのコロニー数を CFU/mL に変換するために、数値 20 が使用されます。この数値は、1mLを播種した培養物の所与の体積の量で割ることによって到着する−この場合、50μLである。
例えば、SS寒天プレートに100個のコロニーが見出され、重量10mgのホモジナイズド臓器の1×10-1 希釈液の50μLが広がる場合、
CFU/mg =
4. 腹膜滲出液中の各種免疫細胞集団のフローサイトメトリー解析
- RayとDittel6によって以前に説明したように腹膜細胞を集める。
- 腹膜洗浄液から細胞ペレットを10%ウシ胎児血清(FBS)を添加した1mLのRPMIに再懸濁する。血球計数器を用いて腹膜洗浄中の全細胞数を列挙する。すべてのチューブが0.2-0.5百万個のセルを受け取るようにセル番号を調整します。
注:敗血症のマウスの腹膜洗浄には、おそらく出血のために現れる赤血球が含まれることがあります。腹膜細胞をカウントする際に赤血球を除外するように注意してください。明視野顕微鏡では、赤血球は免疫細胞よりもはるかに小さく見えます。これらは、中央にくぼみがある円形の平らなディスクまたはドーナツとして表示されますが、中空ではありません。赤血球を溶解する工程7を加えてもよい。 - 細胞を4°Cで200× g で10分間スピンダウンし、上清を捨て、細胞1xを1x冷PBSで洗浄した。細胞を200 × g で4°Cで10分間遠心分離する。
- PBS中の5%FBSおよび0.02%アジ化ナトリウムからなるブロッキング緩衝液中で調製したFcRブロッカー(1:400希釈)を用いてPEC上のFc受容体を遮断する。氷上で15分間インキュベートする。
- 細胞を200 × g で4°Cで10分間遠心分離する。上清を捨てる。目的の蛍光色素結合抗体をブロッキングバッファーで希釈する。抗マウスLY6Gの1:500希釈液を使用して好中球を染色する。
注:他の免疫細胞集団は、例えば、B細胞のための抗マウスB220、T細胞のための抗マウスCD3、およびマクロファージのための抗マウスF4/80を用いて検出することができる。 - 200 万個までの細胞を、抗体の希釈溶液 200 μL で別々のチューブでインキュベートします。陰性対照として、染色されていない対照のために各蛍光色素タイプに1本のチューブを脇に置いておき、抗体を含まない200μLのブロッキングバッファーで細胞をインキュベートした。
- サンプルを氷上で45分間インキュベートし、15分ごとに断続的にタッピングします。
- 細胞を200 × g で4°Cで10分間遠心分離する。 上清を捨てる。細胞を数日間保存する必要がある場合は、室温で約15分間、4%パラホルムアルデヒドで細胞を固定します。ただし、フローサイトメーターで新しく染色されたサンプルからデータを取得するのが最善です。
- 細胞を200 μLのFACS染色バッファー(PBS中の2% FBS)に再懸濁する。フローサイトメーターでデータを取得します。
結果
この特定のモデルを用いた宿主免疫応答の詳細な特徴付けは、以前の刊行物8、9に示されている。このセクションでは、説明したプロトコルのいくつかの代表的な結果が示されています。このモデルは、 Sの全身感染を誘導することを目的とする。腸チフスは細菌培養物の腹腔内注射により敗血症を誘導する。感染を確認するために、敗血症?...
ディスカッション
この記事では、 サルモネラ・ チフス菌の腹腔内注射によって重篤な形態の細菌敗血症を誘発する方法について説明する。このモデルは、 サルモネラ・ チフムリウム菌が細胞内病原体であり、したがって、高病原性であり、グラム陰性敗血症の臨床的に関連する状態を模倣するので、他のモデルよりも有利である。このモデルにおける腹膜炎敗血症の結果は全身性であり、感染...
開示事項
著者らは、開示する利益相反はありません。
謝辞
研究のためにマウスを提供してくれた中央動物施設IIScに感謝します。この研究は、インド政府バイオテクノロジー・サイエンス・アンド・エンジニアリング研究委員会(Department of Biotechnology and Science and Engineering Research Board)からのDpNへの助成金によって資金提供されました。DBT-IIScプログラムとDST-FIST助成金からのインフラ支援は大いに認められています。DpNラボの過去および現在のすべてのメンバーのサポートに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
参考文献
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved