Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Характеристика сальмонеллы Typhimurium-индуцированного септического перитонита у мышей
В этой статье
Резюме
Этот протокол описывает индукцию грамотрицательного монобактериального сепсиса в мышиной модельной системе. Модель полезна для исследования воспалительных и смертельных реакций хозяина во время сепсиса.
Аннотация
Сепсис представляет собой нерегулируемый иммунный ответ хозяина на микробную инвазию или повреждение тканей, приводящий к повреждению органов в месте, удаленном от инфекции или повреждения. В настоящее время широко используемые модели сепсиса на мышах включают липополисахаридную (LPS) эндотоксемию, лигирование и пункцию слепой кишки (CLP) и модельные системы монобактериальных инфекций. Этот протокол описывает метод изучения реакций хозяина во время сальмонеллы Typhimurium, вызванного инфекцией септического перитонита у мышей. С. Typhimurium, грамотрицательный внутриклеточный патоген, вызывает брюшной тифоз у мышей.
Этот протокол разрабатывает культуральную подготовку, индукцию септического перитонита у мышей посредством внутрибрюшинной инъекции и методы изучения системных реакций хозяина. Кроме того, представлена оценка бактериальной нагрузки в различных органах и проточный цитометрический анализ повышенного количества нейтрофилов в перитонеальном лаваже. Сальмонелла Typhimurium-индуцированный сепсис у мышей приводит к увеличению провоспалительных цитокинов и быстрой инфильтрации нейтрофилов в брюшинной полости, что приводит к снижению выживаемости.
Каждый шаг в этом протоколе был оптимизирован, что привело к высокой воспроизводимости патогенеза септического перитонита. Эта модель полезна для изучения иммунологических реакций во время бактериального сепсиса, роли различных генов в прогрессировании заболевания и эффектов лекарств для ослабления сепсиса.
Введение
Сепсис определяется как дисрегулируемый системный воспалительный и иммунный ответ на микробную инвазию или повреждение тканей, приводящий к повреждению органа, удаленному от места инфекции или повреждения. Септический шок представляет собой подмножество сепсиса, характеризующегося гипотонией, сохраняющейся во время объемной реанимации, со значительно повышенным риском смертности1. Широкая общественность стала более осведомлена об этом расстройстве во время пандемии COVID-19. Несмотря на высокую смертность, всеобъемлющие эпидемиологические данные о глобальном бремени сепсиса отсутствуют из-за сложности его диагностики. В 2017 году во всем мире было зарегистрировано 48,9 миллиона случаев сепсиса и 11 миллионов смертей, что составляет 19,7% всех глобальных смертей2. Кроме того, исследование расширенной распространенности инфекции и связанного с ней сепсиса у пациентов отделения интенсивной терапии показало, что 62% положительных изолятов от пациентов были грамотрицательными организмами3.
Первоначально исследования сепсиса были сосредоточены на разграничении микробного патогенеза. Однако понимание «гипотезы опасности», которая диктует, как хозяин различает себя и не-себя, привело к смещению баланса исследований сепсиса в сторону понимания реакции хозяина на вторгшийся патоген. Широко используемые модели сепсиса на мышах включают модель эндотоксемии, индуцированную липополисахаридом (ЛПС), модели полимикробного сепсиса, перевязку и пункцию слепой кишки (CLP) и перитонит стента толстой кишки (CASP) и модели монобактериальной инфекции4.
Мы стандартизировали систему мышиной модели, индуцируя перитонеальный сепсис с использованием Salmonella Typhimurium. Эта модель выгодна перед другими, потому что Salmonella Typhimurium является внутриклеточным патогеном, который имитирует клинически значимое состояние грамотрицательного сепсиса. Исход сепсиса перитонита в этой модели является системным, со 100% смертностью в течение 96 ч после заражения. Таким образом, эта модель играет важную роль в изучении воспалительных и смертельных реакций хозяина. В этой модели сепсис индуцируется внутрибрюшинной инъекцией 0,5 миллиона колониеобразующих единиц (КОЕ) Salmonella Typhimurium в 8-10-недельную мышь C57BL/6. Системная инфекция может быть подтверждена путем оценки бактериальной нагрузки органов ~ 16 ч после заражения. Эта статья демонстрирует сепсис перитонита, вызванный сальмонеллой Typhimurium, у мышей, характеризует результирующие изменения в составе перитонеальных клеток и количественно оценивает бактериальную нагрузку в различных органах.
протокол
Все эксперименты с использованием Salmonella Typhimurium проводились на объектах уровня биобезопасности 2 (BSL-2). Необходимо соблюдать осторожность при использовании надлежащих средств индивидуальной защиты (СИЗ), обеспечивать безопасность и следовать стандартным методам утилизации биологической опасности BSL-2. Все эксперименты на мышах проводились в соответствии с руководящими принципами, установленными Институциональным комитетом по этике животных, IISc. Мыши были выведены и содержались в Центральном животноводческом учреждении IISc (регистрационный номер: 48/1999/CPCSEA, от 03.01.1999), утвержденном Министерством окружающей среды и лесного хозяйства правительства Индии. Протоколы экспериментов были утверждены Комитетом по целям, контролю и надзору за экспериментами на животных с утвержденным номером разрешения CAF/Ethics/797/2020.
Определение BSL2: Рейтинг BSL2 представляет собой то, что биологически опасные агенты представляют умеренную угрозу для окружающей среды и лабораторного персонала5.
1. Приготовление культуры сальмонеллы Typhimurium
- Добавьте 100 мкл бульона сальмонеллы Typhimurium NCTC 12023 глицерина в 3 мл бульона Luria Bertani (LB). Инкубируйте культуру со скоростью 160 об/мин при 37 °C в течение ночи.
- Проведите 50 мкл выращенной на ночь культуры в бульоне LB на агаровую пластину Salmonella Shigella (SS) и инкубируйте при 37 °C в течение ~ 12 ч. Храните агаровую пластину SS с бактериальными колониями при 4 °C в течение нескольких дней до эксперимента с инфекцией in vivo .
- Выберите одну колонию из полосатой агаровой пластины SS с помощью микроконверса. Выталкивайте микрокол в 3 мл бульона LB и культивируйте при 160 об/мин при 37 °C в течение ночи.
- Добавьте 0,1 мл бактериальной культуры к 50 мл бульона LB и инкубируйте при 37 °C в шейкерном инкубаторе при 160 об/мин в течение 3-4 ч, чтобы достичь логарифмической фазы роста. Разбавить культуру в 2 раза, используя бульон LB.
ПРИМЕЧАНИЕ: Во время логарифмической фазы бактериальные клетки находятся в лучшем состоянии здоровья и активно делятся. - Измерьте оптическую плотность (OD) культуры при длине волны света 600 нм в спектрофотометре или считывателе микропластин. Как только ОД достигнет 1,0, сделайте две аликвоты по 1 мл культуры в микрофьюжных пробирках объемом 1,5 мл.
- Центрифугируйте пробирки по 7 750 × г в течение 15 мин. Выбросьте супернатант и промыть гранулу 1 мл 1x PBS 2x. Центрифугируйте пробирки по 7 750 × г в течение 15 мин.
- Повторно суспендировать гранулу в 0,5 мл 1x PBS в двух разных микрофьюжных пробирках по 1,5 мл. Объедините суспензии из обеих трубок в одну трубку объемом 1,5 мл, содержащую ~ 2 × 108 колониеобразующих единиц (КОЕ) / мл.
- Приготовьте бактериальную клеточную суспензию 1 × 106 КОЕ/мл, разбавляя этот раствор.
ВНИМАНИЕ: Оптимизируйте КОЕ, соответствующую OD, в определенных лабораторных условиях для определения КОЕ для OD 1.0 перед началом экспериментов.
2. Мыши и инфекции
- Домашний 8-10-недельный самец мышей C57BL/6 весом ~20 г в помещении для животных в течение нескольких дней для акклиматизации.
- В день заражения подержите мышь одной рукой, протрите кожу живота 70% этанолом, а задние лапы раздвиньте для лучшей доступности брюшной стенки.
- Вводят 0,5 мл 1 × 106 КОЕ/мл бактериальной суспензии внутрибрюшинно с помощью шприца 1 мл. Поэтому каждая мышь получает 5 × 105 КОЕ. Контрольные, неинфицированные мыши получают 0,5 мл PBS в одиночку. После заражения вдавайте культуру, чтобы проверить фактически введенный КОЕ, который может варьироваться от 0,2-0,8 млн КОЕ / 0,5 млн.
- Поместите мышей обратно в клетки по назначению.
- Принесите в жертву мышей, использующих асфиксиюCO2 ~ 12-18 ч после заражения, для лучшего ответа. Обычно все инфицированные мыши умирают в течение 96 ч. При некоторых экспериментальных вмешательствах некоторые мыши могут выжить. Усыпляют этих мышей через 96 ч. Кроме того, усыпляют любую мышь с температурой тела ниже 33,2 ° C и острым дистрессом через 96 ч в качестве гуманной конечной точки.
ПРИМЕЧАНИЕ: В этой модели некоторые мыши могут начать умирать после 12 ч инъекции сальмонеллы . Поэтому планируйте эксперименты правильно, используя несколько временных точек.
3. Оценка КОЕ органов
- Принесите в жертву инфицированную мышь удушьемCO2 и протрите живот кусочком хлопка, смоченным в 70% этаноле. Разрезать кожу живота. Обратитесь к статье Рэя и Диттеля для видеопротокола о том, как собирать жидкость для промывания брюшины6. Вскрываем брюшинную полость и собираем органы, представляющие интерес, в микрофьюжные трубки. Кроме того, поскольку кровь у мышей с сепсисом быстро свертывается, а количество низкое, соберите ее быстро после жертвоприношения.
ПРИМЕЧАНИЕ: Это видео демонстрирует перечисление КОЕ органов из печени, поскольку печень подвергается обширному гистопатологическому повреждению в этой модели сепсиса. - Отрежьте небольшой кусочек печени и поместите его в микрофьюжную трубку.
ПРИМЕЧАНИЕ: Его можно хранить на льду в течение максимум 2-3 ч, прежде чем перейти к следующему шагу. - Взвесьте и переложите кусочки в микроцентрифужные трубки. Предпочтительно нарезать куски массой ~10-15 мг для правильной гомогенизации. Используйте целые органы в случае более мелких, таких как брыжеечные лимфатические узлы (MLN) или тимус.
- Добавьте в трубку 0,5 мл 1x PBS и гомогенизируйте органы с помощью гомогенизатора рук. Убедитесь, что органы полностью гомогенизированы. Увеличьте объем до 1 мл, добавив 0,5 мл 1x PBS.
- Центрифугируйте пробирки по 200 × г в течение 5 мин при 4 °C.
- Соберите супернатант в свежие микрофрагменные трубки и приготовьте разведения 1 × 10−1 и 10−2 в 96-луночной пластине.
- Выложить 50 мкл разбавителя на свежие агаровые пластины SS и инкубировать пластины при 37 °C в течение 12 ч.
- Подсчитайте количество колоний, которые появляются в каждом состоянии, и нормализуйте данные с массой органа с помощью уравнения (1):
КОЕ/мг =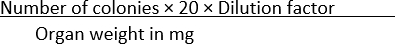 (1)
(1)
ПРИМЕЧАНИЕ: Число 20 используется в формуле для преобразования колоний на пластину в КОЕ/мл. Это число получают путем деления 1 мл на количество данного объема покрываемой культуры - в данном случае 50 мкл.
Например, если в агаровой пластине SS обнаружено 100 колоний, где распространяется 50 мкл 1 × 10-1 разведения гомогенизированного органа весом 10 мг, то
КОЕ/мг =
4. Проточный цитометрический анализ различных популяций иммунных клеток в перитонеальном экссудате
- Соберите перитонеальные клетки, как описано ранее Ray и Dittel6.
- Повторное суспендирование клеточной гранулы из жидкости перитонеального лаважа в 1 мл RPMI с добавлением 10% фетальной бычьей сыворотки (FBS). Перечислите общее количество клеток в промывании брюшины с помощью гемоцитометра. Отрегулируйте количество клеток так, чтобы каждая трубка получала 0,2-0,5 миллиона клеток.
ПРИМЕЧАНИЕ: Перитонеальное лаваж у мышей с сепсисом может содержать эритроциты, которые, вероятно, появляются из-за кровоизлияния. Будьте осторожны, чтобы исключить эритроциты при подсчете перитонеальных клеток. В микроскопе С ярким полем эритроциты кажутся намного меньше, чем иммунные клетки. Они выглядят как плоские диски или пончики, круглые, с углублением в центре, но не полые. Шаг для лизирования эритроцитов может быть добавлен7. - Раскрутите ячейки вниз при 200 × g при 4 °C в течение 10 мин, выбросьте супернатант и промыте ячейки 1x с 1x холодным PBS. Центрифугирование клеток при 200 × г при 4 °C в течение 10 мин.
- Блокируют Fc-рецепторы на PECs с помощью блокатора FcR (разбавление 1:400), приготовленного в блокирующем буфере, состоящем из 5% FBS и 0,02% азида натрия в PBS. Инкубировать на льду в течение 15 мин.
- Центрифугируют ячейки при 200 × г при 4 °C в течение 10 мин. Выбросьте супернатант. Разбавляют фторхром-конъюгированные антитела, представляющие интерес в блокирующем буфере. Используйте разведение 1:500 против мышиного LY6G для окрашивания нейтрофилов.
ПРИМЕЧАНИЕ: Другие популяции иммунных клеток также могут быть обнаружены с помощью, например, антимышечного B220 для В-клеток, антимышечного CD3 для Т-клеток и антимышечного F4/80 для макрофагов. - Инкубируют ~0,2 млн клеток в 200 мкл разбавленных растворов антител в отдельных пробирках. В качестве отрицательного контроля выделяют по одной трубке в каждом типе фторхрома для неокрашенного контроля для инкубации клеток с 200 мкл блокирующего буфера без антител.
- Инкубируйте образцы на льду в течение 45 минут с прерывистым постукиванием каждые 15 минут.
- Центрифугируют ячейки при 200 × г в течение 10 мин при 4 °C. Выбросьте супернатант. Зафиксируйте клетки с 4% параформальдегидом в течение ~ 15 мин при комнатной температуре, если их необходимо хранить в течение нескольких дней. Однако лучше всего получать данные из свежеокрашенных образцов в проточном цитометре.
- Повторное суспендирование клеток в 200 мкл буфера окрашивания FACS (2% FBS в PBS). Получение данных в проточном цитометре.
Результаты
Подробная характеристика иммунного ответа хозяина с использованием этой конкретной модели показана в предыдущих публикациях 8,9. В этом разделе представлены некоторые репрезентативные результаты описанного протокола. Эта модель направлена на индуциро...
Обсуждение
В данной статье описан метод индуцирования тяжелой формы бактериального сепсиса путем внутрибрюшинной инъекции сальмонеллы Typhimurium. Эта модель выгодна перед другими, так как Salmonella Typhimurium является внутриклеточным патогеном и, следовательно, высокопатогенным, имитируя клиниче...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим Центральный центр животноводства, IISc за поставку нам мышей для исследований. Это исследование финансировалось за счет грантов DpN от Департамента биотехнологии и Совета по научным и инженерным исследованиям правительства Индии. Инфраструктурная поддержка со стороны программы DBT-IISc и грантов DST-FIST высоко ценится. Мы благодарим всех предыдущих и нынешних членов лаборатории DpN за их поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
Ссылки
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены