Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Salmonella Typhimurium ile İndüklenen Septik Peritonitin Karakterizasyonu
Bu Makalede
Özet
Bu protokol, bir fare modeli sisteminde Gram-negatif monobakteriyel sepsisin indüksiyonunu açıklar. Model, sepsis sırasında inflamatuar ve ölümcül konakçı yanıtlarının araştırılmasında yararlıdır.
Özet
Sepsis, mikrobiyal invazyon veya doku hasarına karşı düzensiz bir konakçı immün tepkisidir ve enfeksiyon veya hasardan uzak bir bölgede organ hasarına yol açar. Günümüzde sepsisin yaygın olarak kullanılan fare modelleri arasında lipopolisakkarit (LPS) kaynaklı endotoksemi, çekal ligasyon ve ponksiyon (CLP) ve monobakteriyel enfeksiyon modeli sistemleri bulunmaktadır. Bu protokol, farelerde Salmonella Typhimurium enfeksiyonuna bağlı septik peritonit sırasında konakçı yanıtlarını incelemek için bir yöntemi açıklar. S. Gram-negatif hücre içi patojen olan tifimuryum, farelerde tifo benzeri hastalığa neden olur.
Bu protokol, intraperitoneal enjeksiyon yoluyla farelerde septik peritonitin indüklenmesi ve sistemik konakçı yanıtlarını incelemek için kullanılan yöntemler hakkında kültür hazırlığı, indüksiyon konularını detaylandırır. Ayrıca, farklı organlardaki bakteri yükünün değerlendirilmesi ve periton lavajında artmış nötrofil sayılarının akış sitometrik analizi sunulmaktadır. Salmonella Farelerde tifimuryuma bağlı sepsis, proinflamatuar sitokinlerde bir artışa ve periton boşluğunda nötrofillerin hızlı infiltrasyonuna yol açarak daha düşük sağkalıma yol açar.
Bu protokoldeki her adım optimize edilmiş ve septik peritonit patogenezinin yüksek tekrarlanabilirliği ile sonuçlanmıştır. Bu model, bakteriyel sepsis sırasında immünolojik yanıtları, farklı genlerin hastalık progresyonundaki rollerini ve ilaçların sepsiyi zayıflatma etkilerini incelemek için yararlıdır.
Giriş
Sepsis, mikrobiyal invazyon veya doku hasarına karşı düzensiz sistemik inflamatuar ve immün yanıt olarak tanımlanır ve enfeksiyon veya hasar bölgesinden uzakta organ hasarına yol açar. Septik şok, hacim resüsitasyonu sırasında devam eden hipotansiyon ile karakterize bir sepsis alt kümesidir ve mortalite riski önemli ölçüde artmıştır1. Genel halk, COVID-19 pandemisi sırasında bu bozukluğun daha fazla farkına varmıştır. Yüksek ilişkili mortalitesine rağmen, sepsisin küresel yükü ile ilgili kapsamlı epidemiyolojik veriler, tanısının karmaşıklığı nedeniyle eksiktir. 2017 yılında, dünya çapında 48,9 milyon sepsis insidansı ve 11 milyon ölüm meydana gelmiş olup, tüm küresel ölümlerin %19,7'sini oluşturmaktadır2. Ayrıca, yoğun bakım hastalarında enfeksiyon ve buna bağlı sepsis prevalansının uzaması üzerine yapılan bir çalışmada, hastalardan pozitif izolatların% 62'sinin Gram-negatif organizmalar olduğu bulunmuştur3.
Sepsis üzerine yapılan araştırmalar başlangıçta mikrobiyal patogenezi tanımlamaya odaklanmıştır. Bununla birlikte, konağın kendini ve benlik olmayanı nasıl ayırt ettiğini belirleyen "tehlike hipotezini" anlamak, sepsis araştırmasının dengesinin, istilacı bir patojene karşı konakçı tepkisini anlamaya doğru eğilmesine yol açmıştır. Sepsisin yaygın olarak kullanılan fare modelleri arasında lipopolisakkarit (LPS) kaynaklı endotoksemi modeli, polimikrobiyal sepsis modelleri, çekal ligasyon ve ponksiyon (CLP) ve kolon ascendens stent peritonit (CASP) ve monobakteriyel enfeksiyon modelleri4 bulunmaktadır.
Salmonella Typhimurium kullanarak periton sepsisini indükleyerek fare model sistemi standartlaştırdık. Bu model diğerlerine göre avantajlıdır, çünkü Salmonella Typhimurium, Gram-negatif sepsisin klinik olarak ilgili durumunu taklit eden hücre içi bir patojendir. Bu modelde peritonit sepsisinin sonucu sistemiktir ve enfeksiyon sonrası 96 saat içinde %100 mortalite vardır. Bu nedenle, bu model enflamatuar ve ölümcül konakçı yanıtlarını incelemede etkilidir. Bu modelde sepsis, intraperitoneal olarak 0.5 milyon koloni oluşturan Salmonella Typhimurium biriminin (CFU) 8-10 haftalık bir C57BL / 6 fareye enjekte edilmesiyle indüklenir. Sistemik enfeksiyon, enfeksiyon sonrası organ bakteri yükünün ~ 16 saat değerlendirilmesiyle doğrulanabilir. Bu makalede, farelerde Salmonella Typhimurium kaynaklı peritonit sepsisi gösterilmektedir, periton hücre kompozisyonunda ortaya çıkan değişiklikleri karakterize etmekte ve farklı organlardaki bakteri yükünü ölçmektedir.
Protokol
Salmonella Typhimurium kullanılarak yapılan tüm deneyler Biyo Güvenlik Seviye 2 (BSL-2) tesislerinde gerçekleştirilmiştir. Uygun kişisel koruyucu ekipman (KKD) kullanmak, güvenliği sağlamak ve standart BSL-2 biyolojik tehlike bertaraf yöntemlerini takip etmek için özen gösterilmelidir. Tüm fare deneyleri, Kurumsal Hayvan Etiği Komitesi, IISc tarafından belirtilen yönergeleri izleyerek gerçekleştirilmiştir. Fareler, Hindistan Hükümeti Çevre ve Orman Bakanlığı tarafından onaylanan IISc Merkezi Hayvan Tesisi'nde (Kayıt numarası: 48/1999/CPCSEA, 1/3/1999 tarihli) yetiştirildi ve bakımı yapıldı. Deney protokolleri, Hayvanlar Üzerinde Yapılan Deneylerin Amaç ve Kontrol ve Denetimi Komitesi tarafından CAF/Ethics/797/2020 onaylı izin numarası ile onaylanmıştır.
BSL2 tanımı: BSL2 derecesi, biyotehlikeli ajanların çevre ve laboratuvar personeli için orta derecede tehdit oluşturduğunu gösterir5.
1. Salmonella Typhimurium'un kültür hazırlığı
- 3 mL Luria Bertani (LB) suyuna 100 μL Salmonella Typhimurium NCTC 12023 gliserol stoğu ekleyin. Kültürü gece boyunca 37 ° C'de 160 rpm'de inkübe edin.
- LB suyunda gece yetiştirilen kültürün 50 μL'sini bir Salmonella Shigella (SS) agar plakasına yerleştirin ve ~ 12 saat boyunca 37 ° C'de inkübe edin. SS agar plakasını, in vivo enfeksiyon deneyinden önce birkaç gün boyunca bakteri kolonileri ile 4 ° C'de saklayın.
- Bir mikrouç kullanarak çizgili SS agar plakasından tek bir koloni seçin. Mikroucu gece boyunca 37 ° C'de 160 rpm'de 3 mL LB et suyu ve kültürüne çıkarın.
- 50 mL LB suyuna 0,1 mL bakteri kültürü ekleyin ve logaritmik büyüme aşamasına ulaşmak için 3-4 saat boyunca 160 rpm'de bir çalkalayıcı inkübatörde 37 ° C'de inkübe edin. LB suyu kullanarak kültürü 2 kat seyreltin.
NOT: Logaritmik aşamada, bakteri hücreleri en iyi sağlıklarındadır ve aktif olarak bölünürler. - Bir spektrofotometre veya mikroplaka okuyucuda 600 nm ışık dalga boyunda kültürün optik yoğunluğunu (OD) ölçün. OD 1.0'a ulaştığında, 1.5 mL mikrofüj tüplerinde 1 mL kültürden iki aliquot yapın.
- Tüpleri 15 dakika boyunca 7.750 × g'da santrifüj yapın. Süpernatantı atın ve peleti 1 mL 1x PBS 2x ile yıkayın. Tüpleri 15 dakika boyunca 7.750 × g'da santrifüj yapın.
- Pelet, iki farklı 1,5 mL mikrofüj tüpünde 0,5 mL 1x PBS'de yeniden askıya alın. Her iki tüpten gelen süspansiyonları, şimdi ~2 × 108 koloni oluşturan birim (CFU) / mL içeren bir 1,5 mL tüpte birleştirin.
- Bu stok çözeltisini seyrelterek 1 × 106 CFU / mL'lik bir bakteriyel hücre süspansiyonu hazırlayın.
DİKKAT: Deneyleri başlatmadan önce OD 1.0 için CFU'yu belirlemek üzere belirli laboratuvar koşullarında OD'ye karşılık gelen CFU'yu optimize edin.
2. Fareler ve enfeksiyonlar
- Ev 8-10 haftalık erkek C57BL / 6 fareleri, alışma için birkaç gün boyunca hayvan tesisinin temiz hava odasında ~ 20 g ağırlığındadır.
- Enfeksiyon gününde, fareyi bir elinizle tutun, karın derisini% 70 etanol ile silin ve karın duvarının daha iyi erişilebilir olması için arka bacakları yayın.
- 1 mL'lik bir şırınga yardımıyla intraperitoneal olarak 0,5 mL'lik 1 × 106 CFU / mL bakteriyel süspansiyon enjekte edin. Bu nedenle, her fare 5 × 105 CFU alır. Kontrol, enfekte olmamış fareler tek başına 0.5 mL PBS alır. Enfeksiyon sonrası, enjekte edilen gerçek CFU'yu kontrol etmek için kültürü plakalayın, bu da 0.2-0.8 milyon CFU / 0.5 mL arasında değişebilir.
- Fareleri atandığı gibi kafeslere geri koyun.
- En iyi yanıt için CO 2 boğulması ~12-18 saat enfeksiyon sonrası kullanarak fareleri feda edin. Genellikle, tüm enfekte fareler 96 saat içinde ölür. Bazı deneysel müdahaleler altında, bazı fareler hayatta kalabilir. Bu fareleri 96 saat sonra ötenazileştirin. Ayrıca, vücut ısısı 33.2 ° C'nin altında olan ve 96 saatte akut sıkıntı çeken herhangi bir fareyi insancıl bir son nokta olarak ötenazi yapın.
NOT: Bu modelde, bazı fareler 12 saatlik Salmonella enjeksiyonundan sonra ölmeye başlayabilir. Bu nedenle, birden fazla zaman noktasını içeren deneyleri uygun şekilde planlayın.
3. Organların CFU değerlendirmesi
- Enfekte fareyi CO2 boğulması ile feda edin ve% 70 etanol içine batırılmış bir parça pamukla karnı silin. Karın derisini kesin. Peritoneal lavaj sıvısının nasıl toplanacağına dair bir video protokolü için Ray ve Dittel'in makalesine bakın6. Peritoneal boşluğu kesin ve mikrofüj tüplerinde ilgilenilen organları toplayın. Ek olarak, sepsisli farelerde kan hızlı bir şekilde pıhtılaştığından ve miktarlar düşük olduğundan, fedakarlıktan sonra hızlı bir şekilde toplayın.
NOT: Bu video, bu sepsis modelinde karaciğer geniş histopatolojik hasara uğradığı için organ CFU'sunun karaciğerden sayımını göstermektedir. - Karaciğerin küçük bir parçasını kesin ve bir mikrofüj tüpüne yerleştirin.
NOT: Bu, bir sonraki adıma geçmeden önce en fazla 2-3 saat buz üzerinde saklanabilir. - Parçaları tartın ve mikrosantrifüj tüplerine aktarın. Tercihen, uygun homojenizasyon için ~ 10-15 mg ağırlığındaki kesilmiş parçalar. Mezenterik lenf düğümleri (MLN'ler) veya timus gibi daha küçük organlarda tüm organları kullanın.
- Tüpe 0,5 mL 1x PBS ekleyin ve bir el homojenizatörü kullanarak organları homojenize edin. Organların tamamen homojenize edildiğinden emin olun. 0,5 mL'lik 1x PBS ekleyerek hacmi 1 mL'ye yükseltin.
- Tüpleri 4 °C'de 5 dakika boyunca 200 × g'da santrifüj yapın.
- Süpernatantı taze mikrofüj tüplerine toplayın ve 96 delikli bir plakada 1 × 10−1 ve 10−2 seyreltmeleri hazırlayın.
- Seyrelticinin 50 μL'sini taze SS agar plakalarına yayın ve plakaları 12 saat boyunca 37 ° C'de inkübe edin.
- Her koşulda görünen kolonilerin sayısını sayın ve Denklem (1)'i kullanarak verileri organ ağırlığıyla normalleştirin:
CFU/mg =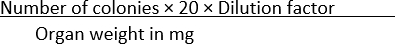 (1)
(1)
NOT: Formülde plaka başına kolonileri CFU / mL'ye dönüştürmek için 20 sayısı kullanılır. Bu sayıya, 1 mL'nin, kaplanan kültürün belirli bir hacminin miktarına bölünmesiyle elde edilir - bu durumda, 50 μL.
Örneğin, 10 mg ağırlığındaki homojenize bir organın 1 × 10-1 seyreltilmesinin 50 μL'sinin yayıldığı bir SS agar plakasında 100 koloni bulunursa, o zaman
CFU/mg =
4. Peritoneal eksüdada çeşitli immün hücre popülasyonlarının akış sitometrik analizi
- Daha önce Ray ve Dittel6 tarafından tanımlandığı gibi periton hücrelerini toplayın.
- Hücre peletini peritoneal lavaj sıvısından %10 fetal sığır serumu (FBS) ile desteklenmiş 1 mL RPMI içinde yeniden askıya alın. Bir hemositometre kullanarak periton lavajındaki toplam hücre sayılarını numaralandırın. Hücre numarasını, her tüp 0.2-0.5 milyon hücre alacak şekilde ayarlayın.
NOT: Sepsisli farelerde periton lavajı, muhtemelen kanama nedeniyle ortaya çıkan RBC'ler içerebilir. Peritoneal hücreleri sayarken RBC'leri dışlamaya dikkat edin. Parlak alan mikroskobunda, RBC'ler bağışıklık hücrelerinden çok daha küçük görünür. Bunlar, ortada bir girinti bulunan, ancak içi boş olmayan, yuvarlak, düz diskler veya çörekler olarak görünür. RBC'leri lize etmek için bir adımeklenebilir 7. - Hücreleri 10 dakika boyunca 4 ° C'de 200 × g'da döndürün, süpernatanı atın ve hücreleri 1x soğuk PBS ile 1x yıkayın. Hücreleri 10 dakika boyunca 4 °C'de 200 × g'da santrifüj yapın.
- PBS'de% 5 FBS ve% 0.02 sodyum azidden oluşan blokaj tamponunda hazırlanan FcR blokeri (1:400 seyreltme) kullanarak PEC'lerdeki Fc reseptörlerini bloke edin. 15 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Hücreleri 10 dakika boyunca 4 °C'de 200 × g'da santrifüj yapın. Süper natantı atın. Bloke edici tamponla ilgilenen florokrom konjuge antikorları seyreltin. Nötrofilleri boyamak için fare karşıtı LY6G'nin 1:500 seyreltilmesini kullanın.
NOT: Diğer bağışıklık hücresi popülasyonları, örneğin, B hücreleri için fare karşıtı B220, T hücreleri için fare karşıtı CD3 ve makrofajlar için fare karşıtı F4/80 kullanılarak da tespit edilebilir. - Ayrı tüplerdeki seyreltilmiş antikor çözeltilerinin 200 μL'sinde ~ 0.2 milyon hücreyi inkübe edin. Negatif bir kontrol olarak, lekesiz kontrolün hücreleri antikorsuz 200 μL bloke edici tamponla inkübe etmesi için her florokrom tipinde bir tüp ayırın.
- Her 15 dakikada bir aralıklı dokunma ile numuneleri 45 dakika boyunca buz üzerinde inkübe edin.
- Hücreleri 4 ° C'de 10 dakika boyunca 200 × g'da santrifüj yapın. Süper natantı atın. Birkaç gün boyunca saklanmaları gerekiyorsa, hücreleri% 4 paraformaldehit ile oda sıcaklığında ~ 15 dakika sabitleyin. Bununla birlikte, bir akış sitometresinde taze boyanmış örneklerden veri elde etmek en iyisidir.
- Hücreleri 200 μL FACS boyama tamponunda (PBS'de% 2 FBS) yeniden askıya alın. Verileri bir akış sitometresinde alın.
Sonuçlar
Bu özel model kullanılarak konakçı immün yanıtının ayrıntılı bir karakterizasyonu önceki yayınlarda gösterilmiştir 8,9. Açıklanan protokolün birkaç temsili sonucu bu bölümde gösterilmiştir. Bu model S'nin sistemik enfeksiyonunu indüklemeyi amaçlamaktadır. Sepsisi indüklemek için bakteri kültürünün intraperitoneal enjeksiyonu ile typhimurium. Enfeksiyonu doğrulamak için, septik farelerden karaciğer lizatları ve dalak SS...
Tartışmalar
Bu makalede, Salmonella Typhimurium'un intraperitoneal enjeksiyonu ile ciddi bir bakteriyel sepsis formunu indükleme yöntemi açıklanmaktadır. Bu model, Salmonella Typhimurium'un hücre içi bir patojen olması ve dolayısıyla Gram-negatif sepsisin klinik olarak ilgili durumunu taklit eden oldukça patojenik olması nedeniyle diğerlerine göre avantajlıdır. Bu modelde peritonit sepsisinin sonucu sistemiktir ve enfeksiyon sonrası 96 saat içinde %100 mortalite vardır. Bu nedenle, bu model enfla...
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Merkezi Hayvan Tesisi, IISc'ye araştırma için bize fareler sağladığı için teşekkür ederiz. Bu çalışma, Hindistan Hükümeti Biyoteknoloji Bölümü ve Bilim ve Mühendislik Araştırma Kurulu'ndan DpN'ye verilen hibelerle finanse edilmiştir. DBT-IISc programından gelen altyapı desteği ve DST-FIST hibeleri büyük ölçüde kabul edilmektedir. DpN laboratuvarının önceki ve mevcut tüm üyelerine destekleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
Referanslar
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır