Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización de la peritonitis séptica inducida por Salmonella Typhimurium en ratones
En este artículo
Resumen
Este protocolo describe la inducción de sepsis monobacteriana Gram-negativa en un sistema modelo de ratón. El modelo es útil para investigar las respuestas inflamatorias y letales del huésped durante la sepsis.
Resumen
La sepsis es una respuesta inmune desregulada del huésped a la invasión microbiana o daño tisular, que conduce a una lesión orgánica en un sitio distante del de la infección o daño. Actualmente, los modelos de sepsis de ratones ampliamente utilizados incluyen endotoxemia inducida por lipopolisacáridos (LPS), ligadura y punción cecal (CLP) y sistemas modelo de infección monobacteriana. Este protocolo describe un método para estudiar las respuestas del huésped durante la peritonitis séptica inducida por la infección por Salmonella Typhimurium en ratones. S. El typhimurium, un patógeno intracelular Gram-negativo, causa una enfermedad similar a la fiebre tifoidea en ratones.
Este protocolo elabora la preparación del cultivo, la inducción de la peritonitis séptica en ratones a través de la inyección intraperitoneal y los métodos para estudiar las respuestas sistémicas del huésped. Además, se presenta la evaluación de la carga bacteriana en diferentes órganos y el análisis citométrico de flujo del aumento del número de neutrófilos en el lavado peritoneal. Salmonella La sepsis inducida por typhimurium en ratones conduce a un aumento de las citoquinas proinflamatorias y a una rápida infiltración de neutrófilos en la cavidad peritoneal, lo que lleva a una menor supervivencia.
Cada paso en este protocolo ha sido optimizado, lo que resulta en una alta reproducibilidad de la patogénesis de la peritonitis séptica. Este modelo es útil para estudiar las respuestas inmunológicas durante la sepsis bacteriana, el papel de diferentes genes en la progresión de la enfermedad y los efectos de los fármacos para atenuar la sepsis.
Introducción
La sepsis se define como una respuesta inflamatoria e inmune sistémica desregulada a la invasión microbiana o daño tisular, que conduce a una lesión orgánica distante del sitio de infección o daño. El shock séptico es un subconjunto de sepsis caracterizado por hipotensión persistente durante la reanimación de volumen, con un riesgo sustancialmente mayor de mortalidad1. El público en general se ha vuelto más consciente de este trastorno durante la pandemia de COVID-19. A pesar de su alta mortalidad asociada, faltan datos epidemiológicos completos sobre la carga global de sepsis debido a la complejidad de su diagnóstico. En 2017, hubo 48,9 millones de incidencias de sepsis y 11 millones de muertes en todo el mundo, lo que representa el 19,7% de todas las muertes mundiales2. Además, un estudio sobre la prevalencia extendida de infección y sepsis relacionada en pacientes de unidades de cuidados intensivos encontró que el 62% de los aislamientos positivos de pacientes eran organismosgramnegativos 3.
Inicialmente, las investigaciones sobre la sepsis se centraron en delinear la patogénesis microbiana. Sin embargo, la comprensión de la "hipótesis del peligro", que dicta cómo el huésped distingue a sí mismo y no-yo, llevó a la inclinación del equilibrio de la investigación de la sepsis hacia la comprensión de la respuesta del huésped a un patógeno invasor. Los modelos de sepsis en ratones ampliamente utilizados incluyen el modelo de endotoxemia inducida por lipopolisacáridos (LPS), los modelos de sepsis polimicrobiana, la ligadura cecal y la punción (CLP) y la peritonitis del stent ascendente del colon (CASP), y los modelos de infección monobacteriana4.
Hemos estandarizado un sistema modelo de ratón mediante la inducción de sepsis peritoneal utilizando Salmonella Typhimurium. Este modelo es ventajoso sobre otros porque Salmonella Typhimurium es un patógeno intracelular que imita la condición clínicamente relevante de la sepsis Gram-negativa. El resultado de la sepsis de peritonitis en este modelo es sistémico, con una mortalidad del 100% dentro de las 96 h posteriores a la infección. Por lo tanto, este modelo es fundamental en el estudio de las respuestas inflamatorias y letales del huésped. En este modelo, la sepsis es inducida por la inyección intraperitoneal de 0,5 millones de unidades formadoras de colonias (UFC) de Salmonella Typhimurium en un ratón C57BL/6 de 8-10 semanas de edad. La infección sistémica se puede confirmar mediante la evaluación de la carga bacteriana del órgano ~ 16 h después de la infección. Este artículo demuestra la sepsis de peritonitis inducida por Salmonella Typhimurium en ratones, caracteriza las alteraciones resultantes en la composición de células peritoneales y cuantifica la carga bacteriana en diferentes órganos.
Protocolo
Todos los experimentos con Salmonella Typhimurium se llevaron a cabo en instalaciones de Nivel de Bioseguridad 2 (BSL-2). Se debe tener cuidado de usar el equipo de protección personal (EPP) adecuado, garantizar la seguridad y seguir los métodos estándar de eliminación de riesgos biológicos BSL-2. Todos los experimentos con ratones se llevaron a cabo siguiendo las pautas establecidas por el Comité Institucional de Ética Animal, IISc. Los ratones fueron criados y mantenidos en el Centro Central de Animales del IISc (número de registro: 48/1999/CPCSEA, de fecha 1/3/1999), aprobado por el Ministerio de Medio Ambiente y Bosques del Gobierno de la India. Los protocolos experimentales fueron aprobados por el Comité de Propósito y Control y Supervisión de Experimentos en Animales con el número de permiso aprobado CAF/Ethics/797/2020.
Definición de BSL2: Una clasificación BSL2 representa que los agentes biopeligrosos representan una amenaza moderada para el medio ambiente y el personal de laboratorio5.
1. Preparación del cultivo de Salmonella Typhimurium
- Añadir 100 μL de caldo de glicerol de Salmonella Typhimurium NCTC 12023 a 3 ml de caldo de Luria Bertani (LB). Incubar el cultivo a 160 rpm a 37 °C durante la noche.
- Rayar 50 μL del cultivo cultivado durante la noche en caldo LB en una placa de agar Salmonella Shigella (SS) e incubar a 37 °C durante ~12 h. Guarde la placa de agar SS con las colonias bacterianas a 4 °C durante varios días antes del experimento de infección in vivo .
- Elija una sola colonia de la placa de agar SS rayada usando una micropunta. Expulse la micropunta en 3 ml de caldo LB y cultive a 160 rpm a 37 °C durante la noche.
- Añadir 0,1 mL del cultivo bacteriano a 50 mL de caldo LB e incubar a 37 °C en una incubadora agitadora a 160 rpm durante 3-4 h para alcanzar la fase logarítmica de crecimiento. Diluir el cultivo por un factor de 2 usando caldo LB.
NOTA: Durante la fase logarítmica, las células bacterianas están en su mejor estado de salud y se están dividiendo activamente. - Mida la densidad óptica (OD) del cultivo a una longitud de onda de luz de 600 nm en un espectrofotómetro o lector de microplacas. Una vez que el OD alcance 1.0, hacer dos alícuotas de 1 mL de cultivo en tubos de microfuge de 1.5 mL.
- Centrifugar los tubos a 7.750 × g durante 15 min. Deseche el sobrenadante y lave el pellet con 1 ml de 1x PBS 2x. Centrifugar los tubos a 7.750 × g durante 15 min.
- Resuspender el pellet en 0.5 mL de 1x PBS en dos tubos de microfuge diferentes de 1.5 mL. Combine las suspensiones de ambos tubos en un tubo de 1.5 ml que ahora contiene ~ 2 × 108 unidades formadoras de colonias (UFC) / ml.
- Preparar una suspensión celular bacteriana de 1 × 106 UFC/ml diluyendo esta solución madre.
PRECAUCIÓN: Optimice la UFC correspondiente a la OD en condiciones específicas de laboratorio para determinar la CFU para OD 1.0 antes de iniciar los experimentos.
2. Ratones e infecciones
- Casa ratones machos C57BL / 6 de 8-10 semanas de edad que pesan ~ 20 g en la sala de aire limpio de la instalación de animales durante varios días para aclimatación.
- El día de la infección, sostenga el ratón con una mano, limpie la piel abdominal con etanol al 70% y extienda las patas traseras para una mejor accesibilidad de la pared abdominal.
- Inyecte 0,5 ml de 1 × 106 UFC/ml de suspensión bacteriana por vía intraperitoneal con la ayuda de una jeringa de 1 ml. Por lo tanto, cada ratón recibe 5 × 105 UFC. Los ratones controlados no infectados reciben 0,5 ml de PBS solo. Después de la infección, coloque el cultivo para verificar la UFC real inyectada, que puede variar de 0.2-0.8 millones de UFC / 0.5 ml.
- Vuelva a colocar a los ratones en las jaulas según lo asignado.
- Sacrifique a los ratones usando asfixia por CO2 ~ 12-18 h después de la infección para obtener la mejor respuesta. Por lo general, todos los ratones infectados mueren dentro de las 96 h. Bajo algunas intervenciones experimentales, algunos ratones pueden sobrevivir. Sacrificar a estos ratones después de 96 h. Además, sacrificar a cualquier ratón con una temperatura corporal inferior a 33,2 ° C y angustia aguda a las 96 h como un punto final humano.
NOTA: En este modelo, algunos ratones pueden comenzar a morir después de 12 h de la inyección de Salmonella . Por lo tanto, planifique los experimentos correctamente que involucren múltiples puntos de tiempo.
3. Evaluación de órganos de la UFC
- Sacrifica al ratón infectado por asfixia de CO2 y limpia el abdomen con un trozo de algodón sumergido en etanol al 70%. Abra la piel abdominal. Consulte el artículo de Ray y Dittel para obtener un protocolo de video sobre cómo recolectar líquido de lavado peritoneal6. Cortar abrir la cavidad peritoneal y recoger los órganos de interés en los tubos de microfuge. Además, como la sangre en ratones con sepsis se coagula rápidamente y las cantidades son bajas, recójala rápidamente después del sacrificio.
NOTA: Este video demuestra la enumeración de la UFC de órganos del hígado a medida que el hígado sufre un daño histopatológico extenso en este modelo de sepsis. - Corte un pequeño trozo del hígado y colóquelo en un tubo de microfuge.
NOTA: Esto se puede almacenar en hielo durante un máximo de 2-3 h antes de continuar con el siguiente paso. - Pesar y transferir las piezas a tubos de microcentrífuga. Preferiblemente, piezas cortadas que pesen ~ 10-15 mg para una homogeneización adecuada. Use órganos enteros en el caso de los más pequeños, como los ganglios linfáticos mesentéricos (MLN) o el timo.
- Agregue 0.5 ml de 1x PBS al tubo y homogeneice los órganos usando un homogeneizador de mano. Asegúrese de que los órganos estén completamente homogeneizados. Aumente el volumen a 1 ml agregando 0.5 ml de 1x PBS.
- Centrifugar los tubos a 200 × g durante 5 min a 4 °C.
- Recoja el sobrenadante en tubos de microfugas frescas y prepare diluciones de 1 × 10−1 y 10−2 en una placa de 96 pocillos.
- Extienda 50 μL del diluyente sobre placas de agar SS frescas e incube las placas a 37 °C durante 12 h.
- Cuente el número de colonias que aparecen en cada condición y normalice los datos con el peso del órgano usando la Ecuación (1):
UFC/mg =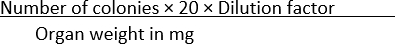 (1)
(1)
NOTA: El número 20 se utiliza en la fórmula para convertir las colonias por placa a UFC/ml. A este número se llega dividiendo 1 mL por la cantidad de un volumen dado del cultivo chapado, en este caso, 50 μL.
Por ejemplo, si se encuentran 100 colonias en una placa de agar SS, donde se extienden 50 μL de una dilución de 1 × 10-1 de un órgano homogeneizado que pesa 10 mg, entonces
UFC/mg =
4. Análisis citométrico de flujo de diversas poblaciones de células inmunes en exudado peritoneal
- Recolectar las células peritoneales como se describió anteriormente por Ray y Dittel6.
- Resuspend el pellet celular del líquido de lavado peritoneal en 1 ml de RPMI suplementado con suero fetal bovino (FBS) al 10%. Enumere el número total de células en el lavado peritoneal utilizando un hemocitómetro. Ajuste el número de celda para que cada tubo reciba 0.2-0.5 millones de células.
NOTA: El lavado peritoneal en ratones con sepsis puede contener glóbulos rojos, que probablemente aparecen debido a una hemorragia. Tenga cuidado de excluir los glóbulos rojos mientras cuenta las células peritoneales. En el microscopio de campo brillante, los glóbulos rojos parecen mucho más pequeños que las células inmunes. Estos aparecen como discos planos o rosquillas, redondos, con una hendidura en el centro, pero no huecos. Se puede agregar un paso para lisar los glóbulos rojos7. - Haga girar las células hacia abajo a 200 × g a 4 °C durante 10 minutos, deseche el sobrenadante y lave las células 1x con 1x PBS frío. Centrifugar las células a 200 × g a 4 °C durante 10 min.
- Bloquear los receptores Fc en los PECs utilizando el bloqueador FcR (dilución 1:400), preparado en tampón de bloqueo que consiste en 5% FBS y 0.02% de azida de sodio en PBS. Incubar en hielo durante 15 min.
- Centrifugar las células a 200 × g a 4 °C durante 10 min. Deseche el sobrenadante. Diluir los anticuerpos conjugados con fluorocromo de interés en el tampón de bloqueo. Use una dilución 1:500 de LY6G anti-ratón para teñir los neutrófilos.
NOTA: Otras poblaciones de células inmunes también se pueden detectar utilizando, por ejemplo, B220 anti-ratón para células B, CD3 anti-ratón para células T y F4/80 anti-ratón para macrófagos. - Incubar ~ 0.2 millones de células en 200 μL de las soluciones diluidas de anticuerpos en tubos separados. Como control negativo, reserve un tubo en cada tipo de fluorocromo para que el control no teñido incube las células con 200 μL de tampón de bloqueo sin anticuerpos.
- Incubar las muestras en hielo durante 45 min con tapping intermitente cada 15 min.
- Centrifugar las células a 200 × g durante 10 min a 4 °C. Deseche el sobrenadante. Fije las células con paraformaldehído al 4% durante ~ 15 minutos a temperatura ambiente si necesitan almacenarse durante varios días. Sin embargo, es mejor adquirir datos de muestras recién teñidas en un citómetro de flujo.
- Resuspend las células en 200 μL de tampón de tinción FACS (2% FBS en PBS). Adquiera los datos en un citómetro de flujo.
Resultados
Una caracterización detallada de la respuesta inmune del huésped utilizando este modelo particular se muestra en publicaciones anteriores 8,9. En esta sección se muestran algunos resultados representativos del protocolo descrito. Este modelo tiene como objetivo inducir la infección sistémica de S. Typhimurium por inyección intraperitoneal del cultivo bacteriano para inducir sepsis. Para confirmar la infección, los lisados del hígado y el bazo de ...
Discusión
Este artículo describe un método para inducir una forma grave de sepsis bacteriana mediante la inyección intraperitoneal de Salmonella Typhimurium. Este modelo es ventajoso sobre otros, ya que Salmonella Typhimurium es un patógeno intracelular y, por lo tanto, altamente patógeno, imitando la condición clínicamente relevante de la sepsis Gram-negativa. El resultado de la sepsis de peritonitis en este modelo es sistémico, con una mortalidad del 100% dentro de las 96 h posteriores a la infección. ...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a la Instalación Central de Animales, IISc por suministrarnos ratones para la investigación. Este estudio fue financiado por subvenciones a DpN del Departamento de Biotecnología y la Junta de Investigación de Ciencia e Ingeniería del Gobierno de la India. El apoyo de infraestructura del programa DBT-IISc y las subvenciones DST-FIST son muy reconocidos. Agradecemos a todos los miembros anteriores y actuales del laboratorio DpN por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
Referencias
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados