Method Article
使用三维类器官培养物离 体 维持人胶质母细胞瘤细胞多样性
摘要
在这里,我们描述了一种从主要患者标本或患者来源的细胞培养物中生成胶质母细胞瘤(GBM)类器官并将其维持至成熟的方法。这些GBM类器官含有表型不同的细胞群,并在 体外重建肿瘤微环境。
摘要
胶质母细胞瘤(GBM)是最常见的原发性恶性脑癌,预后极差。肿瘤内细胞和分子多样性,以及肿瘤微环境之间的复杂相互作用,可能使寻找有效的治疗方法成为一项挑战。传统的贴壁或球体培养方法可以掩盖这种复杂性,而三维类器官培养可以概括区域微环境梯度。类器官是一种三维GBM培养方法,可更好地模拟患者肿瘤结构,包含表型多样化的细胞群,可用于中等通量实验。虽然与传统培养相比,三维类器官培养更加费力和耗时,但它提供了独特的好处,可以弥合当前 体外 和 体内 系统之间的差距。类器官已成为癌症生物学家武器库中的宝贵工具,可以更好地了解肿瘤行为和耐药机制,并且其应用只会继续增长。这里详细介绍了生成和维护GBM类器官的方法。还介绍了如何使用冷冻和石蜡包埋技术进行类器官样品包埋和切片的说明,以及类器官切片的免疫组织化学和免疫荧光方案的建议,以及总类器官细胞活力的测量。
引言
胶质母细胞瘤 (GBM) 是最常见的原发性脑肿瘤,诊断后约 15 个月。在临床前研究中有效的治疗通常对患者效果不佳2,3。临床反应差归因于许多因素,包括GBM的微环境异质性和复杂的肿瘤内相互作用。这些很难在实验室环境中使用传统的贴壁或球体培养方法重现4。GBM中存在一部分自我更新的癌症干细胞(CSC)也可能导致这种复杂性5,6。CSC 对肿瘤增殖至关重要,并通过促进活性血管生成、癌症侵袭和对包括辐射在内的治疗的耐药性来维持肿瘤生长7,8,9。CSCs并非均匀分布在整个肿瘤中,而是富集在特定微环境中,包括血管周围生态位和会坏死区域,每个区域都为其细胞状态提供不同的分子调控10,11,12,13,14。CSC不是微环境线索的被动接受者,而是具有重塑自身微环境的能力7,15,16。CSC的微环境可以促进干细胞状态的维持,以响应营养稀缺,pH和缺氧等压力17,18,19,20,这表明这些条件在模型系统中的重要性。因此,概述肿瘤内不同的细胞微环境对于理解治疗耐药性和确定新疗法至关重要。
三维文化近年来越来越受欢迎21,22。类器官已被用于其他类型的癌症,维持细胞作为类器官的主要目标是允许异质细胞群的生长(其中许多细胞群通常在更均匀的球体培养中可能被竞争所击败)和空间多样性,被视为具有遗传特异性的区域肿瘤微环境4,23,24,25,26.癌细胞的三维培养方法有很多种,每种方法都有优点和缺点27,28,29。类器官培养不能替代传统的贴壁或球状培养。当存在细胞微环境与肿瘤细胞反应之间的相互作用至关重要的特定问题时,最好将其用作二维方法的补充技术。
本文介绍了从原发性患者样本或患者来源的培养物中生成GBM类器官的可靠且可重复的方法。我们解决了三维类器官培养的两个不同目标:(1)从原发性患者组织中建立类器官,无论均匀性如何,都具有最大的植入潜力,或(2)生长均匀类器官以进行更定量的实验使用。当将原代标本建立为类器官时,无需过滤单个细胞或计数细胞,因为保持最大细胞数量和类型以建立初始培养物是当务之急。然而,当为比较实验培养类器官时,需要单细胞过滤和细胞计数,以确保重复类器官具有实验一致性的可比性。该协议详细介绍了如何建立类器官培养物并创建均匀的类器官,以及包埋和保存类器官和标准细胞培养实验的改进方法,包括免疫组织化学,免疫荧光和GBM类器官中总细胞活力的评估。
研究方案
下文详述的协议的所有步骤都是根据克利夫兰诊所机构审查委员会(IRB)协议#2559和机构生物安全委员会(IBC)批准#1711制定和实施的。球体和类器官在"神经基础培养基完全"(NBMc)中培养。有关说明,请参阅 表 1 。
1. 制作类器官模具
- 将蜡纸从封口膜片(大约 4 cm x 4 cm)上取下,并将其放在两个无菌 96 孔聚合酶链反应 (PCR) 板之间。
- 在培养罩中执行这些步骤,并特别注意保持封口膜的"内部"(被纸覆盖的一侧)清洁。这种干净的一面应该使凹痕凹陷。
- 对顶部 96 孔 PCR 板施加均匀压力,以在封口膜中形成小凹陷。目标是使酒窝深度约为 2 毫米,而不会在封口膜上产生孔洞。
- 轻轻分开两个 96 孔 PCR 板。凹陷的封口膜会粘在顶板上。将其放在干冰上约30秒。
- 封口膜在干冰上放置 30 秒后,使用无菌镊子将封口膜从顶部 96 孔 PCR 板上拉下。
- 取下封口膜时,请使用快速动作,而不是非常"小心"。冷冻封口膜比加热的封口膜更容易去除,这会导致酒窝倒置。
- 将完成的封口膜模具放入有盖的无菌 10 cm 细胞培养皿中。模具可以提前制作,如果保持无菌,则可以储存。
2.患者组织标本的宏观解剖
- 在无菌培养皿(10 cm细胞培养板)中,使用两个无菌剃须刀片将患者标本切碎,同时施加均匀的压力。
注意:在培养皿上加入约 500 μL NBMc 时,对标本进行切碎是最容易的。尝试用剃须刀片尽可能细切碎;理想情况下,单个工件为 1 mm3 或更小。 - 使用切割的p1000移液器吸头将切碎的肿瘤碎片转移到15 mL离心管中。
注意:无论何时处理类器官,重要的是只使用切割的p1000移液器吸头。这些可以使用锋利的剃须刀切割成所需的开口尺寸(大约在 5 到 8 毫米之间)并高压灭菌。 - 加入2mL室温(RT)细胞分离溶液(材料表),并将其置于37°C,5%CO2 培养箱中约10分钟。
注意:每隔几分钟观察并混合一次。某些细胞分离溶液或标本可能需要不同的孵育时间。如果出现结块,这可能表明由于细胞裂解而导致DNA释放,请立即进行下一步。 - 加入 8 mL NBMc 培养基以中和细胞分离溶液,并以 65 x g 离心 3 分钟。
- 吸出上清液并将组织重悬于1-2mL的NBMc中。
3. 从患者原发组织生成类器官
注意:从原发性患者组织制作类器官时的目标是建立三维培养。不要过滤单个细胞或计数细胞,而是使用目视检查尽可能保持初始细胞负荷均匀。初始类器官的生长和建立存在异质性是正常的。每个类器官的体积为 20 μL(16 μL 富含层粘连蛋白的细胞外基质 (lrECM) 和 4 μL 悬浮在 NBMc 中的组织,来自步骤 2.5)。指令可以根据预期的类器官数量进行调整;目标是通常从主要患者标本中形成约20-30个类器官。
- 在冰桶或冷块中,放置lrECM和一个小离心管。将适量的lrECM(16μL x X数量的预期类器官)放入小离心管中。
- 将步骤 2.5 中的适当体积的组织悬浮液(4 μL x 预期类器官数量)加入冰上的离心管中。
- 小心地将 20 μL lrECM/细胞悬浮混合物移液到封口膜模具上;这将形成一个珍珠状的水滴。
- 确保彻底混合lrECM /细胞悬液混合物;细胞往往容易在lrECM内沉淀,导致异质类器官。
- 将lrECM /细胞悬浮液混合物放在冰上。如果lrECM变暖,它会聚合并破坏类器官的形成。确保每两到三个类器官冷却移液器吸头,以防止lrECM聚合。不要将气泡引入类器官(避免"双推"移液器)。
- 一旦将所需数量的类器官移液到10cm细胞培养板中的封口膜模具上,盖上板盖,并在37°C,5%CO 2的细胞培养箱中孵育1-2 小时。
- 类器官凝固后,使用NBMc培养基将其轻轻从封口膜模具中冲洗,并放入新的无菌10厘米培养板中,其中总共含有20 mL的NBMc。使用 p1000 吸头最好将类器官从模具上冲洗掉;它们会轻轻地滑落。
注意:当类器官从模具中冲洗到细胞培养板中时,它们在培养基中应显示为粉红色的小球体。如果类器官在培养基中似乎已经分崩离析或破碎,这表明lrECM已经聚合的早期问题,并且类器官可能仍然生长,但大小不太可能均匀。 - 将10厘米培养皿置于37°C,5%CO2 (不摇动)的细胞培养箱中4天。
注意:在最初几天将类器官放在轨道摇床上可能会导致它们分崩离析。确保它们在第 4 天之前不会颤抖。 - 4天后,交换培养基并置于37°C,5%CO2的细胞培养箱中以80RPM的轨道振荡器上。
- 与未成熟的类器官交换培养基具有挑战性,因为它们难以可视化。倾斜细胞培养皿并等待至少20秒;类器官将沉淀在底部,并允许用玻璃或塑料 10-20 mL 移液器缓慢去除上方的培养基。
- 仔细注意底部类器官的收集;如果它们似乎被介质移除的力量搅动,最好暂停并让它们重新稳定。随着类器官的成熟并且更容易可视化,这个过程变得不那么微妙。
注意:有时,在细胞培养板下方放置一张深色纸可以帮助可视化未成熟的类器官。建议不要使用带真空抽吸功能的巴斯德移液器来去除介质,因为类器官很容易被吸入并以这种方式丢失。 - 当类器官首次建立时,它们不会像成熟类器官那样迅速消耗培养基。从 50% 的培养基更换开始,可减少不必要的培养基使用,并减少在培养基更换过程中意外损坏或吸入新类器官的机会。
4. 从已建立的GBM球体,贴壁或类器官培养物中生成类器官
注意:这里的目标是制造大小和细胞数量均匀的类器官,用于比较实验,因此请使用单细胞过滤器并计数细胞以确保这一点。
- 从GBM球体培养物制备单细胞悬液。
注意:GBM细胞的球体培养物保存在NBMc培养基中。- 将球体放入 15 mL 离心管中,并以 120 x g 离心 5 分钟。
- 取出上清液并加入 2 mL RT 细胞分离溶液。置于37°C培养箱中3分钟。
- 加入 8 mL NBMc 培养基以中和细胞分离溶液。通过单细胞过滤器(70μm)应变并以120× g旋转5分钟。
- 从管中取出上清液并将剩余细胞重悬于~1mL的NBMc中。 计数细胞(使用细胞非通透染色剂)并跳至步骤4.4。
- 从GBM贴壁培养物制备单细胞悬液。
- 从板中取出用过的培养基,向板中加入2mLRT细胞分离溶液,并置于37°C培养箱中3分钟。
- 在显微镜下确认细胞已从板上分离。
- 加入 8 mL NBMc 培养基以中和细胞分离溶液。通过单细胞过滤器(70μm)进行应变。
注意:使用贴壁培养时,单细胞菌株是可选的。 - 以120 x g 旋转5分钟。从管中取出上清液并将剩余细胞重悬于~1mL的NBMc中。 计数细胞(使用细胞非通透染色剂)并跳至步骤4.4。
- 从GBM类器官培养物制备单细胞悬液。
- 使用切割的p1000移液器吸头将类器官转移到10cm培养板上,并小心地去除尽可能多的残留培养基。
- 使用两把无菌剃须刀,小心地将类器官切碎。使用切好的p1000尖端,将切碎的类器官移至15 mL离心管中,并加入~2-3 mL的NBMc培养基。
- 以120 x g 旋转3分钟并除去上清液(建议使用移液器吸头而不是真空抽吸)。
- 加入 2 mL 冷细胞分离溶液 10 分钟。
注意:细胞分离溶液应直接从4°C使用,而不是先加热。这似乎可以软化任何剩余的基质胶并有助于细胞恢复。 - 然后移至37°C培养箱10-20分钟,每隔几分钟观察和混合一次。如果出现结块,这可能表明细胞裂解,请立即进行下一步。
- 加入 8 mL NBMc 培养基以稀释细胞分离溶液。通过单细胞过滤器(70μm)应变并以120× g旋转5分钟。
- 从管中取出上清液并将剩余细胞重悬于~1mL的NBMc中。 计数细胞(使用细胞非通透染色剂)并继续步骤4.4。
- 用单细胞悬浮液制造类器官
- 在冰桶或冷块中,放置lrECM和一个小离心管。将适量的lrECM(16μL x X数量的预期类器官)放入小离心管中。
- 创建一个总体积(4 μL x X 数量预期类器官)的细胞混合物,其中包含 20,000 个细胞/类器官,并将其添加到冰上带有 lrECM 的小离心管中。
- 小心地将 20 μL lrECM/细胞悬浮混合物移液到封口膜模具上;这将形成一个珍珠状的水滴。
- 确保彻底混合lrECM /细胞悬浮液混合物,因为细胞往往容易在lrECM内沉淀,这将导致异质类器官。
- 将lrECM /细胞悬浮液混合物放在冰上。如果lrECM变暖,它会聚合并破坏类器官的形成。
- 确保每两到三个类器官冷却移液器吸头,以防止lrECM聚合。不要将气泡引入类器官(避免"双推"移液器吸头)。
- 一旦将所需数量的类器官移液到10cm培养板中的封口膜模具上,在细胞培养箱中在37°C下孵育1-2小时。
- 类器官凝固后,使用NBMc培养基将其轻轻从封口膜模具中冲洗,并放入新的无菌10厘米培养板中,其中总共含有20 mL的NBMc。使用 p1000 吸头最适合将类器官从模具中冲洗掉;它们会轻轻地滑落。
注意:建议每10厘米培养皿约15-20个类器官。 - 将10厘米培养皿置于培养箱(不摇动)中4天。
- 4天后,更换培养基并放置在细胞培养箱中80RPM的轨道振荡器上。此后每 2-3 天更换一次媒体。
- 与未成熟的类器官交换培养基具有挑战性,因为它们难以可视化。倾斜细胞培养皿并等待至少20秒;类器官将沉淀在底部,并允许用大开口玻璃移液管缓慢地从上方去除培养基。
- 仔细注意底部类器官的收集;如果它们似乎被介质移除的力量搅动,请暂停并让它们重新沉降。随着类器官的成熟并且更容易可视化,这个过程变得不那么微妙。
注意:有时,在细胞培养板下方放置一张深色纸可以帮助可视化未成熟的类器官。不要使用带真空抽吸功能的巴斯德移液器来去除介质,因为类器官很容易被吸入并以这种方式丢失。 - 当类器官首次建立时,它们不会像成熟类器官那样迅速消耗培养基。从 50% 的培养基更换开始,以减少不必要的培养基使用,并减少在培养基更换过程中意外损坏或吸入新类器官的机会。
5. 冷冻包埋
- 将每个类器官放入含有 1 mL 4% 多聚甲醛 (PFA) 的单独 1.5 mL 管(使用切割的 p1000 尖端)中。将类器官在4°C下储存过夜。 如果将类器官包埋在石蜡中,请继续执行第 6 部分。
- 在 4% PFA 中固定过夜后,在 1x 磷酸盐缓冲盐水 (PBS) 中洗涤类器官三次。
- 将类器官转移到含有1mL 30%蔗糖的水溶液的新1.5 mL管(使用切割的p1000移液器吸头)中,并在4°C下储存过夜。
- 向低温模具中加入少量(通常为 1-2 mL)最佳切割温度化合物 (OCT),覆盖底部并填充模具深度的约 1/3 至 1/2。
- 使用切割的p1000移液器吸头将单个类器官转移到冷冻中。这将导致一些培养基与类器官转移,这是不可避免的。使用较小的移液器吸头小心地去除周围的介质,而不会干扰类器官。
注意:这可能很难想象,但缓慢移液会显示出培养基和OCT之间的密度存在明显差异,因此这在某种程度上是"凭感觉"完成的)。 - 将冷冻剂放在干冰托盘上。OCT将开始冻结,在此过程中变得不透明。
- 添加额外的OCT以完全覆盖类器官,填充冷冻模具的其余体积。块可以在-20°C下储存以短期储存数天,或在-80°C下无限期储存。
6. 石蜡包埋
- 按大小对类器官进行排序(小类器官小于 3 mm,大型类器官超过 3 mm)。使用切割的p1000移液器吸头将每个类器官转移到组织学盒中,并根据表 2 或 表3处理成石蜡。
注:组织学暗盒的尺寸/配置取决于用户。 - 将类器官从盒中转移到装有 1-2 mL 熔化石蜡的嵌入模具中,并将其冷却至蜡呈半固体。
- 蜡部分凝固后,在模具顶部添加更多蜡。将贴有标签的暗盒顶部放在模具上,然后将其转移到冷板上。继续冷却,直到蜡完全凝固。
- 蜡凝固后,使用切片机切片块。或者,储存在室温或4°C下以供以后切片。
7. 免疫荧光
- 根据以下步骤,使用载玻片染色皿对5-12μm石蜡包埋的组织切片进行脱石蜡和再水化。
注意:如果使用OCT包埋的类器官切片,我们建议使用12 μm切片。通过在PBS中摇动载玻片30分钟来去除OCT。跳至步骤 7.2。- 在二甲苯中孵育5分钟。再重复两次。然后在100%乙醇中孵育10分钟。再重复一次。
- 在95%乙醇中孵育10分钟。再次重复。在蒸馏水中清洗切片5分钟,两次。
- 对于抗原解散,将载玻片浸没在1x柠檬酸盐脱露溶液(材料表)中,并在亚沸点温度下微波10分钟。确保不要让溶液沸腾。
注意:如果最初微波~2分钟直到沸腾,然后降低功率并观察以确保溶液不会沸腾,则可以最好地实现这一点。首选的暴露温度略低于 100 °C,理想情况下为 98 °C。 - 让载玻片在1x柠檬酸盐脱皮溶液中的室温冷却30分钟。
注意:这是相同的1x柠檬酸盐溶液;在此步骤中无需更换解决方案。 - 在蒸馏水中洗涤载玻片5分钟,两次。
- 在1x TBST(Tris缓冲盐水,含0.1%吐温20)缓冲液中洗涤载玻片5分钟。
- 从TBST中取出载玻片,并使用实验室清洁湿巾小心地将其擦干组织切片周围,同时注意不要让组织切片干燥。一旦载玻片足够干燥,用疏水屏障笔圈出组织切片。
- 在室温下用100-400μL的10%血清封闭溶液封闭每个切片1小时。例如,如果使用驴子制造的二抗,请使用 10% 的正常驴血清和 1x TBST。
- 除去封闭溶液,然后在封闭溶液中加入稀释至所需浓度的100-400μL一抗。
- 在4°C下,将切片与一抗孵育过夜。
- 取出一抗溶液,在1x TBST中洗涤载玻片5分钟,三次。
- 向每个切片中加入 100-400 μL 二抗(封闭溶液中的 1:1000 稀释度,或按照制造商的说明),并在室温下孵育 1.5 小时。
- 在 1x TBST 中清洗载玻片 5 分钟,两次。然后在1x PBS中清洗载玻片5分钟。
- 从PBS中取出载玻片,并使用实验室清洁湿巾将其擦干组织切片周围。加入几滴液体固化封片剂,并小心地安装玻璃盖玻片。载玻片干燥后,储存在-20°C避光,直到准备好成像。
8. 免疫组化
- 根据以下步骤,使用玻片染色皿对石蜡包埋的组织切片进行脱石蜡和再水化。
注意:如果使用OCT嵌入的类器官中的切片,请在PBS中摇动载玻片30分钟,以去除OCT。跳至步骤 8.2。- 在二甲苯中孵育5分钟。再重复两次。
- 在100%乙醇中孵育10分钟。再次重复。
- 在95%乙醇中孵育10分钟。再次重复。
- 在蒸馏水中洗涤切片5分钟,两次。
- 对于抗原揭开,将载玻片浸没在1x柠檬酸盐脱露溶液中,并在亚沸点温度下微波10分钟。确保不要让溶液沸腾。
- 让载玻片在室温下在1x柠檬酸盐脱皮溶液中冷却30分钟。
- 在蒸馏水中洗涤载玻片5分钟,三次。
- 将载玻片在3%过氧化氢中孵育10分钟。
- 在蒸馏水中清洗载玻片5分钟两次。
- 在1x TBST中清洗载玻片5分钟。
- 从 1x TBST 中取出载玻片,然后使用实验室清洁湿巾的一角小心地擦干组织切片周围。
- 一旦载玻片干燥,用疏水屏障笔圈住组织切片。
- 将 100-400 μL 封闭溶液在疏水屏障笔圈内的每个部分上,在室温下放置 1 小时。使用在 1x TBST 中稀释的 10% 普通驴血清 (NDS) 或 0.75% 牛血清白蛋白 (BSA)。
- 接下来,取出封闭溶液,向每个切片添加 100-400 μL 一抗。使用相应制造商的稀释剂将该一抗稀释至所需浓度。
- 将切片在4°C孵育过夜。取出一抗溶液,在1x TBST中洗涤载玻片5分钟,三次。
- 向每个切片中加入 100-400 μL IHC 检测试剂,并在室温下孵育 1 小时。
- 用 1x TBST 清洗每个切片 5 分钟,两次,然后用 1x PBS 清洗 5 分钟一次。
- 根据制造商的说明制备3,3-二氨基联苯胺(DAB)溶液。向每个组织切片中加入 100-400 μL DAB 溶液,并在显微镜下密切监测。1-10分钟之间将提供可接受的染色强度;请务必注意这次,并保持一致的所有组织切片。
- 达到所需的染色强度后,将载玻片浸入蒸馏水中。
- 按照 表4中的说明进行苏木精复染和载玻片脱水以进行镶嵌。
- 从二甲苯替代品(材料表)上取下载玻片,并使用实验室清洁湿巾擦去组织切片周围的多余液体。使用少量永久性封片介质将盖玻片安装在组织切片上并使其干燥。
9. 总细胞活力的测量
- 将每个类器官转移到 2 mL 管中,并使用小移液器吸头小心地去除类器官周围的所有多余培养基(此过程的示意图见 图 3 )。
注意:细胞活力测定必须使用由相同数量的细胞制成的类器官进行。该实验不应在直接从手术患者标本、切割alredy形成的类器官或其他未过滤和计数单细胞的情况下制成的类器官上进行。 - 以 1:1 的比例制备发光细胞活力测定试剂和 1x PBS,并向每个试管中加入 500 μL。
- 使用 p1000 移液器吸头上下大力移液以分解类器官并静置 5 分钟。到现在为止,类器官应该有些解离和柔软;再次用P1000移液器吸头重复混合。
- 目标是在 96 孔板中每孔的总体积为 100 μL。加入步骤 9.3 中的 25 μL 混合物(足以进行多次技术重复),并加入 75 μL 剩余的发光细胞活力测定和 PBS 混合物。
- 将板放在摇床上2分钟,然后在室温下孵育20分钟。
- 使用酶标仪上的发光设置读取板并收集数据(见 图4)。
结果
图1 显示了在10倍放大镜下通过光学显微镜观察到的早期类器官生长。 图1A 显示了中央视图中通过lrECM的单个细胞的迁移和侵袭。细胞将继续扩张并"定植"lrECM,并且通过目视检查,它们将显得更致密并最终不透明。 图1B 显示了几个成熟的类器官(在7周时),相对于一角硬币的大小没有放大倍数。
图2 显示了GBM类器官的磷酸化组蛋白H3的免疫组化染色,磷酸化组蛋白H3是活性增殖的标志物。与类器官核心相比,大多数高度增殖的细胞出现在类器官周边。阳性染色将具有棕色/铜色外观。
图3 描述了使用3D特异性发光细胞活力测定法匀浆和测量GBM类器官中总细胞数的过程。由于GBM类器官中存在大量细胞,较大的类器官结构最初通过在发光测定试剂中研磨来均质化。然后将总类器官裂解物的馏分加载到单个孔中,并用额外的发光测定试剂稀释,然后在适当的多孔板读数器上孵育和读数。
图4 表示类器官的DMSO(普通载体)控制数据。绘制的数据显示了类器官内和类器官间的一致性。在生成实验数据时,发光活性数据通常会归一化为每个样品的对照。
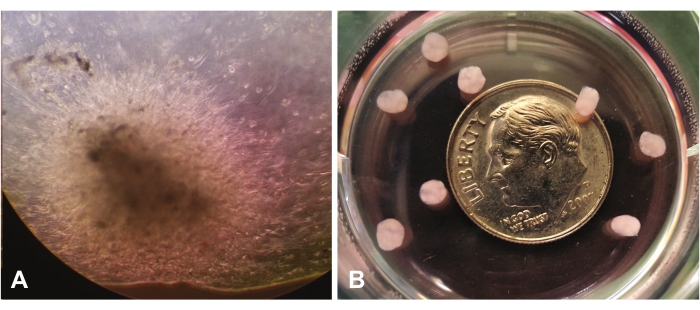
图 1:通过光学显微镜观察 (10x)。 (A)早期类器官生长表明GBM细胞在整个富含层粘连蛋白的细胞外基质中的迁移/侵袭。(B)相对于一角硬币大小的成熟类器官。请点击此处查看此图的大图。
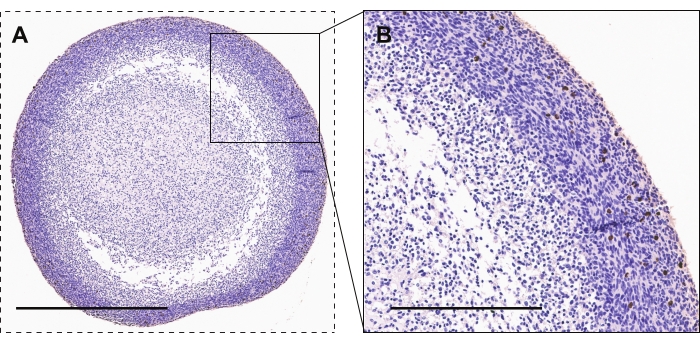
图2:GBM类器官的免疫组织化学 。 (A, B)GBM类器官显示磷酸组蛋白H3染色细胞用于活性增殖。A 和 B 的比例尺分别为 600 μm 和 300 μm。 请点击此处查看此图的大图。
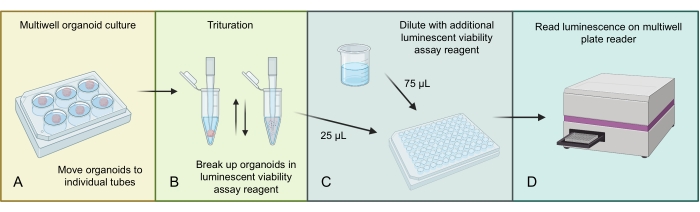
图3:类器官的发光细胞活力方案 。 (A)将单个类器官移动到小离心管中并去除多余的培养基。(B) 向每个试管中加入 500 μL 1:1 PBS 和发光细胞活力测定混合物,并积极移液以分解类器官。(C) 向 96 孔板的每个孔中加入 25 μL 该类器官混合物和 75 μL 相同的 1:1 PBS 和发光细胞活力测定混合物。(D)放在摇床上2分钟,然后在室温下孵育20分钟,然后在读板器上读取发光。使用 BioRender.com 制作的图。 请点击此处查看此图的大图。
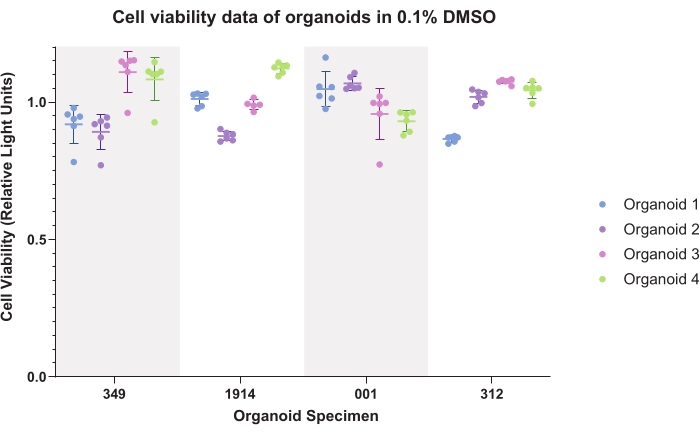
图4:细胞活力。 0.1%二甲基亚砜(DMSO)中类器官的细胞活力数据,用于四个患者标本的四个类器官的六个技术重复。 请点击此处查看此图的大图。
| 元件 | 数量 |
| 神经基础培养基减去酚红 | 500毫升 |
| B-27补充剂减去维生素A(50倍) | 10毫升 |
| 抗生素-抗真菌药(100x) | 5毫升 |
| 丙酮酸钠(100 mM) | 5毫升 |
| 0.85%氯化钠(200毫米)中的谷氨酰胺 | 5毫升 |
| 重组人 FGF 碱性 (250 μg/mL) | 20 微升 |
| 重组人 EFG 蛋白 (250 μg/mL) | 20 微升 |
| 酚红 | 500 微升 |
表1:神经基础培养基完全(NBMc)制剂
| 试剂 | 时间 |
| 50%乙醇 | 3 分钟 |
| 75%乙醇 | 3 分钟 |
| 95%乙醇 | 3 分钟 |
| 95%乙醇 | 4 分钟 |
| 100%乙醇 | 2 分钟 |
| 100%乙醇 | 3 分钟 |
| 100%乙醇 | 4 分钟 |
| 二甲苯替代品 | 2 分钟 |
| 二甲苯替代品 | 3 分钟 |
| 二甲苯替代品 | 4 分钟 |
| 石蜡 | 15 分 |
| 石蜡 | 15 分 |
表 2:小类器官(直径小于 3 mm)的加工计划
| 试剂 | 时间 |
| 50%乙醇 | 6 分钟 |
| 75%乙醇 | 6 分钟 |
| 95%乙醇 | 5 分钟 |
| 95%乙醇 | 8 分钟 |
| 100%乙醇 | 5 分钟 |
| 100%乙醇 | 5 分钟 |
| 100%乙醇 | 8 分钟 |
| 二甲苯替代品 | 5 分钟 |
| 二甲苯替代品 | 5 分钟 |
| 二甲苯替代品 | 8 分钟 |
| 石蜡 | 30 分 |
| 石蜡 | 30 分 |
表 3:大型类器官(直径超过 3 mm)的处理计划
| 试剂 | 时间 |
| 苏木精 | 2 分钟 |
| 运行diH 2O | 2 分钟 |
| 核苏木精澄清试剂 | 1 分钟 |
| 运行diH 2O | 1 分钟 |
| 发蓝试剂 | 1 分钟 |
| 运行diH 2O | 2 分钟 |
| 70%乙醇 | 1 分钟 |
| 100%乙醇 | 1 分钟 |
| 100%乙醇 | 1 分钟 |
| 二甲苯替代品 | 2 分钟 |
| 二甲苯替代品 | 2 分钟 |
表4:苏木精复染剂
讨论
GBM类器官是传统球体的互补培养方法,具有更大的细胞和微环境异质性4,22,30。虽然需要花费更多的时间和资源,但类器官培养可以为肿瘤内行为和耐药机制提供有价值的见解。
GBM由CSCs的5,31种群驱动,这些方法的开发是为了允许CSC种群的持续增长和自我更新。已知表皮生长因子(EGF)和成纤维细胞生长因子(FGF)可增强干细胞的维持和生长,并提供活性受体酪氨酸激酶(RTK)信号传导。GBM肿瘤内异质细胞群和不同肿瘤微环境的形成依赖于支持CSC行为。lrECM的选择模仿富含层粘连蛋白的大脑环境,并支持类器官培养中的细胞通过侵袭进行自我组织和迁移。尽管一些小组已经在不使用lrECM或EGF / FGF富集培养基24,28的情况下建立了类器官培养,这可能为这种培养方法提供了更省时的方式,并且更能选择致癌信号来驱动生长,但选择这些方法来优化前干细胞环境以最好地建立类器官的细胞异质性。脑类器官和GBM类器官在之前的文献中均已用lrECM制成21,32,33。尽管我们已经建立了有关类器官中发现的肿瘤群体和空间变异的数据,但对类器官中的非肿瘤群体以及它们从原始患者标本中存活多长时间知之甚少。某些IHC染色剂(如CD45)可能会提供这些数据,并且可能是未来类器官的一个有趣的研究点。
了解类器官培养的预期用途对于选择合适的方法非常重要。从原始标本建立类器官与为特定实验生长均匀类器官的程序略有不同。了解类器官如何成熟并在 lrECM 支架中视觉填充对于能够为类器官培养分配适当的时间和资源非常重要。类器官中细胞的稀疏区域将缓慢扩展和生长以填充lrECM,这可能需要2-8周的时间,具体取决于标本的行为。这种生长速度在某种程度上是每个标本固有的;它保存在不同批次的类器官中,并且与球体生长的相对速率相当一致。类器官可以维持1年以上,并在异种移植到小鼠中保持肿瘤形成能力;但是,建议以不同的目的种植它们,以免浪费实验室资源(材料和时间)4。类器官生长已在多种孔大小和形式中进行了测试,并表明 10 cm 板是保持最佳细胞活力的理想设置,其次是每孔34 个类器官的 6 孔板。与二维培养物相比,类器官消耗更多的培养基,并且使用较小的孔格式不会导致适当的维护。例如,相对于类器官的大小,96孔板的一个孔没有足够的空间或培养基体积来维持类器官生长。
正如类器官所确立的那样,观察力对于提高成功率很重要。最初,类器官会缓慢消耗培养基,但随着它们变得更密集和更成熟,它们会更快地消耗培养基。向培养基中添加酚红有助于作为培养基消耗的指标。当培养基更黄时,可能会提示我们调整进料模式,无论是更换更大体积的培养基,增加板中的总培养基量,在多个细胞培养板之间分配类器官以跟上其生长,甚至调整实验的时间线。
在许多方面,类器官是进行癌症研究的低效方式。它们涉及较长的时间尺度,与GBM球体培养相比,价格昂贵且资源密集。然而,与患者来源的异种移植物(一种重建细胞和微环境多样性的替代方法)相比,它们更直接、更便宜且可控。选择何时最好地使用类器官对癌症研究人员很重要。它们不是为了取代传统的领域或追随者文化,也不是为了取代异种移植模式。当类器官应用于正确的科学问题时,可以结合这两种系统的好处,并可能允许我们观察肿瘤细胞生物学,否则这些生物学将保持隐藏。科学界才刚刚开始了解类器官提供的学习机会,但很明显,它们将成为未来理解GBM复杂生物学的宝贵工具。
披露声明
作者没有需要披露的冲突。
致谢
我们要感谢Justin Lathia博士的宝贵建议和持续支持。我们还要感谢Katrina Fife,Lisa Wallace和Maya Camhi的出色技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
参考文献
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7(2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416(2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322(2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255(2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101(2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。