Method Article
3차원 오가노이드 배양을 사용한 생체 외 인간 교모세포종 세포 다양성 유지
요약
여기에서는 1차 환자 검체 또는 환자 유래 세포 배양에서 교모세포종(GBM) 오가노이드를 생성하고 성숙할 때까지 유지하는 방법을 설명합니다. 이러한 GBM 오가노이드는 표현형적으로 다양한 세포 집단을 포함하고 생체 외 종양 미세 환경을 재현합니다.
초록
교모세포종(GBM)은 가장 흔하게 발생하는 원발성 악성 뇌암으로 예후가 매우 좋지 않습니다. 종양 내 세포 및 분자 다양성뿐만 아니라 종양 미세 환경 간의 복잡한 상호 작용은 효과적인 치료법을 찾는 것을 어렵게 만들 수 있습니다. 전통적인 부착 또는 구 배양 방법은 이러한 복잡성을 가릴 수 있는 반면, 3차원 오가노이드 배양은 지역 미세 환경 구배를 요약할 수 있습니다. 오가노이드는 환자 종양 구조를 더 잘 모방하고 표현형적으로 다양한 세포 집단을 포함하며 중간 처리량 실험에 사용할 수 있는 3차원 GBM 배양 방법입니다. 3차원 오가노이드 배양은 기존 배양에 비해 더 힘들고 시간이 많이 걸리지만 고유한 이점을 제공하며 현재 체외 시스템과 생체 내 시스템 간의 격차를 해소하는 역할을 할 수 있습니다. 오가노이드는 종양 행동과 내성 메커니즘을 더 잘 이해하기 위해 암 생물학자들의 무기고에서 귀중한 도구로 자리 잡았으며 그 응용 분야는 계속 증가하고 있습니다. 여기에서는 GBM 오가노이드를 생성하고 유지하는 방법에 대한 세부 정보가 제공됩니다. 냉동 및 파라핀 임베딩 기술을 모두 사용하여 오가노이드 샘플 임베딩 및 절편을 수행하는 방법에 대한 지침, 오가노이드 절편에 대한 면역조직화학 및 면역형광 프로토콜에 대한 권장 사항, 총 오가노이드 세포 생존율 측정도 모두 설명되어 있습니다.
서문
교모세포종(GBM)은 진단15개월 후 약 15개월의 암울한 예후를 보이는 가장 흔하게 발생하는 원발성 뇌종양입니다. 전임상 연구에서 효과적인 치료법은 종종 환자 2,3에서 효과가 없을 수 있습니다. 열악한 임상 반응은 GBM의 미세 환경 적 이질성과 복잡한 종양 내 상호 작용을 포함한 많은 요인에 기인합니다. 이들은 전통적인 부착 또는 구체 배양 방법으로 실험실 환경에서 재현하기 어려울 수 있습니다4. GBM 내에자가 재생 암 줄기 세포 (CSC)의 하위 집합이 존재하는 것도 이러한 복잡성에 기여할 수 있습니다 5,6. CSC는 종양 전파에 중요하며 활성 혈관 신생, 암 침윤 및 방사선 7,8,9를 포함한 치료법에 대한 내성을 촉진하여 종양 성장을 유지합니다. CSC는 종양 전체에 균일하게 분포하지 않고 오히려 혈관 주위 틈새 및 회음부 영역을 포함한 특정 미세 환경 내에서 풍부하며, 이는 각각 세포 상태10,11,12,13,14의 뚜렷한 분자 조절을 제공합니다. CSC는 미세 환경 신호의 수동적 수신자가 아니라 대신 자신의 미세 환경을 리모델링 할 수있는 능력을 가지고 있습니다 7,15,16. CSC의 미세 환경은 영양 부족, pH 및 저산소증17,18,19,20과 같은 압력에 반응하여 줄기 세포 상태의 유지를 촉진 할 수 있으며, 이는 모델 시스템에서 이러한 조건의 중요성을 시사합니다. 따라서 종양 내의 다양한 세포 미세 환경의 요약은 치료 내성을 이해하고 새로운 치료법을 식별하는 데 중요합니다.
3 차원 문화는 최근 몇 년 동안 인기가 높아졌습니다21,22. 오가노이드는 다른 유형의 암에서 사용되어 왔으며, 세포를 오가노이드로 유지하는 주요 목표는 이질적인 세포 집단(그 중 다수는 일반적으로 보다 균질한 구 배양에서 경쟁할 수 있음)의 성장과 유전적 특이성을 가진 지역 종양 미세환경으로 간주되는 공간적 다양성을 허용하는 것입니다.4,23,24,25,26 . 암세포의 3 차원 배양을위한 많은 방법이 있으며, 각각 장점과 단점27,28,29가 있습니다. 오가노이드 배양은 전통적인 부착 또는 구 배양을 대체하기 위한 것이 아닙니다. 세포 미세 환경과 종양 세포 반응 사이의 상호 작용이 중요한 특정 질문이있을 때 2 차원 방법에 대한 보완 기술로 가장 잘 사용됩니다.
이 기사에서는 1차 환자 샘플 또는 환자 유래 배양에서 GBM 오가노이드를 생성하는 신뢰할 수 있고 반복 가능한 방법을 설명합니다. 우리는 3차원 오가노이드 배양을 위한 두 가지 다른 목표를 다룹니다: (1) 균일성에 관계없이 최대 생착 잠재력을 가진 1차 환자 조직에서 오가노이드를 확립하거나 (2) 보다 정량적인 실험 사용을 위해 균일한 오가노이드를 성장시킵니다. 1차 검체를 오가노이드로 설정할 때 초기 배양을 확립하기 위해 최대 세포 수와 유형을 유지하는 것이 우선이기 때문에 단일 세포를 필터링하거나 세포를 계수할 필요가 없습니다. 그러나 비교 실험을 위해 오가노이드를 성장시킬 때는 실험 일관성을 위해 복제 오가노이드를 비교할 수 있도록 단일 세포 여과 및 세포 계수가 필요합니다. 이 프로토콜은 오가노이드 배양을 확립하고 균일한 오가노이드를 만드는 방법뿐만 아니라 오가노이드를 매립 및 보존하기 위한 정제된 방법과 면역조직화학, 면역형광법 및 GBM 오가노이드의 총 세포 생존율 평가를 포함한 표준 세포 배양 실험을 자세히 설명합니다.
프로토콜
아래에 설명 된 프로토콜의 모든 단계는 클리블랜드 클리닉 기관 검토위원회 (IRB) 프로토콜 # 2559 및 기관 생물 안전위원회 (IBC) 승인 # 1711에 따라 개발 및 수행되었습니다. 구체 및 오가노이드는 "신경 기저 매체 완료"(NBMc)에서 배양됩니다. 지침은 표 1 을 참조하십시오.
1. 오가노이드 몰드 만들기
- 파라필름 시트(약 4cm x 4cm 크기)에서 왁스 종이를 꺼내 두 개의 멸균 96웰 중합효소연쇄반응(PCR) 플레이트 사이에 놓습니다.
- 배양 후드에서 이러한 단계를 수행하고 파라 필름의 "내부"(종이로 덮인면)를 깨끗하게 유지하도록 특별한주의를 기울이십시오. 이 깨끗한면은 들여 쓰기의 오목한 부분을 만들어야합니다.
- 상단 96웰 PCR 플레이트에 균일한 압력을 가하여 파라필름에 작은 딤플을 형성합니다. 목표는 파라필름에 구멍을 만들지 않고 딤플 깊이가 약 2mm가 되도록 하는 것입니다.
- 두 개의 96웰 PCR 플레이트를 부드럽게 분리합니다. 보조개 파라 필름이 상판에 달라 붙습니다. 이것을 드라이 아이스에 약 30 초 동안 두십시오.
- 파라필름을 드라이아이스에 30초 동안 방치한 후 멸균 집게를 사용하여 상단 96웰 PCR 플레이트에서 파라필름을 꺼냅니다.
- 파라필름을 제거할 때는 매우 "조심"하기보다는 빠른 동작을 사용하십시오. 얼어 붙은 파라 필름은 데워진 파라 필름보다 제거하기 쉽기 때문에 딤플이 뒤집힐 수 있습니다.
- 완성된 파라필름 몰드를 뚜껑이 덮인 멸균 10cm 세포 배양 접시에 넣습니다. 금형은 미리 만들어 멸균이 유지되면 보관할 수 있습니다.
2. 환자 조직 표본의 거대 해부
- 멸균 배양 접시(10cm 세포 배양 플레이트)에서 두 개의 멸균 면도날을 사용하여 균일한 압력을 가하면서 환자 검체를 미세하게 다집니다.
알림: 배양 접시에 약 500μL의 NBMc를 사용하여 검체를 분쇄하는 것이 가장 쉽습니다. 면도날로 가능한 한 미세하게 조각을 다지십시오. 이상적으로 개별 조각은 1mm3 이하입니다. - 잘게 다진 종양 조각을 절단된 p1000 피펫 팁을 사용하여 15mL 원심분리 튜브로 옮깁니다.
알림: 오가노이드를 취급할 때마다 절단 p1000 피펫 팁만 사용하는 것이 중요합니다. 날카로운 면도기를 사용하여 원하는 개구부 크기 (대략 5mm에서 8mm 사이)로 절단하고 오토 클레이브 할 수 있습니다. - 2mL의 실온(RT) 세포 분리 용액(재료 표)을 추가하고 37°C, 5%CO2 인큐베이터에 약 10분 동안 둡니다.
알림: 몇 분마다 관찰하고 혼합하십시오. 일부 세포 분리 용액 또는 표본은 다양한 배양 시간이 필요할 수 있습니다. 세포 용해로 인한 DNA 방출을 나타낼 수있는 덩어리가 나타나면 즉시 다음 단계로 진행하십시오. - 8mL의 NBMc 배지를 추가하여 세포 분리 용액을 중화하고 65 x g에서 3분 동안 회전합니다.
- 상청액을 흡인하고 1-2mL의 NBMc에 조직을 재현탁시킵니다.
3. 1차 환자 조직에서 오가노이드 생성
참고: 1차 환자 조직에서 오가노이드를 만들 때의 목표는 3차원 배양을 확립하는 것입니다. 단일 셀을 필터링하거나 셀을 계산하지 말고 육안 검사를 사용하여 초기 셀 부하를 가능한 한 균일하게 유지하십시오. 초기 유기체의 성장과 확립에 이질성을 갖는 것은 정상입니다. 각 오가노이드는 부피가 20μL(단계 2.5에서 16μL의 라미닌이 풍부한 세포외 기질(lrECM) 및 4μL의 NBMc에 현탁된 조직)일 것입니다. 지침은 의도 된 유기체의 수에 맞게 조정할 수 있습니다. 목표는 일반적으로 1차 환자 표본에서 약 20-30개의 오가노이드를 형성하는 것입니다.
- 얼음 양동이 또는 콜드 블록에 lrECM과 작은 원심 분리기 튜브를 놓습니다. 적절한 양의 lrECM(16μL x X 의도된 오가노이드 수)을 작은 원심분리 튜브에 넣습니다.
- 2.5단계의 적절한 부피의 조직 현탁액(4 μL x 의도된 오가노이드 수)을 얼음 위의 원심분리 튜브에 추가합니다.
- 20 μL의 lrECM/세포 현탁액 혼합물을 파라필름 몰드에 조심스럽게 피펫팅합니다. 이것은 진주 같은 물방울을 형성합니다.
- lrECM/세포 현탁액 혼합물을 완전히 혼합하십시오. 세포는 lrECM 내에 쉽게 정착하는 경향이 있어 이질적인 유기체를 생성합니다.
- lrECM/세포 현탁액 혼합물을 얼음 위에 보관하십시오. lrECM이 따뜻해지면 중합되어 오가노이드 형성이 손상될 수 있습니다. lrECM 중합을 방지하기 위해 2-3개의 오가노이드마다 피펫 팁을 식히십시오. 유기체에 기포를 주입하지 마십시오 (피펫을 "두 번 밀지 마십시오").
- 원하는 수의 오가노이드가 10cm 세포 배양 플레이트의 파라필름 몰드에 피펫팅되면 플레이트 뚜껑으로 덮고 37°C, 5%CO2 의 세포 배양 인큐베이터에서 1-2시간 동안 배양합니다.
- 오가노이드가 응고된 후 NBMc 배지를 사용하여 파라필름 몰드에서 부드럽게 플러시하고 총 10mL의 NBMc가 포함된 새로운 멸균 20cm 배양 플레이트에 넣습니다. p1000 팁을 사용하면 금형에서 유기체를 플러시하는 데 가장 효과적입니다. 그들은 부드럽게 미끄러질 것입니다.
참고: 오가노이드가 주형에서 세포 배양 플레이트로 플러시될 때 배지에서 작은 분홍색 구체로 보여야 합니다. 오가노이드가 배지에서 떨어져 나가거나 부서진 것처럼 보이는 경우, 이는 lrECM이 중합된 이전 문제를 나타내며, 오가노이드는 여전히 성장할 수 있지만 크기가 균일할 가능성은 거의 없습니다. - 10 cm 배양 접시를 37°C, 5%CO2 (흔들지 않음)의 세포 배양 인큐베이터에 4일 동안 둔다.
알림: 초기에 오가노이드를 궤도 셰이커에 놓으면 오가노이드가 떨어져 나갈 수 있습니다. 4 일까지 흔들리지 않도록하십시오. - 4일 후, 배지를 교환하고 37°C, 5%CO2의 세포 배양 배양기에서 80 RPM의 오비탈 쉐이커 상에 놓았다.
- 미성숙 오가노이드와 배지를 교환하는 것은 시각화하기 어렵기 때문에 어렵습니다. 세포 배양 접시를 기울이고 최소 20초 동안 기다립니다. 유기체는 바닥에 가라앉고 유리 또는 플라스틱 10-20mL 피펫으로 위의 배지를 천천히 제거할 수 있습니다.
- 바닥에있는 유기체 수집에주의를 기울이십시오. 미디어 제거의 힘으로 흔들리는 것처럼 보이면 일시 중지하고 다시 정착시키는 것이 가장 좋습니다. 오가노이드가 성숙하고 시각화하기 쉬워짐에 따라 이 과정은 덜 미묘해집니다.
참고: 때로는 세포 배양 플레이트 아래에 어두운 종이를 놓으면 미성숙 오가노이드를 시각화하는 데 도움이 될 수 있습니다. 이러한 방식으로 오가노이드가 빨려 들어가 손실되기 매우 쉽기 때문에 진공 흡입 기능이 있는 파스퇴르 피펫을 사용하여 배지를 제거하지 않는 것이 좋습니다. - 오가노이드가 처음 확립되면 성숙한 오가노이드만큼 빠르게 배지를 소비하지 않습니다. 50%의 미디어 교환으로 시작하면 불필요한 미디어 사용이 줄어들고 미디어 교환 과정에서 실수로 새로운 오가노이드가 손상되거나 흡인될 가능성이 줄어듭니다.
4. 확립된 GBM 구체, 부착성 또는 오가노이드 배양물로부터 오가노이드 생성
참고: 여기서 목표는 비교 실험에 사용하기 위해 크기와 세포 양이 균일한 오가노이드를 만드는 것이므로 단일 셀 필터를 사용하고 세포를 계수하여 이를 확인하십시오.
- GBM 구체 배양으로부터 단세포 현탁액을 제조하는 단계.
참고: GBM 세포의 구 배양은 NBMc 배지에서 유지됩니다.- 구를 15mL 원심분리 튜브에 넣고 120 x g 에서 5분 동안 회전합니다.
- 상청액을 제거하고 2mL의 RT 세포 분리 용액을 추가합니다. 37 ° C 인큐베이터에 3 분 동안 두십시오.
- 8mL의 NBMc 배지를 추가하여 세포 분리 용액을 중화합니다. 단일 세포 스트레이너(70μm)를 통해 변형시키고 120 x g에서 5분 동안 회전시킵니다.
- 튜브에서 상청액을 제거하고 나머지 세포를 ~1mL의 NBMc에 재현탁합니다. 세포를 세고(세포 불투과성 염색 사용) 4.4단계로 건너뜁니다.
- GBM 부착 배양물로부터 단일 세포 현탁액을 제조하는 단계.
- 플레이트에서 사용한 배지를 제거하고 플레이트에 RT 세포 분리 용액 2mL를 추가하고 37°C 인큐베이터에 3분 동안 넣습니다.
- 현미경으로 세포가 플레이트에서 분리되었는지 확인하십시오.
- 8mL의 NBMc 배지를 추가하여 세포 분리 용액을 중화합니다. 단일 세포 스트레이너 (70 μm)를 통해 변형시킵니다.
참고: 단일 세포 변형은 부착 배양으로 작업할 때 선택 사항입니다. - 120 x g에서 5분 동안 돌립니다. 튜브에서 상청액을 제거하고 나머지 세포를 ~1mL의 NBMc에 재현탁합니다. 세포를 세고(세포 불투과성 염색 사용) 4.4단계로 건너뜁니다.
- GBM 오가노이드 배양으로부터 단일 세포 현탁액을 제조하는 단계.
- 절단된 p1000 피펫 팁을 사용하여 오가노이드를 10cm 배양 플레이트로 옮기고 가능한 한 많은 잔류 배지를 조심스럽게 제거합니다.
- 두 개의 멸균 면도기를 사용하여 오가노이드를 조심스럽게 잘게 다립니다. 절단된 p1000 팁을 사용하여 다진 오가노이드를 15mL 원심분리 튜브로 옮기고 ~2-3mL의 NBMc 배지를 추가합니다.
- 120 x g 에서 3분 동안 회전하고 상층액을 제거합니다(이 부분에는 진공 흡입 대신 피펫 팁 사용 권장).
- 2mL의 콜드 셀 분리 용액을 10분 동안 추가합니다.
알림: 셀 분리 용액은 먼저 데우지 말고 4°C에서 직접 사용해야 합니다. 이것은 남아있는 매트리 겔을 부드럽게하고 세포 회복을 돕는 것으로 보입니다. - 그런 다음 37 ° C 인큐베이터로 10-20 분 동안 이동하여 몇 분마다 관찰하고 혼합합니다. 세포 용해를 나타낼 수있는 덩어리가 나타나면 즉시 다음 단계로 진행하십시오.
- 8mL의 NBMc 배지를 추가하여 세포 분리 용액을 희석합니다. 단일 셀 스트레이너(70μm)를 통해 변형시키고 120 x g에서 5분 동안 회전시킵니다.
- 튜브에서 상청액을 제거하고 나머지 세포를 ~1mL의 NBMc에 재현탁합니다. 세포를 계수하고(세포 불투과성 염색 사용) 4.4단계로 진행합니다.
- 단일 세포 현탁액에서 유기체 만들기
- 얼음 양동이 또는 콜드 블록에 lrECM과 작은 원심 분리기 튜브를 놓습니다. 적절한 양의 lrECM(16μL x X 의도된 오가노이드 수)을 작은 원심분리 튜브에 넣습니다.
- 20,000개의 세포/오가노이드를 포함하는 총 부피(4μL x X 의도된 오가노이드 수)의 세포 혼합물을 만들고 이를 얼음 위의 lrECM이 있는 작은 원심분리 튜브에 추가합니다.
- 20 μL의 lrECM/세포 현탁액 혼합물을 파라필름 몰드에 조심스럽게 피펫팅합니다. 이것은 진주 같은 물방울을 형성합니다.
- 세포가 lrECM 내에서 쉽게 침전되는 경향이 있으므로 lrECM/세포 현탁액 혼합물을 완전히 혼합해야 하며, 이로 인해 이질적인 유기체가 생성됩니다.
- lrECM/세포 현탁액 혼합물을 얼음 위에 보관하십시오. lrECM이 따뜻해지면 중합되어 오가노이드 형성이 손상될 수 있습니다.
- lrECM 중합을 방지하기 위해 2-3개의 오가노이드마다 피펫 팁을 식히십시오. 오가노이드에 기포를 주입하지 마십시오(피펫 팁을 "두 번 밀지" 마십시오).
- 원하는 수의 오가노이드가 10cm 배양 플레이트의 파라필름 몰드에 피펫팅되면 세포 배양 인큐베이터에서 37°C에서 1-2시간 동안 배양합니다.
- 오가노이드가 응고된 후 NBMc 배지를 사용하여 파라필름 몰드에서 부드럽게 씻어내고 총 20mL의 NBMc가 포함된 새로운 멸균 10cm 배양 플레이트에 넣습니다. p1000 팁을 사용하면 금형에서 오가노이드를 플러시하는 데 가장 효과적입니다. 그들은 부드럽게 미끄러질 것입니다.
알림: 10cm 배양 접시당 약 15-20개의 유기체를 권장합니다. - 10cm 배양 접시를 인큐베이터 (흔들지 않고)에 4 일 동안 두십시오.
- 4일 후, 배지를 교환하고 세포 배양 인큐베이터에서 80RPM의 오비탈 쉐이커에 놓습니다. 그 후 2-3일마다 미디어를 교환하십시오.
- 미성숙 오가노이드와 배지를 교환하는 것은 시각화하기 어렵기 때문에 어렵습니다. 세포 배양 접시를 기울이고 최소 20초 동안 기다립니다. 유기체는 바닥에 정착하고 큰 개구부 유리 피펫으로 위의 매체를 천천히 제거 할 수 있습니다.
- 바닥에있는 유기체 수집에주의를 기울이십시오. 미디어 제거의 힘으로 흔들리는 것처럼 보이면 일시 중지하고 다시 정착하도록 허용하십시오. 오가노이드가 성숙하고 시각화하기 쉬워짐에 따라 이 과정은 덜 미묘해집니다.
참고: 때로는 세포 배양 플레이트 아래에 어두운 종이를 놓으면 미성숙 오가노이드를 시각화하는 데 도움이 될 수 있습니다. 진공 흡입 기능이 있는 파스퇴르 피펫을 사용하여 매체를 제거하면 오가노이드가 빨려 들어가 손실되기 매우 쉽습니다. - 오가노이드가 처음 확립되면 성숙한 오가노이드만큼 빠르게 배지를 소비하지 않습니다. 50% 미디어 교환으로 시작하여 불필요한 미디어 사용을 줄이고 미디어 교환 과정에서 실수로 새로운 오가노이드를 손상시키거나 흡인할 가능성을 줄입니다.
5. 냉동 임베딩
- 각 오가노이드를 1.5% 파라포름알데히드(PFA) 1mL가 들어 있는 개별 1000mL 튜브(절단 p1000 팁 사용)에 넣습니다. 오가노이드는 4°C에서 밤새 보관합니다. 파라핀에 오가노이드를 내장하는 경우 섹션 6으로 진행하십시오.
- 4% PFA에서 밤새 고정한 후, 오가노이드를 1x 인산 완충 식염수(PBS)로 3회 세척한다.
- 오가노이드를 물에 30% 자당 1mL가 들어 있는 새 1.5mL 튜브(절단된 p1000 피펫 팁 사용)로 옮기고 4°C에서 밤새 보관합니다.
- 소량(일반적으로 1-2mL)의 최적 절단 온도 화합물(OCT)을 냉동 몰드에 추가하여 바닥을 덮고 금형 깊이의 약 1/3 - 1/2을 채웁니다.
- 절단된 p1000 피펫 팁을 사용하여 단일 오가노이드를 저온으로 옮깁니다. 이로 인해 일부 미디어가 유기체와 함께 전달되며 이는 불가피합니다. 더 작은 피펫 팁을 사용하여 오가노이드를 방해하지 않고 주변 매체를 조심스럽게 제거합니다.
참고: 이것은 시각화하기 어려울 수 있지만 느린 피펫팅은 미디어와 OCT 간의 밀도에서 명확한 차이를 보여주므로 어느 정도 "느낌으로" 수행됩니다. - 드라이 아이스 트레이에 냉동 식품을 놓습니다. OCT는 동결되기 시작하여 그 과정에서 불투명해집니다.
- OCT를 추가하여 오가노이드를 완전히 덮고 저온 성형의 나머지 부피를 채 웁니다. 블록은 며칠 동안 단기 보관의 경우 -20 ° C에서 또는 장기 보관의 경우 -80 ° C에서 무기한 저장할 수 있습니다.
6. 파라핀 임베딩
- 크기별로 오가노이드를 정렬합니다(작은 오가노이드는 3mm 미만, 큰 오가노이드는 3mm 이상). 절단된 p1000 피펫 팁을 사용하여 각 오가노이드를 조직학 카세트로 옮기고 표 2 또는 표 3에 따라 파라핀 왁스로 처리합니다.
알림: 조직학 카세트의 크기/구성은 사용자에게 달려 있습니다. - 카세트에서 1-2mL의 녹은 파라핀 왁스로 매립 몰드로 오가노이드를 옮기고 왁스가 반고체가 될 때까지 식힙니다.
- 왁스가 부분적으로 응고되면 금형 상단에 왁스를 더 추가합니다. 라벨이 붙은 카세트 상단을 금형 위에 놓고 냉각판으로 옮깁니다. 왁스가 완전히 고체가 될 때까지 계속 냉각하십시오.
- 왁스가 고형화되면 마이크로톰을 사용하여 블록을 절단합니다. 또는 나중에 절단하기 위해 RT 또는 4 ° C에서 보관하십시오.
7. 면역 형광법 (IF)
- 다음 단계에 따라 슬라이드 염색 접시를 사용하여 5-12 μm 파라핀 포매 조직 절편을 탈파라핀화 및 재수화한다.
참고: OCT 내장 오가노이드의 섹션을 사용하는 경우 12μm 섹션을 사용하는 것이 좋습니다. PBS에서 슬라이드를 30분 동안 흔들어 OCT를 제거합니다. 7.2단계로 건너뜁니다.- 크실렌에서 5 분 동안 배양하십시오. 이것을 두 번 더 반복하십시오. 그런 다음 100 % 에탄올에서 10 분 동안 배양하십시오. 이것을 한 번 더 반복하십시오.
- 95 % 에탄올에서 10 분 동안 배양하십시오. 한 번 더 반복하십시오. 증류수로 섹션을 5 분 동안 두 번 씻으십시오.
- 항원 마스킹 해제의 경우 슬라이드를 1x 구연산염 마스킹 해제 용액(재료 표)에 담그고 비등 온도에서 전자레인지에 10분 동안 돌립니다. 용액이 끓지 않도록하십시오.
알림: 이것은 끓을 때까지 처음에 ~2분 동안 전자레인지에 돌린 다음 전력을 낮추고 용액이 끓지 않도록 관찰하는 것이 가장 좋습니다. 바람직한 마스킹 해제 온도는 100°C 바로 아래, 이상적으로는 98°C입니다. - 30x 구연산염 마스킹 해제 용액의 RT에서 슬라이드를 1분 동안 식힙니다.
참고: 이것은 동일한 1x 구연산염 용액입니다. 이 단계에서 솔루션을 교체할 필요는 없습니다. - 슬라이드를 증류수로 5분 동안 두 번 씻습니다.
- 슬라이드를 1x TBST(0.1% 트윈 20이 있는 트리스 완충 식염수) 완충액에서 5분 동안 세척합니다.
- TBST에서 슬라이드를 제거하고 티슈 섹션이 마르지 않도록 주의하면서 실험실 청소 물티슈를 사용하여 티슈 섹션 주위를 조심스럽게 건조시킵니다. 슬라이드가 충분히 건조되면 소수성 배리어 펜으로 조직 절편을 돌립니다.
- RT에서 1 시간 동안 10 % 혈청 차단 용액 100-400 μL로 각 섹션을 차단하십시오. 2 차 항체를 기반으로 혈청 차단 용액을 선택하십시오. 예를 들어, 당나귀로 만든 2 차 항체를 사용하는 경우 1x TBST에서 10 % 일반 당나귀 혈청을 사용하십시오.
- 블로킹 용액을 제거한 후 블로킹 용액에 원하는 농도로 희석한 1차 항체 100-400 μL를 첨가한다.
- 4°C에서, 절편을 1차 항체와 함께 밤새 인큐베이션한다.
- 1차 항체 용액을 제거하고 슬라이드를 1x TBST에서 5분 동안 3회 세척합니다.
- 각 섹션에 100-400μL의 2차 항체(블로킹 용액에서 1:1000 희석 또는 제조업체의 지시에 따라)를 추가하고 RT에서 1.5시간 동안 배양합니다.
- 슬라이드를 1x TBST에서 5분 동안 2회 세척합니다. 그런 다음 슬라이드를 1x PBS로 5분 동안 세척합니다.
- PBS에서 슬라이드를 제거하고 실험실 청소 물티슈를 사용하여 조직 섹션 주위를 건조시킵니다. 액체 경화 마운팅제 몇 방울을 추가하고 유리 커버슬립을 조심스럽게 장착합니다. 슬라이드가 건조되면 이미징 준비가 될 때까지 빛으로부터 보호되는 -20°C에서 보관하십시오.
8. 면역조직화학
- 탈파라핀화 및 슬라이드 염색 접시를 사용하여 파라핀 포매된 조직 절편을 다음 단계에 따라 재수화한다.
참고: OCT 내장 오가노이드의 섹션을 사용하는 경우 PBS에서 슬라이드를 30분 동안 흔들어 OCT를 제거합니다. 8.2단계로 건너뜁니다.- 크실렌에서 5 분 동안 배양하십시오. 두 번 더 반복하십시오.
- 100 % 에탄올에서 10 분 동안 배양하십시오. 한 번 더 반복하십시오.
- 95 % 에탄올에서 10 분 동안 배양하십시오. 한 번 더 반복하십시오.
- 증류수로 섹션을 5 분 동안 두 번 씻으십시오.
- 항원 마스킹 해제의 경우 슬라이드를 1x 구연산염 마스킹 해제 용액에 담그고 비등 온도에서 10분 동안 전자레인지에 돌립니다. 용액이 끓지 않도록하십시오.
- 30x 구연산염 마스킹 해제 용액의 RT에서 슬라이드를 1분 동안 식힙니다.
- 슬라이드를 증류수로 5분 동안 세 번 씻습니다.
- 슬라이드를 3% 과산화수소에서 10분 동안 배양합니다.
- 증류수에서 슬라이드를 5 분 동안 두 번 씻으십시오.
- 슬라이드를 5x TBST로 1분 동안 세척합니다.
- 1x TBST에서 슬라이드를 제거한 다음 실험실 청소용 물티슈의 모서리를 사용하여 조직 섹션 주변을 조심스럽게 건조시킵니다.
- 슬라이드가 마르면 소수성 배리어 펜으로 조직 섹션을 돌립니다.
- 100-400 μL의 블로킹 용액을 RT에서 소수성 배리어 펜 서클 내의 각 섹션에 1 시간 동안 놓습니다. 1x TBST에 희석한 10% 일반 당나귀 혈청(NDS) 또는 0.75% 소 혈청 알부민(BSA)을 사용하십시오.
- 다음으로, 블로킹 용액을 제거하고 각 섹션에 100-400 μL의 1차 항체를 첨가한다. 적절한 제조업체의 희석제를 사용하여 이 1차 항체를 원하는 농도로 희석합니다.
- 절편을 4°C에서 밤새 배양한다. 1차 항체 용액을 제거하고 슬라이드를 1x TBST에서 5분 동안 3회 세척합니다.
- 각 섹션에 100-400 μL의 IHC 검출 시약을 추가하고 RT에서 1시간 동안 배양합니다. 1차 항체에 따라 IHC 검출 시약을 선택합니다.
- 각 섹션을 1x TBST로 5분 동안 2회 세척한 다음 1x PBS를 5분 동안 한 번 세척합니다.
- 제조업체의 지시에 따라 3,3-디아미노벤지딘(DAB) 용액을 준비합니다. 각 조직 섹션에 100-400 μL의 DAB 용액을 추가하고 현미경으로 면밀히 모니터링합니다. 1-10 분 사이에 허용 가능한 염색 강도를 제공합니다. 이 시간을 기록하고 모든 조직 절편에 대해 일관성을 유지하십시오.
- 원하는 염색 강도에 도달하면 슬라이드를 증류수에 담그십시오.
- 표 4의 지침에 따라 장착을 위해 헤마톡실린 카운터 얼룩 및 슬라이드 탈수를 수행합니다.
- 크실렌 대체물(재료 표)에서 슬라이드를 제거하고 실험실 청소 물티슈를 사용하여 조직 섹션 주변의 여분의 액체를 닦아냅니다. 소량의 영구 장착 매체를 사용하여 커버슬립을 조직 섹션 위에 장착하고 건조시킵니다.
9. 총 세포 생존율 측정
- 각 오가노이드를 2mL 튜브로 옮기고 작은 피펫 팁을 사용하여 오가노이드 주변의 모든 과잉 배지를 조심스럽게 제거합니다(이 절차의 개략도는 그림 3 참조).
참고: 세포 생존율 분석은 동일한 수의 세포로 만들어진 오가노이드로 수행해야 합니다. 이 실험은 수술로 인한 환자 표본에서 직접 만든 오가노이드, 절단된 알레디 형성 오가노이드 또는 단일 세포를 여과하고 계수하지 않은 기타 경우에 대해 수행해서는 안 됩니다. - 발광 세포 생존율 분석 시약과 1x PBS를 1:1 비율로 준비하고 각 튜브에 500μL를 추가합니다.
- p1000 피펫 팁을 사용하여 위아래로 공격적으로 피펫팅하여 오가노이드를 분해하고 5분 동안 그대로 두십시오. 유기체는 지금쯤이면 다소 해리되고 부드러워야 합니다. P1000 피펫 팁으로 다시 혼합을 반복합니다.
- 목표는 96웰 플레이트의 웰당 총 부피가 100μL인 것입니다. 단계 9.3으로부터의 혼합물 25 μL를 추가하고(다수의 기술적 복제에 충분할 것이다), 75 μL의 나머지 발광 세포 생존율 분석 및 PBS 혼합물을 첨가한다.
- 플레이트를 셰이커에 2분 동안 놓은 다음 RT에서 20분 동안 배양합니다.
- 플레이트 리더의 발광 설정을 사용하여 플레이트를 읽고 데이터를 수집합니다( 그림 4 참조).
결과
그림 1 은 10x 배율에서 광학 현미경을 통해 관찰된 초기 오가노이드 성장을 보여줍니다. 그림 1A 는 중앙도에서 lrECM을 통한 단일 세포의 이동 및 침입을 보여줍니다. 세포는 계속해서 확장되어 lrECM을 '식민지화'할 것이며, 육안 검사에 의해 더 조밀하고 결국 불투명하게 보일 것입니다. 그림 1B 는 동전의 크기에 비해 배율 없이 여러 성숙한 유기체(7주)를 보여줍니다.
도 2 는 활성 증식의 마커인 포스포히스톤 H3에 대한 GBM 오가노이드의 면역조직화학적 염색을 입증한다. 대부분의 고도로 증식된 세포는 오가노이드 코어에 비해 오가노이드 주변에서 볼 수 있습니다. 양성 염색은 갈색/구리 모양을 갖습니다.
그림 3 은 3D 특이적 발광 세포 생존율 분석을 사용하여 GBM 오가노이드에서 총 세포 수를 균질화하고 측정하는 과정을 설명합니다. GBM 오가노이드에 존재하는 많은 수의 세포로 인해, 더 큰 오가노이드 구조는 발광 분석 시약에서 분쇄함으로써 초기에 균질화된다. 그런 다음 총 유기형 용해물의 분획을 개별 웰에 로딩하고 적절한 멀티웰 플레이트 판독기에서 배양 및 판독하기 전에 추가 발광 분석 시약으로 희석합니다.
그림 4 는 오가노이드에 대한 DMSO(일반 비히클) 제어 데이터를 나타냅니다. 플로팅된 데이터는 오가노이드 내 및 오가노이드 간 일관성을 보여줍니다. 발광 생존율 데이터는 일반적으로 실험 데이터를 생성할 때 각 시편에 대한 대조군으로 정규화됩니다.
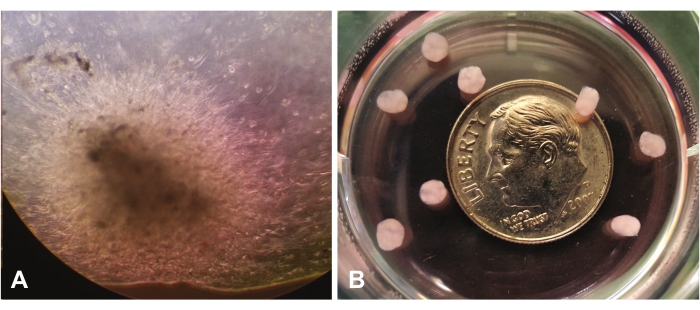
그림 1: 광학 현미경으로 보기(×10). (A) 라미닌이 풍부한 세포외 기질 전반에 걸쳐 GBM 세포의 이동/침입을 보여주는 초기 오가노이드 성장. (B) 동전의 크기에 비해 성숙한 유기체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
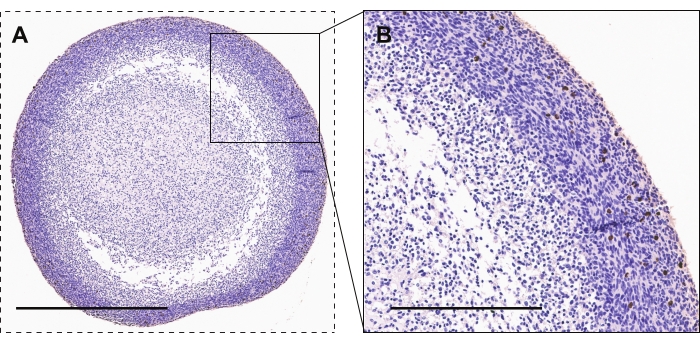
그림 2: GBM 오가노이드의 면역조직화학. (A, B) 활성 증식에 대한 포스포-히스톤 H3 염색 세포를 보여주는 GBM 오가노이드. 스케일바는 A와 B에 대해 각각 600μm와 300μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
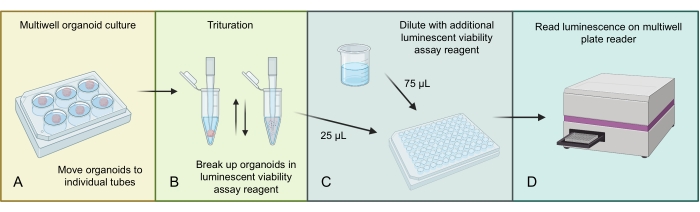
그림 3: 오가노이드에 대한 발광 세포 생존율 프로토콜. (A) 개별 오가노이드를 작은 원심분리기 튜브로 옮기고 과도한 배지를 제거합니다. (B) 500μL의 1:1 PBS와 발광 세포 생존율 분석 혼합물을 각 튜브와 피펫에 적극적으로 추가하여 오가노이드를 분해합니다. (C) 이 오가노이드 혼합물 25μL와 동일한 1:1 PBS 및 발광 세포 생존율 분석 혼합물 75μL를 96웰 플레이트의 각 웰에 추가합니다. (D) 쉐이커에 2 분 동안 놓은 다음 RT에서 20 분 동안 인큐베이션한 다음 플레이트 리더에서 발광을 읽습니다. BioRender.com 사용하여 만든 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
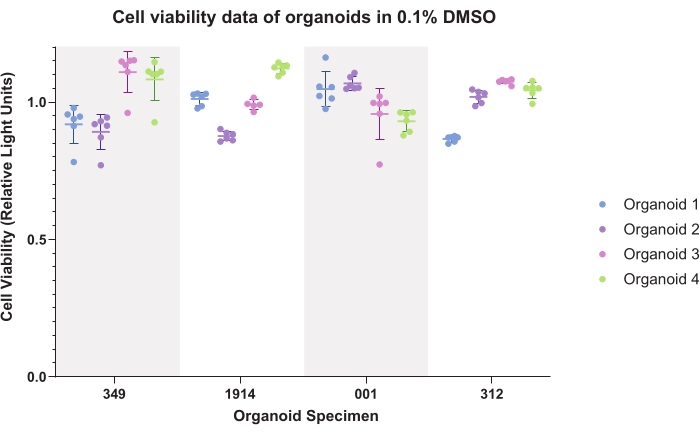
그림 4: 세포 생존율. 4명의 환자 표본에 대한 4개의 오가노이드의 6가지 기술 복제에 대한 0.1% 디메틸설폭사이드(DMSO)의 오가노이드에 대한 세포 생존율 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 구성 요소 | 양 |
| 신경 기저 배지에서 페놀 레드를 뺀 값 | 500 밀리리터 |
| 비타민 A를 뺀 B-27 보충제(×50) | 10 밀리리터 |
| 항균제(×100) | 5 밀리리터 |
| 나트륨 피루 베이트 (100 mM) | 5 밀리리터 |
| 0.85 % NaCl (200 mM) 중 글루타민 | 5 밀리리터 |
| 재조합 인간 FGF 염기성 (250 μg / mL) | 20 μL |
| 재조합 인간 EFG 단백질 (250 μg / mL) | 20 μL |
| 페놀 레드 | 500 μL |
표 1: 신경기저 배지 완성(NBMc) 제형
| 시약 | 시간 |
| 50% 에탄올 | 3 민 |
| 75% 에탄올 | 3 민 |
| 95% 에탄올 | 3 민 |
| 95% 에탄올 | 4 분 |
| 100% 에탄올 | 2 분 |
| 100% 에탄올 | 3 민 |
| 100% 에탄올 | 4 분 |
| 크실렌 대체물 | 2 분 |
| 크실렌 대체물 | 3 민 |
| 크실렌 대체물 | 4 분 |
| 석랍 | 15 분 |
| 석랍 | 15 분 |
표 2: 소형 오가노이드(직경 3mm 미만)의 처리 일정
| 시약 | 시간 |
| 50% 에탄올 | 6 분 |
| 75% 에탄올 | 6 분 |
| 95% 에탄올 | 5 분 |
| 95% 에탄올 | 8 분 |
| 100% 에탄올 | 5 분 |
| 100% 에탄올 | 5 분 |
| 100% 에탄올 | 8 분 |
| 크실렌 대체물 | 5 분 |
| 크실렌 대체물 | 5 분 |
| 크실렌 대체물 | 8 분 |
| 석랍 | 30 분 |
| 석랍 | 30 분 |
표 3: 대형 오가노이드(직경 3mm 이상)의 처리 일정
| 시약 | 시간 |
| 헤마톡실린 | 2 분 |
| 실행 중 diH2O | 2 분 |
| 핵 헤 마톡 실린 정화 시약 | 1 분 |
| 실행 중 diH2O | 1 분 |
| 블루잉 시약 | 1 분 |
| 실행 중 diH2O | 2 분 |
| 70 % 에탄올 | 1 분 |
| 100% 에탄올 | 1 분 |
| 100% 에탄올 | 1 분 |
| 크실렌 대체물 | 2 분 |
| 크실렌 대체물 | 2 분 |
표 4: 헤마톡실린 카운터스테인
토론
GBM 오가노이드는 더 큰 세포 및 미세 환경 이질성 4,22,30을 포함하는 전통적인 영역에 대한 보완적인 배양 방법입니다. 더 많은 시간과 자원 집약적이지만 오가노이드 배양은 종양 내 행동 및 약물 내성 메커니즘에 대한 귀중한 통찰력을 제공할 수 있습니다.
GBM은 CSC 5,31의 인구에 의해 구동되며, 이러한 방법은이 CSC 인구의 지속적인 성장과 자체 갱신을 허용하기 위해 개발되었습니다. 표피 성장 인자 (EGF) 및 섬유 아세포 성장 인자 (FGF)는 줄기 세포 유지 및 성장을 향상시키고 활성 수용체 티로신 키나제 (RTK) 신호를 제공하는 것으로 알려져 있습니다. GBM 종양 내에서 이질적인 세포 집단과 뚜렷한 종양 미세 환경의 형성은 CSC 행동을 지원하는 데 의존합니다. lrECM의 선택은 라미닌이 풍부한 뇌 환경을 모방하고 오가노이드 배양의 세포가 침입에 의해 자가 조직화되고 이동하도록 지원합니다. 일부 그룹은 lrECM 또는 EGF/FGF 농축 배지24,28을 사용하지 않고 오가노이드 배양을 확립했으며, 이는 이 배양 방법의 보다 시간 효율적인 방식과 성장을 촉진하기 위한 발암성 신호전달의 더 강력한 선택을 제공할 수 있지만, 이러한 방법은 오가노이드의 세포 이질성을 가장 잘 확립하기 위해 전줄기세포 환경을 최적화하기 위해 선택되었습니다. 대뇌 오가노이드와 GBM 오가노이드 모두 이전 문헌 21,32,33에서 lrECM으로 만들어졌습니다. 오가노이드 내에서 발견되는 종양 집단과 공간적 변화에 관한 데이터를 확립했지만, 오가노이드 내의 비종양 집단과 원래 환자 표본에서 생존하는 기간에 대해서는 알려진 바가 거의 없습니다. 특정 IHC 염색(예: CD45)은 이러한 데이터를 제공할 수 있으며 향후 오가노이드에 대한 흥미로운 연구 포인트가 될 수 있습니다.
오가노이드 배양의 용도를 아는 것은 적절한 방법을 선택하는 데 중요합니다. 1차 표본에서 오가노이드를 확립하는 것과 특정 실험을 위해 균일한 오가노이드를 성장시키는 것은 약간 다른 절차를 거칩니다. 오가노이드가 어떻게 성숙하고 lrECM 스캐폴드를 시각적으로 채우는지에 대한 이해는 오가노이드 배양에 적절한 시간과 자원을 할당할 수 있는 데 중요합니다. 오가노이드에 있는 세포의 희소 영역은 천천히 확장되고 성장하여 lrECM을 채우며, 이는 표본의 행동에 따라 2-8주가 소요될 수 있습니다. 이 성장률은 각 표본에 다소 내재되어 있습니다. 그것은 유기체의 다른 배치에 걸쳐 보존되며 구체 성장의 상대적 속도와 상당히 일치합니다. 오가노이드는 1년 이상 유지될 수 있으며 마우스로의 이종이식에서 종양 형성 능력을 유지합니다. 그러나 실험실 자원(재료 및 시간 모두)을 낭비하지 않도록 뚜렷한 목적으로 재배하는 것이 좋습니다4. 오가노이드 성장은 여러 웰 크기 및 형식으로 테스트되었으며, 10cm 플레이트가 최적의 세포 생존율을 유지하기 위한 이상적인 설정이며, 그 다음에 웰당 3개의 오가노이드가 있는 6웰 플레이트가 뒤따른다는 것을 보여줍니다(34). 오가노이드는 2차원 배양 제품에 비해 더 많은 배지를 소비하며 더 작은 웰 형식을 사용하면 적절한 유지 관리가 이루어지지 않습니다. 예를 들어, 96웰 포맷 플레이트의 한 웰은 오가노이드 성장을 지속하기에 오가노이드의 크기에 비해 충분한 공간이나 배지 부피를 갖지 않습니다.
유기체가 확립함에 따라 관찰력은 성공을 높이는 데 중요합니다. 처음에 오가노이드는 미디어를 천천히 소비하지만 밀도가 높아지고 성숙해짐에 따라 미디어를 더 빨리 소비합니다. 미디어에 페놀 레드를 추가하면 미디어 소비의 지표 역할을 할 수 있습니다. 배지가 더 노란색이면 더 많은 양의 배지를 교환하거나, 플레이트의 총 배지 양을 늘리거나, 성장을 따라잡기 위해 여러 세포 배양 플레이트에 오가노이드를 나누거나, 실험 일정을 조정하는 등 공급 패턴을 조정하라는 메시지가 표시될 수 있습니다.
여러 면에서 오가노이드는 암 연구를 수행하는 비효율적인 방법입니다. 그들은 오랜 시간 척도를 포함하며 GBM 구 문화에 비해 비싸고 자원이 많이 듭니다. 그러나 세포 및 미세 환경 다양성을 재현하기위한 대체 방법 인 환자 유래 이종 이식편과 비교할 때 더 간단하고 저렴하며 제어 할 수 있습니다. 오가노이드를 가장 잘 사용할 때를 선택하는 것은 암 연구자에게 중요합니다. 그들은 전통적인 구체 또는 부착 문화를 대체하기위한 것이 아니며 이종 이식 모델을 대체하기위한 것이 아닙니다. 오가노이드는 올바른 과학적 질문에 적용될 때 이 두 시스템의 이점을 결합할 수 있으며 그렇지 않으면 숨겨져 있을 종양 세포 생물학을 관찰할 수 있습니다. 과학계는 오가노이드가 제공하는 학습 기회를 이해하기 시작했을 뿐이지만, GBM의 복잡한 생물학을 이해하는 데 미래에 귀중한 도구가 될 것임은 분명합니다.
공개
저자는 공개 할 충돌이 없습니다.
감사의 말
귀중한 조언과 지속적인 지원에 대해 Justin Lathia 박사에게 감사드립니다. 또한 카트리나 파이프, 리사 월리스, 마야 카미의 탁월한 기술 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
참고문헌
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7 (2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416 (2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322 (2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255 (2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101 (2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유