Method Article
Mantenimento della diversità cellulare del glioblastoma umano ex vivo utilizzando la coltura di organoidi tridimensionali
In questo articolo
Riepilogo
Qui, descriviamo un metodo per generare organoidi di glioblastoma (GBM) da campioni di pazienti primari o colture cellulari derivate dal paziente e mantenerli fino alla maturità. Questi organoidi GBM contengono popolazioni cellulari fenotipicamente diverse e ricreano microambienti tumorali ex vivo.
Abstract
Il glioblastoma (GBM) è il tumore cerebrale maligno primario più comune con una prognosi estremamente sfavorevole. La diversità cellulare e molecolare intratumorale, così come le complesse interazioni tra microambienti tumorali, possono rendere difficile trovare trattamenti efficaci. I metodi tradizionali di coltura aderente o a sfera possono mascherare tali complessità, mentre la coltura organoide tridimensionale può ricapitolare i gradienti microambientali regionali. Gli organoidi sono un metodo di coltura tridimensionale GBM che imita meglio l'architettura tumorale del paziente, contiene popolazioni cellulari fenotipicamente diverse e può essere utilizzato per esperimenti a medio rendimento. Sebbene la coltura organoide tridimensionale sia più laboriosa e dispendiosa in termini di tempo rispetto alla cultura tradizionale, offre vantaggi unici e può servire a colmare il divario tra gli attuali sistemi in vitro e in vivo . Gli organoidi si sono affermati come strumenti inestimabili nell'arsenale dei biologi del cancro per comprendere meglio il comportamento del tumore e i meccanismi di resistenza, e le loro applicazioni continuano a crescere. Qui vengono forniti dettagli sui metodi per generare e mantenere gli organoidi GBM. Sono inoltre descritte le istruzioni su come eseguire l'incorporazione e il sezionamento di campioni organoidi utilizzando tecniche sia congelate che di incorporamento di paraffina, nonché raccomandazioni per protocolli di immunoistochimica e immunofluorescenza su sezioni organoidi e misurazione della vitalità totale delle cellule organoidi.
Introduzione
Il glioblastoma (GBM) è il tumore cerebrale primario più comune con una prognosi infausta di circa 15 mesi dalla diagnosi1. I trattamenti che sono efficaci negli studi preclinici possono spesso essere scarsamente efficaci nei pazienti 2,3. La scarsa risposta clinica è attribuita a molti fattori, tra cui l'eterogeneità microambientale del GBM e le complesse interazioni intratumorali. Questi possono essere difficili da ricreare in laboratorio con metodi tradizionali di coltura aderente o a sfera4. Anche la presenza di un sottogruppo di cellule staminali tumorali autorinnovanti (CSC) all'interno del GBM può contribuire a questa complessità 5,6. Le CSCs sono cruciali per la propagazione del tumore e mantengono la crescita tumorale promuovendo l'angiogenesi attiva, l'invasione del cancro e la resistenza alle terapie, comprese le radiazioni 7,8,9. Le CSCs non sono distribuite uniformemente in tutti i tumori, ma piuttosto sono arricchite all'interno di specifici microambienti, tra cui la nicchia perivascolare e le regioni perinecrotiche, che forniscono ciascuna una regolazione molecolare distinta dei loro stati cellulari 10,11,12,13,14. Le CSC non sono destinatari passivi di segnali microambientali, ma possiedono invece la capacità di rimodellare i propri microambienti 7,15,16. Il microambiente di una CSC può promuovere il mantenimento dello stato delle cellule staminali in risposta a pressioni come scarsità di nutrienti, pH e ipossia17,18,19,20, suggerendo l'importanza di queste condizioni in un sistema modello. La ricapitolazione del diverso microambiente cellulare all'interno dei tumori è quindi fondamentale per comprendere la resistenza terapeutica e identificare nuove terapie.
La cultura tridimensionale è aumentata in popolarità negli ultimi anni21,22. Gli organoidi sono stati utilizzati in altri tipi di cancro e l'obiettivo principale di mantenere le cellule come organoidi è quello di consentire la crescita di popolazioni cellulari eterogenee (molte delle quali possono normalmente essere superate in una coltura di sfere più omogenee) e la diversità spaziale, vista come microambienti tumorali regionali con specificità genetica 4,23,24,25,26 . Esistono molti metodi per la coltura tridimensionale delle cellule tumorali, che presentano vantaggi e svantaggi27,28,29. La coltura organoide non è destinata a sostituire la tradizionale coltura aderente o a sfera. È meglio utilizzato come tecnica complementare ai metodi bidimensionali quando ci sono domande specifiche in cui l'interazione tra microambiente cellulare e risposte delle cellule tumorali è critica.
Questo articolo descrive metodi affidabili e ripetibili per generare organoidi GBM da campioni primari di pazienti o colture derivate dal paziente. Affrontiamo due diversi obiettivi per la coltura tridimensionale di organoidi: (1) stabilire organoidi dal tessuto primario del paziente, con il massimo potenziale di attecchimento indipendentemente dall'uniformità, o (2) coltivare organoidi uniformi per un uso sperimentale più quantitativo. Quando si stabilisce un campione primario come organoidi, non è necessario filtrare per singole cellule o contare le cellule, perché mantenere il numero massimo di cellule e tipi per stabilire la coltura iniziale è una priorità. Quando si coltivano organoidi per esperimenti comparativi, tuttavia, sono necessari la filtrazione a singola cellula e il conteggio delle cellule per garantire che gli organoidi replicati siano comparabili per coerenza sperimentale. Questo protocollo descrive in dettaglio come stabilire colture di organoidi e creare organoidi uniformi, nonché metodi raffinati per incorporare e preservare organoidi ed esperimenti di coltura cellulare standard, tra cui immunoistochimica, immunofluorescenza e valutazione della vitalità cellulare totale negli organoidi GBM.
Protocollo
Tutte le fasi del protocollo (i) dettagliato di seguito sono state sviluppate e condotte in conformità con il protocollo # 2559 del Cleveland Clinic Institutional Review Board (IRB) e l'approvazione # 1711 del Comitato istituzionale per la biosicurezza (IBC). Sfere e organoidi sono coltivati in "Neurobasal Media Complete" (NBMc). Vedere la Tabella 1 per le istruzioni.
1. Fare stampi organoidi
- Togliere la carta oleata dal foglio di parafilm (circa 4 cm x 4 cm) e posizionarla tra due piastre sterili di reazione a catena della polimerasi a 96 pozzetti (PCR).
- Eseguire questi passaggi nella cappa di coltura e prestare particolare attenzione a mantenere pulito "l'interno" del parafilm (il lato coperto dalla carta). Questo lato pulito dovrebbe rendere la concavità delle rientranze.
- Applicare una pressione uniforme sulla piastra PCR superiore a 96 pozzetti per formare piccole fossette nel parafilm. L'obiettivo è quello di avere fossette di circa 2 mm di profondità senza creare fori nel parafilm.
- Separare delicatamente le due piastre PCR a 96 pozzetti. Il parafilm a fossette si attaccherà alla piastra superiore. Mettere questo su ghiaccio secco per circa 30 s.
- Dopo che il parafilm è rimasto sul ghiaccio secco per 30 s, utilizzare una pinza sterile per estrarre il parafilm dalla piastra superiore della PCR a 96 pozzetti.
- Quando rimuovi il parafilm, usa un movimento rapido piuttosto che essere molto "attento". Il parafilm congelato è più facile da rimuovere rispetto al parafilm riscaldato, che può causare l'inversione delle fossette.
- Posizionare lo stampo per parafilm completato in un piatto di coltura cellulare sterile coperto e sterile da 10 cm. Gli stampi possono essere realizzati in anticipo e conservati se viene mantenuta la sterilità.
2. Macrodissezione del campione di tessuto del paziente
- In un piatto di coltura sterile (piastre di coltura cellulare da 10 cm), utilizzare due lamette sterili per tritare finemente il campione paziente applicando una pressione uniforme.
NOTA: Tritare il campione è più facile con circa 500 μL di NBMc sul piatto di coltura. Tentare con lamette di tritare i pezzi il più finemente possibile; Idealmente, i singoli pezzi sono 1 mm3 o più piccoli. - Trasferire i pezzi di tumore finemente tritati in una provetta da centrifuga da 15 mL utilizzando una punta di pipetta p1000 tagliata.
NOTA: Quando si maneggiano organoidi, è importante utilizzare solo punte per pipette tagliate p1000. Questi possono essere tagliati utilizzando un rasoio affilato alla dimensione di apertura desiderata (tra 5 e 8 mm circa) e autoclavati. - Aggiungere 2 mL di soluzione di distacco cellulare a temperatura ambiente (RT) (Table of Materials) e metterla in un incubatore a 37 °C, 5% CO2 per circa 10 minuti.
NOTA: Osservare e mescolare ogni pochi minuti. Alcune soluzioni o campioni di distacco cellulare possono richiedere tempi di incubazione variabili. Se appare aggregazione, che può indicare il rilascio di DNA a causa della lisi cellulare, procedere immediatamente al passaggio successivo. - Aggiungere 8 mL di materiale NBMc per neutralizzare la soluzione di distacco cellulare e ruotare per 3 minuti a 65 x g.
- Aspirare il surnatante e risospendere il tessuto in 1-2 ml di NBMc.
3. Generazione di organoidi dal tessuto primario del paziente
NOTA: L'obiettivo quando si realizzano organoidi dal tessuto primario del paziente è quello di stabilire una coltura tridimensionale. Non filtrare per singole celle o contare le celle, ma mantenere il carico iniziale della cella il più uniforme possibile utilizzando l'ispezione visiva. È normale avere eterogeneità nella crescita e nella creazione di organoidi iniziali. Ogni organoide avrà un volume di 20 μL (16 μL di matrice extracellulare ricca di laminina (lrECM) e 4 μL di tessuto sospeso in NBMc, dalla fase 2.5). Le istruzioni possono essere regolate per il numero di organoidi previsti; L'obiettivo è quello di formare tipicamente circa 20-30 organoidi da campioni di pazienti primari.
- In un secchiello per il ghiaccio o in un blocco freddo, posizionare lrECM e una piccola provetta da centrifuga. Introdurre la quantità appropriata di lrECM (16 μL x numero X di organoidi previsti) nella piccola provetta da centrifuga.
- Aggiungere il volume appropriato di sospensione tissutale dal punto 2,5 (4 μL x numero di organoidi previsti) alla provetta della centrifuga su ghiaccio.
- Pipettare accuratamente 20 μL della miscela lrECM/sospensione cellulare su stampi per parafilm; Questo formerà una goccia simile a una perla.
- Assicurarsi di miscelare accuratamente la miscela lrECM/sospensione cellulare; le cellule tendono a depositarsi facilmente all'interno della lrECM, dando luogo a organoidi eterogenei.
- Mantenere la miscela lrECM/sospensione cellulare su ghiaccio. Se lrECM si riscalda, può polimerizzare e compromettere la formazione di organoidi. Assicurarsi di raffreddare la punta della pipetta ogni due o tre organoidi per evitare la polimerizzazione di lrECM. Non introdurre bolle d'aria negli organoidi (evitare di "spingere due volte" la pipetta).
- Una volta che il numero desiderato di organoidi è stato pipettato su uno stampo per parafilm in una piastra di coltura cellulare di 10 cm, coprire con coperchio a piastre e incubare in un incubatore di coltura cellulare a 37 °C, 5% CO 2 per1-2 ore.
- Dopo che gli organoidi si sono solidificati, utilizzare il mezzo NBMc per sciacquarli delicatamente dallo stampo del parafilm e in una nuova piastra di coltura sterile da 10 cm con 20 ml di NBMc totale. L'uso di una punta p1000 funziona meglio per lavare gli organoidi dallo stampo; scivoleranno via delicatamente.
NOTA: Quando gli organoidi vengono lavati dagli stampi in piastre di coltura cellulare, dovrebbero essere visibili nei media come piccole sfere rosa. Se gli organoidi sembrano essere caduti a pezzi o frantumati nei media, ciò indica un problema precedente con lrECM che si è polimerizzato e gli organoidi possono ancora crescere, ma è molto improbabile che siano di dimensioni uniformi. - Porre il piatto di coltura da 10 cm in un incubatore per colture cellulari a 37 °C, 5% CO2 (senza agitare) per 4 giorni.
NOTA: Posizionare gli organoidi su uno shaker orbitale nei primi giorni può causarne la caduta a pezzi. Assicurati che non tremino fino al giorno 4. - Dopo 4 giorni, scambiare il mezzo e posizionarlo su uno shaker orbitale a 80 RPM in un incubatore di coltura cellulare a 37 °C, 5% CO2.
- Lo scambio di supporti con organoidi immaturi è impegnativo perché sono difficili da visualizzare. Inclinare il piatto di coltura cellulare e attendere almeno 20 s; gli organoidi si depositeranno sul fondo e permetteranno di rimuovere lentamente i supporti dall'alto con una pipetta di vetro o plastica da 10-20 ml.
- Prestare particolare attenzione alla raccolta di organoidi in basso; Se appaiono agitati dalla forza della rimozione dei media, è meglio fermarsi e consentire loro di reinsediarsi. Man mano che gli organoidi maturano e sono più facili da visualizzare, questo processo diventa meno sfumato.
NOTA: A volte, posizionare un pezzo di carta scura sotto la piastra di coltura cellulare può aiutare a visualizzare organoidi immaturi. Si consiglia di non utilizzare una pipetta Pasteur con aspirazione a vuoto per rimuovere i fluidi in quanto è molto facile aspirare e perdere gli organoidi in questo modo. - Quando gli organoidi vengono stabiliti per la prima volta, non consumano i terreni così rapidamente degli organoidi maturi. A partire dal 50% di scambi di media, si riduce l'uso non necessario dei media e si riduce la possibilità di danneggiare o aspirare accidentalmente nuovi organoidi durante il processo di scambio dei media.
4. Generazione di organoidi da sfere GBM consolidate, colture aderenti o organoidi
NOTA: L'obiettivo qui è quello di creare organoidi uniformi per dimensioni e quantità di cellule da utilizzare in esperimenti comparativi, quindi utilizzare un filtro a cella singola e contare le celle per garantire questo.
- Preparazione della sospensione monocellulare dalla coltura di sfere GBM.
NOTA: le colture di sfere di cellule GBM vengono mantenute nei supporti NBMc.- Mettere le sfere in una provetta da centrifuga da 15 mL e centrifugare a 120 x g per 5 minuti.
- Rimuovere il surnatante e aggiungere 2 ml di soluzione di distacco di cellule RT. Mettere in un'incubatrice a 37 °C per 3 minuti.
- Aggiungere 8 mL di materiale NBMc per neutralizzare la soluzione di distacco della cellula. Filtrare attraverso un filtro monocellulare (70 μm) e centrifugare per 5 minuti a 120 x g.
- Rimuovere il surnatante dal tubo e risospendere le cellule rimanenti in ~ 1 mL di NBMc. Contare le celle (usando la colorazione imper-media cellulare) e saltare al passaggio 4.4.
- Preparazione della sospensione monocellulare da coltura aderente GBM.
- Rimuovere il mezzo usato dalla piastra, aggiungere 2 mL di soluzione di distacco della cella RT alla piastra e metterlo in un incubatore a 37 °C per 3 minuti.
- Confermare al microscopio che le cellule sono staccate dalla piastra.
- Aggiungere 8 mL di materiale NBMc per neutralizzare la soluzione di distacco cellulare. Filtrare attraverso un filtro monocellulare (70 μm).
NOTA: lo sforzo a singola cellula è facoltativo quando si lavora con colture aderenti. - Girare per 5 minuti a 120 x g. Rimuovere il surnatante dal tubo e risospendere le cellule rimanenti in ~ 1 mL di NBMc. Contare le celle (usando la colorazione imper-media cellulare) e saltare al passaggio 4.4.
- Preparazione della sospensione unicellulare da coltura di organoidi GBM.
- Trasferire gli organoidi utilizzando una punta di pipetta tagliata p1000 su una piastra di coltura da 10 cm e rimuovere con cura quanto più materiale residuo possibile.
- Usando due rasoi sterili, tritare accuratamente gli organoidi finemente. Con la punta p1000 tagliata, spostare gli organoidi tritati in una provetta da centrifuga da 15 ml e aggiungere ~ 2-3 ml di media NBMc.
- Ruotare a 120 x g per 3 minuti e rimuovere il surnatante (si consiglia di utilizzare una punta per pipetta anziché l'aspirazione a vuoto per questa parte).
- Aggiungere 2 ml di soluzione di distacco della cella fredda per 10 minuti.
NOTA: La soluzione di distacco di cella deve essere utilizzata direttamente da 4 °C, non riscaldata prima. Questo sembra ammorbidire qualsiasi matrigel residuo e aiuta nel recupero cellulare. - Quindi passare a un'incubatrice a 37 °C per 10-20 minuti, osservando e mescolando ogni pochi minuti. Se appare l'aggregazione, che può indicare la lisi cellulare, procedere immediatamente al passaggio successivo.
- Aggiungere 8 mL di media NBMc per diluire la soluzione di distacco della cellula. Filtrare con un colino monocellulare (70 μm) e centrifugare per 5 minuti a 120 x g.
- Rimuovere il surnatante dal tubo e risospendere le cellule rimanenti in ~ 1 mL di NBMc. Contare le cellule (usando la colorazione imper-media cellulare) e procedere al passaggio 4.4.
- Fare organoidi da una sospensione unicellulare
- In un secchiello per il ghiaccio o in un blocco freddo, posizionare lrECM e una piccola provetta da centrifuga. Introdurre la quantità appropriata di lrECM (16 μL x numero X di organoidi previsti) nella piccola provetta da centrifuga.
- Creare una miscela di cellule in un volume totale (4 μL x X numero di organoidi previsti) che conterrà 20.000 cellule/organoidi e aggiungerlo al piccolo tubo di centrifuga con lrECM su ghiaccio.
- Pipettare accuratamente 20 μL della miscela lrECM/sospensione cellulare su stampi per parafilm; Questo formerà una goccia simile a una perla.
- Assicurati di mescolare accuratamente la miscela lrECM / sospensione cellulare, poiché le cellule tendono a depositarsi facilmente all'interno della lrECM e ciò si tradurrà in organoidi eterogenei.
- Mantenere la miscela lrECM/sospensione cellulare su ghiaccio. Se lrECM si riscalda, può polimerizzare e compromettere la formazione di organoidi.
- Assicurarsi di raffreddare la punta della pipetta ogni due o tre organoidi per evitare la polimerizzazione di lrECM. Non introdurre bolle d'aria negli organoidi (evitare di "spingere due volte" la punta della pipetta).
- Una volta che il numero desiderato di organoidi è stato pipettato su uno stampo per parafilm in una piastra di coltura di 10 cm, incubare a 37 °C per 1-2 ore in un incubatore di coltura cellulare.
- Dopo che gli organoidi si sono solidificati, utilizzare il mezzo NBMc per sciacquarli delicatamente dallo stampo del parafilm e in una nuova piastra di coltura sterile da 10 cm con 20 ml di NBMc totale. L'uso di una punta p1000 funziona meglio per lavare gli organoidi dallo stampo; scivoleranno via delicatamente.
NOTA: Si consigliano circa 15-20 organoidi per piatto di coltura da 10 cm. - Mettere il piatto di coltura da 10 cm in un'incubatrice (senza agitare) per 4 giorni.
- Dopo 4 giorni, scambiare il mezzo e posizionarlo su uno shaker orbitale a 80 RPM nell'incubatore di coltura cellulare. Successivamente scambia i media ogni 2-3 giorni.
- Lo scambio di supporti con organoidi immaturi è impegnativo perché sono difficili da visualizzare. Inclinare il piatto di coltura cellulare e attendere almeno 20 s; Gli organoidi si depositeranno sul fondo e permetteranno di rimuovere lentamente i supporti dall'alto con una pipetta di vetro ad apertura grande.
- Prestare particolare attenzione alla raccolta di organoidi in basso; Se appaiono agitati dalla forza della rimozione dei media, fermati e consenti loro di reinsediarsi. Man mano che gli organoidi maturano e sono più facili da visualizzare, questo processo diventa meno sfumato.
NOTA: A volte, posizionare un pezzo di carta scura sotto la piastra di coltura cellulare può aiutare a visualizzare organoidi immaturi. Non utilizzare una pipetta Pasteur con aspirazione a vuoto per rimuovere i fluidi in quanto è molto facile aspirare e perdere gli organoidi in questo modo. - Quando gli organoidi vengono stabiliti per la prima volta, non consumano i terreni così rapidamente degli organoidi maturi. Inizia con scambi di media del 50% per ridurre l'uso non necessario dei supporti e ridurre la possibilità di danneggiare o aspirare accidentalmente nuovi organoidi durante il processo di scambio dei media.
5. Crioincorporazione
- Posizionare ciascun organoide in un singolo tubo da 1,5 ml (utilizzando la punta p1000 tagliata) contenente 1 ml di paraformaldeide (PFA) al 4%. Conservare gli organoidi per una notte a 4 °C. Se si incorporano organoidi in paraffina, procedere alla sezione 6.
- Dopo la fissazione notturna in PFA al 4%, lavare gli organoidi in 1x soluzione salina tamponata con fosfato (PBS) tre volte.
- Trasferire l'organoide in una nuova provetta da 1,5 mL (utilizzando la punta della pipetta p1000 tagliata) contenente 1 mL di saccarosio al 30% in acqua e conservare a 4 °C per una notte.
- Aggiungere una piccola quantità (in genere 1-2 ml) di composto a temperatura di taglio ottimale (OCT) a un criostampo, coprendo il fondo e riempiendo circa 1/3 a 1/2 della profondità dello stampo.
- Trasferire un singolo organoide al criomold utilizzando la punta della pipetta p1000 tagliata. Ciò comporterà il trasferimento di alcuni supporti con l'organoide, che è inevitabile. Utilizzare una punta di pipetta più piccola per rimuovere con cura il fluido circostante senza disturbare l'organoide.
NOTA: questo può essere difficile da visualizzare, ma il pipettaggio lento dimostrerà una chiara differenza di densità tra i supporti e lo Strumento di personalizzazione (OCT), quindi questo viene fatto "al tatto" in una certa misura). - Posizionare il criomold su un vassoio di ghiaccio secco. L'OCT inizierà a congelarsi, diventando opaco nel processo.
- Aggiungere ulteriore OCT per coprire completamente l'organoide, riempiendo il resto del volume del criostampo. I blocchi possono essere conservati a -20 °C per la conservazione a breve termine per diversi giorni o a -80 °C per la conservazione a lungo termine a tempo indeterminato.
6. Incorporazione di paraffina
- Ordina gli organoidi per dimensione (gli organoidi piccoli sono inferiori a 3 mm, gli organoidi grandi sono superiori a 3 mm). Trasferire ciascun organoide in una cassetta istologica utilizzando una punta di pipetta p1000 tagliata e trasformarlo in cera di paraffina secondo la tabella 2 o la tabella 3.
NOTA: La dimensione/configurazione della cassetta istologica dipende dall'utente. - Trasferire gli organoidi dalle cassette agli stampi incorporati con 1-2 ml di cera di paraffina fusa e raffreddare fino a quando la cera è semisolida.
- Una volta che la cera è parzialmente solidificata, aggiungere altra cera sulla parte superiore dello stampo. Posizionare la parte superiore della cassetta etichettata sullo stampo e trasferirla su una piastra fredda. Continuare a raffreddare fino a quando la cera è completamente solida.
- Quando la cera si è solidificata, sezionare il blocco usando un microtomo. In alternativa, conservare a RT o 4 °C per il successivo sezionamento.
7. Immunofluorescenza (IF)
- De-paraffinizzare e reidratare sezioni di tessuto incorporate in paraffina 5-12 μm utilizzando un piatto colorante per vetrino, secondo i seguenti passaggi.
NOTA: se si utilizzano sezioni di organoidi incorporati nello Strumento di personalizzazione dello Strumento di personalizzazione OCT, si consiglia di utilizzare sezioni da 12 μm. Rimuovere lo Strumento di personalizzazione di Office agitando il vetrino in PBS per 30 minuti. Andare al passaggio 7.2.- Incubare per 5 minuti in xilene. Ripeti questa operazione altre due volte. Quindi incubare per 10 minuti in etanolo al 100%. Ripeti ancora una volta.
- Incubare per 10 minuti in etanolo al 95%. Ripeti ancora una volta. Lavare le sezioni in acqua distillata per 5 minuti, due volte.
- Per lo smascheramento dell'antigene, immergere i vetrini in 1x soluzione di smascheramento del citrato (tabella dei materiali) e microonde a temperatura di ebollizione per 10 minuti. Assicurati di non far bollire la soluzione.
NOTA: Questo si ottiene meglio se cotto a microonde inizialmente per ~ 2 minuti fino a quando non si verifica l'ebollizione, quindi abbassando la potenza e guardando per garantire che la soluzione non bolle. La temperatura di smascheramento preferita è appena inferiore a 100 °C, idealmente 98 °C. - Lasciare raffreddare le diapositive per 30 minuti a RT nella soluzione di smascheramento del citrato 1x.
NOTA: Questa è la stessa soluzione di citrato 1x; La soluzione non deve essere sostituita in questa fase. - Lavare gli scivoli in acqua distillata per 5 minuti, due volte.
- Lavare i vetrini in 1x tampone TBST (soluzione salina Tris con 0,1% Tween 20) per 5 minuti.
- Rimuovere i vetrini da TBST e asciugarli accuratamente intorno alle sezioni di tessuto utilizzando una salvietta detergente da laboratorio, facendo attenzione a non lasciare asciugare la sezione di tessuto. Una volta che il vetrino è sufficientemente asciutto, cerchiare le sezioni di tessuto con una penna barriera idrofobica.
- Bloccare ogni sezione con 100-400 μL di soluzione di blocco del siero al 10% per 1 ora a RT. Scegliere la soluzione di blocco del siero in base all'anticorpo secondario. Ad esempio, se si utilizza un anticorpo secondario prodotto nell'asino, utilizzare un siero d'asino normale al 10% in 1x TBST.
- Rimuovere la soluzione bloccante e quindi aggiungere 100-400 μL di anticorpo primario diluito alla concentrazione desiderata nella soluzione bloccante.
- A 4 °C, incubare le sezioni con l'anticorpo primario durante la notte.
- Rimuovere la soluzione anticorpale primaria e lavare i vetrini in 1x TBST per 5 minuti, tre volte.
- Aggiungere 100-400 μL di anticorpo secondario (1:1000 diluizione in soluzione bloccante, o secondo le istruzioni del produttore) a ciascuna sezione e incubare per 1,5 ore a RT.
- Lavare i vetrini in 1x TBST per 5 minuti, due volte. Quindi lavare i vetrini in 1x PBS per 5 minuti.
- Rimuovere i vetrini dal PBS e asciugarli intorno alle sezioni di tessuto utilizzando una salvietta per la pulizia da laboratorio. Aggiungere qualche goccia di montante a polimerizzazione liquida e montare con cura un coprivetro di vetro. Una volta che i vetrini sono asciutti, conservare a -20 °C al riparo dalla luce fino al momento dell'imaging.
8. Immunoistochimica
- De-paraffinizzare e reidratare le sezioni di tessuto incorporate in paraffina utilizzando un piatto colorante per vetrino, secondo i seguenti passaggi.
NOTA: se si utilizzano sezioni di organoidi incorporati nello Strumento di personalizzazione di Office, rimuovere lo Strumento di personalizzazione di Office agitando la diapositiva in PBS per 30 minuti. Andare al passaggio 8.2.- Incubare per 5 minuti in xilene. Ripeti altre due volte.
- Incubare per 10 minuti in etanolo al 100%. Ripeti ancora una volta.
- Incubare per 10 minuti in etanolo al 95%. Ripeti ancora una volta.
- Lavare le sezioni in acqua distillata per 5 minuti, due volte.
- Per lo smascheramento dell'antigene, immergere i vetrini in 1x soluzione di smascheramento del citrato e microonde a temperatura di ebollizione inferiore per 10 minuti. Assicurati di non far bollire la soluzione.
- Lasciare raffreddare le diapositive per 30 minuti a RT nella soluzione di smascheramento del citrato 1x.
- Lavare i vetrini per 5 minuti in acqua distillata, tre volte.
- Incubare i vetrini per 10 minuti in perossido di idrogeno al 3%.
- Lavare i vetrini per 5 minuti in acqua distillata due volte.
- Lavare i vetrini per 5 minuti in 1x TBST.
- Rimuovere i vetrini da 1x TBST e quindi utilizzare l'angolo di una salvietta detergente da laboratorio per asciugare accuratamente le sezioni di tessuto.
- Circondare le sezioni di tessuto con una penna barriera idrofobica una volta che il vetrino è asciutto.
- Posizionare 100-400 μL della soluzione bloccante su ciascuna sezione all'interno del cerchio della penna barriera idrofobica a RT per 1 ora. Utilizzare siero d'asino normale al 10% (NDS) o albumina sierica bovina allo 0,75% (BSA) diluita in 1x TBST.
- Quindi, rimuovere la soluzione di blocco e aggiungere 100-400 μL dell'anticorpo primario a ciascuna sezione. Diluire questo anticorpo primario alla concentrazione desiderata utilizzando il diluente del produttore appropriato.
- Incubare le sezioni a 4 °C durante la notte. Rimuovere la soluzione anticorpale primaria e lavare i vetrini in 1x TBST per 5 minuti, tre volte.
- Aggiungere 100-400 μL di reagente di rilevamento IHC a ciascuna sezione e incubare per 1 ora a RT. Scegliere il reagente di rilevamento IHC in base all'anticorpo primario.
- Lavare ogni sezione con 1x TBST per 5 minuti, due volte, seguito da 1x PBS per 5 minuti una volta.
- Preparare la soluzione di 3,3-diaminobenzidina (DAB) secondo le indicazioni del produttore. Aggiungere 100-400 μL di soluzione DAB a ciascuna sezione di tessuto e monitorare attentamente al microscopio. Tra 1-10 minuti fornirà un'intensità di colorazione accettabile; Assicurati di annotare questa volta e mantieni la coerenza per tutte le sezioni di tessuto.
- Dopo aver raggiunto l'intensità di colorazione desiderata, immergere i vetrini in acqua distillata.
- Eseguire la disidratazione contro l'ematossilina e il vetrino per il montaggio secondo le istruzioni riportate nella Tabella 4.
- Rimuovere il vetrino dal sostituto dello xilene (Tabella dei materiali) e rimuovere il liquido in eccesso intorno alla sezione di tessuto utilizzando una salvietta per la pulizia da laboratorio. Utilizzare una piccola quantità di supporto di montaggio permanente per montare il coprislip sulla sezione di tessuto e lasciare asciugare.
9. Misurazione della vitalità cellulare totale
- Trasferire ciascun organoide in una provetta da 2 mL e, utilizzando una piccola punta per pipetta, rimuovere con cura tutti i mezzi in eccesso attorno all'organoide (vedere la Figura 3 per lo schema di questa procedura).
NOTA: I saggi di vitalità cellulare devono essere eseguiti con organoidi realizzati con un numero identico di cellule. Questo esperimento non dovrebbe essere eseguito su organoidi fatti direttamente da campioni di pazienti provenienti da interventi chirurgici, da organoidi da taglio formati o da altri casi in cui le singole cellule non sono state filtrate e contate. - Preparare il reagente di analisi della vitalità cellulare luminescente e 1x PBS in rapporto 1:1 e aggiungere 500 μL a ciascuna provetta.
- Utilizzare una punta di pipetta p1000 per pipettare aggressivamente su e giù per abbattere l'organoide e lasciare riposare per 5 minuti. L'organoide dovrebbe essere un po 'dissociato e più morbido ormai; Ripetere nuovamente la miscelazione con la punta della pipetta P1000.
- L'obiettivo è avere un volume totale di 100 μL per pozzetto di una piastra da 96 pozzetti. Aggiungere 25 μL della miscela dal punto 9.3 (avrà abbastanza per più repliche tecniche) e aggiungere 75 μL di saggio di vitalità cellulare luminescente rimanente e miscela PBS.
- Posizionare la piastra su uno shaker per 2 minuti e quindi incubare per 20 minuti a RT.
- Leggere la lastra utilizzando un'impostazione di luminescenza su un lettore di lastre e raccogliere i dati (vedere la Figura 4).
Risultati
La Figura 1 mostra la crescita precoce degli organoidi osservata al microscopio ottico con un ingrandimento 10x. La Figura 1A mostra la migrazione e l'invasione di singole celle attraverso lrECM nella vista centrale. Le cellule continueranno ad espandersi e "colonizzare" la lrECM, e appariranno più dense e infine opache dall'ispezione visiva. La figura 1B mostra diversi organoidi maturi (a 7 settimane) senza ingrandimento, rispetto alle dimensioni di un centesimo.
La Figura 2 mostra la colorazione immunoistochimica degli organoidi GBM per il fosfo-istone H3, un marker di proliferazione attiva. La maggior parte delle cellule altamente proliferative sono viste nel perimetro organoide rispetto al nucleo organoide. La colorazione positiva avrà un aspetto marrone / rame.
La Figura 3 descrive il processo per omogeneizzare e misurare il numero totale di cellule negli organoidi GBM utilizzando un saggio di vitalità cellulare luminescente specifico per 3D. A causa dell'elevato numero di cellule presenti negli organoidi GBM, la struttura organoide più grande viene inizialmente omogeneizzata mediante triturazione in reagente di saggio luminescente. Quindi le frazioni del lisato organoide totale vengono caricate in singoli pozzetti e diluite con un ulteriore reagente di analisi luminescente prima dell'incubazione e della lettura su un appropriato lettore di piastre multi-pozzetto.
La figura 4 rappresenta i dati di controllo DMSO (veicolo comune) per gli organoidi. I dati tracciati dimostrano la consistenza intra-organoide e inter-organoide. I dati di vitalità luminescenti saranno tipicamente normalizzati ai controlli per ciascun campione durante la generazione di dati sperimentali.
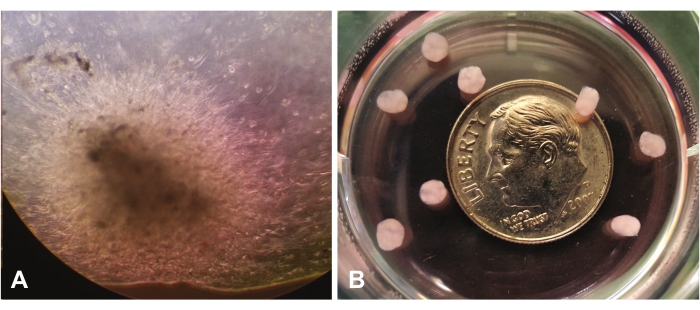
Figura 1: Vista al microscopio ottico (10x). (A) Crescita precoce degli organoidi che dimostra la migrazione/invasione delle cellule GBM in tutta la matrice extracellulare ricca di laminina. (B) organoidi maturi rispetto alle dimensioni di una monetina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
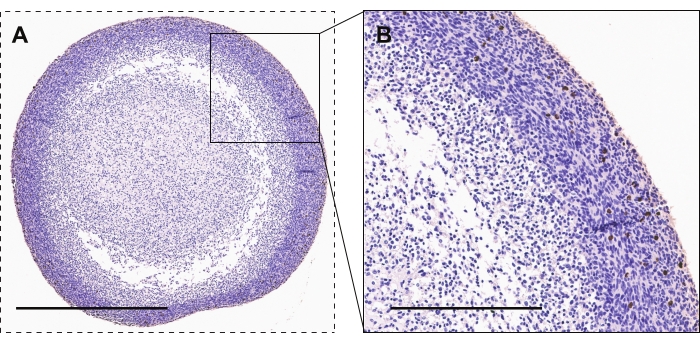
Figura 2: Immunoistochimica degli organoidi GBM. (A, B) Organoidi GBM che mostrano cellule colorate con fosfo-istone H3 per la proliferazione attiva. Le barre di scala sono 600 μm e 300 μm per A e B, rispettivamente. Fare clic qui per visualizzare una versione ingrandita di questa figura.
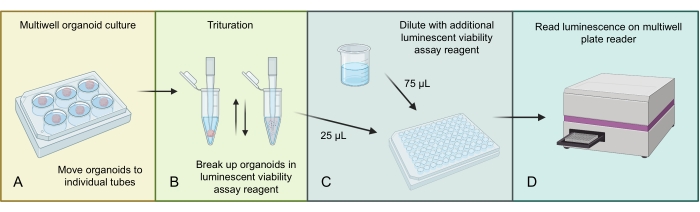
Figura 3: Protocollo di vitalità cellulare luminescente per organoidi . (A) Spostare i singoli organoidi in piccole provette da centrifuga ed eliminare i mezzi in eccesso. (B) Aggiungere 500 μL di PBS 1:1 e miscela di dosaggio di vitalità cellulare luminescente a ciascuna provetta e pipetta in modo aggressivo per abbattere l'organoide. (C) Aggiungere 25 μL di questa miscela organoide e 75 μL della stessa miscela 1:1 PBS e dosaggio luminescente di vitalità cellulare a ciascun pozzetto di una piastra a 96 pozzetti. (D) Posizionare su uno shaker per 2 minuti, seguito da incubazione per 20 minuti a RT, quindi leggere la luminescenza su un lettore di piastre. Figura realizzata utilizzando BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
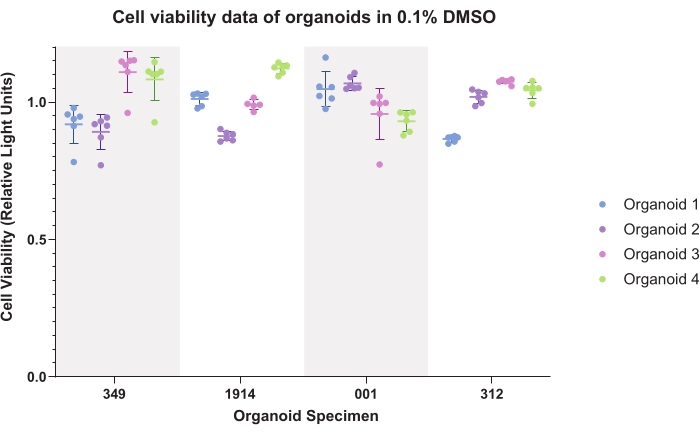
Figura 4: Vitalità cellulare. Dati di vitalità cellulare per organoidi in 0,1% dimetil solfossido (DMSO) per sei repliche tecniche di quattro organoidi per quattro campioni di pazienti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Componente | Quantità |
| Mezzo neurobasale meno rosso fenolo | 500 ml |
| Supplemento di B-27 meno vitamina A (50x) | 10 ml |
| Antibiotico-antimicotico (100x) | 5 ml |
| Piruvato di sodio (100 mM) | 5 ml |
| Glutammina in 0,85% NaCl (200 mM) | 5 ml |
| FGF umano ricombinante basico (250 μg/ml) | 20 μL |
| Proteina EFG umana ricombinante (250 μg/mL) | 20 μL |
| Rosso fenolo | 500 μL |
Tabella 1: Formulazione completa del mezzo neurobasale (NBMc)
| Reagente | Ore |
| 50% etanolo | 3 minuti |
| 75% Etanolo | 3 minuti |
| 95% etanolo | 3 minuti |
| 95% etanolo | 4 minuti |
| 100% etanolo | 2 minuti |
| 100% etanolo | 3 minuti |
| 100% etanolo | 4 minuti |
| Sostituto dello xilene | 2 minuti |
| Sostituto dello xilene | 3 minuti |
| Sostituto dello xilene | 4 minuti |
| Paraffina | 15 minuti |
| Paraffina | 15 minuti |
Tabella 2: Programma di lavorazione per piccoli organoidi (diametro inferiore a 3 mm)
| Reagente | Ore |
| 50% etanolo | 6 minuti |
| 75% Etanolo | 6 minuti |
| 95% etanolo | 5 minuti |
| 95% etanolo | 8 minuti |
| 100% etanolo | 5 minuti |
| 100% etanolo | 5 minuti |
| 100% etanolo | 8 minuti |
| Sostituto dello xilene | 5 minuti |
| Sostituto dello xilene | 5 minuti |
| Sostituto dello xilene | 8 minuti |
| Paraffina | 30 minuti |
| Paraffina | 30 minuti |
Tabella 3: Programma di lavorazione per organoidi di grandi dimensioni (diametro superiore a 3 mm)
| Reagente | Ore |
| Ematossilina | 2 minuti |
| Running diH2O | 2 minuti |
| Reagente chiarificante dell'ematossilina nucleare | 1 min |
| Running diH2O | 1 min |
| Reagente Bluing | 1 min |
| Running diH2O | 2 minuti |
| 70% etanolo | 1 min |
| 100% etanolo | 1 min |
| 100% etanolo | 1 min |
| Sostituto dello xilene | 2 minuti |
| Sostituto dello xilene | 2 minuti |
Tabella 4: Controcolorazione dell'ematossilina
Discussione
Gli organoidi GBM sono un metodo di coltura complementare alle sfere tradizionali che includono una maggiore eterogeneità cellulare e microambientale 4,22,30. Sebbene richieda più tempo e risorse, la coltura di organoidi può offrire preziose informazioni sul comportamento intratumorale e sui meccanismi di resistenza ai farmaci.
GBM è guidato da una popolazione di CSC 5,31, e questi metodi sono stati sviluppati per consentire la crescita continua e l'auto-rinnovamento di questa popolazione CSC. Il fattore di crescita epidermico (EGF) e il fattore di crescita dei fibroblasti (FGF) sono noti per migliorare il mantenimento e la crescita delle cellule staminali e fornire la segnalazione attiva del recettore tirosin-chinasi (RTK). La formazione di popolazioni cellulari eterogenee e microambienti tumorali distinti all'interno dei tumori GBM si basa sul supporto dei comportamenti CSC. La selezione di una lrECM imita l'ambiente cerebrale ricco di laminina e supporta le cellule nella coltura di organoidi per auto-organizzarsi e migrare per invasione. Sebbene alcuni gruppi abbiano stabilito una coltura di organoidi senza l'uso di un lrECM o di mezzi arricchiti con EGF / FGF24,28, che possono offrire un modo più efficiente in termini di tempo di questo metodo di coltura e una selezione più forte di segnalazione oncogena per guidare la crescita, questi metodi sono stati scelti per ottimizzare l'ambiente pro-cellule staminali per stabilire al meglio l'eterogeneità cellulare degli organoidi. Sia gli organoidi cerebrali che gli organoidi GBM sono stati realizzati con lrECM in letteratura precedentemente 21,32,33. Sebbene abbiamo stabilito dati riguardanti le popolazioni tumorali trovate all'interno degli organoidi e la variazione spaziale, si sa meno sulle popolazioni non tumorali all'interno degli organoidi e per quanto tempo sopravvivono dai campioni originali del paziente. Alcune colorazioni IHC (come CD45) possono fornire questi dati e potrebbero essere un interessante punto di ricerca in futuro con gli organoidi.
Conoscere l'uso previsto per la coltura di organoidi è importante per selezionare i metodi appropriati. La creazione di organoidi da campioni primari rispetto alla crescita di organoidi uniformi per esperimenti specifici ha procedure leggermente diverse. Avere un apprezzamento per il modo in cui gli organoidi maturano e riempiono visivamente l'impalcatura lrECM è importante per essere in grado di allocare tempo e risorse adeguati alla coltura degli organoidi. Le regioni sparse di cellule negli organoidi si espandono lentamente e crescono fino a riempire la lrECM, che può richiedere da 2 a 8 settimane, a seconda del comportamento del campione. Questo tasso di crescita è in qualche modo intrinseco a ciascun esemplare; È conservato in diversi lotti di organoidi e abbastanza coerente con il tasso relativo di crescita delle sfere. Gli organoidi possono essere mantenuti per oltre 1 anno e mantenere le capacità di formazione del tumore sullo xenotrapianto nei topi; Tuttavia, si raccomanda di coltivarli con uno scopo distinto per non sprecare risorse di laboratorio (sia materiali che tempo)4. La crescita degli organoidi è stata testata in più dimensioni e formati di pozzetti e dimostra che una piastra di 10 cm è l'impostazione ideale per mantenere la vitalità cellulare ottimale, seguita da una piastra a 6 pozzetti con tre organoidi per pozzetto34. Gli organoidi consumano più media rispetto alle loro controparti di coltura bidimensionale e l'utilizzo di un formato di pozzo più piccolo non porta a una corretta manutenzione. Ad esempio, un pozzetto di una lastra di formato 96 pozzetti non ha abbastanza spazio o volume di supporto rispetto alle dimensioni di un organoide per sostenere la crescita degli organoidi.
Come stabiliscono gli organoidi, essere osservatori è importante per aumentare il successo. Inizialmente, gli organoidi consumeranno i media lentamente, ma man mano che diventano più densi e più maturi, consumeranno i media più rapidamente. L'aggiunta di rosso fenolo ai media può aiutare a servire come indicatore del consumo dei media. Quando il terreno è più giallo, può chiederci di regolare il modello di alimentazione, sia che si tratti di scambiare un volume maggiore di media, aumentare la quantità totale di terreno nella piastra, dividere gli organoidi tra più piastre di coltura cellulare per tenere il passo con la loro crescita, o anche regolare la timeline per gli esperimenti.
In molti modi, gli organoidi sono un modo inefficiente di condurre ricerche sul cancro. Coinvolgono lunghe scale temporali e sono costosi e pesanti in termini di risorse rispetto alla cultura della sfera GBM. Tuttavia, rispetto agli xenotrapianti derivati dal paziente, un metodo alternativo per ricreare la diversità cellulare e microambientale, sono più semplici, meno costosi e controllabili. La selezione di quando utilizzare al meglio gli organoidi è importante per i ricercatori sul cancro. Non sono destinati a sostituire la sfera tradizionale o la cultura aderente e non a sostituire i modelli di xenotrapianto. Gli organoidi possono, se applicati alla giusta domanda scientifica, combinare i benefici di entrambi questi sistemi e possono permetterci di osservare la biologia delle cellule tumorali che altrimenti rimarrebbero nascoste. La comunità scientifica sta solo iniziando a capire quali opportunità di apprendimento offrono gli organoidi, ma è chiaro che saranno uno strumento inestimabile in futuro per comprendere la complessa biologia del GBM.
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Vorremmo ringraziare il Dr. Justin Lathia per i suoi preziosi consigli e il suo continuo supporto. Ringraziamo anche Katrina Fife, Lisa Wallace e Maya Camhi per il loro eccellente supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
Riferimenti
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7(2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416(2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322(2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255(2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101(2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon