Method Article
שמירה על המגוון התאי של גליובלסטומה אנושית Ex vivo באמצעות תרבית אורגנואידית תלת-ממדית
In This Article
Summary
במאמר זה אנו מתארים שיטה ליצירת אורגנואידים של גליובלסטומה (GBM) מדגימות של מטופלים ראשוניים או מתרביות תאים שמקורן בחולה, ושמירה עליהם עד לבגרות. אורגנואידים אלה של GBM מכילים אוכלוסיות תאים מגוונות מבחינה פנוטיפית ויוצרים מחדש מיקרו-סביבה של גידולים ex vivo.
Abstract
גליובלסטומה (GBM) היא סרטן המוח הממאיר הראשוני השכיח ביותר עם פרוגנוזה גרועה ביותר. מגוון תאי ומולקולרי תוך-גידולי, כמו גם אינטראקציות מורכבות בין מיקרו-סביבה של גידולים, יכולים להפוך את מציאת הטיפולים היעילים לאתגר. שיטות מסורתיות של תרבות דבק או כדור יכולות להסוות מורכבויות כאלה, בעוד שתרבות אורגנואידית תלת-ממדית יכולה לשחזר שיפועים מיקרו-סביבתיים אזוריים. אורגנואידים הם שיטה של תרבית GBM תלת-ממדית המחקה טוב יותר את ארכיטקטורת הגידול של המטופלים, מכילה אוכלוסיות תאים מגוונות מבחינה פנוטיפית, ויכולה לשמש לניסויים בתפוקה בינונית. למרות שתרבות אורגנואידית תלת-ממדית היא מייגעת וגוזלת זמן רב יותר בהשוואה לתרבות המסורתית, היא מציעה יתרונות ייחודיים ויכולה לשמש לגישור על הפער בין מערכות in vitro ו-in vivo הנוכחיות. אורגנואידים ביססו את עצמם ככלים יקרי ערך בארסנל של ביולוגים של סרטן כדי להבין טוב יותר את התנהגות הגידול ואת מנגנוני העמידות, והיישומים שלהם רק ממשיכים לגדול. כאן, פרטים מסופקים על שיטות ליצירה ושמירה על אורגנואידים GBM. מתוארות גם הוראות כיצד לבצע הטבעה וחיתוך של דגימות אורגנואידים תוך שימוש בטכניקות של הטבעה קפואה ושל פרפין, כמו גם המלצות לפרוטוקולים של אימונוהיסטוכימיה ואימונופלואורסצנציה על מקטעים אורגנואידיים, ומדידה של הכדאיות הכוללת של תאים אורגנואידיים.
Introduction
גליובלסטומה (GBM) היא הגידול העיקרי השכיח ביותר במוח עם פרוגנוזה קודרת של כ -15 חודשים מאבחון1. טיפולים יעילים במחקרים פרה-קליניים יכולים לעתים קרובות להיות יעילים בצורה גרועה בחולים 2,3. תגובה קלינית ירודה מיוחסת לגורמים רבים, כולל ההטרוגניות המיקרו-סביבתית של GBM ואינטראקציות פנים-טיפוליות מורכבות. אלה יכולים להיות קשים לשחזור בסביבת המעבדה עם שיטות מסורתיות של תרבית דבק או כדור4. נוכחות של תת-קבוצה של תאי גזע סרטניים המתחדשים בעצמם (CSCs) בתוך GBM עשויה גם היא לתרום למורכבות זו 5,6. CSCs חיוניים להתפשטות הגידול ולשמירה על צמיחת הגידול על ידי קידום אנגיוגנזה פעילה, פלישת סרטן ועמידות לטיפולים כולל קרינה 7,8,9. תאי CSCs אינם מפוזרים באופן אחיד בין גידולים, אלא מועשרים בתוך מיקרו-סביבה ספציפית, כולל נישה פריווסקולרית ואזורים פרינקריטיים, שכל אחד מהם מספק ויסות מולקולרי מובהק של מצבי התאים שלהם 10,11,12,13,14. CSCs אינם נמענים פסיביים של רמזים מיקרו-סביבתיים, אלא בעלי יכולת לעצב מחדש את המיקרו-סביבה שלהם 7,15,16. המיקרו-סביבה של CSC יכולה לקדם תחזוקה של מצב תאי גזע בתגובה ללחצים כגון מחסור בחומרים מזינים, pH והיפוקסיה17,18,19,20, מה שמרמז על החשיבות של תנאים אלה במערכת מודל. לפיכך, שחזור של המיקרו-סביבה התאית המגוונת בתוך גידולים הוא קריטי להבנת העמידות הטיפולית ולזיהוי טיפולים חדשניים.
תרבות התלת מימד עלתה בפופולריות בשנים האחרונות21,22. אורגנואידים שימשו בסוגים אחרים של סרטן, והמטרה העיקרית של שמירה על תאים כאורגנואידים היא לאפשר צמיחה של אוכלוסיות תאים הטרוגניות (שרבות מהן עשויות בדרך כלל להיות מחוץ לתרבית כדור הומוגנית יותר) ומגוון מרחבי, הנתפס כמיקרו-סביבה אזורית של גידולים עם ספציפיות גנטית 4,23,24,25,26 . ישנן שיטות רבות לתרבית תלת מימדית של תאים סרטניים, שלכל אחת מהן יתרונות וחסרונות27,28,29. התרבות האורגנואידית לא נועדה להוות תחליף לתרבות החסידות או המרחב המסורתית. הוא משמש בצורה הטובה ביותר כטכניקה משלימה לשיטות דו-ממדיות כאשר יש שאלות ספציפיות שבהן האינטראקציה בין מיקרו-סביבה של תאים לתגובות תאי גידול היא קריטית.
מאמר זה מתאר שיטות אמינות וחוזרות על עצמן ליצירת אורגנואידים של GBM מדגימות מטופלים ראשוניות או מתרביות שמקורן בחולה. אנו מתייחסים לשתי מטרות שונות לתרבית אורגנואידית תלת-ממדית: (1) הקמת אורגנואידים מרקמת המטופל הראשונית, עם פוטנציאל השתלה מקסימלי ללא קשר לאחידות, או (2) גידול אורגנואידים אחידים לשימוש ניסיוני כמותי יותר. בעת הקמת דגימה ראשונית כאורגנואידים, אין צורך לסנן תאים בודדים או לספור תאים, מכיוון ששמירה על מספר וסוגי תאים מרביים כדי לקבוע את התרבית הראשונית היא בראש סדר העדיפויות. עם זאת, כאשר מגדלים אורגנואידים לניסויים השוואתיים, יש צורך בסינון חד-תאי ובספירת תאים כדי להבטיח שהאורגנואידים המשוכפלים יהיו ברי השוואה לצורך עקביות ניסויית. פרוטוקול זה מפרט כיצד להקים תרביות אורגנואידים וליצור אורגנואידים אחידים, כמו גם שיטות מעודנות להטמעה ושימור של אורגנואידים וניסויים סטנדרטיים בתרביות תאים, כולל אימונוהיסטוכימיה, אימונופלואורסצנציה והערכת הכדאיות הכוללת של התאים באורגנואידים GBM.
Protocol
כל השלבים של הפרוטוקולים המפורטים להלן פותחו ונערכו בהתאם לפרוטוקול המועצה לביקורת מוסדית של קליבלנד קליניק (IRB) #2559 ואישור הוועדה המוסדית לבטיחות ביולוגית (IBC) #1711. כדורים ואורגנואידים מתורבתים ב"מדיה נוירובסלית שלמה" (NBMc). ראה טבלה 1 לקבלת הוראות.
1. הכנת תבניות אורגנואידיות
- מורידים את נייר השעווה מיריעת הפרפילם (בגודל של כ-4X4 ס"מ) ומניחים אותו בין שתי צלחות סטריליות של תגובת שרשרת פולימראז (PCR) בגודל 96 בארות.
- בצעו את השלבים האלה במכסה המנוע התרבותי והקפידו במיוחד לשמור על "החלק הפנימי" של הפרפילם (הצד המכוסה על ידי הנייר) נקי. הצד הנקי הזה אמור להפוך את הקעורה של הכניסות.
- הפעילו לחץ אחיד על צלחת ה-PCR העליונה בעלת 96 הבארות כדי ליצור גומות חן קטנות בפרפילם. המטרה היא שגומות החן יהיו בעומק של כ-2 מ"מ מבלי ליצור חורים בפרפילם.
- הפרידו בעדינות בין שתי צלחות ה-PCR בעלות 96 הבארות. הפרפילם הגומה יידבק לצלחת העליונה. מניחים אותו על קרח יבש למשך כ-30 שניות.
- לאחר שהפרפילם היה על קרח יבש במשך 30 שניות, השתמש במלקחיים סטריליים כדי למשוך את הפרפילם מצלחת ה-PCR העליונה בעלת 96 הבארות.
- בעת הסרת הפרפילם, השתמש בתנועה מהירה במקום להיות מאוד "זהיר". פרפילם קפוא קל יותר להסרה מאשר פרפילם מחומם, מה שעלול לגרום לגומות החן להתהפך.
- מניחים את תבנית הפרפילם שהושלמה בתבנית מכוסה וסטרילית של תרבית תאים בקוטר 10 ס"מ. ניתן להכין תבניות מראש ולאחסן אותן אם שומרים על סטריליות.
2. מקרודיסקציה של דגימת רקמת המטופל
- בצלחת תרבית סטרילית (לוחות תרבית תאים בגודל 10 ס"מ), השתמש בשני סכיני גילוח סטריליים כדי לטחון דק את דגימת המטופל תוך הפעלת לחץ אחיד.
הערה: טחינת הדגימה היא הקלה ביותר עם כ-500 μL של NBMc על צלחת התרבית. נסו עם סכיני גילוח לטחון חתיכות בצורה עדינה ככל האפשר; באופן אידיאלי, חתיכות בודדות הן 1 מ"מ3 או קטן יותר. - העבירו את חלקי הגידול הטחונים דק לצינור צנטריפוגה של 15 מ"ל באמצעות קצה פיפטה p1000 חתוך.
הערה: בכל פעם שמטפלים באורגנואידים, חשוב להשתמש רק בקצוות פיפטה חתוכים p1000. ניתן לחתוך אותם באמצעות סכין גילוח חדה לגודל הפתח הרצוי (בין 5 ל-8 מ"מ בערך) ולאוטוקלב. - הוסף 2 מ"ל של תמיסת ניתוק תאים בטמפרטורת החדר (RT) (טבלת חומרים) והנח אותה בחממה של 37 מעלות צלזיוס, 5% CO2 למשך כ -10 דקות.
הערה: יש להתבונן ולערבב כל מספר דקות. תמיסות או דגימות מסוימות של ניתוק תאים עשויות להזדקק לזמני דגירה משתנים. אם מופיע גושים, מה שיכול להצביע על שחרור DNA עקב תזה של תאים, המשך לשלב הבא באופן מיידי. - הוסף 8 מ"ל של מדיה NBMc כדי לנטרל את תמיסת ניתוק התא, וסובב במשך 3 דקות ב 65 x גרם.
- לשאוף את supernatant ולהשהות את הרקמה ב 1-2 מ"ל של NBMc.
3. יצירת אורגנואידים מרקמת המטופל הראשוני
הערה: המטרה בעת ייצור אורגנואידים מרקמת המטופל הראשונית היא ליצור תרבית תלת מימדית. אל תסנן תאים בודדים או תספור תאים, אך שמור על עומס התאים הראשוני אחיד ככל האפשר באמצעות בדיקה חזותית. זה נורמלי יש הטרוגניות בצמיחה והקמת אורגנואידים ראשוניים. כל אורגנואיד יהיה בנפח של 20 μL (16 μL של מטריצה חוץ-תאית עשירה בלמינין (lrECM) ו-4 μL של רקמה התלויה ב-NBMc, משלב 2.5). ניתן להתאים את ההוראות למספר האורגנואידים המיועדים; המטרה היא ליצור בדרך כלל כ-20-30 אורגנואידים מדגימות ראשוניות של מטופלים.
- בתוך דלי קרח או בלוק קר, מניחים את lrECM וצינור צנטריפוגה קטן. הכניסו את הכמות המתאימה של lrECM (16 μL x X מספר האורגנואידים המיועדים) לתוך צינור הצנטריפוגה הקטן.
- הוסף נפח מתאים של תרחיף רקמות משלב 2.5 (4 μL x מספר האורגנואידים המיועדים) לצינור הצנטריפוגה על הקרח.
- בזהירות פיפטה 20 μL של תערובת lrECM / תלייה התא על תבניות parafilm; זה ייצור טיפה דמוית פנינה.
- הקפד לערבב היטב את תערובת ההשעיה lrECM/תאים; התאים נוטים להתיישב בקלות בתוך lrECM, וכתוצאה מכך אורגנואידים הטרוגניים.
- יש לשמור את תערובת ה-lrECM/תרחיף התאים על קרח. אם lrECM מתחמם, הוא יכול להתפלמר ולפגוע בהיווצרות אורגנואידים. הקפידו לקרר את קצה הפיפטה כל שניים-שלושה אורגנואידים כדי למנוע פילמור lrECM. אין להכניס בועות אוויר לאורגנואידים (הימנעו מ"דחיפה כפולה" של הפיפטה).
- לאחר שהמספר הרצוי של אורגנואידים מועברים על תבנית פרפילם בצלחת תרבית תאים בקוטר 10 ס"מ, מכסים במכסה צלחת ודוגרים באינקובטור של תרבית תאים בטמפרטורה של 37 מעלות צלזיוס, 5% CO 2 למשך1-2 שעות.
- לאחר שהאורגנואידים מתמצקים, השתמשו במדיית NBMc כדי לשטוף אותם בעדינות מתבנית הפרפילם ולתוך צלחת תרבית חדשה וסטרילית באורך 10 ס"מ עם 20 מ"ל של NBMc בסך הכל. שימוש בקצה p1000 פועל בצורה הטובה ביותר כדי לשטוף את האורגנואידים מהתבנית; הם יחליקו בעדינות.
הערה: כאשר אורגנואידים נשטפים מהתבניות לתוך לוחות תרבית תאים, הם אמורים להיות גלויים בתקשורת ככדורים ורודים קטנים. אם נראה שהאורגנואידים התפרקו או התנפצו בתקשורת, הדבר מצביע על בעיה מוקדמת יותר עם lrECM שעברו פולימריזציה, ואורגנואידים עשויים עדיין לגדול אך סביר מאוד שלא יהיו אחידים בגודלם. - מניחים את צלחת התרבית בקוטר 10 ס"מ באינקובטור של תרבית תאים בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 (ללא רעידות) למשך 4 ימים.
הערה: הנחת אורגנואידים על שייקר מסלולי בימים הראשונים עלולה לגרום להם להתפרק. ודא שהם לא רועדים עד יום 4. - לאחר 4 ימים, להחליף את התקשורת ולהניח על שייקר מסלול ב 80 סל"ד באינקובטור תרבית תאים ב 37 מעלות צלזיוס, 5% CO2.
- החלפת מדיה עם אורגנואידים לא בוגרים היא מאתגרת מכיוון שקשה לדמיין אותם. הטה את צלחת תרבית התאים והמתן לפחות 20 שניות; האורגנואידים ישקעו בתחתית ויאפשרו להסיר את המדיה מלמעלה עם פיפטה של או פלסטיק 10-20 מ"ל לאט.
- שימו לב היטב לאוסף האורגנואידים בתחתית; אם הם נראים מעוררים עם כוח של הסרת מדיה, עדיף לעצור ולאפשר להם להתיישב מחדש. ככל שהאורגנואידים מתבגרים וקל יותר לדמיין אותם, תהליך זה הופך להיות פחות ניואנסים.
הערה: לפעמים, הצבת פיסת נייר כהה מתחת לצלחת תרבית התאים יכולה לעזור לדמיין אורגנואידים לא בשלים. מומלץ לא להשתמש פיפטה פסטר עם שאיבה ואקום כדי להסיר מדיה כפי שהוא קל מאוד עבור אורגנואידים להישאב ולאבד בדרך זו. - כאשר אורגנואידים נוצרים לראשונה, הם אינם צורכים מדיה באותה מהירות כמו אורגנואידים בוגרים. החל מ-50% חילופי מדיה מפחיתה את השימוש המיותר במדיה ומפחיתה את הסיכוי לפגוע בטעות באורגנואידים חדשים או לשאוף אליהם במהלך תהליך חילופי המדיה.
4. יצירת אורגנואידים מתחום GBM מבוסס, חסיד או תרבות אורגנואידית
הערה: המטרה כאן היא ליצור אורגנואידים אחידים בגודלם ובכמות התאים לשימוש בניסויים השוואתיים, לכן השתמש במסנן חד-תאי וספור תאים כדי להבטיח זאת.
- הכנת השעיה של תא בודד מתרבית כדור GBM.
הערה: תרביות כדור של תאי GBM נשמרות במדיה NBMc.- מניחים כדורים בצינור צנטריפוגה של 15 מ"ל ומסתובבים בגודל 120 x גרם למשך 5 דקות.
- הסר את supernatant ולהוסיף 2 מ"ל של תמיסת ניתוק תאי RT. מניחים בחממה של 37 מעלות צלזיוס למשך 3 דקות.
- הוסף 8 מ"ל של מדיית NBMc כדי לנטרל את תמיסת ניתוק התא. מסננים דרך מסננת חד-תאית (70 מיקרומטר) ומסתובבים במשך 5 דקות ב-120 x גרם.
- הסר את supernatant מן הצינור להשעות את התאים הנותרים ב ~ 1 מ"ל של NBMc. לספור את התאים (באמצעות כתם impermeant התא) ולדלג לשלב 4.4.
- הכנת השעיה של תא בודד מתרבית דבק GBM.
- הסר את המדיה המשומשת מהצלחת, הוסף 2 מ"ל של תמיסת ניתוק תאי RT לצלחת, והניח באינקובטור של 37 מעלות צלזיוס למשך 3 דקות.
- אשרו תחת המיקרוסקופ שהתאים מנותקים מהצלחת.
- הוסף 8 מ"ל של מדיית NBMc כדי לנטרל תמיסת ניתוק תאים. מסננים דרך מסננת חד-תאית (70 מיקרומטר).
הערה: מאמץ של תא בודד הוא אופציונלי בעת עבודה עם תרבית דבק. - סובב במשך 5 דקות ב 120 x גרם. הסר את supernatant מן הצינור להשעות את התאים הנותרים ב ~ 1 מ"ל של NBMc. לספור את התאים (באמצעות כתם impermeant התא) ולדלג לשלב 4.4.
- הכנת השעיה של תא בודד מתרבית אורגנואידית GBM.
- מעבירים את האורגנואידים בעזרת קצה פיפטה p1000 חתוך לצלחת תרבית בקוטר 10 ס"מ ומסירים בזהירות כמה שיותר שאריות מדיה.
- באמצעות שני סכיני גילוח סטריליים, טחנו בזהירות אורגנואידים דק. עם קצה p1000 החתוך, העבר את האורגנואידים הטחונים לצינור צנטריפוגה של 15 מ"ל והוסף ~ 2-3 מ"ל של מדיה NBMc.
- סובבו ב-120X10 גרם למשך 3 דקות והסירו את הסופר-נטנט (מומלץ להשתמש בקצה פיפטה ולא בשאיבה ואקום לחלק זה).
- הוסף 2 מ"ל של תמיסת ניתוק תאים קרים למשך 10 דקות.
הערה: יש להשתמש בתמיסת ניתוק תאים ישירות מ-4 מעלות צלזיוס, ולא לחמם תחילה. נראה כי זה מרכך את כל המטריגל שנותר ומסייע בהתאוששות התאים. - לאחר מכן עוברים לחממה של 37 מעלות צלזיוס למשך 10-20 דקות, מתבוננים ומערבבים כל כמה דקות. אם מופיע גושים, מה שיכול להצביע על תזה של תאים, המשך לשלב הבא באופן מיידי.
- הוסף 8 מ"ל של מדיית NBMc כדי לדלל את תמיסת ניתוק התא. מסננים דרך מסננת חד-תאית (70 מיקרומטר) ומסתובבים במשך 5 דקות ב-120 x גרם.
- הסר את supernatant מן הצינור להשעות את התאים הנותרים ב ~ 1 מ"ל של NBMc. לספור את התאים (באמצעות כתם impermeant התא) ולהמשיך לשלב 4.4.
- ביצוע אורגנואידים מתרחיף חד-תאי
- בתוך דלי קרח או בלוק קר, מניחים את lrECM וצינור צנטריפוגה קטן. הכניסו את הכמות המתאימה של lrECM (16 μL x X מספר האורגנואידים המיועדים) לתוך צינור הצנטריפוגה הקטן.
- צור תערובת של תאים בנפח כולל (4 μL x X מספר האורגנואידים המיועדים) שתכיל 20,000 תאים/אורגנואיד והוסף את זה לצינור צנטריפוגה קטן עם lrECM על קרח.
- בזהירות פיפטה 20 μL של תערובת lrECM / תלייה התא על תבניות parafilm; זה ייצור טיפה דמוית פנינה.
- הקפידו לערבב היטב את תערובת ה-lrECM/תרחיף התא, שכן התאים נוטים להתיישב בקלות בתוך ה-lrECM, והתוצאה תהיה אורגנואידים הטרוגניים.
- יש לשמור את תערובת ה-lrECM/תרחיף התאים על קרח. אם lrECM מתחמם, הוא יכול להתפלמר ולפגוע בהיווצרות אורגנואידים.
- הקפידו לקרר את קצה הפיפטה כל שניים-שלושה אורגנואידים כדי למנוע פילמור lrECM. אין להכניס בועות אוויר לאורגנואידים (הימנעו מ"דחיפה כפולה" של קצה הפיפטה).
- לאחר שהמספר הרצוי של אורגנואידים מועברים על תבנית פרפילם בצלחת תרבית של 10 ס"מ, דוגרים בטמפרטורה של 37 מעלות צלזיוס למשך 1-2 שעות באינקובטור של תרבית תאים.
- לאחר שהאורגנואידים מתמצקים, השתמשו במדיית NBMc כדי לשטוף אותם בעדינות מתבנית הפרפילם ולצלחת תרבית חדשה וסטרילית באורך 10 ס"מ עם 20 מ"ל של NBMc בסך הכל. שימוש בקצה p1000 פועל בצורה הטובה ביותר לשטיפת אורגנואידים מהתבנית; הם יחליקו בעדינות.
הערה: מומלץ כ-15-20 אורגנואידים לכל צלחת תרבית של 10 ס"מ. - מניחים את צלחת התרבית בקוטר 10 ס"מ באינקובטור (ללא רעד) למשך 4 ימים.
- לאחר 4 ימים, להחליף את התקשורת ולהניח על שייקר מסלול ב 80 סל"ד באינקובטור תרבית התא. החלף מדיה כל 2-3 ימים לאחר מכן.
- החלפת מדיה עם אורגנואידים לא בוגרים היא מאתגרת מכיוון שקשה לדמיין אותם. הטה את צלחת תרבית התאים והמתן לפחות 20 שניות; האורגנואידים ישקעו בתחתית ויאפשרו להסיר את המדיה מלמעלה עם פיפטה זכוכית נפתחת גדולה באיטיות.
- שימו לב היטב לאוסף האורגנואידים בתחתית; אם הם נראים מעוררים עם כוח ההסרה התקשורתית, השתהו ואפשרו להם להתיישב מחדש. ככל שהאורגנואידים מתבגרים וקל יותר לדמיין אותם, תהליך זה הופך להיות פחות ניואנסים.
הערה: לפעמים, הצבת פיסת נייר כהה מתחת לצלחת תרבית התאים יכולה לעזור לדמיין אורגנואידים לא בשלים. אין להשתמש בפיפטת פסטר עם שאיבה ואקום להסרת מדיה מכיוון שקל מאוד לשאוב את האורגנואידים ולאבד אותם בדרך זו. - כאשר אורגנואידים נוצרים לראשונה, הם אינם צורכים מדיה באותה מהירות כמו אורגנואידים בוגרים. התחל עם 50% חילופי מדיה כדי להפחית את השימוש המיותר במדיה ולהפחית את הסיכוי לפגוע בטעות או לשאוף אורגנואידים חדשים במהלך תהליך חילופי המדיה.
5. קריואמבינדינג
- הניחו כל אורגנואיד בצינור נפרד של 1.5 מ"ל (באמצעות קצה p1000 חתוך) המכיל 1 מ"ל של 4% פרפורמלדהיד (PFA). יש לאחסן אורגנואידים למשך הלילה בטמפרטורה של 4°C. אם מטמיעים אורגנואידים בפרפין, המשך לסעיף 6.
- לאחר קיבוע בן לילה ב-4% PFA, יש לשטוף את האורגנואידים ב-1x תמיסת מלח (PBS) שלוש פעמים.
- מעבירים את האורגנואיד לצינור חדש של 1.5 מ"ל (באמצעות קצה פיפטה חתך p1000) המכיל 1 מ"ל של 30% סוכרוז במים ומאחסנים בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
- הוסיפו כמות קטנה (בדרך כלל 1-2 מ"ל) של תרכובת טמפרטורת חיתוך אופטימלית (OCT) לקריומולד, המכסה את החלק התחתון וממלאת כ-1/3 עד 1/2 מעומק התבנית.
- מעבירים אורגנואיד יחיד לקריומולד באמצעות קצה פיפטה p1000 חתוך. זה יגרום לכך שחלק מהתקשורת תעבור עם האורגנואיד, וזה בלתי נמנע. השתמש בקצה פיפטה קטן יותר כדי להסיר בזהירות את המדיה שמסביב מבלי להפריע לאורגנואיד.
הערה: זה יכול להיות קשה לדמיין, אבל pipetting איטי ידגים הבדל ברור בצפיפויות בין מדיה OCT, אז זה נעשה "על ידי תחושה" במידה מסוימת). - מניחים את הקריומולד על מגש של קרח יבש. OCT יתחיל לקפוא, ויהפוך אטום בתהליך.
- הוסף OCT נוסף כדי לכסות לחלוטין את האורגנואיד, מילוי שאר נפח של cryomold. בלוקים ניתן לאחסן ב -20 °C לאחסון לטווח קצר במשך מספר ימים או ב -80 °C לאחסון לטווח ארוך ללא הגבלת זמן.
6. הטמעת פרפין
- מיין אורגנואידים לפי גודל (אורגנואידים קטנים הם מתחת ל -3 מ"מ, אורגנואידים גדולים הם מעל 3 מ"מ). מעבירים כל אורגנואיד לקסטת היסטולוגיה באמצעות קצה פיפטה p1000 חתוך ומעבדים לשעוות פרפין לפי טבלה 2 או טבלה 3.
הערה: הגודל/התצורה של קלטת ההיסטולוגיה תלויים במשתמש. - מעבירים אורגנואידים מהקסטות להטמעת תבניות עם 1-2 מ"ל של שעוות פרפין מומסת ומצננים אותה עד שהשעווה היא חצי מוצקה.
- לאחר שהשעווה התמצקה חלקית, הוסיפו עוד שעווה לחלק העליון של התבנית. מניחים את החלק העליון של הקלטת המסומנת מעל התבנית ומעבירים אותה לצלחת קרה. ממשיכים להתקרר עד שהשעווה מוצקה לחלוטין.
- כאשר השעווה התמצקה, חתכו את הבלוק באמצעות מיקרוטום. לחלופין, יש לאחסן ב-RT או ב-4°C לניתוח מאוחר יותר.
7. אימונופלואורסצנציה (IF)
- יש לבצע דה-פרפין ולייבש מחדש מקטעי רקמה משובצים בפרפין בנפח 5-12 מיקרומטר באמצעות צלחת צביעה בשקופיות, בהתאם לשלבים הבאים.
הערה: אם אתה משתמש במקטעים מאורגנואידים מוטבעים ב- OCT, אנו ממליצים להשתמש במקטעים של 12 מיקרומטר. הסר את ה-OCT על-ידי ניעור החלקה ב-PBS למשך 30 דקות. דלג לשלב 7.2.- דגירה במשך 5 דקות בקסילן. חזור על כך פעמיים נוספות. לאחר מכן לדגור במשך 10 דקות ב 100% אתנול. חזור על כך פעם נוספת.
- דגירה במשך 10 דקות ב 95% אתנול. חזרו על הפעולה פעם נוספת. לשטוף את החלקים במים מזוקקים במשך 5 דקות, פעמיים.
- לחשיפת אנטיגן, טבלו את המסכה בתמיסת הסרת מסיכה ציטראט אחת (Table of Materials) והכניסו למיקרוגל בטמפרטורת רתיחה-משנה למשך 10 דקות. הקפד לא לתת את הפתרון להרתיח.
הערה: הדבר מושג בצורה הטובה ביותר אם מכניסים אותו בתחילה למיקרוגל במשך ~2 דקות עד לרתיחה, ולאחר מכן מורידים את ההספק וצופים כדי להבטיח שהתמיסה לא תרתח. טמפרטורת החשיפה המועדפת היא קצת מתחת ל -100 מעלות צלזיוס, באופן אידיאלי 98 מעלות צלזיוס. - תנו לשקופיות להתקרר למשך 30 דקות ב-RT בתמיסת חשיפת ציטראט אחת.
הערה: זהו אותו פתרון ציטראט 1x; אין צורך להחליף את הפתרון בשלב זה. - שטפו את המגלשות במים מזוקקים במשך 5 דקות, פעמיים.
- שטפו את השקופיות במאגר TBST 1x (מלח טריס עם 0.1% טווין 20) למשך 5 דקות.
- הסר את השקופיות מ- TBST וייבש אותן בזהירות סביב מקטעי רקמות באמצעות מגבון ניקוי מעבדה תוך הקפדה לא לתת למקטע הרקמה להתייבש. לאחר שהמגלשה יבשה מספיק, הקיפו את חלקי הרקמה בעט מחסום הידרופובי.
- חסום כל מקטע עם 100-400 μL של 10% תמיסת חסימת סרום למשך שעה אחת ב- RT. בחר את תמיסת חסימת הסרום בהתבסס על הנוגדן המשני. לדוגמה, אם אתה משתמש בנוגדן משני המיוצר בחמור, השתמש בסרום חמור רגיל של 10% ב- 1x TBST.
- הסר את התמיסה החוסמת ולאחר מכן הוסף 100-400 μL של נוגדן ראשוני מדולל לריכוז הרצוי בתמיסת החסימה.
- ב 4 מעלות צלזיוס, לדגור את החלקים עם הנוגדן העיקרי לילה.
- הסר את תמיסת הנוגדנים העיקרית ושטוף את השקופיות ב- 1x TBST במשך 5 דקות, שלוש פעמים.
- הוסף 100-400 μL של נוגדן משני (דילול 1:1000 בתמיסת חסימה, או לפי הוראות היצרן) לכל מקטע ודגרה למשך 1.5 שעות ב- RT.
- שטפו את השקופיות ב-TBST אחד למשך 5 דקות, פעמיים. לאחר מכן לשטוף את השקופיות ב 1x PBS במשך 5 דקות.
- הסר את השקופיות מ- PBS וייבש אותן סביב מקטעי רקמות באמצעות מגבון ניקוי מעבדה. הוסיפו כמה טיפות של נוזל ריפוי והרכבו בזהירות כיסוי זכוכית. לאחר שהמגלשות יבשות, יש לאחסן בטמפרטורה של -20°C מוגנת מפני אור עד שהיא מוכנה להדמיה.
8. אימונוהיסטוכימיה
- יש לבצע דה-פרפין ולייבש מחדש את מקטעי הרקמה המשובצים בפרפין באמצעות צלחת צביעת שקופיות, בהתאם לשלבים הבאים.
הערה: אם אתה משתמש בקטעים מאורגנואידים המוטבעים ב- OCT, הסר את OCT על-ידי ניעור השקופית ב- PBS למשך 30 דקות. דלג לשלב 8.2.- דגירה במשך 5 דקות בקסילן. חזרו על הפעולה פעמיים נוספות.
- דגירה במשך 10 דקות ב 100% אתנול. חזרו על הפעולה פעם נוספת.
- דגירה במשך 10 דקות ב 95% אתנול. חזרו על הפעולה פעם נוספת.
- לשטוף חלקים במים מזוקקים במשך 5 דקות, פעמיים.
- לחשיפת אנטיגן, יש לטבול בתמיסת הסרת מסיכה ציטראט אחת ובמיקרוגל בטמפרטורת תת-רתיחה למשך 10 דקות. הקפד לא לתת את הפתרון להרתיח.
- תנו לשקופיות להתקרר במשך 30 דקות ב-RT בתמיסת חשיפת ציטראט אחת.
- לשטוף את המגלשות במשך 5 דקות במים מזוקקים, שלוש פעמים.
- דגרו את השקופיות במשך 10 דקות ב-3% מי חמצן.
- שטפו את המגלשות במשך 5 דקות במים מזוקקים פעמיים.
- לשטוף את השקופיות במשך 5 דקות ב 1x TBST.
- הסר את השקופיות מ- 1x TBST ולאחר מכן השתמש בפינה של מגבון ניקוי מעבדה כדי לייבש בזהירות סביב מקטעי רקמות.
- הקיפו את חלקי הרקמה בעט מחסום הידרופובי לאחר שהמגלשה יבשה.
- מקם 100-400 μL של תמיסת החסימה על כל מקטע בתוך מעגל עט המחסום ההידרופובי ב- RT למשך שעה אחת. יש להשתמש בסרום 10% חמור רגיל (NDS) או באלבומין בסרום בקר (BSA) מדולל ב-TBST אחד.
- לאחר מכן, הסר את פתרון החסימה והוסף 100-400 μL של הנוגדן העיקרי לכל סעיף. יש לדלל נוגדן ראשוני זה לריכוז הרצוי באמצעות דילול היצרן המתאים.
- לדגום את החלקים ב 4 °C (54 °F) לילה. הסר את תמיסת הנוגדנים העיקרית ושטוף את השקופיות ב- 1x TBST במשך 5 דקות, שלוש פעמים.
- הוסף 100-400 μL של מגיב זיהוי IHC לכל מקטע ודגרה במשך שעה אחת ב- RT. בחר את מגיב זיהוי IHC בהתאם לנוגדן הראשי.
- יש לשטוף כל חלק עם 1x TBST במשך 5 דקות, פעמיים, ואחריו 1x PBS במשך 5 דקות פעם אחת.
- הכן פתרון 3,3-Diaminobenzidine (DAB) בהתאם להוראות היצרן. הוסף 100-400 μL של תמיסת DAB לכל מקטע רקמה ועקוב מקרוב תחת מיקרוסקופ. בין 1-10 דקות יספק עוצמת מכתים מקובלת; הקפד לציין הפעם ולשמור על עקביות עבור כל מקטעי הרקמות.
- לאחר שמגיעים לעוצמת הכתמים הרצויה, יש לטבול את המגלשות במים מזוקקים.
- בצע כתם נגדי של המטוקסילין והתייבשות החלקה להרכבה בהתאם להוראות בטבלה 4.
- הסר את השקופית מתחליף הקסילן (טבלת חומרים) ונגב נוזל נוסף סביב חלק הרקמה באמצעות מגבון ניקוי מעבדה. יש להשתמש בכמות קטנה של מדיום הרכבה קבוע כדי להרכיב את הכיסוי על מקטע הרקמה ולאפשר לו להתייבש.
9. מדידת הכדאיות הכוללת של התא
- העבירו כל אורגנואיד לצינור של 2 מ"ל, ובעזרת קצה פיפטה קטן, הסירו בזהירות את כל המדיות העודפות סביב האורגנואיד (ראו איור 3 עבור הסכימה של הליך זה).
הערה: מבחני כדאיות תאים חייבים להתבצע עם אורגנואידים שנוצרו עם מספר זהה של תאים. ניסוי זה לא צריך להתבצע על אורגנואידים שנעשו ישירות מדגימות חולים מניתוח, מחיתוך אורגנואידים שנוצרו על ידי אלרדי, או מקרים אחרים שבהם תאים בודדים לא סוננו ונספרו. - הכן את מגיב בדיקת הכדאיות של התא הזוהר ואת 1x PBS ביחס של 1:1 והוסף 500 μL לכל צינור.
- השתמש בקצה פיפטה p1000 כדי לבצע פיפטה אגרסיבית למעלה ולמטה כדי לפרק את האורגנואיד ולהניח למשך 5 דקות. האורגנואיד צריך להיות קצת מנותק ורך יותר עד עכשיו; חזור על ערבוב עם קצה פיפטה P1000 שוב.
- המטרה היא שיהיה נפח כולל של 100 μL לכל באר של צלחת 96 באר. הוסף 25 μL של התערובת משלב 9.3 (יהיה מספיק עבור שכפולים טכניים מרובים) ולהוסיף 75 μL של בדיקת כדאיות תאים זוהרים שנותרו ותערובת PBS.
- מניחים את הצלחת על שייקר למשך 2 דקות ולאחר מכן דגירה במשך 20 דקות ב- RT.
- קרא את הלוח באמצעות הגדרת לומינסנציה בקורא צלחות ואסוף את הנתונים ( ראו איור 4).
תוצאות
איור 1 מראה צמיחה אורגנואידית מוקדמת הנראית באמצעות מיקרוסקופיית אור בהגדלה של פי 10. איור 1A מראה נדידה ופלישה של תאים בודדים דרך lrECM בתצוגה המרכזית. התאים ימשיכו להתרחב ו'ליישב' את ה-lrECM, והם ייראו צפופים יותר ובסופו של דבר אטומים יותר על ידי בדיקה חזותית. איור 1B מראה כמה אורגנואידים בוגרים (בגיל 7 שבועות) ללא הגדלה, יחסית לגודל של אגורה.
איור 2 מדגים צביעה אימונוהיסטוכימית של אורגנואידים מסוג GBM עבור פוספו-היסטון H3, סמן של התפשטות פעילה. רוב התאים המתרבים מאוד נראים בהיקף האורגנואידי בהשוואה לליבה האורגנואידית. מכתים חיוביים יהיו בעלי מראה חום/נחושת.
איור 3 מתאר את התהליך להומוגניזציה ולמדידה של מספר התא הכולל באורגנואידים של GBM באמצעות בדיקת כדאיות תא זוהר ספציפית לתלת-ממד. בשל המספר הגבוה של תאים הנמצאים באורגנואידים GBM, המבנה האורגנואידי הגדול יותר הומוגני בתחילה על ידי טריטורציה במגיב בדיקה זוהר. לאחר מכן שברים מכלל הליזאט האורגנואידי נטענים לתוך בארות בודדות ומדוללים בריאגנט נוסף של בדיקה זוהרת לפני הדגירה והקריאה על קורא צלחות מתאים מרובה בארות.
איור 4 מייצג נתוני בקרה של DMSO (רכב משותף) עבור אורגנואידים. נתונים מתווכים מדגימים עקביות תוך-אורגנואידית ובין-אורגנואידית. נתוני כדאיות זוהרים בדרך כלל מנורמלים לבקרות עבור כל דגימה בעת יצירת נתוני ניסוי.
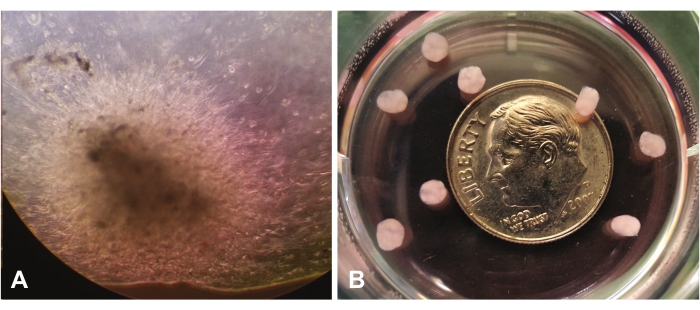
איור 1: מבט דרך מיקרוסקופ אור (10x). (A) צמיחה אורגנואידית מוקדמת המדגימה נדידה/פלישה של תאי GBM לאורך המטריצה החוץ-תאית העשירה בלמינינים. (B) אורגנואידים בוגרים ביחס לגודל של אגורה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
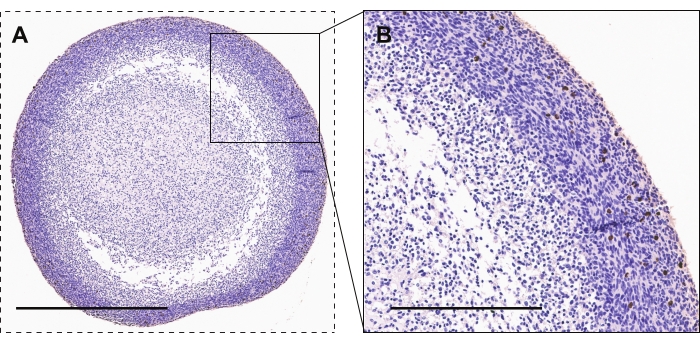
איור 2: אימונוהיסטוכימיה של אורגנואידים GBM. (A, B) אורגנואידים GBM המציגים תאים מוכתמים בפוספו-היסטון H3 לשגשוג פעיל. סרגלי קנה מידה הם 600 מיקרומטר ו-300 מיקרומטר עבור A ו-B, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
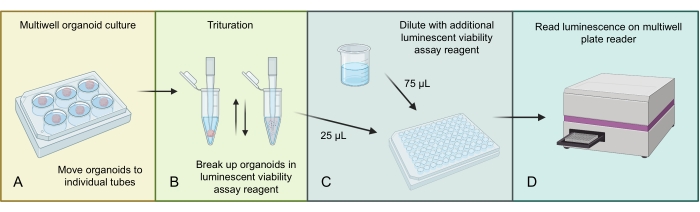
איור 3: פרוטוקול הכדאיות של תאים זוהרים עבור אורגנואידים . (A) להעביר אורגנואידים בודדים לצינורות צנטריפוגות קטנים ולהסיר עודפי מדיה. (B) הוסף 500 μL של 1:1 PBS ותערובת בדיקת כדאיות תאים זוהרת לכל צינור ופיפטה באגרסיביות כדי לפרק את האורגנואיד. (C) הוסף 25 μL של תערובת אורגנואידית זו ו-75 μL של אותה תערובת של 1:1 PBS ובדיקת כדאיות תאים זוהרים לכל באר של צלחת 96 בארות. (D) מניחים על שייקר למשך 2 דקות, ולאחר מכן דגירה למשך 20 דקות ב-RT, ולאחר מכן קוראים לומינסנציה על קורא צלחת. איור שנעשה באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
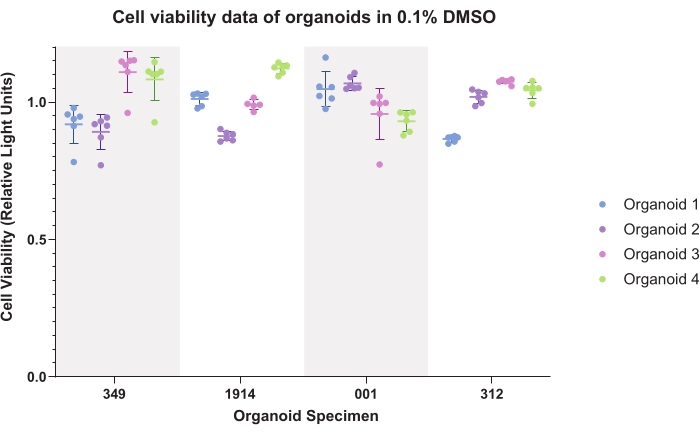
איור 4: כדאיות התא. נתוני כדאיות תאים עבור אורגנואידים ב-0.1% דימתיל סולפוקסיד (DMSO) עבור שישה שכפולים טכניים של ארבעה אורגנואידים עבור ארבע דגימות מטופלים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| רכיב | כמות |
| בינוני נוירובסלי מינוס פנול אדום | 500 מ"ל |
| תוסף B-27 פחות ויטמין A (פי 50) | 10 מ"ל |
| אנטיביוטיקה-אנטי-מיקוטית (100x) | 5 מ"ל |
| נתרן פירובט (100 מ"מ) | 5 מ"ל |
| גלוטמין ב-0.85% NaCl (200 מ"מ) | 5 מ"ל |
| רקומביננטי אנושי FGF בסיסי (250 מיקרוגרם / מ"ל) | 20 מיקרוגרם |
| חלבון EFG אנושי רקומביננטי (250 מיקרוגרם למ"ל) | 20 מיקרוגרם |
| פנול אדום | 500 מיקרון |
טבלה 1: נוסחה שלמה של מדיום נוירובאזלי (NBMc)
| מגיב | זמן |
| 50% אתנול | 3 דק' |
| 75% אתנול | 3 דק' |
| 95% אתנול | 3 דק' |
| 95% אתנול | 4 דק' |
| 100% אתנול | 2 דק' |
| 100% אתנול | 3 דק' |
| 100% אתנול | 4 דק' |
| תחליף קסילן | 2 דק' |
| תחליף קסילן | 3 דק' |
| תחליף קסילן | 4 דק' |
| שעוות פרפין | 15 דק' |
| שעוות פרפין | 15 דק' |
טבלה 2: לוח זמנים לעיבוד אורגנואידים קטנים (בקוטר של פחות מ-3 מ"מ)
| מגיב | זמן |
| 50% אתנול | 6 דק' |
| 75% אתנול | 6 דק' |
| 95% אתנול | 5 דק' |
| 95% אתנול | 8 דק' |
| 100% אתנול | 5 דק' |
| 100% אתנול | 5 דק' |
| 100% אתנול | 8 דק' |
| תחליף קסילן | 5 דק' |
| תחליף קסילן | 5 דק' |
| תחליף קסילן | 8 דק' |
| שעוות פרפין | 30 דק' |
| שעוות פרפין | 30 דק' |
טבלה 3: לוח זמנים לעיבוד אורגנואידים גדולים (מעל 3 מ"מ קוטר)
| מגיב | זמן |
| המטוקסילין | 2 דק' |
| ריצה diH2O | 2 דק' |
| מגיב מבהיר המטוקסילין גרעיני | 1 דקות |
| ריצה diH2O | 1 דקות |
| ריאגנט בלוינג | 1 דקות |
| ריצה diH2O | 2 דק' |
| 70% אתנול | 1 דקות |
| 100% אתנול | 1 דקות |
| 100% אתנול | 1 דקות |
| תחליף קסילן | 2 דק' |
| תחליף קסילן | 2 דק' |
טבלה 4: כתם נגדי של המטוקסילין
Discussion
אורגנואידים GBM הם שיטת תרבית משלימה לתחומים מסורתיים הכוללים הטרוגניות תאית ומיקרו-סביבתית גדולה יותר 4,22,30. למרות שהיא דורשת יותר זמן ומשאבים, התרבות האורגנואידית יכולה להציע תובנות חשובות לגבי התנהגות תוך-סרטנית ומנגנונים של עמידות לסמים.
GBM מונע על ידי אוכלוסייה של CSCs 5,31, ושיטות אלה פותחו כדי לאפשר המשך צמיחה והתחדשות עצמית של אוכלוסיית CSC זו. גורם גדילה אפידרמלי (EGF) וגורם גדילה פיברובלסט (FGF) ידועים כמשפרים את התחזוקה והצמיחה של תאי גזע ומספקים איתות קולטן פעיל טירוזין קינאז (RTK). היווצרותן של אוכלוסיות תאים הטרוגניות ומיקרו-סביבה של גידולים מובחנים בתוך גידולי GBM מסתמכת על תמיכה בהתנהגויות CSC. הבחירה של lrECM מחקה את סביבת המוח העשירה בלמינינים ותומכת בתאים בתרבית אורגנואידית להתארגן בעצמם ולהגר על ידי פלישה. למרות שקבוצות מסוימות ביססו תרבית אורגנואידית ללא שימוש במדיה מועשרת lrECM או EGF/FGF24,28, שעשויה להציע דרך יעילה יותר בזמן של שיטת תרבית זו ובחירה חזקה יותר של איתות אונקוגני כדי להניע צמיחה, שיטות אלה נבחרו כדי לייעל את הסביבה הפרו-תאי כדי לבסס בצורה הטובה ביותר את ההטרוגניות התאית של אורגנואידים. גם אורגנואידים מוחיים וגם אורגנואידים GBM נעשו עם lrECM בספרות בעבר 21,32,33. למרות שביססנו נתונים לגבי אוכלוסיות הגידולים שנמצאו בתוך האורגנואידים והשונות המרחבית, פחות ידוע על אוכלוסיות שאינן גידוליות בתוך האורגנואידים וכמה זמן הם שורדים מדגימות החולה המקוריות. כתמי IHC מסוימים (כגון CD45) עשויים לספק נתונים אלה, ועשויים להיות נקודת מחקר מעניינת בעתיד עם אורגנואידים.
ידיעת השימוש המיועד לתרבית אורגנואידית חשובה לבחירת שיטות מתאימות. לביסוס אורגנואידים מדגימות ראשוניות לעומת גידול אורגנואידים אחידים לניסויים ספציפיים יש הליכים מעט שונים. הערכה לאופן שבו אורגנואידים מתבגרים וממלאים חזותית את פיגום lrECM חשובה ליכולת להקצות זמן ומשאבים מתאימים לתרבות אורגנואידית. אזורים דלילים של תאים באורגנואידים יתרחבו באיטיות ויגדלו כדי למלא את ה-lrECM, מה שיכול להימשך בין 2-8 שבועות, תלוי בהתנהגות הדגימה. קצב גידול זה הוא מהותי במקצת לכל דגימה; הוא נשמר על פני קבוצות שונות של אורגנואידים ועקבי למדי עם הקצב היחסי של צמיחת הכדור. אורגנואידים יכולים להישמר במשך יותר משנה אחת ולשמור על יכולות היווצרות הגידול על xenograft לתוך עכברים; עם זאת, מומלץ לגדל אותם במטרה ברורה לא לבזבז משאבי מעבדה (הן חומרים והן זמן)4. גידול אורגנואידי נבדק במספר גדלים ופורמטים של בארות, ומראה כי צלחת בגודל 10 ס"מ היא ההגדרה האידיאלית לשמירה על כדאיות תאים אופטימלית, ואחריה צלחת של 6 בארות עם שלושה אורגנואידים לכלבאר 34. אורגנואידים צורכים יותר מדיה בהשוואה למקביליהם התרבית הדו-ממדית, ושימוש בפורמט באר קטן יותר אינו מוביל לתחזוקה נאותה. לדוגמה, לבאר אחת של לוח בפורמט 96 בארות אין מספיק שטח או נפח מדיה ביחס לגודל של אורגנואיד כדי לקיים צמיחה אורגנואידית.
כפי שהאורגנואידים קובעים, להיות שומר מצוות חשוב להגברת ההצלחה. בתחילה, אורגנואידים יצרכו מדיה לאט, אך ככל שהם נעשים צפופים ובוגרים יותר, הם יצרכו מדיה מהר יותר. הוספת פנול אדום למדיה יכולה לעזור לשמש אינדיקטור לצריכת מדיה. כאשר המדיה צהובה יותר, זה עשוי לגרום לנו להתאים את דפוס ההזנה, בין אם זה להחליף נפח גבוה יותר של מדיה, להגדיל את כמות המדיה הכוללת בצלחת, לחלק אורגנואידים בין מספר צלחות תרבית תאים כדי לעמוד בקצב הצמיחה שלהם, או אפילו להתאים את ציר הזמן לניסויים.
במובנים רבים, אורגנואידים הם דרך לא יעילה לביצוע מחקר סרטן. הם כרוכים בסקאלות זמן ארוכות, והם יקרים ועתירי משאבים בהשוואה לתרבות הספירה של GBM. עם זאת, בהשוואה לקסנוגרפטים שמקורם בחולה, שיטה חלופית ליצירה מחדש של מגוון תאי ומיקרו-סביבתי, הם פשוטים יותר, זולים יותר וניתנים לשליטה. הבחירה מתי להשתמש בצורה הטובה ביותר באורגנואידים חשובה לחוקרי סרטן. הם לא נועדו להחליף את המרחב המסורתי או את התרבות החסידית ולא להחליף מודלים של קסנוגרפט. אורגנואידים יכולים, כאשר הם מיושמים בשאלה המדעית הנכונה, לשלב את היתרונות של שתי המערכות הללו ועשויים לאפשר לנו להתבונן בביולוגיה של תאי הגידול שאחרת היו נשארים מוסתרים. הקהילה המדעית רק מתחילה להבין אילו הזדמנויות למידה אורגנואידים מציעים, אך ברור שהם יהיו כלי רב ערך בעתיד להבנת הביולוגיה המורכבת של GBM.
Disclosures
למחברים אין קונפליקטים לחשוף.
Acknowledgements
ברצוננו להודות לד"ר ג'סטין לת'יה על עצתו שלא תסולא בפז ותמיכתו המתמשכת. אנו מודים גם לקטרינה פייף, ליסה וואלאס ומאיה קמחי על התמיכה הטכנית המצוינת שלהן.
Materials
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
References
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7(2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416(2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322(2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255(2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101(2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved