Method Article
Erhaltung der zellulären Vielfalt des menschlichen Glioblastoms ex vivo unter Verwendung dreidimensionaler Organoidkultur
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode, um Organoide des Glioblastoms (GBM) aus primären Patientenproben oder von Patienten stammenden Zellkulturen zu erzeugen und bis zur Reife zu erhalten. Diese GBM-Organoide enthalten phänotypisch vielfältige Zellpopulationen und bilden Tumormikroumgebungen ex vivo nach.
Zusammenfassung
Das Glioblastom (GBM) ist der am häufigsten auftretende primäre maligne Hirntumor mit extrem schlechter Prognose. Intratumorale zelluläre und molekulare Vielfalt sowie komplexe Wechselwirkungen zwischen Tumormikroumgebungen können die Suche nach wirksamen Behandlungen zu einer Herausforderung machen. Traditionelle Adhärenz- oder Kugelkulturmethoden können solche Komplexitäten maskieren, während dreidimensionale Organoidkulturen regionale Mikroumweltgradienten rekapitulieren können. Organoide sind eine Methode der dreidimensionalen GBM-Kultur, die die Tumorarchitektur des Patienten besser nachahmt, phänotypisch vielfältige Zellpopulationen enthält und für Experimente mit mittlerem Durchsatz verwendet werden kann. Obwohl die dreidimensionale Organoidkultur im Vergleich zur traditionellen Kultur aufwändiger und zeitaufwendiger ist, bietet sie einzigartige Vorteile und kann dazu dienen, die Lücke zwischen aktuellen In-vitro- und In-vivo-Systemen zu schließen. Organoide haben sich als unschätzbare Werkzeuge im Arsenal der Krebsbiologen etabliert, um das Tumorverhalten und die Resistenzmechanismen besser zu verstehen, und ihre Anwendungen wachsen weiter. Hier werden Methoden zur Erzeugung und Aufrechterhaltung von GBM-Organoiden beschrieben. Anweisungen zur Durchführung der Einbettung und Schnittierung von Organoidproben sowohl mit gefrorenen als auch mit Paraffin-Einbettungstechniken sowie Empfehlungen für Immunhistochemie und Immunfluoreszenzprotokolle für Organoidschnitte und die Messung der Lebensfähigkeit der gesamten Organoidzellen werden ebenfalls beschrieben.
Einleitung
Das Glioblastom (GBM) ist der am häufigsten auftretende primäre Hirntumor mit einer düsteren Prognose von etwa 15 Monaten ab Diagnose1. Behandlungen, die in präklinischen Studien wirksam sind, können bei Patienten oft schlecht wirksam sein 2,3. Ein schlechtes klinisches Ansprechen wird auf viele Faktoren zurückgeführt, einschließlich der Mikroumweltheterogenität von GBM und komplexer intratumoraler Interaktionen. Diese können im Labor mit traditionellen Adhärent- oder Kugelkulturmethoden nur schwer nachgebildet werden4. Das Vorhandensein einer Untergruppe selbsterneuernder Krebsstammzellen (CSCs) in GBM kann ebenfalls zu dieser Komplexität beitragen 5,6. CSCs sind entscheidend für die Tumorausbreitung und halten das Tumorwachstum aufrecht, indem sie die aktive Angiogenese, die Krebsinvasion und die Resistenz gegen Therapien einschließlich Strahlungfördern 7,8,9. CSCs sind nicht gleichmäßig über Tumoren verteilt, sondern werden in spezifischen Mikroumgebungen angereichert, einschließlich der perivaskulären Nische und perinecrotischen Regionen, die jeweils eine eindeutige molekulare Regulation ihrer zellulären Zustände bieten 10,11,12,13,14. CSCs sind keine passiven Empfänger von Mikroumgebungshinweisen, sondern besitzen die Fähigkeit, ihre eigene Mikroumgebung umzugestalten 7,15,16. Die Mikroumgebung eines CSC kann die Aufrechterhaltung des Stammzellzustands als Reaktion auf Belastungen wie Nährstoffknappheit, pH-Wert und Hypoxiefördern 17,18,19,20, was auf die Bedeutung dieser Bedingungen in einem Modellsystem hindeutet. Die Rekapitulation der vielfältigen zellulären Mikroumgebung innerhalb von Tumoren ist daher entscheidend für das Verständnis therapeutischer Resistenzen und die Identifizierung neuartiger Therapien.
Die dreidimensionale Kultur hat in den letzten Jahren an Popularität gewonnen21,22. Organoide wurden bei anderen Krebsarten eingesetzt, und das Hauptziel der Erhaltung von Zellen als Organoide besteht darin, das Wachstum heterogener Zellpopulationen (von denen viele normalerweise in einer homogeneren Kugelkultur überholt werden können) und räumliche Vielfalt zu ermöglichen, die als regionale Tumormikroumgebungen mit genetischer Spezifität angesehen werden 4,23,24,25,26 . Es gibt viele Methoden zur dreidimensionalen Kultur von Krebszellen, die jeweils Vor- und Nachteilehaben 27,28,29. Die Organoidkultur soll kein Ersatz für die traditionelle Anhänger- oder Sphärenkultur sein. Es wird am besten als ergänzende Technik zu zweidimensionalen Methoden verwendet, wenn es spezifische Fragen gibt, bei denen die Interaktion zwischen Zellmikroumgebung und Tumorzellantworten kritisch ist.
Dieser Artikel beschreibt zuverlässige und wiederholbare Methoden zur Erzeugung von GBM-Organoiden aus primären Patientenproben oder aus Patientenkulturen. Wir adressieren zwei verschiedene Ziele für die dreidimensionale Organoidkultur: (1) die Etablierung von Organoiden aus primärem Patientengewebe mit maximalem Engraftment-Potenzial unabhängig von der Einheitlichkeit oder (2) die Züchtung einheitlicher Organoide für eine quantitativere experimentelle Verwendung. Bei der Etablierung einer primären Probe als Organoide ist es nicht notwendig, nach einzelnen Zellen zu filtern oder Zellen zu zählen, da die Beibehaltung maximaler Zellzahlen und -typen zur Bestimmung der ursprünglichen Kultur Priorität hat. Bei der Züchtung von Organoiden für Vergleichsexperimente sind jedoch Einzelzellfiltration und Zellzählung erforderlich, um sicherzustellen, dass Replikationsorganoide hinsichtlich der experimentellen Konsistenz vergleichbar sind. Dieses Protokoll beschreibt, wie Organoidkulturen etabliert und einheitliche Organoide erstellt werden, sowie verfeinerte Methoden zur Einbettung und Konservierung von Organoiden und Standard-Zellkulturexperimenten, einschließlich Immunhistochemie, Immunfluoreszenz und Bewertung der Gesamtzelllebensfähigkeit in GBM-Organoiden.
Protokoll
Alle unten aufgeführten Schritte des Protokolls wurden in Übereinstimmung mit dem Protokoll #2559 des Cleveland Clinic Institutional Review Board (IRB) und der Genehmigung #1711 des Institutional Biosafety Committee (IBC) entwickelt und durchgeführt. Kugeln und Organoide werden in "Neurobasal Media Complete" (NBMc) kultiviert. Anweisungen hierzu finden Sie in Tabelle 1 .
1. Herstellung von Organoidformen
- Nehmen Sie das Wachspapier von der Parafilmfolie (ca. 4 cm x 4 cm groß) und legen Sie es zwischen zwei sterile 96-Well-Polymerase-Kettenreaktionsplatten (PCR).
- Führen Sie diese Schritte in der Kulturhaube durch und achten Sie besonders darauf, das "Innere" des Parafilms (die Seite, die vom Papier bedeckt ist) sauber zu halten. Diese saubere Seite sollte die Konkavität der Vertiefungen machen.
- Üben Sie gleichmäßigen Druck auf die obere 96-Well-PCR-Platte aus, um kleine Grübchen im Parafilm zu bilden. Ziel ist es, dass Grübchen etwa 2 mm tief sind, ohne Löcher im Parafilm zu erzeugen.
- Trennen Sie die beiden 96-Well-PCR-Platten vorsichtig. Der Noppen-Parafilm klebt an der oberen Platte. Legen Sie diese für ca. 30 s auf Trockeneis.
- Nachdem der Parafilm 30 s auf Trockeneis war, ziehen Sie den Parafilm mit sterilen Pinzetten von der oberen 96-Well-PCR-Platte ab.
- Verwenden Sie beim Entfernen des Parafilms eine schnelle Bewegung, anstatt sehr "vorsichtig" zu sein. Gefrorener Parafilm ist leichter zu entfernen als erwärmter Parafilm, was dazu führen kann, dass sich die Grübchen umkehren.
- Die fertige Parafilmform in eine abgedeckte, sterile 10 cm Zellkulturschale geben. Formen können im Voraus hergestellt und gelagert werden, wenn die Sterilität erhalten bleibt.
2. Makrodissektion der Patientengewebeprobe
- Verwenden Sie in einer sterilen Kulturschale (10 cm Zellkulturplatten) zwei sterile Rasierklingen, um die Patientenprobe unter gleichmäßigem Druck fein zu zerkleinern.
HINWEIS: Das Zerkleinern der Probe ist am einfachsten mit etwa 500 μL NBMc auf der Kulturschale. Versuchen Sie mit Rasierklingen, Stücke so fein wie möglich zu zerkleinern; Idealerweise sind Einzelstücke 1 mm3 oder kleiner. - Die fein zerkleinerten Tumorstücke werden mit einer geschnittenen p1000-Pipettenspitze in ein 15-ml-Zentrifugenröhrchen überführt.
HINWEIS: Beim Umgang mit Organoiden ist es wichtig, nur geschnittene p1000-Pipettenspitzen zu verwenden. Diese können mit einem scharfen Rasiermesser auf die gewünschte Öffnungsgröße (zwischen 5 und 8 mm grob) zugeschnitten und autoklaviert werden. - Fügen Sie 2 mL Zellablösungslösung bei Raumtemperatur (RT) hinzu (Table of Materials) und legen Sie sie für ca. 10 min in einen 37 °C, 5%CO2-Inkubator .
HINWEIS: Alle paar Minuten beobachten und mischen. Einige Zellablösungslösungen oder -proben benötigen möglicherweise unterschiedliche Inkubationszeiten. Wenn eine Verklumpung auftritt, die auf eine DNA-Freisetzung aufgrund der Zelllyse hinweisen kann, fahren Sie sofort mit dem nächsten Schritt fort. - Fügen Sie 8 ml NBMc-Medien hinzu, um die Zellablösungslösung zu neutralisieren, und drehen Sie sich für 3 min bei 65 x g.
- Saugen Sie den Überstand ab und resuspendieren Sie das Gewebe in 1-2 ml NBMc.
3. Organoide aus primärem Patientengewebe erzeugen
HINWEIS: Das Ziel bei der Herstellung von Organoiden aus primärem Patientengewebe ist es, eine dreidimensionale Kultur zu etablieren. Filtern Sie nicht nach einzelnen Zellen oder zählen Sie Zellen, sondern halten Sie die anfängliche Zellbelastung durch visuelle Inspektion so gleichmäßig wie möglich. Es ist normal, Heterogenität im Wachstum und der Etablierung von anfänglichen Organoiden zu haben. Jedes Organoid hat ein Volumen von 20 μL (16 μL lamininreiche extrazelluläre Matrix (lrECM) und 4 μL suspendiertes Gewebe in NBMc ab Schritt 2.5). Anweisungen können für die Anzahl der beabsichtigten Organoide angepasst werden; Ziel ist es, typischerweise etwa 20-30 Organoide aus primären Patientenproben zu bilden.
- Legen Sie das lrECM und ein kleines Zentrifugenröhrchen in einen Eiskübel oder kalten Block. Geben Sie die entsprechende Menge lrECM (16 μL x X Anzahl der vorgesehenen Organoide) in das kleine Zentrifugenröhrchen.
- Geben Sie ein geeignetes Volumen der Gewebesuspension aus Schritt 2.5 (4 μL x Anzahl der vorgesehenen Organoide) in das Zentrifugenröhrchen auf Eis.
- 20 μL der lrECM/Zellsuspensionsmischung werden vorsichtig auf Parafilmformen pipettiert; Dadurch entsteht ein perlenartiges Tröpfchen.
- Achten Sie darauf, die lrECM/Zellsuspensionsmischung gründlich zu mischen; Die Zellen neigen dazu, sich leicht innerhalb der lrECM anzusiedeln, was zu heterogenen Organoiden führt.
- Bewahren Sie die lrECM/Zellsuspensionsmischung auf Eis auf. Wenn sich lrECM erwärmt, kann es polymerisieren und die Organoidbildung beeinträchtigen. Achten Sie darauf, die Pipettenspitze alle zwei bis drei Organoide zu kühlen, um eine lrECM-Polymerisation zu verhindern. Führen Sie keine Luftblasen in Organoide ein (vermeiden Sie ein "doppeltes Drücken" der Pipette).
- Sobald die gewünschte Anzahl von Organoiden in einer 10 cm Zellkulturplatte auf Parafilmform pipettiert wurde, mit Plattendeckel abdecken und in einem Zellkulturinkubator bei 37 °C 5%CO2 für 1-2 h inkubieren.
- Nachdem die Organoide erstarrt sind, spülen Sie sie mit NBMc-Medien vorsichtig von der Parafilmform in eine neue, sterile 10 cm Kulturplatte mit insgesamt 20 ml NBMc. Die Verwendung einer p1000-Spitze funktioniert am besten, um die Organoide von der Form zu spülen. Sie werden sanft abrutschen.
HINWEIS: Wenn Organoide aus den Formen in Zellkulturplatten gespült werden, sollten sie in den Medien als kleine rosa Kugeln sichtbar sein. Wenn die Organoide in den Medien auseinandergefallen oder zerbrochen zu sein scheinen, deutet dies auf ein früheres Problem mit lrECM hin, das polymerisiert wurde, und Organoide können immer noch wachsen, aber es ist sehr unwahrscheinlich, dass sie eine einheitliche Größe haben. - Die 10 cm große Kulturschale 4 Tage lang bei 37 °C, 5%CO2 (ohne Schütteln) in einen Zellkulturinkubator stellen.
HINWEIS: Das Platzieren von Organoiden auf einem Orbitalschüttler in den ersten Tagen kann dazu führen, dass sie auseinanderfallen. Stellen Sie sicher, dass sie bis Tag 4 nicht zittern. - Nach 4 Tagen das Medium austauschen und auf einen Orbitalschüttler bei 80 U/min in einem Zellkulturinkubator bei 37 °C, 5%CO2 legen.
- Der Austausch von Medien mit unreifen Organoiden ist eine Herausforderung, da sie schwer zu visualisieren sind. Kippen Sie die Zellkulturschale und warten Sie mindestens 20 s; Die Organoide setzen sich am Boden ab und ermöglichen es, die Medien von oben mit einer 10-20 ml Glas- oder Kunststoffpipette langsam zu entfernen.
- Achten Sie sorgfältig auf die Sammlung von Organoiden am Boden; Wenn sie durch die Kraft der Medienentfernung aufgewühlt erscheinen, ist es am besten, innezuhalten und ihnen zu erlauben, sich neu anzusiedeln. Wenn Organoide reifen und leichter zu visualisieren sind, wird dieser Prozess weniger nuanciert.
HINWEIS: Manchmal kann das Platzieren eines Stücks dunklem Papier unter der Zellkulturplatte helfen, unreife Organoide zu visualisieren. Es wird empfohlen, keine Pasteur-Pipette mit Vakuumabsaugung zu verwenden, um Medien zu entfernen, da die Organoide auf diese Weise sehr leicht angesaugt und verloren gehen können. - Wenn Organoide zum ersten Mal etabliert werden, verbrauchen sie Medien nicht so schnell wie reife Organoide. Beginnend mit 50% Medienaustausch reduziert unnötige Mediennutzung und verringert die Wahrscheinlichkeit, dass versehentlich neue Organoide während des Medienaustauschprozesses beschädigt oder angesaugt werden.
4. Erzeugung von Organoiden aus etablierter GBM-Sphäre, adhärenter oder Organoidkultur
HINWEIS: Das Ziel hier ist es, Organoide herzustellen, die in Größe und Zellmenge einheitlich für die Verwendung in Vergleichsexperimenten sind, also verwenden Sie einen Einzelzellfilter und zählen Sie Zellen, um dies sicherzustellen.
- Herstellung einer Einzelzellsuspension aus GBM-Kugelkultur.
HINWEIS: Kugelkulturen von GBM-Zellen werden in NBMc-Medien gepflegt.- Die Kugeln in ein 15-ml-Zentrifugenröhrchen geben und mit 120 x g für 5 min drehen.
- Entfernen Sie den Überstand und fügen Sie 2 ml RT-Zellablösungslösung hinzu. 3 min in einen 37 °C heißen Inkubator stellen.
- Fügen Sie 8 ml NBMc-Medien hinzu, um die Zellablösungslösung zu neutralisieren. Durch ein Einzelzellsieb (70 μm) abseihen und 5 min bei 120 x g schleudern.
- Entfernen Sie den Überstand aus dem Röhrchen und resuspendieren Sie die verbleibenden Zellen in ~ 1 ml NBMc. Zählen Sie die Zellen (unter Verwendung der Zellimpermeant Färbung) und fahren Sie mit Schritt 4.4 fort.
- Herstellung einer Einzelzellsuspension aus GBM-adhärenter Kultur.
- Entfernen Sie die verwendeten Medien von der Platte, geben Sie 2 ml RT-Zellablösungslösung auf die Platte und legen Sie sie für 3 min in einen 37 °C Inkubator.
- Bestätigen Sie unter dem Mikroskop, dass die Zellen von der Platte gelöst sind.
- Fügen Sie 8 ml NBMc-Medien hinzu, um die Zellablösungslösung zu neutralisieren. Abseihen durch ein einzelliges Sieb (70 μm).
HINWEIS: Einzelzell-Dehnung ist optional, wenn mit adhärenter Kultur gearbeitet wird. - 5 min bei 120 x g drehen. Entfernen Sie den Überstand aus dem Röhrchen und resuspendieren Sie die verbleibenden Zellen in ~ 1 ml NBMc. Zählen Sie die Zellen (unter Verwendung der Zellimpermeant Färbung) und fahren Sie mit Schritt 4.4 fort.
- Herstellung einer Einzelzellsuspension aus GBM-Organoidkultur.
- Die Organoide werden mit einer geschnittenen p1000-Pipettenspitze auf eine 10 cm lange Kulturplatte überführt und so viel Restmedium wie möglich vorsichtig entfernt.
- Mit zwei sterilen Rasierern Organoide vorsichtig fein zerkleinern. Bewegen Sie die gehackten Organoide mit der geschnittenen p1000-Spitze in ein 15-ml-Zentrifugenröhrchen und fügen Sie ~ 2-3 ml NBMc-Medien hinzu.
- Bei 120 x g für 3 min drehen und den Überstand entfernen (für diesen Teil wird empfohlen, eine Pipettenspitze anstelle einer Vakuumabsaugung zu verwenden).
- Fügen Sie 2 ml Kaltzellenablösungslösung für 10 min hinzu.
HINWEIS: Zellablösungslösung sollte direkt ab 4 °C verwendet und nicht zuerst erwärmt werden. Dies scheint das verbleibende Matrigel zu erweichen und hilft bei der Zellwiederherstellung. - Dann für 10-20 min in einen 37 °C Inkubator gehen und alle paar Minuten beobachten und mischen. Wenn eine Verklumpung auftritt, die auf eine Zelllyse hinweisen kann, fahren Sie sofort mit dem nächsten Schritt fort.
- Fügen Sie 8 ml NBMc-Medien hinzu, um die Zellablösungslösung zu verdünnen. Durch ein einzelliges Sieb (70 μm) abseihen und 5 min bei 120 x g schleudern.
- Entfernen Sie den Überstand aus dem Röhrchen und resuspendieren Sie die verbleibenden Zellen in ~ 1 ml NBMc. Zählen Sie die Zellen (unter Verwendung der Zellimpermeant Färbung) und fahren Sie mit Schritt 4.4 fort.
- Herstellung von Organoiden aus einer einzelligen Suspension
- Legen Sie das lrECM und ein kleines Zentrifugenröhrchen in einen Eiskübel oder kalten Block. Geben Sie die entsprechende Menge lrECM (16 μL x X Anzahl der vorgesehenen Organoide) in das kleine Zentrifugenröhrchen.
- Erstellen Sie eine Mischung von Zellen in einem Gesamtvolumen (4 μL x X Anzahl der beabsichtigten Organoide), die 20.000 Zellen / Organoid enthält, und fügen Sie dies dem kleinen Zentrifugenröhrchen mit lrECM auf Eis hinzu.
- 20 μL der lrECM/Zellsuspensionsmischung werden vorsichtig auf Parafilmformen pipettiert; Dadurch entsteht ein perlenartiges Tröpfchen.
- Achten Sie darauf, die lrECM / Zellsuspensionsmischung gründlich zu mischen, da die Zellen dazu neigen, sich leicht innerhalb der lrECM anzusiedeln, was zu heterogenen Organoiden führt.
- Bewahren Sie die lrECM/Zellsuspensionsmischung auf Eis auf. Wenn sich lrECM erwärmt, kann es polymerisieren und die Organoidbildung beeinträchtigen.
- Achten Sie darauf, die Pipettenspitze alle zwei bis drei Organoide zu kühlen, um eine lrECM-Polymerisation zu verhindern. Führen Sie keine Luftblasen in Organoide ein (vermeiden Sie ein "doppeltes Drücken" der Pipettenspitze).
- Sobald die gewünschte Anzahl von Organoiden in einer 10-cm-Kulturplatte auf Parafilmform pipettiert wurde, inkubieren Sie bei 37 °C für 1-2 h in einem Zellkulturinkubator.
- Nachdem sich die Organoide verfestigt haben, spülen Sie sie mit NBMc-Medien vorsichtig von der Parafilmform in eine neue, sterile 10 cm Kulturplatte mit insgesamt 20 ml NBMc. Die Verwendung einer p1000-Spitze funktioniert am besten, um Organoide von der Form zu spülen. Sie werden sanft abrutschen.
HINWEIS: Etwa 15-20 Organoide pro 10 cm Kulturschale werden empfohlen. - Stellen Sie die 10 cm große Kulturschale für 4 Tage in einen Inkubator (ohne zu schütteln).
- Nach 4 Tagen die Medien austauschen und auf einen Orbitalshaker bei 80 RPM im Zellkulturinkubator legen. Tauschen Sie danach alle 2-3 Tage Medien aus.
- Der Austausch von Medien mit unreifen Organoiden ist eine Herausforderung, da sie schwer zu visualisieren sind. Kippen Sie die Zellkulturschale und warten Sie mindestens 20 s; Die Organoide setzen sich unten ab und ermöglichen es, das Medium von oben mit einer großen Öffnungsglaspipette langsam zu entfernen.
- Achten Sie sorgfältig auf die Sammlung von Organoiden am Boden; Wenn sie durch die Kraft der Medienentfernung aufgewühlt erscheinen, halten Sie inne und lassen Sie sie sich wieder niederlassen. Wenn Organoide reifen und leichter zu visualisieren sind, wird dieser Prozess weniger nuanciert.
HINWEIS: Manchmal kann das Platzieren eines Stücks dunklem Papier unter der Zellkulturplatte helfen, unreife Organoide zu visualisieren. Verwenden Sie keine Pasteur-Pipette mit Vakuumabsaugung, um Medien zu entfernen, da die Organoide auf diese Weise sehr leicht angesaugt und verloren gehen können. - Wenn Organoide zum ersten Mal etabliert werden, verbrauchen sie Medien nicht so schnell wie reife Organoide. Beginnen Sie mit 50% Medienaustausch, um unnötige Mediennutzung zu reduzieren und die Wahrscheinlichkeit zu verringern, dass versehentlich neue Organoide während des Medienaustauschprozesses beschädigt oder angesaugt werden.
5. Kryoembedding
- Legen Sie jedes Organoid in ein einzelnes 1,5-ml-Röhrchen (mit geschnittener p1000-Spitze), das 1 ml 4% Paraformaldehyd (PFA) enthält. Organoide über Nacht bei 4 °C lagern. Wenn Sie Organoide in Paraffin einbetten, fahren Sie mit Abschnitt 6 fort.
- Nach der Fixierung über Nacht in 4% PFA die Organoide dreimal in 1x phosphatgepufferter Kochsalzlösung (PBS) waschen.
- Das Organoid wird in ein neues 1,5-ml-Röhrchen (unter Verwendung der geschnittenen p1000-Pipettenspitze) überführt, das 1 ml 30% Saccharose enthält, und über Nacht bei 4 °C lagern.
- Fügen Sie eine kleine Menge (typischerweise 1-2 ml) der optimalen Schneidtemperaturverbindung (OCT) zu einer Kryoform hinzu, bedecken Sie den Boden und füllen Sie etwa 1/3 bis 1/2 der Tiefe der Form.
- Übertragen Sie ein einzelnes Organoid auf Kryomold mit geschnittener p1000-Pipettenspitze. Dies führt dazu, dass einige Medien mit dem Organoid übertragen werden, was unvermeidlich ist. Verwenden Sie eine kleinere Pipettenspitze, um das umgebende Medium vorsichtig zu entfernen, ohne das Organoid zu stören.
HINWEIS: Dies kann schwierig zu visualisieren sein, aber langsames Pipettieren zeigt einen deutlichen Unterschied in der Dichte zwischen Medien und OCT, so dass dies bis zu einem gewissen Grad "nach Gefühl" geschieht). - Legen Sie das Kryomold auf ein Tablett mit Trockeneis. OCT beginnt einzufrieren und wird dabei undurchsichtig.
- Fügen Sie zusätzliche OCT hinzu, um das Organoid vollständig zu bedecken und den Rest des Volumens der Kryoform auszufüllen. Blöcke können bei -20 °C für die kurzfristige Lagerung für mehrere Tage oder bei -80 °C für die Langzeitlagerung auf unbestimmte Zeit gelagert werden.
6. Paraffin-Einbettung
- Sortieren Sie Organoide nach Größe (kleine Organoide sind unter 3 mm, große Organoide sind über 3 mm). Jedes Organoid wird mit einer geschnittenen p1000-Pipettenspitze in eine Histologiekassette überführt und gemäß Tabelle 2 oder Tabelle 3 zu Paraffinwachs verarbeitet.
HINWEIS: Die Größe/Konfiguration der Histologiekassette ist dem Benutzer überlassen. - Übertragen Sie Organoide aus den Kassetten in Einbettungsformen mit 1-2 mL geschmolzenem Paraffinwachs und kühlen Sie es, bis das Wachs halbfest ist.
- Sobald das Wachs teilweise verfestigt ist, fügen Sie mehr Wachs auf die Oberseite der Form hinzu. Legen Sie die beschriftete Kassettenplatte über die Form und geben Sie diese auf eine kalte Platte. Kühlen Sie weiter, bis das Wachs vollständig fest ist.
- Wenn das Wachs erstarrt ist, schneiden Sie den Block mit einem Mikrotom. Alternativ bei RT oder 4 °C zum späteren Schneiden lagern.
7. Immunfluoreszenz (IF)
- Deparaffinisieren und rehydrieren Sie 5-12 μm Paraffin-eingebettete Gewebeschnitte mit einer Objektträger-Färbeschale gemäß den folgenden Schritten.
HINWEIS: Wenn Sie Schnitte aus OCT-eingebetteten Organoiden verwenden, empfehlen wir die Verwendung von 12-μm-Abschnitten. Entfernen Sie das OCT, indem Sie den Objektträger in PBS 30 Minuten lang schütteln. Fahren Sie mit Schritt 7.2 fort.- 5 min in Xylol inkubieren. Wiederholen Sie dies noch zwei Mal. Dann 10 min in 100% Ethanol inkubieren. Wiederholen Sie dies noch einmal.
- Inkubieren Sie für 10 min in 95% Ethanol. Wiederholen Sie den Vorgang noch einmal. Waschen Sie die Abschnitte zweimal 5 Minuten in destilliertem Wasser.
- Zur Antigen-Demaskierung tauchen Sie Objektträger in 1x Citrat-Demaskierungslösung (Table of Materials) und Mikrowelle bei Untersiedetemperatur für 10 min. Achten Sie darauf, die Lösung nicht kochen zu lassen.
HINWEIS: Dies wird am besten erreicht, wenn Sie zunächst ~ 2 Minuten lang in der Mikrowelle erhitzen, bis das Kochen auftritt, dann die Leistung senken und beobachten, um sicherzustellen, dass die Lösung nicht überkocht. Die bevorzugte Demaskierungstemperatur liegt knapp unter 100 °C, idealerweise 98 °C. - Lassen Sie die Objektträger 30 min bei RT in der 1x Citrat-Demaskierungslösung abkühlen.
HINWEIS: Dies ist die gleiche 1x Citratlösung; Die Lösung muss in diesem Schritt nicht ersetzt werden. - Waschen Sie die Objektträger zweimal 5 Minuten lang in destilliertem Wasser.
- Die Objektträger in 1x TBST (Tris-gepufferte Kochsalzlösung mit 0,1% Tween 20) Puffer für 5 min waschen.
- Entfernen Sie die Objektträger von TBST und trocknen Sie sie vorsichtig um Gewebeabschnitte mit einem Laborreinigungstuch, wobei Sie darauf achten, den Gewebeabschnitt nicht trocknen zu lassen. Sobald der Objektträger ausreichend trocken ist, umkreisen Sie Gewebeschnitte mit einem hydrophoben Barrierestift.
- Blockieren Sie jeden Abschnitt mit 100-400 μL 10% Serumblocklösung für 1 h bei RT. Wählen Sie die Serumblockerlösung basierend auf dem sekundären Antikörper. Wenn Sie beispielsweise einen sekundären Antikörper aus Esel verwenden, verwenden Sie ein 10% normales Eselserum in 1x TBST.
- Entfernen Sie die blockierende Lösung und fügen Sie dann 100-400 μL primären Antikörper auf die gewünschte Konzentration verdünnt in die Blockierlösung ein.
- Bei 4 °C die Abschnitte über Nacht mit dem primären Antikörper inkubieren.
- Entfernen Sie die primäre Antikörperlösung und waschen Sie die Objektträger dreimal in 1x TBST für 5 min.
- Fügen Sie 100-400 μL sekundären Antikörper (1:1000 Verdünnung in Blocklösung oder gemäß den Anweisungen des Herstellers) zu jedem Abschnitt hinzu und inkubieren Sie für 1,5 h bei RT.
- Waschen Sie die Objektträger zweimal in 1x TBST für 5 min. Anschließend die Dias in 1x PBS für 5 min waschen.
- Entfernen Sie die Objektträger von PBS und trocknen Sie sie mit einem Laborreinigungstuch um Gewebeabschnitte herum. Fügen Sie ein paar Tropfen flüssiges Härtungsmittel hinzu und montieren Sie vorsichtig ein Glasdeckglas. Sobald die Objektträger trocken sind, bei -20 °C lichtgeschützt lagern, bis sie für die Bildgebung bereit sind.
8. Immunhistochemie
- Deparaffinisieren und rehydrieren Sie die Paraffin-eingebetteten Gewebeabschnitte mit einer Objektträger-Färbeschale gemäß den folgenden Schritten.
HINWEIS: Wenn Sie Abschnitte aus OCT-eingebetteten Organoiden verwenden, entfernen Sie OCT, indem Sie den Objektträger 30 Minuten lang in PBS schütteln. Fahren Sie mit Schritt 8.2 fort.- 5 min in Xylol inkubieren. Wiederholen Sie dies noch zwei Mal.
- Inkubieren Sie für 10 min in 100% Ethanol. Wiederholen Sie den Vorgang noch einmal.
- Inkubieren Sie für 10 min in 95% Ethanol. Wiederholen Sie den Vorgang noch einmal.
- Abschnitte zweimal 5 min in destilliertem Wasser waschen.
- Zur Antigen-Demaskierung Objektträger in 1x Citrat-Demaskierungslösung und Mikrowelle bei Untersiedetemperatur für 10 min tauchen. Achten Sie darauf, die Lösung nicht kochen zu lassen.
- In der 1x Citrat-Demaskierungslösung die Dias 30 min bei RT abkühlen lassen.
- Waschen Sie die Objektträger dreimal 5 Minuten in destilliertem Wasser.
- Inkubieren Sie die Objektträger für 10 min in 3% Wasserstoffperoxid.
- Die Objektträger zweimal 5 min in destilliertem Wasser waschen.
- Die Objektträger 5 min in 1x TBST waschen.
- Entfernen Sie die Objektträger von 1x TBST und trocknen Sie dann vorsichtig in der Ecke eines Laborreinigungstuchs um Gewebeabschnitte herum.
- Kreisen Sie die Gewebeabschnitte mit einem hydrophoben Barrierestift, sobald der Objektträger trocken ist.
- 100-400 μL der Blockierlösung auf jeden Abschnitt innerhalb des hydrophoben Barrierestiftkreises bei RT für 1 h geben. Verwenden Sie entweder 10% normales Eselserum (NDS) oder 0,75% Rinderserumalbumin (BSA), verdünnt in 1x TBST.
- Als nächstes entfernen Sie die Blockierlösung und fügen 100-400 μL des primären Antikörpers zu jedem Abschnitt hinzu. Verdünnen Sie diesen primären Antikörper mit dem entsprechenden Verdünnungsmittel des Herstellers auf die gewünschte Konzentration.
- Die Abschnitte über Nacht bei 4 °C inkubieren. Entfernen Sie die primäre Antikörperlösung und waschen Sie die Objektträger dreimal in 1x TBST für 5 min.
- Fügen Sie 100-400 μL IHC-Detektionsreagenz zu jedem Abschnitt hinzu und inkubieren Sie für 1 h bei RT. Wählen Sie das IHC-Nachweisreagenz entsprechend dem primären Antikörper.
- Waschen Sie jeden Abschnitt zweimal mit 1x TBST für 5 min, gefolgt von 1x PBS für 5 min einmal.
- Bereiten Sie 3,3-Diaminobenzidin (DAB) -Lösung gemäß den Anweisungen des Herstellers vor. Fügen Sie 100-400 μL DAB-Lösung zu jedem Gewebeabschnitt hinzu und überwachen Sie genau unter einem Mikroskop. Zwischen 1-10 min sorgt für eine akzeptable Färbeintensität; Achten Sie darauf, diese Zeit zu notieren und für alle Gewebeabschnitte konsistent zu bleiben.
- Nachdem die gewünschte Färbeintensität erreicht ist, tauchen Sie die Objektträger in destilliertes Wasser.
- Führen Sie eine Hämatoxylin-Gegenfärbung und Objektträgerdehydratisierung zur Montage gemäß den Anweisungen in Tabelle 4 durch.
- Entfernen Sie den Objektträger vom Xylolersatz (Table of Materials) und wischen Sie mit einem Laborreinigungstuch zusätzliche Flüssigkeit um den Gewebeabschnitt herum ab. Verwenden Sie eine kleine Menge permanentes Montagemedium, um das Deckglas über dem Gewebeabschnitt zu montieren und trocknen zu lassen.
9. Messung der Lebensfähigkeit der Gesamtzelle
- Übertragen Sie jedes Organoid in ein 2-ml-Röhrchen und entfernen Sie vorsichtig mit einer kleinen Pipettenspitze alle überschüssigen Medien um das Organoid herum (siehe Abbildung 3 für das Schema dieses Verfahrens).
HINWEIS: Zelllebensfähigkeitstests müssen mit Organoiden durchgeführt werden, die mit identischer Anzahl von Zellen hergestellt wurden. Dieses Experiment sollte nicht an Organoiden durchgeführt werden, die direkt aus Patientenproben aus der Chirurgie, aus dem Schneiden von alredy gebildeten Organoiden oder anderen Fällen hergestellt wurden, in denen einzelne Zellen nicht gefiltert und gezählt wurden. - Bereiten Sie das Lumineszenzzelllebensfähigkeits-Assay-Reagenz und 1x PBS im Verhältnis 1:1 vor und fügen Sie jedem Röhrchen 500 μL hinzu.
- Verwenden Sie eine p1000-Pipettenspitze, um aggressiv auf und ab zu pipettieren, um das Organoid abzubauen, und lassen Sie es 5 Minuten lang ruhen. Das Organoid sollte inzwischen etwas dissoziiert und weicher sein; Wiederholen Sie das Mischen mit der P1000-Pipettenspitze erneut.
- Ziel ist es, 100 μL Gesamtvolumen pro Vertiefung einer 96-Well-Platte zu haben. Fügen Sie 25 μL der Mischung aus Schritt 9.3 hinzu (reicht für mehrere technische Replikate) und fügen Sie 75 μL des verbleibenden lumineszierenden Zelllebensfähigkeitstests und PBS-Gemisches hinzu.
- Legen Sie die Platte für 2 min auf einen Shaker und inkubieren Sie sie dann für 20 min bei RT.
- Lesen Sie die Platte mit einer Lumineszenzeinstellung auf einem Plattenlesegerät, und erfassen Sie die Daten (siehe Abbildung 4).
Ergebnisse
Abbildung 1 zeigt das frühe Organoidwachstum mittels Lichtmikroskopie bei 10-facher Vergrößerung. Abbildung 1A zeigt die Migration und Invasion einzelner Zellen durch lrECM in der mittleren Ansicht. Die Zellen werden sich weiter ausdehnen und das lrECM "besiedeln", und sie werden bei visueller Inspektion dichter und schließlich undurchsichtiger erscheinen. Abbildung 1B zeigt mehrere reife Organoide (nach 7 Wochen) ohne Vergrößerung, relativ zur Größe eines Groschens.
Abbildung 2 zeigt die immunhistochemische Färbung von GBM-Organoiden für Phospho-Histon H3, einen Marker für aktive Proliferation. Die meisten stark proliferativen Zellen sind im Organoidumfang im Vergleich zum Organoidkern zu sehen. Positive Färbung hat ein braunes / kupferfarbenes Aussehen.
Abbildung 3 beschreibt den Prozess zur Homogenisierung und Messung der Gesamtzellanzahl in GBM-Organoiden unter Verwendung eines 3D-spezifischen lumineszierenden Zelllebensfähigkeitsassays. Aufgrund der hohen Anzahl von Zellen in GBM-Organoiden wird die größere Organoidstruktur zunächst durch Verreibung im lumineszierenden Assay-Reagenz homogenisiert. Dann werden Fraktionen des gesamten Organoidlysats in einzelne Vertiefungen geladen und vor der Inkubation und dem Ablesen auf einem geeigneten Multi-Well-Plattenleser mit zusätzlichem Lumineszenz-Assay-Reagenz verdünnt.
Abbildung 4 zeigt DMSO-Steuerdaten (Common Vehicle) für Organoide. Die dargestellten Daten zeigen die intraorganoide und interorganoide Konsistenz. Lumineszenzlebensfähigkeitsdaten werden bei der Generierung experimenteller Daten in der Regel für jede Probe auf Kontrollen normalisiert.
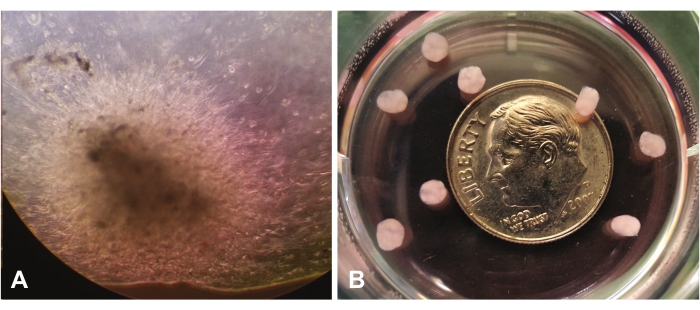
Abbildung 1: Blick durch ein Lichtmikroskop (10x). (A) Frühes Organoidwachstum, das die Migration/Invasion von GBM-Zellen in der lamininreichen extrazellulären Matrix zeigt. (B) Reife Organoide relativ zur Größe eines Groschens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
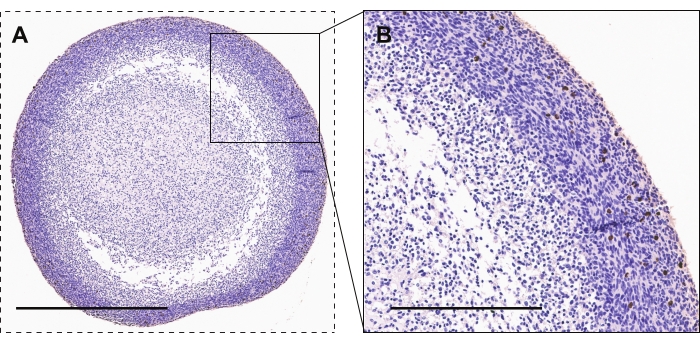
Abbildung 2: Immunhistochemie von GBM-Organoiden . (A, B) GBM-Organoide mit Phospho-Histon-H3-gefärbten Zellen zur aktiven Proliferation. Maßstabsbalken sind 600 μm bzw. 300 μm für A bzw. B. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
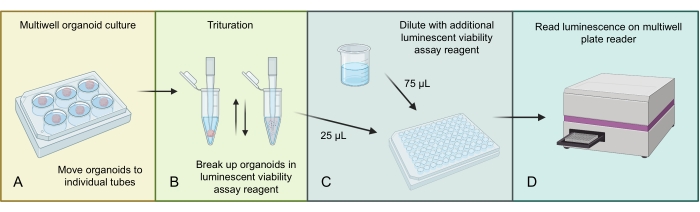
Abbildung 3: Lumineszenzzelllebensfähigkeitsprotokoll für Organoide. (A) Bewegen Sie einzelne Organoide in kleine Zentrifugenröhrchen und entfernen Sie überschüssige Medien. (B) Fügen Sie 500 μL 1:1 PBS und lumineszierende Zelllebensfähigkeits-Assay-Mischung zu jedem Röhrchen hinzu und pipettieren Sie aggressiv, um das Organoid abzubauen. (C) Man gibt 25 μL dieser Organoidmischung und 75 μL derselben 1:1 PBS- und lumineszierenden Zelllebensfähigkeits-Assay-Mischung zu jeder Vertiefung einer 96-Well-Platte. (D) Auf einen Shaker für 2 min geben, gefolgt von einer Inkubation für 20 min bei RT, und dann Lumineszenz auf einem Plattenleser ablesen. Figur aus BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
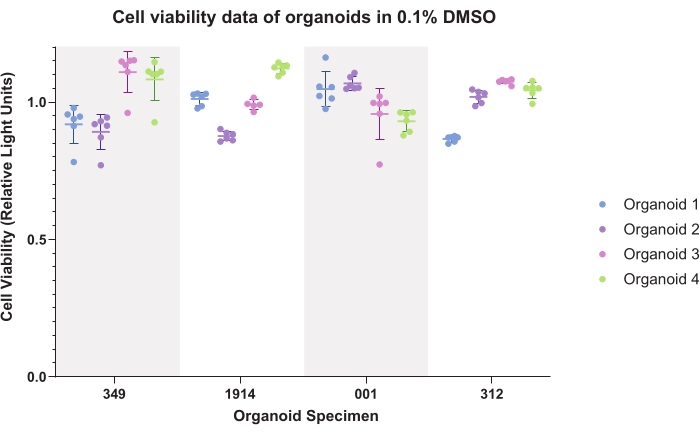
Abbildung 4: Zelllebensfähigkeit. Zelllebensfähigkeitsdaten für Organoide in 0,1% Dimethylsulfoxid (DMSO) für sechs technische Replikate von vier Organoiden für vier Patientenproben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Bestandteil | Menge |
| Neurobasalmedium minus Phenolrot | 500 ml |
| B-27 Ergänzung minus Vitamin A (50x) | 10 ml |
| Antibiotikum-Antimykotikum (100x) | 5 ml |
| Natriumpyruvat (100 mM) | 5 ml |
| Glutamin in 0,85% NaCl (200 mM) | 5 ml |
| Rekombinante humane FGF basic (250 μg/ml) | 20 μL |
| Rekombinantes humanes EFG-Protein (250 μg/ml) | 20 μL |
| Phenol rot | 500 μL |
Tabelle 1: Vollständige Formulierung des neurobasalen Mediums (NBMc)
| Reagenz | Zeit |
| 50% Ethanol | 3 Minuten |
| 75% Ethanol | 3 Minuten |
| 95% Ethanol | 3 Minuten |
| 95% Ethanol | 4 Minuten |
| 100% Ethanol | 2 Minuten |
| 100% Ethanol | 3 Minuten |
| 100% Ethanol | 4 Minuten |
| Xylol-Ersatz | 2 Minuten |
| Xylol-Ersatz | 3 Minuten |
| Xylol-Ersatz | 4 Minuten |
| Paraffin | 15 Minuten |
| Paraffin | 15 Minuten |
Tabelle 2: Verarbeitungsschema für kleine Organoide (unter 3 mm Durchmesser)
| Reagenz | Zeit |
| 50% Ethanol | 6 Minuten |
| 75% Ethanol | 6 Minuten |
| 95% Ethanol | 5 Minuten |
| 95% Ethanol | 8 Minuten |
| 100% Ethanol | 5 Minuten |
| 100% Ethanol | 5 Minuten |
| 100% Ethanol | 8 Minuten |
| Xylol-Ersatz | 5 Minuten |
| Xylol-Ersatz | 5 Minuten |
| Xylol-Ersatz | 8 Minuten |
| Paraffin | 30 Minuten |
| Paraffin | 30 Minuten |
Tabelle 3: Verarbeitungsschema für große Organoide (über 3 mm Durchmesser)
| Reagenz | Zeit |
| Hämatoxylin | 2 Minuten |
| Ausführen von diH2O | 2 Minuten |
| Kernhämatoxylin-klärendes Reagenz | 1 min |
| Ausführen von diH2O | 1 min |
| Bläuliches Reagenz | 1 min |
| Ausführen von diH2O | 2 Minuten |
| 70% Ethanol | 1 min |
| 100% Ethanol | 1 min |
| 100% Ethanol | 1 min |
| Xylol-Ersatz | 2 Minuten |
| Xylol-Ersatz | 2 Minuten |
Tabelle 4: Hämatoxylin-Gegenfärbung
Diskussion
GBM-Organoide sind eine komplementäre Kulturmethode zu traditionellen Sphären, die eine größere zelluläre und mikroökologische Heterogenität aufweisen 4,22,30. Obwohl zeit- und ressourcenintensiver, kann die Organoidkultur wertvolle Einblicke in das intratumorale Verhalten und die Mechanismen der Arzneimittelresistenz bieten.
GBM wird von einer Population von CSCs 5,31 angetrieben, und diese Methoden wurden entwickelt, um ein kontinuierliches Wachstum und eine Selbsterneuerung dieser CSC-Population zu ermöglichen. Es ist bekannt, dass der epidermale Wachstumsfaktor (EGF) und der Fibroblasten-Wachstumsfaktor (FGF) die Erhaltung und das Wachstum von Stammzellen verbessern und eine aktive Rezeptor-Tyrosinkinase (RTK)-Signalisierung bereitstellen. Die Bildung heterogener Zellpopulationen und unterschiedlicher Tumormikroumgebungen innerhalb von GBM-Tumoren beruht auf der Unterstützung des CSC-Verhaltens. Die Auswahl eines lrECM ahmt die lamininreiche Gehirnumgebung nach und unterstützt die Zellen in Organoidkultur dabei, sich selbst zu organisieren und durch Invasion zu migrieren. Obwohl einige Gruppen eine Organoidkultur ohne die Verwendung eines lrECM- oder EGF/FGF-angereicherten Mediums24,28 etabliert haben, was eine zeiteffizientere Art dieser Kulturmethode und eine stärkere Auswahl onkogener Signale zur Wachstumsförderung bieten kann, wurden diese Methoden ausgewählt, um die Pro-Stammzellumgebung zu optimieren, um die zelluläre Heterogenität von Organoiden bestmöglich zu bestimmen. Sowohl zerebrale Organoide als auch GBM-Organoide wurden mit lrECM in der Literatur zuvor 21,32,33 hergestellt. Obwohl wir Daten über die Tumorpopulationen in Organoiden und die räumliche Variation gesammelt haben, ist weniger über Nicht-Tumorpopulationen innerhalb der Organoide bekannt und wie lange sie von den ursprünglichen Patientenproben überleben. Bestimmte IHC-Färbungen (wie CD45) können diese Daten liefern und könnten in Zukunft ein interessanter Forschungspunkt mit Organoiden sein.
Die Kenntnis des Verwendungszwecks für die Organoidkultur ist wichtig für die Auswahl geeigneter Methoden. Die Etablierung von Organoiden aus Primärproben im Vergleich zur Züchtung einheitlicher Organoide für spezifische Experimente hat leicht unterschiedliche Verfahren. Ein Verständnis dafür, wie Organoide reifen und das lrECM-Gerüst visuell ausfüllen, ist wichtig, um in der Lage zu sein, die richtige Zeit und Ressourcen für die Organoidkultur bereitzustellen. Dünne Zellregionen in Organoiden dehnen sich langsam aus und wachsen, um die lrECM zu füllen, was je nach Verhalten der Probe zwischen 2 und 8 Wochen dauern kann. Diese Wachstumsrate ist für jedes Exemplar etwas intrinsisch; Es ist über verschiedene Chargen von Organoiden konserviert und stimmt ziemlich konsistent mit der relativen Rate des Kugelwachstums. Organoide können über 1 Jahr lang aufrechterhalten werden und behalten die Fähigkeit zur Tumorbildung auf Xenotransplantat in Mäusen; Es wird jedoch empfohlen, sie mit einem bestimmten Zweck anzubauen, um keine Laborressourcen (sowohl Materialien als auch Zeit) zu verschwenden4. Das Organoidwachstum wurde in mehreren Well-Größen und -Formaten getestet und zeigt, dass eine 10-cm-Platte die ideale Einstellung für die Aufrechterhaltung einer optimalen Zelllebensfähigkeit ist, gefolgt von einer 6-Well-Platte mit drei Organoiden pro Welle34. Organoide verbrauchen im Vergleich zu ihren zweidimensionalen Kulturgegenstücken mehr Medien, und die Verwendung eines kleineren Well-Formats führt nicht zu einer ordnungsgemäßen Wartung. Zum Beispiel hat eine Vertiefung einer Platte im 96-Well-Format nicht genügend Platz oder Medienvolumen im Verhältnis zur Größe eines Organoids, um das Organoidwachstum aufrechtzuerhalten.
Wie sich Organoide etablieren, ist es wichtig, aufmerksam zu sein, um den Erfolg zu steigern. Anfangs konsumieren Organoide Medien langsam, aber wenn sie dichter und reifer werden, werden sie Medien schneller konsumieren. Die Zugabe von Phenolrot zu den Medien kann als Indikator für den Medienverbrauch dienen. Wenn die Medien gelber sind, können wir das Fütterungsmuster anpassen, sei es, um ein höheres Medienvolumen auszutauschen, die Gesamtmedienmenge in der Platte zu erhöhen, Organoide auf mehrere Zellkulturplatten zu verteilen, um mit ihrem Wachstum Schritt zu halten, oder sogar den Zeitplan für Experimente anzupassen.
In vielerlei Hinsicht sind Organoide eine ineffiziente Art, Krebsforschung zu betreiben. Sie beinhalten lange Zeitskalen und sind im Vergleich zur GBM-Sphärenkultur teuer und ressourcenintensiv. Im Vergleich zu patientenbasierten Xenotransplantaten, einer alternativen Methode zur Wiederherstellung der zellulären und mikroökologischen Vielfalt, sind sie jedoch einfacher, kostengünstiger und kontrollierbarer. Die Auswahl, wann Organoide am besten verwendet werden sollen, ist für Krebsforscher wichtig. Sie sind nicht dazu gedacht, traditionelle Sphären oder zugehörige Kulturen zu ersetzen und Xenograft-Modelle nicht zu ersetzen. Organoide können, wenn sie auf die richtige wissenschaftliche Frage angewendet werden, die Vorteile dieser beiden Systeme kombinieren und es uns ermöglichen, die Tumorzellbiologie zu beobachten, die sonst verborgen bleiben würde. Die wissenschaftliche Gemeinschaft beginnt gerade erst zu verstehen, welche Lernmöglichkeiten Organoide bieten, aber es ist klar, dass sie in Zukunft ein unschätzbares Werkzeug für das Verständnis der komplexen Biologie von GBM sein werden.
Offenlegungen
Die Autoren haben keine Konflikte offenzulegen.
Danksagungen
Wir danken Dr. Justin Lathia für seine unschätzbaren Ratschläge und seine kontinuierliche Unterstützung. Wir danken auch Katrina Fife, Lisa Wallace und Maya Camhi für ihre hervorragende technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
Referenzen
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7(2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416(2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322(2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255(2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101(2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten